摘要
背景
蓝莓品种在冬季休眠时需要一定数量的冷小时来实现春化。在这项研究中,转录组分析使用了来自南方高丛蓝莓“遗产”的未冷藏、冷藏和晚粉色芽的RNA测序数据,以揭示与冷藏积累和芽破裂相关的基因。
结果
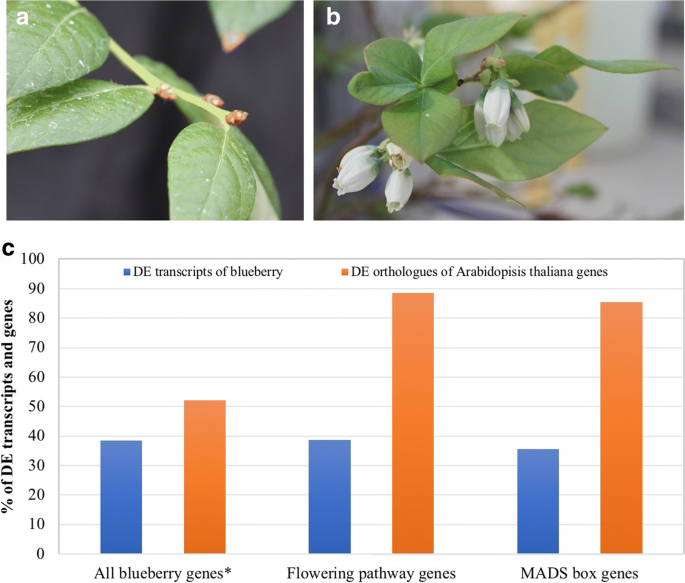
完全冷却的“遗产”植物正常开花,而未冷却的植物不能开花。与未冷冻花蕾相比,冷冻花蕾开花途径基因差异表达率为89%,MADS-box基因差异表达率为86%,冷调节基因差异表达率为84%。蓝莓orthologues的开花轨迹T(英国《金融时报》)在冷藏花蕾中(与未冷藏花蕾相比)没有表达差异,但在晚粉色花蕾中(与冷藏花蕾相比)表达上调。MADS-box主要同源基因在冷鲜花蕾中显著上调,在晚粉花蕾中显著下调。功能orthologues开花轨迹C(方法)在蓝莓中没有发现。orthologues蛋白FD (FD),顶花1 (TFL1), 和叶(LFY)与红绿的花蕾相比,在冷冻的花蕾和晚粉红色中调节。
结论
从未冷藏到冷藏和冷藏到晚粉化花蕾的变化与大量差异表达(DE)植物激素相关基因和DE开花途径基因的转录变化有关。DE基因图谱表明,与FT,FD.,TFL1,LFYMADS-box基因是介导蓝莓芽破的主要基因。结果有助于全面调查木质植物中的春化介导的开花机制。
背景
冬季休眠(内休眠)是落叶果树存活的必要条件[1,2].在秋季感应低温条件下,落叶木本果类和坚果类作物的耐寒性得到驯化;同时,刺激有效冷却时间的积累[3.].充分的低温积累使植物具有充分的春化作用,这是春季开花的先决条件。
过去40岁的气候变化导致了树木不断发展季节的转变(例如,,温带欧洲的2.3天/十年),温度波动提高[4].生长季节的提前会导致果树的冷却时间不足,从而阻止了果树的破芽。植物开花期间温度波动加剧,使早期霜冻成为一种危险,霜冻会对花和幼果造成伤害[5].植物育种以操纵寒冷要求和发展改善的冻胀品种被认为是长期解决方案,以减轻冬季寒冷的减少,减少冻结损害,并确保落叶果生产[6].
季节性开花在植物的生命周期中发挥着重要作用,并由开花途径基因网络控制[7,8,9].开花轨迹C(方法)是冬-一年生植物春化途径的关键调控因子拟南芥蒂利亚纳指标(7].在冬小麦和大麦,vernalization2.(VRN2.)是春化介导开花的主要调控因子[8].方法和VRN2.类似物以桃(碧桃).这些类似物是休眠相关的疯子盒(大坝)作为六种疯子箱转录因子的基因。全部或部分丧失水坝导致非vernalized桃子囱丰突变体[10,11].的大坝基因被认为是替代方法调节vernalization介导的冷却要求和开花[10,12].然而,大坝基因显示出高相似之处A. Thaliana静态24(AGL24),短期营养阶段(高级副总裁)基因[12,13].另外,功能分析水坝在桃中,通过反向遗传学揭示其在冷介导开花中的作用尚未见报道。到目前为止,两者都没有功能FLC-LIKE也不是一个VRN2-LIKE基因已经被证实Vaccinium植物(14].
蓝莓和蔓越莓是最重要的Vaccinium水果,因为它们具有高的抗氧化和抗炎能力[15].弄清春化/冷化介导的开花机制将有助于低冷条件蓝莓品种的分子育种。为了研究在非有利条件下的开花反应,对一种蓝莓进行了功能分析开花轨迹T(VcFT)基因已在高碱基蓝莓中进行(Vaccinium corymbosumL.)[16,17,18].过度的VcFT(叶组织增加约2900倍)导致离体嫩枝和一年生“极光”植物连续早花[16].但是,过度表达VcFT无法满足蓝莓[17,18].超过80%的花蕾是在两到三年的时候长成的VcFT-过度表达的植物在温室条件下没有低温期就不能开花。为了发现春化/冷化反应基因,我们对蓝莓花蕾进行了转录组分析。差异表达(DE)基因的表达谱将有助于我们理解春化/冷化在蓝莓芽裂过程中的作用。
结果
鉴定寒冷的花蕾的成绩单
来自南部高丛蓝莓“遗产”的不冷冻花蕾在暖房中种植了整个冬季。第二年春天,这些花蕾没有开花。相比之下,在自然冬季条件下充分冷却的花蕾正常开花(如图。1).使用Trinity和GenBank中四倍体蓝莓的一个无注释转录组参考(Reftrinity)对冷冻和未冷冻花蕾的转录组比较(登录号:SRX2728597) [19,20.发现了37000个差异表达基因(DEGs)和47000个DE转录本。
进行转录组分析,使用Trinotate注释重新分析(180,000个基因和250,000种同种型)[20.].注释导致来自30,000个基因的14,000个基因和55,000种重新分子。通过这种注释参考,64%的已知的蓝莓基因和同种型显示出差异表达,在冷却到红绿腺芽(本文中指的冷冻花芽中的可再次/ de转录物)进行差异表达。在蓝莓花芽中同时感到众多基因的表达。
低温积累对开花途径基因的影响
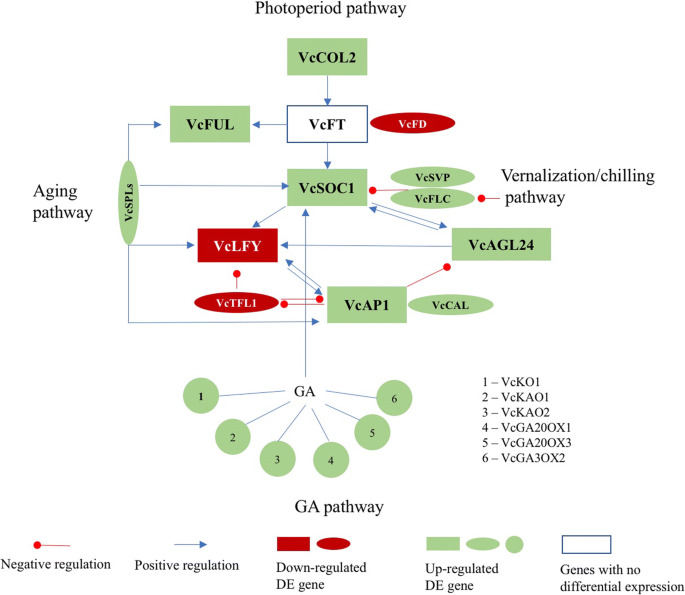
在冷淡的蓝莓花蕾中检测到差异表达89%的开花途径突出词答:芥开花途径基因(表1;无花果。1).其中两个正面之一英国《金融时报》(VcFT:以后风投之前答:芥基因是指蓝莓原基因的略微减少,而另一个显示略有增加。观察到类似的结果Constans-like2.orthologues(表1).
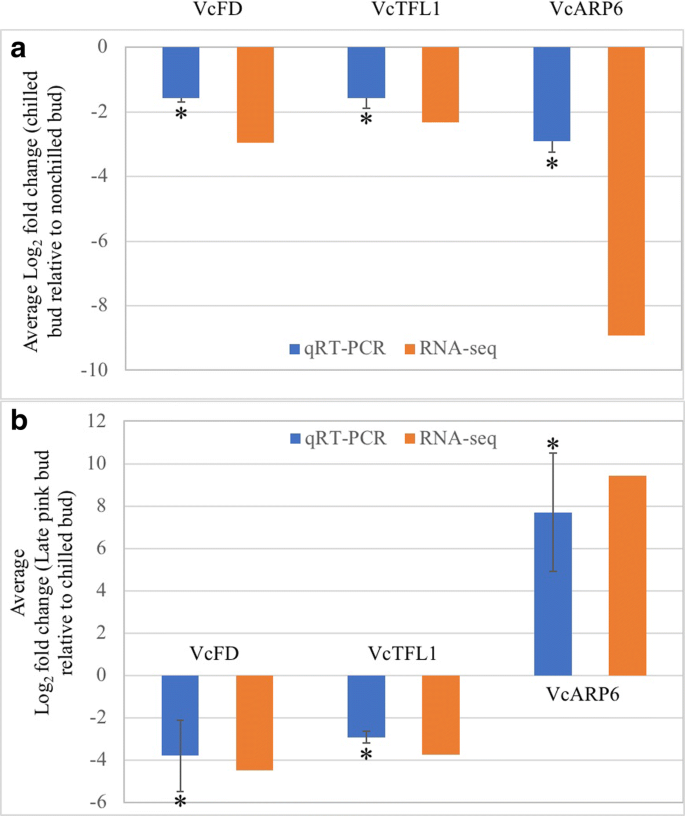
七个主要疯子箱基因的正交芽在开花途径基因的蓝莓芽,Apetala1(AP1),FRUITFULL(富尔语),constans 1过表达抑制因子(soc1),花椰菜(Cal),方法,AGL24, 和高级副总裁,显著上调(表1).orthologues蛋白FD (FD),顶花1 (TFL1), 和叶(LFY),和肌动蛋白相关的蛋白质6(ARP6.)为下调基因。这两个VcFLC和VcSVP表现出对比的反应方法到vernalization答:芥.的衰减VCFD.和差异VcSVP支持那个VcFT结果 [7].然而,表达下降VcLFY与减少矛盾vctfl1.和增加VcAP1, VcAGL24, 和VcSOC1表达。不变的表达VcFT和表达减少VcLFY同系物在植物春化过程中可以阻止冷花芽开花。
MADS-box转录因子和开花阻遏因子,方法,和fr(星期五)主要基因是调节vernalization的主要基因答:芥。星期五激活方法,但春化压制方法[7].这两个vcfri.和VcFLC在蓝莓中存在于注释的重新条件中。vcfri.表现出高度相似之处星期五(e = - 98)而两个VcFLC转录物显示出较低的相似性方法(e =−31)。这两个VcFLC转录物被注释为SEP1的答:芥和MADS6分别米(表1).在寒冷的花蕾,vcfri.未表现出差异表达,而VcFLC前两名增加了25倍VcFLC候选基因(表1).当所有26个潜在的VcFLC候选基因(e < - 20)被纳入分析,4个候选基因显示下调,变化倍数为0.6-0.8倍。其他22个候选基因平均上调4.9倍1:表S2)。之间的矛盾VcFLC和方法对冷/春化反应的反应表明,四倍体蓝莓植物春化介导的开花有一个不同或更复杂的机制。此外,所有参与春化介导的开花途径的其他基因表达均在冷鲜花蕾中上调,只有一个例外VcARP6(c49456_g2日志2FC =−7.7)2:表S1)。
晚粉芽DE转录本的鉴定
在1月份的冷却条件下,每月在寒冷的条件下完全冷静的蓝莓花蕾仍然是休眠状态,直到4月份的连续温暖条件驱动休眠释放和绽放。为了研究休眠释放对基因表达的影响,RNA测序数据是从晚粉红色的芽中获得的。晚粉红色芽与冷冻花蕾的比较转录物分析(以下提及晚粉红色芽中的DEGS / DE转录物)导致28,000种同种型,其注释为11,000个已知的基因。
开花途径基因在晚粉红色芽中的表达
将冷鲜花蕾和深粉花蕾中的主要DE花通路基因进行比较2:表S1)。主要的开花途径基因VcFT,VcSOC1,vcap1.,vcful.,VcFLC,VcSVP, 和VcLFY在晚粉色芽中表达减少。在答:芥,英国《金融时报》,SOC1,AP1.,富裕, 和LFY促进开花高级副总裁和方法是开花阻遏物[7,21].表达的变化VCFD.和vctfl1.在晚粉红色的芽与那些冷藏的花蕾相似(表1).减少了VCFD.表达,至少部分地,与VcFT下调。减少vctfl1.晚粉红色芽中的表达与下调有关vcap1.和VcLFY。此外,减少了VcSVP和VcFLC表达与减少有关VcFT表达式。
疯箱基因的表达
蓝莓DE MADS-box和水坝使用基因使用答:芥MADS-box基因与日本杏(李春万)水坝(PMDAMS.)(附加文件1S2:表;表格1).62年Orthologues答:芥在蓝莓(未发表的数据)中鉴定了MADS-BOX基因。在冷冻的花蕾和后粉红色的芽中检测到53和44个疯狂箱基因的De orthologue。这些正面包括主要开花途径基因VcFLC,VcSOC1,VcSVP, VcAP1,vcful.,VcCAL, 和vcagl24.(桌子1).注释VcSOC1(C86010_G2_I1)显示出高相似之处到25答:芥疯子箱基因。同样,注释VcFLC同源物类似于23答:芥MADS-box基因(表1).结果表明VcSOC1和VcFLC蓝莓可能有多种功能。
三德PmDAMorthologues (VcPmDAM1 VcPmDAM2,和VcPmDAM5)与四个答:芥疯子箱基因,影响开花的小麦2(MAF2.),MAF4.,MAF5.和永远年轻的花.在答:芥,MAF2,MAF4., 和MAF5.是方法Paralogs。MAF2.,MAF5.和方法理气,MAF5.在vernalization期间上调[22].相比之下,蓝莓的同源物VcFLC, VcMAF1, VcMAF2, VcMAF4,和vcmaf5.差异而vcmaf3.被沉闷的花蕾被压抑了(表1;额外的文件1:表S2)。另外,三个devcpmdams.被注释给同源物VcSOC1,VcSVP, VcAP1, 和vcsep1..表达的上调VcPmDAM1同系物是冷冻花蕾中唯一的DE同系物。在晚粉色的花蕾中,75%的DEVcPmDAM1同系物和所有DEVcPmDAM5在de时,同源物在下调VcPmDAM2被上调(附加文件1:表S2)。这些蓝莓MADS-box基因对低温和花芽破碎均表现出显著的响应变化(见表1)1).然而,在春化过程中VcFLC,vcmaf.沙vcpmdams.偏离方法的回应vernalization答:芥.
植物激素相关基因对冷芽和晚粉芽的响应
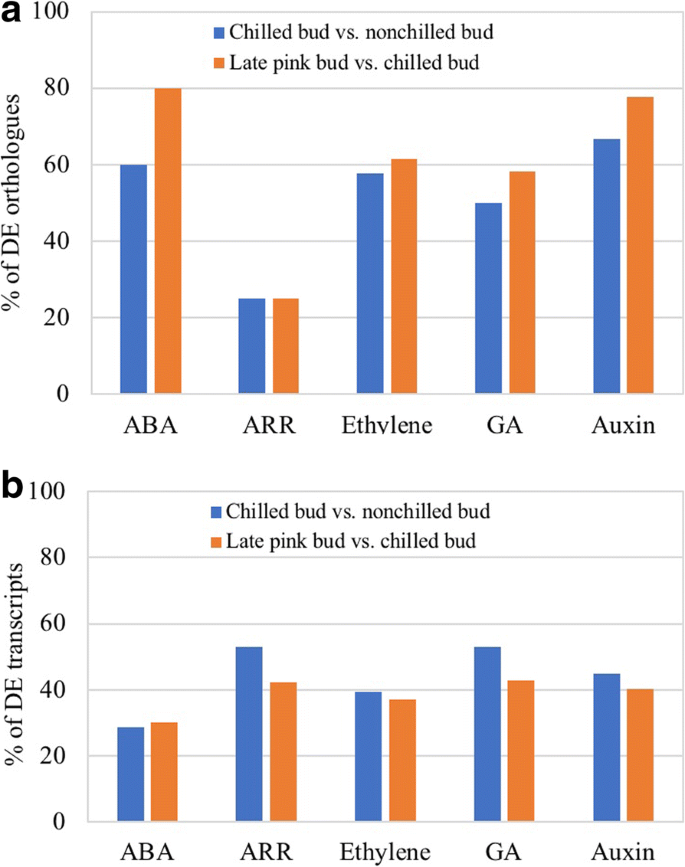
对于冷冻芽和晚粉红色的芽,De转录物与五种主要植物激素的途径基因显示出高相似之处(附加档案3.:表S3)。50%的De Bluebery Orthothologue与脱胶(ABA),乙烯,养羊酸和赤霉素(GA)基因有关,而25%与细胞蛋白基因有关(图。2).晚粉红色芽显示比冷芽更加斑季莫啶酮原理(图。2).植物激素基因表明这些激素可能参与了冷寒和开花过程。
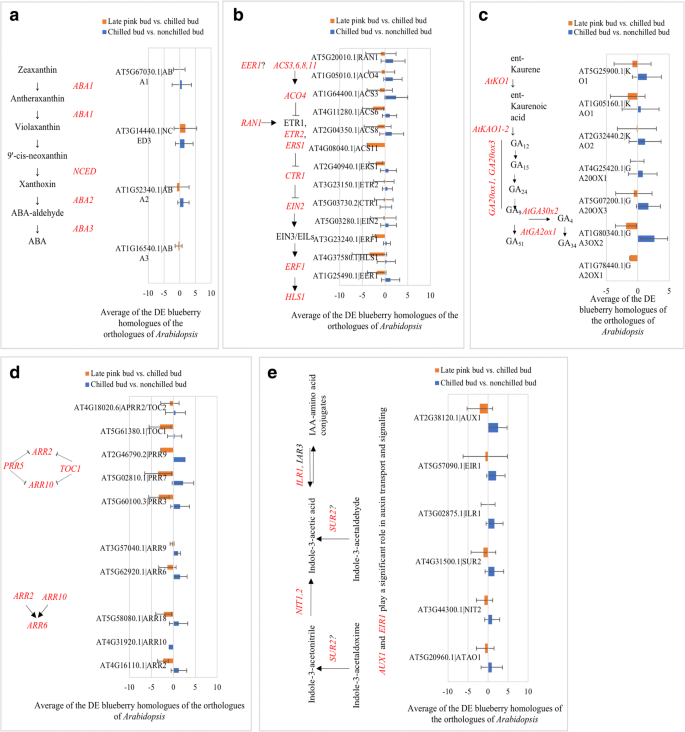
由于“遗产”的四倍体性质,每一个同源物答:芥用于查询的基因通常具有多于一个同源物(图。2).因此,平均更改(日志2褶皱变化)对于衍生自单个的所有转录物答:芥查询基因用来表示各植物激素相关基因的总体变化(图。3.).表达的增加ABA1.,ABA2.和NINE-CIS-EPOXYCAROTENOID加双氧酶3(NCED3)在ABA生物合成途径在冷藏的花蕾中看到。ABA1.和ABA2.继续增加和NCED3晚粉红色的芽下降(图。3.).这些同源物的表达增加表明在春化过程中ABA生物合成的潜在增加。无论下降ABA1.表达,增加NCED3表达表明,花芽突破期间ABA生物合成增加(图。3.).
乙烯信号通路基因的DE同源基因在冷芽中表达上调,在花芽中表达下调(图2)。3.).这些矫形器被认为是用于冷冻耐受性的调节因素答:芥.吲哚-3-乙酸(IAA)和GA生物合成途径同源物在冷鲜花蕾中表达上调,而在晚粉花蕾中表达降低(图2)。3.).赤霉素3-BETA-DIOXYGENASE 2(GA3OX2)在GA通路和AUX1在IAA途径中,具有高表达变化的主要舞台。德拟南芥响应监管机构(加勒比海盗)矫形器包括两种A型,两种B型和五种arr样基因,在冷冻芽和开花芽中。一个b型正轨(ARR10.)仅在冷芽中被抑制(Fig.;3.).
冷鲜花蕾和晚粉色花蕾中DEGs的基因网络
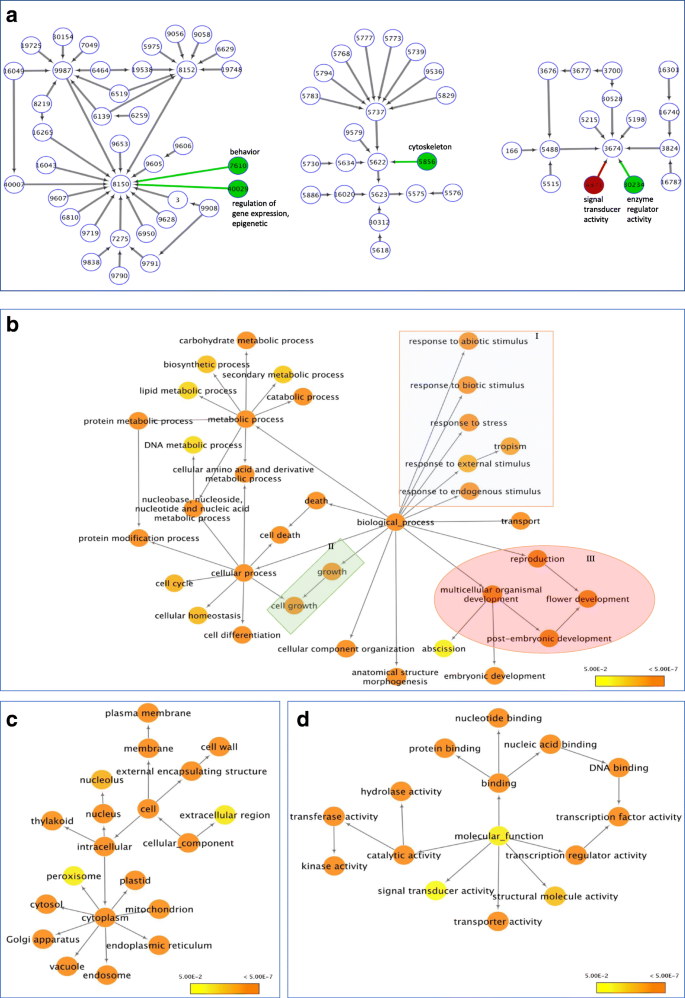
过度代表的基因本体(GO)术语(P< 0.05)进行分组,以GOslim_Plant作为选择的GO文件,可视化注释的DE转录本的基因网络答:芥作为引用的注释。在冷冻花蕾和晚粉色花蕾中,DE转录本分别被分为70和73个代表较多的GO术语(图。4).除了两个GO术语外,冷冻花蕾和后粉红色芽的过度代表的GO术语是相同的(图。4),表明相同的转录本对这些芽中的温度变化做出了反应。“biological_process”的差异在于两个额外的氧化石墨烯术语(GO:0007610-behavior和GO:040029-regulation of gene expression, epigenetic),它们存在于晚霞花蕾中,而不存在于冷鲜花蕾中。(无花果。4).
冷鲜花蕾和晚粉花蕾差异表达基因(DEGs)的基因网络与未冷冻的花蕾相比,冷鲜花蕾中的DEGs含量较高;与冷鲜花蕾相比,晚粉色花蕾中的DEGs含量较高。使用BiNGO中GOSlim_Plants的本体文件来识别过度表示的GO术语(P< 0.05)。一个将寒冷的花蕾基因网络与晚粉红色芽的比较;两个基因网络中存在白色节点和黑色边缘;红色节点和边缘仅存在于冷冻芽中;绿色节点和边缘仅在晚粉红色的芽中存在。每个圆圈中的数字是Go Identity号码。冷冻花蕾的基因网络(b“Biological_process”c“细胞成分”d“分子功能”)。I, II,和IIIb分别显示与胁迫、植物生长和繁殖有关的GO项
冷藏花蕾的过度代表的术语揭示了在三个类别的GO术语上发冷的影响(图。4).“biological_process”中氧化石墨烯的过度表达表明,春化/冷却作用影响了与生长、应激反应和生殖相关的多个氧化石墨烯基因的表达(图1)。4).基于GO术语的基因网络有助于我们理解DEGs在冷鲜花蕾和晚粉色花蕾中的作用(图。4).
选定基因表达的验证
在冷淡的花蕾和晚粉红色的芽中,qrt-pcr用于验证de转录物VCFD.,vctfl1., 和VcARP6(无花果。5).结果表明,RNA-seq数据具有较高的可靠性。
讨论
转录组分析是研究开花途径基因的有效方法[23,24].利用该方法,在日本梨(Pyrus Pyrifolia中井)和东方百合[24].对于蓝莓,表达序列标签已经从蓝莓花蕾中生成[25].然而,尚未记录不同阶段花芽的比较转录组分析。
角色VcFT,VcLFY和VcARP6春化介导的蓝莓开花
过度的VcFT(叶组织中的表达水平> 2000倍)导致了预先开花[16,17].然而,高表达量并没有完全逆转正常植物开花时的低温需求,说明低温需求是不可替代的VcFT操纵。当结果与开花途径一致时答:芥[7]所获得的寒意没有改变VcFT表达在蓝莓花蕾(图。6).在木质梨中也观察到该结果,但不在草本百合中[24].不活跃的VcFT响应于冷却的表达可能是在暴露于萌芽的温度之前冷冻花蕾的一个主要原因VcFT晚粉红色的芽增加(表1).
过度的VcFT在叶片中促进了下游基因的表达VcSOC1,vcful.,vcap1., 和VcLFY[17].在这项研究中,表达了VcSOC1,vcful., 和vcap1.上调但是VcLFY无论如何都被压抑了VcFT花蕾中的表达(表1:无花果。5).表达VcFT下游基因的调控是独立的VcFT在寒冷的花蕾。另外,压抑VcLFY冷冻花蕾的反应与在葡萄藤上观察到的结果相似(葡萄) [26].这些结果表明VcLFY抑制可能通过维持芽破前的芽休眠在冷介导的开花中发挥作用。
互动FD和英国《金融时报》促进开花的答:芥尽管TFL1是一个负稳定者英国《金融时报》[27,28].在这项研究中,减少了VCFD.和vctfl1.表达没有改变VcFT在冷冻的花蕾中表达。但是,增加VCFD.并减少vctfl1.晚粉色的花蕾与增加有关VcFT.TFL1被认为是两者的压缩机LFY和AP1.在答:芥直到最近的证据表明TFL1转录被抑制AP1.但被LFY[29,30.].对于寒冷的蓝莓花蕾,增加表达vcap1.和表达减少VcLFY与减少的表达有关vctfl1..该结果与最近关于这三种基因之间的相互作用的报告一致[30.].在花蕾休息期间,压抑vctfl1.与减少VcLFY和vcap1.支持理论TFL1镇压LFY[30.].虽然蓝莓中的一些开花途径基因匹配所提出的互动答:芥[7],VCFD.和vctfl1.似乎在蓝莓中起着更重要的作用(图。4).
方法与高级副总裁两者都在春化过程中受到抑制答:芥[19].在冷藏的蓝莓花蕾中,两者都有VcFLC和VcSVP同源物表现出的表达减少,但晚粉红色的芽(表1).在答:芥,ARP6.激活方法,MAF4., 和MAF5.,都是春化途径中植物开花的阻遏因子[31].在蓝莓,减少VcARP6在冷冻的花蕾与减少的表达无关VcFLC,vcmaf4.,或vcmaf5..但是,增加VcARP6(C49456_G2,日志2Fc = 8.1)与晚粉红色芽中这些基因的增加有关(表1;额外的文件2:表S1)。由于ARP6.在...的角色答:芥春化处理,德VcARP6可能对寒冷介导的蓝莓花蕾开花有重要作用。
蓝莓MADS-box基因在冷鲜花蕾和晚粉色花蕾中的表达
主要的开花途径基因SOC1,方法,AP1.,富裕,高级副总裁, 和AGL24MADS-box基因编码MIKC吗c(古典MIKC)蛋白[7].类似于答:芥,在不同的开花阶段存在并激活多个蓝莓榴箱基因。VcSOC1, VCAP1和vcful.响应于VcFT过度表达[17].另外,组成思考VcSOC1或角蛋白样(K)域VcSOC1促进蓝莓开花[32].在本研究中,功能同源物方法和AGL24在蓝莓中未检测到,表明蓝莓的春化/冷却介导的开花途径不同答:芥。VcSVP在寒冷和后粉红色的芽中显示出差异表达(表1).
在木质水果作物中,功能方法同源物尚未确定。桃子大坝基因模仿方法反应答:芥在休眠(10].的大坝基因是orthologue答:芥AGL24和高级副总裁基因(12,33].在这项研究中,DE水坝与多个MADS-box基因(vcap1.,VcSVP,VcSOC1, 和VcSPL3)(表1).因此,有可能多个MADS-box基因的互作共同调控了蓝莓及其他木本植物的冷生开花。
春化和大化过程中植物激素基因的反应
植物激素参与植物开花和休眠过程。在答:芥、冷驯化、休眠和植物开花均受植物激素基因表达的影响[7,34,35].赤霉素途径与开花途径相互作用SOC1[7,36].乙烯信号传导途径基因被认为是用于冷冻耐受性的调节剂答:芥.本研究在蓝莓的冷芽和晚粉芽中分别鉴定了DE植物激素基因。2;额外的文件3.:表S3)。这些DE植物激素基因在蓝莓的冷驯化、休眠、抗冻和冷介导的开花过程中发挥着潜在的作用。例如,冷冻的蓝莓芽比未冷冻的芽和花组织表现出更高的抗冻性[37].在冷冻的蓝莓芽中增加乙烯基因的乙烯基因的脱位是对冷冻芽的增强的冰冷耐受性,同时降低了在后粉红色芽中的De乙烯直蛋白的表达减少了冷冻耐受性(图。3.).
结论
从未冷藏到冷藏和冷藏到晚粉芽的变化与大量DE植物激素相关基因和DE开花途径基因的转录变化有关。DE开花途径基因提示FT,FD.,TFL1,LFYMADS-box基因是介导蓝莓芽破的主要基因。DE植物激素基因揭示了植物激素基因在蓝莓冷驯化、休眠、抗冻和冷介导开花中的潜在作用。本研究结果为深入研究木本植物冷生开花机制奠定了基础。
方法
植物材料
四倍体南方高臀蓝莓'遗产'需要超过800个冷却单位(CU),用于正常开花。通过体外培养芽的微扫描获得了12岁的4岁的遗产植物。所有植物在密歇根州立大学的自然光线下,在密歇根州立大学,密歇根州(Latitude 42.701847,经度 - 84.482170)中,所有植物都在一个安全的庭院中生长。2016年1月的平均低温和高温分别为-11°C和-1.8°C(http://www.usclimatedata.com/climate/east-lansing/michigan/united-states/usmi0248).2015年9月,六株植物被移动到加热温室,其中12-H光周期和最低温度为23°C,以使植物从任何冷却小时积累。剩下的六个植物被保留在安全的庭院中。11月,三种植物选自温室,每株植物收获30-50个花蕾。这些花蕾没有收到任何冷却温度,并被标记为非舱内花蕾。2016年1月底,从庭院中选择了三种植物,每株植物收获30-50个花蕾。这些花蕾通过冬季经历了自然的冷却条件,并标记为冷淡的花蕾。4月份,每株植物20-30个花蕾从庭院中同一三植物的第二次收获获得。这些花蕾经历了自然寒冷的条件,并在早春开始花。选择的芽在早期粉红色阶段,并标记为晚粉红色的芽。 All tissues collected were frozen immediately in liquid nitrogen and stored at − 80°C.每种芽型的三种植物被用作转录组分析的三种生物学重复。
RNA制备,测序和DE Novo转录组组件
使用单独的CTAB方法分离每种蓝莓样品(来自个体植物)的总RNA从200mg芽组织中分离出[38]使用Rneasy Mini Kit(Qiagen,Valencia,Ca,USA)纯化。使用与RNA酶的DNA酶组(QIAGEN)的柱DNA酶消化纯化所有RNA样品。使用Agilent RNA 6000 Pico Kit(Agilent Technologies,Inc.,Germany)评估RNA样品的完整性。所有样品在利用Michigan州立大学的研究技术支持设施中使用Illumina Hiseq2500平台进行测序(100-BP对末端读数)之前,所有样品都具有大于8.0的RNA质量得分大于8.0,在密歇根州立大学(East Lansing,Michigan,USA)。FASTQC程序(www.bioinformatics.babraham.ac.uk项目/ fastqc /)用于评估每个基础质量评分30 - 40的测序reads的质量。
差异表达分析和转录组注释
对未冷藏、冷藏和晚粉芽的3个生物复制的RNA-seq reads进行了分析。对每个生物复制进行两个技术重复测序,并结合在一起进行分析。每个生物复制的两组配对阅读,与Reftrinity为“遗产”开发的转录组参考序列对齐[17然后使用Trinity命令“align_and_estimate_abundance.pl”估计每次读取的丰度。使用Trinity命令“run_DE_analysis.pl——method edgeR”进行差分表达式分析。假发现率(FDR)低于0.05的DE转录本用于进一步分析。通过比较冷冻花蕾和未冷冻花蕾的转录组,可以发现冷冻花蕾中的DE转录本/基因。通过对晚粉花蕾和冷鲜花蕾转录组的比较,发现晚粉花蕾中的DE转录本/基因。冷芽中的DE转录本使用Trinotate_v2.0注释(https://trinotate.github.io).
基因网络建设
带注释的转录本在BiNGO的默认参数下导入到Cytoscape 3.5.0,其中包含选定的本体文件“GOSlim_Plants”和选定的有机体答:芥[39,40].
所选途径基因的鉴定
所选基因的代表性蛋白序列答:芥从TAIR服务器下载(https://www.arabidopsis.org/tools/bulk/sequences/index.jsp).将检索到的序列用BLAST+的tblastn命令搜索蓝莓转录组参考文献(refTrinity)。结果显示e值低于- 20的转录本被用来筛选未冷冻花蕾的DE转录本列表。
在之前的研究中发现的蓝莓花基因[17]分析开花途径基因.主要植物激素的途径基因(赤霉素[41,脱落酸[42],细胞素/拟南芥响应性调节剂[43,吲哚-3-乙酸[44,乙烯[45))答:芥根据发布的基因标识从TAIR_10服务器检索(附加文件3.:表S3)。另外,序列答:芥用MADS-box蛋白分析蓝莓MADS-box基因。DE植物激素基因的百分比是根据同源物的数量来计算的答:芥基因或De Bluebery转录物的数量。
DE转录本的RT-PCR
通过对6个选定的转录本进行qRT-PCR分析,评估通过RNA-seq鉴定的DE基因或转录本的可靠性(附加文件)4:表S4)。这些转录本来自生长素、乙烯、细胞分裂素和赤霉素途径中代表性的DE基因。它们具有高倍数变化(> 2)和序列特异性(根据不同亚型的比对结果),便于PCR扩增。真核生物翻译起始因子3 H亚基为内控(附加文件)4:表S4)。
用于RNA测序的RNA样本,包括三个生物复制的样本,用于cDNA制备。用SuperScript II逆转录酶(Invitrogen公司,Carlsbad, CA, USA)将RNA逆转录为cDNA。1微克RNA的cDNA在水中稀释(体积1:4),用1 μl/样品(25 ng)进行PCR反应。
综合DNA科技有限公司(https://www.idtdna.com/Primerquest/Home/Index)为底漆设计并合成了底漆的在线工具(附加文件4:表S4)。使用Sybr绿色系统(Life Technologies,Carlsbad,CA)对Agilent Technologies Stratagene MX3005P(Agilent Technologies,Santa Clara,CA)进行三种QRT-PCR分析。在每种25μl反应混合物中,包括25ng cDNA,200nm的引物和12.5μl2×SYBR绿主混合物。所有底漆对的反应条件为95℃,在72℃下在95℃,60秒处为95℃,在60℃,60秒,在72℃下,然后在95°处的一个循环。C,30s在55°C和30s处,在95°C。通过熔化曲线测定每个引物对的扩增反应的特异性。样品内的转录物水平被归一化为真核形态翻译因子3亚基H.通过-ΔΔct= - [(CT)计算折叠变化。[(CTgoi.- - - - - - Ct笔名)组织1——(Ctgoi.- - - - - - Ct笔名)组织2](n = 3).
缩写
- 阿巴:
-
脱落酸
- 德:
-
表达差异化
- 罗斯福:
-
错误发现率
- 遗传算法:
-
赤霉素
- 走:
-
基因本体论
- 国际宇航科学院:
-
indole-3-acetic酸
- 存在:
-
定量逆转录聚合酶链反应
参考文献
- 1.
安德森的合资企业。植物休眠研究进展。瑞士:施普林格国际出版公司;2015.
- 2.
津恩·柯,Tunc-Ozdemir M,哈珀·JF。温度胁迫与植物有性繁殖:揭示最薄弱环节。中国生物医学工程学报。2010;61(7):1959-68。
- 3.
Ouellet F,Charon J-B。植物中的冷驯化和冷冻耐受性。在:目.Chichester: John Wiley & Sons, Ltd;2013.
- 4.
Chuine IC, Bonhomme M, Legave J-M, De Cortázar-atauri I, Charrier G, Lacointe A, Améglio t未来物候模型能准确预测树木物候吗?内休眠打破的未被揭示的障碍。Glob Chang Biol. 2016;22:17。
- 5.
Luefeling E,Girvetz Eh,Semenov Ma,棕色pH值。气候变化会影响温带水果和坚果树的冬季寒意。Plos一个。2011; 6(5):E20155。
- 6。
阿特金森CJ,Brennan RM,Jones Hg。寒冷的减少及其对温带常年农作物的影响。Environ Exp Bot。2013; 91:48-62。
- 7。
王志强,王志强,王志强,等。拟南芥开花调控的研究进展。细胞。2010;141 (3):550,550. e1-2。
- 8。
绿色A,孔雀WJ,Dennis Es,Trevaskis B.拟南芥和谷物中季节性开花的分子生物学。Ann Bot。2009; 103(8):1165-72。
- 9。
Higgins Ja,Bailey PC,Laurie Da。铜卷曲洞穴开花时间途径的比较基因组学作为温带草的模型。Plos一个。2010; 5(4):E10065。
- 10.
王勇,李志刚,范绍华,Reighard GL, Scorza R,雅培股份有限公司。桃(Prunus persica (L.))长生位点的测序与注释Batsch]揭示了6个MADS-box转录因子作为调控末芽形成的候选基因簇。植物基因组学。2008;4(3):495-507。
- 11.
王Y,Georgi Ll,Reighard GL,Scorza R,Abbott AG。桃蚜中Evengring基因的遗传映射[蛋白PERSICA(L.)沥青]。j hered。2002; 93(5):352-8。
- 12.
Sasaki R,Yamane H,OOKA T,Jotatsu H,Kitamura Y,Akagi T,Tao R.与日本杏子骨间相关的PMDAM基因的功能和表达分析。植物理性。2011; 157(1):485-97。
- 13.
Jimenez S, Reighard GL, Bielenberg DG。DAM5和DAM6基因表达受低温抑制,且与破芽率呈负相关。acta botanica sinica(云南植物学报),2010;43(2):157 - 167。
- 14.
陈志强,陈志强,陈志强,等。园艺树种花分化的调控。植物学报。中国生物医学工程学报。2008;59(12):3215-28。
- 15.
Ehlenfeldt MK,先前的RL。氧自由基吸光度(orac)和酚醛和酚类和花青素浓度在高巴蓝莓的果蔬组织中。j农业食品化学。2001; 49(5):2222-7。
- 16。
歌GQ,Walworth A,Zhao Dy,Jiang N,Hancock JF。髋关节植物植物骨盆开花基因座T样基因(VCFFT):开花活化剂在蓝莓中逆转光周期和冷却要求。植物细胞批准。2013; 32(11):1759-69。
- 17。
蔡斌,宋gq。过表达vcft的蓝莓植物开花调控基因的转录谱。《公共科学图书馆•综合》。2016;11 (6):e0156993。
- 18。
高X,Walworth AE,Mackie C,歌曲GQ。蓝莓开花基因座T的过度表达与蓝莓植物中植物激素相关基因表达的变化有关。Hortic Res。2016; 3:16053。
- 19。
宋国强,高翔。转基因蓝莓矮化和延迟开花1基因的转录组学研究。植物学报。2017;17(1):106。
- 20。
Haas BJ,Papanicolaou A,Yassour M,Grabherr M,血液PD,Bowden J,Couger MB,Eccles D,Li B,Lieber M等。从RNA-SEQ使用Trinity平台进行参考生成和分析的DE Novo转录序列重建。NAT PROTOC。2013; 8(8):1494-512。
- 21。
拟南芥短营养期和开花位点C的组合活动确定了不同的开花调控模式。基因组医学杂志。2015;16:31。
- 22。
Ratcliffe OJ, Kumimoto RW, Wong BJ, Riechmann JL。拟南芥MADS影响开花基因家族的分析:MAF2通过短时间的寒冷阻止春化。植物细胞。2003;15(5):1159 - 69。
- 23.
温志,郭伟,李军,林华,何超,刘颖,张强,刘伟。春化和细胞分裂素诱导金钗石斛花转化的转录组比较分析。Sci众议员2017;7:45748。
- 24.
Li W,Liu X,Lu Y.转录组比较揭示了响应东方百合的vernalization的关键候选基因。BMC基因组学。2016; 17:664。
- 25.
关键词:蓝莓,低温驯化,叶片,果实发育,花蕾,转录组序列BMC Plant Biol. 2012;12:46。
- 26.
古巴P Carmona MJ,马丁内斯-萨帕特JM。VFL是葡萄藤FLORICAULA/多叶同源物,在分生组织区独立于其命运。植物杂志。2002;130(1):68 - 77。
- 27.
Abe M, Kobayashi Y, Yamamoto S, Daimon Y, Yamaguchi A, Ikeda Y, Ichinoki H, Notaguchi M, Goto K, Araki T. FD, bZIP蛋白在茎尖介导花通路整合子FT的信号。科学。2005;309(5737):1052 - 6。
- 28.
王志刚,王志刚,王志刚,王志刚。拟南芥花诱导过程中时间和空间信息的整合。科学。2005;309(5737):1056 - 9。
- 29.
Liljegren SJ,Gustafson-Brown C,Pinyopich A,Ditta GS,Yanofsky MF。Apetala1,绿叶和终端花中的相互作用指定了公司名命运。植物细胞。1999; 11(6):1007-18。
- 30.
Goslin K,Zheng BB,Serrano-Mislata A,Rae L,Ryan Pt,Kwasniewska K,Thomson B,O'Maoileidigh DS,Madueno F,Weller F等人。花香和阿培拉/花椰菜之间的转录因子相互作用。植物理性。2017; 174(2):1097-109。
- 31。
Deal RB, Kandasamy MK, McKinney EC, Meagher RB。核肌动蛋白相关蛋白ARP6是一种多效发育调节剂,在拟南芥中维持开花位点C的表达和抑制开花。植物细胞。2005;17(10):2633 - 46。
- 32。
关键词:越桔,SOC1-like (VcSOC1-K) mdas -box基因,结构域表达,烟草植物学报2013;32(11):1819-26。
- 33。
Jimenez S, Lawton-Rauh AL, Reighard GL, Abbott AG, Bielenberg DG。桃休眠相关MADS-box基因的系统发育分析及分子进化。BMC Plant Biol. 2009;9:81。
- 34。
Shi Y,Ding Y,杨S.冷信号转导及其在冷置的植物激素中的相互作用。植物细胞生理。2015; 56(1):7-15。
- 35.
拟南芥的休眠诱导需要低温和CBF转录因子对DOG1和激素代谢的平行调控。植物细胞。2011;23(7):2568 - 80。
- 36.
交叉途径:细胞分裂素信号转导与串扰。发展。2013;140(7):1373 - 83。
- 37.
Walworth AE, Rowland LJ, Polashock JJ, Hancock JF, Song GQ。蓝莓CBF基因的过表达增强了南方高丛蓝莓品种的耐冷性。摩尔品种。2012;30(3):1313 - 23所示。
- 38.
Zambobi A,Pierantoni L,De Franceschi P.从草莓树(arbutus Unedo)和其他几个木料植物的总RNA提取。Iforest。2008; 1:122-5。
- 39.
Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T. Cytoscape:一种生物分子相互作用网络集成模型的软件环境。基因组研究》2003;13(11):2498 - 504。
- 40。
Maere S,Heymans K,Kuiper M.宾果:一种Cytoscape插件,用于评估生物网络中基因本体类别的超级陈述。生物信息学。2005; 21(16):3448-9。
- 41。
赤霉素生物合成基因AtKAO1和AtKAO2在拟南芥发育过程中具有重叠的作用。植物j . 2014; 80(3): 462 - 74。
- 42。
熊L,朱杰克。脱落酸生物合成的调节。植物理性。2003; 133(1):29-36。
- 43。
黄大伟,陈春春,陈志强。拟南芥的双组分信号转导途径。植物杂志。2002;129(2):500 - 15所示。
- 44。
冗余作为一种生活方式——IAA代谢。植物学报。1999;2(3):207-13。
- 45。
王克良,李浩,李海涛。乙烯生物合成及其信号转导网络。植物细胞。2002;14(增刊):S131-51。
- 46。
董T,Park Y,Hwang I. Asscisic acid:生物合成,灭活,同性恋和信号传导。散文生物化学。2015; 58:29-48。
- 47.
李志刚,夏强。乙烯对水稻种子休眠的调控作用。植物科学学报2014;5:539。
- 48.
关键词:拟南芥(Arabidopsis thaliana, Arabidopsis thaliana, Arabidopsis thaliana, Arabidopsis thaliana, Arabidopsis thaliana, Arabidopsis thaliana);植物细胞。2004;16(2):367 - 78。
- 49.
王志强,王志强。细胞分裂素信号转导的研究进展。科学。2007;318(5847):68 - 9。
- 50.
《植物生理过程与生理动态的整合》。[j] .光子学报。2015;16(10):598-610。
- 51.
Velasquez SM, Barbez E, Kleine-Vehn J, Estevez JM。生长素和细胞伸长。植物杂志。2016;170(3):1206 - 15所示。
确认
作者感谢Wayne H. Loescher博士审阅了这份手稿,密歇根州立大学RNA测序研究技术支持中心的Jeff Landgraf博士和Kevin Carr先生。这项研究得到了密歇根州立大学绿色农业生物研究项目的部分支持(http://www.canr.msu.edu/research/plant-agriculture/project_greeen/).
资金
这项研究得到了密歇根州立大学agbiresearch (http://agbioresearch.msu.edu/programs/info/project_greeen.).
数据和材料的可用性
我们的蓝莓转录组参考Reftrint已经存放在Genbank(登录号:SRX2728597)。来自当前研究的数据集可根据要求提供相应的作者。
作者信息
隶属关系
贡献
GS构思并监督了这项研究;QC和GS进行了实验;GS分析了数据并撰写了手稿。两位作者阅读并批准了手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
利益争夺
提交人声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
表S2。DE MADS-box基因在冷花蕾(CB) [vs非冷花蕾(NB)]和晚粉色花蕾(LPB) (vs CB)中。冷冻芽的LogFC:日志2(CB / NB)。晚粉色花蕾的LogFC:原木2(LPB / CB)。除#N/A(无差异表达)外,其余均为DE基因。(XLSX 23 kb)
附加文件2:
表S1。在冷冻花蕾(CB)中的德花基因[vs nonchiilled花蕾(nb)]和'遗留的后粉红色芽(lpb)(vs cb)。冷冻芽的LogFC:日志2(CB / NB)。晚粉色花蕾的LogFC:原木2(LPB / CB)。#N/A:无微分表达式。(XLSX 140 kb)
附加文件3:
表S3。在冷藏花蕾(CB)中的植物激素(CB)[与“遗产”中的晚粉红色芽(LPB)(VS CB)。冷冻芽的LogFC:日志2(CB / NB)。晚粉色花蕾的LogFC:原木2(LPB / CB)。除#N/A(无差异表达)外,其余均为DE基因。(XLSX 401 KB)
额外的文件4:
表S4。本研究使用的引物。(多克斯54 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
首歌,《Gq》。,Chen, Q. Comparative transcriptome analysis of nonchilled, chilled, and late-pink bud reveals flowering pathway genes involved in chilling-mediated flowering in blueberry.BMC植物杂志18,98(2018)。https://doi.org/10.1186/s12870-018-1311-8
已收到:
接受:
发表:
关键字
- 令人心寒的要求
- 冷硬度
- 开花时间控制
- 冻结公差
- Vaccinium corymbosum
- 春化处理
- 木本植物