抽象的
背景
不定根是由不生根组织产生的根。ARs通常是在正常发育过程中以及在胁迫条件下产生的,如淹水、营养缺乏、重金属胁迫和伤害等。植物形成ARs的能力是植物繁殖的一个关键特性,尤其是对大多数树种而言。
结果
本文研究了一个杨树杂交品种组织培养中AR形成的动力学。杨树AR的形成主要发生在前8天,组织学研究表明,前期和新形成的原基均参与AR的形成。在切除(DAE)后0、2、4、6和8天收集的茎基进行rna - seq转录组分析。在此基础上,研究了8个植物激素相关基因的表达模式,并考虑了它们对AR形成的影响。随后的基因表达聚类分析显示了许多参与AR形成的生物学过程。在这些生物途径中,H2O2稳态在一个集群中显示出从DAE0到DAE8高度上调的集群中的浓缩。药理测定证实H的适当含量2O2在茎碱中可以加速杨树中的形成。
结论
基于本研究的结果,我们能够预测7种植物激素在杨树AR形成中的调控网络。H的影响2O2关于AR形成也得到证实.这些结果提高了我们对树种中AR形成调节的理解。
背景
不定根(ARs)是由茎、叶和下胚轴等不生根组织在离体和田间培养中产生的根。ARs通常是在正常发育过程中以及在胁迫条件下产生的,如淹水、营养缺乏、重金属胁迫和伤害等[1].ARs的形成是大多数树木和一些草本植物最重要的生物学过程之一。因此,在一些植物中,形成ARs的能力是使其繁殖的关键性状。在过去的几十年里,许多研究集中在确定在草本植物中AR形成的机制,例如拟南芥那奥雅萨苜蓿和矮牵牛混合动力汽车(2那3.].通常,三个因素是归因于控制AR形成,包括遗传,环境和生理因素(例如,植物激素,酚类化合物和氮氧化物)2那4.]. 这三种因子及其组分相互作用,形成一个复杂的调节AR形成的网络。然而,对树种AR形成的认识相对有限。虽然这一生物过程的细节在一定程度上可以在草本植物和木本植物之间共享,但这两种植物之间存在着相当大的差异;例如,树木形成ARs的能力通常随着年龄的增长而下降;而大多数草本植物没有幼年期[5.那6.那7.]. 因此,研究树木AR形成的机制是必要的。
植物激素又称植物激素,在植物生长和环境反应中起着重要作用。植物激素是控制植物AR形成过程的最重要的内源因子。在众多的植物激素中,生长素在AR的形成中起着重要的作用[8.]. 一般来说,产生ARs的组织需要高水平的生长素,而这种高含量的生长素通常依赖于极性生长素转运(PAT)[9那10].有趣的是,已经观察到过高的植物水平在AR形成的后期阶段具有抑制作用[11]. 细胞分裂素(Cytokinins)是另一类重要的植物激素,调节植物细胞的分裂和分化。在香石竹AR诱导的早期,细胞分裂素的积累增加,而在中期,细胞分裂素的积累减少[12]. 除这两种激素外,脱落酸(ABA)、油菜素类固醇(BRs)、乙烯(ET)、赤霉素(GAs)、茉莉酸(JA)和水杨酸(SA)也被发现在AR的形成过程中起作用。一般来说,这些激素之间形成一个庞大而复杂的网络,使激素对AR形成的影响复杂化。例如,ET、GAs和ABA之间的相互作用调节了深水稻ARs的出现和生长速率[13].通过影响养羊酸转运,气体抑制杨树和拟南芥的偶然生根[14]. 在矮牵牛属植物中,JA对插条中AR的形成起着积极的调节作用[15].由于有这些植物激素,生物圈之间的相互作用和SA也可以参与AR形成的调控。然而,植物如何调节和平衡不同植物激素的影响的了解是有限的。因此,总而言之,在AR形成植物激素的作用是复杂的,关于调控网络知识仍然匮乏。
在影响AR形成的内源性因素中,反应性氧物种(ROS)也在调节AR形成方面发挥重要作用。通常,ROS被认为是信号分子,并据报道,调节气孔运动和生物和非生物应激反应以及植物发育的许多方面,包括侧根形成[16那17那18那19那20.]. 近年来,一些研究集中在活性氧在AR形成中的作用。在绿豆中,过氧化氢(H2O2),主要类型ROS中的一种,已经预测由RNA-SEQ分析,以通过调制许多基因的[正向调节AR形成21].在橄榄偶联生根上,发现AOX蛋白(替代呼吸道途径上的关键酶)在不定根过程的第一个阶段期间,在ROS稳态期间立刻调节[22].H的外施2O2也被证明能增加万寿菊形成不定根的能力[23那24].与其他内源因素相比,了解ROS在AR形成中的作用非常有限。
杨树基因组较小,高质量的基因组草案发布较早,且具有高效的转基因平台,是一种模式树种。通常,杨树被认为是容易生根的植物,然而,不同类型的物种对此性状仍存在差异[25].最近,已经对杨树形成了几项研究。例如,通过表达的序列标签测序揭示了根和AR开发中涉及的转录物[26]. 细胞分裂素B型反应调节剂PTRR13.同时也发现它对不定根的发育起负调控作用杨树[27].随后,还发现AP2家族中的转录因子在AR形成期间发挥作用[28]. 一些WUSCHEL相关同源盒(WOX)转录因子也被报道调控杨树AR形成的关键发育过程[29那30.].然而,仍然有杨树AR形成的认识不足与AR的形成草本模式植物进行比较。在此,为了提高我们的认识到杨树的AR结构和基因或负责该生物过程的内在因素的屏幕的规定,我们在AR形成由RNA-Seq的调查杨树AR发展和动态的基因表达的动力学基于转录组分析杨树。基于这些数据,植物激素的相关基因的表达模式进行了研究,以及它们对AR的形成的影响进行了审议。随后的基因表达聚类分析表明参与H中的基因2O2途径可能有助于杨树形成。最后,药理测定证实了H的影响2O2杨树AR形成的研究。因此,在这项研究中,我们提供了新的信息,在调节AR形成的树种。
结果
杨树在WPM中AR的形成
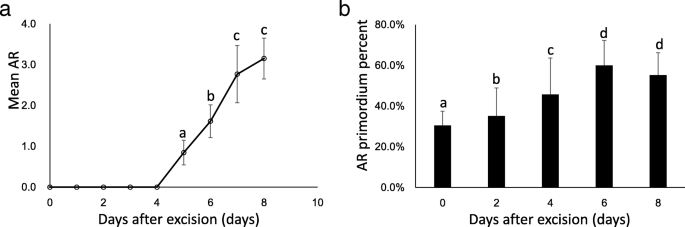
为了研究杨树AR形成的动力学,在没有植物激素和其他生长调节剂的条件下,将“NL895”30个上部2-3片叶和一个顶芽(约2-3 cm)的微插条培养在WPM中。第一次可见的AR是在切除后5天(DAE5), > 80%的微切片在DAE8处显示出根。从DAE0到DAE8的ARs个数如图所示。1一种。在DAE5,DAE6,DAE7和DAE8中,DAE1至DAE4没有来自DAE1至DAE4的可见ARS。在DAE8之后,AR的总数略微增加,并且AR的长度急剧增加(数据未显示)。从DAE0到DAE8的典型AR形成过程如图4所示。2. 根据图中显示的数据。1和2因此,在前4个时期,AR的发育主要发生在茎段内部 天;而在WPM中生长的杨树插条可见AR伸长主要发生在DAE4~DAE8之间。
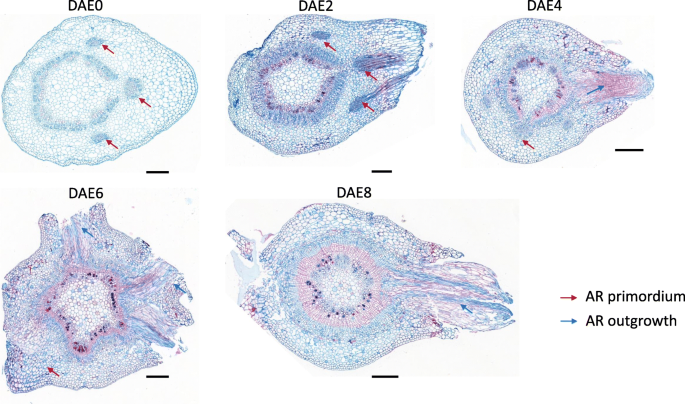
当使用解剖学方法以WPM调查杨树形成杨树形成时,我们发现5个测试阶段中存在不同的AR原序。百分比是DAE0(30.4%±7.0%),DAE2(35.2%±13.7%),DAE4(45.7%±17.9%),DAE6(60.0%±12.3%)和DAE8(55.3%±11.0%)(图。1b)。多重比较(P = 0.05), significant difference among DAE0, DAE2 and DAE4; while difference between DAE6 and DAE8 didn’t reach significant level. The typical sections from DAE0 to DAE8 are illustrated in Fig.3..可见,在DAE0时,茎皮层中AR原基的切片率较高(30.4±7.0%),说明在扦插前就已经形成了AR原基。此外,DAE0处理后的AR原基率也有所增加(除DAE8处理后略有下降外,这可能是由于成熟AR大量存在,难以计数所致),说明杨树扦插在发育过程中也会形成新的AR原基。因此,杨树扦插中既存在预形成的AR原基,也存在新形成的AR原基。
AR形成过程中基因表达的时间过程
为了确定AR形成过程中的基因表达谱,在每个时间点收集插入WPM的0.5cm切割碱基(DAE0、DAE2、DAE4、DAE6和DAE8)。总共用收集的样本创建了15个RNA-Seq文库(每个时间点三个生物样本)。共获得约2.84亿个150 bp配对末端(PE)读数(表1)1).在质量控制和过滤后,保持84.0g清洁数据,样品中的平均数据量为5.60±0.61g(表1).最小的样品是DAE4-1,具有4.83g,而最大的样品是DAE2-2,具有6.29g清洁数据(表1).clean reads占所有raw reads的98.5%。高质量和充足的RNA-Seq数据为进一步的基因表达分析提供了支持。
将所有清洁读数均映射到参考基因组上,并通过Tophat和Cufflink计算基因表达数[31那32].为鉴定差异表达基因,将DAE0、DAE2、DAE4、DAE6、DAE8四个时间点的基因表达情况与DAE0进行比较。同时比较连续时间点DAE2与DAE4、DAE4与DAE6、DAE6与DAE8。因此,共进行7对比较。根据材料与方法章节中差异表达基因的标准,有7483个非冗余差异表达基因(附加文件1:表S2)。当这些差异表达的基因进行聚类分析时,来自同一时间点的样本,清楚地倾向于聚集在一起(附加文件2:图S1)。这些结果表明,采集的样品质量较高。DAE8和DAE0的距离小于其他时间点,可归为一个亚类,DAE2、DAE4和DAE6属于另一个亚类。2个表达亚支的存在与上述杨树AR形成动力学的结果一致。AR的形成主要发生在DAE2到DAE6期间,DAE8使茎基部恢复正常生长。
当所有选中的比较的差异表达基因进行检测时,发现有4882,4774,4354,3129,940,1173和2155个基因显示之间的微分表达式DAE0 DAE2, DAE0 DAE4, DAE0 DAE6, DAE0 DAE8, DAE2 DAE4, DAE4 DAE6,分别和DAE6 DAE8(附加文件3.:图S2)。在DAE0和DAE2之间发现最多的差异表达基因,并且在DAE2和DAE4之间发现了最低数量的差异表达基因。在4个连续的比较(DAE0和DAE2,DAE2和DAE4,DAE4和DAE6和DAE0和DAE8)中具有最高数量的差异表达基因,而DAE2和DAE4具有最低数量。由于连续的比较可能对AR开发过程中基因表达的动态变化的可靠反映,因此该结果可能表明,0到2 DAE的时间段是AR形成的最重要阶段。
为了从RNA-SEQ分析验证基因表达数据,对于RT-QPCR测定,随机选择显示5个时间点中的差异表达模式的10个基因。通过在等于1的DAE0的表达式来计算每个时间点和控制样本(DAE0)之间的相对折叠变化(图。4.). 为了比较RNA-Seq和RT-qPCR数据的基因表达谱,进行了相关分析。两种表达数据高度一致,R2值等于0.86和aP-值小于0.0001。这个高R2值清楚地表明表达结果对于进一步分析非常可靠。
植物激素相关基因表达模式的研究
植物激素被认为是AR形成的关键调控因子。在AR形成过程中,不同的激素相互作用,形成一个庞大而复杂的网络,调节这一动态的生物学过程。为了深入了解植物激素在AR形成中的作用,我们采用同源性搜索的方法对杨树的激素相关基因进行了研究(见材料和方法)。共807个基因被预测参与8种植物激素的生物合成、转运、代谢和接收(附加文件4.:表S3)。这8种激素包括ABA、生长素、BRs、细胞分裂素、ET、GAs、JA和SA,相应的相关基因数分别为75、201、291、29、42、58、82和29(表1)2).预计不会参与BR运输,ET运输和代谢,GA运输和新陈代谢,JA运输和SA接收(表2).当检查这些植物激素相关基因的表达模式,180个基因显示期间AR形成差异表达;他们的标准化的表达值示于附加文件5.:表S4。
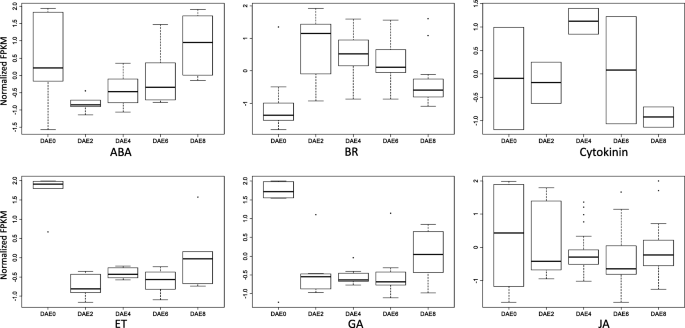
因此,我们总结了发生在5个AR时间点的动态基因表达。在植物激素生物合成基因中,6种激素的生物合成基因均有明显的模式。5.). 在AR形成过程中,没有生长素和SA生物合成基因表现出差异表达。在DAE2、DAE4和DAE6处ABA生物合成基因的表达降低,然后在DAE8处略微升高到正常水平。在DAE2作用下,BR生物合成基因的表达量急剧上升到很高的水平,然后在随后的时间点略有下降;然而,从DAE2到DAE8这些基因的表达仍然高于DAE0。相反,ET和GA生物合成基因的表达呈现相反的趋势。DAE2使这类基因的表达量急剧下降至极低水平,然后在随后的时间点略有增加。细胞分裂素生物合成基因分别在DAE4和DAE8表达最高和最低,而在其他3个时间点则保持在正常水平。与DAE0相比,JA生物合成基因在各个阶段的表达均降低。
植物激素生物合成相关差异表达基因FPKM值的箱线图。FPKM代表每千碱基转录物每百万个片段的片段。每个箱线图包括Q1(1/4四分位,方框底部)、Q3(3/4四分位,方框顶部底部)、中间值Q2(方框内的线)、Q3 + 1.5 IQR(四分位区间,Q3-Q1,方框外的最高行)和Q1–1.5 IQR(方框外的最低行)。值大于Q3 + 1.5 IQR或小于Q1–1.5 IQR被视为异常值,它们被标绘为Q3之外的点 + 1.5 IQR或Q1–1.5 IQR。如果Q3 + 1.5 IQR小于Q3或Q1–1.5 IQR小于Q1,其对应的线将不显示。ABA代表脱落酸,BR代表油菜素类固醇,ET代表乙烯,GA代表赤霉素,JA代表茉莉酸
在植物激素运输基因中,只有3个激素,ABA,植物蛋白和细胞蛋白,具有使其表达式模式调查的数据(附加文件6.:图S3)。所有3种植物激素迁移基因的平均表达在DAE0的比其他阶段高。用于DAE0阶段的植物材料也代表了植物在正常生长状态下的组织。因此,DAE0的那些植物激素迁移基因的最高平均表达表明,杨树正常生长需要ABA,毒素和细胞蛋白的运输。3毛细管的运输也可能支持在杨树中启动AR发育的要求。在DAE2的阶段,这些植物激素传输基因的平均表达急剧下降可能归因于来自母植物的枪击事件的切除。从DAE2到DAE8的这些植物激素运输基因的平均表达的稳步增加表明ABA,养羊酸和细胞质素越来越多地涉及杨树AR发育。由于生物合成和转运的方法是植物中内源性植物激素的来源,因此这7种植物激素生物合成和运输基因的动态表达模式可能反映其在形成过程中的作用。
在植物激素代谢基因中,那些与BRs、细胞分裂素和SA相关的基因从DAE2到DAE8的表达高于它们在DAE0的表达(另一个文件)7.:图S4)。在植物激素受体基因中,与6个激素有关的那些具有能够调查其表达模式的数据(附加文件8.:图S5)。BR和细胞肝素受体基因显示出类似的表达模式,通过DAE2急剧下降,然后在随后的阶段增加;然而,它们在DAE8的表达仍然低于DAE0。ABA和GA受体基因也共享了类似的表达模式,其表现出与BR和细胞蛋白受体基因相反的趋势。蟾蜍蛋白和Et受体基因还显示出与BR和细胞素受体基因的相反的图案;在DAE2和DAE4的表达首先降低,然后通过DAE6和DAE8增加到比DAE0更高的水平。通常,当它们对相应的植物激素响应时,存在对代谢和受体基因的阴性和阳性调节,因此,我们不能在杨树形成期间结论这些基因的作用。
AR形成过程中差异表达基因功能的基因聚类分析
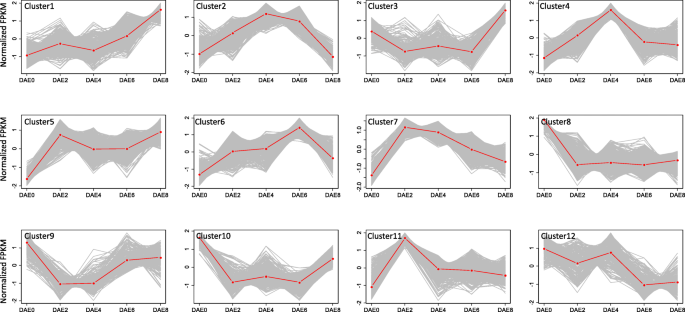
为了全面研究影响杨树AR形成的其他因素,我们根据其动态表达模式对差异表达基因进行了聚类。利用K-means算法,对这7483个差异表达基因形成12个聚类。聚类1、2、3、4、5、6、7、8、9、10、11、12分别有551、743、304、479、457、454、854、1567、305、896、638和235个基因1:表S2)。每个簇的表达式配置文件如图4所示。6..簇1、簇4、簇5、簇6和簇7的基因从DAE0到DAE8的表达量均为上调,而簇8、簇9、簇10和簇12的基因从DAE0到DAE8的表达量均为下调(图1)。6.).但12个聚类均具有独特的表达模式,在不同AR形成阶段均有最高和最低的平均表达值。杨树AR的形成是一个复杂的生物学过程。
同一群体中的基因分组通常表明这些基因参与了类似的生物过程。因此,对每个基因簇进行功能性富集分析。12个集群中的十个展现了至少一个生物学功能的丰富(附加档案9:表S5);只有群集3和9未能显示任何富集。最富集的聚类1的生物过程是“光合作用”,群体5的最丰富的过程是“光合作用,光收获”。这2簇中的基因表达模式显示出稳定上调(图。6.).这些结果可能表明,光合作用过程中形成的AR发生和光合作用将是杨树AR形成有益。此外,“几丁质分解代谢过程”,“响应于生物刺激”,和“防卫反应”在簇7富集和11以前,已经报道了这些功能的基因是参与植物对疾病[33那34].簇7和簇11均在DAE2处达到表达高峰,随后逐渐降低至正常水平;这一结果可能表明,一些疾病反应基因也在AR形成过程中发挥作用。由于KEGG分析更直接地表明了基因功能及其相关的通路,我们仔细检查了KEGG分析的每个聚类的结果。总共有5个KEGG通路在3个基因簇中富集(表3.).“小管蛋白β”富集在群中;该结果类似于群集2上面描述的结果[35那36].三种Kegg途径,“过氧化物酶”,“水素蛋白皮”和“抗水合酶1 /同种酰氨酸酶”,富集在簇6中。“大亚基核糖体蛋白L39E”在簇12中富集。在这4 kegg途径中,“过氧化物酶”是通常对ROS宿舍负责,ROS通常在植物开发期间充当信号分子。因此,编码过氧化物酶的基因可能参与杨树中的AR形成。
H2O2在白杨AR形成中
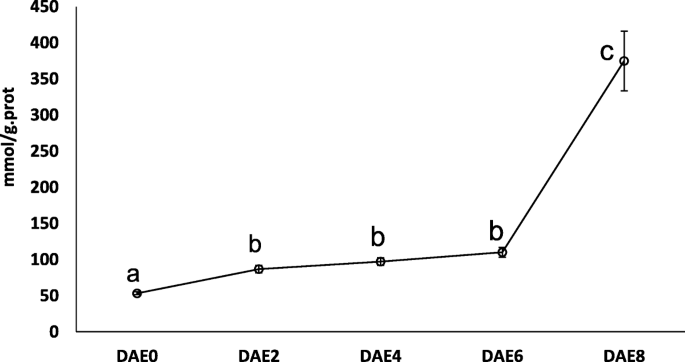
为了测试上述假设,我们主要专注于过氧化物酶途径中的基因。在簇6中将总共7个差异表达基因编码过氧化物酶进行分组,并且大多数基因在DAE0和DAE6的峰表达后表达增加(表3.). 基因Potri.005G195600选择用于RT-QPCR测定。结果与RNA-SEQ结果非常一致(图。4.).RT-QPCR分析后,H2O2对组培苗基部茎的含量进行了测定。H2O2在AR形成的整个过程中,积累明显增加。H2O2内容为53.5±2.0、86.8±5.2、97.3±5.3、110.2±6.7,374.8±41.3更易与g。DAE0、DAE2、DAE4、DAE6、DAE8的prot(图1)。7.).通过方差分析和多重比较,H2O2DAE2、DAE4和DAE6显著高于DAE0 (P < 0.05), while the H2O2这3个时间点的含量均显著低于DAE8 (P < 0.05). 因此,我们得出结论,H2O2在AR形成过程中,含量表现为三个水平:H2O2含量在开始时间点处于基线水平;从DAE2到DAE6,它增加并保持在一个相对较高的水平,然后在DAE8急剧增加。
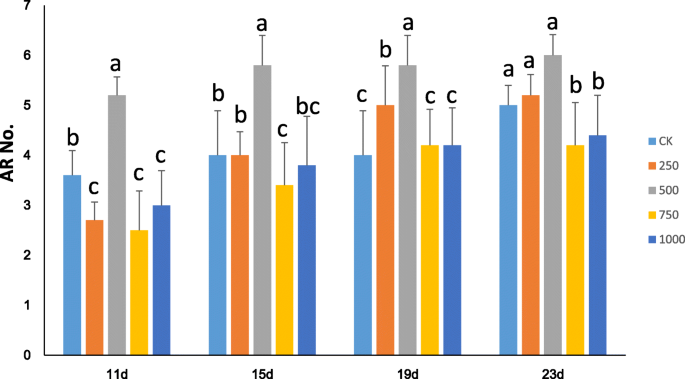
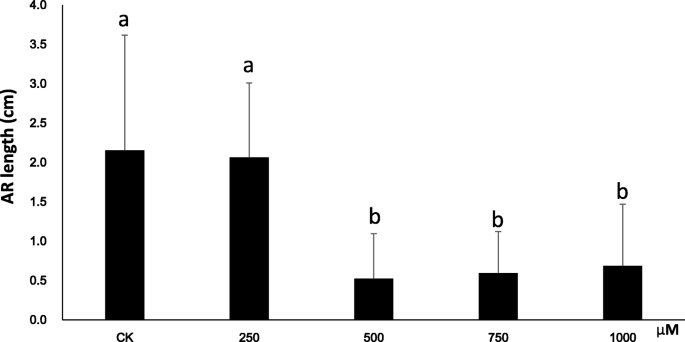
为了进一步了解H2O2杨树AR形成期间,我们通过使用杨“NL895”的半硬木屑作为植物材料进行水培。在the preliminary experiment, five cuttings with uniform growth status were grown in hydroponic solution supplemented with 0, 500 or 1000 μM H2O2. 插条生长在500 μM小时2O2在Dae11中产生的ars明显多于另一个人生长的扦插2O2浓度(附加文件10:图S6)。然后,在5个水培溶液中的每一个中,平均均匀的30个具有均匀生长状态的切屑(注意,最终获得了1000μmH的15个数据2O2处理),每天记录每种切割的ARS数量。在补充0,250,500,750或1000μmH的水培溶液中11,15,19和23天后记录AR的数量。2O2.结果表明,ARS的平均数是显着影响H的浓度2O2(图。8.). 从第11天到第19天,在含500的溶液中生长的插条的平均AR值 μM小时2O2高于其他解决方案中生长的扦插(P< 0.05),平均AR值之间的差异在第19天后似乎有所下降。此外,在750 μM和1000 μM H溶液中,岩屑的平均AR数有所增加2O2低于在未处理的对照溶液(0μm)中生长的扦插的那些。因此,从这些数据中显而易见的三种结果。首先,用外源性H处理2O2可能影响ar形成;其次,AR在500μm的溶液中比其他解决方案更快;第三,高浓度的外源性H.2O2减缓了杨树AR的形成。所有这些结果也提示适当水平的H2O2生产可以加速杨树的形成。为了验证上述结果,杨树“NL895”切割也在具有0.5mm DMTU的水培溶液中生长,这是一种化学H.2O2食腐动物。到第8天,H2O2在DMTU溶液中生长的插条茎基含量为142.7% ± 7.3 (N = 30),而未处理对照的茎基部为367.7 ± 3.2 (N = 30). 这说明DMTU减少了H的积累2O2(T检验,P< 0.05)。在0.5 mM DMTU水培溶液中生长的岩屑中ARs的平均数量显著低于在DAE12对照溶液中生长的岩屑(图1)。9).DMTU中AR的平均AR数为0.8±1.1,而未处理的对照组是6.6±1.3。此结果支持查找适当水平的H2O2生产可以加速杨树的形成。虽然AR在具有适当浓度的H方面发挥更快的解决方案2O2,h的影响2O2在AR长度上似乎遵循一个不同的趋势。第23天,在添加了0、250、500、750和1000 μM H的溶液中,岩屑的平均AR长度增加2O2是2.2 ± 1.5, 2.1 ± 0.9, 0.5 ± 0.6, 0.6 ± 0.5和0.7 ± 0.8 厘米(图。10).补充有500,750和1000μmH的溶液2O2与补充较低浓度的2个解决方案相比,平均AR长度明显低于较低的曲线(P < 0.05). 虽然在添加0和250的溶液中生长的插条的平均AR长度没有显著差异 μM小时2O2,从溶液中的溶液中的绝对数量较低,250μmH2O2.这个结果可能表明H2O2负调节杨树的AR伸长率。
在水培培养物下建立后12天的杨树切割的长度,具有不同浓度的h2O2.各处理的植株数与无花果相同。8..AR长度由每种治疗的平均值提出。多重比较在显着水平下进行P值等于0.05。误差条表示每种处理的标准偏差
讨论
杨树AR的形成经历了复杂的生物过程
杨树是一种易生根的树种,在AR的形成过程中还存在着复杂的生物学过程[1].以往的研究将杨树AR的发育分为3个阶段:原基组织、原基分化和根伸长[4.那7.].如图所示。1 b和3.,我们的结果与此结论部分一致。我们的数据显示,原始组织和差异化也发生在切割之前。预先和新成立的基金均为杨树“NL895”的AR形成有助于。此结果与先前的报告一致[37那38那39].一些切割产生从DAE5到DAE8的ARS,而其他切割则不会在同一时间点产生ARS。在所有5个阶段也可以观察到新形成的Ar原始。该结果表明,阶段之间没有明确的边界,并且在DAE4之后的一个茎切割的同一时间点同时存在3个方法(原始组织,原始分化和根伸长率)。但是,主要发育事件的时间点清晰;原始组织和分化主要发生在DAE0到DAE4,并且根伸长率主要从DAE4到DAE8。因此,我们在杨树“NL895”中分类为2个阶段,早期和晚期。早期阶段是从DAE0到DAE4,AR开发发生在茎的内侧;虽然晚期从DAE4到DAE8,而AR开发发生在茎的外部。根据上述分析,我们可以得出结论1)WPM中AR形成的关键阶段是切除后的前8天; 2) both pre- and newly- formed AR primordia contribute to AR formation for poplar; 3) the production of newly formed AR primordia occurs at most of the whole stage from DAE0 to DAE8. Therefore, our data demonstrated that the development of poplar ARs is a dynamic and complex biological process.
多因素显示对杨树形成的影响
植物激素是影响AR形成的最重要因素。在不同的植物激素中,已经证实在许多研究中的AR形成中发挥着核心作用[8.那9那10]. 由于转录组学分析已被证明是揭示特定生物过程潜在机制的一种有效方法,因此许多研究都集中在根或AR的形成上[22那25那26].在这项研究中,我们还发现了杨树法规的一些潜在影响因素。根据图1中所示的数据。5.和附加文件6.:图S3,附加文件7.:图S4和附加文件8.:图S5,本研究AR形成过程中,与生长素生物合成相关的基因均未出现表达差异;而与生长素运输相关的50个基因表现出差异表达。因此,这一数据表明在杨树AR形成过程中没有发生局部生物合成,生长素的积累主要是由于运输。这项结果与以往的报告相似[10].根据植物激素生物合成和传输相关基因的表达谱和累积特征(来自其他地点的局部生物合成或运输),我们能够推断出7种研究的植物激素的作用,包括ABA,Auxin,BRS,Cytokinins,等,天然气和Ja。这7种植物激素可以清楚地分为5组。第一组仅包括一个植物激素,ABA。本地ABA生物合成从DAE2降低到DAE6,然后由DAE8增加。这种模式表明,ABA负调节原始组织和原始分化,而是在形成过程中积极调节根伸长。第二组包括一种植物激素,BRS。这种植物激素肯定地调节了所有3个AR发育阶段,但其效应在AR开发后期减少。第三组包括一种植物激素,Cytokinins。 The roles of cytokinins in AR regulation are complex compared to those of other phytohormones. The expression of cytokinin biosynthesis genes had very large variation from DAE0 to DAE8; the expression levels were slightly decreased by DAE2, sharply elevated by DAE4, and then decreased by DAE6 and DAE8. This complex expression profile suggested a complex role in which cytokinins act as positive regulators at some stages and as negative regulators at the other stages. The fourth group included 3 phytohormones, ET, GAs and JA. All of these phytohormones exerted negative effects on AR formation at all 3 stages. The fifth included one phytohormones, auxin. Its accumulation mainly depended on transport and it positively regulates AR formation at both early and late stages.
根据RNA-Seq结果,除了植物激素外,还可以推断出其他因素对杨树AR形成的影响。根据附加文件中列出的数据9:表S5,有些结果与以往的研究非常同意。例如,“微管”功能在簇2 [富集35那36]“对激素的反应”和“对伤害的反应”在集群10和11中富集[33那34]分别是。此外,还揭示了杨树AR形成的一些有趣的新信息。光合作用和碳固定途径在基因表达簇1中富集,该簇的表达从DAE0到DAE8稳步增加(图。6.和附加文件9:表S5)。该结果可能表明糖信号通路涉及杨树形成。类似地,伤害响应性,生物刺激和防御调节途径显示群体11中的富集,并且在DAE0下急剧增加该簇的表达(图。6.和附加文件9:表S5)。相关基因表达在杨树AR形成的早期较高可能表明杨树切割的切除活化伤害信号并随后引发。此预测与先前的报告非常相似[26].根据结果如图所示。6.和附加文件9:表S5,,显示在杨树AR形成也可能参与多种其它因素,可以发现,如次级代谢产物,能量,一氧化氮和氧化还原。所有这些结果与以前的一些研究[23那24那40].由此可见,影响杨树AR形成的因素有多种。
H2O2可能会影响杨树AR形成
在本研究中,我们考察了H2O2杨树AR形成的药理研究。H的积累2O2在DAE0之后增加了(图。7.).但是,我们也可以观察到H2O2DAE8的含量也显著高于DAE2 ~ DAE6 (P< 0.05)。提示存在3个水平的H2O2DAE0 ~ DAE8含量最低,DAE0、DAE2 ~ DAE6和DAE8含量最高。由于在DAE8上有可见ARs,我们不能完全排除新形成ARs对H的影响2O2含量测定,因此高得多2O2DAE8的积累可能部分归因于新形成的ARs(杨树根系产生较高的H2O2内容比茎,数据未显示)。然而,H2O2在DAE2 ~ DAE6处理下,H2O2在杨树AR形成的早期,其含量确实有所增加。在以前的研究中,H2O2也被发现参与了AR或侧根的形成,如绿豆[21]、万寿菊[23那24]还有苜蓿[17].与这些研究相比,我们的结果与之前的报道高度一致。
数据清楚地透露了一个适当的h2O2可以加速AR的形成,而较高的H2O2内容可以减缓形成并减少根伸长率。H2O2是一种活性氧,在许多生物过程中起着不同的作用,包括对生物和非生物胁迫的反应以及植物生长[40].然而,其影响杨树AR形成的潜在机制尚不清楚。以前的一些研究报道了H2O2和许多植物激素[41].在这里,我们还预测了7种植物激素和h的作用2O2在杨树AR形成期间。自H的积累以来2O2由于生长素和BRs两种植物激素正调控AR的形成,这些结果可能表明H对AR的形成有直接或间接的调控作用2O2,植物素和BRS。在答:芥ROS作为生长素的下游调节因子促进根毛发育[42]. 根据我们的数据,我们还可以推测H2O2在AR形成过程中受到生长素和BRs的调控。一个适当的H2O2内容促进了AR形成。然而,杨树形成,原始组织,原始分化和伸长根有3个阶段。H.2O2这3个阶段的浓度差异显著(P< 0.05)。因此,我们不能断定H2O2在所有3个阶段或仅在特殊阶段发挥作用。因此,需要进行更多的研究来综合判断H2O2在杨树中的ar形成。
结论
在此,我们可以提供一个关于植物激素和H的作用的全局视图2O2应用RNA-Seq和药理学方法研究杨树AR形成过程。结果表明,不同植物激素与H2O2. 从这项研究中获得的知识将有助于我们了解AR形成的潜在机制。
方法
植物材料,生长条件和治疗方法
杨树的杂交品种“NL895”(胡杨。欧美黑)在组织培养和田间培养中容易地形成ARS,用作本研究中的植物材料。根据法律许可,从华中农业大学(HZAU)的树质地质储存量获得了这种品种。为了调查杨树AR形成的动力学和用于制备高通量测序的RNA,用“NL895”的组织培养植物用作植物材料。具有不同少年时期的木质植物表现出非常不同的AR形成能力;因此,采用了两种策略来避免这种影响。首先,从分化的杨树外植体的第一类脱卵产生的顶部芽中获得所有具有未分化的AR的微包。其次,仅在木质植物培养基(WPM)中繁殖具有2-3个上叶和顶芽(约2-3cm)的微闭合以进一步分析。根据之前的报告编写了WPM [43].Additionally, all microcuttings that were inserted similar deep into the WPM (ca. 0.5 cm). All the tissue culture experiments were conducted at 25 °C with a 16/8 h photoperiod. To prepare samples for RNA extraction, the 0.5 cm cutting base was collected from each plantlet. Ten to 15 cutting bases were used for one biological sample. Three biological samples were prepared for each time point. Samples were collected at 5 time points: 0, 2, 4, 6 and 8 days after the cuttings were inserted into WPM. These time points were termed DAE0, DAE2, DAE4, DAE6 and DAE8, respectively. At DAE0, the cuttings had not experienced any treatment but were simply excised from the explants.
测试H2O2在AR形成时,N,N'-二甲基脲(DMTU)
采用水培系统试验了H2O2DMTU对杨树AR形成的影响。为制备用于水培繁殖的杨树半硬木扦插苗,在离体条件下生长的幼苗,用6~10 株高1厘米,驯化后移栽于1L土盆中。这些植株生长了大约1年 直到植物长出10-15片叶子。从1个月龄的杨树植株上切下2-4片上部叶片和一个顶芽。采用双消毒水配制水培液。
为了测试H的影响2O2on poplar AR formation, cuttings were inserted into the hydroponic solution with 0, 250, 500, 750 or 1000 μM H2O2. 为了研究DMTU对杨树AR形成的影响,将插条插入0.5%的水培液中 mM或不带DMTU。
两项实验记录了可见的ARS数量一个月。对于数据收集和分析,为每个单独的切割记录AR长度和数量,然后为每种处理产生平均值。所有水培均在25℃下用16/8H光周期进行。水培溶液每2天改变。在补充有H的水培繁殖期间每次治疗的平均植入量平均生长2O2还有DMTU,除了1000 μM小时2O2治疗有15个最终收集的数据。
解剖和显微分析
组织学分析采用与RNA-Seq制备相同的方法和生长条件采集0.5 cm的切基。每个时间点至少收集15个切割基地。收集的组织用FAA(50%乙醇,5%冰醋酸和4%甲醛)固定,然后按照先前研究中描述的方案处理[34].用旋转切片机(Leica RM2255)制作切片(15 μm),用藏红(1%)和快绿(1%)染色。随机选取0.5 cm切基至少10个横截面进行AR原基计数。所有切片用Olympus BX51显微镜观察并拍照。软件FV10-ASW 3.1 Viewer (Olympus Support)用于导出照片。
H2O2含量测定
对于H.2O2内容测定,我们按照Bio-101中描述的协议,略微修改[44].简单地说,收集插入WPM或水培溶液中的茎基。收集5 ~ 15个茎基形成一个生物样本(至少0.1 g),并为一次处理准备6个生物样本。样品(0.1 g)在液氮中研磨成粉末,用4°C的磷酸盐缓冲液悬浮,涡旋彻底。混合物在4℃下12000 rpm离心。上清液检测H的浓度2O2Amplex Red过氧化氢/过氧化物酶检测试剂盒(Molecular Probes, USA, CAS: A22188)。每个生物样本设置6个技术重复。
总RNA的提取及全转录组分析
总RNA按照说明书(DP432,天根生物技术(北京)有限公司,北京)使用RNeasy Plant Mini试剂盒分离。采用琼脂糖凝胶电泳和A260/280波长比检测检测所有RNA样本的质量。所有样本的RNA完整性数(RIN)也由安捷伦生物分析仪2100检测。根据先前描述的协议,所有质量足够的样本都用于RNA-Seq文库构建[45].构建的文库使用HiSeq 2500平台进行测序。
生物信息学分析
原始RNA序列读取使用Trimmomatic软件进行质量修剪和质量过滤,并使用默认参数设置[46].的P毛果基因组3.0用作本研究中的参考基因组[47].使用具有默认参数的Tophat软件将每个样本的清洁读数映射到参考基因组上[31那32].通过Cufflinks软件获得每千碱基百万片段值(FPKM),通过Cuffdiff软件进行差异表达分析[31那32]. 错误发现率(FDR)小于0.05,折叠变化率(FC)大于2.0为差异表达基因的阈值。在所有5个时间点FPKM值小于10的差异表达基因被排除在进一步分析之外。
对于杨树激素相关的基因注释,同源性检索策略使用。首先,在激素相关的基因答:芥,来源于拟南芥激素数据库(http://ahd.cbi.pku.edu.cn/) [48保留了与生物合成,运输,代谢和受体相关的功能的基因。其次,通过使用当地爆炸数据库中的命令“BLASTP”进行与保留的拟南芥激素基因同源的杨树搜索杨树基因(ftp://ftp.ncbi.nlm.nih.gov/blast/executables/blast+/LATEST/). 从P毛果基因组3.0用作查询。爆炸点击得分大于250(e-experse大约e- 60)被保留了下来。在拟南芥激素数据库中,对保留的杨树查询蛋白进行了功能注释。
为了对差异表达的基因进行聚类,用R软件中的scale命令确定每个FPKM值的z值(零均值归一化)(https://www.r-project.org/).然后将所有差异表达基因的z分数用R软件中的“k-means”命令形成聚类。集群的数量如前所述确定[49]. 利用PlantGSEA(Plant GeneSet Enrichment Analysis Toolkit)在线对每个簇中差异表达基因进行功能注释,http://structuralbiology.cau.edu.cn/PlantGSEA/) [50.].
基因表达分析
选取10个差异表达基因进行RT-qPCR检测。这10个随机选择的差异表达基因的引物列在附加文件中11S1:表。用于RNA- seq分析的RNA样本用于基因表达研究。每个RNA样本的浓度用NanoDrop 8000 (Thermo Fisher Scientific CN, Shanghai, China)定量,等量的RNA用于cDNA合成。一步式gDNA去除和cDNA合成SuperMix试剂盒(AU311-02;反式生物技术,北京,中国)用于cDNA合成。将10对引物的PCR产物送Sanger测序,确认预期扩增物的扩增后,再进行RT-qPCR检测。所有RT-qPCR检测均使用LightCycler 96(罗氏)平台和FastStart Essential DNA Green Master混合(罗氏分子系统公司,中国)。每个样品进行3次技术重复。对每个引物的标准曲线进行检测,以确定某一基因的扩增效率。仅对显示预期扩增子的引物对进行基因表达分析,PCR效率估计数在1.9 ~ 2.1之间,并采用独特的熔融曲线(见下)。 The cycling conditions were set as followed: 95 °C for 10 min and 40 cycles of 95 °C for 10 s and 65 °C for 60 s. Fluorescence data were collected during the 65 °C step and analyzed with the LightCycler 96 Manager. After the running of cycling, melting curves were also examined by an addtiontional program of 95 °C for 10 s, 65 °C for 60 s and 97 °C for 1 s. Sample quantification cycle (Cq) values were determined and were standardized relative to the expression of the two reference genes (ACTIN and UBQL, Additional file11:表S1)。2-ΔΔCq.方法根据RT-qPCR数据计算基因相对表达量[51.]. 每个测试基因的DAE0表达水平设为1。所有数据分析均通过LightCycler®96软件(版本1.1.0.1320,中国上海罗氏)进行。
统计分析
所有统计分析都是通过使用R软件进行的(https://www.r-project.org/). 采用aov函数进行方差分析,所有多重比较均在显著水平下进行P值等于0.05。
缩写
- 阿坝:
-
脱盐酸
- 基于“增大化现实”技术:
-
不定根
- 比尔:
-
芸苔类固醇
- 数据采集设备:
-
天切除后
- DMTU:
-
二甲基硫脲
- 电子技师:
-
乙烯
- 飞行里程:
-
每千碱基片段百万
- GA:
-
赤霉素
- 青年成就组织:
-
茉莉酸
- 拍:
-
生长素极性转运
- 活性氧:
-
活性氧
- SA:
-
水杨酸
参考文献
- 1.
不定根的生理学研究。植物杂志。2016;170(2):603 - 17所示。
- 2.
贝利尼C,帕库拉尔迪,佩罗内一世。不定根与侧根的异同。植物生物学年鉴。2014;65:639–66.
- 3.
德鲁奇U,弗兰肯普,丽思斯基S,Ahkami啊,Zerche S,Hause B,Hajirezaei先生。转录组分析显示乙烯作为刺激剂和植物素作为矮牵牛扦插在不定根形成的调节因子。前植物SCI。2014; 5:494。
- 4.
赵X,郑H,李氏,杨C,江j,刘乐。杨树扦插的根源:综述。新的。2014; 45(1):21-34。
- 5。
Abu Abied M、Szwerdszarf D、Mordehaev I、Levy A、Stelmakh OR、Belausov E、Yaniv Y、Uliel S、Katzenellenbogen M、Riov J等。微阵列分析显示巨桉幼嫩扦插中硝酸还原酶的上调与一氧化氮生成增加和不定根形成有关。植物J。2012;71(5):787–99.
- 6。
皮萨罗A,迪亚兹萨拉C。林木不定根形成成熟相关衰退过程中的细胞动力学。生理植物。2018;165(1):73–80.
- 7。
Legue V,Rigal A,Bhaleao RP.树种不定根形成:转录因子的参与。生理植物。2014;151(2):192–8.
- 8.
Pacurar di,Perrone I,Bellini C.植物结中是一种中央球员,串联谈话,控制不定的生根。physiol植物。2014; 151(1):83-96。
- 9
Garrido G, Ramon Guerrero J, Angel Cano E, Acosta M, Sanchez-Bravo J.康乃馨扦插生根IAA的起源和基性运输。杂志。2002;114(2):303 - 12所示。
- 10
Ahkami AH、Melzer M、Ghaffari先生、Pollmann S、Ghorbani Javid M、Shahinnia F、Hajirezaei先生、Druege U。吲哚-3-乙酸在矮牵牛茎尖插穗中的分布及其与生长素运输、碳水化合物代谢和不定根形成的关系。足底。2013;238(3):499–517.
- 11
De Klerk GJ、Van der Krieken W、De Jong JC。回顾-不定根的形成:新概念,新可能性。体外细胞开发-Pl.1999;35(3):189–99.
- 12.
Agullo-安东MA,Ferrandez-Ayela A,费尔南德斯加西亚N,尼古拉斯C,阿尔巴塞特A,佩雷斯 - Alfocea女,桑切斯 - 布拉沃Ĵ,佩雷斯 - 佩雷斯JM,阿科斯塔M.早期步骤不定根的:形态学,激素分析和碳水化合物成交在康乃馨茎插条。physiol植物。2014; 150(3):446-62。
- 13.
斯蒂芬斯B,王JX,乙烯,赤霉素和脱落酸之间索特M.相互作用调节在深水水稻不定根出现和生长速率。Planta。2006; 223(3):604-12。
- 14.
Gibberellins通过影响植物生长素的运输来抑制杂交白杨和拟南芥的不定根。植物j . 2014; 78(3): 372 - 84。
- 15.
Lischweski S,Mudow A,Guthorl D,哈萨斯酸族在矮牵牛切割中的不定根形成阳性。BMC植物BIOL。2015; 15:229。
- 16。
van Buer J,Cvetkovic J,Baier M。质体抗坏血酸过氧化物酶的冷调控是拟南芥ROS信号转导的启动枢纽。BMC植物生物学。2016;16(1):163.
- 17。
陈Z,顾Q,于X,黄L,徐S,王R,沈W,沈W。过氧化氢作用于褪黑素下游诱导侧根形成。安·博特。2018;121(6):1127–36.
- 18
O' brian JA, Daudi A, Finch P, Butt VS, Whitelegge JP, Souda P, Ausubel FM, Bolwell GP。培养的拟南芥细胞中过氧化物酶依赖的外质体氧化破裂在mamp诱导的防御中起作用。植物杂志。2012;158(4):2013 - 27所示。
- 19
Bindschedler LV,Dewdney J,Blee KA,Stone JM,Asai T,Plotnikov J,Denoux C,Hayes T,Gerrish C,Davies DR,et al.拟南芥中过氧化物酶依赖的质外体氧化爆发是病原菌抗性所必需的。植物J。2006;47(6):851–63.
- 20
高XQ,刘CZ,李德德,赵tt,李文,贾xn,赵xy,张xs。SNRK1复合物的Arabidopsis Kinbetagamma亚基通过介导花粉中的活性氧量水平来调节耻骨上的花粉水合。Plos Genet。2016; 12(7):E1006228。
- 21
李SW,LENG Y,SHI RF。转录组分析为在绿豆幼苗中的过氧化氢诱导的亚氧化氢诱导的分子见解。BMC基因组学。2017; 18(1):188。
- 22
Velada I、Grzebelus D、Lousa D、Soares CM、Santos Macedo E、Peixe A、Arnholdt Schmitt B、Cardoso HG。AOX1亚家族基因成员齐墩果欧洲公司简历。”Galega Vulgar“——IBA诱导离体不定根过程中转录物的基因特征和表达。国际分子科学杂志。2018;19(2):597.
- 23
关键词:万寿菊,外植体,no, h2o2,不定根abstract:植物生理学杂志,2012;
- 24.
廖文斌,黄国斌,于建华,张美玲,施XL。一氧化氮和过氧化氢参与了吲哚-3-丁酸诱导万寿菊不定根的发育。霍尔特科学生物技术杂志。2011;86(2):159–65.
- 25.
Zalesny RS和Zalesny JA:从环境效益、纤维和能源等方面选择不同不定根类型的杨树。植物不定根的形成及其应用[j] . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin . chin。
- 26.
李凯,梁勇,邢磊,毛杰,刘铮,董飞,孟y,韩敏,赵超,包玲,等。转录组分析揭示了多种激素、损伤和糖信号通路介导苹果砧木不定根的形成。国际J Mol Sci. 2018:19(8).
- 27.
Ramirez Carvajal GA、Morse AM、Dervinis C、Davis JM。细胞分裂素B型反应调节剂PtRR13是杨树不定根发育的负调控因子。植物生理学。2009;150(2):759–71.
- 28。
Rigal A、Yordanov YS、Perrone I、Karlberg A、Tisserant E、Bellini C、Busov VB、Martin F、Kohler A、Bhalero R等。类AINTEGUMENTA同源异型转录因子PtAIL1控制杨树不定根原基的形成。植物生理学。2012;160(4):1996–2006.
- 29。
徐明、谢伟、黄明。两个WUSCHEL相关同源异型盒基因PeWOX11a和PeWOX11b参与了杨树不定根的形成。生理植物。2015;155(4):446–56.
- 30
李杰,张继,贾H,刘B,Sun P,Hu J,Wang L,Lu M. Wuschel相关的Homeobox 5a(Ptowx5a)参与杨树的不定根发育。树生理。2018; 38(1):139-53。
- 31.
纪念,陈克克。用Tophat和袖扣分析RNA-SEQ数据。方法Mol Biol。2016; 1374:339-61。
- 32.
Trapnell C、Roberts A、Goff L、Pertea G、Kim D、Kelley DR、Pimentel H、Salzberg SL、Rinn JL、Pachter L。TopHat和袖扣RNA-seq实验的差异基因和转录表达分析。Nat协议。2012;7(3):562–78.
- 33
Ahkami AH, Lischewski S, Haensch KT, Porfirova S, Hofmann J, Rolletschek H, Melzer M, Franken P, Hause B, Druege U等。矮牵牛扦插不定根形成的分子生理学研究:创伤反应和初级代谢的参与。新植醇。2009;181(3):613 - 25所示。
- 34
周Z,田Y,丛P,朱Y。苹果LysM结构域受体基因在防御反应中的功能研究。植物科学:一门国际植物生物学。2018;269:56–65.
- 35
Abu-eBied M,Rogovoy Stelmakh O,Mordehaev I,Grumberg M,Elbaum R,Wastieneys Go,Sadot E.解剖了微管行为在不定根诱导中的贡献。J Exp Bot。2015; 66(9):2813-24。
- 36.
Abu Abied M、Szwerdszarf D、Mordehaev I、Yaniv Y、Levinkron S、Rubinstein M、Riov J、Ophir R、Sadot E。巨桉幼嫩和成熟插条的基因表达谱揭示了微管重构在不定根形成过程中的重要性。BMC基因组学。2014;15:826.
- 37.
吴先生。杨树(Populus×robusta)茎中潜在根原基的分布及影响扦插生根的因素。林业。1972;45(2):197–209.
- 38.
柳树结状不定根的形成。中国生物医学工程学报,1938;25(9):721-5。
- 39.
不同年龄柳树茎的节状不定根。中国生物医学工程学报,2000;
- 40.
Finkel T,Holbrook NJ。氧化剂,氧化应激和老化生物学。自然。2000; 408(6809):239-47。
- 41
Singh R、Singh S、Parihar P、Mishra RK、Tripathi DK、Singh VP、Chauhan DK、Prasad SM。活性氧(ROS):植物发育过程中的有益伴侣。前植物科学。2016;7:1299.
- 42
Mangano S,Denita-Juarez SP,Choi HS,Marzol E,Hwang Y,Ranocha P,Velasquez Sm,Borassi C,Barberini ML,Aptekmann Aa等。蟾蜍素和ros介导的极性生长之间的分子联系。P Natl Acad Sci USA。2017; 114(20):5289-94。
- 43.
McCown BH,Lloyd G:木质植物培养基(WPM) - 一种木质植物种类微培养的矿物质营养制剂。Hortscience 1981,16(3):453-453。
- 44.
尤杰,方勇,熊璐:活性氧检测。bio - 101 2018年,e1010170。
- 45
Masters TL、Hilker CA、Jeraldo PR、bhagate AV、Greenwood-Quaintance KE、Eckloff BW、Chia N、Hanssen AD、Abdel MP、Yao JZ等。用于低rna含量人类样本RNA-Seq分析的cDNA文库构建方法的比较评价。中国微生物学杂志。2018;154:55-62。
- 46
Bolger AM、Lohse M、Usadel B。Trimmomatic:一种灵活的用于Illumina序列数据的微调器。生物信息学。2014;30(15):2114–20.
- 47
图斯康(Tuskan)等[1]研究了一种新型的生物信息学方法。黑杨木(Populus trichocarpa, Torr。&灰色)。科学。2006;313(5793):1596 - 604。
- 48.
江泽民,刘X,彭泽,万义,ji y,他w,wan w,luo j,guo h. ahd2.0:拟南芥激素数据库的更新版本植物系统研究。核酸RES。2011; 39(数据库问题):D1123-9。
- 49.
Steinley D,Brusco MJ。选择kappa-meath群集中的群集数。心理学方法。2011; 16(3):285-97。
- 50。
易X,杜Z,苏Z。PlantGSEA:植物群落基因集富集分析工具。核酸研究,2013年;41(网络服务器问题):W98–103。
- 51.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(T)(−Delta Delta C)方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
确认
作者感谢美国期刊专家(AJE)提高了本文的英语水平。
基金
这项工作得到了中国国家自然科学基金(NSFC登录号31670651)的支持。资金机构没有参与数据的设计,收集,分析和对数据的解释以及写作稿件。
可用性数据和材料
所有的原始数据已被存放在美国国家生物技术信息中心(NCBI)顺序读取存档(http://www.ncbi.nlm.nih.gov/sra/)在项目编号prjna516245下。
作者信息
从属关系
贡献
NW组织了整个项目,NW,YZ,ZX,CZ,ML和WX进行了实验和数据分析。NW写下并编辑了这份手稿。所有作者阅读并认可的终稿。
通讯作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
表S2。在杨树AR形成过程中基因差异表达。这些数字表示FPKM值。(XLSX 507 kb)
附加文件2:
图S1。用于时间过程转录组分析的RNA-Seq样本树状图。(PPTX 125 kb)
额外的文件3:
图S2。在杨树形成期间差异表达的基因数。(PPTX 9022 KB)
额外的文件4:
表S3。杨树中的植物激素相关基因(XLSX 30 KB)
额外的文件5:
表S4。植物激素相关基因差异表达的标准化表达值(XLSX 28kb)
附加文件6:
图S3。植物激素转运相关差异表达基因FPKM值的箱线图。FPKM代表每千碱基转录物每百万个片段的片段。每个箱线图包括Q1(1/4四分位,方框底部)、Q3(3/4四分位,方框顶部底部)、中间值Q2(方框内的线)、Q3 + 1.5 IQR(四分位区间,Q3-Q1,方框外的最高行)和Q1–1.5 IQR(方框外的最低行)。值大于Q3 + 1.5 IQR或小于Q1–1.5 IQR被视为异常值,它们被标绘为Q3之外的点 + 1.5 IQR或Q1–1.5 IQR。如果Q3 + 1.5 IQR小于Q3或Q1–1.5 IQR小于Q1,其对应的线将不显示(PPTX(38 kb)
附加文件9:
表S5。12个基因簇的功能富集(XLSX(15 kb)
额外的文件10:
图S6。具有不同浓度的杨树扦插水培培养物2O2在DAE11。面板A,B和C代表在0,500和1000μmH中生长的杨树扦插2O2分别是。酒吧 = 1. 厘米(PPTX(579 kb)
附加文件11:
表S1。RT-qPCR检测的引物。(XLSX 9 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,Y.,肖,Z.,展,C。等等。动态基因表达综合分析及过氧化氢在杨树偶然生根期间的作用调查。BMC植物杂志19,99 (2019). https://doi.org/10.1186/s12870-019-1700-7
收到了:
公认:
出版:
关键词
- 杨树
- 不定根
- 基因表达
- 植物激素
- 过氧化氢