- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
环核苷酸门控离子通道6通过胞质钙离子调节一氧化氮的产生介导拟南芥幼苗的耐高温性GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba, 文章编号:GydF4y2Ba368.GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
我们之前报道过一氧化氮(NO)和环核苷酸门控离子通道6 (CNGC6)参与植物对热休克(HS)暴露的响应。以阐明它们与耐热性的关系GydF4y2Ba拟南芥GydF4y2Ba,我们检查了HS对几组幼苗的影响:野生类型,GydF4y2Bacngc6GydF4y2Ba,GydF4y2Bacngc6GydF4y2Ba互补和过表达线。GydF4y2Ba
结果GydF4y2Ba
在HS曝光后,否较低的水平GydF4y2Bacngc6GydF4y2Ba与野生型幼苗相比,转基因株系的幼苗数量显著增加GydF4y2BaCNGC6GydF4y2Ba表达水平。用钙离子(CaGydF4y2Ba2+GydF4y2Ba在HS条件下,拟南芥幼苗NO水平升高,而EGTA (CaGydF4y2Ba2+GydF4y2Ba这表明CNGC6刺激NO的积累依赖于胞质Ca的增加GydF4y2Ba2+GydF4y2Ba([CA.GydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba).通过对NIA2和NOA1过表达转基因植株的表型观察和耐热性试验证实了这一观点GydF4y2Bacngc6GydF4y2Ba背景。Western blotting表明CNGC6通过NO刺激HS蛋白的积累。GydF4y2Ba
结论GydF4y2Ba
这些数据表明,CNGC6在HS途径中作用于NO的上游,这改善了我们对植物高温响应启动机制的认识不足。GydF4y2Ba
介绍GydF4y2Ba
植物的生长受许多环境因素的控制,其中包括热休克(HS),热休克往往对植物造成严重的损害。亚致死热暴露会在细胞中引发防御反应,并阻止它们后续致死热暴露。例如,HS蛋白(HSPs)在HS条件下的细胞反应中起重要作用。一些热休克蛋白作为分子伴侣来抑制蛋白质的变性和聚集;然而,其他热敏感蛋白,如泛素和某些蛋白酶,以非原生蛋白为目标进行降解[GydF4y2Ba1GydF4y2Ba].因此,HSP合成的调控是植物耐热一个特别重要的问题。GydF4y2Ba
一氧化氮(NO)是一种关键的信号分子,参与植物整个生命周期的许多过程,包括种子萌发和休眠、植物生长发育、开花以及植物与生物或非生物胁迫的相互作用[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].精氨酸 - denpendent NO合酶(NOS)和亚硝酸盐依赖性硝酸还原酶(NR)是用于NO产生在植物中的两个重要的酶。NOS的生理功能已引起显著的兴趣。L-精氨酸,NADPH和OGydF4y2Ba2GydF4y2Ba是它的底物;它们被用来产生NO,NADPGydF4y2Ba+GydF4y2Ba,和瓜氨酸[GydF4y2Ba4.GydF4y2Ba].一氧化氮相关蛋白1 (Nitric oxide associated protein 1, NOA1)参与了一氧化氮水平的调控GydF4y2Ba拟南芥GydF4y2Ba(下文中,拟南芥)GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].虽然NOA1影响植物NO生成的机制尚未完全阐明,GydF4y2Banoa1GydF4y2Ba展示内源性降低的内源性没有水平,也是植物中无功能研究的有价值的材料。GydF4y2Ba
NR,对于氮同化的必要胞质溶胶定位酶,也是NO的植物[一个重要来源GydF4y2Ba7.GydF4y2Ba].在正常情况下,它优先将硝酸盐还原为亚硝酸盐[GydF4y2Ba8.GydF4y2Ba].相比较而言,极端的生长条件下,NR可以从NAD(P)H传递电子到NOGydF4y2Ba2GydF4y2Ba−GydF4y2Ba以诱导NO的生物合成。NR在调节NO的产生响应于生物或非生物应力中心作用。两个高度同源的自然保护区,硝酸还原酶1(NiAl的)和硝酸还原酶2(NIA2),已经在拟南芥中被确定。虽然保护区的氨基酸序列是高度保守的,NIA2显示出比NR1更大的活性,占在植物细胞中的总NR活性的约90%的GydF4y2Ba9.GydF4y2Ba].GydF4y2Ba
作为一种广泛分布的信号分子,NO已经发现,增加的植物耐受性的许多环境因素,包括干旱,盐度,重金属,和疾病[GydF4y2Ba2GydF4y2Ba].此外,我们甚至报道了增加后极端热暴露的增加对于植物驯化而对热应力来说至关重要[GydF4y2Ba10.GydF4y2Ba,与先前的研究结果不一致[GydF4y2Ba11.GydF4y2Ba],这可能是由于光、年龄和温度对NO产生的影响,如我们以前的工作所示[GydF4y2Ba12.GydF4y2Ba(见补充图S3)。在最近的一项检讨中[GydF4y2Ba13.GydF4y2Ba],提出了一个模型,即NO的过度积累诱导了热敏表型(可以用NO清除剂挽救),这与我们之前的结论一致[GydF4y2Ba10.GydF4y2Ba]只有中等的不增加可能导致增加的耐热性(见图。GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
我们之前报道过过氧化氢(HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)刺激的NO产生的这反过来又调节的下游蛋白calmodulin3(CAM3)取决于增加HSP积累促进耐热[GydF4y2Ba12.GydF4y2Ba].有趣的是,我们随后的研究表明HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba-诱导的NO刺激抗氧化酶的活性,从而消除过量的HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,表示H之间的反馈抑制GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba及耐热性中的NO [GydF4y2Ba14.GydF4y2Ba].虽然NO在耐热性具有重要作用,它的感应背后的确切机制尚不清楚。HS信号的这方面的进一步研究将丰富我们的耐热性的理解。GydF4y2Ba
环核苷酸门控阳离子通道(CNGCs)是由环核苷酸磷酸或超极化激活的非选择性阳离子传导通道。在植物中,在信令可被绑定到其传导的钙离子能力途径CNGCs函数(CAGydF4y2Ba2+GydF4y2Ba)而不是其他阳离子进入植物细胞[GydF4y2Ba15.GydF4y2Ba].加利福尼亚州GydF4y2Ba2+GydF4y2Ba动员是在各种植物的信号传导途径的一个核心问题。在拟南芥基因组中包含具有两个不同的和共享的生物活性[20个表示CNGC基因GydF4y2Ba16.GydF4y2Ba].例如依赖cngc14的CaGydF4y2Ba2+GydF4y2Ba信号传导在介于拟南芥根系中培养植物素生长反应的早期术语阶段发挥直接作用[GydF4y2Ba17.GydF4y2Ba].相比之下,拟南芥CNGC2与茉莉酸诱导的外体细胞CaGydF4y2Ba2+GydF4y2Ba表皮细胞内的内流[GydF4y2Ba18.GydF4y2Ba].在这八个钙GydF4y2Ba2+GydF4y2Ba拟南芥(包括六种CNGC和两个谷氨酸受体样通道),CNGC18是唯一对花粉管道引导至关重要的渠道[GydF4y2Ba19.GydF4y2Ba].然而,植物CNGCs的功能和调节尚未彻底在植物科学的重大问题进行评估。GydF4y2Ba
cngc也被认为是Ca的调解人GydF4y2Ba2+GydF4y2BaHS通路中的信号。我们发现热激活质膜(PM) CaGydF4y2Ba2+GydF4y2Ba-透性通道CNGC6参与拟南芥幼苗HSP基因的表达和耐热性的获得[GydF4y2Ba20.GydF4y2Ba].在花粉,花粉AtCNGC16在开发过程中对耐热性至关重要[GydF4y2Ba21.GydF4y2Ba].相反地,CNGC2缺乏导致升高的耐热性的植物,表明在诱导拟南芥植物的耐热性[其负作用GydF4y2Ba22.GydF4y2Ba].这些报道可能表明拟南芥中某些CNGCs受高温刺激,并在不同生长阶段介导HS信号。GydF4y2Ba
近年来,越来越多的研究认为NO与Ca之间存在密切关系GydF4y2Ba2+GydF4y2Ba植物中的信号传导。加利福尼亚州GydF4y2Ba2+GydF4y2Ba并且没有很好地建立为普遍的细胞内第二使者[GydF4y2Ba23.GydF4y2Ba].对植物的研究表明,它们各自的途径有显著的重叠;然而,谁是另一个的下游仍然存在争议。大量的研究表明NO在调节Ca中具有特定的作用GydF4y2Ba2+GydF4y2Ba信号。例如,在没有捐赠者释放的释放诱导细胞溶质CA的瞬时升高GydF4y2Ba2+GydF4y2Ba([CA.GydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba) 在GydF4y2Ba烟草plumbaginifoliaGydF4y2Ba细胞(GydF4y2Ba24.GydF4y2Ba].相反,一些研究评估了Ca的作用GydF4y2Ba2+GydF4y2Ba启动NO信令。例如,在一些植物物种中,加利福尼亚GydF4y2Ba2+GydF4y2Ba和CaM作为辅助因子稳定植物NOS活性和NO积累,表明CaGydF4y2Ba2+GydF4y2Ba或CaGydF4y2Ba2+GydF4y2Ba-CaM直接与植物中的nos类酶相互作用[GydF4y2Ba8.GydF4y2Ba].目前,NO和Ca之间的关系GydF4y2Ba2+GydF4y2Ba在高温下的植物中是不明显的。GydF4y2Ba
在这项研究中,我们使用的模型植物拟南芥,探讨NO和Ca的功能GydF4y2Ba2+GydF4y2Ba-高温条件下CNGC6的渗透通道。我们的研究结果表明CNGC6作为HS信号通路的上游因子参与NO信号通路。GydF4y2Ba
结果GydF4y2Ba
在野生型的幼苗NO积累HS的影响,GydF4y2Bacngc6GydF4y2Ba中,补充线,并且过度表达线GydF4y2Ba
NO是一种植物信号分子,在应对多种环境胁迫中起着至关重要的作用,包括HS [GydF4y2Ba2GydF4y2Ba].大量的研究表明在控制NO积累[为CNGCs特定角色GydF4y2Ba25.GydF4y2Ba].为了研究CNGC6与NO的耐热性之间的关系,我们首先利用野生型植株,一个T-DNA插入突变体(GydF4y2Bacngc6GydF4y2Ba;SALK_042207),互补行(COM12;GydF4y2Bacngc6 + cngc6GydF4y2Ba),GydF4y2BaCNGC6GydF4y2Ba超表达线(OE8;哥伦比亚[Col] +GydF4y2BaCNGC6GydF4y2Ba)[GydF4y2Ba20.GydF4y2Ba].用荧光探针4-氨基-5-甲基氨基-2 ',7 ' -二氟荧光素二乙酸酯(DAF-FM DA)检测细胞内NO的形成,它能渗透细胞膜,并被细胞内酯酶转化为4-氨基-5-甲基氨基-2 ',7 ' -二氟荧光素(DAF-FM)。它不直接与NO自由基反应,而是与亚氮酸酐反应生成一种高荧光的三唑化合物[GydF4y2Ba26.GydF4y2Ba].GydF4y2Ba
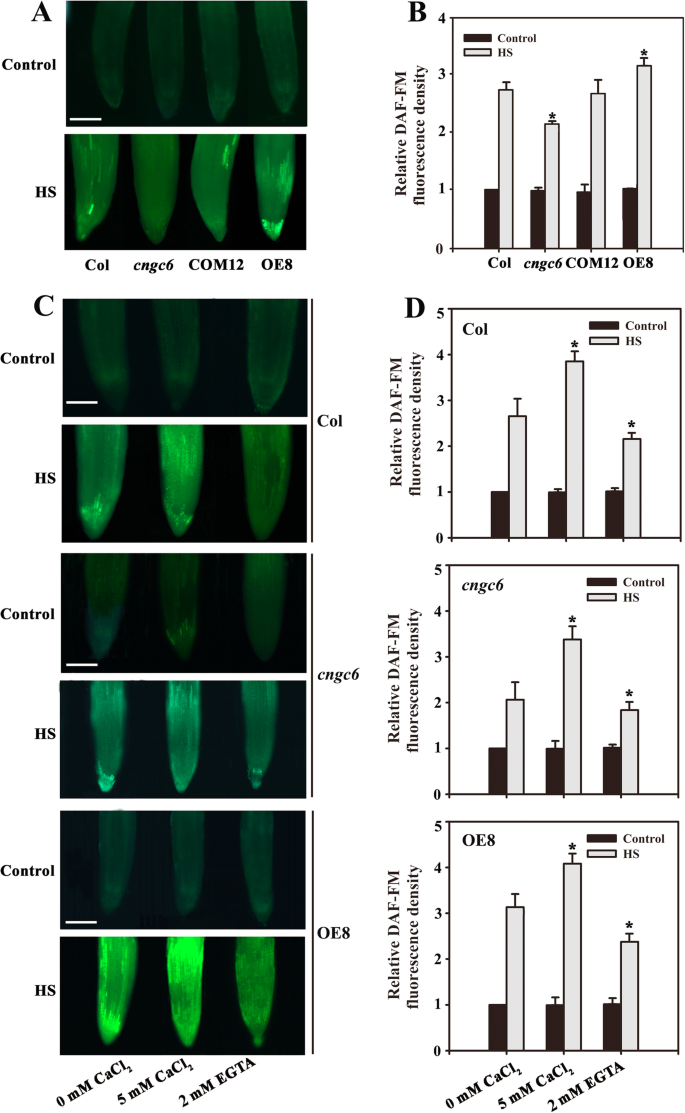
荧光分析表明,在正常生长条件下(22°C),幼苗中没有丰富的差异。在45℃下HS处理60分钟[GydF4y2Ba10.GydF4y2Ba],NO水平在野生型幼苗提高了273%。这比中观察到的更大的增加GydF4y2Bacngc6GydF4y2Ba(213%);然而,NO水平几乎完全在COM12秧苗(269%)救出,甚至在更高的幼苗OE8(310%)比野生型苗(图GydF4y2Ba1GydF4y2Baa, b).这些数据表明,HS处理后NO的变化依赖于GydF4y2BaCNGC6GydF4y2Ba表达式。GydF4y2Ba
Ca的影响GydF4y2Ba2+GydF4y2Ba对拟南芥幼苗NO积累的影响(GydF4y2Ba一种GydF4y2Ba)在英国野生型,GydF4y2Bacngc6GydF4y2Ba将22°C下生长的COM12和OE8幼苗置于45°C (HS)或22°C (Control)下处理60 min。用DAF-FM DA染色根,用荧光显微镜检测幼苗中NO水平。Bar = 100 μm。(GydF4y2BaB.GydF4y2Ba)根系中相对DAF-FM荧光密度。所提供的数据是来自5个独立实验的平均值±标准误差(SE),每个处理至少有10个根。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col (Student’sT.GydF4y2Ba以及)。(GydF4y2BaCGydF4y2Ba)在英国野生型,GydF4y2Bacngc6GydF4y2Ba,将OE8幼苗置于45°C (HS)或22°C (Control)维持60 min。然后用荧光显微镜检测植物根部的NO水平。Bar = 100 μm。(GydF4y2BaD.GydF4y2Ba)相对DAF-FM荧光密度在根部。给出的数据是平均值±来自五个独立的实验,至少十根对各治疗测量SE。*GydF4y2BaP.GydF4y2Ba < 0.05 versus 0 mM CaCl2GydF4y2Ba(学生的GydF4y2BaT.GydF4y2Ba以及)GydF4y2Ba
钙的影响GydF4y2Ba2+GydF4y2Ba对野生型幼苗NO水平的影响GydF4y2Ba
CNGC6是热活化的CaGydF4y2Ba2+GydF4y2Ba在质膜中可透过的信道的植物细胞(PM)[GydF4y2Ba20.GydF4y2Ba].加利福尼亚州GydF4y2Ba2+GydF4y2Ba,可能是最通用的在真核生物中发现离子,已被证实在一些生理过程[与NO协调GydF4y2Ba8.GydF4y2Ba].因此,我们推断CNGC6通过Ca促进NO的积累GydF4y2Ba2+GydF4y2Ba介导热能。GydF4y2Ba
为了验证这一假设,我们审查了野生型的NO水平,GydF4y2Bacngc6GydF4y2Ba, 5 mM CaCl预处理的OE8幼苗GydF4y2Ba2GydF4y2Ba或2mm EGTA (CaGydF4y2Ba2+GydF4y2Ba螯合剂)在萌发前[GydF4y2Ba27.GydF4y2Ba].荧光分析表明,在正常条件下的幼苗中NO水平无明显差异。Under HS conditions, treatment with 5 mM Ca2+GydF4y2Ba野生型的NO水平分别为389、326和407%。GydF4y2Bacngc6GydF4y2Ba、OE8幼苗。而在野生型中,2 mM EGTA降低了NO的增加,分别为对照个体的219、187和227%GydF4y2Bacngc6GydF4y2Ba和OE8苗(图GydF4y2Ba1GydF4y2BaC,D)。GydF4y2Ba
上的耐热NO的影响GydF4y2Bacngc6GydF4y2Ba幼苗GydF4y2Ba
接下来,我们研究了两种NO供体,硝普钠(SNP)和外源性应用的效果GydF4y2BaS.GydF4y2Ba亚硝基的- - - - - -GydF4y2BaNGydF4y2Ba-乙酰青霉胺(SNAP)对抗热性的影响GydF4y2Bacngc6GydF4y2Ba幼苗。GydF4y2Ba
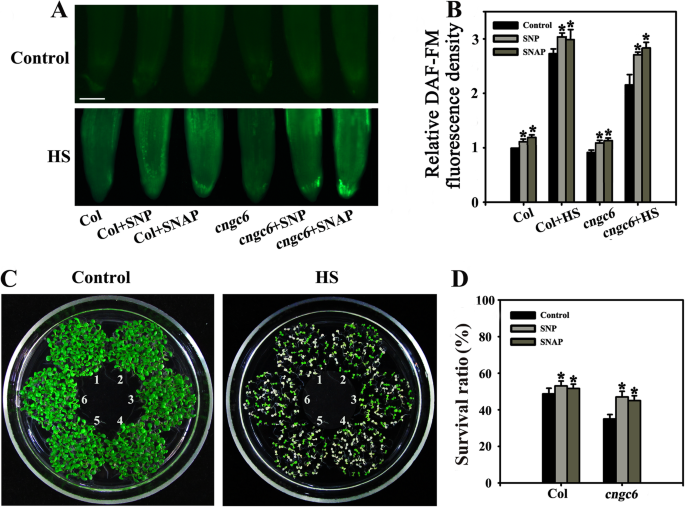
荧光分析表明,SNP和SNAP(各20 μM)均增加了野生型和野生型的NO含量GydF4y2Bacngc6GydF4y2Ba正常和HS条件下的植物;此外,SNP的效果尤其明显(图。GydF4y2Ba2GydF4y2Baa, b).为了测定植物对热胁迫的生理适应性,计算45°C HS处理100 min和22°C恢复5 d的植物存活率[GydF4y2Ba28.GydF4y2Ba].正常生长条件下(22℃),野生型与野生型无明显表型差异GydF4y2Bacngc6GydF4y2Ba苗(无花果。GydF4y2Ba2GydF4y2Bac、控制)。HS处理后,野生型幼苗的成活率(48%)高于野生型GydF4y2Bacngc6GydF4y2Ba幼苗(36%),与我们之前的报告一致[GydF4y2Ba20.GydF4y2Ba](参见图GydF4y2Ba3.GydF4y2Ba).外源基因20 μM SNP或SNAP预处理均能提高白藜芦醇的存活率GydF4y2Bacngc6GydF4y2Ba与野生型幼苗相似(图。GydF4y2Ba2GydF4y2Bad),说明在CNGC6缺失的情况下,NO的加入挽救了突变体的热敏性。同时,野生型幼苗的成活率略有提高(图。GydF4y2Ba2GydF4y2Bad)。基于这些结果,我们得出的初步结论是,NO参与CNGC6信号作为下游的因素。GydF4y2Ba
NO供体对其耐热性的影响GydF4y2Bacngc6GydF4y2Ba幼苗。(GydF4y2Ba一种GydF4y2Ba) 8天大的野生型和GydF4y2Bacngc6GydF4y2Ba将幼苗暴露在45°C (HS)或22°C (Control)下60 min。然后用荧光显微镜检测植物根部的NO水平。Bar = 100 μm。(GydF4y2BaB.GydF4y2Ba)相对DAF-FM荧光密度在根部。给出的数据是平均值±来自五个独立的实验,至少十根对各治疗测量SE。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col. (CGydF4y2Ba将幼苗置于45°C (HS)或22°C(对照)处理100 min, 5天后恢复至22°C并拍照。聚类如下:1,Col;2、Col + SNP;3、Col + SNAP;4,GydF4y2Bacngc6GydF4y2Ba;5,GydF4y2Bacngc6GydF4y2Ba + SNP; and 6,cngc6GydF4y2Ba + SNAP. (D.GydF4y2Ba) HS处理后幼苗的成活率。所提供的数据是至少5个独立实验的平均值±标准差,每个实验50棵幼苗。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col (Student’sT.GydF4y2Ba以及)GydF4y2Ba
通过改善热电图GydF4y2BaAtNOA1GydF4y2Ba过度的GydF4y2Bacngc6GydF4y2Ba背景。(GydF4y2Ba一种GydF4y2Ba) RT-qPCR分析GydF4y2BaAtCNGC6GydF4y2Ba和GydF4y2BaAtNOA1GydF4y2Ba野生型转录,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba2GydF4y2Ba植物。实验重复了三次,得到了相似的结果。Each data point represents the mean ± standard deviation (SD; n = 3). Asterisks indicate a significant difference relative to Col (Student’sT.GydF4y2Ba-T.E.st, **P < 0.01 and ***P < 0.001). (B.GydF4y2Ba)在英国野生型,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba2GydF4y2Ba将生长在22°C的幼苗暴露在45°C (HS)或22°C (Control)下60 min。然后用荧光显微镜检测植物根部的NO水平。Bar = 100 μm。(GydF4y2BaCGydF4y2Ba)相对DAF-FM荧光密度在根部。给出的数据是平均值±来自五个独立的实验,至少十根对各治疗测量SE。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col. (D.GydF4y2Ba) 22℃条件下生长的幼苗在45℃(HS)或22℃(Control)条件下暴露100 min, 5天后恢复到22℃并拍照。聚类如下:1、野生型;2,GydF4y2Bacngc6GydF4y2Ba;3,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba;4,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba2GydF4y2Ba.(GydF4y2BaE.GydF4y2Ba) HS处理后幼苗的成活率。所提供的数据是至少5个独立试验的平均值±标准差,每个试验50棵幼苗。*P < 0.05 vs Col(学生的GydF4y2BaT.GydF4y2Ba以及)GydF4y2Ba
AtNOA1GydF4y2Ba和GydF4y2Baatnia2GydF4y2Ba过度的GydF4y2Bacngc6GydF4y2Ba背景提高了耐热性GydF4y2Ba
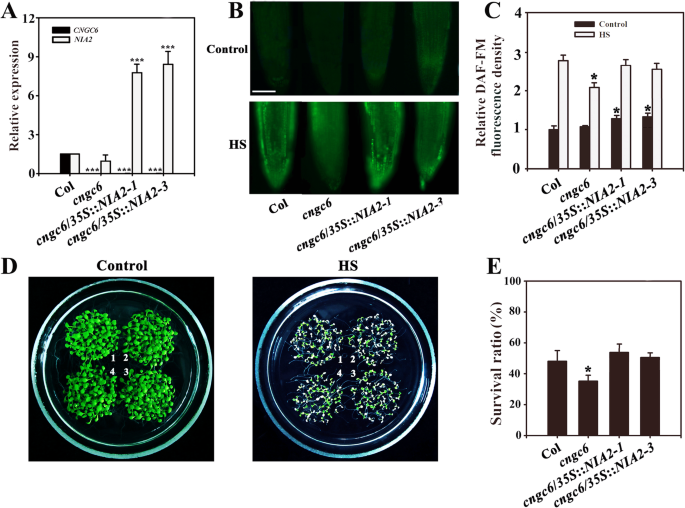
我们以前发现,NO功能是作为信号在使用耐热突变体GydF4y2Banoa1GydF4y2Ba和GydF4y2Bania1 nia2GydF4y2Ba,其示出热灵敏度由于NO [缺乏GydF4y2Ba10.GydF4y2Ba].为了进一步证实在HS条件下CNGC6对NO信号转导的影响,我们得到两个GydF4y2BaAtNOA1GydF4y2Ba-overexcress转基因素线,GydF4y2Bacngc6/35S: NOA1-1GydF4y2Ba和GydF4y2Bacngc6/35S: NOA1-2GydF4y2Ba,两个GydF4y2BaAtNIA2-GydF4y2Baoverexpressing转基因线,GydF4y2Bacngc6/35S: NIA2-1GydF4y2Ba和GydF4y2Bacngc6/35S: NIA2-3GydF4y2Ba,并检查了超额内部的影响GydF4y2BaCNGC6GydF4y2Ba-缺陷突变体。高亢的表情GydF4y2BaAtNOA1GydF4y2Ba和GydF4y2Baatnia2GydF4y2Ba是通过实时定量RT-PCR确定的GydF4y2Ba(GydF4y2BaRT-QPCR)(图GydF4y2Ba3.GydF4y2Ba一种,GydF4y2Ba4.GydF4y2Ba一个)。GydF4y2Ba
通过改善热电图GydF4y2Baatnia2GydF4y2Ba过度的GydF4y2Bacngc6GydF4y2Ba背景。(GydF4y2Ba一种GydF4y2Ba) RT-qPCR分析GydF4y2BaAtCNGC6GydF4y2Ba和GydF4y2Baatnia2GydF4y2Ba野生型转录,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6/35S: NIA2-3GydF4y2Ba植物。实验重复了三次,得到了相似的结果。每个数据点代表平均值±SD (n = 3)。星号表示显著相对山口差异(学生GydF4y2BaT.GydF4y2Ba-T.E.st, ***P < 0.001). (B.GydF4y2Ba)在英国野生型,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6/35S: NIA2-3GydF4y2Ba将生长在22°C的幼苗暴露在45°C (HS)或22°C (Control)下60 min。然后用荧光显微镜检测植物根部的NO水平。Bar = 100 μm。(GydF4y2BaCGydF4y2Ba)相对DAF-FM荧光密度在根部。给出的数据是平均值±来自五个独立的实验,至少十根对各治疗测量SE。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col (Student’sT.GydF4y2Ba以及)。(GydF4y2BaD.GydF4y2Ba) 22℃条件下生长的幼苗在45℃(HS)或22℃(Control)条件下暴露100 min, 5天后恢复到22℃并拍照。聚类如下:1、野生型;2,GydF4y2Bacngc6GydF4y2Ba;3,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba;4,GydF4y2Bacngc6/35S: NIA2-3GydF4y2Ba.(GydF4y2BaE.GydF4y2Ba) HS处理后幼苗的成活率。所提供的数据是至少5个独立试验的平均值±标准差,每个试验50棵幼苗。*P < 0.05 vs Col(学生的GydF4y2BaT.GydF4y2Ba以及)GydF4y2Ba
DAF-FM荧光分析表明GydF4y2BaAtNOA1GydF4y2Ba和GydF4y2Baatnia2GydF4y2Ba在正常和HS条件下,过表达增加了转基因品系体内NO水平(图3)。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba).在室温下,之间没有观察到明显的表型差异GydF4y2Bacngc6GydF4y2Ba和转基因植物GydF4y2Ba.GydF4y2Ba然而,在高温下,GydF4y2BaAtNOA1GydF4y2Ba或GydF4y2Baatnia2GydF4y2Ba过表达明显增加了相应的转基因线的存活率与GydF4y2Bacngc6GydF4y2Ba(无花果。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba).GydF4y2Ba
这些结果表明,过度表达GydF4y2BaAtNOA1GydF4y2Ba或GydF4y2Baatnia2GydF4y2Ba恢复的耐热性在一个GydF4y2BaCNGC6GydF4y2Ba缺陷型突变体,提供在耐热性和NO CNGC6之间的关系的遗传证据。GydF4y2Ba
HS对其耐热性的影响GydF4y2Bacngc6 noa1GydF4y2Ba双突变体幼苗GydF4y2Ba
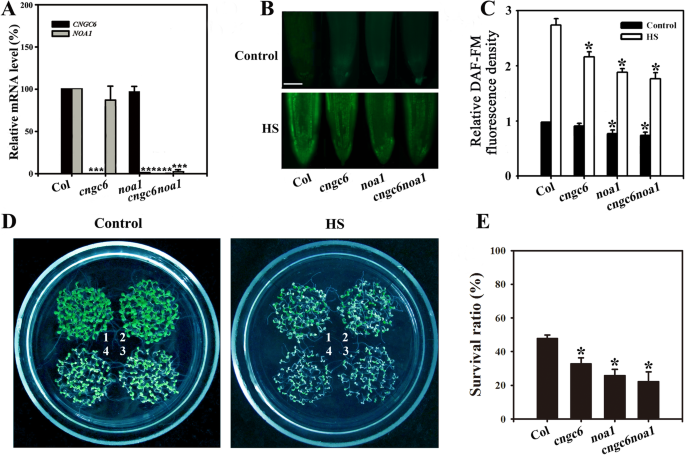
为了进一步确定CNGC6和NO在耐热性中的作用,我们获得了GydF4y2Bacngc6 noa1GydF4y2Ba通过杂交获得双突变体GydF4y2BaCNGC6GydF4y2Ba和GydF4y2BaNOA1GydF4y2Ba利用RT-qPCR进行转录(图GydF4y2Ba5.GydF4y2Baa).在正常和HS条件下GydF4y2Bacngc6 noa1GydF4y2Ba苗是接近的值GydF4y2Banoa1GydF4y2Ba苗(无花果。GydF4y2Ba5.GydF4y2BaB, c),表示缺少GydF4y2BaCNGC6GydF4y2Ba没有明显降低NO在GydF4y2Banoa1GydF4y2Ba幼苗。在正常情况下,GydF4y2Bacngc6 noa1GydF4y2Ba苗小表现和褪绿,类似GydF4y2Banoa1GydF4y2Ba苗(无花果。GydF4y2Ba5.GydF4y2Bad,控制)。在HS条件下,存活率GydF4y2Bacngc6 noa1GydF4y2Ba苗期接近GydF4y2Banoa1GydF4y2Ba苗(无花果。GydF4y2Ba5.GydF4y2Bad,e)中,表示不存在GydF4y2BaCNGC6GydF4y2Ba是否加剧了热敏感性GydF4y2Banoa1GydF4y2Ba.GydF4y2Ba
生存现状GydF4y2Bacngc6 noa1GydF4y2Ba双突变体。(GydF4y2Ba一种GydF4y2Ba) RT-qPCR分析GydF4y2BaCNGC6GydF4y2Ba和GydF4y2BaNOA1GydF4y2Ba野生型转录,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Banoa1GydF4y2Ba,GydF4y2Bacngc6 noa1GydF4y2Ba幼苗。实验重复了三次,得到了相似的结果。每个数据点代表平均值±SD (n = 3)。***P < 0.001(学生的GydF4y2BaT.GydF4y2Ba以及)。(GydF4y2BaB.GydF4y2Ba)在英国野生型,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Banoa1GydF4y2Ba,GydF4y2Bacngc6 noa1GydF4y2Ba将生长在22°C的幼苗暴露在45°C (HS)或22°C (Control)下60 min。用DAF-FM DA染色根,用荧光显微镜检测幼苗中NO水平。Bar = 100 μm。(GydF4y2BaCGydF4y2Ba)根系中相对DAF-FM荧光密度。所提供的数据是来自5个独立实验的平均值±标准误差(SE),每个处理至少有10个根。*GydF4y2BaP.GydF4y2Ba < 0.05 versus Col (Student’sT.GydF4y2Ba以及)。(GydF4y2BaD.GydF4y2Ba) 22°C条件下生长的8日龄幼苗在45°C (HS)或22°C (Control)条件下暴露100 min, 5天后恢复到22°C并拍照。聚类如下:1、野生型;2,GydF4y2Bacngc6GydF4y2Ba;3,GydF4y2Banoa1GydF4y2Ba;4,GydF4y2Bacngc6 noa1GydF4y2Ba.(GydF4y2BaE.GydF4y2Ba) HS处理后幼苗的成活率。所提供的数据是至少5个独立试验的平均值±标准差,每个试验50棵幼苗。*P < 0.05(学生的GydF4y2BaT.GydF4y2Ba以及)GydF4y2Ba
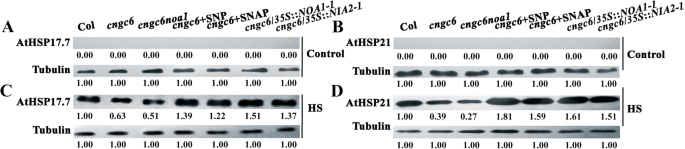
通过NO对AtHSP17.7和AtHSP21表达CNGC6的影响GydF4y2Ba
热休克蛋白是重要的所有生物体通过保持蛋白内稳态分子伴侣急性应激下生存。为了检验CNGC6-在拟南芥的基本机制和NO诱导的耐热性,我们接下来检查了AtHSP17.7和AtHSP21在通过Western印迹苗积累CNGC6和NO的影响。Both of AtHSP17.7 and AtHSP21 were not detected at 22 °C (Fig.6.GydF4y2Baa、b);但在37℃时,两种蛋白均有积累。突变体的积累水平低于野生型(最低GydF4y2Bacngc6 noa1GydF4y2Ba), 20 μM SNP或SNAP强烈刺激。此外,AtHSP17.7和AtHSP21的积累在GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba和GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba植物相比,GydF4y2Bacngc6GydF4y2Ba(非转换背景;无花果。GydF4y2Ba6.GydF4y2Bac, d).在每一个实验中,都使用微管蛋白以确保样品载量相等。GydF4y2Ba
CNGC6经NO介导对AtHSP17.7和AtHSP21表达的影响(GydF4y2Ba一种GydF4y2Ba-GydF4y2BaD.GydF4y2Ba)Ten-day-old seedlings grown at 22 °C were exposed to 37 °C (HS) or maintained at 22 °C (Control) for 2 h. Total protein was then extracted, separated by SDS-PAGE, and analyzed by Western blotting. Tubulin was used as an internal control. Three independent experiments were carried out; the results indicate similar trends in protein accumulation. The numbers below each lane represent the relative intensity of each signal
在这些结果表明,NO供体的该应用程序超表达GydF4y2BaAtNOA1GydF4y2Ba或GydF4y2Baatnia2GydF4y2Ba刺激HSPs表达GydF4y2Bacngc6GydF4y2Ba突变体,提供进一步的证据表明在HS途径中没有CNGC6下游的作用。GydF4y2Ba
NO对Ca活性的影响GydF4y2Ba2+GydF4y2Ba透水通道GydF4y2Ba
以上结果为CNGC6在no介导的拟南芥幼苗耐高温性获得中的作用提供了证据。在植物中,NO在控制Ca中起着特殊的作用GydF4y2Ba2+GydF4y2Ba稳态亦已报告[GydF4y2Ba24.GydF4y2Ba].GydF4y2Ba
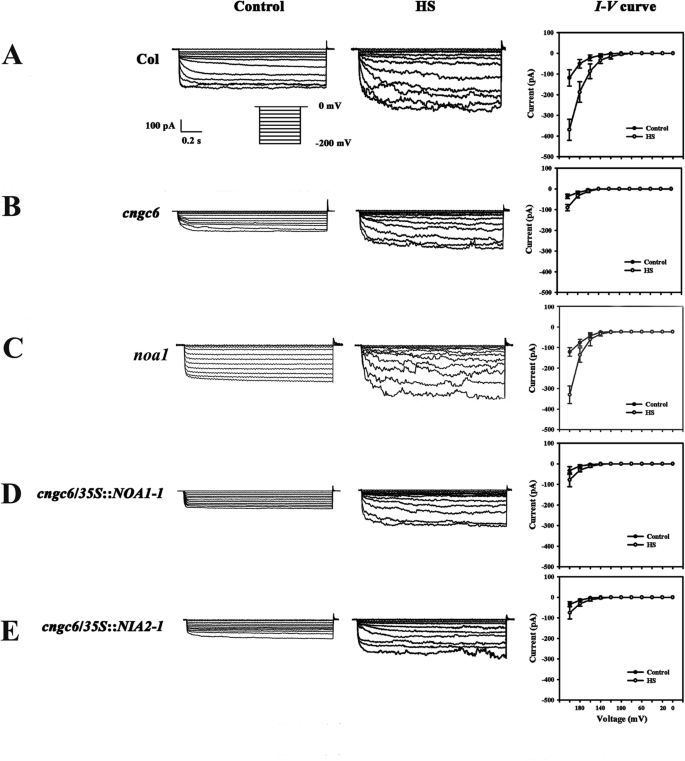
确定NO是否影响热响应性Ca的功能GydF4y2Ba2+GydF4y2Ba利用全细胞膜片钳技术,研究了内源性NO对拟南芥根原生质体PM中CNCG6活性的影响[GydF4y2Ba20.GydF4y2Ba].在正常情况下,钙GydF4y2Ba2+GydF4y2Ba目前在GydF4y2Bacngc6GydF4y2Ba−200 mV时(−36 pA)低于野生型(−118 pA)。HS在37℃下,向内CaGydF4y2Ba2+GydF4y2Ba野生型在1 min内电流大幅增加至−369 pA,而野生型仅轻微增加至−90 pAGydF4y2Bacngc6GydF4y2Ba(无花果。GydF4y2Ba7.GydF4y2BaA, b),与我们以前的报告一致[GydF4y2Ba20.GydF4y2Ba].在GydF4y2Banoa1GydF4y2Ba突变体,内部没有水平,CAGydF4y2Ba2+GydF4y2Ba电流显示出与那些在野生型正常和HS条件下没有明显的差异(图GydF4y2Ba7.GydF4y2BaC)。两个转基因品系具有高内部NO水平,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba和GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,钙GydF4y2Ba2+GydF4y2Ba电流的那些相似的GydF4y2Bacngc6GydF4y2Ba(非转基因背景)在正常和HS条件下(图。GydF4y2Ba7.GydF4y2Bad, e)GydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba使用钙水平GydF4y2Ba2+GydF4y2Ba传感器蛋白aequorin(附加文件GydF4y2Ba1GydF4y2Ba:图S1),说明NO对Ca无明显影响GydF4y2Ba2+GydF4y2Ba通道的活动。GydF4y2Ba
钙的膜片钳分析GydF4y2Ba2+GydF4y2Ba-野生型cngc6, noa1, cngc6/ 35s:: noa1 - 1, cngc6/ 35s:: NIA2-1幼苗的渗透通道。加利福尼亚州GydF4y2Ba2+GydF4y2BaCurrent before HS (at 22 °C, control) and after HS (at 37 °C, HS) was compared in the root cell protoplasts of 10-day-old wild-type (一种GydF4y2Ba),GydF4y2Bacngc6GydF4y2Ba(GydF4y2BaB.GydF4y2Ba),GydF4y2Banoa1GydF4y2Ba(GydF4y2BaCGydF4y2Ba),GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba(GydF4y2BaD.GydF4y2Ba) 和GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba(GydF4y2BaE.GydF4y2Ba) 植物。加利福尼亚州GydF4y2Ba2+GydF4y2Ba电流通过步骤电压钳记录。每个轨迹是从六个原生质体的代表电流。在原生质体的电流被分别显示在左侧和中间列。的GydF4y2BaI-V.GydF4y2Ba曲线右栏显示(均值±标准差,n = 6)GydF4y2Ba
讨论GydF4y2Ba
CNGC6, CaGydF4y2Ba2+GydF4y2BaHS条件下拟南芥幼苗中NO的积累GydF4y2Ba
暴露于高温,通常导致增加的[CaGydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba以及植物细胞中NO的产生;这两个CaGydF4y2Ba2+GydF4y2Ba和NO在植物抗热胁迫中起重要作用[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba].CA之间的关系是什么?GydF4y2Ba2+GydF4y2Ba和NO信号通路在耐热性中的作用?在这项研究中,我们获得了证据,CNGC6是一种热激活的CaGydF4y2Ba2+GydF4y2Ba可透过的信道,诱导NO的产生,以便调节的HSP的积累,以促进耐热拟南芥。GydF4y2Ba
NO作为植物多个生物学过程中的重要信使,被多种成分诱导介导抗性反应。我们之前发现NO在植物的耐热性中起信号作用[GydF4y2Ba10.GydF4y2Ba].我们随后证明了HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba作为第二信使通过NO诱导热耐受性[GydF4y2Ba12.GydF4y2Ba].HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba以前有报道称其与细胞内游离钙GydF4y2Ba2+GydF4y2Ba[GydF4y2Ba30.GydF4y2Ba].最近,一些研究强调Ca的作用GydF4y2Ba2+GydF4y2Ba在发起NO产生在植物中[GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].因此,我们推导出CA之间应该有一个密切的关系GydF4y2Ba2+GydF4y2Ba和NO在HS信令。GydF4y2Ba
cngc通过调节离子的流入和流出来影响各种生物过程。我们发现了热激活和camp激活的PM CaGydF4y2Ba2+GydF4y2Ba通道CNGC6,参与传导CaGydF4y2Ba2+GydF4y2Ba进入细胞质;在那个研究中,T-DNA插入突变体GydF4y2Bacncg6GydF4y2Ba表现出较低的钙GydF4y2Ba2+GydF4y2Ba当前型比野生型[GydF4y2Ba20.GydF4y2Ba].此外,向内的CaGydF4y2Ba2+GydF4y2Ba在COM12和OE8中电流高于在GydF4y2Bacngc6GydF4y2Ba取决于GydF4y2BaCNGC6GydF4y2BaHS条件下的表达水平[GydF4y2Ba20.GydF4y2Ba],提示CNGC6介导CaGydF4y2Ba2+GydF4y2Ba进入细胞。因此,我们利用GydF4y2Bacngc6GydF4y2Ba和上述两种转基因品系,研究在HS条件下CNGC6与NO的关系。GydF4y2Ba
首先,我们用荧光探针DAF-FM DA检测了在HS条件下NO的积累。在正常生长条件下,野生型GydF4y2Bacngc6GydF4y2Ba、COM12和OE8幼苗相对稳定。而高温暴露刺激了NO在这些幼苗体内的积累GydF4y2BaCNGC6GydF4y2Ba表达水平(无花果。GydF4y2Ba1GydF4y2Baa, b),表明CNGC6通过调节NO积累在耐热性中起重要作用。GydF4y2Ba
由于CNCG6在hs处理植物中的生物活性,我们检测了CaGydF4y2Ba2+GydF4y2Ba在野生型NO积累,GydF4y2Bacngc6GydF4y2Ba和OE8植物。我们的实验表明CaGydF4y2Ba2+GydF4y2Ba在HS条件下刺激了NO在这些幼苗中的积累。然而,CaGydF4y2Ba2+GydF4y2Ba螯合剂EGTA对野生型和OE8幼苗NO积累有明显的抑制作用(图2)。GydF4y2Ba1GydF4y2Bac, d),提示cngc6介导的游离CaGydF4y2Ba2+GydF4y2Ba是促进NO信号的关键因素。因此,我们提出CNGC6通过游离Ca调控体内NO水平GydF4y2Ba2+GydF4y2Ba在HS条件下。GydF4y2Ba
NO和CNGC6对拟南芥幼苗耐热性的影响GydF4y2Ba
为了阐明NO和CNGC6对小鼠耐热性的影响,我们检测了NO对小鼠存活的影响GydF4y2Bacngc6GydF4y2Ba在HS条件下的工厂。中等浓度(20 μM)的两种NO供体(SNP和SNAP)可提高hs治疗组体内NO水平和生存率GydF4y2Bacngc6GydF4y2Ba苗(无花果。GydF4y2Ba2GydF4y2Ba).两种NO合成相关酶的过表达,GydF4y2BaNOA1GydF4y2Ba和GydF4y2BaNIA2GydF4y2Ba相比,增强了其转基因素的内部没有水平和存活率,相比GydF4y2Bacngc6GydF4y2Ba(非转基因背景)HS条件(图下。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba).这些结果表明,由于去除,内部没有救出植物的热易感性GydF4y2BaCNGC6GydF4y2Ba.GydF4y2Ba
最后,我们得到了双突变体GydF4y2Bacngc6 noa1GydF4y2Ba,表现出与之相似的表型GydF4y2Banoa1GydF4y2Ba在正常生长或HS条件下(图。GydF4y2Ba5.GydF4y2Ba),表明两者都存在缺陷GydF4y2Banoa1GydF4y2Ba和GydF4y2BaCNGC6GydF4y2Ba不增强热敏感性造成的缺乏症GydF4y2Banoa1GydF4y2Ba独自的。GydF4y2Ba
所述HS响应经由其中HSP表达被诱导的过程介导的[GydF4y2Ba1GydF4y2Ba].为了确认在HS信号通路CNGC6和NO之间的关系,我们检查CNGC6和NO对HSP表达HS的条件下的效果。HSP的基因是基于其分子量,如HSP100,HSP90,HSP70,HSP60和小HSP的分类。其中,热休克蛋白小是最重要的,由于HS条件下的植物生存的至关重要的作用[GydF4y2Ba32.GydF4y2Ba].本文通过HSP17.7和HSP21这两个小的HSP来验证CNGC6是否通过NO促进HSP在植物耐热性中的表达。Western blotting结果显示,在HS条件下,细胞数量减少GydF4y2BaCNGC6GydF4y2Ba在水平GydF4y2Bacngc6GydF4y2Ba抑制AtHSP17.7和AtHSP21的表达。相反,没有捐助者和GydF4y2BaNOA1GydF4y2Ba和GydF4y2BaNIA2GydF4y2Ba超表达在GydF4y2Bacngc6GydF4y2Ba突变体增加和AtHSP17.7 AtHSP21(图中的表达。GydF4y2Ba6.GydF4y2Ba),表明CNGC6通过NO刺激HSP表达。GydF4y2Ba
综上所述,我们的数据为HS信号通路的存在提供了生理学、药理学和生化证据,其中NO作为CNGC6的下游伙伴,赋予其耐热性。GydF4y2Ba
NO对Ca的影响GydF4y2Ba2+GydF4y2Ba通量在拟南芥幼苗耐热GydF4y2Ba
no诱导的cGMP刺激NAD的合成GydF4y2Ba+GydF4y2Ba代谢产物cADPR是一种有效的CaGydF4y2Ba2+GydF4y2Ba-动员剂,结合细胞内CaGydF4y2Ba2+GydF4y2Ba信道,并激活Ca的释放GydF4y2Ba2+GydF4y2Ba在烟草(GydF4y2Ba烟草GydF4y2Ba)[GydF4y2Ba33.GydF4y2Ba].另外,在提高细胞内和细胞外钙的可用性NO特定角色GydF4y2Ba2+GydF4y2Ba假设生长素诱导黄瓜不定根形成过程中存在池(GydF4y2BaCucumis sativusGydF4y2Ba)[GydF4y2Ba34.GydF4y2Ba].因此,我们想知道是否NO变造的CaGydF4y2Ba2+GydF4y2Ba影响耐热性的熔剂。GydF4y2Ba
在[CaGydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba观察到野生型植物对单次温度升高(从22°C到37°C)的响应(图。GydF4y2Ba7.GydF4y2Ba).但是,目前显然被禁止GydF4y2Bacngc6GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba植物,但没有明显的改变GydF4y2Banoa1GydF4y2Ba植物(图。GydF4y2Ba7.GydF4y2Ba),说明no对Ca无明显影响GydF4y2Ba2+GydF4y2Ba可透过的通道活性。这些数据中,结合在图中所示的结果。GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba和GydF4y2Ba5.GydF4y2Ba,提示hs诱导的[CaGydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba单向影响植物中的信令。这些结果的合理的解释是,补充NO,下游分子,恢复的热敏状态GydF4y2BaCNGC6GydF4y2Ba缺陷型苗(图GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba和GydF4y2Ba5.GydF4y2Ba),但不能激活CNGC6的热响应活性(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
然而,有一个奇怪的现象,在GydF4y2Bacngc6GydF4y2Ba突变体,在HS作用下刺激NO的产生,EGTA可轻微抑制NO的产生(图。GydF4y2Ba1GydF4y2Ba).这应该是由于磷酸肌醇特异性磷脂C9的作用[GydF4y2Ba35.GydF4y2Ba]和磷酸肌苷特异性磷脂酶C3 [GydF4y2Ba36.GydF4y2Ba[CaGydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba通过HS下细胞内钙池。GydF4y2Ba
结论GydF4y2Ba
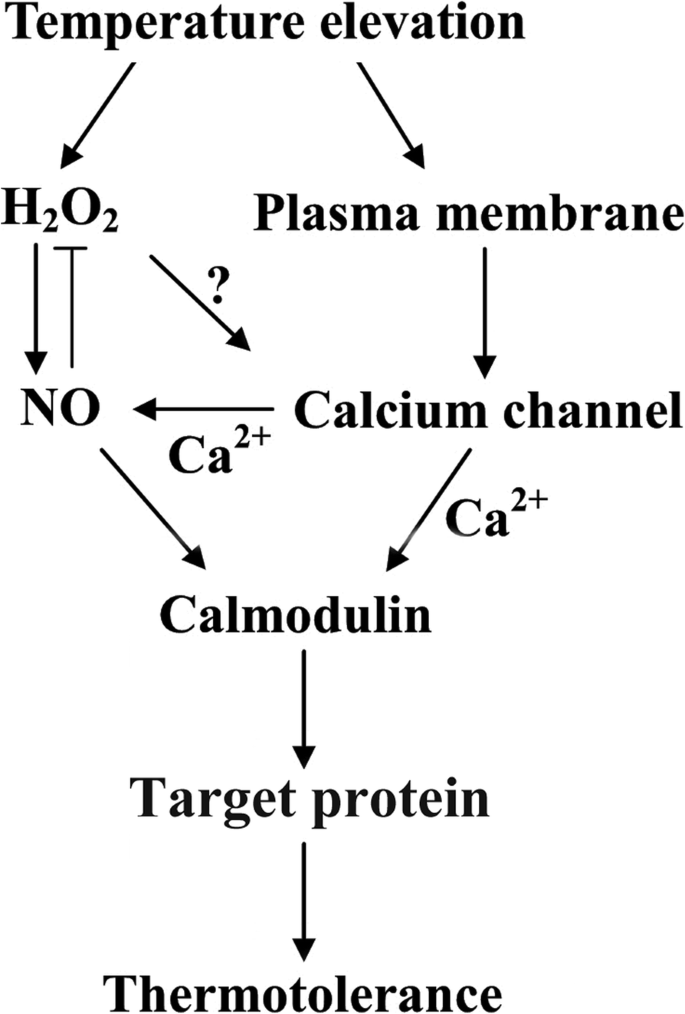
据我们所知,这些数据提供了证据,表明hs响应CaGydF4y2Ba2+GydF4y2Ba可透过的通道CNGC6参与HS信令通过NO诱导。我们以前提出的其中HS信号进行鉴定一个未知的受体HS信号模型,进而增加^ hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,直接刺激NO积累,激活AtCaM3,启动植物对高温的适应[GydF4y2Ba12.GydF4y2Ba].另外,反馈抑制,提出了NO和H之间存在GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在拟南芥幼苗HS通路中的作用[GydF4y2Ba14.GydF4y2Ba].在这项研究中,CNGC6发现通过游离Ca作用NO的上游GydF4y2Ba2+GydF4y2Ba在植物对HS的响应。HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba应用也显示增加细胞内游离钙的水平GydF4y2Ba2+GydF4y2Ba[GydF4y2Ba37.GydF4y2Ba].加利福尼亚州GydF4y2Ba2+GydF4y2BaAtCaM3参与拟南芥HSP基因的表达[GydF4y2Ba38.GydF4y2Ba].结合到Ca上GydF4y2Ba2+GydF4y2Ba,结合到特定的靶蛋白,改变其作为hs响应Ca的一部分的功能GydF4y2Ba2+GydF4y2Ba信号转导通路;已证实的靶点包括cam结合蛋白激酶3 [GydF4y2Ba39.GydF4y2Ba]和PP7 [GydF4y2Ba40GydF4y2Ba].这些结果表明,48的H发生复杂的关系GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,没有,GydF4y2Ba2+GydF4y2Ba通道和CaGydF4y2Ba2+GydF4y2Ba/ cam依赖的HS通路靶蛋白的激活(图GydF4y2Ba8.GydF4y2Ba).GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
野生型和突变型拟南芥均为col0生态型。的GydF4y2Banoa1GydF4y2Ba种子由Nigel M. Crawford博士(加州大学圣地亚哥分校)提供。GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2-1GydF4y2Ba和GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2-3GydF4y2Ba种子来源为宋春鹏博士(河南大学,中国开封)。双突变体GydF4y2Bacngc6 noa1GydF4y2Ba和转基因线GydF4y2Bacngc6/35SGydF4y2Ba::GydF4y2BaNIA2-1GydF4y2Ba和GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2-3GydF4y2Ba通过杂交获得,而转基因株系GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1-1GydF4y2Ba和GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1-2GydF4y2Ba用花浸法得到。GydF4y2Ba
用2% (v/v)次氯酸钠对拟南芥种子进行表面消毒1 min,然后用水冲洗。将无菌种子置于含3%蔗糖、0.7%琼脂的Murashige and Skoog (MS)培养基上,4℃黑暗保存48 h。将植株转入22℃、120 μmol m的生长室GydF4y2Ba- 2GydF4y2Ba年代GydF4y2Ba- 1GydF4y2Ba在16小时16小时每日光照期。GydF4y2Ba
For chemical treatment, 2 ml of SNP or SNAP (20 μM each) (Sigma-Aldrich, St. Louis, MO) were sprinkled onto the leaf surfaces of 8-day-old seedlings after filter sterilization for 48 h. Water was used as a substitute for control seedlings. After 8 h of pretreatment, the seedlings were subjected to HS conditions [12.GydF4y2Ba].在一种D.D.ition, 5 mM CaCl2GydF4y2Ba或2 mm egta用于预处理野生型,GydF4y2Bacngc6GydF4y2Ba和OE8种子进行荧光实验30 min,以超纯水为对照。GydF4y2Ba
耐热性测试GydF4y2Ba
Eight-day-old seedlings, grown at 22 °C, were incubated in sterilized 5 mM CaCl2GydF4y2Ba37°C刺激30min,恢复至22°C刺激2h,然后45°C刺激100min,最后恢复至22°C 5 d [GydF4y2Ba26.GydF4y2Ba].那些幼苗仍然是绿色,继续产生新叶子的植物被注册为幸存者。对于蛋白质印迹,将10天龄幼苗保持在37℃下进行2小时,并收集HSP积聚分析。GydF4y2Ba
所有实验均至少重复3次,每次均为3个独立的生物学重复。GydF4y2Ba
荧光显微镜GydF4y2Ba
如前所述,使用特定的荧光探针DAF-FM DA (Sigma-Aldrich)观察NO [GydF4y2Ba5.GydF4y2Ba经过一些修改。野生型和突变型幼苗分别在pH为5.8的MS液体培养基(1ml, 10 μM DAF-FM DA)中培养20 min。然后,根在液体MS培养基中清洗3次,每次15分钟,然后在荧光显微镜下显示(Eclipse TE 200,尼康,东京,日本)。利用MetaMorph (Molecular Devices, Sunnyvale, CA)计算信号强度。GydF4y2Ba
矢量建筑与转基因植物的产生GydF4y2Ba
获得GydF4y2BaAtNOA1-YFPGydF4y2Ba用于生产过表达的植物GydF4y2BaAtNOA1GydF4y2Ba在一个GydF4y2Bacngc6GydF4y2Ba背景下,GydF4y2BaAtNOA1GydF4y2Ba通过逆转录聚合酶链反应(RT-PCR)扩增互补DNA(cDNA),用引物NOA1F1(5' -GydF4y2Ba中国商用飞机有限责任公司GydF4y2BaATGGCGCTACGAACACTCTCAA-3')和NOA1F2(5'-AAAGTACCATTTGGGTCTTACT-3')(在NOA1F1加下划线的序列用于连结的pENTR / SD / d-TOPO该反应链内)。将产物在有义方向到pENTR / SD / d-TOPO,然后进入pEarleyGate使用网关LR重组酶(Invitrogen公司,卡尔斯巴德,CA)以产生101克隆GydF4y2Ba35SGydF4y2Ba::GydF4y2BaAtNOA1GydF4y2Ba-GydF4y2Bayfp.GydF4y2Ba.GydF4y2Ba
将这种构建变为拟南芥(GydF4y2Bacngc6GydF4y2Ba),按花浸法进行[GydF4y2Ba41.GydF4y2Ba)与GydF4y2Ba根癌土壤杆菌GydF4y2Ba(菌株GV3101)。Transformants were screened on plates containing 15 mg l- 1GydF4y2Ba巴斯塔。选择纯合T3转基因系以进一步分析。GydF4y2Ba
RT-qPCR分析GydF4y2Ba
使用PrimeScript RT Reagent Kit (Takara Bio Inc., Otsu, Japan)从10日龄幼苗中分离总RNA (500 ng),按制造商说明进行首次站cDNA合成。程序如下:聚合酶在95℃初始活化10 s, 95℃活化5 s, 60℃活化31 s,共40个循环。使用ABI Prism 7000序列检测系统(应用生物系统公司,福斯特城,CA)和SYBR Premix Ex Taq (Takara Bio Inc.)进行反应。利用Primer Express (Applied Biosystems)设计引物对。详细的引物序列显示在附加文件GydF4y2Ba1GydF4y2BaS1:表。GydF4y2Ba
Western印迹分析GydF4y2Ba
10日龄幼苗在37℃下保存2 h,然后在液氮中研磨。用提取缓冲液(10 mM HEPES, pH 7.9,含0.4 M NaCl, 0.5 mM二硫苏糖醇,0.1 mM EDTA, 5%甘油,0.5 mM苯甲烷磺酰氟)提取总蛋白,14000 ×离心纯化GydF4y2BaGGydF4y2Bafor 20 min at 4 °C. The supernatants were transferred to fresh tubes, and the protein content was measured as the description of Bradford [42.GydF4y2Ba].Total proteins (50 μg) were analyzed by western blotting as described previously [12.GydF4y2Ba].GydF4y2Ba
原生质体和电分析的制备GydF4y2Ba
如先前所描述的原生质体分离[GydF4y2Ba43.GydF4y2Ba在22°C垂直培养6-7天的拟南芥幼苗的1厘米长的根尖。如前所述进行了全电池电压贴片箝位[GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba44.GydF4y2Ba].GydF4y2Ba
aequorin和Ca的体内重建GydF4y2Ba2+GydF4y2Ba测量GydF4y2Ba
体内水母发光蛋白的重组按照高的方法进行[GydF4y2Ba20.GydF4y2Ba].(CaGydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba通过如前所述与方程计算PCA得到水平[GydF4y2Ba45.GydF4y2Ba].GydF4y2Ba
可用性数据和材料GydF4y2Ba
在当前的研究中使用和/或分析的数据集可从通信作者在合理的要求。GydF4y2Ba
本文的序列数据可以在拟南芥基因组计划数据库中找到,登录号如下:GydF4y2BaNOA1GydF4y2Ba(At3g47450),GydF4y2BaNIA2GydF4y2Ba(At1g37130),GydF4y2BaCNGC6GydF4y2Ba(At2g23980),GydF4y2BaActin2GydF4y2Ba(At3g18780)。GydF4y2Ba
缩写GydF4y2Ba
- [加利福尼亚州GydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba:GydF4y2Ba
-
胞质钙GydF4y2Ba2+GydF4y2Ba
- 加利福尼亚州GydF4y2Ba2+GydF4y2Ba:GydF4y2Ba
-
钙离子GydF4y2Ba
- CaM3:GydF4y2Ba
-
Calmodulin3GydF4y2Ba
- cDNA:GydF4y2Ba
-
互补DNAGydF4y2Ba
- 中国:GydF4y2Ba
-
环核苷酸门控阳离子通道GydF4y2Ba
- DAF-FM DA:GydF4y2Ba
-
4-amino-5-methylamino-2 ', 7 ' -difluorofluorescein二醋酸盐GydF4y2Ba
- DAF-FM:GydF4y2Ba
-
4-氨基-5-甲基氨基-2',7'- difluorofluoresceinGydF4y2Ba
- HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba:GydF4y2Ba
-
过氧化氢GydF4y2Ba
- HS:GydF4y2Ba
-
热休克GydF4y2Ba
- HSP:GydF4y2Ba
-
热休克蛋白GydF4y2Ba
- 多发性硬化症:GydF4y2Ba
-
Murashige和斯库GydF4y2Ba
- NiAl的:GydF4y2Ba
-
硝酸还原酶1GydF4y2Ba
- NIA2:GydF4y2Ba
-
硝酸还原酶2GydF4y2Ba
- 不:GydF4y2Ba
-
一氧化氮GydF4y2Ba
- NOA1:GydF4y2Ba
-
一氧化氮相关蛋白1GydF4y2Ba
- nos:GydF4y2Ba
-
没有合酶GydF4y2Ba
- NR:GydF4y2Ba
-
硝酸还原酶GydF4y2Ba
- 下午:GydF4y2Ba
-
血浆膜GydF4y2Ba
- rt - pcr:GydF4y2Ba
-
逆转录 - 聚合酶链式反应GydF4y2Ba
- RT-qPCR的:GydF4y2Ba
-
实时定量RT-PCRGydF4y2Ba
- SDS-PAGE:GydF4y2Ba
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳GydF4y2Ba
- 折断:GydF4y2Ba
-
S.GydF4y2Ba亚硝基的- - - - - -GydF4y2BaNGydF4y2Ba-acetylpenicillamineGydF4y2Ba
- SNP:GydF4y2Ba
-
硝普酸钠GydF4y2Ba
参考GydF4y2Ba
- 1。GydF4y2Ba
Lawas LMF, Zuther E, Jagadish SVK, Hincha DK。谷物抗旱抗热复合胁迫的分子机制植物生态学报。2018;45:212-7。GydF4y2Ba
- 2。GydF4y2Ba
Farnese FS,Menezes-Silva Pe,Gusman GS,Oliveira Ja。当坏人变得好的时候:反应性氧物种和一氧化氮在植物反应对非生物胁迫的关键作用。前植物SCI。2016; 7:471。GydF4y2Ba
- 3.GydF4y2Ba
沈春华,吴玉萍,叶伟华。一氧化氮对抗坏血酸盐抑制植物开花的作用。Sci众议员2016;6:35246。GydF4y2Ba
- 4。GydF4y2Ba
奥尔德顿WK,库珀CE,诺尔斯RG。一氧化氮合酶:结构,功能和抑制。生物化学杂志2001; 357:593-615。GydF4y2Ba
- 5。GydF4y2Ba
郭FQ,冈本男,克劳福德NM。参与激素信号植物型一氧化氮合酶基因的鉴定。科学。2003; 302:100-3。GydF4y2Ba
- 6。GydF4y2Ba
弗洛雷斯-佩雷斯U,索雷特-GüetoS,气体E,贾维斯P,罗德里格斯翁M.甲生产质体编码的蛋白质的突变体受损的揭示对于类异戊二烯生物合成酶在体内平衡机制GydF4y2Ba拟南芥GydF4y2Ba叶绿体。植物细胞。2008;20:1303-15。GydF4y2Ba
- 7。GydF4y2Ba
Horchani F, Prévot M, Boscari A, Evangelisti E, Meilhoc E, Bruand C, Raymond P, Boncompagni E, Aschi-Smiti S, Puppo A, Brouquisse rGydF4y2BaMedicago Truncatula.GydF4y2Ba固氮结节。植物杂志。2011;55:1023-36。GydF4y2Ba
- 8。GydF4y2Ba
植物一氧化氮信号通路的新认识。植物生物学学报2008;59:21-39。GydF4y2Ba
- 9。GydF4y2Ba
Kim JY, Kwon YJ, Kim SI, Kim DY, Song JT, Seo HS。铵可抑制色素甲基化酶3介导的拟南芥硝酸盐还原酶基因NIA2的甲基化。植物学报2016;6:1161。GydF4y2Ba
- 10.GydF4y2Ba
关键词:拟南芥,AtCaM3,耐高温,一氧化氮植物杂志。2010;153:1895 - 906。GydF4y2Ba
- 11.GydF4y2Ba
Lee U,Wie C,Fernandez Bo,Felisisch M,Vierling E.亚硝化压力的调节GydF4y2BaS.GydF4y2Ba-亚硝基谷胱甘肽还原酶对拟南芥的耐热性和植物生长至关重要。植物细胞。2008;20:786 - 802。GydF4y2Ba
- 12.GydF4y2Ba
王L,过Y,贾L,储H,周S,陈K,召L.过氧化氢作用于在拟南芥幼苗热休克途径的一氧化氮的上游。植物理性。2014; 164:2184-96。GydF4y2Ba
- 13。GydF4y2Ba
Parankusam S,Adimulam SS,Bhatnagar-Mathur P,Sharma KK。植物热应力耐受的一氧化氮(NO):当前的知识和观点。前植物SCI。2017; 8:1582。GydF4y2Ba
- 14。GydF4y2Ba
吴丹丹,楚华,贾磊,陈科,赵立安。拟南芥幼苗热休克通路中一氧化氮和过氧化氢的反馈抑制作用。植物生长规律。2015;75:503-9。GydF4y2Ba
- 15。GydF4y2Ba
Jha Sk,Sharma M,Pandey GK。循环核苷酸门控通道在植物中应力管理中的作用。Curr基因组学。2016; 17:315-29。GydF4y2Ba
- 16。GydF4y2Ba
CNGCs:植物环核苷酸信号的主要靶点?植物科学进展。2003;8:286-93。GydF4y2Ba
- 17。GydF4y2Ba
Shih HW, DePew CL, Miller ND, Monshausen GB。环核苷酸门控通道CNGC14调控根向地性GydF4y2Ba拟南芥GydF4y2Ba.Curr Biol。2005; 25:3119-25。GydF4y2Ba
- 18。GydF4y2Ba
Lu M, Zhang Y, Tang S, Pan J, Yu Y, Han J, Li Y, Du X, Nan Z, Sun Q. AtCNGC2参与茉莉酸诱导的钙动员。J Exp Bot. 2016; 67:809-19。GydF4y2Ba
- 19。GydF4y2Ba
高QF,顾LL,王HQ,飞CF,方X,侯赛因Ĵ,孙SJ,董JY,刘H,王YF。环核苷酸门控通道18是一个必不可少的CaGydF4y2Ba2+GydF4y2Ba拟南芥花粉管尖端引导胚珠的通道。美国国家科学研究院2016;113:3096-101。GydF4y2Ba
- 20.GydF4y2Ba
高女,汉X,吴Ĵ,郑S,尚Z,太阳d,周RG,李B.一种热激活的钙可渗透通道 - 拟南芥环核苷酸门控离子通道6 - 参与热休克响应。植物杂志2012; 70:1056至1069年。GydF4y2Ba
- 21.GydF4y2Ba
Tunc-Ozdemir M, Tang C, Ishka MR, Brown E, Groves NR, Myers CT, Rato C, Poulsen LR, McDowell S, Miller G, Mittler R, Harper JF。花粉中环状核苷酸门控通道(CNGC16)对花粉生殖发育的耐受性至关重要。植物杂志。2013;161:1010-20。GydF4y2Ba
- 22.GydF4y2Ba
质膜环核苷酸门控钙通道调控陆地植物的热敏感和获得的耐热性。植物细胞。2012;24:3333-48。GydF4y2Ba
- 23.GydF4y2Ba
Petersen哦,Michalak M,Verkhratsky A.钙信号传导:过去,现在和未来。细胞钙。2005; 38:161-9。GydF4y2Ba
- 24.GydF4y2Ba
D.一氧化氮诱导游离胞质Ca增加的机制GydF4y2Ba2+GydF4y2Ba浓度GydF4y2Ba烟草plumbaginifoliGydF4y2Ba一个细胞。自由基生物医学2006;40:1369-76。GydF4y2Ba
- 25.GydF4y2Ba
Jeandroz S, Lamotte O, asttier J, Rasul S, Trapet P, Basson-Bard A, Bourque S, Nicolas-Francès V, Ma W, Berkowitz GA, Wendehenne dGydF4y2Ba2+GydF4y2Ba信号。植物杂志。2013;163:459 - 70。GydF4y2Ba
- 26.GydF4y2Ba
利用荧光法检测细胞内一氧化氮GydF4y2Ba金黄色葡萄球菌GydF4y2Ba.生物协议。2016; 6:e1878。GydF4y2Ba
- 27.GydF4y2Ba
刘海涛,孙大勇,周荣刚。加利福尼亚州GydF4y2Ba2+GydF4y2BaATCAM3参与拟南芥中热休克蛋白基因的表达。植物细胞环境。2005; 28:1276-84。GydF4y2Ba
- 28.GydF4y2Ba
米特勒R.非生物胁迫,场环境和应力的组合。趋势植物SCI。2006; 11:15-9。GydF4y2Ba
- 29.GydF4y2Ba
孙AZ,郭FQ。在植物中热应激反应的叶绿体反向调控。前植物SCI。2016; 7:398。GydF4y2Ba
- 30.GydF4y2Ba
乙酰胆碱通过心肌细胞中毒蕈碱和烟碱受体减弱过氧化氢诱导的细胞内钙平衡失调。细胞生理生化。2016;39:341-9。GydF4y2Ba
- 31.GydF4y2Ba
俞Y,谢Q,刘伟,郭Y,徐N,徐升,刘S,李S,徐Y,孙L.增加细胞内钙GydF4y2Ba2+GydF4y2Ba通过调节人卵巢癌细胞iNOS表达降低顺铂耐药。生物医学Pharmacother。2017;86:8-15。GydF4y2Ba
- 32.GydF4y2Ba
Carre S,Alberti S,Benesch JLP,Belens W,Buchner J,Carver Ja,Ceconi C,Ecroyd H,Gusev N,Hightower Le,Klevit Re,Leee Hy,Liberek K,洛克伍德B,Poletti A,Timmerman v,Toth Me,Vierling E,Wu T,Tanguay RM。小型热休克蛋白:多方面的蛋白质,具有重要意义。细胞Stree&伴侣。2019; 24:295-308。GydF4y2Ba
- 33.GydF4y2Ba
杜纳J,温德亨内D。一氧化氮、环GMP和环ADP核糖诱导烟草防御基因的研究。中国科学(d辑:地球科学)1998;95:10328-33。GydF4y2Ba
- 34.GydF4y2Ba
钙和钙依赖蛋白激酶参与了一氧化氮和生长素诱导的黄瓜不定根形成。J Exp Bot. 2006; 57:1341-51。GydF4y2Ba
- 35。GydF4y2Ba
关键词:拟南芥,耐高温,磷酸肌苷,磷脂酶C9植物j . 2012; 69:689 - 700。GydF4y2Ba
- 36。GydF4y2Ba
高K,刘YL,李斌,周RG,孙DY,郑SZ。GydF4y2Ba拟南芥GydF4y2Ba磷酸肌醇特异性磷脂酶C亚型3(AtPLC3)和AtPLC9对耐热性的添加剂的效果。植物细胞环境。2014; 55:1-11。GydF4y2Ba
- 37。GydF4y2Ba
氧化应激反应和Ca门田Y,古都T,佐野T,卡亚H,郡治W,村上Y,武藤S,Hasezawa S,Kuchitsu K.细胞周期依赖性调节GydF4y2Ba2+GydF4y2Ba烟草BY-2细胞的NtTPC1A/B渗透通道。生物化学学报。2005;336:1259-67。GydF4y2Ba
- 38。GydF4y2Ba
张伟,周荣刚,高玉军,郑淑珍,徐鹏,张树清,孙大勇。AtCaM3在拟南芥热激信号转导中的关键作用的分子和遗传证据。植物杂志。2009;149:1773 - 84。GydF4y2Ba
- 39。GydF4y2Ba
刘海涛,高芳,李国良,韩建林,刘东东,孙德元,周荣国。钙调素结合蛋白激酶3是热休克信号转导的一部分GydF4y2Ba拟南芥GydF4y2Ba.植物j . 2008; 55:760 - 73。GydF4y2Ba
- 40.GydF4y2Ba
Liu HT, Li GL, Chang H, Sun DY, Zhou RG, Li B. Calmodulin binding protein phosphatase PP7参与拟南芥的耐热性。植物学报2007;30:156-64。GydF4y2Ba
- 41.GydF4y2Ba
阵伤SJ,弯曲AF。花卉浸:农杆菌介导转化的简化方法GydF4y2Ba拟南芥GydF4y2Ba.植物杂志1998; 16:735-43。GydF4y2Ba
- 42.GydF4y2Ba
布拉德福德MM。用于利用蛋白质 - 染料的原理结合蛋白的微克量的定量的快速和灵敏的方法。肛门生物化学。1976; 72:248-54。GydF4y2Ba
- 43.GydF4y2Ba
拟南芥原生质体中钠离子通过非选择性阳离子通道的通量。植物杂志。2002;128:379 - 87。GydF4y2Ba
- 44.GydF4y2Ba
刘涛,徐晓霞,李树华,马磊,尚志强。拟南芥花粉萌发过程中异质三聚体g蛋白的调控GydF4y2Ba2+GydF4y2Ba透水通道。新植醇。2007;176:550-9。GydF4y2Ba
- 45.GydF4y2Ba
Plieth C. Aequorin作为报告基因。方法2006;323:307-27。GydF4y2Ba
确认GydF4y2Ba
我们感谢Drs。奈杰尔·M.·克劳福德(美国加州大学圣地亚哥分校,CA)和骏彭松(河南大学,开封,中国)提供在这项研究中所用的种子。GydF4y2Ba
资金GydF4y2Ba
本研究得到了美国国家科学基金会(批准号:)的资助。31770297)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
BL和LZ设计了研究;XP和XZ执行了所有实验和数据分析。lz起草了手稿。所有作者都参与了修改稿件并批准了最终版本。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者声明他们在这项研究中没有竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
额外的文件1:GydF4y2Ba
图S1。GydF4y2Ba[加利福尼亚州GydF4y2Ba2+GydF4y2Ba]GydF4y2BacytGydF4y2Ba使用的Ca分析GydF4y2Ba2+GydF4y2Ba野生型传感器蛋白aequorin,GydF4y2Bacngc6GydF4y2Ba那GydF4y2Banoa1GydF4y2Ba那GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNOA1GydF4y2Ba-GydF4y2Ba1GydF4y2Ba,GydF4y2Bacngc6GydF4y2Ba/GydF4y2Ba35SGydF4y2Ba::GydF4y2BaNIA2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba幼苗。GydF4y2Ba表S1。GydF4y2Ba实时定量RT-PCR引物。(PDF 91 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
彭,X.,张,X.,李,B.GydF4y2Baet al。GydF4y2Ba环核苷酸门控离子通道6通过胞质钙离子调节一氧化氮的产生介导拟南芥幼苗的耐高温性。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba368(2019)。https://doi.org/10.1186/s12870-019-1974-9.GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1974-9.GydF4y2Ba
关键字GydF4y2Ba
- 拟南芥GydF4y2Ba
- 环核苷酸门控离子通道6GydF4y2Ba
- 热休克GydF4y2Ba
- 热休克蛋白GydF4y2Ba
- 一氧化氮GydF4y2Ba