摘要
背景
小RNA在植物中调节各种过程,从器官开发到生物和非生物应激反应。作为遗传网络中的掌握监管机构,它们的生物发生和行动是一个基本方面,以了解植物生长和发展。三个主要基因家族是RNA沉默的关键组分:Dicer样(DCL),Argonaute(前)和RNA依赖性RNA聚合酶(RDR)。尽管它们的特征在于其他植物物种,但没有关于这些基因家族的信息柑橘sinensis,来自经济和营养原因的最重要的水果种之一。虽然在植物生长和发展的多个方面的调节中涉及小RNA,但它们在脱落过程中的作用尚未表征。
结果
利用全基因组分析和系统发育方法,我们共鉴定了13个AGO, 5个DCL和7个RDR基因。我们利用RNA-seq数据分析了它们在根、叶、肉、皮和胚胎中的表达模式。此外,我们通过在果皮上的基因表达分析来研究它们在果实脱落中的作用,并与激光捕获显微切割获得的果实脱落带进行比较。有趣的是,我们确定了几个RNA沉默因子在果实脱落带的表达下调,尤其是RNA依赖的DNA甲基化途径的基因成分,这表明抑制这一过程是果实脱落发生的必要条件柑橘sinensis..
结论
这3个家庭的成员存在特征保守域和不同的表达模式。我们对这些家庭的成员提供了详细的分析,并根据RNA-SEQ数据改善了一些这些基因的注释。我们的数据表明RNA依赖性DNA甲基化途径参与了重要的果实脱落过程制成。
背景
植物中各种各样的生物过程都是由小RNA调控的,小RNA是RNA的调节分子,通常长度在21到24个核苷酸之间。一般来说,有两大类不同的小rna,分别是microrna (mirna)和短干扰rna (sirna)。然而,迄今为止所描述的大量siRNA来源已经在siRNA类中呈现了多个亚群,包括反式(ta- sinas)、分阶段(phase - sinas)、异色(hc- sinas)和自然反义sinas (nat- sinas)等[1那2].在植物中,这些调控分子的生物发生和作用主要依赖于AGO、RDR和DCL家族成员。rdr能够以RNA为模板合成dsRNA,而dcl由于其rnaseiii型活性,负责将dsRNA切割成21-24 nt长的小RNA。反过来,小RNA提供了包含AGO因子的RISC复合物的特异性作用,针对转录后水平具有部分或全部碱基互补的RNA分子,这些分子可以通过AGO蛋白的rnasah -type活性或通过翻译抑制而被切割[3.那4.。在植物中,RDR蛋白质含有一个名为RNA依赖性RNA聚合酶(RDRP)的一个独特的保守域[5.那6.]而六个结构域以DCL蛋白质存在:DEXDC,Helicase-C,RNA结合,PAZ,RNASEIIIA,RNASEIIIB(RIBOC)和双链RNA结合(DSRB),但可能缺少一个或多个[7.。在AGO蛋白中,有四个主要的结构域,分别是N-Terminal, PAZ, Mid和PIWI [8.。不同的研究报道,植物DCL、RDR和AGO基因家族通常由多个成员组成。在拟南芥中共鉴定出20个编码这些蛋白家族的基因,在番茄和玉米中鉴定出28个基因[5.那9.,水稻中的32个基因[3.和22 in grapevine and pepper [10那11。
甜橙(柑橘sinensis.)是世界范围内栽培的最重要的水果消费品种之一。它对人类健康的营养属性是众所周知的,因为它是一个很好的来源,很容易获得维生素C [12],除此之外,这一物种的巨大经济重要性,据估计,2012年全球产量为90亿美元[13。从农业的角度来看,脱落对产量有巨大的影响,导致关键作物的高产量损失,包括柑橘[14].已经显示出小RNA参与植物生长和发展的几个方面,例如压力反应,叶极性,开花时间[15那16那17那18和对疾病的抵抗力[19].在目前的工作中,我们进行了基因组的分析,以表征这些重要的蛋白质家庭柑橘sinensis..使用系统发育方法,我们在橙中鉴定和特征,DCL和RDR基因系列,并在五种植物组织中分析了它们的表达模式,使用RNA-SEQ数据改善了其中五种的基因结构注释。最后,我们建立了这些家庭的选定成员以及RNA依赖性DNA甲基化(RDDM)途径(RDDM)途径的额外单拷贝因子显示使用激光捕获微量碎裂(LCM)分析的甜橙色样品的果实脱落区中的差异表达。对之前,RDR和DCL基因家庭的详细分析柑橘sinensis.在这项工作中呈现,我们提供了在该物种中果实脱落的调节中的表观遗传成分的初步证据。
结果
柑桔AGO、RDR和DCL基因的鉴定和硅分析
为了鉴定橘子中AGO、RDR和DCL基因家族,我们收集了拟南芥、水稻、杨树和番茄中此前已鉴定的基因。(附加文件1).使用Arabidopsis序列作为Blast分析中的查询,我们确定了一种编码DCL蛋白(CSDCLS),七个编码RDR(CSRDRS)和13个编码蛋白(CSAGO)的五种基因(Pythozome)(www.phytozome.org)和在“中华柑桔注释项目”(CSAP) (http://citrus.hzau.edu.cn/Orange/)数据库(表1).尽管这些基因大部分都存在于两个数据库中,但在两个基因组版本的功能和结构注释中发现了一些不一致的地方,其中一些基因结构注释较差。总体而言,除了在Phytozome中注释较好的orange1.1g001771m (CsRDR3)和orange1.1g002204m (CsAGO5a)基因外,CSAP数据库中的结构注释与RNA-seq数据比较一致(Table)1).为了使用最准确的基因模型,我们利用两个数据库的信息以及来自不同植物组织的RNA-seq数据改进了5个基因的注释(表1)1;附加文件2).例如,CsAGO5c的CSAP注释基因模型缺少Mid和PIWI域;但当我们使用RNAseq数据更新该基因的结构注释时,在新注释的基因模型中检测到所有典型的AGO域(图)。1,附加文件2).本研究中鉴定的所有基因的特征见表1,包括两个数据库中的基因id、ORF长度、蛋白长度、等电点(IP)和分子量(Mw),而修正后的基因结构注释的基因结构分析和更新的蛋白序列详见附加文件2.此外,在CsAGO, CsRDR和CsDCL蛋白中识别的所有结构域的Pfam和SMART ID详见附加文件3.他们相关的基因本体论术语在附加文件中详述4.,它描述了这些基因的相关生物学功能。
在橙色基因组中发现的所有7个RDR基因编码具有RdRP结构域的蛋白质。该家族成员的氨基酸数量在969和1197之间(见表)1).我们利用来自叶、根、胚、肉和果皮文库的RNA-seq数据对基因orange1.1g048783m/Cs1g14730 (CsRDR6b)进行了注释1和额外的文件2和5.).我们在该基因注释为内含子3的区域的所有文库中都观察到了表达,因此对基因结构进行了更新(附加文件)2).该蛋白质的RDDP域的更新序列码的区域,该蛋白质的RDDP域在该重新注释之后使用智能预测(图。1),而之前版本的基因显示了截断的RdDP结构域。
CsDCL家族由5个成员组成,其编码序列在4191 ~ 5892 bp之间,编码蛋白在1396 ~ 1963氨基酸之间1).PFAM和智能分析显示,所有CSDCLS显示六个保守结构域:DEXDC,Helicase C,RNA结合,PAZ和两个连续的Riboc结构域(RNASEIIIA和RNASEIIIB)。除此之外,CSDCL1和CSDCL4在Riboc结构域之后呈现两个连续的DSRB域(图。1).
13个AGO蛋白具有n端、L1、PAZ和PIWI结构域,而L2结构域在12个蛋白中存在,但在orange1.1g003630m/Cs7g17970 (CsAGO5b)中缺失。此外,除orange1.1g001684m/Cs7g03360 (CsAGO7)外,所有蛋白中都存在Mid结构域,且只有orange1.1g001466m/Cs5g16710 (CsAGO1)以Gly-Rich结构域开头(图)。1).
除了这些蛋白中的保守结构域外,我们还检测了这些基因家族中保守基序的存在。在拟南芥中,AGO蛋白在PIWI结构域具有DDH/H或DDD/H基序,这些基序负责其内切酶活性[20.那21那22].我们发现CSAGO1,CSAGO7和CSAGO10中的DDH / H图案,DDD / H主题存在于CSAGO2A中(附加文件6.).我们还鉴定了CsAGO4a和CsAGO4b的DDH/P基序;在CsAGO6中有DDH/S motif,在CsAGO5a和CsAGO5b中分别有DDY/H和DDY/P motif。最后,在CsAGO6-like蛋白中观察到一个D-H/T motif(附加文件)6.),因此可能缺乏内切酶活性。
我们在所有CSDCl蛋白中检测到保守的DECH基序,其是植物DCL蛋白的特征[23那24]和通常存在于RDR蛋白催化结构域的DLDGD基元[6.那25],在CSRDR蛋白的7个中的5分中检测到(附加文件6.).
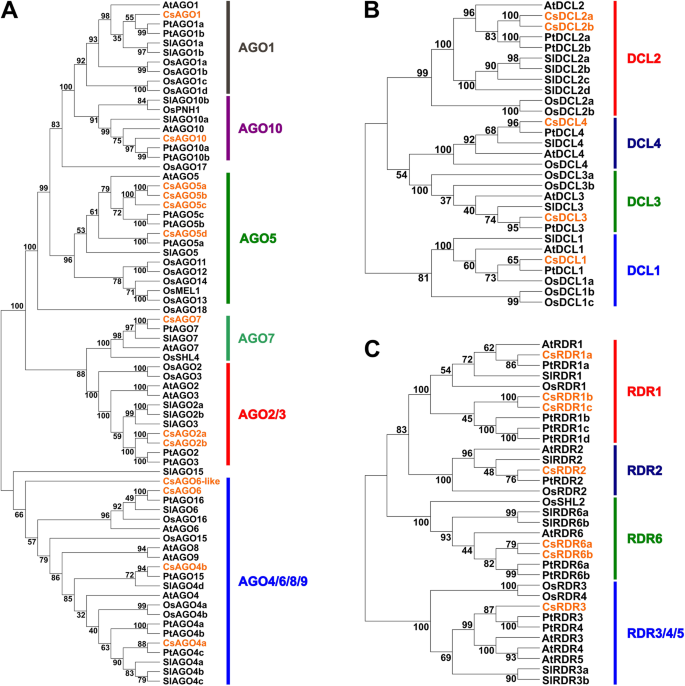
系统发育分析允许识别DCL, RDR和AGO假定的同源物在橙色
我们使用了系统发育方法来识别橙色中的rdr和dcl家族的推定的正非基因。我们为三个分析的家庭建造了一个邻近的邻近树,使用拟南芥,番茄,杨树和水稻的全长蛋白质序列(图。2).Agene Family被分成六个分支:前1,前10,5,5,8,前7,前2/3和前4/6/8/9(图。2a).我们只确定了一个基因c . sinensis我们将其命名为CsAGO1, CsAGO10和CsAGO7。在AGO2/3进化支中发现了两个AGO成员,分别被命名为CsAGO2a和CsAGO2b,后者只存在于CSAP基因组中,彼此共享93%的氨基酸同源性。四个c . sinensis它们分别被命名为CsAGO5a、CsAGO5b、CsAGO5c和CsAGO5d,也是仅存在于CSAP基因组中的最后两个。还有四个橘色AGO家族成员,属于AGO4/6/8/9分支;其中,我们将其中的两个命名为CsAGO4a和CsAGO4b,而第三个命名为CsAGO6,因为它靠近AtAGO6(图2)。2a).最后,AGO4/6/8/9进化枝中的一个AGO蛋白未能与该进化枝中的其他特征蛋白分组,由于其与AGO6基团的邻近性,被命名为CsAGO6-like(见表)1,图。2a,相应的基因id请参考附加文件1或表1).
5个CsDCL蛋白分布在4个分支:DCL1、DCL2、DCL3和DCL4(图2)。2b).在DCL2分支中,有两个氨基酸同源性高达90%的高度相似的蛋白质,因此分别被命名为CsDCL2a和CsDCL2b。其余三个进化支各含有一个CsDCL蛋白,我们分别称之为CsDCL1、CsDCL3和CsDCL41,图。2b和附加文件1).
最后,由CsRDRs序列衍生的树还包括四个分支:RDR1、RDR2、RDR6和RDR3/4/5。RDR1分支包含三种蛋白质:CsRDR1a、CsRDR1b和只存在于Phytozome基因组的CsRDR1c(见表2)1,图。2C)。将两种蛋白质置于RDR6 CLADE,CSRDR6A和CSRDR6B中,它们的长度相似,分别为1197和1145个氨基酸,并分享80%的氨基酸序列。最后,每个RDR2和RDR3 / 4/5中只有一种蛋白质分别被命名为CSRDR2和CSRDR3(表1,图。2c,额外的文件1).
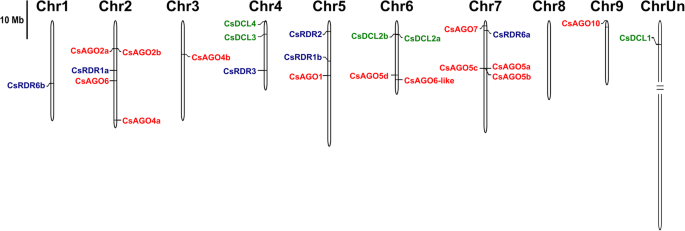
橙色DCL、RDR和AGO基因的染色体定位
接下来,我们利用CSAP数据库分析了甜橙中所有DCL、RDR和AGO基因的染色体分布,提供了染色体位置(图)。3.).对应于四种CSDCl的基因,五种CSRDR和13个CSAGO蛋白位于所有染色体中不均匀,除了8染色体8,其不涉及分析的家族的任何成员。从前的一个家族中只有一个基因分别在每个染色体3和9中编码,即CsAgo4b和Csago10。寄生虫CSDCL2A和CSDCL2B在染色体6上非常接近,以及染色体2和CSAGO5A,CSAGO5B和CSAGO5C上的CSAGO2A和CSAGO2B在染色体7上(图。3., 桌子1).相反,CsRDR1a和CsRDR1b分别位于染色体2和5。2号染色体和7号染色体各包含分析家族中的5个基因成员,而4号染色体和5号染色体则包含其中3个基因成员。本数据库中只有CsRDR1c没有注释,因此图中没有表示。3.(表1),而CsDCL1则被置于“未知染色体”(ChrUn,图。3.(表1),其中包含来自c . sinensis还不能分配给任何染色体的基因组。
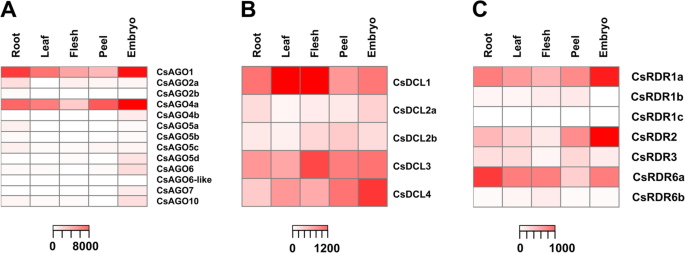
不同组织中AGO、DCL和RDR基因表达模式的共性和特异性
为了表征这些家庭的不同成员的表达模式,我们分析了来自五种不同组织的RNA-SEQ数据:叶,根,肉,剥离和胚胎(原始数据的登录号在附加文件中详述5.).我们对所有组织进行了差异表达分析(附加文件7.),并使用每个家庭的一张热图来表示表达水平(图。4.).CsAGO1和CsAGO4a在AGO家族中表现出最高的表达水平,两者都比分析的其他AGO基因积累到更高的水平。为了更好地欣赏差异的表达,附加文件8.显示了与图相同的热图图。4.没有这两个基因。在胚胎组织中,除CsAGO2a、CsAGO2b、CsAGO5a和CsAGO5c外,大部分AGO基因的表达量均高于其他分析组织(图2)。4.一个;附加文件8.).相反,果肉、果皮和叶片中大部分基因表达较弱,而CsAGO2b、CsAGO5b和CsAGO6-like在所有组织中表达水平都很低(图)。4.一个额外的文件8.).
所有CSDCl蛋白在五种分析的组织中表达:CSDCL2A和CSDCL2B表现出该家庭中最低表达,而CSDCL1具有最高的表达水平,特别是叶片和肉体。另一方面,CSDCl3和CSDCl4显示中间体表达,分别呈现肉体和胚胎中的最高积聚(图。4.b)。
关于RDR家族,在任何分析的组织中都未检测到CsRDR1c(图。4.c,额外的文件7.), CsRDR1b在肉、皮、叶和根中积累较弱,在这些样本中CsRDR1a是这个家族中最丰富的基因。CsRDR2在胚胎中高表达,CsRDR6a在根中优先积累,而CsRDR6b在所有组织中弱表达,在肉中优先积累(图)。4.c,额外的文件7.).
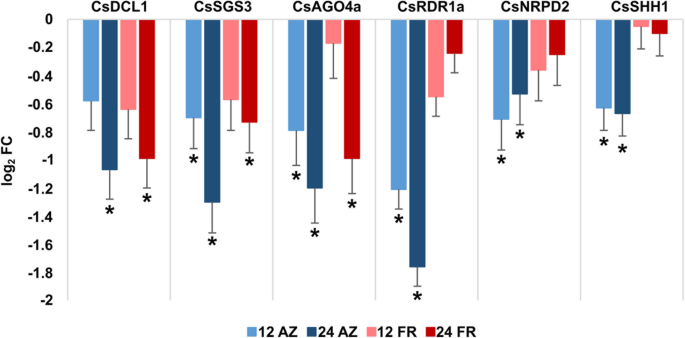
参与RDDM和TA-siRNA途径的基因的表达在橙色果实脱落期间显示下调
为了深入了解RNA沉默通路在脱落过程中的作用,我们鉴定了[14,包括新特征的AGO、RDR和DCL基因以及其他编码单拷贝因子的基因,这些基因参与了小rna的生物发生和作用(图。5.,附加文件9.).我们分析了剥离带(AZ)和果皮(FR)的表达数据,在乙烯诱导剥离12或24小时后,用LCM获得的数据[14].有趣的是,我们检测到被分析的三个家族成员的表达下调:CsDCL1, CsRDR1a和CsAGO4a,以及三个单拷贝基因:基因沉默抑制3 (CsSGS3)的同源性,一个ta-siRNA生物发生途径的组成部分;PolIV和Pol V亚基2的橙色同源物(CsNRPD2)和SAWADEE HOMEODOMAIN HOMOLOGUE 1的同源物(CsSHH1),它们参与了RdDM通路。除CsRDR1基因本方法未检测外,其余基因均通过qRT-PCR检测下调(附文件)10和11).其中,在乙烯处理后12和24小时,AZ中CsRDR1a、CsSHH1和CsNRPD2特异性下调,而FR中没有下调(图2)。5.).CsSGS3和CsAGO4a在12 h时在AZ中特异性下调,在24 h时在FR中也下调。最后,在乙烯处理24 h后,AZ和FR中CsDCL1均下调(图)。5.).其中部分表达变化也通过qRT-PCR得到证实,该方法也证实了这些基因的总体下调趋势(supplementary file)10).这些分析表明,在果实脱落过程中,参与小rna生物发生和作用的几个因素的下调是必要的,这意味着小rna在这一重要过程中的作用尚未被探索。
讨论
RNA沉默是一种古老的分子机制,它涉及小RNA在不同水平上参与调控基因表达。植物已经通过不同的RDR-DCL-AGO组合进化出了各种各样的途径,这些途径已经被证明参与了植物发育的几个方面[1那2].例如,DCL1和AGO1主要参与miRNA通路,而RDR蛋白不是miRNA生物发生所必需的[1那26].一些特殊的miRNA已经进化了专门的动作模式,例如miR166绑定前10个,专门调节射击顶端开发和拟南芥中的异常miR390 / ago7组合,以调节毒素响应因子3和4(ARF3和ARF4)[27那28].RDR6、SGS3、AGO1和DCL4是ta-siRNA通路的主要成分,负责目前研究的多种植物物种转录后水平上靶mrna的下调[29那30.那31];而RDR2、AGO4和DCL3参与RdDM通路,主要参与基因组重复区域的沉默[32那33那34].
RDR家庭柑橘sinensis.目前特征和成员特定的表达式模式
rdr的特点是存在一个保守的结构域,它可以将单链RNA复制成双链RNA,本研究在该家族的所有成员中都发现了这个结构域(图)。1).在这些蛋白质中也存在于催化部位中的保守DLDGD基序,其在CSRDR中检测到。在这个主题中,赖氨酸通常是可变的,这是CSRDR3的情况,呈现DFDGD基序,也在其他物种中检测到拟南芥,米饭,胡椒和咖啡术中[6.那35那36],而CsRDR1c则呈现一个DQDGE motif,有两个氨基酸替换,其功能活性尚待检测(附加文件6.).RDR蛋白的生物学功能通常与特定DCL蛋白的后续作用有关,在真核生物基因组中发现,包括植物、真菌和无脊椎动物,但在脊椎动物和昆虫中未发现[37].不同的RDR家族成员表现出功能多样化,这通常是保守的跨物种;例如,RDR1蛋白已被证明在拟南芥、辣椒和土豆的抗病毒防御中发挥作用[36那38那39];RDR2在RNA定向的DNA甲基化和抑制染色质修饰中起着关键作用,在拟南芥和玉米之间,在其他物种之间保守[2那32].除了参与病毒防御,RDR6同源物已经被证明参与了一些物种的ta-siRNA生物发生途径,通过调控植物发育的关键作用TAS3生物发生途径[29那40].在这项研究中,我们鉴定了7个CsRDR家族成员,包括一个RDR2同源体和一个与RDR3/4/5分支分组的成员(图)。3.).有趣的是,我们确定了两个RDR6正轨,这也是番茄和其他茄科喜欢马铃薯的情况美国commersonii[41]和三个RDR1矫形器,只在柑橘基因组中看到。在拟南芥,水稻和番茄中未观察到基因数的这种扩张,其在RDR1疏水中只有一个成员(图。2),而杨树(p . trichocarpa),一个在进化上更接近于橙色的物种,呈现出四个RDR1同源物(图。2) [42].该系列的成员在分析的组织中显示出明显的表达模式(图。4.),其中CsRDR1a、CSRDR2和CsRDR6a最为丰富。在分析的样本中没有检测到CsRDR1c,这表明这个特定的基因可能在不同的植物组织中很重要,在这里没有分析的不同发育阶段,或者它的表达是在植物在特定环境条件下生长时诱导的[11那43那44].值得一提的是,CsRDR1c仅存在于柑橘sinensis.基因组发表在Phytozome上,但没有在CSAP数据库中1),这可能是由于这些基因组处于早期版本,预期会有差异和不完整的基因结构注释。CsRDR1b、CsRDR3和CsRDR6b呈低表达(图)。4.),但它们表现出组织偏好,这表明它们可能在植物生长和发育的特定环境下发挥作用,或者它们的表达可能是对特定环境线索的响应。
DCL家庭成员柑橘sinensis.呈现不同的表达模式
DCL内切酶将dsRNA加工成2-nt 3 '悬垂的小RNA双链。DCL1能够识别pre-miRNA转录本中存在的不完美茎环底物,而在植物中发现的其他DCLs负责21-,22和24-nt siRNA的产生[45].植物DCL基因形成一个单系群,在1.5亿年前植物-动物分裂后,但在单子体-双子体分化之前产生[46].本研究中发现的所有基因都含有DEXDc、Helicase C、RNA结合和两个串联RIBOc结构域,而CsDCL1和CsDCL4则显示了两个额外的dsRB结构域(图)。1).此外,所有这些都呈现了特征DECH主题(附加文件6.).的c . sinensis基因组显示DCL1、DCL3和DCL4各有一个成员,类似于拟南芥和番茄,但值得注意的是,DCL2有两个成员,OsDCL2蛋白也是如此。由于CsDCL2a和CsDCL2b在第6染色体上的位置接近,且其氨基酸序列的90%同源性,CsDCL2蛋白似乎遭受了串联复制(图1)。2和3.).检测到这两个基因的不同表达模式表明它们获得了不同的表达调节,并且可以在特定组织中具有优先的作用。CSDCl1在分析的所有组织中显示表达,这与其在miRNA生物生物中的推定作用一致[1那26].同样,CsDCL3和CsDCL4在肉中表达量最高,但在所有分析的样品中都大量表达,这也与它们分别在RdDM和ta-siRNA生物发生中普遍存在的作用一致[2].
以前的家人柑橘sinensis.在进化过程中经历了串联复制事件
以前蛋白质是跨国公司的主要RNA沉默效果,因为它们具有小型RNA介导的调节途径所需的切片活动。以前的家族在植物演变中扩大,来自古代单细胞或多细胞绿藻(例如micromonas pusilla.和Volvox carteri),在开花植物中有3个或更少的AGO基因,到10个或更多的成员。植物中AGO家族的扩展表明AGO蛋白的功能多样化可能是由于小rna导向的调节途径的扩展[47].真核agos含有四个主域:变量n末端域和高度保守的销售,中期和piwi域[1].在这项研究中,我们在所有AGO蛋白中识别出了这些结构域,除了CsAGO7缺失了中间结构域(图)。1),这与将小rna分类为不同的AGOs有关[48].AGO7已被证明仅在拟南芥中结合miR390 [27],但这种独特的AGO7-miR390关联的基础尚不完全了解,仍有待研究c . sinensis.我们还分析了这些蛋白质中的特征DDH / H和DDD / H主题的存在,存在于拟南芥前蛋白质及其功能已经过广泛研究,建立了以前的切片活动所需的蛋白质[21那22那49].在其他物种如番茄和芸菜中也检测到一些氨基酸替换,包括在本研究鉴定的CsAGO蛋白中检测到的DDH/P、DDH/S、DDY/H和DDY/P基序[5.那25].然而,CsAGO6-like并没有呈现出这种motif,这表明CsAGO家族的这个成员可能缺乏切片活动(附加文件6.).
我们鉴定了单个的CsAGO1, CsAGO6, CsAGO7和CsAGO10,同时检测到两个高度相同的CsAGO2等位基因(93%的氨基酸同源性),根据它们在2号染色体上的紧密位置,可能起源于串联复制(图)。3., 桌子1).同样,在第7号染色体上的橙色基因组中检测到三个CsAGO5类似物,也表明重复事件导致这些等位基因共享超过90%的氨基酸同源性(图)。3., 桌子1).CsAGO5a和CsAGO5c在根中表达量略高,而CsAGO5b在所有分析的样本中表达量均较低,说明复制事件发生后出现了新的等位基因功能化(图)。4.).正如预期的那样,CsAGO1在大多数组织中表现出高积累,其作为mirna介导的调控效应。CsAGO2在根中优先表达,而CsAGO4a、CsAGO5d、CsAGO6和CsAGO10主要在胚中积累。这可能与胚胎发育过程中涉及RdDM途径的CsAGO4和CsAGO6的需求有关,因为该途径在该过程和其他过程中具有特殊的重要性,如配子发生和减数分裂,hc- sirna是沉默基因组重复区域的关键[2];以及Csago10类似于Atago10在胚胎发育中的作用的规定作用[50那51].与CsAGO5b类似,CsAGO7和CsAGO4b的表达也非常低8.;无花果,4.);这可能表明这些基因产物在其他组织和/或发育阶段和/或暴露在特定环境条件下的优先作用。
有趣的是,在我们的表达分析中发现了参与相同调控途径的因子的共表达。例如,对于miRNA的生物发生和作用,需要CsDCL1和CsAGO1,并检测到这些基因的共表达(图。4.).同样,RdDM需要CsRDR2、CsDCL3和CsAGO4的协同作用,而ta-siRNA通路需要CsRDR6、CsDCL4和CsAGO1,这些都在我们的表达分析中被证明是共同表达的(图)。4.).然而,同样重要的是要考虑到这些途径产生的小rna的生物学功能在植物生长和发育的大多数植物组织中通常是必要的。例如,mirna是参与叶和果实发育的几个转录因子的关键调节因子[26那52那53那54]以及TAS3- 通过裂解ARF转录物调节植物蛋白的响应来调节[29那30.那31],以及转录水平上的基因沉默,这也是由RNA沉默成分调控的[55那56那57].因此,这些因素的不同组合通常是普遍活跃的。阐明在植物生长发育过程中RNA沉默因子的不同组合是了解AGO、RDR和DCL家族基因成员的扩展如何促进其在不同物种中的独特功能化的关键。也有必要深入了解这些科不同成员的亚细胞定位,例如,在拟南芥和番茄中已经有了很好的特征,但在其他物种中知之甚少[58那59].
小RNA通路在果实脱落过程中被下调
在柑桔中,果实脱落占年产量损失的很大比例。众所周知,植物生长激素与植物脱落密切相关,其中乙烯被认为是植物脱落的自然调节剂[60].这一过程特别发生在果实和其他器官的脱落带(AC),通过基因表达的协调变化,并被乙烯处理加速[14那61那62].我们在柑桔果实脱落过程中的基因表达分析是为了分析RNA沉默相关基因的表达变化,在之前用于分析乙烯处理诱导脱落过程的分子机制的模型系统中[14那61那62].因此,我们比较了AGO、RDR、DCL以及其他与已知RNAi因子同源的单基因因子在果实脱落带的表达情况(图。5.,附加文件10).有趣的是,我们检测到RNAi因素的一般下调。特别是,我们检测到AZ中CSAGO4A,CSSHH1和CSNRPD2的较低水平的表达。这些基因参与RDDM途径,这是植物中重要的RNAi介导的脑膜脑途径。RDDM途径涉及转座子和重复序列的转录沉默,并依赖于包括植物特异性RNA聚合酶POL IV和POL V.POL IV转录物通过RDR2将POL IV转录物快速加工成DSRNA,然后加工成24个核苷酸。SiRNA通过DCL3并出口到细胞质。在细胞质中,它们主要掺入前4个含有复合物,并进口到核,以靶向通过同一基因座的POL V转录的新生转录物,导致DNA甲基化[2].基因沉默还涉及染色质重塑,通常通过组蛋白H3的甲基化。SHH1在答:芥是识别H3K9ME2(在组蛋白H3中的赖氨酸9的二甲基化),其促进Pol IV并引发siRNA生物发生以维持基因沉默[63].除了24 nt的sirna介导的RdDM通路外,在拟南芥中的研究表明21 nt的ta- sirna也可以介导RdDM。这些ta- sirna不是通过DCL4加工并加载到AGO1中以靶向trans中的mRNA切割,而是通过DCL1加工并加载到AtAGO4或AtAGO6中,从而指导甲基化助教位点(64].因此,在FR或AZ中观察到的CsDCL1和CsSGS3的下调也可能有助于在脱落过程中DNA甲基化的普遍抑制,因为这些成分的下调助教- 相关的RDDM途径和TA-siRNA生物发生。RDR1和RDR6的角色在涉及抗病毒防御时通常是多余的,并且两者都产生DCL4基板[39].因此,CsRDR1的作用可以提出在ta-siRNA的生物发生和/或助教基因座相关的RdDM,而CsRDR6没有差异表达。这些RNA沉默因子表达的变化可能导致表达的修饰助教RdDM和ta- sirna生物发生途径调控的基因和其他基因组区域,推测参与果实脱落的细胞过程,如细胞壁拆卸[14].
目前的工作提出了有趣的问题,潜在的表观遗传调节脱落过程。进一步的研究包括对脱落带DNA甲基化和脱落过程中小RNA群体变化的全基因组分析,以及它们的调控基因是非常有趣的实验,这些实验将有助于阐明在柑橘生物学这一有趣且经济重要的方面中涉及RNA沉默的分子机制。
结论
在目前的工作中,我们通过仔细搜查和分析可用的橙色基因组存在于橙色基因组中的5 dcl和7个RDR基因。c . sinensis基因组。它们在五种植物组织中的表达模式表明,这些基因大多数是普遍表达的,但在不同的植物组织中表现出不同的表达水平。我们利用RNA-seq数据进一步改进了其中5个基因的注释。最后,我们确定这些家族的选定成员以及其他RdDM途径的单拷贝因子(CsSHH1, CsNRPD2和CsAGO4a)在使用LCM分析的甜橙样品的果实脱落带中表现出差异表达。提供了表观遗传成分调控该物种果实脱落的初步证据。
方法
候选前识别,DCL和RDR基因在橙色
柑橘sinensis.基因组组件(V1.1)和蛋白质序列从植物血红素血压v12.1下载(https://phytozome.jgi.doe.gov)及CSAP V2 (http://citrus.hzau.edu.cn/Orange/).所有DCL的氨基酸序列和rdr基因拟南芥从TAIR (https://www.arabidopsis.org/),利用Phytozome的在线BLASTP工具搜索橙色同源基因。使用Simple Modular Architecture Research Tool (SMART,http://smart.embl-heidelberg.de/)和Pfam数据库(31.0,https://pfam.xfam.org/).蛋白质的等电点和分子量采用计算pI/Mw (http://web.expasy.org/compute_pi/).基因结构附加文件2是使用GSDS 2.0创建的[65].
系统发育分析和染色体定位
候选人蛋白质柑橘sinensis.的AGO、RDR和DCL蛋白与拟南芥,番茄茄和水稻使用Mega 6.0 [66。对于系统发育树的估计,我们使用了MUSCLE算法(gap open,−2.9;差距的扩大,0;疏水性的乘数,1.2;聚类方法,UPGMB) ([67].使用邻近的方法使用邻接方法为每个蛋白质家族构建系统发育树,其中自举测试复制了1000次。根据基因组注释进行染色体位置图像“素类注释项目“(CSAP) (http://citrus.hzau.edu.cn/Orange/),使用网上工具mapgene2染色体V2 (http://mg2c.iask.in/mg2c_v2.0/).
DCL、AGO、RDR基因在橙色组织中的表达分析
我们利用公开的RNA-seq文库分析了这些基因在不同植物组织中的表达水平。登录号详见附加文件3..对原始reads进行处理,去除Rfam 13.0数据库中存在的非编码RNA序列(http://rfam.xfam.org/),使用领结版本1.1.1,允许2个不匹配[68].干净的读取被映射到柑橘sinensis.参考基因组来自CSAP,如果是CsRDR1c和CsRDR6b,则来自Phytozome,它们在CSAP的基因组版本中没有注释。我们使用Hisat2软件,版本2.1.0 [69和hisat2-build来创建相应的索引基因组。接下来,我们使用featucounts 1.5.3 [70使用CSAP (csi.gene.models.gff3)或Phytozome (csinensis_154_v1 .gene.gff3)中的CsRDR1c和CsRDR6b基因模型来获得每个基因的读计数。使用DESeq2 version 1.20.0选择表达有2倍变化的差异表达基因[71]调整后P.值< 0.05。
DCL、AGO和RDR橙基因在果实脱落过程中的表达分析
对于分离带中的基因表达,数据来源于[14使用了)。本研究以华盛顿脐橙果实为材料,分析乙烯处理0、12和24 h后基因的表达情况。采用LCM法分别从果皮脱落带和果皮细胞中获得RNA样本。为了进行基因表达分析,使用了含有21.081个柑橘推定基因的cDNA微阵列[14].调整的基因P.-value≤0.05和±2倍变化视为差异表达。
定量RT-PCR分析
在0,12和24小时后,将脱落区和果实RIND组织从鞘蛋白处理后的乙烯处理中解剖,如[14].按照制造商的说明,使用Quick-zol试剂(Kalium Technologies)制备总RNA,并使用DNase I (Promega)处理。根据制造商的协议,使用EasyScript (Trans)从每个样本1000 ng RNA中合成cDNA。设计基因特异性引物(附加文件)11)与TransStart Tip Green qPCR SuperMix (Trans)一起使用。所有扩增产物的特异性通过解离曲线分析确定。通过3个生物学重复和3个技术重复计算相对定量值-Δct.方法,使用泛素(CsUBI)表达作为归一化控制。仅CsSGS3引物需要进行效率校正(计算为88%),如[72].
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其附加文件中。
缩写
- 前:
-
Argonaute
- DCL:
-
Dicer-like
- RdDM:
-
RNA-directed DNA甲基化
- RDR:
-
依赖RNA的RNA聚合酶
参考
- 1.
拟南芥内源沉默小rna的多样性、生物起源和活性。植物学报。2014;65:473-503。
- 2.
Borges F, Martienssen RA。植物中小rna不断扩展的世界。细胞生物学杂志。2015;16(12):727-41。
- 3.
Kapoor M, Arora R, Lama T, Nijhawan A, Khurana JP, Tyagi AK,等。水稻DICER-LIKE、ARGONAUTE和RNA- dependent RNA POLYMERASE基因家族的全基因组鉴定、组织和系统发育分析及其在生殖发育和逆境中的表达分析BMC基因组学。2008;9:1-17。
- 4.
费强,夏锐。转录后调控网络中的阶段性、二级、小干扰rna。植物细胞。2013;25:2400-15。
- 5.
白M,杨GS,陈WT,毛泽东,康HX,Chen Gh,等。响应病毒感染和非生物应激的基因组 - 依赖性鉴定DICER样,嗜颗粒状和RNA依赖性RNA聚合酶基因家族及其表达分析茄属植物lycopersicum.基因。2012;501:52 - 62。
- 6.
Wassegger M,Krczal G. RNA定向RNA聚合酶的命名和功能。趋势植物SCI。2006; 11:142-51。
- 7.
maris R, Fusaro AF, Smith NA, Curtin SJ, Watson JM, Finnegan EJ,等。植物切块的进化和多样化。2月。2006;580:2442-50。
- 8.
Hutvagner G, Simard MJ。Argonaute蛋白:RNA沉默的关键角色。《细胞生物学》2008;9:22-32。
- 9.
钱永强,程永华,程斌。玉米DICER-LIKE、ARGONAUTE和RNA依赖RNA聚合酶基因家族的鉴定与鉴定。植物细胞代表2011;30:1347-63。
- 10.
赵华,赵凯,王静,陈旭,陈智,蔡锐,等。葡萄中DICER-LIKE、ARGONAUTE和RNA依赖RNA聚合酶dene家族的综合分析(葡萄).植物生长规律。2015;34:108-21。
- 11.
胡椒粉DCL、AGO和RDR基因家族的全基因组分析Capsicum Annuum.l .)。中华医学杂志。2018;19。
- 12.
徐强,陈丽丽,阮旭,陈东,朱安,陈超,等。甜橙的基因组草图(类).Nat麝猫。2013;45:59 - 66。
- 13.
吴桂芳,张志强,张志强,等。对不同的柑橘、柚子和橙子基因组的测序揭示了柑橘驯化过程中混合剂的复杂历史。Nat Bitechnol。2015;32:656 - 62。
- 14.
Merelo P, Agustí J, Arbona V, Costa ML, Estornell LH, Gómez-Cadenas A,等。乙烯促进柑橘果实脱落过程中脱落带细胞的细胞壁重塑。植物学报。2017;8:126。
- 15.
植物microrna和相关小rna的功能。自然遗传学。2006;38:31-7。
- 16.
Nag A, Jack T.雕刻花朵;microrna在花发育中的作用。Curr Top Dev Biol. 2010;91(C): 349-78。
- 17.
金东,王颖,赵颖,陈明。MicroRNAs及其在植物发育中的相互作用。中国基因工程杂志。2013;40:161-70。
- 18.
等。mirna在非生物胁迫下对作物生长发育的调控作用。Biotechnol。2017;39:685 - 700。
- 19.
翟建军,郑德辉,德保利E, Park S, Rosen BD, Li Y, et al. .microrna作为植物NB-LRR防御基因家族的主要调控因子,通过产生阶段性的、反式作用的sirna。基因Dev。2011;25:2540-53。
- 20.
宋俊杰,刘杰,刘俊杰,等。纯化的Argonaute2和siRNA形成重组人RISC。国立生物医学研究所。2005;12:340-9。
- 21.
Baumberger N, Baulcombe DC。拟南芥ARGONAUTE1是一个RNA切片机,选择性招募microrna和短干扰RNA。中国科学院院刊。2005;102(33):11928。
- 22.
Carbonell A, Fahlgren N, Garcia-Ruiz H, Gilbert KB, Montgomery TA, Nguyen T,等。三种拟南芥ARGONAUTES的切片缺陷突变体功能分析。植物细胞。2012;24:3613-29。
- 23.
刘C,艾斯特尔MJ,Fedoroff NV。拟南芥Dicer样1的螺旋酶和RNASEIIIA结构域在微稻草生物发生过程中调节催化参数。植物理性。2012; 159:748-58。
- 24.
Lee Y, Ahn C, Han J, Choi H, Kim J, yij,等。核rna酶III Drosha启动microRNA加工。大自然。2003;425:415-9。
- 25.
曹建勇,徐永平,李伟,李世生,Rahman H,蔡学忠。芸薹属植物DICER-LIKE、ARGONAUTE和RNA依赖RNA聚合酶基因家族的全基因组鉴定及其拟南芥抗性同源基因的功能分析菌核病sclerotiorum.植物科学学报2016;7:1-17。
- 26.
余勇,田然,薛梅。植物microrna的基因表达。新植醇。2017;216:1002-17。
- 27.
Montgomery TA, Howell MD, Cuperus JT, Li D, Hansen JE, Alexander AL,等。ARGONAUTE7-miR390相互作用的特异性和TAS3反式作用siRNA形成的双重功能。细胞。2008;133:128-41。
- 28.
朱辉,胡芳,王锐,周旭,施绍华,刘丽伟,等。拟南芥ARGONAUTE 10特异性隔离miR166/165调控茎尖分生组织发育。细胞。2011;145:242-56。
- 29.
Fahlgren N, Montgomery TA, Howell MD, Allen E, Dvorak SK, Alexander AL,等。TAS3 ta-siRNA对生长素反应因子3的调控影响拟南芥的发育时间和模式。咕咕叫医学杂志。2006;16:939-44。
- 30.
Yifhar T, Pekker I, Peled D, Friedlander G, Pistunov A, Sabban M, et al.;番茄反式短干扰RNA程序未能调控生长素反应因子3和ARF4是导致丝状叶综合征的原因。植物细胞。2012;24:3575 - 89。
- 31.
Dotto MC, Petsch KA, Aukerman MJ, Beatty M, Hammell M, Timmermans MCP。全基因组分析leafbladeless1 -调控和分阶段的小rna强调了TAS3 ta-siRNA通路对玉米发育的重要性。公共科学图书馆麝猫。2014;10 (12):e1004826。
- 32.
J A L,Jacobsen SE。建立,维持和修饰植物和动物的DNA甲基化模式。NAT Rev Genet。2010; 11:204-20。
- 33.
王飞,Axtell MJ。在pol v依赖位点上的异色siRNA积累特异性需要AGO4拟南芥.植物j . 2017; 90:37-47。
- 34.
刘伟,王志强,王志强,等。rna导向的DNA甲基化涉及拟南芥中聚合酶V转录本的共转录小rna引导的切片。Nat植物。2018;4:181-8。
- 35.
Fernandes-Brum CN,Rezende Pm,Ribeiro Thc,De Oliveira Rr,De Sousa Cardoso TC,Do Amaral LR等。对咖啡中的RNA引导沉默途径的基因组分析显示出对其调节机制的见解。Plos一个。2017; 12:1-29。
- 36.
秦磊,莫宁,张勇,赵刚,张勇,等。CaRDR1是一种RNA依赖的RNA聚合酶,在辣椒抗花叶病毒中发挥积极作用。植物学报2017;8 - 13。
- 37.
张丹,马海涛,姚晓东,马海涛。RNA聚合酶(RdRP)基因的进化及其在真核生物分类中的应用。基因。2009;447:29-39。
- 38.
Hunter LJR,Brockington SF,Murphy Am,Pate Ae,Gruden K,Macfarlane Sa等。RNA依赖性RNA聚合酶1在马铃薯(Solanum Tuberosum.)及其与其他植物RNA依赖性RNA聚合酶的关系。SCI REP。2016; 6:1-11。
- 39.
植物的RNA沉默抑制:防御、反防御和反-反防御。2013; 11:745-60。
- 40.
Yoshikawa M,Peragine A,Park My,Poithig Rs。生物发生的途径。基因开发。2005年:2164-75。
- 41.
Esposito S,Aversano R,D'Amelia V,Villano C,Alioto D,Mirouze M等。Dicer样和RNA依赖性RNA聚合酶基因家族鉴定和栽培的注释Solanum Tuberosum.它的野性相对美国commersonii.Planta。2018; 248:729-43。
- 42.
赵克,赵立,陈泽,冯L,ren j,cai r等。Dicer样,argonaute和RNA依赖性RNA聚合酶基因系列Populus Trichocarpa.:基因结构、基因表达、系统发育分析和进化。J麝猫。2015;94:317-21。
- 43.
曲凡,叶雪梅,莫里斯TJ。拟南芥DRB4、AGO1、AGO7和RDR6参与了由DCL1负调控的dcl4启动的抗病毒RNA沉默通路。中国科学院院刊2008;105:14732-7。
- 44.
Curtin SJ, Kantar MB, Yoon HW, Whaley AM, Schlueter JA, Stupar RM。大豆dicer类基因的共表达对胁迫和发育的响应。功能整合基因组学。2012;12:671-82。
- 45.
植物DICER-LIKE蛋白:用于小RNA生物发生的双链RNA切割酶。植物学报2017;130:33-44。
- 46.
张学军,张学军,张学军,等。拟南芥DICER在小RNA加工、基因沉默和DNA甲基化模式中的作用Nat麝猫。2006;38:721-5。
- 47.
张H,夏R,Meyers Bc,Walbot V.植物植物Argonaute蛋白的进化,功能和奥秘。CurrOp植物BIOL。2015; 27:84-90。
- 48.
Frank F,Hauver J,Sonenberg N,Nagar B. Arabidopsis Argonaute Midomains使用它们的核苷酸特异性环来对小RNA分类。Embo J. 2012; 31:3588-95。
- 49.
Arribas-Hernández L, Marchais A, Poulsen C, Haase B, Hauptmann J, Benes V, et al.;ARGONAUTE1的切片活性对于拟南芥中反式作用的短干扰rna的分阶段(而不是产生)是特别需要的。植物细胞。2016;28:1563 - 80。
- 50.
Tucker Mr,Hinze A,Tucker EJ,Takada S,Jurgens G,Laux T.血管信号由Zwille介导的血管信号在征征在拟南芥胚胎中的拍摄性胚胎晶体发育过程中。发展。2008; 135:2839-43。
- 51.
ZWILLE基因在拟南芥胚芽分生组织细胞命运调控中的作用。EMBO j . 1998; 17:1799 - 809。
- 52.
陈欣。植物microRNA的生物发生和功能。2月。2005;579:5923-31。
- 53.
Karlova R, Van Haarst JC, Maliepaard C, Van De Geest H, Bovy AG, Lammers M, et al.;利用高通量测序和降解组分析鉴定番茄果实发育中的microRNA靶点。J Exp Bot. 2013;64: 183 - 78。
- 54.
José Ripoll J, Bailey LJ, Mai Q-A, Wu SL, Hon CT, Chapman EJ, et al. microRNA对果实生长的调控。Nat植物。2015;1:15036。
- 55.
表观遗传学:异染色质与RNAi的结合。细胞研究》2009;19:282 - 95。
- 56.
等。活性转座元件的表观遗传沉默是由RDR6和21-22核苷酸小干扰rna触发的。植物杂志。2013;162:116-31。
- 57.
Simon SA, Meyers BC。植物中小rna介导的表观遗传修饰。植物生态学报。2011;14(4):489 - 494。
- 58.
陈志强,陈志强,陈志强。植物RNA沉默机制的研究进展[j]。植物细胞。2013;25:22-37。
- 59.
谢志强,乔汉森k,古斯塔夫森m, Kasschau KD, Lellis AD, Zilberman D,等。植物小RNA通路的遗传和功能多样化。公共科学图书馆杂志。2004;2:642-52。
- 60。
乙烯,叶片脱落的自然调节因子。大自然。1970;225:1019-22。
- 61。
Agustí J, Merelo P, Cercós M, Tadeo FR, Talón M.乙烯诱导的柑橘叶片脱落过程中的差异基因表达。J Exp Bot. 2008; 59:2717-33。
- 62.
Agustí J, Merelo P, Cercás M, Tadeo FR, Talán M.乙烯促进柑橘叶片脱落过程中薄片脱落带细胞和端皮层细胞转录水平的比较研究。BMC Plant Biol. 2009; 9:1-20。
- 63.
luo JA, Du J, Hale CJ, Feng S, Krajewski K, Palanca AMS, et al.;聚合酶IV在rna导向的DNA甲基化位点上的占用需要SHH1。大自然。2013;498:385-9。
- 64.
吴L,毛泽东,齐y。Dicer样和Argonaute蛋白在TAS-衍生的小干扰RNA触发的DNA甲基化中的角色。植物理性。2012; 160:990-9。
- 65.
胡b,金吉,郭艾,张h,罗j,高g. gsds 2.0:升级基因特征可视化服务器。生物信息学。2015; 31:1296-7。
- 66.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物学杂志。2013;30:2725-9。
- 67.
埃德加钢筋混凝土。MUSCLE:多序列比对,高精度,高通量。核酸学报2004;32:1792-7。
- 68.
Langmead B.将短测序读数与领结对齐。生物信息学。2010。- 24页。
- 69.
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12:357-60。
- 70。
廖颖,史伟,史伟:一种高效的基因组特征赋值通用程序。生物信息学。2014;30:923-30。
- 71。
利用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15:1-21。
- 72。
pfaffl mw。实时RT-PCR中相对量化的新数学模型。核酸RES。2001; 29:45E-45。
确认
我们感谢阅读这份文件并分享宝贵意见和讨论的同事。MD、AV和LD是CONICET国家调查委员会Científicas y Técnicas (CONICET)研究员,AS是CONICET博士研究员。
资金
这项研究部分得到了FONCyT基金PICT 201-0426的支持。
作者信息
从属关系
贡献
构思和设计了实验:MD,LD,FT,AV,MT。执行实验:AS,MD。分析了数据:AS,MD,LD,FT。写了论文:AS,MD。修改了稿件:LD,FT,MT。所有作者均阅读并批准最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用
同意出版物
不适用
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
用于系统发育分析的AGO, RDR和DCL基因家族的基因ID (XLSX 13 kb)
额外的文件2:
基因结构注释和更新的蛋白质序列(pdf461 kb)
额外的文件3;
Pfam和SMART domain id (XLSX 12kb)
额外的文件4:
分析基因的术语注释(XLSX 13 KB)
额外的文件5:
本研究中使用的RNA-seq文库的登录数(XLSX 11 kb)
附加文件6:
在CSAGO,CSRDR和CSDCL蛋白中检测到的图案(XLSX 13 KB)
附加文件7:
CSAGO,CSDCL和CSRDR基因的差异表达分析(XLSX 10 KB)
附加文件8:
不含CsAGO1和CsAGO4a的AGO系列热图(TIF 3434kb)
附加文件9:
来自于AZ和FR的RNA沉默因子芯片数据c . sinensis水果(XLSX 13 KB)
额外的文件10:
RNA沉默基因的相对表达量。qRT-PCR检测转录水平(平均±SE;N= 3)比较了未经乙烯处理(0 h)的AZ或FR中各基因的表达,并以CsUBI为归一化对照(*P.< 0.05;Arunachal Pradesh,P.-Value <0.001)(TIF 5450 KB)
额外的文件11:
用于QRT-PCR的引物(XLSX 11 KB)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Sabbione,A.,Daurelio,L.,Vegetti,A。等等。对前的全基因组分析,DCL和RDR基因系列揭示了RNA定向的DNA甲基化参与水果脱落柑橘sinensis..BMC植物杂志19,401(2019)。https://doi.org/10.1186/s12870-019-1998.1.
收到了:
公认:
发表:
关键词
- 小rna
- DCL
- 前
- RDR.
- 橙色
- 离层
- 柑橘sinensis.