抽象的
背景
Apple是全球最受欢迎的水果作物之一,其肤色是商业价值至关重要的重要质量考虑因素。然而,红色皮肤苹果遗传育种的策略和肤色分化的遗传基础非常有限,仍然很大程度上未知。
结果
在这里,我们报道了富士苹果的芽体育突变体,具有红色肤色和增强的花青素积累。定量SWATH-MS(顺序窗口获取所有理论光谱 - 质谱)蛋白质组学研究揭示了苹果红皮肤芽突变中的蛋白质组变化,并且在苹果皮中鉴定了共451个差异表达的蛋白质。突变体显示出显着增加的光合作用蛋白质的表达水平,应激相关蛋白质以及花青素生物合成途径。另一方面,检测丝裂原激活蛋白激酶4(MAPK4)和甲羟戊酸激酶(MVK)的大量下调,表明突变体中的红色肤色发育的有希望的作用。此外,我们还假设通过先进的SWATH-MS分析,在突变体中发生皮肤颜色的转录后调节。
结论
我们的工作提供了有关蛋白质组学方法应用蛋白质组学的应用的重要信息,分析富士苹果苹果的变化,并突出了调节蛋白的思考,可能导致果皮的分子育种。
背景
苹果(Malus Domestica.)是世界范围内经济上最重要的水果作物之一,由于其营养价值和广泛的健康益处,消费者对其需求不断增长。苹果的品质主要取决于多种特征,包括大小、口感、甜度、质地和明亮的肤色[1那2].有趣的是,我们经常使用红色的果皮颜色作为表型的外部评估来判断苹果的质量。事实上,优化其中任何一个都能提高苹果的品质。
苹果果实着色被认为是水果育种期间成熟度和外部质量的表观指标[3.那4.那5.].基本上,一组天然的类黄酮化合物,尤其是花青素,是水果着色所必需的,占苹果总皮肤色素沉着的80% [6.].而涉及花色苷生物合成途径的苯丙氨酸解氨酶(PAL)、查尔酮异构酶(CHI)、二氢黄酮醇还原酶(DFR)等大多数基因在苹果中也已得到很好的表征[7.那8.那9.].积累在红皮中的花青素具有抗氧化和保护肝的作用,有助于水果的健康益处[10.那11.].然而,除了花青素,各种未知的遗传和环境因素明显对苹果的皮肤颜色的影响。一些研究已经进行了调查对不同品种和变异之间的比较底层的分子成分。亚洲的苹果品种“富士”是在中国商业化而呈现红色的皮肤色素沉着“富士”苹果的红色芽变在中国江苏省最近发现。这芽变苹果总是红红的,通过不断观察跨越与稳定的表型的整个皮肤着色的发展阶段和嫁接实验。因此,从这个突变体解剖皮肤着色的潜在的分子机制,并确定候选基因控制的红色形成是苹果栽培的分子育种非常有意义的。
苹果果实颜色的转录组学和代谢组学分析已经进行了研究,以提供关于苹果皮肤颜色形成的整体mRNA谱和色素沉着代谢物的见解[6.那12.].然而,由于各种后术后修改,基因表达调节可能无法充分反映相应的蛋白质表达[13.].到目前为止,由于报道的少数蛋白质组学研究,理解苹果果实着色和蛋白质组水平突变的突变仍然不明确。在该研究中,通过SWATH-MS(顺序窗口采集的所有理论质谱)确定了“富士”苹果和红色芽突变之间的蛋白质组简曲线的变化,这已经广泛地应用于拟南芥如研究模型植物中和米[14.那15.].SWATH-MS实验在无关的数据上执行(DIA)模式,它结合了霰弹枪蛋白质组学的高吞吐量和SRM蛋白质组学的高再现性,导致大规模的蛋白质鉴定和蛋白质量化精度[16.].与传统的二维凝胶电泳(2D-gel electrophoresis, 2D-gel electrophoresis)和iTRAQ相比,该方法具有更高的准确性和重现性,在植物蛋白质组学研究中受到了广泛的关注。在“富士”苹果皮中定量鉴定了1470个独特的蛋白质。其中,在“富士”苹果果实发育及其芽突变过程中,共观察到451个差异表达蛋白。Go和通路富集分析显示,在光合作用和能量代谢、胁迫相关蛋白以及花青素生物合成途径等生物学方面,蛋白质组发生了显著的变化。通过对“富士”苹果及其芽突变的蛋白质组差异进行生物信息学分析,对苹果果皮色发育的分子机制有较全面的认识。
我们的Swath-MS基于蛋白质组学调查可以揭示它们在蛋白质水平上的苹果肤色形成的遗传差异,并确定未来高质量和大型果实以及未来明亮的苹果品种的潜在应用的关键调节剂.
结果
富士红皮肤突变体(FUJI_M)中的SWATH-MS定量蛋白质组学分析
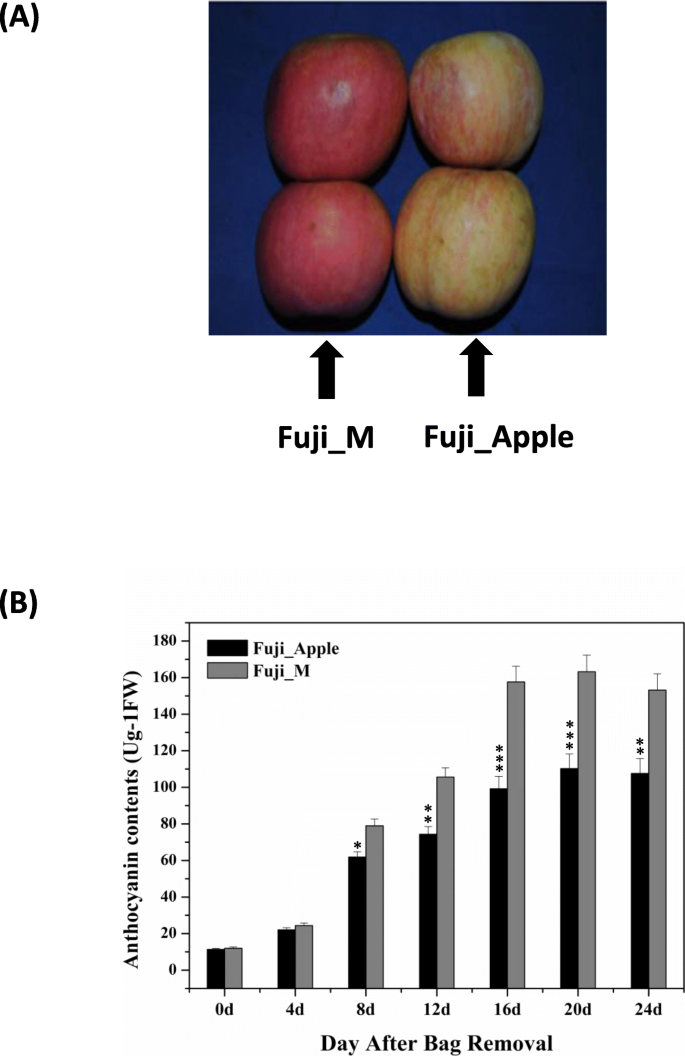
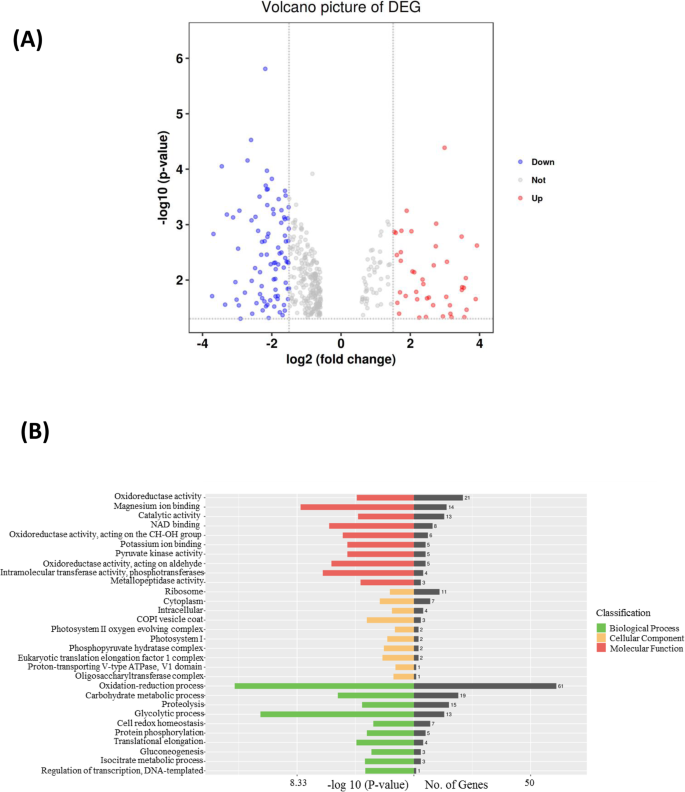
富士苹果(Malus x Domesticabrokh cv。富士)和红皮肤突变体Fuji_M在2017年的收获季节在江苏省Shilaojia发现。粉授粉后,他们的年轻水果已经长30天,然后用棕色袋子覆盖。如图2所示,在移除后16天拍摄了水果的分化颜色。1一种。众所周知的花青素已被鉴定为负责在许多植物中果皮颜色形成的重要指标[3.那4.].因此,为了确保在Fuji_apple和Fuji_M之间有一个合适的采样时间点进行蛋白质组学分析,采用LC-MS/MS法测定内源花青素含量。摘袋后,果实成熟过程中花青素水平逐渐升高,但富士m的加速速度高于富士苹果(图2)。1b).富士苹果和富士m的花青素含量差异最大发生在去袋后16天(图2)。1b)。因此,选择16个DABR(果实暴露于正常阳光),选择该蛋白质组研究,以研究通过SWATH-MS分析在水果成熟期间富士葡萄和富士_M之间的蛋白质组变化。合并来自六个生物重复的数据后,鉴定了大约1470个独特的蛋白质,并以临界虚假发现率为1%(附加文件)1:表S1)。折叠变化的蛋白质高于1.5或低于0.67(P. < 0.05) were considered as differentially expressed proteins (DEPs) in this study. Accordingly, in all of 451 proteins showing significant protein abundance changes between Fuji_apple and Fuji_M with 135 increased and 316 decreased (Table1).差异表达蛋白质的火山图像还揭示了显示红色皮肤突变体中丰度增加的DEP的数量,而不是在FUJI_APPLE中的折叠(图。2A),表明一些重要的调节或通路被诱导,可能导致红皮肤表型。
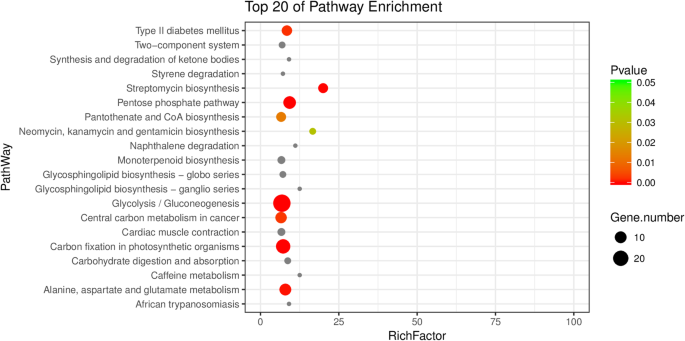
随后,通过基因本体学(GO)分析,包括生物学过程,细胞组分和分子功能,进行那些DEP的功能分类。因此,属于类别的“氧化还原过程”和“碳水化合物代谢过程”的蛋白质含有最多的DEPS,表明这些课程在红皮芽突变中受到大受影响(图。2b).同样值得注意的是,具有氧化还原酶活性和镁活性的蛋白质在“分子功能”的氧化石墨烯术语中具有高度代表性,这表明这些酶对红色皮肤颜色的形成是协调调节的。大多数具有GO术语“细胞组分”的DEPs分布在核糖体和细胞质中(图2)。2b).因此,GO分析的这些结果表明,在苹果红皮芽突变中,不同的相应生物过程或酶被激活或抑制,以实现苹果的脸红特性。此外,KEGG(京都基因和基因组百科全书)路径分类也在dep上进行,提供了芽突变中最重要的路径的快速视图(图。3.).在DEPs的图谱上,我们列出了糖酵解、光合作用中碳固定、氨基酸代谢等前20个途径(图2)。3.),其中应该是苹果中分化表型的关键。
光合和能量代谢蛋白
光合作用程度对于果实肤色变化至关重要。从绿色到红色的果子颜色总是取决于叶绿素含量的减少或抑制,以通过调节光合作用蛋白的颜色来看来花青素的颜色[17.那18.].在这项研究中,有18个与过度的丰富的光合相关蛋白质。有趣的是,大多数均在红色皮肤突变体中调节上调,其中光合酶复合物的重要元素包括细胞色素B6 / F,光系统I和II(PSI和PSII)和光收获叶绿素蛋白复合物(LHC)(附加文件2:表S2)强烈表明,与Fuji_apple相比,在红色肤色突变体中加强了光反应。同样,CO.2还显示同化在突变体中增加了CALVIN循环酶的增加的蛋白质丰度,包括CO的RUBISCOActivase(MDP0000944409)2固定和甘油醛-3-磷酸脱氢酶(MDP0000835914, MDP0000527995)参与还原阶段,以及d -核酮糖-5-磷酸-3-epimerase (MDP0000276466)参与二磷酸核酮糖的再生。有趣的是,nad依赖的苹果酸脱氢酶(MDH)在突变体中也表现出较高的丰度,该酶是黑毒酸中羟基氢离子催化草酰乙酸再生的关键酶,表明红皮芽突变体的呼吸代谢增强。因此,该突变体光合活性整体上调可能是由于花青素积累对光吸收的需求,从而导致红皮芽突变体的光反应能力、碳同化能力以及呼吸能力的提高。
富士红皮肤突变体中花青素生物合成途径的上调
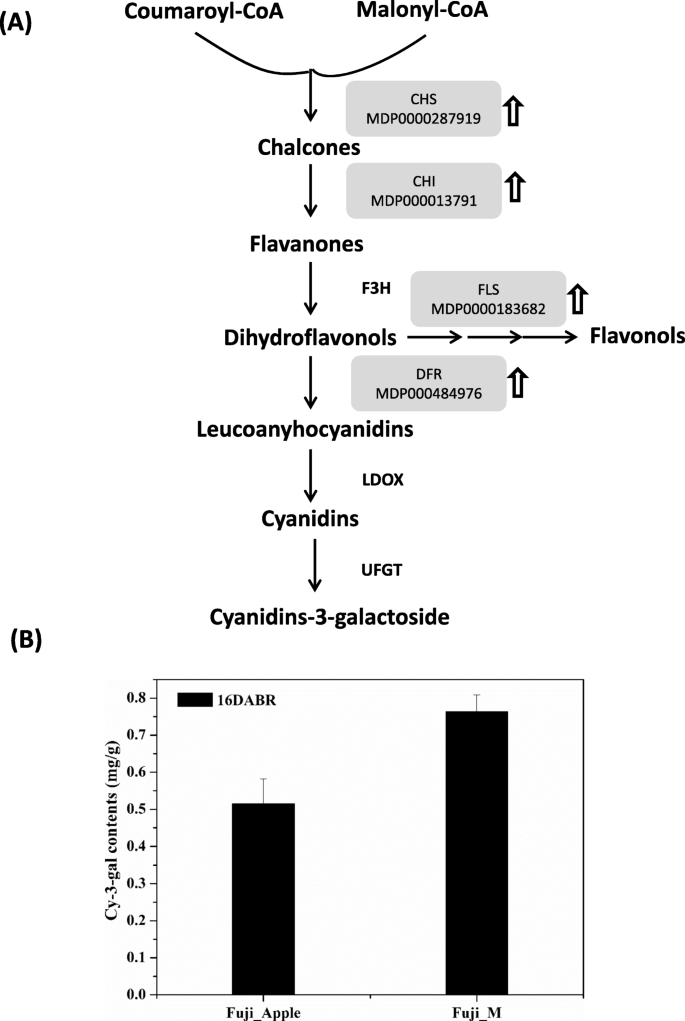
花青素是苹果肤色的红色着色源中的必需组分[5.].红皮品种的花青素积累量高于浅色或白色品种,被认为是影响市场价值的重要果实性状。在这里,一些丰度变化增强的关键酶参与并被定位到花青素生物合成的顺序反应中(图。4.a).香豆蔻酰辅酶a和丙二酰辅酶a经查尔酮合成酶(CHS, MDP0000287919)催化合成花青素。随后,查尔酮异构酶(CHI, MDP000013791)催化查尔酮转化为黄酮。下一步是由黄酮-3ß-羟化酶(F3H)催化生成二氢黄酮醇。一方面,二氢黄酮醇通过二氢黄酮醇-4还原酶(DFR, MDP000484976)进行还原,形成淡色anyhocyanidin;另一方面,二氢黄酮醇也通过黄酮醇合成酶(FLS, MDP0000183682)通过顺序反应进入黄酮醇的生产。最后两种酶LDOX和UFGT分别完成了白花青素向花青素基花青素的转化。因此,那些丰度增加的酶分支的变化直接反映了Fuji_M中花青素生物合成的上调(图。4.a),这也与富士葡聚糖和富士糖素之间的花青素含量的结果一致(图。1b).此外,我们通过LC-MS/MS分析研究了苹果皮中花青素的组成,发现苹果皮中含有多种类型的花青素。特别是,在Fuji_M中检测到的cyanidin-3-半乳糖(cy-3-gal)与Fuji_Apple相比显著增加了约50%(图。4.b),这也是苹果中最丰富的花青素[6.].因此,Fuji_Apple和Fuji_M的显著肤色差异可能是受花青素生物合成的调控。有趣的是,这种调节机制主要基于一个转录复合物,该复合物由MYB、bHLH和WD40类三种转录因子组成[4.那17.],通过大多数植物MYB-bHLH-WD40复合物激活花青素生物合成途径[19.].然而,在本研究中,未发现MYB和bhlh相关蛋白,仅定量鉴定出两个WD40重复样蛋白(MDP0000231283和MDP0000433881),且在突变体中丰度增强2:表S2)。揭示了WD重复蛋白质的几份报告促进了植物中的花青素的积累,包括苹果,绿茶和鞑靼荞麦[20.那21那22].苹果WD40蛋白通过bHLH的相互作用而不是MYB-bHLH-WD40复合物的激活来调节花青素的生物合成[23].因此,由呼出潜在突变基因引起的两个WD40类蛋白的上调可能调节富士糖中的花青素积累,从而有助于红色肤色。
应激相关的蛋白质
在我们的研究中,一些鉴定的差异表达蛋白显示出比富士_M中的增加的丰富富集的蛋白质在应激相关蛋白质的组分中,它们可能会参与各种生物和非生物胁迫(附加档案2:表S2)。据公知的,压力相关蛋白自发为工厂电阻与环境胁迫因素,包括温度异常,重金属,干旱和盐度[应对合成24那25].检测在富士-M(附加文件被累积:在这里,几个热休克蛋白(HSP70 HSP101; HSP81.4; HSP90.1的HSP)2:表S2),这是一种保守压力家族蛋白。例如,HSP70能够通过其与E2泛素连接酶的分子伴随的分子伴蛋白功能来处理受损或有缺陷的蛋白质到蛋白水解途径[26那27].巧妙地,我们还发现了独特的E2(MDP00714492),在这种红皮肤突变体(FUJI-M)中具有显着增加的丰富,这表明这种细胞保护机械被保守,对红皮芽突变(FUJI-M)是必不可少的。因此,与FUJI_APPLE相比,红色皮肤突变体可能具有改善的抵抗能力,这将需要进一步调查。有趣的是,HSP70还据报道,通过其伴随蛋白水解途径的连杆参与人类视网膜色素上皮细胞[28[还可以参与Hsp70的进一步表明Hsp70。另外,在富士米中也上调了三种S-腺苷-1-甲硫氨酸依赖性甲基转移酶(SAMMTASE:MDP0000277065; MDP0000268065; MDP0000776572)。Sammterase基本上是将来自S-腺苷蛋氨酸(SAM)供体转移到各种生物分子的甲基,在主要天然产物的生物合成途径中在包括脂质,萜类化合物,核酸和黄酮类化合物的生物合成途径中,特别是在其生物活性通过调节中的生物活性甲基化模式[29].因此,Sammterass对苹果中黄酮类化合物的生物合成具有相当大的努力,这与肤色形成高度相关。富士糖中的Sammtase的上调可能会改变黄酮类结构性能和黄酮类色素色素沉着,导致红色皮肤的特征。
讨论
候选蛋白质负责红色皮肤突变
寻找富士综合症和富士蛋白之间的差异表达蛋白中的红色皮肤突变的靶蛋白是照亮该芽突变的分子机制。在这里,我们在FUJI_M中收集了16个候选蛋白质,具有急剧下降的丰富(折叠变化> 100),如表所示2.代表性的有丝裂原活化蛋白激酶4 (MAPK4: MDP0000321746)在Fuji_M中表现出116倍的下调。MAPKs在调控细胞信号转导或作为信号分子发挥重要作用,已有报道参与色素细胞发育[30.].有趣的是,黄酮类化合物对MAPK的激活有抑制作用[31].因此,在FUJI_M中观察到MAPK4的破坏和黄酮类化合物生物合成途径的破坏,强烈暗示MAPK信号通路可能用作苹果皮色素沉着过程中的调节剂。更有趣的是,相关蛋白质HSP70也参与MAPK信号通路[32,它可能是苹果中形成红色的下游信号分子。另一方面,另一个候选蛋白甲戊酸激酶(MVK: MDP0000025413)在Fuji_M中显著下调,Fuji_M是类异戊二烯合成的关键酶。有趣的是,植物通过MEP (Methylerythritol 4-phosphate)和MVA (Mevalonic acid)两种不同的途径合成类异戊二烯,用于光合作用、色素生产和激素生物发生[30.].属于MVA途径的MVK作为类异戊二烯生产的速率决定酶发挥作用[33[MVK上的抑制可能导致异戊二烯供应的无序控制,这是必需的必要方法,如光合作用和色素沉着。这两者都对于苹果中的肤色形成至关重要。此外,与FUJI_APPLE相比,富士蛋白蛋白在富士蛋白中的最低表达编码了属于F1型ATP酶(MDP0000624197)的线粒体ATP合酶亚单次δ。它是对应激诱导呼吸功能诱导氧化损伤的植物进行线粒体呼吸道复合物的组分[34那35].在可能的突变这种蛋白质的严重抑制由于作为线粒体的呼吸微弱偏移光合作用的巨额成本。总之,生物信息学分析进一步的遗传和分子战略,将推动以确认这些候选蛋白控制水果皮肤色素沉着的作用和验证负责皮肤表面的红色芽变靶蛋白。
蛋白质组学分析揭示了转录后变化可能有助于苹果中的红皮芽突变
几个转录组测序实验已经使用不同的植物物种,如拟南芥,黄瓜,玉米和马铃薯[进行36那37那38那39].然而,鉴定差异表达的基因的蛋白质丰度仍不清楚。以前基于SWATH-MS的研究报告说,一些转录因子中差异表达蛋白的名单中发现[15.],支持该权利要求书的转录因子的调控主要发生在翻译后水平。在目前的工作中,观察到12个蛋白参与通过RNA加工转录后调控(表3.).参考SRGD数据库中总结的剪接相关基因(SRG) (http://www.plantgdb.org/SRGD/index.php),其中5个基因被分为3大类剪接因子,包括参与剪接体组成的蛋白质(小核核糖核蛋白,snRNP), Poly A结合和调节剪接因子(富含甘氨酸的RNA结合蛋白)(表3.).其中,一些蛋白质(例如,E.G.MDP0000283985,MDP0000245145和MDP320945)与拟南芥中的RNA加工相关蛋白质高度同源,这已经很好地研究了参与剪接过程,例如剪接过程或剪接部位选择[40那41]暗示,除了传统的转录控制之外,替代剪接的大量变化可能在皮肤颜色形成期间作为额外的调节机制层存在[42].同时,MDP0000260339,拟南芥富含甘氨酸的RNA结合蛋白的同源物(AtGRP7)其参与发育和非生物胁迫应答[43那44那45那46],在Fuji_m中显着上调。有趣的是,蛋白质组学分析也检测到几种AtgRP7蛋白的同种型以应对环境压力[47,进一步说明苹果果皮颜色形成过程中可能存在转录后调控。此外,在Fuji_M中发现了苹果异质核糖核蛋白(hnRNP) MDP0000614064的表达上调。两种同源蛋白(RBP45和RBP47)此前在n plumbaginifolia[48].这两种蛋白质已被证明能够与Poly A RNA结合,是U1 snRNP的潜在成分[48].因此,该蛋白质与MDP0000283985之间的推定相互作用,聚结蛋白[49]在提出后转录后调节期间。然而,MDP0000614064在肤色形成中的潜在作用仍然是难以捉摸的。此外,还在下调蛋白质子集中检测到转录的调节的几种相关蛋白质(附加文件2:表S2),表明RNA稳定性的复杂性和转录可用性可能对于植物肤色发育可能是重要的。
结论
果实肤色形成似乎启动了复杂的响应网络,从转录到翻译后控制。因此,使用单一转录组或蛋白质组学方法的传统实验设计将遇到更多困难,以找到对果皮颜色负责的真正调节器或途径。传统的蛋白质组学方法如2D-GEL患有蛋白质量化和大变异的不稳定性[50].因此,作为新一代的无标记方法,是根据SWATH-MS蛋白质组学被认为增强差异表达的蛋白质的鉴定,并在同一时间提高重复性之间重复[15.那51].此外,射击枪蛋白质组学通常受其参考数据库的限制,其可以通过来自平行短读取RNA测序的自建蛋白质数据库来互补[52].近年来,近年来,近年来,近年来,近年来,近年来,近年来,近年来,近年来变得流行的生物素学素描器的发展[42那53].当然,功能分析如使用遗传方法和构建转基因株系是强烈推荐的,以验证生物信息学方法的发现。虽然我们的调查揭示了几个不同的调节事件,但它也可能是这种红皮肤芽突变的影响而不是原因。因此,结合蛋白质组学、rna测序和更多的分子方法,将进一步阐明果皮颜色形成的信息。
本研究揭示了富士苹果与突变体之间的分子分化,在光合作用和能量代谢、花青素生物合成以及胁迫反应等方面的蛋白质丰度发生了显著变化。此外,在红皮突变体中发现了MAPK4、MVK和F1型atp酶等潜在的靶蛋白,这些蛋白在其颜色突变体中丰度大大降低,其中对红苹果性状的着色过程起着积极的作用。此外,先进的SWATH-MS分析还显示,一定比例的蛋白涉及转录后变化在水果着色中起调节作用。总之,我们的蛋白质组分析为进一步研究苹果果皮颜色的形成提供了新的线索,并将扩展我们对果皮颜色的理解,为未来的水果育种。
方法
植物材料及取样
Bud Sport在苹果和葡萄等园艺植物中特别影响花卉和果实颜色的表型罕见变化54].这里是富士苹果(Malus Domestica.brokh cv。富士)和芽运动分支的红皮肤突变体富士福音_M是从江苏省市江苏省市石岛市的标准果园实践下的苹果园获得。富士苹果是商业上可获得的栽培品种,并从日本收集。在嫁接期间,这种芽运动突变体的表型本身就出现,我们已获得果园许可来收集样本,并根据国家准则进行进一步的研究。正常分支和芽斑上的鲜花都被授粉。粉授粉(30 dap)后生长幼栗30天,然后用棕色袋(尺寸:13×16cm)覆盖。在收获之前除去袋子(150个DAP),并收集样品六个时间点:0,4,8,12,16,20,24天,袋式去除(DABR)24天进行用于花青素含量分析,最终选择16个DABR蛋白质组研究。每次点储存并用六个生物重复测量。
花青素内容分析
根据先前的常见方法进行测量[55那56].简单地说,收集大约0.5 g苹果皮,在室温下,加入10 mL含1%盐酸的甲醇溶液,在黑暗中提取2 h。用分光光度计分别在530 nm和600 nm处测定花色苷含量。根据公式计算相对花青素含量Q: Q = OD530nm-OD600nm,为方便起见,以每0.01为花青素含量单位。利用ABI2000-QTrap质谱仪(Applied Biosystems)对苹果中不同类型的花青素进行检测。根据上述方法提取植物总花青素。样品中花青素的组成通过ABI2000-QTrap的HPLC-MS/MS分析,详细步骤见57].简要地,用95%溶剂A(水中0.1%甲酸)和5%溶剂B(0.1%甲酸)和5%溶剂B捕获核苷100-5c18柱(5μm,150×2mm,安静技术)捕获核血管捕获和过滤的样品(20μl)。(乙腈中的0.1%甲酸),然后以0.2mL / min的流速以15-60%B的梯度分离。最终的LC洗脱产物由在线ABI2000-QTRAP质谱仪(MRM)模式下的在线ABI2000-QTRAP质谱仪(施用生物系统)测定(阳性电离,扫描范围:200-1200m / z)。
蛋白质提取及多肽制备
将大约1克苹果皮用液氮在研钵中磨成粉末。样品用预冰10X vol的溶液A(10%三氯乙酸(TCA)/丙酮)均质,然后在16000 g离心5分钟。去除上清液后,用10X vol的B溶液(80%甲醇/0.1 M NH)清洗微球4.OAC)然后再次离心,然后将10倍的洗涤溶液C(冷却为80%丙酮)。通过将上清液离心除去,将粒料溶解在8ml SDT缓冲液中(4%SDS,0.1M DTT,0.1MMOP / Cl,pH8.0)。此后,将溶解的样品在95℃下温育10分钟并立即在冰上冷却5分钟。再次离心两次后,在-20℃下通过4倍体积的80%丙酮获得80%丙酮的最终上清液。最后,将粒料溶解到1-2ml溶液缓冲液中(6M尿布中的200mM摩托-C1 / 4mM CaCl2那P.H 8.0) according to the size of pellet. The protein concentration was determined based on the Bradford method (Bradford Protein Assay, Bio-Rad).
每个样品中的100 μg蛋白在50℃下用10 mM DTT还原40分钟,然后在室温下用40 mM IAA(碘乙酰胺)烷基化30分钟。随后,每个样品用蒸馏水进一步稀释,使尿素浓度降低到2 M以下,并在37°C过夜,通过胰酶消化(酶/蛋白,1:50 w/w)获得样品肽。经10%三氟乙酸(TFA)酸化后的多肽用SepPak C18 cartridge (Waters)进一步脱盐。此外,过滤后的多肽样品在真空浓缩器中快速干燥,并直接溶解到0.1%甲酸水溶液中进行质谱分析。
SWATH-MS数据分析
质谱分析采用三重TOF 5600质谱(AB Sciex)与Eksigent NanoLC-2D plus系统耦合。肽(2μg)被困在一个nanoFlexcHiPLC列(3μm, ChromXP C18CL, 120, 0.5毫米×200μm)在95%的缓冲区(水和0.1%甲酸)和5%缓冲B(甲酸乙腈与0.1%),其次是通过120 - min梯度分离从5到35%的缓冲B在一个稳定的300 nL /分钟的流量。采用三重TOF 5600质谱仪,在离子喷射电压为2300v的正离子模式下进行全扫描质谱。首先采用数据依赖采集(DDA)模式构建参考光谱库。在350 ~ 1250 (m/z)范围内,通过250 ms的全扫描收集MS1的全部光谱,其中选择前40个前体离子进行ms / ms破碎(m/z 100 ~ 1800)。在SWATH采集模式下,使用类似的色谱参数作为上述DDA模式。在400-1250 Da范围内创建了一组50个重叠窗口,用于通过循环DIA(数据独立采集)模式进一步破碎MS2。随后,利用ProteinPilot 4.5 (AB Sciex)软件对Phytozme-进行DDA质谱分析Malus Domestica.v 1.0蛋白质数据库(63,517蛋白条目,2019年6月;https://phytozome.jgi.doe.gov/pz/portal.html).在数据库搜索过程中建立了消化、烷基化、生物修饰和ID搜索等参数,并将错误发现率(FDR) < 1%用于蛋白质鉴定和多肽分配的标准选择。随后,将所有DIA原始文件和参考库加载到PeakView v.1.2 (AB Sciex)软件中,使用限制参数,如8个肽段,6个过渡段,肽信度> 99%和XIC宽度(50 ppm)。处理后的mrkvw文件随后被加载到markview (AB Sciex)中,通过其峰值区域的蛋白质强度标准化进行进一步量化分析,如[58那59].Fuji_apple和FUJI_M之间的蛋白质差异表达以比例为> 1.5或<0.67P.值< 0.05分别为上调或下调。所有原始数据文件已提交至PRIDE proteomicsidentitions (PRIDE)数据库,登录号为PXD011132。
蛋白质组学数据分析
基因本体(GO)分析(http://geneontology.org/)基因和基因组的京都百科全书(Kegg;http://www.kegg.使用DEPS数据集进行JP /)富集分类。
可用性数据和材料
数据集包含在文章及其附加文件中。
缩写
- Chi:
-
查尔酮异构酶
- CHS:
-
查耳酮合酶
- DABR:
-
取袋后将果实置于正常阳光下照射
- DAP:
-
授粉后的几天
- DEPs:
-
差异表达的蛋白质
- DFR:
-
二氢烷醇-4-还原酶
- 直径:
-
数据无关的收获
- F3H:
-
黄烷酮-3β-羟化酶
- FDR:
-
假发现率
- 读者:
-
黄酮醇合成酶
- 去:
-
基因本体论
- 热休克:
-
热休克蛋白
- IAA:
-
碘乙酰胺
- LHC:
-
光收获叶绿素
- MAPK4:
-
丝裂原激活蛋白激酶4
- MDH:
-
苹果酸脱氢酶
- 议员:
-
Methylerythritol 4-phosphate
- MVA:
-
甲戊酸酸
- MVK:
-
甲戊二醇酯激酶
- PSI:
-
照相我
- SAMMTases:
-
S-腺苷-1-甲硫氨酸依赖性甲基转移酶
- SRG:
-
剪接相关基因
- SWATH-MS:
-
所有理论谱-质谱的顺序窗口获取
- TFA:
-
三氟乙酸
参考文献
- 1。
马可汗,奥尔森,索维罗,库沙德,科尔班。果实品质性状在苹果驯化中起着关键作用。植物基因组。2014;7 (3):doi:https://doi.org/10.3835/plantgenome2014.04.0018.
- 2.
Marondedze C,Thomas La。Apple Hypanthium坚定。比较蛋白质组学的新见解。Appl Biochem Biotech。2012; 168(2):306-26。
- 3.
等。花青素生物合成基因在苹果皮的红色着色过程中协调表达。植物生理学报。2002;40(11):955-62。
- 4.
Koes R,VERWEIJ W,Quattrocchio F.黄酮类化合物:生化途径的监管和发展丰富多彩的模型。趋势植物SCI。2005; 10(5):236-42。
- 5.
兰开斯特·杰,杜格尔·DK。苹果果皮颜色的调节。植物科学进展,1992;10(6):487-502。
- 6.
苹果酚类化合物的生物合成及其调控。植物生长规律。2001;34(1):71-89。
- 7.
Lister CE,兰开斯特JE,Walker Jrl。黄绿色苹果品种皮肤生物合成酶的发育变化。科学生植物耕作。2015; 71(3):313-20。
- 8。
刘艳,张旭,赵志。果实套袋对‘青史密斯’和‘金味’果实成熟过程中花色苷、糖、有机酸及颜色特性的影响。食品科学。2013;236(2):329-39。
- 9。
王H,Araakawa O,Motomura Y.成熟和装袋对'Jonathan'苹果中的花青素积累和苯丙氨酸氨酶(PAL)活性的影响。Postharvest Biol Tec。2000; 19(2):123-8。
- 10.
Kano M,Takayanagi T,Harada K,Makino K,Ishikawa F.紫色甘薯的花青素抗氧化活性,Ipomoera Batatas Frymara Ayamurasaki。JAgric Chem Soc Japan。2005; 69(5):979-88。
- 11.
苏田等。紫肉红薯花色苷的生理功能及其在食品中的利用。中国海洋大学学报(自然科学版);2003;37(3):167-73。
- 12.
El-Sharkawy I,Liang D,Xu K.苹果(Malus×Diversa)黄果体突变的转录组分析鉴定了与花青素和表观遗传调节高度相关的基因网络模块。J Exp Bot。2015; 66(22):7359-76。
- 13.
Gallardo K,Firnhaber C,Zuber H,牧师D,Belghazi M,Henry C等人。Medicago Truncatula种子的组合蛋白质组和转录分析。Mol细胞蛋白质组学。2015; 6(12):2165。
- 14.
朱财,陈MX,陈WL,阳楼,田Y,宋T,等人。SWATH-MS定量拟南芥中的氮饥饿的蛋白质组研究揭示了植物氮胁迫响应新的方面。J蛋白质组学。2018年。
- 15.
朱凤英,陈明明,苏永文,徐旭,叶宁华,曹云云,等。水稻籽粒灌浆过程中劣穗和优穗蛋白质的swat - ms定量分析。植物科学学报。2016;7(e0125934):1926。
- 16.
李胜,曹强,肖伟,郭勇,杨勇,段旭,等。所有理论碎片离子质谱序列窗口采集改进蛋白质组定量的采集和数据处理参数的优化。蛋白质组学杂志2017;16(2):738-47。
- 17.
染色我们的水果的MYB转录因子。植物学报,2008;13(3):99-102。
- 18。
Romo-Chacón A, Orozco-Avitia JA, Gardea AA, Guerrero-Prieto V, Soto-Parra JM。冰雹对红星苹果树光合速率和果实颜色发育的净影响。acta photonica sinica, 2007;61(4): 174-8。
- 19。
Schaart Jg,Dubos C,Romero DLFI,Van Houwelingen Am,De Vos Rc,Jonker Hh等人。用草莓(Fragaria×Ananassa)果实鉴定与表征MyB-BHLH-WD40监管综合体的调控复合物。新植物。2013; 197(2):454-67。
- 20.
姚鹏,赵华,罗晓峰,李春华,等。Fagopyrum tataricum FtWD40是转基因烟草花青素合成的正调节因子。植物生长规律。2017;36(3):755-65。
- 21.
安晓霞,田颖,陈科,王旭东,郝玉英。苹果WD40蛋白MdTTG1与bHLH相互作用,调控花青素的积累。植物生理学杂志。2012;169(7):710-7。
- 22.
刘艳,侯华,姜旭,王鹏,戴旭,陈伟,等。茶树WD40重复蛋白通过MYB-bHLH-WD40三系配合物的形成调控花青素和原花青素的积累。中华医学杂志。2018;19(6):1686。
- 23。
秀红A,易T,Ke-Qin C,Xiao-Fei W,Yu-Jin H.苹果WD40蛋白MDTTG1与BHLH相互作用,而不是MYB蛋白来调节花青素积累。植物生理学杂志。2012;169(7):710-7。
- 24。
拟南芥的热驯化与耐缺氧性研究。植物学报。2010;31(7):1029-37。
- 25.
鲍伊VL,卡巴科夫AE。热休克蛋白水平赋予糖耐量上升到能源匮乏。费用。1993; 327(3):247-50。
- 26.
Downs CA, Heckathorn SA。线粒体热休克小蛋白在植物热应激过程中保护电子传递链上的NADH:泛素氧化还原酶。2月。1998;430(3):246。
- 27.
Lüders J, Demand J, Höhfeld J.泛素相关BAG-1提供了分子伴侣Hsc70/Hsp70与蛋白酶体之间的连接。中国生物化学杂志。2000;275(7):4613。
- 28.
Ryhänen T, Hyttinen JMT, Kopitz J, Rilla K, Kuusisto E, Mannermaa E, et al.;人视网膜色素上皮细胞自噬介导蛋白水解中Hsp70分子伴侣、溶酶体和蛋白酶体之间的串扰。Acta角膜切削。2009;13 (9 b): 3616 - 31所示。
- 29.
s腺苷-蛋氨酸依赖性甲基转移酶:生物催化、生物合成和其他生物技术应用中的高度通用酶。Chembiochem。2012;13(18):2642 - 55。
- 30.
Squarzoni P,Parveen F,Zanetti L,Ristoratore F,Spagnuolo A. FGF / MAPK / ETS信号呈颜料细胞前体通过直接控制CI-TCF转录来响应WNT信号。发展。2011; 138(7):1421-32。
- 31.
Gutiérrez-Venegas G,Jiménez-estradaM,Maldonado S.类黄酮类化合物对脂多糖处理的人牙龈成纤维细胞转导机制的影响。int免疫药物。2007; 7(9):1199-210。
- 32.
镉对人滋养细胞MAPK信号通路和HSP70表达的影响。胎盘。2008;29(8):725 - 33所示。
- 33.
Purido P,Perello C,Rodriguezconcepcion M.新见解植物等异戊二烯代谢。莫尔植物。2012; 5(5):964-7。
- 34.
梅耶尔,泰勒NL,米勒AH。利用凝胶电泳三维分析和鉴定植物线粒体呼吸复合物的蛋白质组分。蛋白质组学杂志2008;7(2):786-94。
- 35。
谭YF,奥图尔N,泰勒NL,米勒啊。在植物线粒体二价金属离子和它们在与蛋白质和呼吸功能的氧化应激诱导的损伤的相互作用的作用。植物理性。2010; 152(2):747-61。
- 36。
赵伟,杨旭,于海,姜伟,孙宁,刘旭,等。基于rna - seq的黄瓜幼苗早期氮缺乏反应的转录组分析为氮调控网络提供了新的见解。植物生理学。2014;pcu172。
- 37.
陈志强,陈志强,陈志强,等。拟南芥的初级和二级代谢、蛋白质合成、细胞生长过程和对氮的响应的调控基础的全基因组重编程。植物杂志。2004;136(1):2483 - 99。
- 38.
Galvez Jh,Tai Hh,LAGUE M,Zebarth BJ,Stromvik MV。马铃薯的氮响应转录组(Solanum Tuberosum.L.)揭示了重要的基因调控基序。Sci众议员2016;6:26090。
- 39.
他x,ma h,zhao x,nie s,li y,zhang z等。比较RNA-SEQ分析表明,玉米根部发育的调节网络控制基因的表达响应N应激。Plos一个。2016; 11(3):E0151697。
- 40。
Kim Jy,Kwak Kj,Oh Sh,Han Ys,Kang H.富含甘氨酸富含RNA结合蛋白在冷适应过程中拟南芥和Oryza Sativa在功能上保守。J Exp Bot。2010; 61(9):2317-25。
- 41.
邓旭,卢涛,王磊,孙军,孔旭,等。19复合体的募集到活化的剪接体需要AtPRMT5。中国科学院院刊2016;113(19):5447-52。
- 42.
朱凤英,陈明明,叶宁华,石磊,马昆,杨建峰,等。蛋白质基因组分析揭示了拟南芥幼苗对脱落酸反应的选择性剪接和翻译。植物j . 2017; 91(3): 518 - 33所示。
- 43.
曹爽,李军,宋爽,冉娟,徐刚。AtGRP7基因参与拟南芥脱落酸的调控和胁迫响应。细胞生物学杂志。2006;11(4):526-35。
- 44.
Ciuzan O,Hancock J,Pamfil D,Wilson I,Ladomery M.演化保守的多功能甘氨酸富含RNA结合蛋白在开发和应力适应方面发挥关键作用。physiol platararum。2014; 153(1):1。
- 45.
Kwak Kj,Kim Yh。高盐度,脱水或冷应力下过表达GR-RBP4转基因拟南芥植物的表征。J Exp Bot。2005; 56(421):3007-16。
- 46.
Staier D.RNA结合蛋白和拟计拟南芥的昼夜节律。Philos Trans R SoC Lond Ser B Biol Sci。2001; 356(1415):1755-9。
- 47。
Schmidt F,Marnef A,Cheung M,Wilson ID,Hancock JT,Staiger D等人。含氧化胁迫诱导的拟南芥植物植物植物植物ATGRP7和ATGRP8的氧化胁迫诱导的拟南芥αARNA的寡核苷酸(DT)-命令MRNP蛋白质组学分析。MOL BIOL REP。2010; 37(2):839-45。
- 48。
Lorkoviä‡ZJ,Wieczorek Kirk Da,Klahre U,Hemmings-Mieszczak M,Filipowicz W.RBP45和RBP47,两种寡核苷酸特异性HNRNP样蛋白与植物细胞核中的聚(A)+ RNA相互作用。RNA。2000; 6(11):1610-24。
- 49.
Palanivelu R, Belostotsky DA, Meagher RB。拟南芥(Arabidopsis thaliana) poly (a) binding protein 2 (PAB2)在酵母翻译和mRNA衰变过程中的作用。植物j . 2010; 22(3): 187 - 98。
- 50。
吴文伟,王刚,Baek SJ, Shen R. DIGE、cICAT和iTRAQ三种蛋白质组学定量方法的比较研究。蛋白质组学杂志2006;5(3):651-8。
- 51。
朱财,陈WL,陈MX,香港RP,蔡C,王琪,等。SWATH-MS定量蛋白组学调查揭示了茉莉酸在拟南芥属前导响应期间的作用。J蛋白质组。2016; 15(10):3528。
- 52。
Komor MA,Hiemstra交流,范电视,Piersma SR,Sebra RP,韩BW等。可变剪接的Proteogenomic分析:探索用于结肠直肠癌的生物标志物的新。癌症res。2016; 76(14增刊):848。
- 53.
库马尔d,达夫AK,贾X,MulvennaĴ,使用工作流proteogenomic提炼大鼠基因组注释短跑D.集成转录-蛋白质组学分析。Mol细胞蛋白质组学。2016; 15(1):329-39。
- 54.
Walker Ar,Lee E,Robinson SP。两种新的葡萄品种,赤霞珠芽体育呈苍白的浆果,是删除浆果颜色基因座的两种监管基因的结果。植物mol biol。2006; 62:623-35。
- 55.
Mullins Mg。用蔗糖,硝酸盐和脱落酸处理的葡萄叶和水果组织的花青素和酚醛含量的变化。植物理性。1976年; 58(4):468-72。
- 56.
徐y,冯思,娇q,刘c,张w,陈俊。MADMYB1序列MADMYB1序列的比较,雄性植物在Malus Domestica Borkh之间的调控基因的表达。品种的“团队”及其腮红运动。Euphytica。2012; 185(2):157-70。
- 57.
雷震,徐勇,岳军,王军,岳勇,杨勇,等。修剪花丛对‘Houman’葡萄花色苷水平及花色苷相关基因表达的影响Hortic杂志2016;3:16037。
- 58.
Haverland Na,Fox Hs,Ciborowski P.Swath-MS的定量蛋白质组学显示出在HIV-1感染巨噬细胞中的核酸结合和调节蛋白的改变表达。J蛋白质组。2014; 13(4):2109-19。
- 59。
chadle C, Vawter MP, Freed WJ, Becker KG。利用Z分数变换分析微阵列数据。中华医学杂志。2003;5(2):73-81。
资金
该工作得到了中国国家自然科学基金(NSFC31701341),NJFU项目资金(GXL2018005),中国博士后科学基金会(2017 M62280)和广东省自然科学基金(2018A030313030)。
作者信息
从属关系
贡献
CMX和SC设计并进行实验,ZKL, SYC, TY, CX, LYG, YNH分析数据,ZFY和ZJH起草并修改手稿,ZFY和QSC构思项目。所有作者审查了结果,修改了手稿并批准了最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
用SWATH-MS量化的1470个独特蛋白质的蛋白质报告。(XLSX 538 KB)
附加文件2:表S2。
分类分析后差异表达蛋白质清单。折叠变化> 1.5(增加)或<0.67(减少)的蛋白质被视为DEPS(P.值<0.05)。(XLSX 125 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
陈,MX。那Sun, C., Zhang, KL.等等。富士苹果与红皮芽体育突变体果皮的果皮促进蛋白质组学曲线。BMC植物杂志19,445(2019)。https://doi.org/10.1186/s12870-019-2018-1
收到了:
公认:
发表:
关键词
- 芽的运动
- 皮肤的颜色
- Swath-Ms.
- 转录后调控