抽象的
背景
Pyropia haitanensis.,分布在潮间区,可以耐受超过90%的水损失。但是,机制能够实现p . haitanensis生存苛刻的条件保持不协调。阐明基础的机制p . haitanensis干燥耐受性,我们完成了转录组和蛋白质组的综合分析以及转基因莱茵衣藻拿着一个p . haitanensis基因。
结果
p . haitanensis快速调整其生理活性,以补偿高达60%的水损失,之后,激活光合作用,抗氧化系统,伴侣和细胞骨架以反应严重的干燥应激。整合分析表明,转铁糖蛋白酶(TKL)受到所有干燥处理的影响。转基因C. Reinhardtii.细胞过表达PhTKL比野生型细胞在渗透胁迫下生长更好。
结论
p . haitanensis迅速建立甲状腺系统稳态,了解其转录组和蛋白质组,以确保其在再水化后其Thalli可以恢复。此外,PhTKL这对我们来说至关重要p . haitanensis干燥耐受性。目前的数据可以为藻类和植物的繁殖提供具有增强的干燥耐受性的新见解。
背景
Pyropia物种是商业有价值的海洋红藻类,在东亚几个世纪以来,包括日本,韩国和中国1].年产量Pyropia物种(其中许多以前Porphyra.物种目前的价值近9.5亿美元,在所有水产养殖海藻物种中,每单位质量的商业价值最高(近523美元)[2]. 这些物种被广泛用作食物、肥料、药物和化学品的来源[1].凯洛格和莱拉(2013)报告了这一点Pyropia物种的提取物在体外抑制系统的氧自由基的生成,这表明如果它们掺入饮食,它们可能对许多的氧化损伤有关的病症的有益作用(例如肥胖症和心血管疾病)3.].Pyropia物种也可能有助于生产“蓝色碳”的和代表生物燃料的一种潜在的有用来源。人工接种和浮动培养法的开发的扩张已大大提高了养殖和加工的Pyropia这代表了最大的水产养殖业之一。Pyropia haitanensis.原本在中国福建省确定的,是一个典型的温带温带区,它占总生产的75%Pyropia中国种[4.].
Pyropia物种在潮间区生长,在那里他们因潮汐周期而遇到几种非生物因素的波动。在低潮,p . haitanensis暴露在空气中,导致80-95%的水分流失[1].Pyropia物种已经进化了各种策略和机制,以承受这种干燥应激条件。因此,在过去50年中,人工增加干燥时间已被广泛用于消除野生藻类和病原菌,从而提高生产Pyropia种类(图。1). 使潮间带大型藻类能够在恶劣条件下生存的基本策略尚未完全确定。对耐旱机制的研究主要集中在活性氧(ROS)的作用和对光合速率的变化上。在里面p . haitanensis,抗氧化酶积累以响应干燥条件产生的清除RO [5.].对许多潮间带大型藻类的研究表明,降低光合作用效率是减少ROS产生的另一种方法[6.]. 此外,渗透溶质的积累是对干燥胁迫反应的一个重要部分。例如,植物体内的花苷浓度p . haitanensis据报道,由脱水造成的损害增加保护细胞[7.].但是,允许的保护机制Pyropia适应干燥条件尚未完全阐明。
“组学”技术的最新进展使得能够以高通量的方式对生物分子的丰度进行定量分析,从而有可能阐明潮间带海藻耐干燥的机制[8.].由于缺乏基因组信息,转录组学和蛋白质组学分析近年来被广泛应用于研究Pyropia种类[9.那10.那11.].Wang et al.(2015)分析了转录组p . haitanensis暴露于干燥胁迫下,鉴定出1500多个差异表达的单基因(DEG)。此外,一些代谢途径被确定参与脱水反应,如海藻糖生物合成、凋亡诱导、卟啉和叶绿素代谢[12.].在一项研究中Pyropia orbicularis.结果表明,129个蛋白受干旱胁迫影响,经生物信息学分析鉴定出56个蛋白。这些被鉴定的蛋白质在功能上被分类为与能量和生物分子代谢、抗氧化和防御功能以及其他相关的蛋白[13.].Xu等(2016)鉴定了100个差异表达蛋白(DEPs)p . haitanensis在干燥条件下,主要与光合作用和能量代谢有关[14.].但是,这两项调查了干燥的耐受性p .轮匝肌和p . haitanensis基于二维电泳(2-DE)进行。2-de的缺点包括相对有限的覆盖范围和不准确的蛋白质定量的可能性。为了克服基于凝胶的技术的一些局限性,最近已经申请了相对和绝对定量(ITRAQ)的阻碍标签进行研究Pyropia物种,从而提高吞吐量并增加蛋白质组学研究的敏感性[15.].
政府的回应Pyropia对于干燥条件的物种不仅受到干燥响应基因或蛋白质的影响,而且是通过基因和蛋白质之间的相互作用影响。转录组和蛋白质组之间的关系尚未表征p . haitanensis暴露在干燥压力下。因此,在生物学研究中整合转录组学和蛋白质组学方法是有必要的,因为可以产生互补的数据,使更全面的分子表征。然而,基因功能通常是根据BLAST搜索来预测的。尽管之前的研究已经检验了转化Pyropia它们涉及到瞬时转化和不稳定的藻类[16.那17.].莱茵衣藻最近被描述为一个很好的向量,用于功能验证Pyropia物种基因[16.那17.].因此,在本研究中,我们使用过C. Reinhardtii.全面调查p . haitanensis干燥耐受性。本研究的主要目的是鉴定这种跨藻类物种适应干燥应激的重要基因/蛋白或途径。
结果
主成分分析Pyropia haitanensis.转录组和蛋白质组学数据
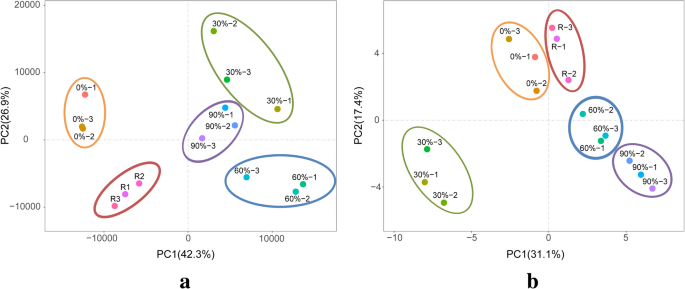
关于从头转录组组装和功能注释的详细信息在附加文件中提供1:表S3。为了评估转录组数据之间的相关性,每处理三次重复进行主要成分分析(PCA)(图。2一种)。转录组数据对于每次治疗三次重复相似。此外,不同的处理产生了不同的结果,表明基因表达水平在长时间暴露于干燥应激期间变化。此外,ITRAQ的所有蛋白质组学分析p . haitanensis样品导致149,413个光谱。在消除低得分光谱之后,符合鉴定标识的严格置信标准的30,726个独特的光谱与2676个独特的蛋白质匹配。蛋白质组学数据的PCA产生与转录组数据类似的结果(图。2b)。
差异表达基因和蛋白质的表达谱
与对照组(0%)相比,在干燥治疗中升级或下调的unigenes(0%)(日志2|倍数变化| ≥ 1 and false discovery rate ≤ 0.001) were determined as DEGs. In response to the 30, 60, and 90% desiccation and rehydration treatments, 276, 794, 526, and 543 unigenes exhibited up-regulated expression, respectively, whereas 287, 628, 519, and 730 unigenes exhibited down-regulated expression, respectively (Fig.3.一种)。在60和0%(对照)干燥处理之间的比较中检测到最大数量的DEGS(1422)。在各种干燥应力和再水合处理下的DEGS的AA VENN图分析(图。3.b)揭示了不同的基因对不同的干燥条件响应,相对于对照水平响应于所有治疗,267个基因差异表达。在脱盐条件下的一个或多个时间点鉴定了总共303的DEP,其代表了所有鉴定的蛋白质的11.32%。DEP的数量通常随着干燥水平而增加,但在2-H再水合步骤后降低。响应于30,60和90%的干燥和再水化处理,分别为36,83,114和17个蛋白质的丰度分别增加,分别增加了14,60,77和9个蛋白质(图。3.C)。还进行VENN图分析,揭示了不同的蛋白质对不同的处理。另外,响应于所有处理,只有一种蛋白质差异表达(图。3.d)。不幸的是,该蛋白质在功能上没有注释。
差异表达基因和蛋白质的功能分析
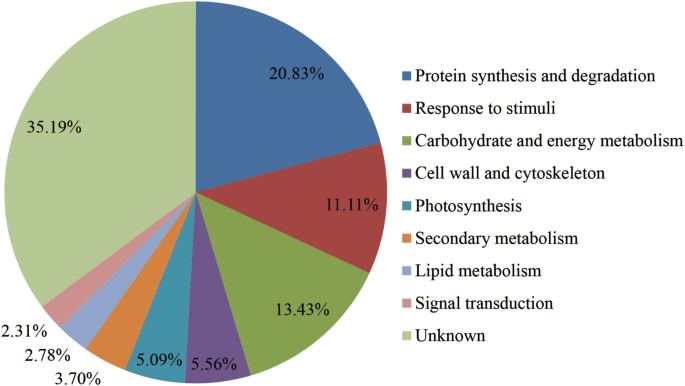
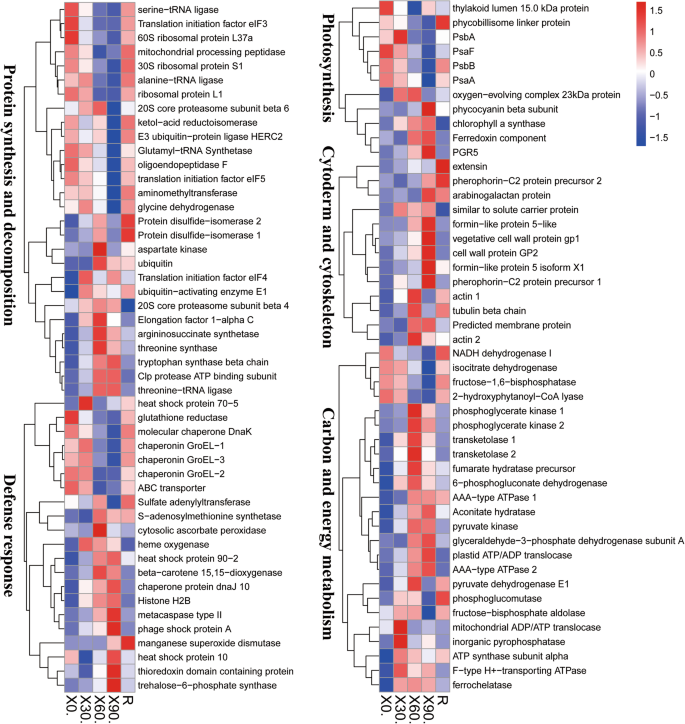
获得如何概述p . haitanensis回应干燥应激,我们总结了根据其推定的生物学功能的基因表达水平的变化。一些重要的Deg在附加文件中列出1:表S4,包括与光合作用,蛋白质合成和降解的那些,对刺激,细胞壁和细胞骨架的反应,以及能量和碳水化合物代谢。DEPS的功能分类(图。4.)表明,大多数(所有DEPS的80.56%)属于以下四类中的一种:蛋白质合成和降解(20.83%),碳水化合物和能量代谢(13.43%),对刺激的反应(11.11%)和假设或假设或假设或假设或未知(35.19%)。DEPS的其他类别是细胞壁和细胞骨架(5.56%),光合作用(5.09%),次生代谢(3.70%),脂质代谢(2.78%)和信号转导(2.31%)。分层聚类分析在以下主要类别中响应干燥应力和再水化而分组DEPS:蛋白质合成和降解,碳水化合物和能量代谢,对刺激,细胞壁和细胞骨架的反应和光合作用(图。5.).
核查差异表达基因和蛋白质
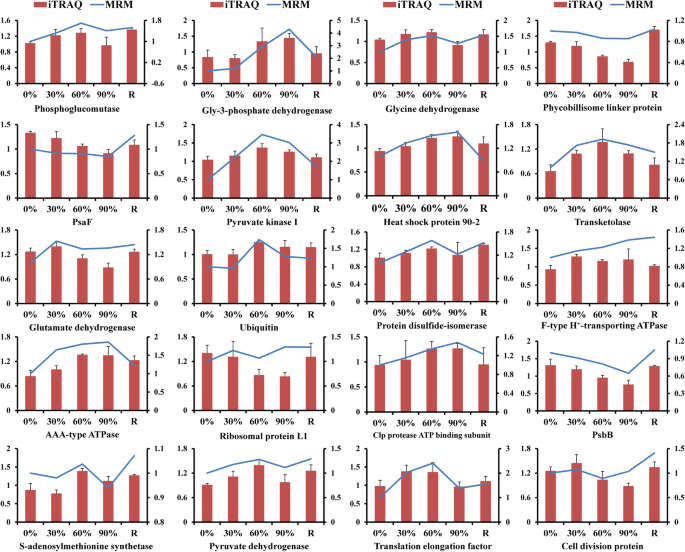
通过QRT-PCR测定评估RNA-SEQ数据的可靠性,其中设计了基因特异性引物用于18个随机选择的基因。基于QRT-PCR测定的转录物丰富与RNA-SEQ数据露出的转录物曲线之间存在良好的相关性(附加文件1:图S1)。共选择总,30ACE以建立MRM方法,该方法是为20瓦斯开发的。基于来自额外MRM分析的定量数据的表达式模式与ITRAQ数据确定的表达式模式基本相关(图。6.),暗示ITRAQ结果是可靠的。
转录组和蛋白质组数据的综合分析
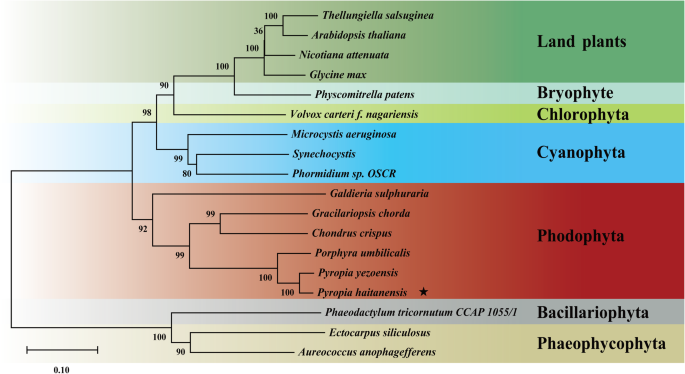
使用日志的散点图分析相应mRNA的分布:蛋白质比率2- 转化比率。大多数mRNA:浓缩蛋白质比率在图(象限5)的中心,其中mRNA和蛋白质水平分别不会分别变化超过1.2-和2倍(附加文件1:图S2)。在216个确定的DEP中,只有48个在RNA-seq数据中具有相应的DEG,这些DEG在象限1、3、7和9中检测到。随后的分析用象限3和7中的红色散点图完成,这表明DEG和相应的DEP之间的表达水平变化是一致的。共鉴定出26个DEG(表1)1).此外,上调的DEGs与特定的活性(如戊糖磷酸途径、清除ROS、肌醇代谢、卡尔文循环、光合电子传递、糖酵解和细胞壁修饰)有关。而下调的DEGs则与分子伴侣、蛋白质加工和光合作用有关。在30、60和90%的干燥条件下,转酮醇酶基因和编码蛋白均上调(表1)1).系统发育树支持姐妹组之间的关系p . haitanensis和其他牙龈细胞物种,但暗示了Pyropia从蓝藻门、绿藻门、褐藻门和陆生植物中分离出来的物种。7.).
PhTKL增强转基因的渗透耐受性莱茵衣藻
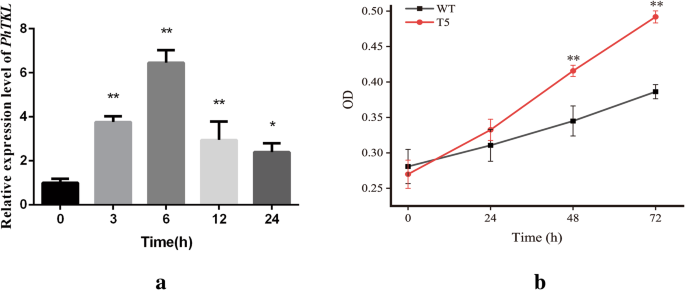
假定的C. Reinhardtii.利用PCR方法检测对潮霉素耐药的转化子PhTKL- 特异性底漆(附加文件1:表S2)。所有随机选择的抗湿黴素株系均得到了预期的PCR产物,但野生型株系未得到预期的PCR产物,验证了两者的整合PhTKL进入抗潮霉素抗性线的基因组(附加文件1:图S3)。第一转基因素(T1)进行转录和形态学分析以评估其渗透耐受性。具体而言,完成qRT PCR分析以确定PhTKL渗透胁迫诱导的表达水平。PhTKL在渗透胁迫下表达上调,在处理6 h时达到峰值(图)。8.一种)。在功能特征分析PhTKL那C. Reinhardtii.细胞过表达PhTKL在含有200mM甘露醇200mM的抽头培养基中培养。野生型和转化C. Reinhardtii.细胞最初同样地增长,但在2天后转基因细胞的生长速率明显更大(图。8.b)。
讨论
在这项研究中,我们发现,p . haitanensis在减少60%的细胞水之前,迅速调节其生理活性。长期暴露于干燥条件刺激一系列保护反应,但是p . haitanensis也可在其转录组和蛋白质组中快速建立适应稳态,以确保浸泡在海水中后的恢复。我们鉴定了2283个DEG和303个DEP,但只有26个DEG表现出与相应DEP丰度变化一致的表达水平变化。转录组学和蛋白质组学数据之间的相关性差可能是由于干燥条件下的转录后调节活动。这些发现强调了在转录和翻译水平上研究分子过程的必要性。这种综合分析揭示了一组应激诱导基因/蛋白质,但也揭示了与应激相关的分子机制p . haitanensis干燥耐受性。
光合作用
光的吸收是光合作用的初始步骤。藻胆体,它由藻胆蛋白(的PBPs)和接头多肽,是主要的捕光络合物在Pyropia种类[15.].在其光谱性质和颜料组合物的基础上,PBP可分为三个主要基团,即浮藻,植物植物和联苯硅蛋白。除了与PBP相关的基因的上调外,我们还观察到植入植物植物的产生升高p . haitanensis暴露于干燥应力(表1,无花果。5.). 这一现象在中国也被观察到p .轮匝肌,这是沿智利海岸的岩石上潮间带分布[13.].转录组和蛋白质组的综合分析显示了与光合作用有关的下调的次数或DEPS(表1).PBPs丰度的增加可能会捕获光能并进一步减少ROS的产生。在这项研究中PSBA.那PSBB.,及PsaA转录物和编码的蛋白质水平在温和的干燥条件下(30%的水损失)保持并在中间干燥条件下降低(60%的水损失),但随后可以恢复到原始水平(图。5.).获得类似的结果进行检查p . haitanensis光合参数表明,当水损失超过60%时,强烈抑制了光化系统II(PSII)的最大和有效的光化学量子产量;但是,在没有干燥应激的情况下,它们分别恢复到其原始水平的79%和60%[14.].因此,p . haitanensis可能已经进化以适应周期性脱水和再水化循环。
光合仪的物理性质对耐旱植物很重要。光合成分非常敏感,易于损坏,并且在再水合后必须快速维护或修复。为防止蓄能的PSII积累,修复过程包括氧化机械的组装[18.]. 在本研究中,一个23kD的放氧复合蛋白在中度干燥胁迫下上调(图。5.).它具有稳定Mn的功能4.曹4.集群(19.].干燥应力通常会破坏PS II的析氧复合物[20.那21.]. 相比之下,在目前的研究中,它在脱水食品中的含量PyropiaThalli可能有助于在适度的干燥条件下维持氧不变复合物的结构,这可能会影响Pyropia物种对干燥压力的反应。另外,对PS II和PS的反应中心的能量转移导致电子转移到富勒沙昔林,然后减少NADP+致NADPH。NADP+PS I中是电子的主要受体[22.].在目前的研究中,铁还蛋白在严重干燥胁迫下上调(图。5.),表明其可能具有促进NADP减少的作用+对于NADPH,从PSI减少电子传输到分子氧,抑制ROS生产[22.].NADPH的积累p . haitanensis为P700+提供电子,并在严重脱水条件下(84%的水分损失)通过PSI驱动循环电子流,在复水过程中恢复,而PS II活性在76%的水分损失时被消除[23.].这表明在严重干燥条件下在线性电子流动后,PSI周围的循环电子流仍然活跃。同样,PS I驱动的干燥循环电子流量P. yezoensis.在重新水合时,Thalli在87%的水分损失可以迅速恢复,这比PS II速度更快[24.].此外,已经提出了质子梯度调节5(PGR5)以通过Ferredoxin介导的循环电子流介导电子传递[25.].PGR5电子转移的依赖性调节和质子动力对于保护PS I对抗光电二极管是显着的[26.].成熟的拟南芥过表达PGR5比野生型更好地在高光和干燥应力下存活地暴露[27.].在这里,我们也发现,PGR5基因编码的蛋白质严重脱水状态(图中被上调。5.桌子1).这些结果表明,PS I周围的循环电子流可能在响应脱水和复水中发挥重要的生理作用,并可能是一个重要的因素Pyropia适应跨境环境。
细胞壁和细胞骨架
细胞壁修改对于植物适应环境应力是重要的[28.].在Ulva Compressa.细胞壁结构变化提供了在周期性干燥复合循环期间的机械损伤的保护,从而使该物种能够适应潮间区[29.].Herburger等人。(2019)报道说,Zygnema灯丝细胞壁中果胶同源肌酐的积累导致了干燥耐受性增加[30.].在干燥条件下,p . haitanensis细胞收缩,类似于除去对其他藻类细胞的影响[7.].我们的数据还揭示了与细胞壁修饰相关的糖蛋白的丰富量增加(即,克临床,Pherophorin-C2蛋白,阿拉伯半乳蛋白和细胞壁蛋白)(图。5.). 盐胁迫可导致大鼠肠扩张素水平升高p . haitanensis,增强保水性[31.].这些变化可能会增加细胞壁的灵活性和帮助p . haitanensis适应环境条件。通过干燥诱导膜蛋白的产生(图。5.). 作为受体样激酶发挥作用的膜蛋白被认为可以感知细胞外空间的变化,并将其信号传递到细胞中[32.]. 许多编码受体样激酶的基因的表达水平是由非生物胁迫诱导的,因此放大了必要的胁迫适应性反应的信号,包括维持细胞壁的完整性[33.].这些结果突出显示了使能的细胞壁变化p . haitanensis适应干燥条件。
细胞骨架是一种高度动态的细胞组分,主要包含微管和肌动蛋白长丝。当受非生物应激时,植物细胞的细胞骨架可以进行大量变化[34.].细胞骨架蛋白的降解可能导致细胞骨架的分解和细胞结构的改变Physcomitrella patens.在干燥压力下[35.].绿藻种类的肌动蛋白微丝Klebsormidium crenulatum响应干燥明显破坏,可能是因为肌动蛋白微丝磷酸化状态的变化[36.].细胞骨架的破坏可能是高等植物和绿藻之间干燥应激的结果[37.]. 然而,最近的研究揭示了细胞骨架与植物的非生物胁迫耐受性之间的密切关系Pyropia种类[13.那15.].三种肌动蛋白和小管蛋白蛋白的丰富p . haitanensis在60%(图一WL速率增加。5.).肌动蛋白丰度也增加了水生苔藓Fontinalis Antibyreteteta.β-微管蛋白含量的增加可能有助于保护细胞结构f . antipyretica补液后(34.].目前的研究结果表明细胞骨架会影响细胞稳态p . haitanensis在干燥的条件下。然而,相关的机制背后的脱水耐性Pyropia物种需要在未来的研究中表征。
渗透调整
海藻糖是葡萄糖的一种非还原性双糖,作为一种兼容的溶质,在非生物胁迫下帮助稳定生物结构[38.].催化海藻糖合成的海藻糖-6-磷酸合酶(TPS)的丰度开始响应于60%干燥处理而增加(图。5.).这结果与调查结果一致TPS表达水平响应相当大的水损失而增加[39.].在卷柏lepidophylla脱水的条件下,海藻糖积累的植物干重的12%,并保护蛋白质和膜结构[40].此外,TPS在p .轮匝肌在干燥条件下[41.].这p . haitanensis菌体可能通过大量合成海藻糖和其他渗透物来积极调节渗透势,以适应短期100‰高盐胁迫[31.].因此,海藻糖似乎是一个重要的渗透剂p . haitanensis.
蛋白质合成和降解
非生物胁迫与蛋白质折叠和变性不当的风险增加有关[38.]. 在目前的研究中,干燥胁迫降低了与蛋白质合成相关的基因表达水平和蛋白质丰度,包括核糖体蛋白、翻译起始因子和氨酰-tRNA合成酶(表1)1,无花果。5.). 高温应力也能抑制蛋白质的合成p . haitanensis蛋白质[15.].这些变化可能会降低蛋白质的总体生产,从而消除一些错误和变性。然而,在非生物胁迫条件下,错误折叠的蛋白质不可避免地在细胞中积聚,这需要普遍存在靶蛋白以通过蛋白酶降解[42.].我们的结果表明,在干燥处理过程中,与蛋白质降解有关的基因的表达水平降低(表1),但相应蛋白质的丰度增加(图。5.). 在里面一种n earlier investigation of石莼prolifera,观察到,在不相应的MRNA水平的情况下,DEPS的丰度可以显着增加或减少[43.].DEGS和DEPS之间的差异意味着由于蛋白质谱的变化可能在转录后水平控制。此外,与泛素化相关的Deps的丰富量增加可能有所帮助p . haitanensis去除错误折叠的蛋白质并降低细胞损伤的风险。另外,我们的数据清楚地表明,该途径中的DEP的丰度在具有60%的水分损失的细胞中受到显着影响(图。5.),与光合作用相关的DEPs相似。这些观察进一步证明60%的白垩素率是一个重要的阈值p . haitanensis对干燥的反应。
除了泛素化外,伴侣蛋白的活性也可能控制非生物胁迫诱导的错误折叠蛋白的积累p . haitanensis[9.那44.那45.].例如,HSP是通过防止非抗性蛋白质聚集和将蛋白质重新折叠成原生蛋白质的非生物胁迫条件下的功能性蛋白质构象的常见伴侣。46.].之前的2-de调查得出结论,HSPS在高度丰富Pyropia暴露于干燥应力下[13.那14.].与此相反的转录的结果,热休克蛋白70,Hsp90的,的DnaJ,和HSP10丰度增加(图5.),这突出了p . haitanensis.此外,降低蛋白质生产(表1)是避免蛋白质错误折叠和变性的有效策略p . haitanensis[15.].这可能解释了分子伴侣水平和蛋白质加工活动的下降。这些deg的表达模式表明p . haitanensis刀片可能会限制由干燥引起的可修复水平引起的损害。
对刺激的反应
耐干燥植物的潜在机制之一包括激活几个过程,使特定副产物(如ROS)的损害最小化[47.那48.那49.].在早期的调查中Zygnema Cablarinatum.编码谷胱甘肽-S-转移酶,过氧化氢酶过氧化物酶基因的表达水平,肽甲硫氨酸亚砜还原酶和过氧氧化还原酶分别在组P2比L组高,指示在更严重的ROS应激反应z circumcarinatum在琼脂平板上生长的细丝(干燥胁迫)比在液体培养中生长的细丝[50.].在不同的潮间带物种中,干燥也显著增加了ROS的产生,导致抗氧化剂含量的增加,包括酶[5.那6.].在该研究中,在高(≥60%)干燥应激条件下,抗坏血酸过氧化物酶,血红素氧酶,血红素氧化酶,血红素氧酶,锰过氧化物歧化酶和硫酮的含量增加(图。5.). 在里面p . haitanensis,用于冗余RO的抗氧化系统清除,以在短期110℃胃肠应激期间保持某种氧化还原平衡[27.].表达水平PPSOD.那PHCSD1和PHCSD2.,由o高度诱导2·-内容p . haitanensis在干燥和高温胁迫下[51.].在透明海藻至干燥应激的反应期间,已经揭示了低ROS生产和高酶活性和抗氧化含量[6.].因此,p . haitanensis似乎部署解毒酶和蛋白质以控制ROS水平,并且抗氧化系统可能在干燥条件下提高叶片的存活。此外,编程的细胞死亡对于植物开发和防御机制至关重要[52.]. 在目前的研究中,我们检测到元蛋白酶丰度增加(图。6.),这与先前的分析一致p . haitanensis对高温压力的反应[15.].因此,编程的细胞死亡是重要的一部分p . haitanensis防御反应。
碳水化合物与能量代谢
为了应对压力,植物会启动一系列与碳水化合物和能量代谢有关的活动[53.].之前的一项2-DE研究表明p . haitanensis增加与能量有关的蛋白质的产量,以承受干燥条件[14.].我们在此提出的iTRAQ结果证实,介导碳水化合物和能量代谢的蛋白质对脱水耐受是必需的,包括29个与糖酵解、三羧酸(TCA)循环和戊糖磷酸途径相关的DEPs(图)。5.).糖酵解是一种中央代谢途径,可提供能量,并产生前体用于合成原发性代谢物[54.].我们的转录组分析表明参与糖酵解大多数DEGS表现出上调的表达(表1).类似地,在干燥处理后,所有糖酵解相关DEP的丰度增加(图。5.).呼吸系统随着TCA周期的线粒体反应进行,最终产生大量ATP [55.]. 在干燥胁迫下,丙酮酸脱氢酶、乌头酸水合酶和富马酸水合酶(属于该途径)的丰度增加(图。5.). 此外,戊糖磷酸途径也有助于在非生物胁迫条件下产生能量和糖磷酸[56.].环境压力原因Pyropia种类增加糖酵解活动并诱导TCA周期[13.那15.].这些观察结果表明,能量代谢是一个复杂的过程,而且p . haitanensis刀片需要相当大的能量来容忍干燥应激条件。
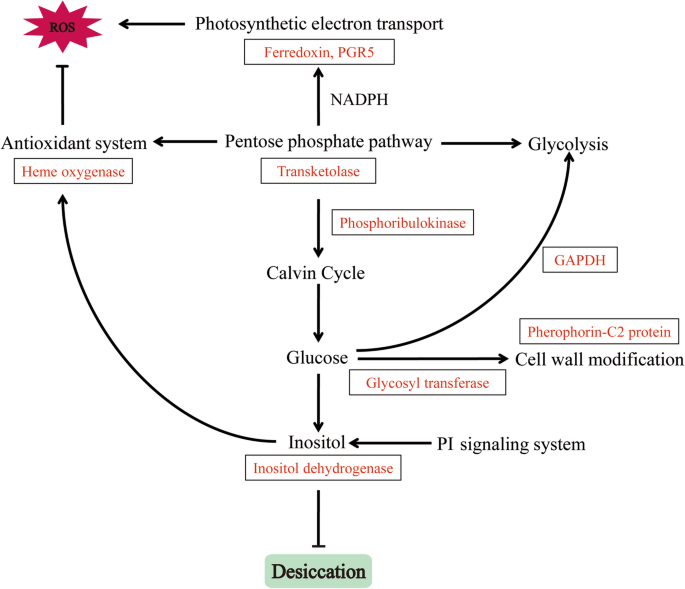
响应于所有干燥治疗,检测到戊糖途径至关重要的ATK1(表1). TKL产生NADPH和糖磷酸中间体[57.].戊糖磷酸途径作为一个多功能途径,与应激耐受性密切相关。在美国prolifera源自磷酸磷酸盐途径的NADPH为PSI周围的循环电子提供电子,这增强了暴露于盐胁迫的蛋白的存活率[58.].观察到的富勒莫林和PGR5水平的增加意味着在干燥条件下具有类似的作用。戊糖磷酸途径的中间体,例如果糖6-磷酸酯和甘油醛3-磷酸盐,也参与糖酵解[47.].我们的数据表明,甘油醛-3-磷酸脱氢酶在p . haitanensis通过干燥应激诱导,表明戊糖磷酸盐途径调节糖酵解途径。除了提供还原的等同物和能量之外,戊糖磷酸途径通过磷素胰岛素酶与钙素循环有关[59.].在这项研究中,phosphoribulokinase生产轻度和中度干燥条件下增加的,这意味着p . haitanensis卡尔文循环维持碳水化合物的积累。糖基转移酶有助于合成半纤维素、果胶、甘露聚糖和各种糖蛋白,使其对植物细胞壁代谢至关重要[60.].此外,肌醇是由大多数植物产生的糖类碳水化合物,调节细胞水压并展示抗氧化能力[61.].关于ROS清除,血红素氧合酶有助于保护细胞免受氧化损伤[62.].在这些结果的基础上,我们推测戊糖磷酸途径间接影响抗氧化活性p . haitanensis.此外,Gao et al.(2013)报道p . haitanensis,PSI周围的循环电子流量在干燥条件下增加,而PSII周围的线性电子流量被抑制。PSI驱动的循环电子流量可以比重复水合后的PSII活性更快地恢复,可能部分是因为由于衍生自磷酸磷酸磷途径的NADPH而周围的PSI周围的循环电子流动的增强循环电子流动[23.].我们在功能上表现出来PhTKL根据我们综合分析的结果。我们观察到这一点PhTKL通过渗透应激诱导表达(图。8.一种)。此外,转基因C. Reinhardtii.过度表达PhTKL在含有高浓度甘露醇的TAP培养基上,细胞比对照细胞生长得更好(图。8.b) 。因此,这是第一份描述PhTKL对于干燥公差(图。9.).此外,一种系统发育树,包括PhTKL建议Pyropia物种从蓝藻门、绿藻门、褐藻门和陆生植物物种分化而来(图。7.).与之相关的具体监管机制PhTKL需要在未来的研究中表征,这可能会对压力耐受性提供新的见解p . haitanensis.
结论
我们进行了一种集成的转录组和蛋白质组分析p . haitanensis暴露在干燥压力下。我们的数据显示出明确的p . haitanensis响应于干燥条件下,用表示此反应的重要阈值的60%WL率。这p . haitanensisThalli能够在轻度干燥条件下通常成长;然而,WL速率超过60%活化的干燥耐受机制,主要影响光合作用活性以及细胞壁和细胞骨架,戊糖磷酸盐途径和抗氧化体系。我们对转录组,蛋白质组和转基因的综合分析C. Reinhardtii.提示戊糖磷酸途径在植物的脱水耐性中起重要作用p . haitanensis.这是第一次阐明转录组和蛋白质组学变化的研究p . haitanensis响应解压力。本文提供的数据为潜在的耐受性耐受性耐受性的分子机制提供了新的洞察。
方法
材料和应力处理
Pyropia haitanensis.菌株Z-61是由紫花苜蓿种质改良与应用实验室获得的Pyropia在福建市梅丽大学[63].Blades were cultured in Provasoli’s enriched seawater in a growth chamber set at 21 °C with a 12-h light: 12-h dark photoperiod (50 μmol photons m- 2 s- 1).Provasoli的丰富海水每3天刷新一次。随机选择增长15±2cm的Z-61叶片以进行应力处理。在随后的实验中分析了每个样品的三种生物重复。基于防水损失设定以下四种干燥水平:0%(对照),30%(轻度干燥),60%(中等干燥)和90%(严重干燥)。再水化(R)治疗涉及在水分损失达到90%之后浸没叶片2小时。对于干燥和再水化处理,温度保持恒定。使用以下公开的公式计算了水损(WL)速率,其中有一些修改[5.].首先,我们设计了预先实验,以估计Z-61菌株的初始含水量(IWC)。在用纱布(W0)除去表面水后,选择总共12叶片,并称重,称重(W0)。然后,将它们在60℃下在烘箱中干燥至恒重(Wi)。IWC使用以下公式计算:
对于干燥处理,我们第一叶片的表面用纱布干燥后获得的重量(W0)。然后,基于该IWC和特定失水率(WL),我们计算根据下面的公式的实际重量(WD):
然后,Z-61叶片暴露于空气中并每15分钟称重。达到WD时,叶片储存在液氮中以进一步RNA和蛋白质萃取。
莱茵衣藻应变“CC-400 CW15 MT +”是由谢,李民教授(海洋生物研究所,国立中山大学)提供,并用于测定候选基因的生理功能。具体来说,C. Reinhardtii.Cells were grown in Tris-acetate-phosphate (TAP) medium at 25 °C with shaking at 100 rpm under 14 h:10 h light/dark (L:D) photoperiod with cool fluorescent light (50 μmol photons m- 2S.- 1).对于渗透应激处理,将细胞培养直至对象,然后在与对照组相同条件下将含有200mM甘露醇的喷头培养基。使用750nm的OD值计算细胞生长速率,以测量细胞抵抗渗透压力的能力(附加文件1:图S4)[64].
RNA提取,de novo组装和基因注释
e.z.n.a.®植物RNA套件(欧米茄,德国)用于从海藻样品中提取经过干燥和再水合处理的海藻样品的总RNA。高质量的RNA用于RNA测序(RNA-SEQ)分析,在MajorBio Biotech Co. Ltd.(上海)的Illumina Hiseq™2000系统完成。先前由谢等人(2013)提供基因组装和注释的细节[65].基于RPKM (reads per kb per million reads)方法计算基因表达水平[66].
通过定量实时PCR验证
使用GDNA橡皮擦(Takara,Japan)的Primescript TM RTNA与Primescript TM RTNA的1μg总RNA合成第一链cDNA。将所有cDNA样品用无核酸酶的水稀释至5 ngμl- 1在用ABI 7300实时PCR检测系统中在96孔板中进行的定量实时聚合酶链反应(QRT-PCR)测定中进行分析之前。泛素缀合的酶基因(Phubc.)作为对照,使靶基因表达水平正常化[67].基因特异性qRT-PCR引物的详细信息请参见附加文件1S1:表。qRT-PCR程序为:95℃30 s, 95℃5 s, 60℃31 s,共40个循环。每个样品进行3个重复的qRT-PCR检测。
蛋白质组学分析
先前描述的方法用于提取、消化和标记蛋白质[15.].计算三种生物重复的平均值和三种技术复制,以表示每个时间点的最终蛋白质丰度。蛋白质在样品之间有1.2倍的变化(P.-价值观< 0.05)被确定为DEPs。
利用多反应监测分析验证差异表达蛋白
如上所述萃取并消化样品,然后用50fmolβ-半乳糖苷酶掺入,以使数据标准化。使用LC-20 AD纳米PLC(Shimadzu,京都,日本Shimadzu,日本),用Qtrap 5500质谱仪(SCIEX,Framingham,MA,USA)完成多反应监测(MRM)分析。生成的原始数据文件与Skyline软件集成。除非检测到来自基质的干扰,否则每种肽的所有转变都用于定量。用β-半乳糖苷酶掺入的样品用于无可甲状腺数据标准化。我们使用了线性混合效果模型的MSSTATS,以及P.调整值以控制0.05的截止值的错误发现率。所有蛋白质具有至少1.2倍的丰度变化(P <0.05)被认为是显着的。
功能分类和富集分析
根据Mapman本体论,DEPS在功能上分类[68].使用Agrigo Toolkit的单数富集分析工具进行了富集分析[69].基于基因和基因组途径数据库的京都百科全书中的信息来鉴定与响应蛋白相关的富集的代谢途径。
分离替代酮基因和矢量构建
Transketolase基因的完整cDNAp . haitanensis(PhTKL)使用基因特异性引物克隆(附加文件1:表S2)。使用Pchlamy_3载体(Invitrogen,USA)来构建转化载体。PCR扩增PhTKL序列和pchlamy_3载体被消化kpn.我和XBA我(Takara,日本),之后它们被连接以产生pchlamy-phtk1重组质粒。
莱茵衣藻核转型
莱茵衣藻根据Yamano等人描述的电穿孔程序的改性版本转化细胞。(2013)[70].这C. Reinhardtii.培养细胞直至细胞密度达到1〜2×106.细胞ml.- 1.通过以600×g离心5分钟来收集10ml等分试样的培养细胞,并在含有40mm蔗糖的200μl脱离介质中重新悬浮,最终密度为1×108.细胞ml.- 1.然后,用KPNI线性化2μgpChlamy-phtk1质粒并加入细胞悬浮液。将细胞悬浮液置于电穿孔(ECM830,USA)中。参数优化为300 V的三个PPS,具有6ms脉冲长度和50ms脉冲间隔。电穿孔后,将细胞悬浮液转移至含有40mM蔗糖的10ml脱离介质,并在昏暗的光下孵育(1〜2μmol光子M- 2 s- 1)24小时 H转化菌落在含有10%葡萄糖的琼脂凝固TAP培养基上生长3天后进行鉴定 μg/mL潮霉素。根据在750℃下测量光密度确定的细胞计数监测细胞生长 纳米[64].
统计分析
QRT-PCR分析PhTKL表达重复三次。数据被记录为平均值±标准偏差。治疗和控制值之间的任何差异的意义在SPSS 12.0(SPSS Inc.,Chicago,IL,USA)中,用单向ANOVA和LSD后HOC测试测定。P. < 0.05).
可用性数据和材料
所有支持数据都包含在文章中或附加文件中。
缩写
- 二:
-
二维电泳
- 度:
-
不同表达基因
- 副署长:
-
差异表达蛋白
- PBPS:
-
PhycobilipRoteins.
- 主成分分析:
-
主成分分析
- Phubc.:
-
泛素缀合酶基因
- PSI:
-
照相我
- psii:
-
光系统II
- qRT PCR:
-
定量实时PCR
- ROS:
-
活性氧
- 点击:
-
三醋酸磷酸
- TCA:
-
三羧酸
- TKL:
-
Transpterolase.
- TPS:
-
海藻糖-6-磷酸合酶
- WT:
-
野生型
参考文献
- 1。
布卢因·娜、布罗迪·贾、格罗斯曼·AC、徐普、布劳利·什。Porphyra.:由压力形成的海洋作物。趋势植物SCI。2011; 16(1):29-37。
- 2。
粮农组织。渔业和水产养殖渔业和水产养殖概况。网址(http://www.fao.org/fishery/factsheets/en.。)(2017年8月2日访问)。
- 3.
凯洛格Ĵ,莉拉MA。化学和体外的阿拉斯加沿岸植被的抗氧化能力的评估。ĴAGRIC食品化学。2013; 61(46):11025-32。
- 4。
中国渔业局,渔业生产,中国渔业统计年鉴(中文),中国农业快递(2016)。
- 5。
谢杰,徐毅,季德,陈聪,谢聪。植物抗氧化系统的生理反应Pyropia haitanensis.到干燥压力。中国鱼类科学。2014;21(2):405-12。
- 6。
Flores-Molina Mr,Thomas D,Lovazzano C,NúñezA,Zapata J,Kumar M,Correa Ja,Contreras-Porcia L.潮间海藻中的干燥应激:对形态学,抗氧化反应和光合性能的影响。aquat bot。2014; 113:90-9。
- 7.
钱楼罗Q,杨R,朱Z,陈华,闫十,沿海红藻Pyropia haitanensis.使用佛罗里达吡啶的快速积累作为干燥适应策略。J Appl Phycol。2015; 27(1):621-32。
- 8.
查拉巴图拉D,巴特尔斯D。复活植物的脱水耐性:来自转录组、蛋白质组和代谢组分析的新见解。前沿植物科学。2013;4:482.
- 9.
王伟,滕福,林烨,纪德,徐烨,陈聪,谢聪。用转录组学研究一株耐高温菌株的热适应Pyropia haitanensis..Plos一个。2018; 13(4):E0195842。
- 10。
王W,林Y,腾F,ji d,xu y,chen c,谢c.耐热与敏感的比较转录组分析Pyropia haitanensis.应对高温胁迫的菌株。藻类。2018; 29:104-12。
- 11.
IM S,Lee Hn,Jung Hs,Yang S,Park EJ,Hwang Ms,Jeong Wj,Choi DW。基于转录的基于转录物的癌症抗性基因的鉴定Pyropia Tenera(红藻)和通过PTDRG2.在里面衣藻.Mar Biotechnol。2017; 19(3):232-45。
- 12.
王L,Mao Y,Kong F,Cao M,Sun P.基因组的表达概况Pyropia haitanensis.响应深序技术响应渗透压力。BMC基因组学。2015; 16(1):1012。
- 13。
López-Cristoffanini C,Zapata J,Gaillard F,Potin P,Correa Ja,Contreras-Porcia L.鉴定蛋白质中参与红海藻中干燥耐受性的蛋白质Pyropia orbicularis.(牙龈牙龈)。蛋白质组学。2015; 15(23-24):3954-68。
- 14。
徐k,徐y,ji d,谢j,陈c,谢c.经济海藻蛋白质组学分析Pyropia haitanensis.响应干燥。藻类。2016; 19:198-206。
- 15.
Shi J,Chen Y,Xu Y,Ji D,Chen C,谢C. ITRAQ的差异蛋白质组学分析显示了Pyropia haitanensis.应对高温胁迫。SCI批准。2017; 7:44734。
- 16。
Lee Hn,Kim Sh,Han Yj,Im S,Jeong Wj,Park EJ,Hwang Ms,Choi DW。pscyp1.海洋红藻Pyropia seriata.(乳腺,肾甲膜)赋予盐和耐热性衣藻.J Appl Phycol。2017; 29(1):617-25。
- 17.
na y,lee hn,wi j,jeong wj,choi dw。PTDRG1.,一种干燥的反应基因Pyropia Tenera(红藻门),具有伴侣功能并增强非生物胁迫耐受性。马尔生物技术公司。2018;20(5):584–93.
- 18.
Takahashi S,Murata N.环境压力如何加速照片?趋势植物SCI。2008; 13(4):178-82。
- 19.
Kanady JS,Tsui Ey,Day MW,Agapie T.氧气系统II中的氧化复合物的MN3CA子部分的合成模型。科学。2011; 333(6043):733-6。
- 20。
Georgieva K,RödingA,BüchelC.在复活植物干燥后一些类囊膜蛋白和颜料的变化Haberlea rhodopensis..acta botanica sinica(云南植物研究),2009;
- 21。
江克,王z,尚h,杨w,hu z,菲利普斯j,deng x.从复活植物的叶片蛋白质组分析Boea Hygrometrica.对脱水和再水化的反应。车前草。2007;225(6):1405.
- 22。
Kumar M,Kumari P,Reddy Crk,JHA B.盐度和干燥诱导海藻中的氧化应激适应。在:植物学研究进展。阿姆斯特丹:elestvier学术出版社;2014; 71:91-123。
- 23。
Gao S,Niu J,Chen W,Wang G,Xie X,Pan G,Gu W,朱D.中等干燥中增加了电极系统II活性的生理环节Porphyra Haitanensis.(脑袋,肾小序)在干燥和再水合过程中循环电子流动。光合作用res。2013; 116(1):45-54。
- 24。
Gao S,王G.增强光照周围的循环电子流量我改善了严重干燥的恢复Porphyra yezoensis.(乳房,肾小球)。J Exp Bot。2012; 63(12):4349-58。
- 25。
Dalcorso G,Pesaresi P,Masiero S,Aseeva E,Schünemannd,Finazzi G,joliot P,Barbato R,Leister D.含有PGR1和PGR5的复合物涉及线性和循环电子流动之间的开关拟南芥. 牢房。2008;132(2):273–85.
- 26。
Suorsa M, Järvi S, Grieco M, Nurmi M, Pietrzykowska M, Rantala M, Kangasjärvi S, Paakkarinen V, Tikkanen M, Jansson S, Aro EM拟南芥照相我到自然和人为波动的光线条件。植物细胞。2012; 24(7):2934-48。
- 27。
Long Ta,Okegawa Y,Shikanai T,Schmidt GW,隐蔽SF。质子梯度调节5在PSI环循环电子传输调节中的守恒作用。Planta。2008; 228(6):907。
- 28。
Sasidharan R,Voesenek La,Pierik R.细胞壁改性蛋白质调解植物适应生物和非生物胁迫。CRIT Rev Plant Sci。2011; 30(6):548-62。
- 29。
Holzinger A,Herburger K,卡普兰楼刘易斯LA。在绿藻绿藻脱水耐性Ulva Compressa.:细胞壁建筑有助于生态成功吗?车前草。2015;242(2):477–92.
- 30
Herburger K,Xin A,Holzinger A.绿藻藻Zygnema Sp细胞壁中的同性恋肌室积累。(accobophyta)增加干燥抗性。边疆。植物SCI。2019; 10:540。
- 31
王文,徐y,陈t,xing l,xu k,ji d,chen c,谢c.稳态术后监管机制Pyropia haitanensis.在高盐胁迫条件下。中国环境科学。2019;662:168-79。
- 32
Osakabe Y,Yamaguchi-Shinozaki K,Shinozaki K,Tran LSP。感应环境:膜局部激酶在植物感知中的关键作用和对非生物胁迫的反应。J Exp Bot。2013; 64(2):445-58。
- 33。
CrRLK1L受体样激酶:不只是墙上的另一块砖。植物学报。2012;15(6):659-69。
- 34。
DE CARVALHO RC,DA SILVA AB,SOARES R,ALMEIDA AM,Coelho AV,DA SILVA JM,Branquinho C.脱水脱水蛋白质组学和苔藓脱水的再水合作用:朝着常见的干燥耐受机制的证据。植物细胞环境。2014; 37(7):1499-515。
- 35。
王学Q,杨普夫,刘子强,刘文强,胡毅,陈浩,等。探讨脑缺血再灌注损伤的机制Physcomitrella patens.通过蛋白质组学战略抗旱性。植物理性。2009; 149(4):1739至50年。
- 36。
干湿胁迫引起陆生绿藻的结构和超微结构变化Klebsormidium crenulatum(KlebsormidIophyceae,Streptophyta)与高山土壳中分离的1. J phycol。2011; 47(3):591-602。
- 37。
Holzinger A,Karsten U.绿藻的干燥应激和耐受性:超微结构的后果,生理和分子机制。边疆植物科学。2013; 4:327。
- 38。
Garg AK、Kim JK、Owens TG、Ranwala AP、Choi YD、Kochian LV、Wu RJ。水稻体内海藻糖的积累使其对不同的非生物胁迫具有较高的耐受性。P自然科学杂志。2002;99(25):15898–903.
- 39。
史杰,徐毅,纪德,陈聪,谢聪。中国海藻糖-6-磷酸合成酶(TPS)家族基因的克隆与表达分析Pyropia haitanensis.(在中国)。J Fish China。2015; 39(4):485-95。
- 40.
Zentella R、Mascoro Gallardo JO、Van Dijck P、Folch Mallol J、Bonini B、Van Vaeck C等。卷柏lepidophylla海藻糖-6-磷酸合酶在yESTTPS1突变体中补充生长和耐胁迫缺陷。植物理性。1999; 119(4):1473-82。
- 41.
费罗C、洛佩斯·克里斯托法尼尼C、梅纳德A、洛瓦扎诺C、卡斯塔涅达F、瓜哈尔多E、孔特雷拉斯·波西亚L。潮间带海藻在潮汐周期中耐干燥因子的表达谱。车前草。2017;245(6):1149–64.
- 42.
Araújowl,tohge t,Ishizaki K,Leaver CJ,Fernie AR。蛋白质降解 - 用于应激植物的替代呼吸基材。趋势植物SCI。2011; 16(9):489-98。
- 43。
樊明,孙旭,徐宁,廖志强,李勇,王杰,崔东,李鹏,苗志。水杨酸调控高温胁迫的深层转录组和蛋白质组学分析石莼prolifera.SCI批准。2017; 7(1):11052。
- 44。
Ji D,Li B,Xu Y等。五种热休克蛋白70基因的克隆与定量分析Pyropia haitanensis..J Appl Phycol。2015; 27(1):499-509。
- 45。
王伟,常杰,郑H,纪德,徐毅,陈聪,谢聪。应用于热休克蛋白和多不饱和脂肪酸生物合成的测序平台组合获得的全长转录组序列Pyropia haitanensis..J Appl Phycol。2019; 31:1483-92。
- 46。
王伟,维诺科B,肖西耶夫O,奥特曼A。植物热休克蛋白和分子伴侣在非生物胁迫反应中的作用。趋势植物科学。2004;9(5):244–52.
- 47。
王志强,王志强,王志强,等。植物脱水过程中的抗氧化防御Haberlea rhodopensis..植物理性生物生物。2017; 114:51-9。
- 48。
潘L,蒙C,王J,等。两个年度的黑麦草综合组学数据(多花黑麦草L。)基因型在干旱胁迫下揭示了核心代谢过程。BMC植物BIOL。2018; 18(1):26。
- 49。
张志强,张志强,张志强,等。链生绿藻脱水耐性的转录组学研究进展Klebsormidium揭示土地植物的防御反应。Plos一个。2014; 9(10):E110630。
- 50。
RIPPIN M,Becker B,Holzinger A.增强了肌醇绿藻的成熟培养物中的干燥耐受性Zygnema Cablarinatum.揭示了转录组。植物生理学报。2017;58(12):2067-84。
- 51
Ji D,Xu Y,Xiao H,Chen C,Xu K,谢C.超氧化物歧化酶基因Pyropia haitanensis.:分子克隆,表征和mRNA的表达。Acta Oceanol Sin。2016; 35(6):101-11。
- 52
Reape TJ,Molony Em,McCabe PF。植物中编程的细胞死亡:区分不同模式。J Exp Bot。2008; 59(3):435-44。
- 53
Zadrağnikt,霍隆k,egge-jacobsen w,megličv,Šuštar-vozličj.普通豆叶中的干旱胁迫反应的差分蛋白质组学分析(菜豆L.)。j.蛋白质组学。2013; 78:254-72。
- 54
Plaxton Wc。植物糖酵解的组织和调节。Annu Rev植物Biol。1996年; 47(1):185-214。
- 55
Fernie Ar,Carrari F,SweetLove LJ。呼吸新陈代谢:糖酵解,TCA循环和线粒体电子传输。CurrOp植物BIOL。2004; 7(3):254-61。
- 56
Stincone A, priigione A, Cramer T, Wamelink MM, Campbell K,张E, Olin-Sandoval V, Grüning NM, Krüger A, Alam MT, Keller MA, Breitenbach M, Brindle KM, Rabinowitz JD, Ralser M.代谢的回归:戊糖磷酸途径的生物化学和生理学。启杂志2015;90(3):927 - 63。
- 57。
Bernacchia G,Schwall为G,Lottspeich楼萨拉米尼楼巴特尔斯D的转酮酶基因家族的复活植物的车前角口炎:再水化阶段的差异表达。Embo J. 1995; 14(3):610-8。
- 58。
欢L,谢X,郑Z,孙楼吴S,李毅男,高S,顾W,在潮间带大型藻类盐胁迫时PSI反应和氧化磷酸戊糖途径的活性之间的王G.正相关关系。植物细胞生理。2014; 55(8):1395-403。
- 59。
Michels Ak,Wedel N,Kroth PG。硅藻体积具有磷酸氨基酶,具有改变的调节和无氧化戊糖磷酸途径。植物理性。2005; 137(3):911-20。
- 60。
Egelund J,SkjøtM,Geshi N,Ulvskov P,Petersen Bl。一种互补的生物信息学方法来鉴定潜在植物细胞壁糖基转移酶编码基因的方法。植物理性。2004; 136(1):2609-20。
- 61.
Bolouri-Moghaddam Mr,Le Roy K,Xiang L,Roldand F,Van Dene W.糖信号和抗氧化网络连接在植物细胞中。FEBS J.2010; 277(9):2022-37。
- 62.
Yannarelli GG,Noriega Go,Batlle A,Tomaro ML。紫外线氧气氧酶上调紫外线-B照射大豆植物涉及反应性氧。Planta。2006; 224(5):1154-62。
- 63.
陈聪,纪德,谢聪,徐烨,梁烨,甄烨,史某,王菲,赵力。水稻耐高温品系选育及经济性状的初步研究Porphyra Haitanensis.(在中国)。海洋学报2008;30:100-6。
- 64.
Kumar A,Falcao VR,Sayre Rt。评估核转基因表达系统莱茵衣藻.藻类。2013; 2(4):321-32。
- 65.
谢C,李B,徐Y,陈C。全基因组转录组的特征分析Pyropia haitanensis.(BANGIALES,Rhodophyta)和CSSR标记的发展。BMC基因组学。2013; 14(1):107。
- 66.
莫塔扎维A、威廉姆斯BA、麦考伊K、谢弗L、世界B。通过RNA-Seq定位和定量哺乳动物转录组。Nat方法。2008;5(7):621–8.
- 67。
李b,陈c,徐y,ji d,谢c。管家基因的验证作为研究基因表达的内部对照Pyropia haitanensis.(BANGIALES,肾小序)通过定量实时PCR(中文)。Acta Oceanol Sin。2014; 33:152-9。
- 68。
USADEL B,Poree F,Nagel A,Lohse M,Czedik-Eysenberg A,STITT M.使用MAPMAN来可视化和比较植物中的OMICS数据的指南:玉米作物物种中的案例研究。植物细胞环境。2009; 32(9):1211-29。
- 69。
杜Z,周X,Ling Y,Zhang Z,Su Z. Agrigo:农业社区的GO分析工具包。核酸RES。2010; 38(Web服务器问题):W64-70。
- 70
山野T、伊瓜奇H、福泽H。快速转化莱茵衣藻没有细胞壁去除。中国生物工程学报。2013;15(6):691 - 694。
致谢
我们感谢李文峰,伊甸园集团中国(www.liwenbianji.cn/ac.)为编辑本手稿的英文初稿。
资金
该工作得到了中国国家自然科学基金(Grant No:41806185),中国福建省的自然科学基金(Grant No. 2018 J05069)和中国农业研究系统(Cars-50)“。这些融资机构在研究和收集,分析和解释方面没有作用,以及编写手稿。
作者信息
隶属关系
贡献
JS、WW、CX和CC构思并设计了实验。WW、JS、YL、YX和KX进行了实验和数据分析。JS、WW、DJ和CX起草了手稿。WW、JS和CX修订了手稿。所有的作者都阅读并批准了最后的手稿。
作者的信息
施智市和文磊王同等贡献了这项工作。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
特异性QRT-PCR引物,用于验证差异表达基因Pyropia haitanensis。表S2。用于克隆的基因特异性引物PhTKL并量化其表达。表S3。摘要Pyropia haitanensis.转录。表S4。重要的差异表达基因Pyropia haitanensis.在干燥和再水化条件下。图S1。unigenes的相对表达Pyropia haitanensis.在QRT-PCR测定的干燥条件下。图S2。比较mRNA水平和蛋白质丰富的变化Pyropia haitanensis..相对变化以log2表示:(a) 30% vs 0%, (B) 60% vs 0%, (C) 90% vs 0%, (D)复水vs 0%。不同颜色的斑点代表如下结果:红色,mRNA水平和蛋白质丰度发生显著变化;绿色表示只有mRNA水平发生了显著变化;蓝色表示只有蛋白质丰度发生了显著变化;黑色时,mRNA水平和蛋白质丰度均无显著变化(P.> 0.05)。图S3。存在的证明PhTKL在转基因衣藻reinhardtii。图S4。之间的相关性C. Reinhardtii.文化OD.750和细胞数。od.750用于实验的四种培养物的值为0.0962 ± 0.0010, 0.1544 ± 0.0008, 0.2261 ± 0.0049和0.3250 ± 分别为0.0016
权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Shi,J.,Wang,W.,Lin,Y.et al。洞察TransketolasePyropia haitanensis.基于常规分析的常规分析和转化的干燥应力。BMC植物BIOL.19日,475(2019)。https://doi.org/10.1186/s12870-019-2076-4
收到:
公认:
出版:
关键字
- Pyropia haitanensis.
- 脱水耐性
- 综合组学分析
- Transpterolase.
- 转基因实验