摘要
背景
摘要小泛素样修饰蛋白(SUMO)的翻译后修饰在植物的发育过程和响应非生物胁迫中起着重要的作用。然而,关于花生(arachis hypogaea.L.)是世界上主要的食物豆类作物之一。在这项研究中,我们以花生的二倍体祖细胞基因组特征为雄性组织体系,落花生duranensis(AA)和arachis ipaensis.(BB)。
结果
基因组分析显示出现40个SUMO系统基因的存在答:duranensis和答:ipaensis.我们的研究结果表明,花生还编码了SCE1的新型II类同种型,以前据报道含有谷物唯一存在。RNA-SEQ数据显示Sublation级联的核心组件SUMO1/2和SCE1G.ydF4y2Ba基因表现出荚果特异性的表达模式,表明荚果发育过程中调控是协调的。此外,转录本和结合谱均表明SUMOylation在荚果发育过程中具有重要作用。此外,在对非生物胁迫的响应中,还观察到SUMO偶联物的动态变化。
结论
花生SUMO系统的鉴定和组织表明SUMO化在逆境防御和荚果发育中起重要作用。本研究将为提高花生产量和揭示花生荚果发育机理提供新策略。
背景
翻译后修饰(PTMs)在特定氨基酸上设置可逆标记,使蛋白质功能发生动态和可逆变化[1那2].其中,小泛素样改性剂(SUMO)肽与蛋白质底物(SuMoylation)是真核生物中的主要后期调节过程[3.].SubOlation的方法在类似于泛素酰化钛的E1-E3阶段的四个步骤中示出。首先,SuMo前体通过Sumo肽酶活性通过SUMO特异性半胱氨酸(CYS)蛋白酶(ULP,泛素样蛋白质蛋白酶)加工,使羧基末端截短前蛋白质至二甘氨酸(GG)基序。SUMO羧基 - 末端G与AMP(SAMO-AMP)连接,在ATP依赖性反应中由异二聚体E1 SUMO活化酶1和2(SAE1和SAE2)催化。随后,活化的SUMO转移到SUMO缀合酶(SCE)的活性位点CYS。SCE可以将SUMO与底物蛋白缀合,导致在基材内羧基 - 末端GLY和赖氨酸(Lys)残基的羧基末端Gly和ε-氨基之间的异肽连杆形成[1].SUMO连接酶在体内发挥重要作用,以确定底物特异性和SUMO化程度[4.].SUMO缀合的可逆性来自异肽键的水解通过SUMO特异性蛋白酶释放SUMO以进行进一步的共轭循环[5.].
Sufoylation在植物开发和压力中起重要作用[6.].在相扑系统中,SAE1.那SAE2.,SCE1.单突变体,sumo1 sumo2和siz1 mms21双突变体是胚胎致死的[7.那8.]证实核心缀合级联在拟南芥中至关重要,因为它在动物中[9.].的spf1 spf2ULP双突变体结实率和自受精率降低[10.那11.].观察到类似的现象OTS1 OTS2.ULP突变体[12.那13.].使用E3连接酶的函数突变体的研究已经鉴定了营养稳态的许多SUMO底物,通过激素(赤霉素(GA),SA,脱离酸(ABA),光敏,干细胞维持和光周期控制开花[14.那15.那16.那17.那18.那19.].另一方面,Sumo长期以来一直是植物压力系统的强大球员建立[20.那21.那22.].在拟南芥中,SUMO结合物的丰度在响应不同的非生物胁迫(如高盐、高温、冰冻、干旱和氧化胁迫)时增加[13.那23.那24.那25.那26.那27.那28.].最近,使用蛋白质组学鉴定了涉及非生物胁迫的许多潜在的Sublation靶标[23.那29.那30.].
种植花生(arachis hypogaea.L.)是人类营养和长大世界的重要油田[31.].花生是异源四倍体(AABB, 2n = 4)X= 40)是由一个单一的杂交事件落花生。Duranensis.(AA Genome)和落花生。ipaensis(BB基因组),随后发生了自发基因组复制[32.那33.].花生水果开发的独特特征是,受精发生在地面上方的花朵中,但水果在地下发展。受精后,卵巢底部的闰份数经历了有源分裂,导致尖迹状结构,称为“PEG”[34.].在PEG渗透到土壤中后,PEG的末端膨胀以形成“POD”。然后,制作豆荚和成熟的花生荚[35.那36.].地下果实是花生种子生产中最突出的特征,因此对研究心动发生和演化具有生物学上重要意义[37.].此外,花生通常种植在半干旱的热带地区,在开花和荚果发育的关键阶段,经常遭受水分胁迫(季中和季末)和高温(> 34°C) [38.].而且,近年来,试图申请花生培养以获得更多的作物产量[39.那40],这使花生必须遭受盐胁迫。
以往对拟南芥和作物物种的研究表明,蛋白SUMOylation在植物发育过程或应对各种非生物胁迫中起着关键作用[1那9.那41.那42.那43.那44.].然而,目前尚无关于花生SUMOylation的报道,特别是SUMOylation随豆荚发育的变化。因此,全面描述花生相扑系统是一件非常有趣的事情。本文对花生SUMO系统的核心成分进行了鉴定,并进行了系统发育分析。分析了荚果发育过程中SUMO系统基因的组织特异性表达模式和SUMO化变异。此外,SUMOylation响应的热,干旱,盐和H2O.2进一步研究了应力。我们的结果表明,Sufoylation在POD开发和非生物应激反应中发挥了潜在的作用,并有利于进一步研究花生中雄性底物鉴定。
结果
花生Sumo途径基因的鉴定与表征
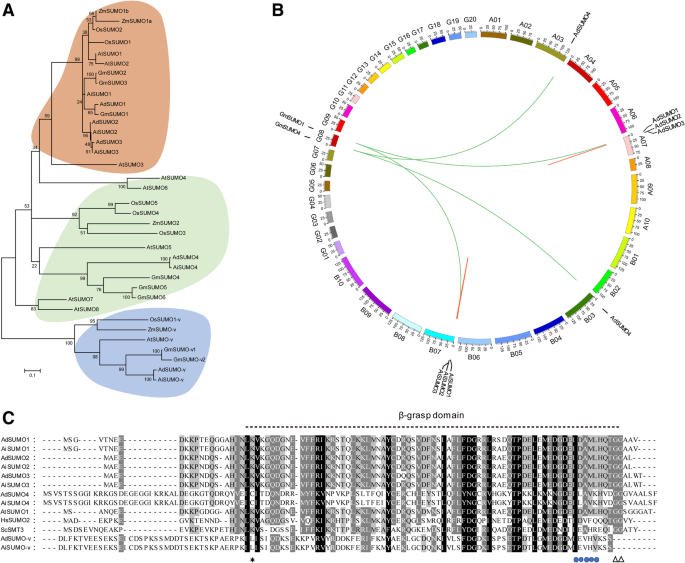
两个祖先物种的全基因组测序(落花生。Duranensis.和落花生。ipaensis) 已经完成 [32.].首先,我们扫描了二倍体祖先的基因组:落花生。Duranensis.(AA Genome)和落花生。ipaensis(BB基因组)可在花生基地(http://peanutbase.org/)使用BLASTP和TBLASTN。利用已知拟南芥SUMO、E1、E2、E3和SUMO蛋白酶蛋白的氨基酸序列进行查询。由于基因组装配仍然不完整,许多最初鉴定的位点错误地分配了连接。然后将基因组序列与花生总RNA聚焦反转录(RT)-PCR分析得到的相应转录本进行比对。从两种野生花生中共鉴定出40个编码SUMO通路核心成分的基因(见表1)1),分析基因结构(附加文件1:图S1)。我们的名单显示,每个AA和BB基因组含有四个Sumo基因,指定为Adsumo1.到Adsumo4.和AiSUMO1到AiSUMO4, 分别。在AA和BB基因组之间具有同源基因座的SUMO基因具有一致的氨基酸序列(附加文件2:图S2)。为了进一步了解这些Sumo同种型之间的进化关系,系统发育树与来自其他植物基因组的同源物构成(图。1一种)。系统发育分析显示出一种高度保守的SUMO组,称为规范组,包括ADSUMO1 / 2/3,AISUMO1 / 2/3,GMSUMO1 / 2/3,ATSUMO1 / 2,ZMSUMO1A / B和OSSUMO1 / 2。相比之下,“非甘露甘露苷”基团包括Adsumo4,AisumO 4,GMSumO 4 / 5/6,ATSumO 3/5分享到规范基团的下氨基酸同一性。氨基酸序列对准发现,非规范构件还具有所需的缀合所需的C-末端二甘醇基质(图。1b),其表明了它们与目标蛋白共价连接的潜在能力。为了支持这一发现,我们确定了一些残留物对SuMOS至E1,E2和Sumo-Interactiving Motifs的非共价结合(SIMS,ψψXψD/ s / e,d / s /Eψxψψ或ψψdlt,其中ψ站对于疏水性氨基酸和X表示在生物王国中保存的任何残留物[45.(图。1b)。
缓慢和其他植物物种中的Sumo相关蛋白质。一种蛋白质序列来自拟南芥那大豆那奥雅萨苜蓿,花生和Zea Mays.用于通过Mega 5中的邻接方法构建系统发育树5.它们分为三组:典型的Sumo,非规范的SUMO和SUMO-VARIANT。B.花生和花生中sumo的同源性分析大豆.圆圈上短而浅的黑线表示花生或花生染色体的大致位置大豆相扑。花生和大豆SUMOS由彩色线表示。C对SUMO序列进行比对,发现花生、拟南芥(AtSUMO1)、人(HsSUMO2, NP_008868.3)和酵母(ScSmt3, KZV12750.1)中的保守和差异残基。只显示了保守区域。黑色虚线位于β-抓褶处。黑色三角形定位了ULP的加工位置,暴露了diGly基序在规范SUMOs中共轭必不可少。星号表示形成sumo链所需的保守Lys。蓝色圆点表示相扑相互作用基序(SIMs)。灰盒和黑盒分别识别相似和保守的氨基酸。破折号表示缺口。在,拟南芥;ZM,Zea Mays.;卫生,奥雅萨苜蓿;通用,大豆;HS,HOMO SAPIENS.;Sc,酿酒酵母酿酒酵母
为了进一步了解SUMOs的起源和进化关系,我们对花生和大豆序列进行了同步分析。1b)。鉴定的四对正非基因对如下:Adsumo1.-GmSUMO1那AiSUMO1-GmSUMO1那Adsumo4.-GmSUMO4,AiSUMO4-GmSUMO4.只有两对平行的SUMO.基因在花生中发现:Adsumo2.-Adsumo3.和AiSUMO2-AiSUMO3.直方图表明SUMO1.和SUMO4.花生和大豆的基因可能来自普通的进化祖先。基因SUMO2.和SUMO3.在花生植物中可能从最近的串联复制事件中程度上升,因为它们的基因座在花生染色体上彼此相互作用。
除了规范和非甘露解集组,aSUMO-v家族广泛存在于植物基因组中,该植物基因组在预测的β-掌握折叠内被保存,并且缺乏明显的C末端偏心图案[43.].序列比对发现,花生基因组中有两个较长的SUMO相关蛋白SUMO-v家庭,并被指定为Adsumo-V.和AiSUMO-v.系统发育分析也有分歧Adsumo-V.和AiSUMO-v进入sumo-V.来自其他物种的伞菌的群体。ad / aisumo.-V.在没有暴露diGly motif的情况下,SUMO β-grasp结构域上游有超过100个残基的n端延伸(Additional file2:图S2)。因此,SUMO-v可能不参与已深入研究的E1/E2/E3 sumo化途径,但可能在植物中具有其他有待探索的功能。
在花生中,有三个亚单位SAE1同种型(Adsae1a / b和Aisae1)和两个亚单位sae2同种型(ad / aisae2)(表1).来自各种植物物种的SAE的系统发育分析表明,Adsae1a / b和aisae1最接近Gmsae1a / b,SAE2与GMS2具有高相似之处(附加文件3.:图S3)。
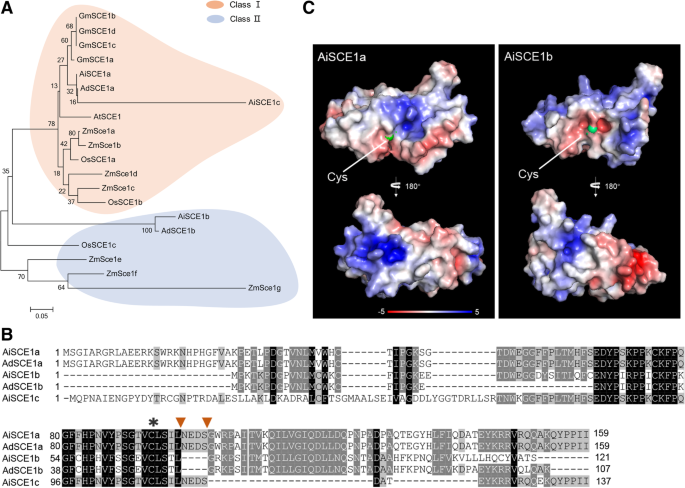
在途径的第二步,SUMO从E1转移到E2活性位点Cys (SCE),形成SUMO-E2硫酯中间体[20.].花生基因组含有五种SCE基因,包括AdSCE1a / b在AA基因组和AISCE1A / B / C.在BB基因组中。为了进一步了解这些E2基因的起源,我们从其他植物基因组中提出了几种SCE1蛋白,并构建了系统发育树(图。2a).系统发育分析显示存在两个可能的亚科:一个包括Adsce1a.那AiSCE1a,AiSCE1c与atsce1密切相关的基因,以及其他亚家族Adsce1b.和AiSCE1b与玉米密切相关SCE1E.到SCE1G.基因。有趣的是,结果与先前的单粒子谷物分支中的分类一致,其中将E2分为两种不同的亚属,被称为I类和II类。在所有真核生物和必要的成员(如拟南芥SCE1和酵母UBC9)中发现了I级代表。相比之下,仅在单焦点的谷物分支中发现了II类思克,例如玉米Sce1e至SCE1G [43.].II类疏水部门在活性位点Cys周围具有更负的静电表面,除了在活性位点袋附近的氨基酸的不变缺失[43.].系统发育分析表明,双子叶花生SCE1b属于II类进化支,我们进一步将SCE1b的氨基酸序列与SCE1a和SCE1c进行了比对。结果表明,Ad/AiSCE1b与玉米中的II类成员相似,也有许多非保守的替换,同时活性位点Cys附近有一个不变的氨基酸缺失(图)。2b)。为了进一步确认花生SCE1B是否属于II类组,我们通过可用的人UBC9模型作为模板,通过Swiss-Model预测AISCE1A(I类)和AISCE1B(II类)的三维结构,并分析静电表面电荷。AISCE1A中的受影响的表面类似于ATSCE1,富含围绕活性位点Cys的带正电荷的残留物,而Aisce1b富含活性位点Cys的带负电荷残留物(图。2C)。这些结果表明,除了单像的谷物分支外,二坐子花生还存在II类E2蛋白的e2蛋白。另外,氨基酸序列对准显示,Adsce1a和Aisce1a的序列是完全相同的,表明Sce1a在花生进化中高度保守,对于花生发育至关重要(附加文件4.:图S4)。
花生编码了一个新的SCE1亚家族。一种SCE1序列系统发育分析。SCE1蛋白序列的系统发育关系拟南芥(在),Zea Mays.(ZM),奥雅萨苜蓿(OS),大豆(GM)和花生由使用MEGA 5的邻近加入方法进行评估。秤条表示P距离。B.Ad/AiSCE1a、Ad/AiSCE1b、AiSCE1c与拟南芥AtSCE1序列比对星号突出显示活动站点的Cys。棕色箭头所指的残基表示AiSCE1b和AdSCE1b中的一个氨基酸缺失。灰色和黑色盒子分别表示相似和保守的氨基酸。破折号表示缺口。C在AiSCE1a和AiSCE1b之间,活性位点Cys(绿色)周围的静电表面电荷是不同的。使用PyMOL中的自适应Poisson-Bolzmann Solver插件计算两个方向的表面静电。蓝色表示正电荷,红色表示负电荷
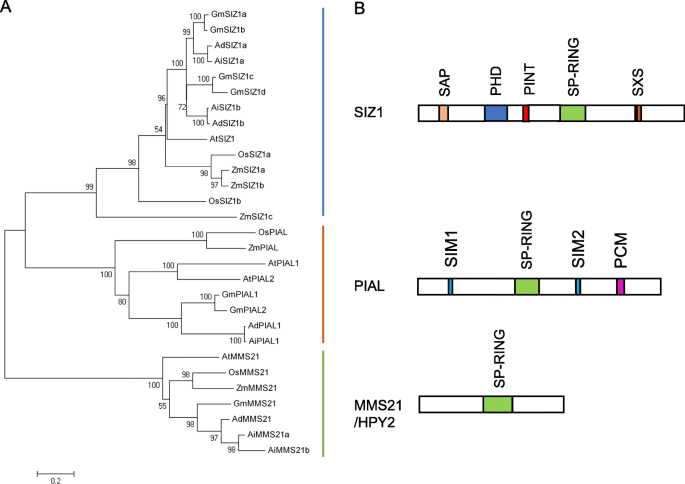
SUMO E3连接酶是一种e2相互作用蛋白,可促进SUMO在体内从SCE1转移到底物,尽管有些底物不需要E3连接酶的存在,在体外进行修饰[9.].在拟南芥中发现的SUMO连接酶,包括SIZ1、MMS21和PIAL1/2,属于SP-RING家族[9.].花生中的SUMO E3连接酶(E3)也可分为3个亚家族:SIZ1、PIAL和MMS21。3.).花生SIZ1家族包含4个蛋白(AdSIZ1a/b和AiSIZ1a/b),其中包含保守的SAP、PHD、MIZ/SP-RING结构域、PINIT和SXS motif(补充文件)5.:图S5)。系统发育分析表明,AD / AISIZ1a最进化地与GMSIZ1A / B相关,AD / AISIZ1B最接近GMSIZ1C / D。AA和BB基因组中只鉴定出两个小型同源物(Ad / Aipal1)。序列对齐显示花生Pials具有Miz / Sp环域以及PCM和SIM图案(附加文件6.:图S6)。系统发育分析表明,AD / AIPal1与Gmpial1最接近进化(图。3.).AtMMS21的三个同源物包括AdMMS21a和AiMMS21a/b,它们都含有保守的SP-RING结构域7.:图S7)。那里有两个MMS21在AA基因组和一个中拷贝MMS21复制BB基因组。氨基酸对准显示,AIMMS21A / B与N-末端的ADMMS21A显示出更多的分歧,这意味着花生的两个亚基因组中的MMS21蛋白可能已经采取了不同的进化路线(图。3.).
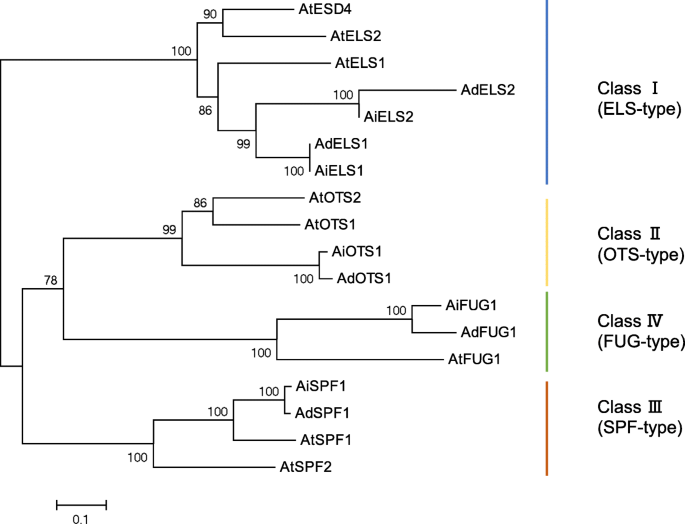
属于Ub-Like蛋白酶(ULP) C48基因家族的植物去umoylating蛋白酶控制解连接和SUMO成熟[5.].使用拟南芥中的Sumo蛋白酶作为疑问,在花生基因组中鉴定了11个Sumo蛋白酶。花生中的Sumo蛋白酶基因可以分为四组:I类ELS型,II类OTS型,III类FUG型和IV类SPF型(图。4.),这与拟南芥的分类结果一致[46.那47.].此外,它们都有一个peptidase_C48结构域(附加文件8.图S8),推断相似的SUMO蛋白酶活性。
SUMO系统的转录分析
为了进一步了解Sumo系统在花生中的时空表达,从先前研究的22种组织样本中从RNA-SEQ数据组分析相关基因的表达模式[48.].
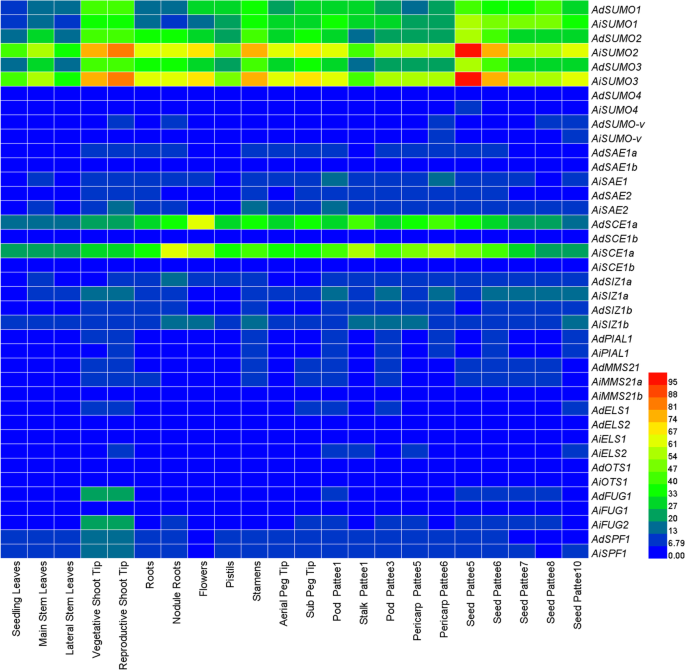
22个花生组织中所有SUMO通路基因的RNA-seq的RPKM数据显示在附加文件中10.表S2,这表明sumo化在花生所有类型组织的发育过程中都是必不可少的。特别是,Adsumo1./2/3和AiSUMO1 / 2/3这些基因在花生的多个发育阶段可能具有不同的功能。值得注意的是,SUMO基因表现出优先的组织特异性表达,特别是在荚果发育过程中,表明它们可能在荚果发育过程中发挥调控作用。然而,SUMO4.和SUMO-v在整个数据集中检测到转录物不良(图。5.).在E2组,Adsce1a.和AiSCE1a在所有这些22种组织中表现出适度的表达水平Adsce1b.和AiSCE1b在几乎所有发育阶段都以低水平表达,暗示Sce1a.可能支持花生的正常生长和发育。此外,MMS21和软膜的基因在几乎所有组织中表达较差,而SIZ1基因是组织特异性的。例如,AiSIZ1a在拍摄提示和豆荚开发中表现出更高的表达,但AiSIZ1b在根,结节,荚和果皮发育阶段的较高水平下表达(图。5.).相反,Adsiz1a / b.在任何被调查的组织中都很难被检测到。的ulp.家族基因在几乎所有的样本中表达水平都很低,除了那个广告/ AiFUG1和广告/ AISPF1.在植物人和生殖射击尖端的表达相对较高(图。5.).
花生不同组织SUMO系统成分的转录组分析。RNA-seq实验代表22个发育不同的组织[48.通过每百万千兆碱基读取(RPKM)值的读取(RPKM)值为各自的SUMO途径基因开采。子,地下
花生荚果发育中的SUMOylation谱
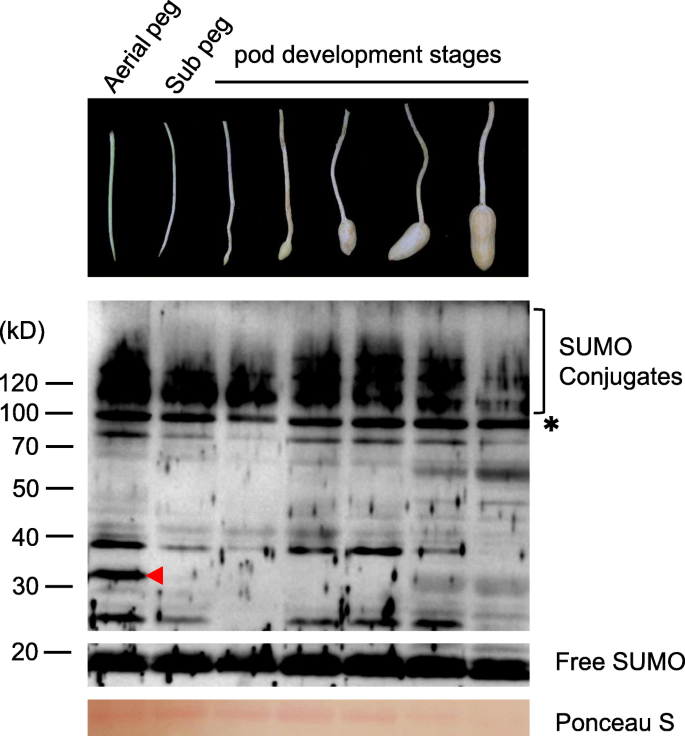
作为SUMO.和SCE1G.ydF4y2Ba根据RNA-seq数据,我们在花生荚发育的两个阶段(气栓和地下无肿胀栓)和五个不同的荚发育阶段检测到了SUMO结合物。与空中桩相比,SUMO缀合物在地下无肿胀桩中显示减少(图。6.).而且,在地下没有膨胀钉中没有发现几种特征缀合物(图。6.).在佩格的土壤渗透之后,Sumo缀合物的量急剧下降,这可能是由黑暗和机械刺激产生的。在POD开发期间,SUMO缀合物曲线在种子膨胀阶段期间逐渐上升,然后随着POD成熟而降低(图。6.).这些结果表明,Sumoylation在促进POD开发方面发挥着积极作用。
花生的应激调节的sumo化
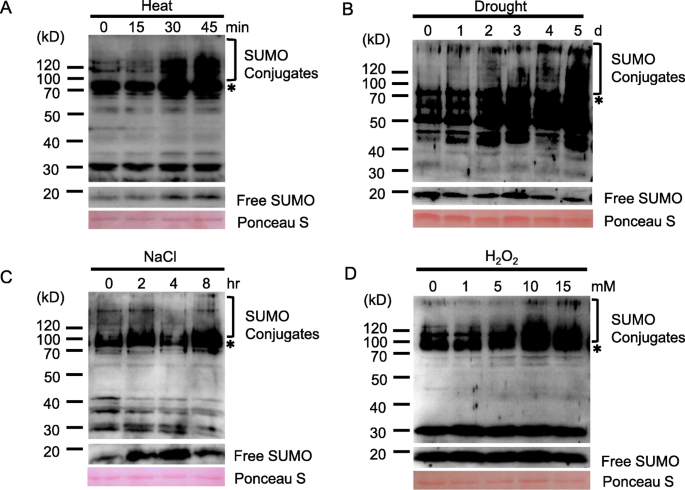
非生物胁迫,如热休克、干旱和氧化应激,已被报道引发SUMO结合水平的显著增加[22.那27.那28.那39.].为了更好地定义对花生中非生物胁迫的雄性响应,研究了SUMO缀合物的变化,以响应热,干旱,盐和过氧化氢(H.2O.2).在热处理(37℃)期间,与未经顽固的条件相比,在15分钟的热刺激后,花生叶中的Sumo缀合物的量保持不变(图。7.一种)。然而,在施加热应激之后,缀合物水平基本上从30〜45分钟上升。此外,在治疗过程中,自由相同的水平也同时增加。结果表明,Sumoylation涉及对高温诱导应力的反应。
干旱和盐胁迫是影响全球农作物产量的主要因素[49.那50.].研究植物对干旱和土壤高盐度的适应机制越来越重要[20.].在拟南芥中,很好地确定了Sumo缀合物的丰度响应暴露干旱和高盐度而增加[1那51.]但是小在花生中众所周知。因此,我们首先在干旱胁迫下调查了花生幼苗的Sumo缀合物。Sumo缀合物的量随着暴干燥持续时间的增加而逐渐增加,并且在干旱胁迫5天后终止化(图。7.b)。在盐处理期间,在盐处理2小时后检测高分子量宁静的产物的积累(图。7.c).当处理4 h时,大部分游离SUMO被重新填充,SUMO偶联物的数量大大减少。但在盐度处理8 h时,SUMOylation再次被快速诱导(图。7.C)。
先前的报告显示,细胞内SUMO结合物的水平增加暴露于氧化应激(H2O.2)在动物和拟南芥中,我们在Sumos在花生中发挥着类似的作用,我们测试了。将花生幼苗暴露于30分钟至各种浓度的过氧化氢(H.2O.2).结果表明,随着H浓度的增加,SUMO结合物逐渐积累2O.2(图。7.d),与拟南芥和其他抗应激氧化应激的植物一致[28.那43.].
讨论
在植物中,sumo化途径在植物发育及其对环境刺激的反应中具有重要意义[22.].本研究鉴定了40个花生SUMO通路基因。花生基因组包含SUMOylation所需的基因,这些基因在进化上与拟南芥和大豆的同源物相关。拟南芥和大豆中推测的8个SUMO拷贝和6个SUMO拷贝的比较花生基因组包含8个成员,它们拥有相似的泛素样结构。在花生基因组中,有六个典型SUMO.基因(AdSUMO1/2/3和AiSUMO1/2/3出现了同源的atsumo1 / 2..已知这些基因在环境刺激下与多种靶蛋白结合[29.那30.].但是,另外两个基因广告/ aisumo4.都与atsumo5.属于非洲游戏。没有确定基因同源物atsumo3.在花生基因组。有人建议,非洲同志独立地发展多次,然后快速多样化[52.].在拟南芥中,SUMO3.和SUMO5.,很可能是独立于串联复制SUMO2.分别来自一个古泛双二体古六倍体事件[52.].此外,SUMO3.经常删除,转换回来SUMO2.或在其他人中伪种化Brassicaceae.[43.那52.].该结果符合提出的建议,恢复到植物中的Sumlo基因的Sumo基因的Sumo拷贝数,并且保留的Archetype Sumos在其表达式模式方面具有亚官能化,而不是其序列[52.].此外,植物基因组普遍编码SUMO亲属,SUMO-v,其特征是在核心β-grasp褶皱上有一个长而可能灵活的N端延伸[43.].的SUMO-v花生中的基因在RNA-SEQ数据中表现出低表达。这些结果涉及六个规范SUMO.花生基因可能在植物发育中起着至关重要的作用。的非正则群SUMO.基因和SUMO-v基因可能有其他特殊功能。
有五个南加州爱迪生公司在花生中共享一个保守的UBC域的基因拷贝,分为两种同型。我们的结果发现花生还编码一种新的类型(II类同型)SCE1G.ydF4y2Ba,它以前被发现只存在于玉米等单子叶植物中[43.].蛋白质结构的序列分析和预测表明,II类E2s在活性位点Cys周围有一个更负的静电表面,这是由大量非保守的取代产生的,以及活性位点袋附近的一个氨基酸缺失。这些特征与玉米的II类E2s一致,表明花生和玉米可能具有相同的进化路径。类I e2显示了广泛的表达模式,类似于花生中的规范SUMOs。这表明该家族基因与相扑在正常的生长和发育中起着潜在的重要作用。相比之下,II类e2,广告/ AiSCE1b,在花生中表现出非常低的表达水平。以前对玉米的研究认为是II类同型SCE1f.能显示出更多受限的表达模式,并能有效地指导Sumo1a.[43.].此外,II类SCE1基因拷贝被认为与某些SUL基因共同进化,并组成了新的偶联途径[43.那53.].因此,研究第二类的进化将是很有趣的SCE1G.ydF4y2Ba和它们的催化活性生成多sumo链。
此外,花生基因组编码了三种类型的Sumo E3连接和四种类型的Sumo蛋白酶。SUMO E3连接酶广泛参与环境压力应答和发育过程的调节[9.那54.].表达水平SIZ1基因显示出差异组织特异性。例如,AiSIZ1a在拍摄提示中显示出更高水平的表达,但AiSIZ1b在根、根瘤和荚果发育过程中表达量相对较高(图2)。5.).此前在拟南芥研究中发现,MMS21在DNA损伤修复和根系发育中发挥着更为重要的作用[54.那55.].然而,MMS21基因在几乎所有组织中的表达都很差,这表明MMS21在花生主要是专注于DNA修复。具有除去活性的Sumo蛋白酶也在植物开发和压力响应中起着重要的调节作用[51.那56.].例如,ESD4被发现参与了拟南芥开花的调节[57.].ATSPF1 / 2.规管雌/雄配子及胚胎发育[10.那11.], 和OTS1 / 2.调节水稻中的生长和盐应激反应[12.那24.].除了所有发展阶段之外,SUMO蛋白酶家族基因在几乎所有发育阶段都具有较低的表达。广告/ AiFUG1和广告/ AISPF1.在茎尖中表达量较高,可能在茎尖发育中起作用。进一步,表示AiSIZ1a与广告/ AiFUG1和广告/ AISPF1.在射击尖端还提出了Fug1和SPF1可能有助于在Siz1a介导的稳定性的逆转中有所帮助的可能性。
同源基因在异源多倍体中的偏置表达被认为是多倍体化的一个重要特征[58.那59.].在不同的组织和发育阶段,还研究了来自A和B亚胍基的同种杂种SUMO系统基因对的表达。总体而言,大多数SuMo系统的同源源基因表现出均衡模式的表达模式,这暗示这些正交基因表现出具有功能冗余。然而,来自B亚基组的一些基因表现出比某些特定组织和发育阶段的亚基因组的产后更高的表达水平。例如,平均值Aisumo2 / 3.B子组表达水平中的副本高于亚基因组(Adsumo2 / 3.)在整个发育阶段复制。在茎尖和种子发育阶段,AiSIZ1a表达更高的表达水平Adsiz1a.(图。5.).优先表达可能归因于A和B子组织在其数量和转换元素(TES)的分布中不同的事实,其中一个基因组中的TES更接近基因,而不是它们在另一个共居内基因组中[60.].
花生枸杞的重力生长是花生果实的最关键特征之一,其中PEG是一种从向上增长习惯转变为施肥后向下流逝的专业器官,将豆荚驱动到土壤中的后续发育下的土壤[37.那61.那62.].尽管一系列的研究试图通过转录组学和蛋白质组学揭示这一现象,但仍不清楚为什么在空中发育的豆荚不能与渗透到土壤中的豆荚相比正常膨胀[37.那61.那63.].我们的研究结果发现,空中PEG阶段与地下PEG阶段之间的SUMO途径基因表达水平没有显着差异。然而,SuMo缀合物的量急剧下降,特别是在PEG渗透到土壤中后几个SUMO缀合物消失(图。6.).据认为,花生PEG的伸长和肿胀受植物素,赤霉素和其他植物激素的影响[35.那62.那64.].另一方面,Sumoylome的评估显示,Sumoylation参与植物激素的运输和信号传播(植物蛋白,甘草蛋白和积极酸)。这些结果隐含的Sumoylation可以在翻译后水平的植物激素途径中控制PEG伸长率并溶胀。进一步努力识别专门参与此过程中的Sumo基板将有助于了解花生的这种监管机制。
虽然转录分析表明SUMO系统对大多数组织类型都是必不可少的,但我们注意到它与荚果发育密切相关。在花生中,种子膨大开始于Pattee stage 5(早期荚果发育阶段),此时果皮含糖量最大,种子开始与果皮分化[65.].在Seed Pattee 5阶段并继续进入第6阶段,所有典型的Sumo基因最高表达,然后随着种子发育进展其表达减少(图。5.).与此同时,在荚果发育早期的第5阶段,SUMO结合也显著上升,然后下降(图5)。6.),从而提高了SUMO丰度增加导致SUMO化增加的可能性。此前花生发育转录组研究表明,这一阶段的顶级富集基因包括有丝分裂、DNA甲基化、微管运动、糖酵解和脂肪酸生物合成[48.].巧合地,Sumo底物的蛋白质全组鉴定也检测到参与DNA修饰,分解代谢和基于微管的蛋白质中的显着富集[30.].鉴于SUMO共轭的发展与canonical表达的增加相一致相扑,在种子扩张期间,可以的转录物SUMO.将首先激活基因,然后Sumoylation将改变与有丝分裂,DNA甲基化,基于微管的运动和脂肪酸生物合成有关的底物以调节早期荚的开发。
已知各种非生物应力导致Sumo缀合物的积累,包括氧化应激,盐,干旱和温度胁迫[1那20.那23.].尽管拟南芥中SUMOylation-dependent非生物胁迫反应的特性很好,但越来越多的证据表明,这种联系在许多作物物种中是保守的,如水稻、玉米或大豆[41.那42.那43.那44.].例如,Sumo缀合物的水平响应于非生物应激而增加,例如冷,高盐度或水稻中的ABA增加[44.,以及玉米对热和氧化应激的反应[43.].此外,Sumo缀合物的水平也增加了暴露于各种非生物应力的大豆植物,包括高盐度,热量或增加ABA [41.那42.].我们的研究结果表明,当盐胁迫胁迫的幼苗时,蛋白质水平上的Sumo缀合物最初增加,然后降低。此外,花生被认为是中等盐敏感物种[39.那40].这一结果表明花生对盐胁迫的反应正在适应。值得注意的是,SUMO偶联物是在对干旱、高温和高温的响应下逐渐积累起来的2O.2花生处理(图。7.).研究表明,花生与其他植物一样,通过SUMO结合蛋白的调控,对干旱、高温和氧化胁迫具有保守的响应。这些结果揭示了花生SUMOylation翻译后修饰对环境胁迫反应的复杂性。
结论
总之,从花生基因组中鉴定了共同组合体系中涉及的40个基因。Sumo途径基因的表征和组织特异性表达谱意味着Sumo途径成员可能在花生中的各种组织中发挥作用。此外,免疫印迹分析证明了蛋白质修饰可以参与非生物胁迫,并且可以在POD开发期间发挥关键作用。鉴于在应力和荚开发期间看到的高度雄性,用于鉴定SUMO基材的进一步的蛋白质组屏幕将提供新的策略,以提高农艺产品,并揭示花生荚发育的机制。
方法
花生SUMO通路基因的鉴定
花生SUMO通路基因是利用拟南芥(拟南芥)生态型哥伦比亚-0作为查询。SuMo途径蛋白序列从拟南芥信息资源网站下载(Tair,http://www.arabidopsis.org.).BLASTP和TBLASTN分析用PEANUT基因组数据库中可用的两种野生花生物种(AA和BB基因组)进行(http://peanutbase.org/).使用NCBI进行互惠BLASSP分析,以确保主题命中最接近匹配SUMO路径查询。使用PFAM数据库预测蛋白质域(http://pfam.xfam.org.).从相关基因组数据库中收集蛋白质序列,以进行以下额外的植物物种:玉米基因组数据库(https://maizegdb.org/),大豆基因组数据库(https://soybase.org/soyseq/),奥雅萨苜蓿基因组数据库(http://www.plantgdb.org/osgdb/).本研究中SUMO途径组分的氨基酸序列见附加文件9.S1:表。使用GPS-SUMO版本1.0.1的默认设置预测可能的sumo位点和SIM序列[45.].
多序列比对、基因结构和系统发育分析
使用软件集群x 2.0进行蛋白质多序列对准[66.]并用Genedoc编辑对齐(http://www.psc.edu/biomed/genedoc/).利用基因结构显示服务器2.0 (GSDS)绘制SUMO系统基因结构[67.].系统发育树采用MEGA 5蛋白序列构建,采用neighbor joining (NJ)方法,bootstrap检测1000次重复,完全缺失缺失[68.].
蛋白质模型螺纹
对于三维结构的预测arachis ipaensis.SCE1A / C蛋白质序列由Swiss-Model螺纹(http://swissmodel.expasy.org.[69.;)进入人体UBC9的晶体结构。PyMOL版本1.7.0.3中显示了线程PDB输出(http://www.pymol.org.).Adaptive Poisson Bolzmann Solver插件版本2.1计算静电表面密度。
检测正交基因对和同步分析
mcscanx v0.8软件[70)(http://chibba.pgml.uga.edu/mcscan2/)用于检测花生基因组内的重复基因以及花生与高粱的同序基因块。将花生和高粱的全基因组蛋白序列进行合并,利用BLASTP进行搜索,e值截断值为1 × 10- 5然后,McScanx和关联的下游工具的默认参数。使用Perl脚本在染色体上标记每个SUMO基因的位置。使用电池绘制两种物种中的正交对的关系(http://circos.ca/)[71.].
植物生长和处理
花生品种Luhua Luhua 14(LH14),由山东花生机构的同事培养(http://www.sdshss.com/)[39.,作为本研究的实验材料。花生幼苗在沙土中萌发8 d后,转入含2 L霍格兰营养液的水培盆,在人工气候控制的室内培养,光照16 h (200 μmol质子m)- 2 s- 1在相对湿度50%的情况下,8小时黑暗(24°C)。营养液每周更换一次。幼苗18天时开始处理。每个花盆里有四株复制的植物。在NaCl处理下,幼苗在添加300 mM NaCl的营养液中生长0、2、4和8 h。对于热处理,将幼苗转移到42°C的生长室中,分别待0、15、30和45分钟。对H2O.2处理,花生植物暴露30分钟至各种浓度(0,1,5,11,15mM)过氧化氢(H.2O.2).干旱胁迫条件下,花生种子在沙土中萌发生长16 d,光照16 h (200 μmol质子m)- 2 s- 1在相对湿度50%的情况下,8小时黑暗(24°C)。在此期间,幼苗每4天浇水一次。然后对16日龄的幼苗进行0、1、2、3、4、5天不浇水的干旱处理。实验结束时,采集所有叶片,立即用液氮冷冻,在−80°C下保存,直至分析。本研究采用七个发育阶段对花生钉的发育进行分析。气生木栓,颜色为绿色或紫色,长3 ~ 5 cm;Peg在土壤中生长约3 d,未见子房膨大;荚果发育期分别为15 d、30 d、45 d和60 d。人工解剖peg的尖端区域,在液氮中冷冻,并在−80°C下存储,用于后续实验。
SUMO通路基因的RNA-seq数据及表达
为了进一步表征花生Sumo途径基因在花生发育过程中的功能,从国家生物技术信息中心下载来自耕种花生的22种不同组织的RNA-SEQ数据(http://www.ncbi.nlm.nih.gov/)在Bioproject prjna291488下[48.].在附加文件中列出了花生组织的描述10.S2:表。使用Heml 1.0 heatmap illustrator生成SUMO通路基因在不同组织中的表达模式[72.].
Sumo缀合物的蛋白质提取和免疫印迹分析
采用植物活性蛋白提取试剂盒(上海生工生物技术有限公司),根据生产说明书从花生不同组织中提取总蛋白。以BSA为标准,采用Bradford法测定蛋白浓度。20 μg纯化的蛋白在12% SDS - PAGE上分离,按标准方案转移到硝化纤维素膜上。凝胶加载对照采用Ponceau S染色法(转移后立即)。洗后TBST缓冲区(10 mMTris-HC1, pH值8.0,150毫米氯化钠,渐变20 0.05%),5%的奶粉的膜堵塞TBST缓冲在室温下1 h,然后用AtSUMO1探测主要抗体(Abcam、中国、ab5316)准备在TBST缓冲区包含1%牛奶(1:20 00)一夜之间在4°C。用TBST缓冲液洗涤去除未结合抗体后,将印迹与山羊抗兔IgG二抗(辣素过氧化物酶偶联,Thermo Fisher Scientific, USA)在TBST缓冲液中稀释1:50 000孵育。根据制造商(默克密理波,美国)的说明,使用ECL Plus试剂盒检测样品。
数据和材料的可用性
在当前的研究中使用的材料可从相应的作者在合理的要求。
缩写
- 半胱氨酸:
-
半胱氨酸
- RPKM:
-
读取每千基/百万映射读取
- SAE:
-
相扑激活酶
- SCE:
-
SUMO-conjugating酶
- SUMO:
-
小ubiquitin-related修饰符
- ULP:
-
泛素样蛋白质蛋白酶
参考文献
- 1。
Augustine Rc,Vierstra Rd。Sufoylation:在压力和发育过程中重新接线植物核。CurrOp植物BIOL。2018; 45(PT A):143-54。
- 2。
拟南芥小泛素类修饰物parogs在发育和防御方面具有独特的功能。植物细胞。2010;22(6):1998 - 2016。
- 3.
Gareau Jr,Lima CD。SUMO途径:形状特异性,共轭和识别的新兴机制。NAT Rev Mol Cell Biol。2010; 11(12):861-71。
- 4.
sumoylation的概念:十年后。中华医学会细胞生物学分会。2007;8(12):947-56。
- 5。
Yates G,Srivastava Ak,Sadanandom A. Sumo蛋白酶:揭示脱水剂在植物中的作用。J Exp Bot。2016; 67(9):2541-8。
- 6。
Park Hj,Kim Wy,Park HC,Lee Sy,Bohnert HJ,Yun DJ。植物中的Sumo和Sumoylation。2011年。
- 7。
Takashi I,Mika Y,Kenji M,Kenji M,Keiko S. MMS21 / HPY2和Siz1,两个rabidopsis sumo E3连接酶在开发中具有不同的功能。Plos一个。2012; 7(10):E46897。
- 8。
Saracco Sa,Miller MJ,Jasmina K,Vierstra Rd。拟南芥族化的遗传分析:Sumo1和Sumo2对核蛋白的缀合至关重要。植物理性。2007; 145(1):119-34。
- 9。
Elrouby N.小泛素样改性剂(SUMO)靶标的分析反映了蛋白群岛的基本性质,并提供了阐明SUMO在植物开发中的作用的洞察力。植物理性。2015; 169(2):1006-17。
- 10.
刘升,江y,张x,王x,王y,汉y,excipand g,金jb,searle i,fu yf等。拟南芥中生育能力需要与生育率1和2相关的两个Sumo蛋白酶Sumo蛋白酶。植物理性。2017; 175(4):1703-19。
- 11.
孔旭,席琳,曲桂平,彭丽,景建平。拟南芥SUMO蛋白酶ASP1通过调控FLC稳定性部分正向调节开花时间。acta botanica yunnanica(云南植物研究). 2017;59(1):15-29。
- 12.
刘丽,严欣,孔旭,赵颖,龚志,金建斌,郭勇。OTS1 SUMO蛋白酶维持转录基因沉默需要dna依赖的聚合酶v依赖途径。植物杂志。2017;173(1):655 - 67。
- 13。
关键词:盐胁迫,盐胁迫,泛素修饰酶,拟南芥植物细胞。2008;20(10):2894 - 908。
- 14。
林X,NIU D,Hu Z,Kim DH,Jin YH,Cai B,Liu P,Miura K,Yun D,Kim W.一种拟南芥Sumo E3连接酶,Siz1,通过促进COP1活性来负调节光血管血小胺。Plos Genet。2016; 12(4):E1006016。
- 15.
Sadanandom A,Ádámé,奥罗萨B,Vicziána,klose c,张c,josse e,Kozma-bognárl,植物f.植物植物的平均胁迫调节拟南芥拟南芥中的光诱导的信号传导。PROC NATL ACAD SCI。2015; 112(35):11108-13。
- 16。
Kim S, Park BS, Yeu SY, Song SI, Song JT, Seo HS。E3 SUMO连接酶AtSIZ1正调控sle1介导的GA信号转导和植物发育。j . 2015; 469(2): 299 - 314。
- 17。
关键词:赤霉素,SUMO,小泛素样修饰蛋白,植物生长调控Dev细胞。2014;28(1):102 - 10。
- 18。
徐P,袁D,刘M,李C,刘y,张S,姚n,杨c.atmms21,smc5 / 6复杂亚基,拟南芥根系中的干细胞育植物维持和DNA损伤反应。植物理性。2013; 161(4):1755-68。
- 19。
Zheng Y,Schumaker Ks,Guo Y.通过小泛素样改性剂E3连接酶Siz1介导拟南芥的脱落酸反应的转录因子MyB30的Sumoylation。PROC NATL ACAD SCI。2012; 109(31):12822-7。
- 20。
Benlloch R,Lois LM。植物的平等:机械洞察力及其在干旱胁迫中的作用。J Exp Bot。2018; 69(19):4539-54。
- 21.
Raorane M. L, Mutte, Sumanth K, Varadarajan, Adithi R, Pabuayon, Isaiah M, Kohli, Ajay。蛋白质平均和植物非生物应激信号:在硅壳中;水稻灼热,热冲击和CA2的研究+- 粘合蛋白质.植物学报2013;32(7):1053-65。
- 22.
Castro Ph,Rui Mt,Bejarano er,Azevedo H. Sumo,植物非生物应激反应的重量级球员。细胞mol寿命。2012; 69(19):3269-83。
- 23.
Rytz TC, Miller MJ, McLoughlin F, Augustine RC, Marshall RS, Juan Y, Charng Y, Scalf M, Smith LM, Vierstra RD. SUMOylome分析揭示了在热胁迫下由SUMO连接酶SIZ1修饰的不同的核靶标。植物细胞。2018;30(5):1077 - 99。
- 24.
关键词:SUMO蛋白酶,盐- 1,转录因子OsbZIP23,抗旱性植物j . 2017; 6(92): 1031 - 43。
- 25。
Mishra N,Sun L,Zhu X,Smith J,Prakash Srivastava A,Yang X,Pehlivan N,Esmaeili N,Luo H,Shen G.过表达在棉花中的水稻Sumo E3连接酶基因Ossiz1增强了干旱和耐热性,并大大降低灌溉和雨量条件下,改善现场纤维产量。植物细胞生理。2017; 58(4):735-46。
- 26。
Miura K, Jin JB, Lee J, Yoo CY, Stirm V, Miura T, Ashworth EN, Bressan RA, Yun D,长谷川总理。siz1介导的ICE1的sumoylation控制拟南芥CBF3/DREB1A的表达和抗冻性。植物细胞。2007;19(4):1403 - 14所示。
- 27。
张雪梅,张雪梅,张宁。拟南芥E3 SUMO连接酶SIZ1对植物生长和干旱的调控作用。植物细胞。2007;19(9):2952 - 66。
- 28。
sumo1和sumo2偶联物的积累在胁迫下增加,而sumo1和sumo2偶联物的积累在胁迫下增加。中国生物化学学报。2003;27(9):6862-72。
- 29。
在拟南芥中,蛋白质组学分析鉴定了一系列受小泛素类修饰物偶联影响的核过程。中国科学院院刊。2011;107(1):16512-7。
- 30.
Nabil E,George C.的小泛素样改性剂(SUMO)底物筛选(SUMO)底物鉴定拟南芥蛋白,其具有不同的生物过程。PROC NATL ACAD SCI。2010; 107(40):17415-20。
- 31.
Foncéka D, Hodoabalo T, Rivallan R, Faye I, Sall MN, Ndoye O, Fávero AP, Bertioli DJ, Glaszmann JC, Courtois b。植物学报。2009;9(1):103。
- 32.
Bertioli DJ, Cannon SB, Froenicke L, Huang G, Farmer AD, Cannon EKS, Liu X, Gao D, Clevenger J, Dash s落花生duranensis和arachis ipaensis.是栽培花生的二倍体祖先。Nat麝猫。2016;48(4):438。
- 33.
Kenta S, Bertioli DJ, Varshney RK, Moretzsohn MC, Leal-Bertioli SCM, Mahendar T, Pandey MK, Jean-Francois R, Daniel F, Gowda MVC。花生栽培亲缘与野生亲缘的整合图谱揭示了花生a和B基因组的结构落花生豆科植物基因组的分化。DNA研究》2013;20(2):173 - 84。
- 34.
史密斯bw。arachis hypogaea..气生花和地下果。[J] .中国生物医学工程学报,2000,37 (10):802-15 .]
- 35。
xi xy。花生花粉和胚囊囊的发展与结构(arachis hypogaea.l .)。BOT GAZ。1991; 152(2):164-72。
- 36。
关键词:胚珠,果实发育,形态学解剖arachis hypogaea.L. Ann Bot。1984; 53(3):399-411。
- 37。
陈X,杨q,李h,李h,hong y,pan l,chen n,zhu f,chi x,zhu w.转录组范围的测序为花生的Geocarpy提供了洞察力(arachis hypogaea.l .)。植物生态学报;2016;14(5):1215-24。
- 38。
Musingo Mn,Basha Sm,桑德斯Th,Cole RJ,Blankenship PD。干旱和温度胁迫对花生的影响(arachis hypogaea.L.)种子组成。J植物理性。1989; 134(6):710-5。
- 39。
崔飞,隋宁,段国华,刘艳,韩艳,刘爽,万胜,李国栋。花生盐胁迫与恢复相关代谢产物的鉴定。植物学报。2018;9:217。
- 40.
Singh AL, Hariprassana K, Solanki RM花生耐盐基因型的筛选与选择。作物学报,2008;1(3):69-77。
- 41。
李S,林M,王J,张L,林M,Hu Z,齐Z,江H,傅y,Xin D.对大豆雄性系统的调节,响应植物对植物感染和热休克。植物生长调节。2019; 87(1):69-82。
- 42。
李Y,王G,徐Z,李家,太阳M,Guo J,JI W.在非生物胁迫条件下的大豆雄性系统组织与调节。前植物SCI。2017; 8:1458。
- 43。
Augustine Rc,York S1,Rytz TC,Vierstra Rd。定义玉米的Sumo系统:雄月在胚乳开发期间上调并迅速引起压力。植物理性。2016; 171(3):2191。
- 44。
Chaikam v,Karlson DT。水稻苏幼苗体系的响应和转录调控在开发和压力条件下。BMB REP。2010; 43(2):103。
- 45。
赵Q,谢y,郑y,姜,刘开,mu w,刘z,zhao y,xue y,ren J.GPS-Sumo:一种预测Suboylation网站和Sumo-Interaction主题的工具。核酸RES。2014; 42(Web服务器问题):W325-30。
- 46.
罗莎MT,Almeida DM,Pires是,Da Rosa FD,Martiveira AC,De Oliveira Ac,Saibo NJ,Oliveira MM,Abreu Ia。探视水稻苏米野生蛋白酶的转录和转录后调节以及两种稻瘟病蛋白酶的作用。BMC植物BIOL。2018; 18(1):349。
- 47.
Castro PH, Bachmair A, Bejarano ER, Coupland G, Lois LM, Sadanandom A, Van Den Burg HA, Vierstra RD, Azevedo H.植物去umoylating蛋白酶ULP基因家族的修订命名和功能概述。J Exp Bot. 2018;69(19): 4505-9。
- 48.
陈志强,陈志强,陈志强,等。异源四倍体的发育转录组图谱arachis hypogaea..前植物SCI。2016; 7:1446。
- 49。
陈志强,陈志强,陈志强,等。非生物胁迫与代谢组学。Ann Plant修订版2018:61-85。
- 50.
朱茹非生物应激信号和植物反应。细胞。2016; 167(2):313-24。
- 51.
利用蛋白质修饰系统提高作物产量:重点研究SUMO蛋白酶。J Exp Bot. 2018;69(19): 4625-32。
- 52.
Hammoudi V, Vlachakis G, Schranz ME, van den Burg HA。在被子植物中,由全基因组复制和串联复制驱动蛋白质修饰因子SUMO的多样化。新植醇。2016;211(1):172 - 85。
- 53.
Knobbe AR, Horken KM, Plucinak TM, Eniko B, Heriberto C, Weeks DP。由应力特异性的小泛素样修饰物E2偶联的sumo化是生存所必需的衣藻reinhardtii在压力条件下。植物理性。2015; 167(3):753-65。
- 54.
赖俊,韩东,杨超。AtMMS21:连接DNA修复与根系发育。植物学报,2018;23(2):89-91。
- 55.
刘义,赖j,yu m,王f,张j,姜j,胡h,wu q,lu g,xu p等。拟南芥SUMO E3连接酶ATMMS21在细胞周期调节中解离E2FA / DPA复合物。植物细胞。2016; 28(9):2225-37。
- 56.
Castro ph,Azevedo H,Bachmair A,Bejarano ER,Zereand G,Lois Lm,Sadanandom A,Van Den Burg Ha,Vierstra Rd。植物脱水蛋白酶ULP基因系列的修订重述和功能概述。J Exp Bot. 2018;69(19): 4505-9。
- 57.
Hermkes R,Fu YF,NürrenbergK,Budhiraja R,Schmelzer E,Elrouby N,Dohmen RJ,Bachmair A,Zhameand G.拟南芥Sumo蛋白酶ESD4及其最近的同源els1。Planta。2011; 233(1):63-73。
- 58.
吴建军,林林,徐敏,陈鹏,刘东,孙强,冉磊,王勇。异源多倍体的同源表达偏性和表达水平优势芸苔栗鸟.BMC基因组学。2018;19(1):586。
- 59。
格罗弗ce,gallagher jp,szadkowski ep,yoo mj,鞭毛le,wendel jf。产后表达偏见和表达水平在各种多多合物中的优势。新植物。2012; 196(4):966-71。
- 60。
Bottani S,Zabet NR,Wendel JF,Vitia Ra。异聚倍数的基因表达优势:假设和模型。趋势植物SCI。2018; 23(5):393-402。
- 61.
夏华,赵超,侯丽,李安生,毕颖,安静,赵颖,万胜,王雪梅。花生雌蕊核的转录组分析揭示了荚早期发育过程中基因表达的整体重编程。BMC基因组学。2013;14(1):517。
- 62.
张勇,孙军,夏辉,赵超,侯丽,王波,李爱华,陈敏,赵胜,王小霞。花生光敏色素的特性及其在花生荚早期发育中的调控作用。《公共科学图书馆•综合》。2018;13 (5):e198041。
- 63.
孙y,王q,李z,侯l,戴s,刘W.暗与机械刺激下花生枸杞发育的比较蛋白质组学。J蛋白质组。2013; 12(12):5502-11。
- 64.
花生植株雌蕊发育中生长素模式的变化(arachis hypogaea.l .)。Ann Bot。1999; 83(3):235-42。
- 65。
Pattee He,Johns Eb,Singleton Ja,Sanders Th。成熟期间花生水果零件的成分变化。花生科学。1974; 1(2):57-62。
- 66。
Tang Z, Blacquiere G, Leus G. Clustal W和Clustal X版本2.0。生物信息学》2007。
- 67。
胡b,金j,guo a,张h,罗j,高g. gsds 2.0:升级的基因特征可视化服务器。生物信息学。2015; 31(8):1296-7。
- 68。
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 28(10):2731-9。
- 69。
Marco B,Stefan B,Andrew W,Konstantin A,Gabriel S,Tobias S,Florian K,Tiziano Gallo C,Martino B,Lorenza B. Swiss-Model:使用进化信息建模蛋白质三级和第四纪结构。核酸RES。2014; 42(Web服务器问题):W252。
- 70.
王Y,Tang H,Debarry JD,Tan X,Li J,Wang X,Lee T,Jin H,Marler B,Guo H. McScanx:一种用于基因同培和共同性的检测和进化分析的工具包。核酸RES。2012; 40(7):E49。
- 71.
Krzywinski M,谢德吉。电讯:对比较基因组学的信息审美。Genome Res。2009; 19(9):1639-45。
- 72.
Wankun D,Yongbo W,Zexian L,Han C,Yu X. Hemi:用于说明热插拔的工具包。Plos一个。2014; 9(11):E111988。
致谢
感谢马登超教授在田间植物栽培方面的帮助。
资金
这项工作得到了国家自然科学基金(31401034/3170101067/31871665)到FC,YL和GL的支持。GL由Taishan Scholar计划(No.TSQN20161058)和SaaS的创新计划提供支持。YL和GL承认山东科技部门的基础(ZR2017YL016 / 2017LZN035)的支持。资金机构在研究和收集,分析和解释方面没有在数据和书面撰写手稿中的设计中发挥作用。
作者信息
隶属关系
贡献
YL和JZ进行了分析和实验室测定并写了稿件。ZP和SS进行了系统发育分析和RNA-SEQ分析。FC,YH和XZ提供了对Western印迹分析的帮助。GL和SW构思和设计了实验,促进了项目,并协助稿件准备。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
花生SUMO系统基因的基因结构。蓝框表示外显子,单线表示内含子。基因模型按比例绘制,如下图所示。
附加文件2:图S2。
来自花生的Sumos的序列对齐。使用软件集群X 2.0进行ADSUMO1 / 2/3 / 4,AISUMO1 / 2/3 / 4,ADSUMO-V和AISUMO-V序列对准,并用Genedoc编辑对齐。灰色和黑色盒子分别识别类似和相同的氨基酸。破折号表示缺口。
附加文件3:图S3。
花生和其他植物的sese序列比对。SAEs (E1)蛋白序列拟南芥那Zea Mays.那奥雅萨苜蓿,花生和大豆用于通过Mega 5中的邻近方法构建系统发育树。
附加文件4:图S4。
AdSCE1a与AiSCE1a序列比对分析。
附加文件5:图S5。
SUMO连接酶SIZ1型蛋白序列比对。SAP、PHD、MIZ/SP-RING结构域、PINIT和SXS motif在序列上方用蓝线表示。每个多肽都有残基数。灰盒和黑盒分别识别相似和保守的氨基酸。破折号表示缺口。
附加文件6:图S6。
Sumo连接酶小型蛋白序列的对准。MIZ / SP-环形域和SIMS按蓝线序列上方表示。每个多肽都有残基数。灰盒和黑盒分别识别相似和保守的氨基酸。破折号表示缺口。
附加文件7:图S7。
SUMO连接酶MMS21型蛋白序列比对。SP-RING结构域在序列上方用蓝色裸区表示。每个多肽都有残基数。灰盒和黑盒分别识别相似和保守的氨基酸。破折号表示缺口。
附加文件8:图S8。
花生SUMO蛋白酶家族的序列比对。C48肽酶结构域的范围在序列比对的上方用蓝色线表示。每个多肽都有残基数。灰盒和黑盒分别识别相似和保守的氨基酸。破折号表示缺口。
附加文件9:表S1。
本研究中SUMO通路成分的氨基酸序列。
附加文件10:表S2。
Sumo途径基因的RNA-SEQ数据在花生中。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘永强,朱军,孙绍。等等。确定SUMO系统在花生荚果发育和非生物胁迫中的作用。BMC植物BIOL.19,593(2019)。https://doi.org/10.1186/s12870-019-2136-9
收到了:
公认:
发表:
关键词
- 花生
- Sumo途径
- SUMOylation
- 豆荚发展
- 非生物胁迫