摘要
背景
番木瓜是一种三种植物,具有由性染色体确定的遗传性别系统。在不利的环境条件下,雄性和雌雄同体表现出性逆转。以往的基因组研究表明,该物种的性别分化候选基因很少。然而,木瓜性花器官发育的机制仍需进一步研究。
结果
本研究的目的是鉴定在木瓜花发育的早期(减数分裂前)和后期(减数分裂后)的雄性、雌性和两性花之间的差异表达基因。用RNA-seq评价差异表达基因的表达,RT-qPCR验证结果。根据这些基因与其他植物同源基因的同源性和表达模式,分析了它们的可能功能。我们鉴定了一个雄性不育1基因(CPMS1.)与女性花蕾相比,在雄性和雌雄同的花蕾中高度调节,其在小雄花芽(3-8毫米)中表达,并且由于其对MS1的同源性,这可能在雄性花器官发展中发挥重要作用以前在其他植物中鉴定的基因。这是第一项研究,其中在番木瓜中报道了在花药发育途径中与Tapetum发育有关的基因的性偏见表达。除了与花器官开发和开花时间调节相关的重要转录因子外,我们鉴定了已知参与ABA,ROS和生长素信号传导途径的基因的差异表达(ABA-8-羟基酶,AIL5,乐观1,VAN3结合蛋白)。
结论
CPMS1.在早期阶段的番木瓜雄性和雌雄同体中表达,表明该基因可能参与雄性花器官开发过程,然而,该基因不能被认为是性别测定基因。由于其与其他植物MS1蛋白质的同源性及其表达模式,我们假设该基因参与花药和花粉发育,下游性别规范。番木瓜中的进一步基因功能表征研究是确认这一假设所必需的。ABA和ROS信号传导途径在木瓜花开发中的作用也需要进一步探索。
背景
被子植物的单性花分为雌雄同株和雌雄异株。雌雄同株的植物在同一个体上有雌花和雄花(6%的被子植物物种),而雌雄异株的植物在不同的个体上有雌花和雄花(5%的被子植物物种)。雌雄异株植物可以通过三个主要步骤从雌雄同株或雌雄同株种群进化而来[1那2].首先,发生了隐性雄性不育突变原雌株。这种突变的发生将人口是有利的,因为雌性植物可以通过来自不同群体的个体,减少近亲繁殖和种群内增加了遗传变异授粉。后来,第二显性女性不育突变出现在雌雄同株异花群中产生雄株。随着时间的推移,一对染色体中,这些突变发生停止重组,并开始积累突变和重复元素。重组停止,因为有两个突变的个体将成为完全无菌的,占人口没有优势。最后,携带这些突变的染色体成了一对不同的性染色体[1那2].
性染色体是雌性植物中最熟练的性别测定系统之一,并且已经在许多植物种类中鉴定了几个性别染色体阶段[2那3.].其中一些物种被认为是研究雌雄异株植物性别决定和性染色体进化的重要模式,包括木瓜(卡里卡番木瓜)[4.].然而,木瓜被认为是三种种,这意味着木瓜种群的个体可以有雄性、雌性或雌雄同体的花[5.].天然番木瓜种群是雌雄异株的,而栽培种群是雌雄异株的。在木瓜中,性别是由一个最近的性染色体系统决定的,它有三个不同的性染色体(X, Y和Y)H).雌性植株的X染色体是纯合的(XX),雄性和两性植株的X染色体是杂合的(XY和XY)H, 分别) [6.那7.].在X和Y之间H染色体,已经确定了几种差异,可以解释雌雄同体和雌性植物之间的表型差异[7.].相反,Y和YH染色体已被描述为高度相似(99.60%)[6.那8.因此,要解释在雌雄同体植物和雄性植物之间观察到的差异是什么导致了它们的表型一直是一个挑战。
尽管在所有这三种性染色体中发现了遗传差异,但黄瓜植物中的花卉发育在其早期阶段非常相似。男性,女性和雌雄同体花卉开发开始在男性和雌雄同体花的花药发生后分化[9.那10.].这些花之间的一个主要区别是雄花中存在一个被称为“雌蕊”(或退化雌蕊)的矛状结构,而不是像雌雄同体和雌花中存在的功能性雌蕊[9.那10.].因此,认为有一个雌性不育显性突变抑制雄花的心皮发育,该突变在Y染色体上存在,而在Y染色体上不存在H染色体。由于Y和YH染色体高度相似,大多数检测到的遗传差异或突变位于内含子而不是外显子上[6.那8.[雌雄同体植物中的差异雌性癌症,不受在雄性植物中的差异雌蕊的发育是性别类型之间的Carpel发育抑制基因的差异表达的结果。同样,女性花没有雄蕊,但男性和雌雄同体花费[9.那10.].因此,认为具有雄性促进功能的基因位于Y和Y上H染色体。
番木瓜植物的一个有趣方面是,在某些环境条件或刺激(例如,高或寒冷的温度,较短的日子长,水分胁迫和末端芽损伤),雄性和雌雄同体植物可以切换他们的花卉性别[11.那12.那13.那14.那15.那16.].这种现象被称为“性逆转”,显然影响了木瓜果实的产量,因为在不理想的环境条件下,雌雄同体要么变成雄性,要么呈现雄蕊心皮(雄蕊类似心皮或与心皮“融合”的情况),导致畸形的木瓜果实无法出售[10.那17.那18.那19.].有趣的是,雌性植物不会像雄性和雌雄同体植物那样遭受性逆转。因此,确定正确表达番木瓜性别或性花器官发育的基因及其表达调控机制是番木瓜生产的基础。
为了确定在木瓜花中负责正确表达性别的基因,先前的研究人员观察了参与花发育ABC模型的同源性基因的表达。木瓜性别差异表达基因及MADS-box基因调控花发育的研究报道较少[16.那20.那21.那22.那23.那24.].最近,一个数字转录组分析了位于X和Y上的基因H番木瓜中的染色体使用高通量的超越技术与雄性和雌雄同体植物之间的全基因组序列比较鉴定了一种短暂的营养阶段(SVP)基因和摩尔山酸盐还原酶(MDAR)基因,作为木瓜性别测定的候选者[23.那25.].此外,最近的一项利用rna测序的转录组分析表明,在雄性到雌雄同体诱导的性逆转植物中,表观遗传修饰(miRNAs)沉默了心皮抑制功能[16.].最近的一项研究,提出了三种候选性相关的基因座,包括短期营养阶段(SVP)基因和染色质组合因子1亚基A样(CAF1AL),如替代剪接的纸质番木瓜中的正确花卉发育使用不同的花螺纹的差异表达分析[26.].然而,目前还没有发表的比较转录组分析,侧重于利用rna测序分析木瓜不同的开花发育阶段,包括所有三种不同性别类型(包括雄性、雌性和两性花)。因此,对木瓜花发育调控机制、雄花心皮发育抑制机制、两性花雄蕊心皮发育机制以及仅在雄性和两性花中出现的性逆转现象,还需要进一步分析。
RNA测序或RNA-SEQ包括用于研究转录om的高通量DNA测序技术[27.那28.].RNA-SEQ已被描述为发现新型转录物和模型和非模型植物物种中基因表达的量化的一种非常强大的工具,最终导致鉴定有助于的差异表达基因,途径和监管网络了解生物过程。因此,在开花过程中不同发育阶段的所有三种不同性别类型中的花蕾的差异基因表达分析可以有助于找到与正确性表达相关的差异表达基因,并更好地了解木瓜中的花器官发展调节。本研究的目的是在使用RNA-SEQ的花卉发育的早期和后期和后来阶段鉴定古草蛋白,葡萄鱼中的雄性,女性和雌雄同体花蕾的基因,并通过RT-QPCR评估高差分表达基因的表达并且,基于与其他植物物种的同源性及其表达模式来确定这些基因的推定功能。
结果
RNA-SEQ之前的质量控制和差异表达分析
在两个不同的发育阶段(减数分裂前:1 - 6mm和减数分裂后:7 - 12mm),我们对雄性‘AU9’、雌性‘AU9’和两性‘SunUp’的木瓜花蕾的转录组进行了测序7.:表S1)。平均而言,获得了每个库的2.28E + 07原始读取(附加文件7.:表S1)。通常,RAW读取的质量被FASTQC程序归类为良好。尽管如此,在修剪低质量的读取和适配器后,平均为99.71%的原始读数,平均长度为100bp。这些高质量的读数与木瓜基因组对齐。平均而言,每张文库的总共83.99%唯一对基因组对齐,并且很少有读物未对齐或对齐到基因组(附加文件7.:表S1)。平均而言,46.08%的读取与基因组对齐的读数被分配给外显子(附加文件7.:表S1)。reads归一化后,在差异表达分析之前,对样本进行聚类,并计算生物变异系数,作为我们质量控制分析的一部分(附加文件)1:图S1)。样本分为三组,一组由正常和畸形的品种“中黄”雄性组成,第二组由雌性“AU9”样本组成,第三组由雄性“AU9”和雌雄同体的“SunUp”样本组成。这些结果表明,雌性减数分裂前阶段与雌性减数分裂后阶段差异较小,雄性减数分裂前阶段与两性减数分裂后阶段差异较小。未发现混杂批效应,计算出的生物变异系数趋势与计算出的共同趋势相差不远(附加文件)1:图S1)。因此,差异表达基因分析采用归一化表达值。
利用RNA-Seq分析差异基因表达
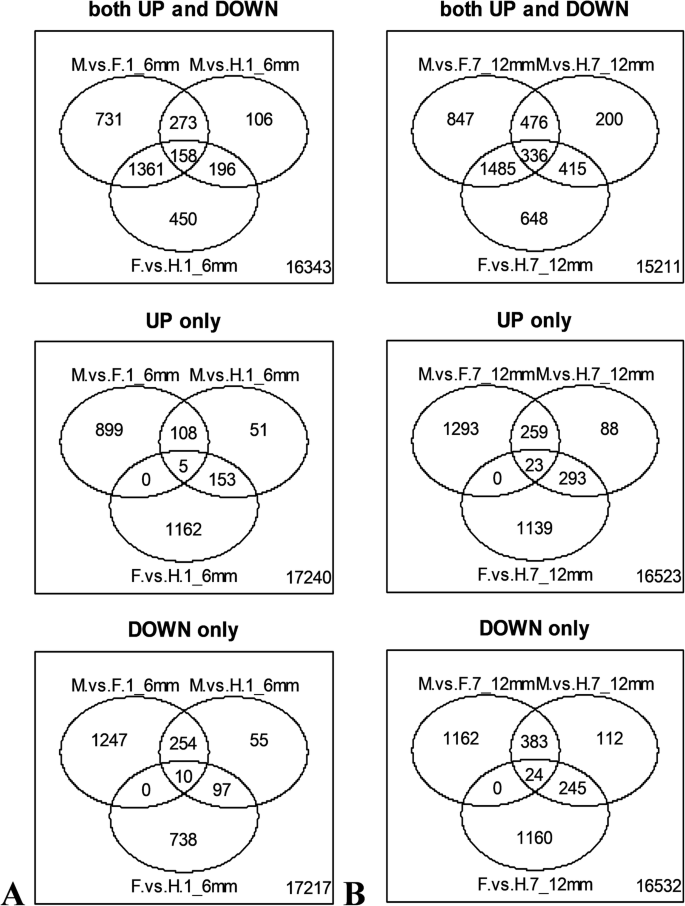
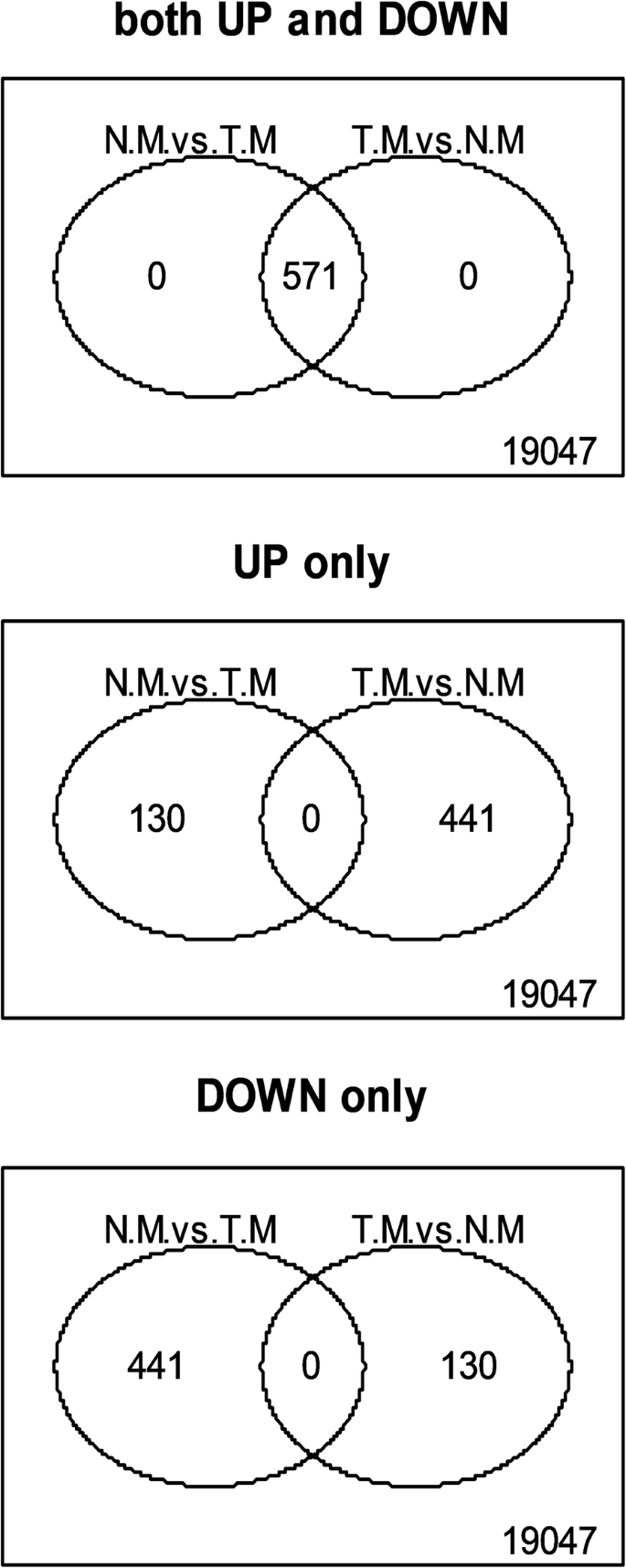
从19618年的共分析基因中,许多人被发现在群体之间进行差异表达。总共2523个基因在雌雄和雌雄同的花蕾的尺寸为1-6mm,733的血管和雌性花蕾的血管和雌性花蕾之间差异表达2523个基因在雌雄同体和雌性花蕾之间的血管和雌雄同的花蕾之间的较大1-6mm和2165之间1-6毫米(图。1一种)。然而,差异表达基因的数量增加了大小为7-12毫米的花蕾。总共,3144个基因在雌雄和雌性花蕾的血型和雌性花蕾的较大7-12mm,1427之间的血型和雌性花蕾之间差异表达,雌雄同体和雌性花蕾的雌雄同的花蕾尺寸为7-12mm和28847-12 mm(图。1b).只有571个基因在正常雄性和畸形雄性(雄性向雌雄同体性逆转)雌蕊中有差异表达(图。2).总体来看,雌雄花芽间或雌雄同体与雌性花芽间的差异表达基因数量高于雌雄同体花芽间的差异表达基因数量。
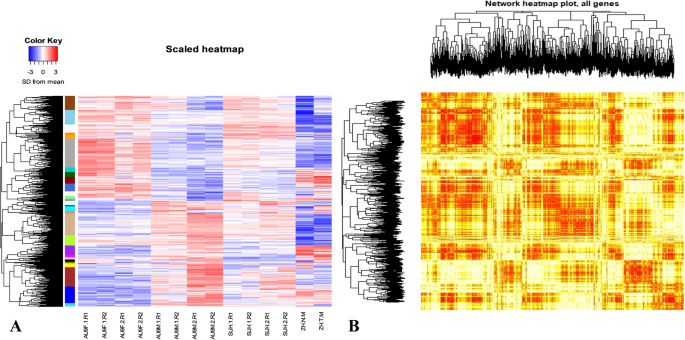
由于本研究的目标是鉴定候选基因,以纠正男性,女性和雌雄同体之间的正确性表达,并促进番木瓜在不同性类型中的花卉发育调节的理解,只有往外表达的男性,女性和雌雄同体之间的基因选择正常雄性和畸形男性样品之间的芽和差异表达以进一步分析(总共2117个基因)。构建缩放的热线图以比较不同样品中这些基因的表达(图。3.a).在热图中,上调的基因用红色表示,下调的基因用蓝色表示。颜色模式显示不同性别的样本之间表达差异明显,而同性的不同阶段的样本之间表达差异较小(图2)。3.一种)。基于这些颜色,女性和男性样本之间存在对比,其中两种大群基因似乎在女性中过度表达,但在男性中下调或在男性中过度表达但在女性中下调。这种清晰的模式在雌雄同体样本中不明显。在雌雄石样本中,一半的基因在女性中上调,但在雄性中下调似乎上调,而另一半似乎下调,并且似乎是在雄性中上调但在女性中下调的基因的情况。热线图还揭示了少量基因,显示出畸胎和正常的阳阳脂样品之间的对比表达。还建立了汤姆(拓扑重叠矩阵)图,以了解番木瓜花发育中所涉及的基因网络的复杂程度(图。3.b).在该图中,具有相似表达模式的基因用红色表示,而没有相似表达模式的基因用黄色表示(图2)。3.b)。该图中所示的颜色模式揭示了许多可能是类似途径的一部分的基因或模块的一部分,以及用于花发育的基因网络的高水平复杂性。
基因本体分析和过度代表结果
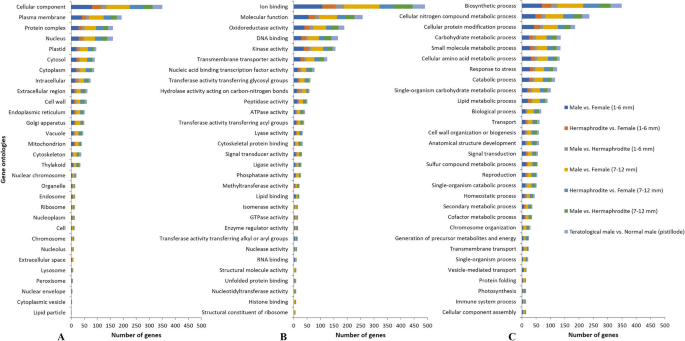
分析了2117个选定基因的基因本体注释,并根据其GO期分类为三类:分子函数(MF),生物过程(BP)或细胞组分(CC)。总共2081个序列在MF类别中分类为2632,在CC类别中的1736类(图。4.).最丰富的细胞成分术语是质膜、蛋白质复合物和细胞核(图。4.a).最丰富的分子功能项是离子结合活性、氧化还原酶活性、DNA结合活性、激酶活性和跨膜转运蛋白活性(图)。4.b)。最丰富的生物过程术语是对生物合成过程,氮代谢,蛋白质修饰,碳水化合物代谢,氨基酸代谢,应激反应,分解代谢过程和单一生物体碳水化合物过程(图4.C)。数字4.A,B和C还显示了来自在样品组中的所有单独比较的每个注释类别发现的差异表达基因的百分比(在图中的比较中指示了比较)。
在生物学过程中:发现发育过程,繁殖和胚胎发育基因注释(图。4.C)。在此最后类别中,与花开发过程和花器官身份相关的基因被发现为差异表达(表格1那2和3.),并将作进一步讨论。没有一个基因被映射到现有的木瓜性染色体序列(X, Y或YH),这意味着在这项研究中发现的性别类型差异表达的基因并不是决定番木瓜性别的最终因素,而是可能有助于正确的性别表达或性花器官的发育。有趣的是,在雄性、雌雄同体和雌性花蕾之间表现出最高倍数变化的基因是' evm.model.supercontig_2.119 ',经鉴定为PHD型植物同源结构域蛋白(PHD finger protein male STERILITY 1)(表2)1和2).
过度代表的基因本体(GO)SLIM术语(P.值< 0 05;FDR < 0,05)使用样本组之间每对比较的差异表达基因列表进行分析(附加文件2:图S2,附加文件3.:图S3和附加文件4.:图S4),以确定花发育的差异(所有性别类型中都有)和正确的性别表达的重要途径。结果,常见的被认为代表过多的细胞成分术语有:膜的整体和内在成分;微管及微管相关复合物;核;高分子细胞骨架纤维;超分子复合物和纤维;超分子复合物、纤维和聚合物(附加文件2:图S2,用蓝色表示)。然而,在细胞组成项中被高度代表的是:叶绿体类囊体膜;植物型液泡和质体血红蛋白(附加文件2:图S2,红色部分)。常见的分子功能术语有:跨膜转运蛋白活性;腺苷三磷酸酶活动;催化活性;裂合酶活动;氧化还原酶活性;和传输器活动(附加文件3.:图S3,以蓝色显示)。高度超代表的分子函数术语是:酰胺跨膜转运蛋白活性;ATP依赖性微管运动活性,肽和寡肽跨膜转运蛋白活动(附加文件3.:图S3,红色部分)。常见的生物过程术语被确定为代表过多:基于微管的运动;对含氧化合物的反应;和小分子代谢过程(附加文件4.:图S4,以蓝色显示)。高度过度代表的生物过程术语是:无机阴离子跨膜运输;jasMonate介导的信号通路;防御反应的调节,对刺激,应激,信号转导,热性和伤害的反应(附加文件4.:图S4,红色部分)。这些结果表明,参与应激条件、含氧化合物和外部刺激反应相关过程的差异表达基因,与跨膜转运和氧化还原酶活性相关的分子功能可能对木瓜花的发育和正确的性别表达具有重要意义。
RT-QPCR表达分析CPMS1.
由于“evm.model.supercontig_2.119”或CPMS1.基因在花发育早期和晚期的性别类型中表现出最高的Fold Change (FC),我们也检测了模式植物中调控雄性不育1表达的基因的表达4.),CPMS1.通过QPCR在雄性花蕾中验证过表达,并探讨了该基因的其他特征。
通过qPCR方法获得了PHD指蛋白MALE STERILITY 1的相对表达量或Fold Change (FC),并比较了不同性别间的差异。有趣的是,这种雄性不育基因(CPMS1.)未在雌性,雌雄岩或雄性植物的叶片组织样品中扩增;这表明其表达是特异性的花(组织特异性表达)。此外,该基因仅在雌雄同体'Sunup'和雄性'AU9'花中扩增,这使其对具有雄性花器官的植物的表达,因此表明其参与番木瓜的男性花器官发展。评价表达的CPMS1.通过RT-QPCR显示它与雌雄同花朵相比,它在雄性花中调节(图。5.a),这可以通过雌雄同体所需的RNA提取所需的不同数量的花芽来解释,这是由于雌雄同花芽(较大)和雄性花蕾(较小)甚至由于组成每个样品的花蕾的发育阶段的差异。没有放大CPMS1.在任何女性花样中检测到基因,支持RNA-SEQ结果和CPMS1.参与雄花器官发育。
关于CPMS1.表情木瓜男性不同大小的花蕾,花蕾的基因表达显著上调3 - 8毫米,但没有明显上调小花蕾(1或2毫米),成熟的花蕾(从9到35毫米)或花器官从开雄花(花瓣、萼片或花药)(图。5.b).由于雌雄同体植物缺乏代表所有这些不同发育阶段(1至35毫米)的花蕾材料,无法对雌雄同体植物的花蕾和雄蕊进行详细的比较。无论雌雄同体花蕾的缺乏为本分析,表达CPMS1.根据先前的转录组分析(表格)未被认为在雄性和雌雄同体花芽之间显着差别(表1和2).
CPMS1.:同源性分析和基因组位置
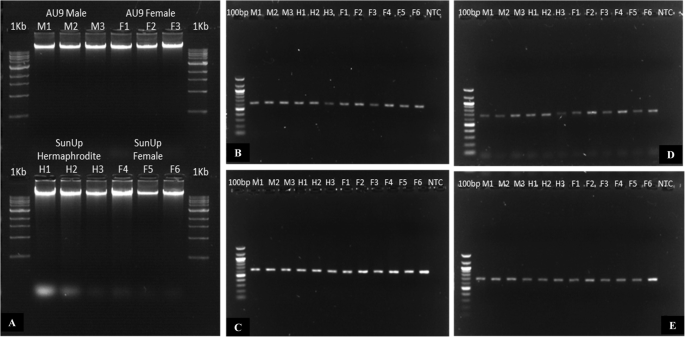
PHD指蛋白雄性不育1 (CPMS1.分析了雄性不育1基因与其他物种雄性不育1基因的差异,并对其在具有雄性器官的木瓜花中的特异表达进行了分析,探讨了其在木瓜基因组中的位置。CPMS1.包含一个独特的PHD锌指基序(Cys4-His-Cys3),位于氨基酸位置605和653之间。该蛋白与其他被子植物中克隆的MS1蛋白高度同源:拟南芥(ATMS1身份)(53.18%),奥雅萨苜蓿(osms1.)(45.17%的身份),Hordeum Vulgare.(HvMS1)(43.80%同一性)和Capsicum annum.(CaMS1(29.33%同一性)(图。6.),这些功能已经有了很好的特征。该基因位于常染色体(木瓜染色体02)上,利用cDNA和基因组数据未发现该基因在木瓜基因组上的其他位点。然而,在木瓜中鉴定到一个同源蛋白:PHD Finger MALE MEIOCYTE DEATH 1 (' evm.model.supercontig_87.13 ')或CpMMD1(图。6.),大小在1-6 mm的雄花和雌花,雌雄同体和雌花7-12 mm之间也有差异表达(表)1和2),根据之前的转录组分析。然而,CpMMD1没有群体与其余的MS1蛋白,这表明它可能具有比来自的功能不同CPMS1.(图。6.).不幸的是,CPMS1.基因未被归类为性别测定的候选者,因为它使用来自三种不同性别类型的基因组DNA扩增,这意味着该基因未位于Y染色体上(图。7.),尽管它的表达具有性别倾向性(特异性于雄性和两性花),而且其基因组序列在性别类型之间没有差异。
花药开发途径基因的共表达网络
利用所有差异表达基因构建共表达相关网络,并从中提取子网络(附加文件)5.:图S5)使用CPMS1.基因,鉴定为已知调节MS1的表达的基因的基因。拟南芥(表4.)他们在总基因网络中的第一个最接近的邻居。此相关子网具有287个节点和4127个边缘,包括4个相关基因的4个群集(附加文件5.:图S5)。第一组是最大的,它包括了209个节点和3462层的边缘。这个集群还包括CPMS1.基因,以及转录因子的矫形器:孢子芯无胶质/喷嘴(SPL / NZZ),绦虫发育和功能1的缺陷和中产孢子。第二簇包括转录因子的正性质:激发菌(PI)和Apetala 3(AP3),它们之间的正相关。第三簇包括蛋白质clavata1(CLV1),第四簇包括转录因子功能障碍Tapetum(Dyt)。通过分析该子网中发现的所有基因的生物过程注释的过度表示(附加文件6.:图S6),发现了具有最高持久性最高的类别:细胞组件组件涉及形态发生,花粉发育,花粉壁组件,外部封装结构组织,花粉外部形成和孢子醇生物合成过程(附加档案6.:图S6)。
讨论
在番木瓜花性别类型的早期和晚期发现了差异表达基因。雌雄花或雌雄花与雌花间差异表达基因数量高于雌雄花间差异表达基因数量。雄性和雌雄同体的植物在基因上是相似的,都有相似的Y染色体;这可以解释在它们的花中观察到的类似的基因表达模式[6.那8.].此外,在发育的早期阶段,类似的表达模式是有意义的,因为在花药发育之前,雄花和两性花的发育非常相似[9.那10.].然而,差异表达基因数量的最新发展阶段几乎翻了一番相比,男性和雌雄同体的植物,这有可能解释性别类型中观察到的差异之间的早期发育阶段。
花药发育途径中的差异表达
本研究的主要发现是雄性不育1基因(CPMS1.)与雌性花蕾相比,男性和雌雄同体花蕾的高度调控,组织(仅花蕾)和特异性发育(在3至8mm的雄性花蕾中表达)表达。由于此基因的差异表达尚未在番木瓜花芽中尚未讨论其调节并讨论该基因的特征。木瓜博士手指蛋白雄性不育1(MS1),同源于拟南芥,辣椒粉,米饭和大麦MS1蛋白质。该基因属于Phd-Finger族转录因子。在植物中,PHD(Planthomeodomain)转录因子家族被描述为几种植物开发过程,例如花粉成熟,胚胎分类启动,根影发育,萌发和开花时间控制。It is still unknown what is the specific function of this transcription factor in papaya flowers or its regulation mechanism, but proteins with a PHD motif act as epigenomic effectors, which means that they recognize and bind to histone modifications (e.g. histone methylation), and as a result they activate or repress genes [29.].这种蛋白在木瓜中的功能知之甚少,但它在其他被子植物中是一个研究得很好的基因。在拟南芥,此基因(ATMS1)被描述为调节雄性配子的转录因子,至关重要的花药,花粉和绒毡层发育和它表达了简要孢子在绒毡层细胞,只是孢子释放之前[30.那31.那32.那33.那34.].在MS1 Arabidopsis.突变植物,Tapetum不会正确形成,它异常退化,并且花粉细胞壁发育受到影响;因此,植物被描述为雄性无菌,因为它们的花粉不可行。该表型表明MS1可以改变参与参与花粉细胞壁发育和塔皮特编程细胞死亡(PCD)的塔皮特基因的转录[34.].由MS1调节的基因被认为参与花粉细胞壁和涂层形成,但该基因还调节参与花粉生产和孢子醇蛋白生物合成的转录因子,以及某些酶(半胱氨酸蛋白酶)[33.].该基因在拟南芥结果植物显示出延迟开花,开花茎,增加数量的分支和扭曲器官的植物,肥力降低[33.].MS1基因的同源性拟南芥已被描述在其他植物品种:大麦(HvMS1)[35.], 白饭 (osms1.)[36.]和红辣椒(CA05g06780) [37.],所有功能都有类似的功能。因此,我们假设这一点CPMS1.可能在木瓜有类似的功能,因为它与其他植物物种的基因MS1的同源性,但需要更多的研究来检验这个假设。
重要的是要提及其他植物种类,如花园芦笋(芦笋officinalis)及猕猴桃(猕猴桃SPP。),已发现与早期花药开发和雄性不育有关的基因,作为性别决定的特定候选者[38.那39.那40那41.].在芦笋中,雄性花蕾的转录组分析显示了患有花粉微孔和绦虫发育的几种基因的雄性偏见表达[40].鉴定芦笋中表现偏倚表达的差异表达基因,可以确定花药发育途径中可能受性别决定基因影响的最早点。Harkness et al.(2015)研究发现,芦笋小孢子成熟基因在雄性和超雄性植株中表达上调,而在雌性植株中表达下调。后来,一个仅在芦笋雄花芽中表达的myb样基因被鉴定为雄特异性表达1 (male SPECIFIC EXPRESSION 1, MSE1),被认为是决定性别的基因[38.].该基因对塔皮特发育和功能1(TDF1)或MYB35基因的缺陷同源拟南芥,它位于芦笋Y染色体中[38.那41.].在猕猴桃中,一种类似束状蛋白的基因被称为友好的男孩(弗拉丁)已被确定为一种决定性别的基因[39.].该基因在花药发育早期绒毡层细胞中强烈表达,被认为有助于程序性细胞死亡(PCD)后绒毡层的降解,该基因也位于猕猴桃Y染色体上[39.].尽管观察到男性和雌雄同体的偏倚表达模式CPMS1.基因,发现该基因为常染色体,不具有Y特异性(存在于男性或两性Y染色体中),不能作为确定木瓜男性性别的候选Y特异性基因。
相反,我们假设该基因在花发育早期的雄花器官发育中发挥着重要作用,如花药、花粉和绒毡层的发育,并在性别鉴定的下游发挥作用。在共表达相关子网络中,花药和花粉发育相关生物学过程的过度表达支持了我们的假设。此外,已有报道称,在木瓜雄花中,花粉开始在0.6厘米(6毫米)大小的花蕾花药中发育,在0.7厘米和0.85厘米(7至8.5毫米)大小的花蕾中已经发现了四分体[42.].此时段与表达模式重叠CPMS1.(3至8毫米)。此外,番木瓜的花粉发育已被描述为在各种花粉生产花中的同样的速度上进展,始终如一地与其他植物的花粉发育[43.那44.];因此,上调CPMS1.在新出现的花药中可能需要在小花芽中进行Tapetum和花粉发育。尽管如此,需要更多的研究来确定确切的作用CPMS1.在木瓜雄性花器官发育中发挥作用,以及在网络中发现的与MS1表达相关的其他基因。
在拟南芥,男性花器官开发已被广泛研究,涉及以空间/时间方式表达的转录因子的复杂网络相互作用[45.].雄性不育1 (MALE STERILITY 1, MS1)是参与该网络的最后几个转录因子之一,参与绒毡层发育和花粉细胞壁合成的后期阶段[33.].重要的转录因子已报告采取行动的上游对花药细胞规范MS1,如AGAMOUS(AG),SPOROSYTELESS / NOZZLE(SPL / NZZ),SEPALLATA 3(SEP3),几乎没有任何MERISTEM 1(BAM1),几乎没有任何MERISTEM2(BAM2)和过量MICROSPOROCYTES1 / EXTRA造孢细胞(EMS1 / EXS)45.].在这些转录因子中,仅鉴定为SPL / NZZ('EVM.model.supercontig_12.16')的同源基因被鉴定为雄性和雌性和雌雄同的木瓜花蕾(表4.).SPL / NZZ基因拟南芥编码与MADS-box转录因子相关的核蛋白,MADS-box转录因子是产生大多数花药细胞和调节小孢子发生所必需的[46.那47.].
MS1上游的其他转录因子参与Tapetal发育,如功能障碍Tapetum 1(DYT1),塔皮特开发和功能1(TDF1),中止的micropores(AMS)和MYB80有缺陷45.那48.那49.].在这些转录因子中,与DYT1 (' evm.model.supercontig_871.3 ')、TDF1 (' evm.model.supercontig_871.3 ')的同源基因。u .contig_28309.2 ')和AMS的两种不同亚型(' evm.model.supercontig_20.94 '和' evm.model.supercontig_20.95 ')在雄性和雌性以及雄性和雌雄同体的木瓜花蕾之间均有差异表达(表1)4.).在拟南芥, DYT1编码一个基本的螺旋-环-螺旋(bHLH)转录因子,作用于SPL/NZZ的下游和TDF1、AMS和MS1的上游[50.那51.].该转录因子在绒毡层发育过程中对绒毡层基因调控至关重要,有报道称它与其他bHLH和MYB转录因子相互作用[50.那52.].在拟南芥,TDF1编码Tapetal开发所需的R2R3 MyB转录因子,该转录因子直接由Dyt1调节并按上游AMS [51.].在拟南芥,AMS是一个的bHLH蛋白,其功能下游DYT和上游MS1和它是花粉发育和花粉细胞壁合成[必不可少53.那54.].值得一提的是,在Y染色体上的两个不同倒置中已经鉴定出了两个MYB转录因子[6.那7.]但是,这些转录因素是否参与木瓜花药开发的任何步骤仍然未知。
总的来说,之前的结果表明CPMS1.在雄性和两性花芽中观察到的过度表达可能是复杂的级联调控的结果,由一个作为雄蕊促进因子的Y特定基因调控,这是植物性染色体进化理论假设的。需要更多的研究来确定番木瓜中促进男性功能的性染色体上的性别决定基因。
其他基因在不同的番木瓜性别类型中有差异表达
Among the differentially expressed genes annotated as participating in development, reproduction, and embryo development processes between male and hermaphrodite flowers at early stages, we found ABA-8-hydroxylase 1 (‘evm.model.supercontig_1525.1’), which was overexpressed in male flowers, and ABA-8-hydroxylase 4, which was overexpressed in hermaphrodite flowers (‘evm.model.supercontig_49.19’). Interestingly, the same hydrolases were differentially expressed between normal and teratological male-to-hermaphrodite pistillode, being ABA-8-hydroxylase 1 overexpressed in the normal male and ABA-8-hydroxylase 4 overexpressed in teratological male (male-to-hermaphrodite induced plants). Abscisic acid (ABA) is a well-known phytohormone that is involved in the regulation of several plant developmental processes, including seed dormancy and germination, adaptation to environmental stress conditions, mediation of stomatal closure, senescence and flowering time. In拟南芥,ABA通过诱导Gigantea(Gi),致态(CO)和开花基因座T(FT)的上调来诱导开花(DE反应)。55.]通过诱导开花基因座C(FLC)的上调来抑制开花[56.那57.].在terestingly, in male flower buds of a size of 7–12 mm, a GIGANTEA (GI) gene (‘evm.model.supercontig_26.81’) was up-regulated significantly compared to female flower buds, while in hermaphrodite flower buds of a size of 7–12 mm, a GIGANTEA-like gene (‘evm.model.supercontig_26.82’) was up-regulated significantly compared to female flower buds.
在雄性和两性花后期差异表达的基因中,我们发现了几个转录因子。一个转录因子(` evm.model.supercontig_18.81 `)在两性花中较雄花早期过度表达。该转录因子属于bHLH转录因子家族,已被描述为调控过氧化物酶的表达,过氧化物酶间接决定了根分生组织细胞分化或增殖的活性氧浓度拟南芥[58.那59.].ROS是已知积累响应于应力和是重要的信号传导分子,细胞分裂和分化的植物中调控[60.].ROS也被描述参与植物的不同发育过程,如程序性细胞死亡(PCD)、种子萌发、根生长和根毛发育、花粉管生长和叶发育[61.].在橄榄(齐墩果欧洲公司雌雄同体花,ROS (H2O.2据据报道,否)据报道,以发育依赖性方式在生殖组织中积聚,具有巨大存在的柱头和花药,其在分化过程中可能通过高代谢活性和细胞扩张来解释[62.].
其他转录因子在雌雄同体或雌性花蕾中过度表达。在这些转录因子中,我们发现了一个类似ap2的乙烯响应转录因子AIL5 (' evm.model.supercontig_233.1 ')和一个wuschele相关同源框4基因(' evm.model.supercontig_21.170 ')。AIL5是一种AINTEGUMENTA-LIKE/PLETHORA转录因子,被描述在花发育(特别是花器官的起始、生长和模式形成)、胚胎发生、幼苗生长和萌发(介导抑制赤霉素生物合成响应ABA)中发挥重要作用[63.那64.那65.].在拟南芥, AIL5在发育中的花的特定器官(花瓣、雄蕊和心皮)以类似AINTEGUMENTA (ANT)的模式表达,它的过度表达产生更大的花器官[63.那66.].与雄性花蕾相比,雌雄同体和女性花蕾的AIL5过度表达有道理,因为雌雄同体和女性花蕾比雄花芽更大,它们呈现更大的花器官[9.那10.那43.].有趣的是,该转录因子在正常雄性和畸形雄性雌蕊之间也存在差异表达,在正常雄性中受到抑制,而在畸形雄性中则过度表达。WUSCHEL-related homeobox 4 (' evm.model.supercontig_21.170 ')在雌雄同体的雌蕊与雄蕊之间表达上调,在畸形雄性(雄性-雌雄同体)与正常雄性之间表达上调。WUSCHEL-related homeobox (WOX)蛋白是属于ZIP超家族同源盒蛋白家族的转录因子,在植物中具有多种功能,包括决定细胞命运和侧器官发育[67.].在拟南芥,已经确定了15种WOX基因(包括WUSCHEL)。这些WOX基因(包括武术)中的一些调节胚珠发育,花组体发生,花卉过渡,并参与Gynoecium和Embryo Development [67.那68.].在拟南芥, WUSCHEL还激活了AGAMOUS (AG)基因,这是花心皮正常发育所需的C类基因[69.那70那71.].其他wox基因拟南芥还能够改变抗氧基基因的表达[72.].
Here we confirmed the differential expression of important flowering homeotic genes between males or hermaphrodites and females: PISTILLATA (‘evm.model.supercontig_26.316’) and two AP2-like ethylene-responsive transcription factor AINTEGUMENTA (ANT) genes (‘evm.model.supercontig_129.70’ and ‘evm.model.supercontig_160.33’), which were also differentially expressed between males and teratological males (male-to-hermaphrodite). It is well known that PISTILLATA (PI) and AINTEGUMENTA (ANT) are required for proper flower organ development in拟南芥.PI是适当的雄蕊和花瓣发育所必需的;虽然适当的花器官分配和增长需要蚂蚁[66.那69.那73.那74.那75.那76.].在木瓜中,PISTILLATA基因或CPPI已克隆并在雄性、两性和雌性花器官中进行了表达分析。CPPI在雄花和雌雄同体花的花瓣和雄蕊中有表达,仅在雌花的花瓣上有表达[20.].因此,与雌花相比,该基因在雄性和两性花蕾中可能会过度表达,因为雌花不存在雄蕊。的下调CP已呈报PI [16.],以及两个木瓜同源AINTEGUMENTA (ANT)基因的上调,在畸形雄性(雄性到雌雄同体)[16.,这与我们的结果是一致的。在拟南芥,除了参与花器官的生长外,ANT还参与抑制第二花轮AGAMOUS (AG)的表达,促进花瓣表皮细胞的识别,并在雌蕊和胚珠的发育中发挥重要作用[77.].因此,ANT同源基因在木瓜、雌性花和畸形雄性(雄性到雌雄同体)样本中过度表达是有道理的。
最后,在雄性、雌雄同体和雌性花早期和晚期参与发育、生殖和胚胎发育过程的差异表达基因中,我们发现了一个van3结合蛋白。该基因在1 ~ 6 mm的雄花芽中明显抑制;雄花的花蕾大小为7-12毫米,而雌花和两性花的花蕾大小为7-12毫米。在其他植物中,有报道称该蛋白存在于trans- golgi网络的一个泡囊亚群中,并通过泡囊运输系统参与调控生长素信号通路[78.].有趣的是,与正常的雄性样品相比,该基因在畸形雄性(雄性-两性诱导植物)中也有差异表达。尽管生长素的极性运输在雌核发育中起着重要的作用拟南芥,该基因在木瓜花发育中的具体作用尚未探讨[79.那80].
结论
我们的转录组分析显示出在不同花卉类型的植物中参与开发,繁殖和胚胎发育过程的基因表达的重要差异。尽管这些基因未位于性染色体上,但它们的差异表达揭示了番木瓜需要更多关于花药开发,ABA和ROS信号传导途径的研究,以更好地了解这些基因在花卉发育中的角色甚至是性别测定。预计,大多数这些基因在番木瓜中的下游性别规范以及更多的研究都需要在性染色体上确定哪种性别染色体对性别测定负责。此外,我们的结果证实了基因的表达:CPMS1.(位于仿血清素花蕾中,可能需要在番木瓜中正常发育雄性生殖器官的正常发育。然而,需要进一步的研究来阐明其在该物种中雄性器官发展的途径中的作用及其作用。
方法
植物材料
2013年,夏威夷农业研究中心(HARC)的库尼亚研究站(Kunia Research Station of Hawaii Agriculture Research Center)从雌性和雄性“AU9”番木瓜植物以及雌雄同体的“SunUp”植物中采集了花蕾。木瓜‘AU9’是一种原产于澳大利亚的育种植物材料,在HARC可获得;而木瓜“SunUp”是一种来自夏威夷的商业品种,在HARC可以买到。利用花芽进行性别间的基因表达比较,通过RNA-Seq获得候选的性别决定基因。这些花蕾首先根据它们的表型(性别)分类,然后根据它们的大小(毫米)分为两组。一组花蕾大小在1 - 6mm之间(发育早期或减数分裂前),另一组花蕾大小在7 - 12mm之间(发育后期或减数分裂后)。花蕾在液氮中研磨,进一步提取RNA。每个表型和每个组包含两个生物学重复。为了进一步通过qPCR证实已鉴定的高差异表达基因的差异表达,我们再次从三种不同的SunUp雌性植株、三种不同的SunUp雌雄同体植株、三种不同的“AU9”雌性植物和三种不同的“AU9”雄性植物于2017年在HARC的Kunia研究站生长。 These samples were collected and used for the qPCR analysis as described below because original flower bud samples from 2013 were not available. All samples were collected in Hawaii by HARC personnel (no required permissions were necessary to collect the samples), shipped in dry ice (−80C) to Urbana, Illinois and then ground in liquid nitrogen (− 196C) for further RNA extraction.
总RNA提取
根据制造商的说明,使用100mg组织样品和TrizoL®试剂(Ambion USA)提取总RNA。萃取后,用纳米玻璃器量化总RNA,其质量通过电泳检查(琼脂糖1%,TBE 1x缓冲液)。具有良好质量和量的RNA样品被稀释至100ngμl- 1并保持在-80℃直至进一步使用。
RNA-SEQ图书馆制备和测序
使用2 ~ 2.5 μg总RNA和TruSeq®链mRNA LT试剂盒(Illumina USA)构建RNA- seq文库,遵循制造商描述的低样本协议。RNA-Seq文库通过电泳(1%琼脂糖,TBE 1X缓冲液)评估,并用荧光仪定量(Qubit®fluorometer, Invitrogen,美国)。RNA-Seq文库使用两个平台进行测序:HiSeq2000(单端,100 nt)用于第一个生物复制,HiSeq2500(对端,100 nt)用于第二个生物复制(Illumina, USA)。对分析的库进行了总结(表5.).此外,从正常男性(登录号:SRX1770718)和畸形男性(低温诱导的雄性向雌雄同体的性逆转,登录号:SRX1770817)从国家生物技术信息中心(NCBI)数据库序列读取档案(Sequence Read Archive, SRA)下载[81.]并包括在分析中,以鉴定在“激光沸腾”中差异表达的基因,在雄性和雌性对雌雄同体的性逆转植物之间[16.].每个文库的原始序列数据可在基因表达综合(GEO,https://www.ncbi.nlm.nih.gov/geo/)在加入号GSE137547(Bioproject:Prjna565901,SRP221947)下。
差异基因表达分析
RNA测序后,原始读取质量使用FastQC(版本0.11.5)[分析82.使用Trimmomatic(版本0.36)删除适配器和低质量读取。[83.].修剪后,使用Hisat2(2.0.5版)将原始读数与新的木瓜基因组组件(Papaya Pacbio组件,280.5 MB)对齐[84.].对齐后,使用samtools(版本1.3.1)将SAM文件转换为BAM文件[85.和对齐的读取使用featuounts (Version 1.5.2)进行计数。[86.].对每个基因ID的外显子进行计数和总结。因此,使用GMAP (Version 2013-11-27)生成注释文件(gff3文件)。注释文件使用Phytozome v.12中的木瓜编码序列生成(cpapaya_113_asgpbv0.4 .cd .fa.gz, Version 12-29-2015)和一个新的木瓜基因组组装(papaya PacBio组装,280.5 Mb)。如上所述,使用gffread(版本0.9.8)将gff3文件转换为gtf文件,以计算对齐读的数量。
使用R(3.2.3)和Rstudio(1.0.136)分析样品之间的差异基因表达,其中包含以下包编辑(3.12.1版),WGCNA(版本1.51)和Limma(3.26.9版)。用于分析的对比度矩阵包括所有组之间的所有成对比较。只有具有对数折叠变化的基因(日志2FC) > 1或<−1(或Fold Change > 2)和错误发现率(FDR) < 0.05被认为是真正差异表达。利用所有已鉴定的差异表达基因在R中构建热图。利用Blast2GO Basic (Version 4.1.9)对2117个精选差异表达基因的GO进行基因本体论(Gene Ontology, GO)分析,揭示差异表达基因的GO类别[87.那88.那89.那90.].基于每个条件下的差异表达基因列表的Go-Slim功能过度表示分析(雄性与雌性;男性对雌雄同体和雌雄同体在不同尺寸1-6 mm和7-12mm的雌雄同体与女性)使用Panther数据库进行[91.相应的相应基因ID拟南芥同性恋,以揭示每个条件之间的差异过度代表的GO术语。检查2117差异表达的基因是否属于性染色体或对自动体组,差异表达的基因被喷出并映射到组装的性染色体假调子(x,y和y)H)[6.那7.].没有找到匹配的基因,也没有一个基因可以被映射回性染色体伪分子。
RT-qPCR表达分析,验证差异表达CPMS1.
从100mg冷冻的磨碎花芽和叶片组织样品中提取的总RNA从野生型'苏up'女性和雌雄同体植物中提取。和wild type ‘AU9’ female and male plants were treated with DNAse I (ThermoScientific) and 2.0 μg were converted to cDNA with the High Capacity cDNA Reverse Transcription Kit (Applied Biosystems) in a 20 μl reaction, following the steps described by the manufacturer. The relative expression or Fold Change (FC) of the highly differentially expressed geneCPMS1.(通过RNA-SEQ鉴定)通过使用特异性引物进行QPCR评估(表5.)CFX96™实时PCR检测系统(BiORAD)中的10 ng cDNA和Powerup™Sybr™绿色主混合物(Applied Biosystems),标准循环模式(TM 58C),包括解离曲线作为最后一步.使用三种生物重复,三种实验重复和三种非模板对照(NTC)。相对基因表达被归一化针对三种不同的内源基因(Actin 2,EIF1和TBP1)和各种雌性样品作为参考。ΔΔCT方法用于计算相对表达式,其中每个基因的折叠变化(fc)= 2 ^ - (ΔΔct)和日志折叠变化= log2(FC)。Log有显著差异2用ANOVA和Tukey检验分析(FC)(α= 0.05)。该基因的表达还通过在不同发育阶段的雄性花蕾中通过其各自的尺寸以毫米(从1至35mm)分类的雄性花蕾中的评估;如前所述,在瓣,萼片和面部从完全开发的雄性花朵中。由于缺乏来自雌雄同体植物的所有不同花阶段(1mm至35mm)的材料,不可能在雄性和雌雄岩花芽之间进行详细的比较分析。
一种高差异表达的基因CPMS1.:同源性分析和基因组位置
对于高度差异表达的基因的基因组和蛋白质序列:“evm.model.supercontig_2.119”(CPMS1.)从植物血红素(V12.1)中提取。使用三种不同的数据库分析蛋白质序列中存在的蛋白质基序:PFAM数据库[92.],智能数据库[93.]及NCBI保守域数据库[94.].用于分析木瓜基因组中基因的位置和拷贝的位置和拷贝数。BLASTP用于在番木瓜基因组中找到同源蛋白质。以前和新的木瓜基因组组件(木瓜PACBIO组件,280.5 MB)用于定位并计算木瓜基因组中基因的副本数。To find out whether this gene was sex-specific or not, primers were designed to amplify the whole gene in segments of 700–800 bp by PCR and DNA from three biological replicates (wild type ‘SunUp’ female and hermaphrodite plants and wild type ‘AU9’ female and male plants) were used. A PCR standard 10 μl reaction composed byTaq具有标准的DNA聚合酶Taq缓冲液(NEB), 0.5 ng的DNA和0.5 μM的4对不同的特异性引物对CPMS1.(表6.)使用推荐的制造商热循环条件(TM 55C)在Geneamp®PCR系统9700热循环仪(Applied Biosystems)中使用。所有PCR产物都是通过伊利诺伊大学伊利诺伊州伊利诺伊州的伊利诺伊州伊利诺伊州的兰纳 - 香槟,使用ChromAspro(版本2.1.8),并与之相比CPMS1.基因组参考序列。在其他物种中的这种基因的直列药(在MS1,HV.MS1,OS.MS1,和加利福尼亚州MS1),以及木瓜的同源物,与MUSCLE [95.]并与之相比CPMS1.番木瓜蛋白质参考序列使用Mega7 [96.].
Co-expression网络分析
Cytoscape建立了一个Co表达相关网络[97.]使用表达相关性应用,以及包含所有差异表达基因的归一化表达值的表达矩阵。使用鉴定为已知的基因的矫诊的基因从该共表达相关网络中提取亚网络,该基因是调节MS1的表达的基因拟南芥(表4.),CPMS1.基因及其所有第一邻居在共表达网络中。为了确定在该子网络中有统计过度代表哪个生物过程,使用宾果APPE在Cytoscape中进行多重测试校正(Benjamini和Hochberg FDR校正)的高度测量测试和显着性水平0.0598.].
数据和材料的可用性
目前研究中使用和/或分析的数据集在基因表达综合(GEO,https://www.ncbi.nlm.nih.gov/geo/)在加入号GSE137547(Bioproject:Prjna565901,SRP221947)下。
缩写
- 阿巴:
-
脱落酸
- microrna:
-
microRNA.
- RNA:
-
核糖核酸
- RNA-SEQ:
-
核糖核酸测序
- ROS:
-
反应性氧气
- RT-qPCR:
-
定量逆转录PCR
- 超常:
-
基因表达序列分析的改进变体
参考
- 1。
植物性别决定与性染色体。遗传。2002;88:94 - 101。
- 2。
植物性染色体。植物生物学学报。2016;67:397-420。
- 3.
Pannell Jr。植物性别决定。Curr Biol。2017; 27:R191-7。
- 4.
开花植物中的aryal r,ming r.性别测定:番木瓜作为模型系统。植物SCI。2014; 217-218:56-62。
- 5。
明锐,于强,摩尔。番木瓜的性别测定。Semin Cell Dev Biol. 2007; 18:401-8。
- 6。
沃尔彭·r,zeng f,chen c,zhang z,wai cm,han j等。木瓜y的起源和驯化H染色体。Genome Res。2015; 25:524-33。
- 7。
王静,那建坤,于青,韩杰,曾飞,等。测序木瓜X和Yh染色体揭示了早期性染色体进化的分子基础。中国科学院院刊2012;109:13710-5。
- 8。
廖泽,余Q,明河番木瓜中男性特异性标志的发展及性逆转突变体的鉴定。Euphytica。2017; 213(2):53。https://doi.org/10.1007/s10681-016-1806-z.
- 9。
Ronse de Craene LP,Smets EF。Carica Papaya Caricaceae的花卉发展和解剖学。可以j bot。1999年; 77:582-98。
- 10。
DE R,Craene L,TréhinC,莫雷利P,Negrutiu I. Carpeloidy在花卉进化和多样化中:Carica Papaya和Arabidopsis Thaliana的比较研究。Ann Bot。2011; 107:1453-63。
- 11.
陈志强,陈志强,陈志强,等。环境对番木瓜无性系雄性和雌性的影响。Sci Hortic。1987;32:221-32。
- 12.
艾恩斯MJ。关于Carica Papaya性别变化的观察。科学。1908; 28:125-6。
- 13。
库马尔,Jaiswal VS.性反转和由乙烯利和chlorflurenol番木瓜的雄株果实的形成。PROC植物科学。1984; 93:635-41。
- 14。
androecious木瓜通过乙烯利和chlorflurenol导致坐果库马尔A.女性化。Acta Hortic。1998; 463:251-60。https://doi.org/10.17660/ActaHortic.1998.463.30.
- 15.
Mitra SK, Ghanta PK.木瓜性表达的修饰。兰契。Acta Hortic。2000;515:281-6。
- 16。
林H,廖Z,张L,余Q.番木瓜低温雄性对雌雄同体性逆转的转录组分析。树遗传学基因组织。2016; 12:94。https://doi.org/10.1007/S11295-016-1055-2..
- 17。
Chan YK。番木瓜Carica Pagaya L. Mardi Res公牛雄蕊的研究。1984; 12(2):157-62。
- 18。
茂物 - arias a,mora-newcomer e。基因型和温度对木瓜饼干的影响。Agron Mesoam。2017; 28:557-90。
- 19。
Jiménez VM, Mora-Newcomer E, Gutiérrez-Soto MV。番木瓜的生物学。在:明R,摩尔PH,编辑。番木瓜的遗传学和基因组学。纽约,NY:施普林格纽约;2014.17-33页。https://doi.org/10.1007/978-1-4614-8087-7_2.
- 20.
Ackerman Cm,Yu Q,Kim S,Paull Re,Moore ph,Ming R. B级Mad-Box基因在Triorecious Pagaya中:两个Paleoap3副歌,CPTM6-1和CPTM6-2,以及PI Ortholog CPPI。Planta。2008; 227:741-53。
- 21.
Lee Mj,Yang Wj,Chiu Ct,Chen Jj,Chen Fc,Chang LS。木瓜疯子箱E级基因,CPMADS1和CPMADS3的分离与表征,以及TM6谱系CPMADS2。genet mol res。2014; 13:5299-312。
- 22。
Liu J, Liu J, Yu Q, Ming R. methylation and expression of HUA1 ortholog in three gender types of papaya。植物科学。2018;272:99 - 106。
- 23。
Urasaki N,Tarora K,Shudo A,Ueno H,Tamaki M,Miyagi N等。木瓜卡里卡番木瓜推定性别测定基因的数字转录组分析。Plos一个。2012; 7:E40904。
- 24.
于强,侯绍峰,费尔图斯,刘志强,刘志强,等。4对木瓜性别连锁基因的X/Y差异低。植物j . 2008; 53:124-32。
- 25.
上野,Urasaki N,夏目漱石,Yoshida K, Tarora K, Shudo A,等。通过基因组序列比较,发现了一个参与番木瓜树雌雄同体分化的候选基因。基因组学。2015;290:661-70。
- 26.
Lee Cy,Lin H,Viswanath K,Lin C,Chang B,Chiu P等人。三个性别相关基因型在Carica Pagaya L. Plos Plos中的第三轮与三个性别有关的基因座的开发。2018; 13:e0194605。
- 27.
Garg R,Jain M.RNA-SEQ在非模型植物中的转录组分析。在:编辑玫瑰RJ。豆科基因组学。TOWA,NJ:Humana媒体;2013. p。43-58。https://doi.org/10.1007/978-1-62703-613-9_4.
- 28.
RNA-Seq:转录组学的革命性工具。Nat Rev Genet, 2009; 10:57-63。
- 29.
Mouriz A, López-González L, Jarillo JA, Piñeiro博士管理植物发展。植物信号学报。2015;10(7):e993253。https://doi.org/10.4161/15592324.2014.993253..
- 30.
威尔逊za,morroll sm,道森j,swarup r,tighe pj。拟南芥雄性不育1(MS1)基因是雄性配子的转录调节剂,具有同源性的转录因子:MS1雄性配子的转录调节剂。工厂J. 2001; 28:27-39。
- 31.
ITO T,Shinozaki K.拟南芥的雄性无菌性1基因,用Phd-Finger基序编码核蛋白质,在Tapetal细胞中表达,需要花粉成熟所需的。植物细胞生理。2002; 43(11):1285-92。https://doi.org/10.1093/pcp/pcf154.
- 32.
关键词:拟南芥,雄性不育,基因工程,基因工程abstract:植物细胞。2007;19(11):3549 - 62。https://doi.org/10.1105/tpc.107.054536.
- 33。
杨志强,陈志强,杨志强。雄性不育1是绒毡层发育和花粉壁生物合成所必需的。植物细胞。2007;19:3530-48。
- 34。
Vizcay-Barrena G.在拟南芥MS1突变体中改变了Tapetal PCD和花粉墙开发。J Exp Bot。2006; 57:2709-17。
- 35。
FernándezGómezJ,威尔逊ZA。大麦PHD手指转录因子通过影响Tapetal发育来赋予雄性不育性。植物Biotechnol J. 2014; 12:765-77。
- 36。
齐y,刘q,张l,毛b,yan d,金q等。水稻新型热敏基因雄性不育TMS9-1基因的精细映射及候选基因分析。Al Appl Genet。2014; 127:1173-82。
- 37。
桢H,Tombor B,阿尔伯特R,Oltvai ZN,BarabásiA-L。代谢网络的大型组织。自然。2000; 407:651-4。
- 38。
Murase K,Shigenobu S,Fujii S,Ueda K,Murata T,Sakamoto A等。芦笋中涉及性别测定的MYB转录因子基因。基因细胞。2017; 22:115-23。
- 39。
Akagi T,Pilkington Sm,Varkonyi-Gasic E,Henry Im,Sugano SS,Sonoda M,等。两种染色体编码的基因决定了猕猴桃中的性别。Nat植物。2019; 5:801-9。
- 40。
Harkest A,Mercati F,Sunseri F,Sunseri F,Maravigna A,Leebens-Mack J.性别偏见的基因表达在Diocious Garden Asparagus Asparagus Officinalis。新植物。2015; 207:883-92。
- 41。
周建军,徐超,王志强,等。芦笋的基因组揭示了一个年轻Y染色体的起源和进化。Nat Commun。2017;8:1279。
- 42。
卡里卡番木瓜的Allan P.花粉研究。I.花粉的形成,发展,形态和生产。S.D AFR JAGRIC SCI。1963; 6:517-30。
- 43.
Saran P,Solanki I,Choudhary R. Papaya:生物学,培养,生产和用途。第1卷。第1版。佛罗里达州:CRC新闻泰勒&弗朗西斯集团;2016:11-52。https://doi.org/10.1201/B18955..
- 44.
Santos LMS, Pereira TNS, de Souza MM, Damasceno Junior PC, da Costa FR, Ribeiro BF,等。雌雄同体番木瓜树花粉粒发育的光学和超微结构研究。
- 45.
维尔马N.转录调控拟南芥花药发育的。基因。2019; 689:202-9。
- 46。
Schiefthaler U,Balasubramanian S,Sieger P,Chevalier D,WISMAN E,Schneitz K.喷嘴的分子分析,一种拟南芥性器官发展中的模式形成和早期孢子发生的基因。Proc Natl Acad Sci U S A. 1999; 96:11664-9。
- 47。
关键词:拟南芥,无孢子细胞基因,孢子发生,拟南芥基因Dev。1999;13:2108-17。
- 48.
李D-D,Zhu J-S,朱茹,杨Z-n。拟南芥Tapetum开发基因监管网络。前植物SCI。2017; 8:1559。
- 49.
朱茹,娄y,徐x,杨z-n。拟计的绦虫发育和功能的遗传途径。J Intent Plant Biol。2011; 53:892-900。
- 50.
张伟。拟南芥绒毡层发育和功能的调控。发展。2006;133:3085 - 95。
- 51.
顾建宁,朱军,于勇,滕晓东,娄毅,徐晓峰,等。DYT1在拟南芥绒毡层发育和花粉壁形成中直接调控TDF1的表达。植物j . 2014; 80:1005-13。
- 52.
朱娥,尤晨,王胜,崔军,牛斌,王勇,等。bHLH010、bHLH089和bHLH091是拟南芥花药发育和转录组的冗余蛋白。植物j . 2015; 83:976 - 90。
- 53.
徐建军,丁志刚,石建军,梁伟,袁志,等。败育的小孢子在拟南芥花粉壁形成中起主要调控作用。植物细胞。2014;26:1544-56。
- 54.
娄艳,周海生,韩艳,曾庆艳,朱杰,杨志宁。拟南芥花药发育需要TDF1对AMS的正调控和TDF1-AMS复合物的形成。新植醇。2018;217:378 - 91。
- 55.
Riboni M,Robustelli测试A,Galbiati M,Tonelli C,Conti L. ABA依赖性控制Gigantea信号传导使得通过拟南芥拟南芥中的开花基因座T的上调来实现干旱逃生。J Exp Bot。2016; 67:6309-22。
- 56.
王Y,Li L,YE T,Lu Y,Chen X,Wu Y. ABA对花卉过渡的抑制作用是由Abi5在拟南芥中介导的。J Exp Bot。2013; 64:675-84。
- 57。
刘锐,张华,王胜,等。aba - insensitive 4通过直接促进拟南芥开花LOCUS C转录负调控开花。J Exp Bot. 2016; 67:195-205。
- 58。
Tsukagoshi H, Busch W, Benfey PN。ROS的转录调节控制着根从增殖到分化的转变。细胞。2010;143:606-16。
- 59。
DM的威尔斯,MH的威尔逊,MJ的本内特。对生长感到乐观:联系ROS梯度和细胞增殖。Dev细胞。2010;19:644-6。
- 60。
Schmidt r,瑞士学习河JHM。ROS介导在植物细胞分化期间的氧化还原信号传导。Biochim Biophys Acta BBA - Gen Subj。1850年; 2015:1497-508。
- 61。
Singh R, Singh S, Parihar P, Mishra RK, Tripathi DK, Singh副总裁,等。活性氧(ROS):植物发育过程中的有益伴侣。植物科学学报2016;7:1299。https://doi.org/10.3389/fpls.2016.01299.
- 62。
acta opheica sinica, 2010, 34(4): 558 - 564。BMC Plant Biol. 2010;10:36。
- 63。
Nole-Wilson S, Tranby TL, Krizek BA。aintegumeta -like (AIL)基因在年轻组织中表达,可能指定分生组织或分裂能力状态。acta botanica sinica(云南植物学报)2005;57:613-28。
- 64。
Yano R,Kanno Y,Jikumaru Y,Nakabayashi K,Kamiya Y,Nambara E. Chotto1,推定的双脂血症重复转录因子参与拟拟合拟拟拟合种子萌发过程中的嗜酸性酸介导的粘性酸介导的抑制。植物理性。2009; 151:641-54。
- 65。
Tsuwamoto R,横井S,高畠Y.拟南芥EMBRYOMAKER编码的AP2结构域转录因子起着从营养胚胎发育阶段变化的关键作用。植物mol biol。2010; 73:481-92。
- 66。
Krizek Ba。Arapidopsis植物中Aintegumenta的异位表达导致花动器官的增长增加。Dev Genet。1999年; 25:224-36。
- 67.
连刚,丁志,王强,张东,徐建军。植物界wuschel相关同源box蛋白家族的起源与进化。Sci World J. 2014;
- 68.
Deveaux Y,Toffano-Nioche C,Claisse G,Thareau V,Morin H,Laufs P等人。植物中最保守的WOX思想基因影响拟南芥的根和花卉发育。BMC EVOL BIOL。2008; 8:291。
- 69.
Bowman JL,Smyth Dr,Meyerowitz Em。引导拟南芥花发育的基因。植物细胞。1989; 1:37-52。
- 70。
拟南芥同源基因agamous编码的蛋白质与转录因子相似。大自然。1990;346:35-9。
- 71.
关键词:拟南芥,花器官同源性,异位表达,拟南芥细胞。1992;71:119-31。
- 72.
公园。PRETTY FEW SEEDS2基因编码一个调控胚珠发育的拟南芥同源结构域蛋白。发展。2005;132:841-9。
- 73.
Krizek Ba。Aintegumenta样基因与Aintegumenta具有部分重叠的功能,但对拟南芥的花卉开发做出了明显的贡献。J Exp Bot。2015; 66:4537-49。
- 74.
王志强。拟南芥的花发育:野生型和同型雌蕊突变体的比较。Can J Bot. 1989; 67:2922-36。
- 75.
拟南芥同源基因APETALA3和PISTILLATA足以提供B类器官识别功能。发展。1996;122:11。
- 76.
Wuest SE,O'Maoileidigh DS,Rae L,Kwasniewska K,Raganelli A,Hanczaryk K,等。Apetala3和Pistillata的花动器官规范的分子基础。PROC NATL ACAD SCI。2012; 109:13452-7。
- 77.
Krizek Ba,Prost V,Maciad A. Aintegumenta促进了花瓣身份,并充当抗毒性的负调节器。植物细胞。2000; 12:1357-66。
- 78.
Koizumi K.Van3 Arf-Gap介导的囊泡输送涉及叶血管网络形成。发展。2005; 132:1699-711。
- 79.
Nemhauser JL,费尔德曼LJ,Zambryski PC。生长素和双头怪拟南芥雌蕊形态。发展。2000; 127:3877。
- 80。
Larsson e,Franks Rg,Sundberg E.植物生长素和拟南芥古尼奥。J Exp Bot。2013; 64:2619-27。
- 81。
Leinonen R,Sugawara H,Shumway M,代表国际核苷酸序列数据库合作。序列读取存档。核酸RES。2011; 39数据库:D19-21。
- 82。
Andrews S. FASTQC用于高吞吐量序列数据的质量控制工具。2016年。https://www.bioinformatics.babraham.ac.uk/projects/ FASTQC /。。
- 83。
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30:2114-20。
- 84。
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12:357-60。
- 85。
李洪波,李洪波,李洪波,等。序列对齐/映射格式和SAMtools。生物信息学。2009;25:2078-9。
- 86。
Liao Y,Smyth GK,Shi W. FeatureCounts:用于分配序列的有效通用程序读到基因组特征。生物信息学。2014; 30:923-30。
- 87。
Blast2GO:植物基因组学功能分析的综合套件。植物基因组学杂志。2008;1 - 12。
- 88。
Conesa A,Gotz S,Garcia-Gomez JM,Terol J,Talon M,Robles M.Baster2Go:功能基因组学研究中的注释,可视化和分析的普遍工具。生物信息学。2005; 21:3674-6。
- 89。
Gotz S,Garcia-Gomez JM,Terol J,Williams Td,Nagaraj Sh,Nueda MJ,等。高吞吐功能注释与BLAST2GO套件的数据挖掘。核酸RES。2008; 36:3420-35。
- 90。
Götz S, Arnold R, Sebastián-León P, Martín-Rodríguez S, Tischler P, Jehl M-A,等。B2G-FAR,一个以物种为中心的GO注释存储库。生物信息学。2011;27:919-24。
- 91。
黄雪梅,黄雪梅,王志强,等。PANTHER version 11:扩展了来自基因本体论和Reactome路径的注释数据,增强了数据分析工具。核酸Res. 2017;45: D183-9。
- 92。
El-Gebali S, Mistry J, Bateman A, Eddy SR, Luciani A, Potter SC,等。2019年Pfam蛋白家族数据库。核酸Res. 2019;47: D427-32。
- 93。
舒尔茨J. SMART:一个基于网络的研究基因移动领域的工具。核酸Res. 2000; 28:231-4。
- 94。
Marchler-Bauer A, Derbyshire MK, Gonzales NR, Lu S, Chitsaz F, Geer LY等。CDD: NCBI的保守域数据库。核酸Res. 2015;43: D222-6。
- 95.
Edgar Rc。肌肉:高精度和高吞吐量的多个序列对齐。核酸RES。2004; 32:1792-7。
- 96.
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33:1870-4。
- 97.
Shannon P,Markiel A,Ozier O,Baliga NS,Wang JT,Ramage D等人。Cytoscape:用于生物分子交互网络的集成模型的软件环境。Genome Res。2003; 13:2498-504。
- 98.
BiNGO:一种用于评估生物网络中基因本体论类别过度表达的Cytoscape插件。生物信息学。2005;21:3448-9。
致谢
作者要感谢Jennifer Wai,她对RNA分离和RNA- seq文库的制备做出了贡献。
资金
该项目由美国国家科学基金会(NSF)植物基因组研究计划奖db -1546890颁发给R.M.。NSF资助为所有人员、所有研究助理和所有实验费用提供资金。实验费用包括:实验设计、样本的收集和运输、样本的处理、数据的分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
所有作者都读过并批准了稿件。RM设想的项目;RM,JW设计实验;JW和MLW进行的实验;DZC分析的数据;DZC和LY帮助与样品进行进一步的qPCR分析设计和收集。DZC,JN和RM写和纠正的手稿。
作者的信息
Dessireé P. Zerpa-Catanho目前是伊利诺伊大学香槟分校植物生物系的博士生,在Ray Ming的指导下工作。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
基于标准化的LogCPM值(A)并计算RNA-SEQ分析后的变异生物学系数的一组样本
附加文件2:图S2。
折叠认定为过度代表的GO-超薄细胞成分方面的富集。
附加文件3:图S3。
GO-Slim分子功能术语被确定为过度代表。
附加文件4:图S4。
GO-Slim生物工艺术语被确定为过度富集。
附加文件5:图S5。
花药发育途径中基因共表达相关亚网络。
附加文件6:图S6。
共表达相关子网中的过度代表生物过程。
附加文件7:表S1。
使用FastQC进行质量控制的总结,使用HISAT2进行校准,使用featurecots读取计数。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Zerpa-Catanho,D.,Wai,J.,Wang,M。等等。三种性类型中的差异基因表达揭示了雄性不育者1(CPMS1.)的性别分化。BMC植物BIOL.19,545(2019)。https://doi.org/10.1186/s12870-019-2169-0
收到了:
公认:
发表:
关键词
- 卡里卡番木瓜
- 花开发
- 雄性不育基因
- RT-QPCR.
- RNA-SEQ.
- 性别分化