抽象的
背景
Mepiquat chloride (MC)是一种植物生长调节剂,通过促进棉花侧根的形成来促进根系的生长。然而,这种现象背后的分子机制仍是未知的。
方法
在本研究中,我们使用了10种棉花(gossypium hirsutum linn.)品种进行MC种子处理以研究侧根形成,并选择一个MC敏感的棉花品种进行MC种子处理后侧根发育过程中的根系生长动态监测和转录组分析。
结果
结果表明,MC处理的种子对侧根的形成具有剂量依赖性的促进作用,有效促进区域在5 MC处理的种子通过改变赤霉素(GA)生物合成和信号以及脱落酸(ABA)信号的基因表达诱导内源生长素水平。同时,MC处理的种子差异表达吲哚乙酸(IAA)相关基因此外,MC诱导的IAA调节侧根发育的细胞周期和分裂相关基因的表达。
结论
我们的数据表明,MC调控GA和ABA的代谢和信号转导,进而调控生长素的生物合成、运输和信号转导,促进细胞分裂,负责侧根的形成。
背景
通过提供高于地机械支撑和控制水和营养采集,根系对植物生长起着枢轴作用。侧根,根系的主要部分在根长度和数量方面,对水和营养吸收具有重要的生理能力[1],并用作响应异质土壤环境的主要界面[2]因此,侧根的发育对作物生长和收获都有决定性的影响[3.,4].
侧根的发育是由遗传因素和内源激素共同作用的调控网络调控的。生长素积累诱导木质部极-中柱鞘细胞不对称分裂形成侧根[5,6,7,8,9,10].在植物中,细胞周期和细胞分裂的进展是由感应正调节剂,如细胞周期蛋白(CYCS)和细胞周期蛋白依赖性激酶(CDK)的两端,及负调节,包括硖相关蛋白(KRPS)的抑制促进[11,12].这个A-type CDKs and D-type CYCs complex play a critical role in cell cycle by regulating the G1-to-S transition. The G2-to-M checkpoint, regulating cell cycle progression to the mitotic phase, is mainly controlled by B-type CDKs and A- or B-type赛克[13,14,15].
生长素运输影响不对称细胞分裂[5,6,16,17,18].生长素的定向转运受生长素载体的不对称分布控制,包括内流载体、生长素转运蛋白1 (auxin TRANSPORTER PROTEIN 1, AUX1) /like AUX1 (LAX)和PIN- formed (PIN)家族的外排载体。AUX1促进枝源吲哚乙酸(IAA)装载到血管运输系统。LAXs介导生长素梯度的形成,在根尖内部组织中产生生长素向顶运输,在根尖外部组织中产生生长素向基部运输[19].这个针极性定位,允许生长素定向运输和建立局部生长素最大值和最小值[5,17,20.].
生长素/吲哚-3-乙酸(Aux/IAAs)、生长素反应因子(ARF)和小生长素UP RNA(SAUR)是负责生长素信号转导的关键成员。IAA14/SLR(孤根)-ARF7-ARF19和IAA12/BDL(BODENLOS)-ARF5是参与侧根起始的重要生长素信号模块[21,22,23]生长素诱导的Aux/IAA蛋白降解释放ARF7和ARF19转录因子,激活侧根起始的下游基因表达[23,24,25].LBD (LATERAL ORGAN BOUNDARIES DOMAIN)转录因子家族,在侧根形成中起作用,被鉴定为ARF7和ARF19的直接下游组分之一[22,25,26,27].
除了生长素外,其他植物激素,包括嗜酸甘油蛋白(Ga),脱落酸(ABA),乙烯和茉鲸酸(JA),还对依ux素依赖性的方式影响横向根部形成。GA对侧根的形成有一定的负面影响,部分是通过调控生长素的极性运输杨属[28]ABA受体PYL8通过增强生长素信号传导促进侧根生长[29,30].ABSCISIC acid insensitive 4 (ABI4)通过降低生长素的表达来抑制生长素的极性转运PIN1影响侧根的形成[31].乙烯影响养羊酸信号传播和运输来调节根部发展[32,33].JA通过直接诱导生长素的合成和/或调控来促进侧根的形成PIN2在血浆膜上积聚[34,35].
植物生长调节剂氯mepiquat chloride (MC)是一种赤霉素合成的生长阻燃剂,可以阻断戊二醛基二磷酸合酶(CPS.),Ent-Kaurene合成酶(KS)在Ga新陈代谢的早期步骤中[36].MC是一种水溶性有机分子,在浸种或叶面喷洒该分子后调节植物生长[37].MC在棉花生产中常用来缩短节间伸长,减少主茎节,降低株高,使植株结构更加紧凑[38,39,40,41]。除了操纵植物冠层外,MC还通过增加侧根数量来促进根系生长。然而,潜在的机制在很大程度上是未知的。
本研究选择一个MC敏感棉花品种,利用RNA-seq对其侧根发育过程进行转录组分析。我们证明,MC调控GA和ABA的代谢,进而调控生长素的生物合成、运输和信号转导,从而控制细胞分裂,负责侧根的发育。
结果
MC促进棉花幼苗侧根的发育
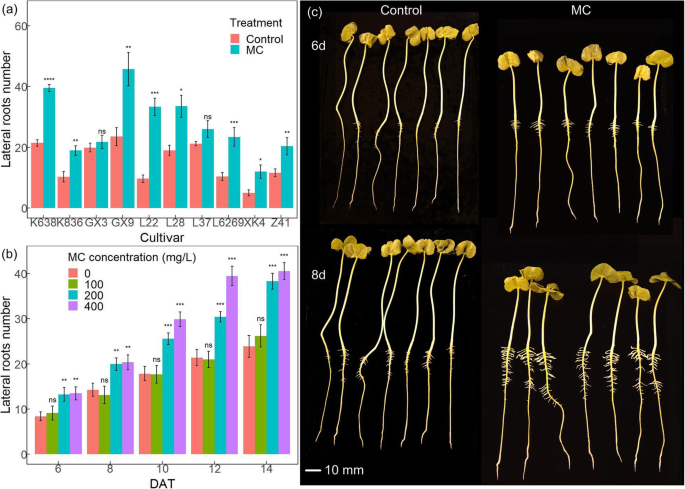
为了研究MC对棉花侧根形成的影响,我们对棉花种子进行了MC预处理,发现除GX3和L37外,MC处理的棉花种子的侧根数量显著增加(图3)。1a).在这些品种中,K638对MC对侧根形成的响应最显著,选择K638进行进一步分析。采用不同浓度的MC检测K638侧根形成情况。结果表明,MC对侧根形成的诱导具有剂量依赖性。100 mg/L MC处理的侧根数较H处理无明显增加2O治疗。200 mg/L和400 mg/L MC处理对侧根数的诱导率分别为28.5 ~ 37.7%和30.1 ~ 45.8%2O治疗(无花果。1b). MC处理8 d后,K638的侧根比对照发育得更多、更长(图4)。1c).结果表明,MC浸种促进棉花幼苗侧根形成,且呈剂量依赖性。
MC促进棉花侧根发育。一个MC促进不同棉花种类的侧向根部发育。收集来自10种棉花种子的种子,以检测其浸出与去离子水(对照)或400mg / L MC浸泡的种子的侧根12的12小时。获取图像以量化横向根系。bMC以剂量依赖性的方式促进侧根发育。分别用100 mg/L、200 mg/L和400 mg/L MC处理K638棉花种子,在指定时间点采集图像,定量测定侧根数。cK638的根表型。图像是在MC处理后6天和8天(DAT)获得的。显著差异从通过标准t检验三个重复(评估*p < 0.05, * *p < 0.01,***p < 0.001,****p < 0.0001).每个处理3个重复,每个重复7株,每个处理共21粒种子
对根生长的MC效应的动态监测
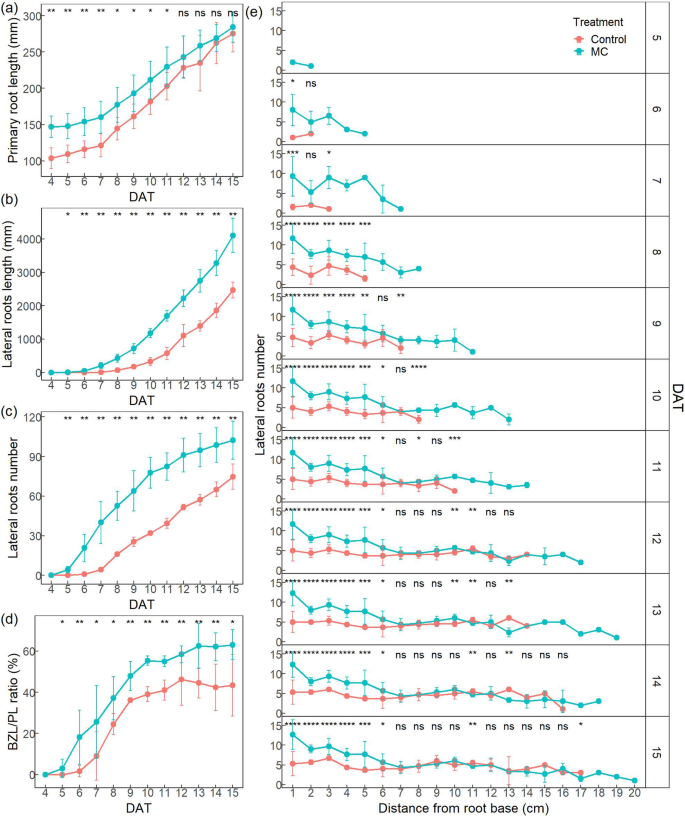
为研究MC对K638棉花根系生长的动态影响,利用定制的高通量机器人平台rhizochamb - monitor [42来监测根系的动态生长。与对照(去离子水处理)相比,主根长度显著增加。MC处理的主根长度更高(图。2a) 对于侧根,MC处理的总根长和根数均显著高于对照(图。2在第7天,MC处理侧根长度的增加速率显著高于对照,而从第5天开始,MC处理侧根数的增加速率显著高于对照(图5)。2此外,MC处理的BZL/PL比(分支区长度/主根长度)显著高于对照(图2)。2d) 而BZL/PL比值的增长率在9日前较高。
为了进一步确定MC处理在主根中产生侧根的来源,我们量化了根系动态生长过程中主根从根底到根尖1 cm截面侧根数量的变化。在离主根基部5 cm范围内,MC处理的侧根数量显著增加(图2)。2e).此外,MC处理的侧根出现比对照早得多。7 d前,MC对侧根形成的促进作用明显。同时,MC浸种促进了侧根的形成,提前了侧根的出现时间。
MC处理棉籽的转录体分析
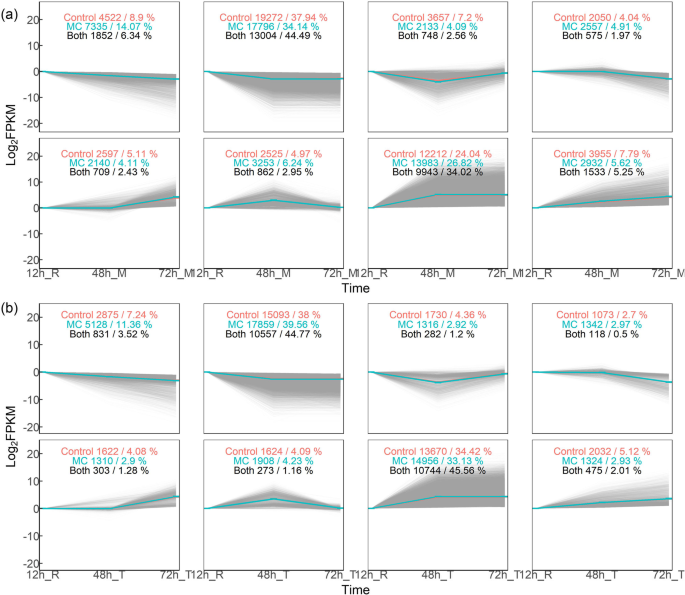
为了探讨MC处理后棉花根系发育过程中基因表达的动态变化,我们对棉花根系进行了RNA-seq分析。Illumina测序后的序列组装概述见附加文件1S1:表。Q20和Q30分别高于96和92%。平均错误率小于0.02%。对照组中低(FPKMs在间隔1-3)、中(FPKMs在间隔3-15)和高(FPKMs超过15)表达基因的百分比分别为15、24.8和15.5%(附加文件)2:表S2)。通过主成分分析(PCA)和层次聚类评估Control和MC处理的转录组样本在三个时间点的关系(附加文件)6:图S1)。数据表明,每个处理的三个生物重复之间有很强的相关性。
通过K-means聚类分析,鉴定了CK和MC处理根尖和根中部沿3个时间点的8种基因表达模式(图2)。3.).根据Euclidean距离分析基因表达水平的相似性。在根中区域,分别将50,790和52,129个基因分配到八个簇(K1至K8),分别用于控制(红色)和MC处理(绿色数字)(图。3.a).共有29226个基因(MC/Control处理的56.1%/57.5%)在两个处理中表现出相同的表达模式(黑色数字)。在根尖,Control和MC处理分别将39,719和45143个基因分配到8个簇中(图2)。3.b)。总共23,583个基因(MC / CONCORIC处理中51.9%/ 59.3%)在两种治疗中表现出相同的表达模式。在一起,MC处理的种子在棉根发育过程中改变转录组动力学。
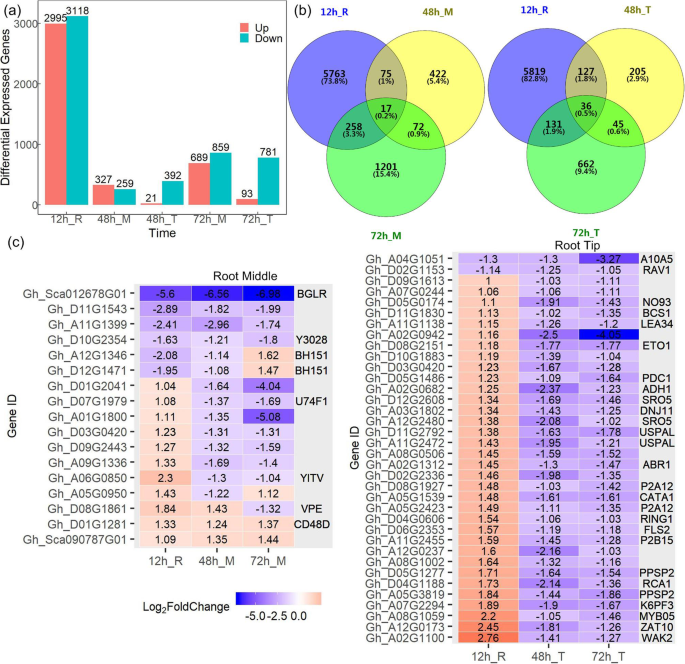
进一步测定了对照和MC浸种处理之间的差异表达基因(DEGs)(图。4).总体6113度(FDR < 5%, |日志2Fc |≥1)在整个根12 h (12 h_R), 586度根中部地区(48 h_M), 413度在根尖48 h (48 h_T), 1548度根中部地区(72 h_M),在根尖和874度72 h (72 h_T) MC治疗后被确定(无花果。4a). DPC处理后,3个时间点均观察到17个(0.2%)DEGs;7386(94.6%)基因仅在一个时间点有差异表达(图2)。4b).在根尖3个时间点均观察到36 (0.5%)deg;而6686(95.2%)基因仅在一个时间点有差异表达(图。4b)。其中常见的度(罗斯福< 5%,|日志2Fc|≥1)。4C), 4个基因下调,2个基因上调,包括CD48D.编码细胞分裂控制蛋白的基因;两个BHLH转录因子基因(BH151)调节细胞增殖与根生长中的分化之间的平衡[43],下调至12 h和48 h、 而在72时上调 H对于根尖(图。4c),编码生长素诱导蛋白A10A5的基因以及包含AP2/ERF和B3结构域的两个转录因子RAV1在三个时间点均下调;有34个基因在12 h表达上调,48 h和72 h表达下调,其中包括乙烯反应转录因子ABR1, ABA信号通路的负调控因子,myb相关转录因子MYB05,乙烯过剩蛋白基因Eto1.,壁相关受体激酶基因WAK2.这些deg大多是与植物激素相关的基因,参与根系发育。
GO和KEGG分析
使用GOseq R包将deg分配到不同的功能类别中。将对照组和MC处理的差异值(q值< 0.05)分为54个功能组。在生物过程中,“R生物合成过程”(GO:0032774)、“转录,d依赖”(GO:0006351)、“电子传递”(GO:0006118)和“对化学刺激的响应”(GO:0042221)等类别中富集了407、405、136和130个DEGs(补充文件)3.:表S3)。在分子功能方面,在“氧化还原酶活性”(GO:0016491)、“序列特异性D结合转录因子活性”(GO:0003700)和“核酸结合转录因子活性”(GO:0001071)类别中富集了336个、64个和64个DEGs(附加文件)3.:表S3)。根中部和根尖各时间点下调和上调的DEGs的功能注释和GO富集在Additional文件中7:图S2。
为了鉴定MC处理后参与侧根发育的生物途径,我们使用KOBAS软件检测KEGG途径中DEGs的统计富集程度。对照组和MC处理组的2486个deg被分配到35个KEGG通路(附加文件)8:图S3)。其中,研究代谢途径的有696个,研究次生代谢产物的生物合成的有451个,研究植物激素信号转导的有312个。
MC调控多种植物激素的表达谱和积累
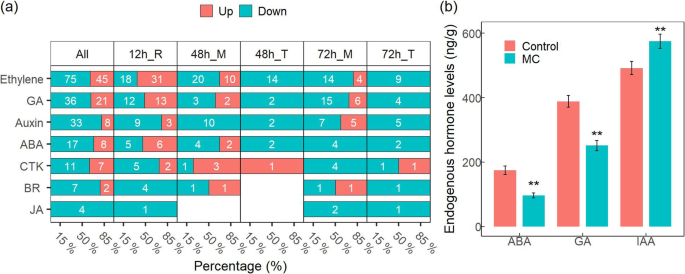
植物激素在植物生长中起着关键作用,与根系发育密切相关。接下来,我们研究了MC种子处理后丰富的激素代谢功能类别,发现274个deg参与激素代谢、信号转导或响应(图)。5一种)。这些液体主要与乙烯(120基因,43.8%),Ga(57基因,20.8%),生长素(41基因,15%),ABA(25基因,9.1%)和CTK(18个基因,6.6%)有关).89%的Degs与乙烯有关,属于ERF / EF.转录因子家庭。此外,九次与芸苔类固醇(BR)有关,观察到四次有关的次数。
为了进一步证实这些激素的参与,我们检测了棉花MC种子处理后根系中GA、ABA和IAA的浓度。数据显示,MC处理诱导了IAA水平,但降低了处理后5 d (DAT5)棉花根系GA和ABA水平(图5)。5b) 数据表明,MC可以协调激素内稳态。
MC治疗变造GA-的表达,乙烯,和ABA - 相关基因
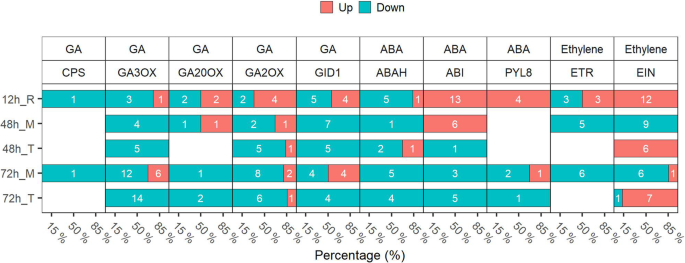
植物激素对侧根形成有重要影响[30,33,35].具体而言,在每个时间点鉴定Ga-,乙烯和与ABA相关的次数(基因通过FDR <5%控制)(图。6).GA生物合成基因CPS.,GA20OX,GA3OX被MC处理下调。而Ga2ox.,参与Ga分解代谢的基因,在12小时内上调。GA受体胃肠杆菌蛋白不敏感DWARF1, GID1被抑制。GA在侧根形成中起负作用。我们的研究结果一致表明,MC在侧根形成过程中抑制GA的生物合成和信号转导。我们还发现了乙烯受体etr和乙烯不敏感蛋白(静脉)家族基因在根中48h和72h表达下调。此外,我们观察到阿参与ABA氧化降解的基因家族被下调。虽然,脱钙酸不敏感3/4/5(ABI3 / 4/5)和参与ABA信号转导的ABA受体PYL8在12 h表达上调。
MC调节与生长素相关基因的表达
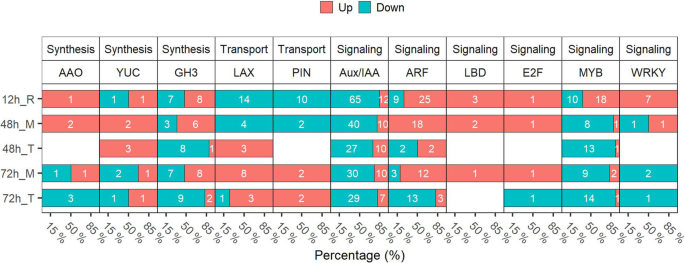
植物素是控制侧根开发的主要激素。在每个时间点鉴定属于不同家庭的植物素相关的次数(图。7额外的文件4:表S4)。对于生长素合成DEG,AAO2,encoding the enzyme for oxidizing indole-3-acetaldehyde to IAA, was up-regulated at 12 h and 48 h in the root middle region; YUC family genes, which encode flavin monooxygenase-like proteins that catalyze a rate-limiting step in IAA biosynthesis, were up-regulated at 48 h, indicating that MC could induce auxin biosynthesis. GH3 family genes, which encode IAA-amido synthetases, were mostly down-regulated at 48 h and 72 h in root tip. Meanwhile, auxin transport genes, like LAX and PIN family genes were down-regulated at 12 h and 48 h, but up-regulated at 72 h, indicating that MC may gradually regulate auxin transport to promote lateral root formation. DEGs related to auxin signaling, like negative regulator Aux/IAA family genes, were down-regulated by MC treatment. Moreover, over half of the东盟地区论坛家族基因以12小时凝固,在根中部区域的48小时和72小时内调节。的LBDs和E2FS.转录因子,两个下游组分东盟地区论坛,在根中区域以12小时和48小时和72小时在根中调节。此外,在12小时的情况下,一些与Wrky和MyB相同的植物素相关的转录因子,表明在侧根引发区的MC处理时增强了蟾蜍素信号传导。
MC通过调节细胞周期和分裂促进侧根发育
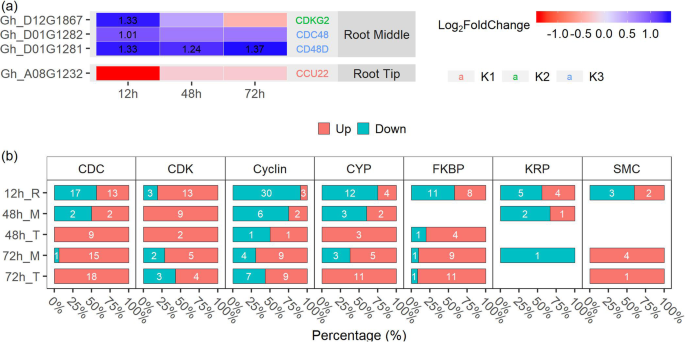
细胞增殖和分化调节侧根开始。已知参与细胞周期和细胞分裂的基因分别在根中间区域和根尖被鉴定(图8a).在根中部区域,有两个细胞分裂周期蛋白基因家族,CDC48和CD48D.,在所有三个时间点均上调;一个周期素依赖的激酶基因,CDKG2,也通过MC处理上调。具体地,属于不同的家庭细胞周期和细胞分裂有关DEGS被确定在每个时间点(图8b).大多数的赛克参与细胞周期在G1/S(开始)过渡时的调控的家族基因在72 h时上调。多数的CDK72 h后基因表达上调KRPMC处理12 h后基因表达下调。大多数疾病预防控制中心PPIase (PPIase)家族基因(CYP和FKBP)和染色体蛋白基因的结构维持(SMC)在72岁时被上调 h、 结果表明,MC通过调控细胞周期和细胞分裂相关基因促进侧根形成。
讨论
MC促进棉花侧根形成
MC是棉花生产通常使用的植物生长调节剂,并通过增加侧根和根生物量[数量提高的根生长37].然而,MC促进棉花侧根起始的分子机制尚不清楚。我们的研究表明,用MC浸种显著促进棉花侧根的形成,且呈剂量依赖性(图2)。1a,b)。通过RNA-SEQ分析,在用MC处理的种子的横向根部形成期间测定大量的DEG,特别是与激素代谢和信号传导相关的基因。
MC在侧根形成过程中介导GA、ABA和IAA之间的串扰
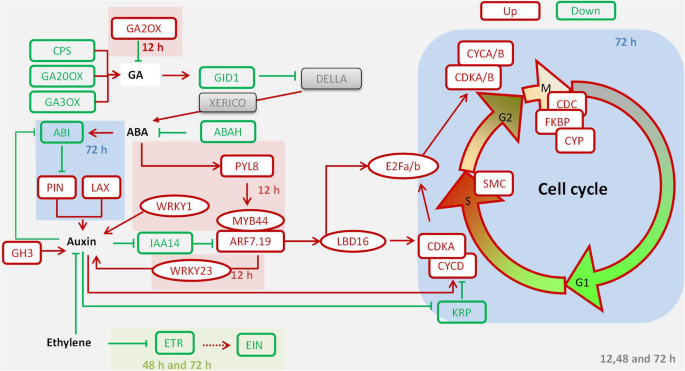
气体生物合成的抑制剂,如紫杉蛋白,可以增强番茄中的侧根形成(茄属植物lycopersicum) [44),辣椒(辣椒) [45],以及若干种树木[46].发现GA生物合成或信号传导缺陷的突变体刺激侧根形成[28,44,47].MC可能通过调控内源性赤霉素促进侧根发育。这里,RNA-seq结果显示MC下调了GA生物合成基因,如CPS.,Ga0oxs.,Ga3ox.,上调GA分解代谢基因氧化镓(图。6和附加文件9:图S4)。与对照相比,MC处理的种子根系中的GA水平显著降低(图2)。5b)。
GA与生长素、ABA等激素的串扰在侧根发育的调控中起重要作用[28].GA受体GID1诱导DELLA蛋白降解,进而调控ABA生物合成诱导剂XERICO的表达[35,48].因此,MC处理可能在种子发育阶段提高了内源ABA水平。GA对侧根的形成有一定的负面影响,部分是通过调控生长素的极性运输杨属[28].我们的结果表明,在5dat时,MC处理显著增加了根组织的生长素水平,降低了ABA水平(图5)。5b),与GA通过生长素介导途径或直接下调ABA生物合成影响侧根形成的结果一致[28].
生长素是一种重要的植物激素,参与调节侧根的发育[23]侧根起始区的生长素最大值是侧根原基形成的关键因素,通过激活生长素生物合成和运输维持侧根原基[5,6,16,17,18].ABA通过调控生长素的信号转导和转运来影响侧根的形成[29,30,31].然而,ABA对侧根形成的影响存在着矛盾的认识。ABA受体Pyl8.通过激活促进横向根系生长MYB44诱导生长素信号传导[29,30].而Shkolnik-Inbar和Bar-Zvi则报道了ABA通过调节生长素运输来抑制侧根的形成[31].Abi4.通过降低表达式来抑制根部的极性助长传输PIN1;和表达的Abi4.由ABA增强并被养羊酸压制。在我们的研究中,Pyl8.和MYB44在12 h表达上调(Figs6,7和附加文件9:图S4);Abi5.被抑制。同时,针在72 h表达上调(图。7)因此,MC处理可能通过上调ABA受体增强生长素信号Pyl8.,并通过下调节增强助长信号传导Abis.促进侧根生长。尼吉等人[32]报道etr1或ein2乙烯信号传导中的突变体通过串扰增加横向根部形成,具有助长信号传导和运输途径。一致地,我们的数据显示ETR家族基因在48小时和72小时下调。大多数EIN家族基因在根中区域下调(图。6).总之,这些结果提供了证据表明MC作为一种以激素串扰方式作为侧根发育的重要调节因素。
MC直接调控生长素的代谢、转运和信号转导
由YUC或TAA介导的养羊酸生物合成促进侧根形成[49].过表达YUC1/6和TAA1增加IAA浓度以及增强的侧根形成拟南芥蒂利亚纳[49].这个一个uxin efflux regulators PIN and auxin influx carrier AUX1 mediate auxin transport in lateral root formation [5]在我们的研究中,YUC家族基因在48岁时被MC处理上调 h(图。7).此外,大多数生长素流入载体LAX家族基因和生长素流出载体PIN家族基因在MC处理后72 h表达上调(图)。7和附加文件11:图S6)。MC处理的种子根系中IAA水平显著升高(图2)。5b)。因此,MC处理的种子可以通过直接调节植物生长素生物合成和转运的基因的表达促进侧根形成。
作为生长素信号转导的最重要成员,辅助/ IAAs家族基因在横向根部形成中发挥作用[21,50,51,52].一些Aux/IAA-ARF模块在驱动侧根形成中被牵连[25].这个IAA28-ARF5/6/7/19 module is specific for priming cell specification [6,53].这个IAA14-ARF7/19 module and IAA12-ARF5 module are specific for lateral root initiation and patterning [21,22,23].这个repression ofIAA12和IAA14诱发ARF5和ARF7/19基因表达激活细胞周期并形成侧根原始[25].在我们的研究中,大多数Aux/IAA家族基因在MC处理下表达下调,包括IAA14,IAA18,AUX28(图。7和附加文件9:图S4,附加文件11:图S6)。然而,一些ARF家族基因,如ARF5/6/7和ARF19根中部区域的表达上调(图。7和附加文件9:图S4,附加文件11:图S6)。的LBD.转录因子家族是一个下游的组成部分ARF7和ARF19,并参与各种与生根相关的发育过程[54,55,56].LBD16,LBD18,LBD29,LBD33对拟南芥侧根的萌生和出现具有协同调控作用[26,57,58].在这项研究中,LBD16和LBD18被MC处理上调(图。7和附加文件9:图S4,附加文件11:图S6)。LBD18 / LBD33二聚体可能进一步调整对象E2FA.和E2FB.基因表达是细胞周期中刺激细胞进入S期和M期的两种转录激活因子[27,59,60].综上所述,MC主要通过诱导侧根形成过程中生长素相关转录因子来激活生长素信号。
MC在侧根形成过程中诱导细胞周期基因
侧根的形成受生长素介导的细胞周期和细胞分裂控制。生长素依赖的细胞周期主要由CDKA和CDKB控制[61].这个一个ctivity of CDK is largely determined by association with different cyclin partner CYCs [11,15,62].生长素和CTK的表达水平增加CYCD激活CDKA,表明其在细胞分裂中有丝分裂活性的重要作用[63,64,65].在我们的研究中,大多数赛克和CDK家族的基因,其中包括CYCA / B和CDKB.,在MC处理后72 h上调。KRP作为一种负调控因子,通过阻断G1-to-S的转变,在侧根起始早期被生长素转录调控[11,62].在这里,我们发现KRP被MC处理的种子下调(图。8b和附加文件10:图S5)。CDC45是启动染色体DNA复制所必需的。它作用于复制的起点和微小染色体的维持[66,67].这个peptidyl-prolyl isomerase (PPIase) family genes (CYP and FKBP) are essential for regulation of mitosis and cell growth [68].这个chromosomal structure maintains SMC is involved in cell cycle and DNA repair progression [69].在本研究中,MC处理后72 h, CDCs、FKBP、CYP和SMC均上调(图)。8b和附加文件10:图S5),表明MC通过细胞周期的转录调节引起横向根形成。
结论
综上所述,MC对棉花侧根形成的促进作用具有剂量依赖性,且在棉花根系中表现出有限、有效的持续时间和位置。在这里,我们发现MC浸渍种子通过调控GA合成和信号转导基因来抑制GA生物合成并降低GA水平。ABA信号进一步的基因影响,因为MC处理过的种子也会影响生长素信号和传输通过调节基因参与生长素生物合成、运输、和信号传导,细胞周期和细胞分裂过程,转录变化和被选为进一步确认了存在(附加文件11:图S6)。这些结果证实MC在横向根起始期间统治素食依赖性转录网络(图。9).乙烯通过调控生长素极性转运来改变MC处理下的生根。此外,MC通过调控生长素的表达来影响生长素的生物合成和转运YUC,阳极氧化铝,别针和l提示MC通过促进生长素与其他植物激素的协同作用影响侧根的形成。此外,随着生长素信号的激活,其下游靶点,LBDs和E2FS.,调控细胞周期进程。的压迫KRPs的归纳赛克,CDKs,疾病控制中心,FKBP,CYP,SMC,激活细胞周期,促进细胞分裂进程。结果表明,MC可能通过诱导生长素代谢和通过调节激素稳态来激活细胞周期和分裂过程来促进侧根的形成。
mc调控棉花侧根形成的模型。MC通过下调赤霉素的合成来抑制赤霉素的生物合成CPS,GA20oxs,和Ga3ox.和上调氧化镓.MC下调GID1激活德拉和Xerico.,ABA生物合成的诱导剂;此外,下调的ABAH降低了ABA的氧化降解,促进ABA积累。同时,MC通过UP-COMMENTION激活ABA信号传导Pyl8.,引出的表达MYB44和ARF7,可能促进表达WRKY23激活生长素信号。生长素运输基因l和别针在侧根起始区上调调控生长素最大值。差异YUC和阳极氧化铝增加养阴生物合成。养阴诱导的降解IAA14失败ARF7/19诱导LBD16/18,哪个负责激活E2Fa/b促进第一次不对称细胞分裂。此外,生长素增加了CYCD和CDKA.来调节g1到s的过渡,CDKA / B.和CYCA / B调节G2-to-M转换,以及疾病预防控制中心,FKBP,和CYP调节有丝分裂。综上所述,我们的数据表明,MC调控GA和ABA的代谢,进而调控生长素的信号传递、运输和生物合成,从而控制细胞分裂,负责侧根的形成
材料和方法
植物材料、实验装置及生长条件
十棉(gossypium hirsutum linn。品种K638、K836、Lu22 (L22)、Lu28 (L28)、Lu37 (L37)、Lu6269 (L6269)、国新3号(GX3)、国新9号(GX9)、新康4号(XK4)和中41号(Z41)为供试材料,由河北省国新农村技术服务协会、中国农业科学院棉花研究所、山东省农业科学院棉花研究中心提供。种子用15% H浸泡进行表面消毒2O215分钟,然后用自来水冲洗。设计了两种浸泡实验处理。实验1:将10种棉花种子浸泡在去离子水(对照)或氯化物中浸泡(MC,纯度97%,河北Guoxin Ahadzi生物科技有限公司Hejian,河北,中国)解决方案(400 Mg / L)30°C 12小时;实验2:将K638的种子浸泡在去离子水(对照)或不同浓度的MC溶液(100,200和400mg / L),在30℃下进行12小时。
种子在两张湿润的发芽纸(25 cm × 38 cm, Cat。No OP1015, Hoffman Manufacturing Inc., Albany, OR 97321, USA),带有背板支持。在离萌发纸顶端6 cm处排列7颗种子,间隔2.5 cm。每个品种有3个重复发芽板(共21粒种子)。发芽板垂直放置在有自来水的发芽槽中,以保证发芽纸在实验过程中保持水分。将发芽罐置于25°C黑暗处促进萌发。当幼苗生长超过发芽纸顶部,种皮自然脱壳后,移至光照10 h /黑暗14 h、(25±0.5/20±0.5)℃、相对湿度40 ~ 60%、(400±30)μmol m的定制生长室−2年代−1光合成有效辐射。
实验1在浸泡种子处理后12 DAT采集棉花幼苗在发芽纸上的图像,实验2在浸泡种子处理后6、8、10、12、14 DAT采集棉花幼苗在发芽纸上的图像。根据这些图像定量计算侧根的数量。
根系生长动态监测
利用定制的高通量机器人平台RhizoChamber-Monitor监测MC对根系生长的动态影响[42].K638的棉花种子通过在30℃下浸泡在30℃下进行12小时,然后用自来水冲洗并在银砂床(20厘米深度)中发芽3-4天直至出现。在移植之前,小心地冲走了沙子。选择每次治疗的三十颗幼苗进行移植。幼苗在根瘤杆菌中仔细放置[42].这些植物是在1点钟浇灌的 h间隔为50 ± 3. mL溶液。营养素浓度(mM)为:2.5 Ca(NO3.)2,1 mgso.4,0.5(NH4)H2宝4, 2 × 10− 4.CuSO4, 1 × 10− 3.ZnSO4FeNaEDTA, 2 × 10−2H3.薄3., 5 × 10−6(NH.4)6莫7O24, 1 × 10− 3.MNSO.4, 0.1 mM K2所以4.实验是在定制的生长室内进行的。
棉花幼苗移栽后12 d(浸泡处理后15 d)进行根系监测。根据根系形态特征和图像质量选择9种相似植物进行处理。一个定制的图像处理软件,用Matlab实现[42],自动提取根系基本生长性状,包括总根面积、总根长、主根长、侧根长和侧根数。利用该软件对主根不同部位的侧根数进行半自动提取。Wu等给出了RhizoChamber-Monitor系统和图像处理软件的详细信息[42].
RNA提取,cDNA文库的制备和测序RNA测序
将K638的种子浸泡在去离子水(对照)或400中 30 mg/L MC溶液 12摄氏度 H然后使用发芽纸卷对幼苗进行发芽,并将其放置在25℃下 生长室中黑暗中的摄氏度。种子发芽约36小时 h浸种后。浸种12、48和72天的根 h进行RNA序列分析。根尖区域(0到4 从根尖到根部中部(4到20–40毫米 除12个样本外,从根尖(毫米)处分别取样 因为根太短,不能分开。收获后,立即将样品冷冻在液氮中,并储存在室温下− 80°C用于RNA分离。每个处理分析三个独立的生物重复。每个重复采集约30根进行测序。
用RNAprep纯植物试剂盒提取总RNA。使用纳米光度计分光光度计(美国加利福尼亚州IMPLEN)检查RNA纯度。使用安捷伦2100生物分析仪中的安捷伦RNA 6000纳米芯片(安捷伦科技公司,美国加利福尼亚州圣克拉拉)评估RNA完整性和质量。
Two μg total RNA per sample was used as input material for the mRNA sample preparations. Sequencing libraries were generated using NEBNext UltraTM RNA Library Prep Kit for Illumina (NEB, USA) following manufacturer’s recommendations and index codes were added to attribute sequences to each sample.
根据制造商的说明,在使用TruseQ PE群集套件V4-CBOT-HS(Illumina)的CBOT簇生成系统上执行索引编码样本的聚类。在集群生成之后,在Illumina Hiseq 4000平台上测序库准备,并生成配对端150bp读取。
RNA-Seq统计分析
质量控制
fastq格式的原始数据(原始读取)首先通过内部perl脚本进行处理。在此步骤中,通过删除包含适配器和ploy-N的读以及原始数据的低质量读,可以获得干净数据(干净读)。同时计算干净数据的Q20、Q30、gc含量和序列重复水平。所有的下游分析都是基于高质量的干净数据。
基因表达水平的量化。
基因表达被标准化为FPKM(每百万次映射读数的外显子模型的每千碱基碎片)值[70].HTSEQ V0.5.3(embl,海德堡,德国)用于将读数的读数数计算为每个基因。FPKM> 1用作阈值以确定基因是否在随后的分析中表达。
采用主成分分析(PCA)和层次聚类方法对样本关系进行分析。PCA使用R中的prcomp函数进行,默认设置。基于皮尔逊相关生成所有样本的层次聚类。基于欧氏算法的K-means聚类,利用OmicShare工具(www.omicshare.com/工具)。
差异表达分析
使用DESEQ R包进行每个两种重复的差异表达分析[71.].DESeq提供了一个基于负二项分布的模型,用于确定数字基因表达数据中的差异表达的统计例程。由此产生的P值采用Benjamini和Hochberg的方法进行调整以控制错误发现率。基因的调整P-Value <0.05被分配为差异表达。
差异表达基因(DEGs)的GO和KEGG富集分析。
基于Wallenius非中心超几何分布的GOseq R包实现了DEGs的基因本体(GO)富集分析[72.,可以调节基因长度偏倚。KEGG [73.],通过基因组测序和其他高通量实验技术生成了一个数据库资源,用于了解生物系统的高级功能和效用,如细胞、生物体和分子水平的生态系统(http://www.genome.jp/kegg/).我们用的是KOBAS[74.]软件检测KEGG通路中DEGs的统计学富集程度。
实时定量PCR (qRT-PCR)分析
cDNA合成根据制造商的说明书用Superscript II逆转录酶(Invitrogen)进行。定量RT-PCR使用SYBR绿主混合物进行。的reaction volume was 15 μl which contained 1.5 μl of diluted cDNA, 0.3 μl of ROX reference dye, 0.3 μl of each 10 μM forward primer and reverse primer, and 7.5 μl SYBR Premier Ex Taq mix (Takara, Japan). PCR amplification was performed using two-step cycling conditions of 95 °C for 30 s, followed by 40 cycles of 95 °C for 5 s and 60 °C for 35 s. The levels of each gene transcript were calculated relative to its corresponding untreated control. Fold-changes of RNA transcripts were calculated by CT方法[75.].选取12个内参基因进行qRT-PCR分析。各内参基因的引物列于附加文件中5:表S5。
内源激素水平测定
在五个DAT中,植物激素,IAA,GA和ABA,并根据杨等人所述的方案提取和纯化。[76.].约2个 切去cm根,用去离子水冲洗。大约0.5 g新鲜根在2.0℃下均质化 ml 80%甲醇,储存于− 20 摄氏48度 H提取物在4000℃下离心 g代表15人 4分钟 °C,然后上清液通过C18 Sep-Pak筒(美国马萨诸塞州米尔福德沃特斯公司)。沉积物用10%的水重新悬浮 100%(v/v)甲醇和10毫升 毫升乙醚。之后,洗脱液在20℃下用纯N2干燥 摄氏度,然后储存在− 40 °C。按照Zhao等人所述的方案,通过ELISA技术测定植物激素的浓度[77.].内源性游离IAA、GA和ABA根据Weiler et al. [78.].
数据和材料的可用性
支持本文结论的数据集可在https://github.com/wuqiangithub/MC_Root_RNA-seq.
缩写
- BZL / PL:
-
分枝带长度/主根长度
- DAT:
-
浸泡种子处理后的日子
- 可见:
-
差异表达基因
- FPKM:
-
每千碱基外显子模型的片段每百万映射读取
- 主持人:
-
氯化甲吡喹
- 主成分分析:
-
主要成分分析
参考
- 1.
根发育的营养控制。植物土壤。2001;232:51-68。
- 2.
Osmont KS,Sibout R,Hardtke CS。隐藏分支:发展中的根系统架构。Annu Rev植物Biol。2007; 58:93-113。
- 3.
王雪峰,王志强,王志强。玉米的分枝根。一、一级分支及其数量、大小和分类。安机器人。1991;67:357。
- 4.
根尖直径和分枝密度对香蕉侧根伸长率的影响。环境Exp Bot. 2007; 59:243-51。
- 5.
E - mail: Michniewicz M, Sauer M, Teichmann T, Seifertová D, Jürgens G, et al.作为植物器官形成的一个共同模块的本地,外排依赖的生长素梯度。细胞。2003;115:591 - 602。
- 6.
Smet ID,Tetsumura T,Rybel BD,Dit Frey NF,Laplaze L,Casimiro I等。拟南芥基础分词中的侧根定位的辅助依赖性调节。发展。2007; 134:681-90。
- 7。
Lucas M,Godin C,Jay-allemand C,Laplaze L.植物素在根顶部共调节重力和侧根引发。J Exp Bot。2008; 59:55-66。
- 8。
杜布罗夫斯基JG,Sauer M,纳普利 - 门维尔S,Ivanchenko Mg,Friml J,Shishkova S等人。助生素充当局部形态发生触发器,以指定横向根创始人细胞。《美国国家科学院学报》上。2008; 105:8790-4。
- 9。
王金勇,王金勇,王金勇,等。高分辨率细胞特异性IAA分布和合成分析显示,拟南芥根尖的生长素梯度和最大值。植物细胞。2009;21:1659 - 68。
- 10.
Yu P,Eggert K,Wirén n,von Li C,Hochholdinger F.通过RNA Seq进行的细胞类型特异性基因表达分析显示,通过调节生长素相关的细胞周期调节,局部高硝酸盐触发了玉米地上部根的侧根起始。植物生理学。2015;169:690–704 00888.2015。
- 11.
黄志强,黄志强,黄志强,等。生长素介导的生长素诱导侧根形成的细胞周期激活。植物细胞。2002;14:2339-51。
- 12.
周期素依赖性激酶抑制剂KRP1的降解是由两种不同的泛素E3连接酶调控的。植物j . 2008; 53:705-16。
- 13.
Nieuwland J, Scofield S, Murray JAH。控制植物干细胞及其衍生物的分裂和分化。Semin Cell Dev Biol. 2009; 20:1134-42。
- 14
Sanz L,Dewitte W,Forzani C,Patell F,Nieuwland J,Wen B等人。拟南芥D型Cyclin Cycd2; 1和抑制剂ICK2 / KRP2调节肿瘤引起的横向根部形成。植物细胞。2011; 23:641-60TPC.110.080002。
- 15
陈志强,王志强,王志强,等。CYCA2s的发育调控有助于拟南芥组织特异性增殖。EMBO j . 2011; 30:3430-41。
- 16
Marchant A,Bhalerao R,Casimiro I,EklöfJ,Casero PJ,Bennett M等。Aux1通过促进拟南芥幼苗中的水槽和源组织之间的吲哚-3-乙酸分布来促进横向根系。植物细胞。2002; 14:589-97。
- 17
Marhavý P, Vanstraelen M, Rybel BD,赵军D, Bennett MJ, Beeckman T,等。内皮层和中柱鞘之间的生长素回流促进侧根的形成。EMBO j . 2013; 32:149-58。
- 18。
引用本文:张志强,张志强,张志强,等。在侧根器官发生过程中,细胞分裂素控制pin1依赖性生长素转运的极性。咕咕叫医学杂志。2014;24:1031-7。
- 19。
de Billy F, Grosjean C, May S, Bennett M, Cullimore JV。截茎紫花苜蓿中AUX1-like基因的表达研究表明,生长素在根瘤早期发育的两个阶段都需要。MPMI。2001; 14:267 - 77。
- 20.
Taylor-Teeples M, Lanctot A, Nemhauser JL。如上所述,生长素在侧器官发育中的作用。Dev杂志。2016;419:156 - 64。
- 21.
Fukaki H,Tameda S,Masuda H,Tasaka M.拟南芥单根/IAA14基因的功能增益突变阻止侧根形成。植物杂志,2002;29:153–68。
- 22。
Okushima Y,Overvoorde PJ,Arima K,Alonso JM,Chan A,Chang C等人。拟南芥植物症响应因子基因家族成员的功能基因组分析:ARF7和ARF19的独特和重叠功能。植物细胞。2005; 17:444-63。
- 23。
杜艳艳,张志强。植物生长素在植物侧根形成中的作用。J Exp Bot. 2018; 69:155-67。
- 24。
Lavenus J,Goh T,Guyomarc'h S,Hill K,Lucas M,VoßU等。对拟南芥侧根基因调控网络的推断表明了一种分岔机制,定义了原基侧翼和中心区域。植物细胞。2015;27:1368–88。
- 25。
Stoeckle d,Thellmann男,维米尔JE。Arabidopsis Thaliana的突出侧根出现。CurrOp植物BIOL。2018; 41:67-72。
- 26。
OKUSHIMA Y,Fukaki H,Onoda M,神学is,塔斯卡卡M.ARF7和ARF19通过直接激活拟南芥的LBD / ASL基因调节横向根部。植物细胞。2007; 19:118-30。
- 27。
Berckmans B,Vassileva V,Schmid SPC,Maes S,Parizot B,Naramoto S等人。通过横向器官边界蛋白通过拟南芥E2Fa的转录调节,依赖依赖性细胞周期再激活。植物细胞。2011; 23:3671-83。
- 28.
郭杰,施特劳斯,蔡希杰,方克,陈毅,蒋X,等。赤霉素通过与生长素和其他激素的相互作用调节杨树侧根的形成。植物细胞。2010;22:623-39。
- 29.
shr, Burch AY, Huppert KA, Tiwari SB, Murphy AS, Guilfoyle TJ,等。拟南芥转录因子MYB77调控生长素信号转导。植物细胞。2007;19:2440-53。
- 30.
赵y,xing l,wang x,hou y j,gao j,王p等。ABA受体Pyl8通过增强患有症响应基因的MyB77依赖性转录来促进侧向根生长。SCI信号。2014; 7:RA53。
- 31。
ab4通过降低生长素极性运输调控拟南芥侧根形成的脱落酸和细胞分裂素。植物细胞。2010;22:3560-73 tpc.110.074641。
- 32.
Negi S,Ivanchenko MG,Muday GK.乙烯调节拟南芥侧根形成和生长素运输.植物杂志2008;55:175–87。
- 33.
乙烯是葡萄糖诱导拟南芥侧根萌发的负调控因子。植物信号学报。2015;10:e1058460。
- 34.
孙军,徐勇,叶胜,姜辉,陈强,刘芳,等。在拟南芥侧根形成过程中,ASA1在茉莉酸介导的生长素生物合成和转运调控中发挥重要作用。植物细胞。2009;21:1495 - 511。
- 35.
孙军,陈强,齐磊,姜辉,李胜,徐勇,等。茉莉酸调节拟南芥PIN2蛋白的胞吞和质膜积累。新植醇。2011;191:360 - 75。
- 36.
《生长延缓剂:对赤霉素生物合成和其他代谢途径的影响》,Annu Rev Plant Physical Plant Mol Biol.2000;51:501–31。
- 37.
De Almeida AQ,Rosolem Ca.棉根草和枝叶增长,受到氯化物氯化物到棉籽的影响。Acta SCI农学。2012; 34:61-5。
- 38
雷迪·VR,贝克·DN,霍奇斯·霍夫。温度和氯化甲哌喹对棉花冠层结构的影响。Agron J.1990;82:190–5。
- 39
杨飞,杜敏,田旭,恩尼吉·艾艾,段磊,李铮。植物生长调控对棉花钾吸收和利用效率的影响。田间作物Res. 2014; 163:109-18。
- 40.
王l,mu c,du m,chen y,tian x,zhang m等。氯化物在棉花伸长中的作用(陆地棉(L.)节间与低浓度的赤霉素有关。植物科学。2014;225:15-23。
- 41.
顾S,evers jb,张l,毛升,张某,赵x等。塑造棉花植物的结构响应与氯化物和种群密度的构建。Ann Bot。2014; 114:877-87。
- 42.
吴军,吴强,Pagès L,袁勇,张旭,杜敏,等。根室监测:一个机器人平台和软件,使表征根系生长。工厂方法。2018;14。https://doi.org/10.1186/s13007-018-0316-5.
- 43.
Tsukagoshi H,BuSch W,Benfey Pn。ROS的转录调节控制从扩散到根系中的分化转变。细胞。2010; 143:606-16。
- 44.
多效唑处理番茄植株的生理反应及产量Lycopersicon esculentum植物生长规律2000;30:117-23。
- 45.
Saraiva Grossi JA,de Moraes PJ,de Araújo TS,Barbosa JG,Finger FL,Cecon PR.多效唑对“pitanga”观赏辣椒生长和结果特性的影响.植物学报,2005;683:333–6。
- 46。
移栽沃森G.影响和多效唑对“绿柱”黑枫和“峰会”灰绿色的根系生长。ĴENVIRON Hortic。2004; 22:209-12。
- 47。
等。转基因gai或rgl1导致杨树矮化,并改变赤霉素、根系生长和代谢谱。足底。2006;224:288 - 99。
- 48。
Ariizumi T, Hauvermale AL, Nelson SK, Hanada A, Yamaguchi S, Steber CM。通过Nonproteolytic gibberellin signaling,解除DELLA对拟南芥种子萌发的抑制。植物杂志。2013;162:2125-39。
- 49。
田中康,田中康,田中康,等。拟南芥生长素的主要生物合成途径。《美国国家科学院学报》上。2011; 108:18512-7。
- 50。
IAA28的功能获得突变抑制侧根发育。植物细胞。2001;13:465 - 80。
- 51。
Tatematsu K,Kumagai S,Muto H,Sato A,Watahiki Mk,Harper RM等。Massumu2编码Aux / Iaa19,一种毒素调节的蛋白质,其与转录活化剂NPH4 / ARF7一起致电,以调节下胚轴的差异生长响应并在拟南芥中形成侧重根。植物细胞。2004; 16:379-93。
- 52。
Uehara T,Okushima Y,Mimura T,Tasaka M,Fukaki H.CRANE/IAA18中的结构域II突变抑制拟南芥侧根形成并影响新梢发育。植物细胞生理学。2008;49:1025–38。
- 53。
De Rybel B,Vassileva V,Parizot B,Demeulenaere M,Grunewald W,Audenaert D等人。一种新颖的AUX / IAA28信令级联激活横向根系创始人特性的GATA23依赖性规范。Curr Biol。2010; 20:1697-706。
- 54。
等。冠状无根1是水稻冠状根形成所必需的,是生长素反应因子在生长素信号转导中的靶点。植物细胞。2005;17:1387 - 96。
- 55。
王志强,王志强,王志强,等。玉米RTCS基因编码一个LOB结构域蛋白,该蛋白是胚胎种子和胚后芽生根起始的关键调控因子。植物j . 2007; 50:649。
- 56.
Péret B, De Rybel B, Casimiro I, Benková E, Swarup R, laplazl, et al.;拟南芥侧根发育:一个新兴的故事。植物学报。2009;14:399-408。
- 57.
Lee HW,Kim Ny,Lee DJ,Kim J.LBD18 / ASL20在ARF7和ARF19的下游的LBD16 / ASL18中调节横向根部形成和拟南芥。植物理性。2009; 151:1377-89。
- 58.
关键词:拟南芥,生长素诱导,LBD基因,侧根形成足底。2012;236:1227-37。
- 59.
Magyar Z,Veylder Ld,Atanassova A,Bakól,inzéd,BögreL。拟南芥E2FB转录因子在调节养阴依赖性细胞分裂方面的作用。植物细胞。2005; 17:2527-41。
- 60.
Sozzani R,Maggio C,Varotto S,Canova S,Bergounioux C,Albani D等人。拟南芥激活因子E2FB和E2FA之间的相互作用在细胞周期进展和发展中。植物理性。2006; 140:1355-66。
- 61.
Polyn S,Willems A,De Veylder L.《植物发育过程中的细胞周期进入、维持和退出》。Curr Opin plant Biol.2015;23:1–7。
- 62.
王志强,王志强,王志强,等。早期侧根起始的转录谱分析。中国科学院院刊2004;101:5146-51。
- 63.
Riou的-Khamlichi C,亨特利R,Jacqmard A,默里扎哈。细胞分裂素活化拟南芥细胞分裂的通过d型细胞周期蛋白。科学。1999; 283:1541-4。
- 64.
弗朗西斯·D·索雷尔·达。细胞周期和植物生长调节剂之间的界面:一个小型综述。植物生长调节。2001;33:1–12.
- 65.
对生长素的细胞反应:分裂与扩张。《冷泉Harb展望生物学》2010;2:a001446。
- 66.
Hopwood B, Dalton S. Cdc45p组装成一个Cdc46p/Mcm5p的复合物,是微型染色体维持所必需的,也是染色体DNA复制所必需的。中国科学(d辑:地球科学)1996;93:12309-14。
- 67.
关键词:酵母,CDC45, DNA复制,起始识别复合物,mcm蛋白细胞生物学杂志1997;17:553-63。
- 68.
陆吉,刘y-c,周谢兹。固定脯氨酸定向的磷酸化信号。趋势细胞BIOL。2002; 12:164-72。
- 69.
Yazdi PT, Wang Y, Zhao S, Patel N, Lee EY-HP, Qin J. SMC1是人类S相检查点ATM/NBS1分支的下游效应子。基因Dev。2002;16:571 - 82。
- 70
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold B.用RNA-SEQ进行测绘和量化哺乳动物转录om。NAT方法。2008; 5:621-8。
- 71
序列计数数据的差异表达分析。基因组医学杂志。2010;11:R106。
- 72
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体论分析:考虑选择偏差。基因组医学杂志。2010;11:R14。
- 73
Kanehisa M,Araaki M,Goto S,Hattori M,Hirakawa M,Itoh M等。Kegg用于将基因组联系到生命和环境。核酸RES。2008; 36(SUPPLE_1):D480-4。
- 74。
基于KEGG Orthology (KO)的自动化基因组注释和路径识别。生物信息学。2005;21:3787 - 93。
- 75。
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。
- 76。
杨军,张军,王铮,朱强,王伟。灌浆期水分胁迫下水稻籽粒激素变化。植物杂志。2001;127:315-23。
- 77。
李赵J, G, Yi G-X王b m,邓ax,南T-G, et al。小分子的传统间接竞争酶联免疫吸附试验(icELISA)与简化icELISA的比较。Acta agricula sinica; 2006; 571:79-85。
- 78。
Weiler Ew,Jourdan Ps,Conrad W.吲哚-3-乙酸的水平完整和斩首COLEOPTIL,如特定且高敏化固相酶免疫测定法测定。Planta。1981; 153:561-71。
致谢
我们感谢张晓雷和王赛在实验中给予的帮助。我们感谢小凯文·l·考克斯博士对手稿的批判性阅读。
资金
这项工作由国家重点研究开发项目(Sq2018YFD10000)资助,中国博士后科学基金会赵虎丽(2017)资助。 M620960)至Q.W.,新疆生产建设兵团科技项目(2018AB039)至杜明伟。
作者信息
从属关系
贡献
ZL, XT和FL构思和设计了研究;QW和QW进行了实验;QW、MD、JW、NW、BW对数据进行分析解释;QW, FL和XT准备了手稿。所有作者阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
从所有作者获得同意和批准出版物。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
Illumina测序后的序列组装总结。
附加文件2:表S2。
统计不同表达水平区间的基因。
附加文件3:表S3。
差异表达基因的归因富集分析。
附加文件4:表S4。
ABA,GA-和乙烯相关的差异表达基因的名单
附加文件5:表S5。
用于QRT-PCR分析的每个参考基因的引物。
附加文件6:图S1。
转录组样本的关系。A. MC处理后3个时间点Control和MC RNA-Seq样品的主成分分析(PCA);B.基于Pearson相关性的RNA-Seq样本层次聚类。高度表示y轴的方差程度。用去离子水(对照)或400 mg/L MC处理K638棉籽12 h。分别对处理后12、48和72 h的根进行RNA-seq分析。“R”表示整个根,“M”表示根中间区域(距离根尖4 ~ 20 ~ 40mm),“T”表示根尖区域(距离根尖0 ~ 4mm)。
附加文件7:图S2。
根中部和根尖每个时间点下调和上调的DEGs的功能注释和GO富集。
附加文件8:图S3。
KEGG通路的功能富集的统计分析。盒子里的值是丰富基因的数量,盒子里和括号里的值是P- value(0代表P < 0.01).
附加文件9:图S4。
上调并在MC处理下调的激素相关度的视角。用去离子水(对照)或400 mg/L MC浸种处理K638棉籽12 h。的DEGs were collected with FDR < 5%.
附加文件10:图S5。
MC处理后,不同基因家族的细胞周期/分裂相关基因表达上调或下调,包括CDC,CDK,细胞周期蛋白,KRP,CYP,FKBP和SMC.用去离子水(对照)或400 mg/L MC处理K638棉籽12 h。MC处理72 h后,在根中部(FDR < 5%)收集DEGs。
附加文件11:图S6。
的生长素和细胞周期相关基因的相对表达模式。A.在控制和MC生长素生物合成和转运的基因的表达动力学。通过定量RT-PCR对应A基因B.相对转录水平。在控制和MC生长素和细胞周期相关基因C的相对表达。通过qRT-PCR对应至C基因D.相对转录物水平。
权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
吴强,杜敏,吴杰。et al。助壮素通过调节植物激素促进动态平衡棉花侧根形成。植物生物学19,573 (2019). https://doi.org/10.1186/s12870-019-2176-1
收到了:
接受:
出版:
关键字
- 棉花
- Mepiquat氯(MC)
- 侧根
- 植物激素
- 转录组