抽象的
背景
梨是世界上最重要的水果作物之一。花青素和原花青素是影响梨外观和营养品质的重要次生代谢产物。然而,对梨花青素和PA积累的分子机制研究甚少。
结果
通过代谢组和转录组分析,鉴定了参与梨品种‘Clapp Favorite’(CF)及其红色突变品种‘red Clapp Favorite’(RCF)幼果中花青素和PA积累的候选基因。基因代谢物相关性分析显示,20个基因的“核心集合”与10个花青素和7个PA代谢物密切相关。其中,PcGSTF12被证实参与了花青素和PA积累通过互补tt19-7拟南芥突变体。有趣的是,PcGSTF12而不是petunidin 3,5 -二葡萄糖苷,与AtGSTs在拟南芥.转变PcGSTF12极大地促进或抑制参与花青素和PA生物合成、调控和运输的基因。电泳迁移率和荧光素酶报告基因检测证实PcGSTF12PcMYB114。
结论
这些发现鉴定了梨中的花青素和PA积累的核心基因组。其中,PcGSTF12,确认参与花青素和PA积累。我们的结果还鉴定了包含两个核基因的重要花青素和PA调节节点,PcGSTF12和PCMYB114.这些结果为研究梨中花青素和PA的积累提供了新的思路,并为梨的功能研究和育种提供了有价值的数据集。
背景
梨是人类消费的重要水果,其全球总产量仅次于葡萄和苹果,位居世界第三[1].梨在全世界76个国家或地区商业培养[2其中,中国是世界上最大的梨生产国。2017年,中国生产了1640万吨梨果,占全球梨产量(2420万吨)的68% (FAOSTAT, 2017)。
梨是花青素和procyanidin(Pa)代谢物的良好来源。迄今为止,在红梨品种中已鉴定出五种花青素3-葡糖苷,Cyanidin 3-葡糖苷,Cyanidin 3-葡糖苷,辣味素蛋白3-葡糖苷,芍药蛋白3-葡糖苷和芍药蛋白3-葡糖苷。‘D’Anjou’ [3.]和'红色zaosu'[4.].花青素和PAs在梨的果皮中含量丰富,它们有助于梨的颜色、味道和营养[5.].
花青素和PA的生物合成途径已经在植物中得到了很好的描述。花青素和PA最初由苯丙氨酸生物合成,在类黄酮生物合成途径中共享大部分步骤。它们是通过酶在胞质中生物合成的,酶包括苯丙氨酸解氨酶(PAL)、查尔酮异构酶(CHI)、查尔酮合酶(CHS)、类黄酮3-羟化酶(F3H)和二氢黄酮醇还原酶(DFR) [6.].白花青素和花青素是花青素和PA生物合成途径之间的两个重要分支。这些分支点下游的花青素由花青素合成酶(ANS)和udp -葡萄糖类黄酮3-葡萄糖转移酶(UFGT)合成,PAs由亮色花青素还原酶(LAR)和花青素还原酶(ANR)合成[7.那8.].O-甲基转移酶(OMT)和糖基转移酶(GT)负责制定各种花青素和PAS [9.那10].在细胞溶溶胶中合成花青素和PAS后,它们被运输到其最终目的地,液泡。一些谷胱甘肽S-转移酶(GSTS)和多药和毒性复合挤出蛋白(配对)被认为用作花青素和PA载体蛋白,以将它们隔离成真空[11].
在众多植物中广泛研究了花青素和PA积累的分子机制。已经确定并表征了许多花青素和PA结构基因及其上游调节因子。其中,R2R3-MYB TFS通过与BHLH和WD40蛋白一起作用来调节结构基因,在控制花青素和PA积累时起着关键作用。编码有助于花青素累积的R2R3-MYB TFS的基因包括MdMYB1在苹果,Pymyb10.和Pymyb114.梨,vvmyba1.在葡萄中[12那13那14那15].一些R2R3-MYB TFS调节花青素和PAS,包括VvMYB5a和VvMYB5b在葡萄,MdMYB9和mdmyb11.在苹果,PBMYB10B.和PBMYB9.梨,PpMYB18在桃子[4.那16.那17.那18.那19.].其他R2R3-MYB TFS仅适用于PA的监管,包括VvMYBPA1在葡萄和PpMYBPA1在桃子[16.那20.].此外,其他转录因子如AUX和ERF也通过与R2R3-MYB转录因子和结构基因直接或间接相互作用调控花青素或PA生物合成[21.那22.].
近年来,转录组和代谢组分析技术的发展为识别新的基因和代谢产物,阐明植物复杂的次生代谢过程提供了有效的方法。在图(榕辣海参L.),集成的转录组和代谢物分析揭示了黄酮类化合物和花青素途径中的基因,其显示紫色和绿皮肤品种之间的差异表达[23.].另一项研究使用转录组和代谢组数据集成功地在马铃薯中构建了表达-花青素代谢网络[24.].最近,鉴定出7个类黄酮代谢产物和6个基因与红肉和绿肉品种的着色相关猕猴桃arguta[25.].
红梨富含花青素和果酸,具有很高的营养价值和经济价值。因此,研究花青素和PA的调控对提高梨花青素和PA产量具有重要意义。由于花青素和PAs的数量众多,其在梨中的生物合成和修饰的分子机制可能比预期的更为复杂。芽突变是红梨新品种选育的重要方法。红色突变具有高度相似的遗传背景,是研究花青素和PA积累分子机制的理想材料[13].在本研究中,我们进行了代谢物和转录组分析,以鉴定使用“CF”的年轻果实和其红突变体“RCF”的梨中参与梨中参与梨的候选基因。差异表达基因(DEGS)和花青素/ PAS之间的相关分析显示了203个候选基因,用于在梨中积累10个花青素和七种PAS。其中,20个基因与所有10个花青素和七种PAS强烈相关。因此,它们似乎是与花青素和梨中的PA积累有关的核心候选基因。的GST.基因PcGSTF12与大多数花青素和Pa代谢物相关。PcGSTF12通过功能互补分析证实其在梨花青素和PA积累中起重要作用。此外,PcGSTF12被发现直接和积极地由PCMyB114,众所周知的TF调节梨中的花青素积累。这些结果极大地延长了我们对梨子中花青素/ PA积累的分子机制的了解。
结果
Anthocyanin和'CF'的PA型材及其红色突变体'RCF'
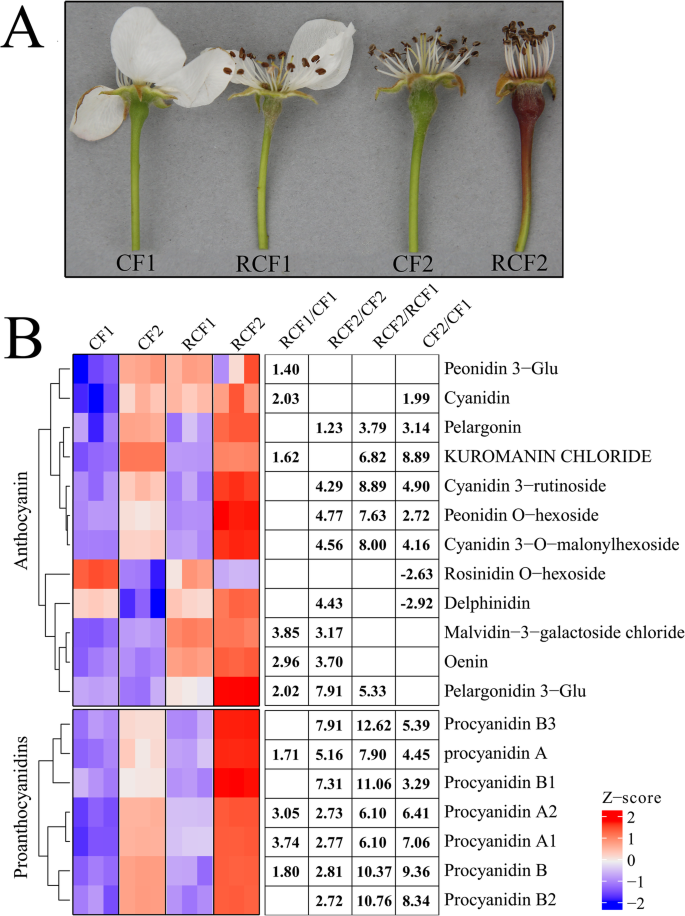
除肤色外,在“CF”的果实和红突变体“RCF”中没有观察到显着的形态差异。'CF'和'RCF'的年轻果实最初有一个深绿色的外观。'CF'和'RCF'之间的色差在完全绽放(DAFB)之后大约5天开始可见。“RCF”果实迅速变为深红色,并保持其强烈的颜色直至成熟。相比之下,'CF'的果实仅在曝光表面上开发了轻微的红色腮红(图。1一个)。
颜料的变化(花青素和原霉素; PAS)内容在“CF”和“RCF”中。一种果实‘CF’和‘RCF’色素沉着的变化。B.在'CF'和'RCF'剥皮中浓度的花青素和PAS。‘CF1’ and ‘RCF1’ refer to fruits of ‘CF’ and ‘RCF’ collected at 2 days after full bloom (DAFB), respectively, ‘CF2’ and ‘RCF2’ refer to fruits of ‘CF’ and ‘RCF’ collected at 5 DAFB, respectively. Numbers refer to -fold change in metabolite contents
我们对‘CF’及其红色突变体‘RCF’中的单个花青素和PAs进行了鉴定和量化。我们从' CF1 '、' RCF1 '、' CF2 '和' RCF2 '中鉴定并定量了12种花青素和7种PAs。花青素代谢产物包括天竺葵苷、天竺葵苷3-芦丁苷、天竺葵苷3-谷氨酸、malvidin-3-半乳糖苷、花青素3- o -丙二酰己苷、花青素、飞燕花苷、芍药苷o -己苷、花青素、蔷薇苷o -己苷;PAs包括原花青素A、原花青素B3、原花青素B、原花青素A1和原花青素A2,均为首次在梨中检测到。如图所示。1B,与'CF'相比,大多数花青素和PAS在“RCF”中显着上调。在“CF”和“RCF”中的花青素和PAS的水平最初是低的,然后在果实着色过程中急剧增加,除了替代蛋白和松香蛋白O-己醚外(图。1b).这些色素积累模式与‘RCF’和‘CF’显著不同的果实颜色表型一致。
两个品种间代谢物水平显著差异的临界值为预测值(VIP)≥1和| log2(fold change) |≥1。根据这些标准,‘RCF1’与‘CF1’、‘RCF2’与‘CF2’、‘RCF2’与‘RCF1’、‘CF2’与‘CF1’四个对照组中,6、8、6、8个花青素代谢物,4、7、7和7个PA代谢物分别积累显著差异(Supplementary Table)S1).因此,选择这些花青素和PAS用于进一步代谢物和转录物相关分析。
转录组分析
RNA-SEQ工艺得到95.6克干净的基础和6.37亿清洁阅读。每个样本的平均清洁读数数为5300万。清洁读数,93.54%总共映射,90.72%唯一地映射到改善的苹果参考基因组序列。总共,用FPKM≥10表示14,514个基因(补充表S2).
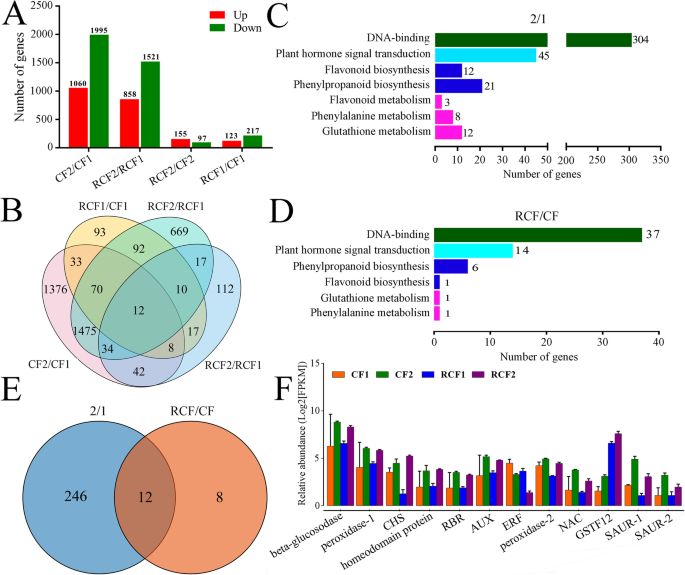
我们在四个对照组中鉴定了4065个DEGs。‘RCF1’与‘CF1’之间有340个DEGs,‘RCF2’与‘CF2’之间有252个DEGs,‘RCF2’与‘RCF1’之间有2379个DEGs,‘CF2’与‘CF1’之间有3055个DEGs(补充表)S3):在对照组中,分别有123、155、858、1060个基因表达上调,217、97、1521、1995个基因表达下调(图1)。2a).四个对照组中只有12个deg是共同的(图。2b)。
第2-1组和rCF-CF之间的次数进行了进展(补充表S4)和Kegg功能途径分析(补充表S5).对于用花青素和PAS的相关试验,我们在第2-1组中选择了DNA结合,植物激素信号转导,黄酮类生物合成,苯丙酮化生物合成,类黄酮代谢,苯丙氨酸代谢,谷胱甘肽代谢,分类为Grous RCF-CF组中的谷胱甘肽代谢和参见DNA结合,植物激素信号转导,苯丙醇丙烷生物合成,黄酮类生物合成,谷胱甘肽代谢和苯丙氨酸代谢(图。2总共,我们选择了203个deg。其中,2-1组(' RCF2 ' vs. RCF1 ', ' CF2 ' vs. CF1 ')和rcf组(' RCF1 ' vs. CF1 ', ' RCF2 ' vs. CF2 ')之间有12个差异。这12个deg编码了一个β-葡萄糖苷酶(PCP011059),两个过氧化物酶(PCP024451和PCP017906),一个CHS (PCP023048),一个同源结构域蛋白(PCP024513),一个ERF (PCP044584),一个RBR(视网膜母细胞瘤相关蛋白,PCP007207),一个AUX (PCP036703),一个NAC (PCP028501),一个GST (PCP025171)和两个SAURs (PCP037299和PCP040169)(图)。2e)。其中,PcGST(PCP025171)是对照组RCF1上调最多的基因vs..CF1'和'RCF2vs..cf2'(图。2f)。
所选转录本与花青素/PAs的相关性分析
为了鉴定梨花青素和PA积累的候选基因,我们对选定的转录本和代谢物进行了相关性分析。共检测到420个显著相关(相关系数R2 > 0.8) between 203 transcripts and 17 metabolites, including 10 anthocyanins (kuromanin chloride, pelargonin, cyanidin 3-rutinoside, pelargonidin 3-Glu, malvidin-3-galactoside chloride, cyanidin 3-O-malonylhexoside, oenin, delphinidin, peonidin O-hexoside, cyanidin, and rosinidin O-hexoside) and seven PAs (procyanidin A, procyanidin A1, procyanidin A2, procyanidin B, procyanidin B1, procyanidin B2, and procyanidin B3) (Supplementary TableS6).每种代谢物与许多不同的转录物相关。麦类-3-半乳糖苷氯化物,Oenin和Delphinidin分别与最少的转录物:五,七和三个转录物相关。KulaniNin氯化物和Pelargonin分别与最多数量的转录物:184和56转录物相关。有趣的是,Kurancon氯化物和Pelargonin分享了最多的常见转录物(36份转录物)。这表明Kulanian氯化物和肉肝苷可能已经进化了类似的积累机制。
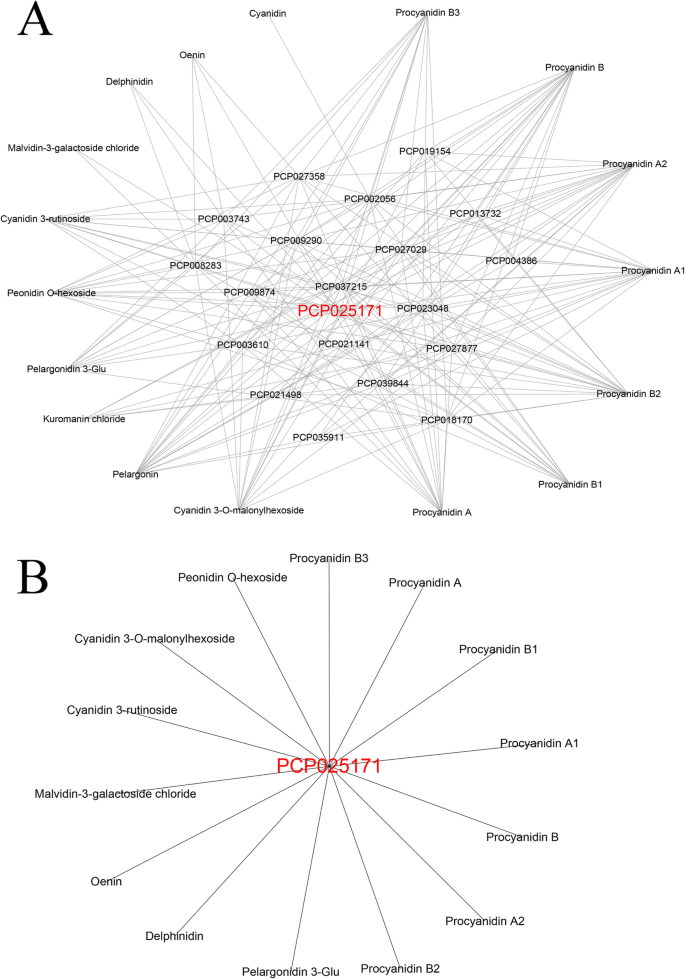
203转录物用Swissprot和NR数据库的描述注释。已经在功能上表现出六种转录物,以前在梨中的梨蛋白积累中的作用:PcMYB10那PCMYB114那PcCHS那PcCHI那pcf3h,和PcANS(补充表S7).其余基因被新鉴定为参与梨花青素和PA积累的候选基因。203份转录本分为两组(I-II)(补充表)S7).簇中的基因我与花青素密切相关。集群I包含183个基因(90.1%)。其中,147个基因与单个花青素相关:142个基因与Kurancan氯化物相关,三种基因与Cyanidin相关,一个基因与麦芽素-3-半乳糖胺氯化物相关,并且一种基因与Pelargonin相关。群体中的剩余基因与两个或更多个花青素密切相关:31种基因通常与Kulancin氯化物和Pelargonin相关,两个基因与肉豆苷和Cyanidin相关,两个基因与麦芽素-3-半乳糖胺氯化物和OENin相关。一个基因与Cyanidin 3- rutinoside,Oenin和Cyanidin相关。簇II含有20个基因(9.9%)与花青素和PAS强烈相关。这些基因,两个苯基丙醇结构基因(编码4Cl1和4Cl2),六种类黄酮结构基因(编码CHS,3 CHI,F3h和ANS),六种TF基因(编码BzIP1,MYB3,MYB86,MYB111,MYB114和KNAT1)那two phytohormone signal transduction genes (encoding IAA13 and ERF003), two DNA-directed RNA polymerase genes (encoding rpoB and Rpb1) and one GST transporter gene (encoding GSTF12) were positively correlated with anthocyanins and PAs. One WRKY TF gene,Wrky28,与花青素和PAS呈负相关(补充表S7那S8).簇II中的每个基因都与许多代谢物密切相关。我们发现这20个基因与所有17个花青素和PA代谢物都有很强的相关性(图。3.一个)。因此,它们被认为代表梨中花青素和PA积聚的核心基因。其中,PcRPB1(PCP004386)与最少的代谢物相关:1个花青素和3个PAs;和PcGSTF12(PCP025171)与大多数代谢产物相关:7种花青素和7种PAs(图。3.b)。
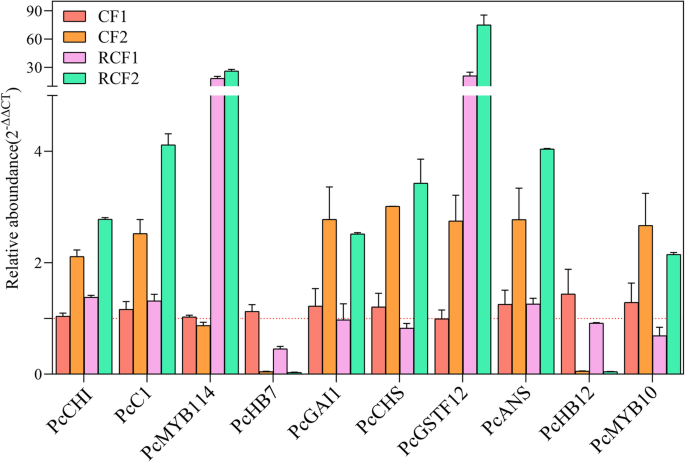
QPCR分析与花青素和PA积累有关的DEGS
为了验证RNA-SEQ数据,我们对花青素和/或PA候选基因的10个进行了QPCR分析:PcCHI那PcC1那PCMYB114那PcHB7那PcGAI1那PcCHS那PcGSTF12那PcANS那PCHB12,和PcMYB10(基因id及引物见补充表S9).所有选择的基因的转录谱与从RNA-seq数据中检测到的转录谱非常相似(图)。4.).结果表明PcGSTF12“RCF1 vs. CF1”和“RCF2 vs. CF2”在对照组中上调最多。这一结果与RNA-seq的结果高度一致,进一步证明了基因的关键作用PcGSTF12在梨中的花青素和Pa积累。因此,我们进一步分析以确认功能PcGSTF12.
PcGSTF12- 在梨中呈现的花青素和Pa积累
我们的代谢产物和转录组分析显示了一种与梨花青素和PAS密切相关的核心基因集,这强烈建议他们在梨中发挥关键作用和PA积累。为了测试这一点,我们专注于核心组的核心组和PA候选基因中最上调的基因,PcGSTF12,用于功能分析。
功能分析PcGSTF12
系统发育分析表明PcGSTF12是一个同源物FvRAP在草莓,Riant2在桃子里,和MdGST在apple中,所有的都在phi亚家族中[26.(图。5.一个)。Phi亚家族的成员是花青素转运蛋白。测试潜在的作用PcGSTF12在花青素积累中,35S::PcGSTF12被转变为拟南芥突变体tt19-7(对于引物,见补充表S9).的tt19-7植株表现为绿色的下胚轴表型tt19-7 -OE转基因植株表现出红色的下胚轴表型,与野生型(WT)相似(图)。5.b).然而,种皮的棕色并没有得到拯救tt19-7- 一条线(图。5.b)。该结果与通过转移35s ::获得的新鲜种子表型一致RAP-RFP.进入拟南芥tt19-7[26.].
功能分析PcGSTF12在花青素和原花青素(PA)的积累中。一种PcGSTF12及其同源基因的系统发育分析。登录号为MdGST (AEN84869), Riant2 (KT312848), LcGST4 (KT946768), AN9 (Y07721), FvRAP-L1 (gene28763), VvGST4 (AAX81329), CsGST (ABA42223), AtGSTF2 (At4G02520), AtGSTF5 (At1G02940), AtGSTF3 (At2G02930), bronse -2 (AAV64226), FvRAP-L7 (gene10552), AtGSTF12/TT19 (At5G17220), AtGSTF14 (At1G49860), AtGSTF7 (At1G02920), VvGST1 (AAN85826),FvRAP (gene31672), FvRAP- l4 (gene10549), FvRAP- l2 (gene08595), FvRAP- l3 (gene22014), AtGSTF10 (At2G30870), FvRAP- l5 (gene10550), AtGSTF11 (At3G03190), AtGSTF13 (At3G62760), FvRAP- l6 (gene10551), AtGSTF8 (At2G47730), AtGSTF4 (At1G02950), AtGSTF6 (At1G02930), AtGSTF9 (At2G30860)。B.表型的tt19-7-OE幼苗和新鲜种子。C花青素的热图和7天幼苗的PAStt19-7突变体,tt19-7-OE和WT(野生型)tt19-7- ie指的是35s ::PcGSTF12转基因线。比例尺:5mm (B-C)。WT和tt19-7-OE标记为红星。D.记录水平之间的相关分析PcGSTF12和PCMYB114.E.EMSA化验。探针为含有MBS基序的生物素标记片段。竞争探针为无标记探针。突变探针包含两个核苷酸突变。在每个反应中,竞争对手和超出10×、25×和50×摩尔的突变探针存在(+)或不存在(-)。黑色箭头表示倍数增加。FPCMYB114对荧光素报道分析证明的推动者活动的影响。空载体被用作控制。值是三个独立生物重复的±SD。统计学意义: **P.<0.01
探讨的作用PcGSTF12在花青素和PA的积累中,我们利用代谢产物分析拟南芥幼苗。3个PAs和9个花色苷显著上调,3个花色苷显著下调tt19-7- 同学相比tt19-7.其中,原花青素A3、花青素o -乙酰己苷、飞燕草苷3- o -芦丁苷、花青素3-对羟基苯甲酰sophoside -5-glucoside特异上调tt19-7- 同学相比tt19-7(图。5.c). 5种花色苷(malvidin 3-乙酰-5-二葡萄糖苷、天竺葵苷3- o -beta- d -葡萄糖苷、飞燕花苷3- o -芦丁苷、天竺葵苷、花青素3- o -半乳糖苷)和1种PA(原花青素A3)显著上调,2种花色苷(petunidin 3,5 -二葡萄糖苷和飞燕花苷o -丙二酰-丙二酰己苷)显著下调tt19-7有趣的是,在WT中检测到大量的petunidin 3,5 -二葡萄糖苷,而在WT中检测不到tt19-7oe。而原花青素A3仅在tt19-7oe。这些结果证实了PcGSTF12负责花青素和PA的积累。有趣的是,其对花青素和PAs的亲和力不同于AtGSTs在拟南芥.特别是,我们的结果表明PcGSTF12是负责前花青素A3的积累,而不是petunidin 3,5 -二葡萄糖苷,与AtGSTs在拟南芥.PcGSTF12是一个新发现的PHI GST系列成员,参与了花青素和PA积累。
接下来,我们分析RNA-seq数据,以确定哪些基因受到影响PcGSTF12在幼苗tt19-7oe vs。tt19-7.我们总共发现了28个受强烈影响的基因,它们编码的蛋白涉及花青素和PA的生物合成、调控和运输(补充表)S10).这些结果表明PcGSTF12可能不仅是一种花青素和PA运输扣,而且还可能参与花青素和PA积累的许多其他步骤。
上游规定PCGST12.
相关分析表明,转录水平PcGSTF12与此显着相关PCMYB114(图。5.d)。此外,发现了几种MYB结合位点PcGSTF12子,这表明PcGSTF12可能直接受到MYB转录因子(补充表S11).已知有几个R2R3-MYB基因与MBS位点结合[27.,在起始密码子上游801-bp区域内发现一个MBS位点。因此,该MBS位点被用于EMSA检测(引物见补充表)S9).生物素化探针能够结合PcMYB114蛋白,添加高浓度的冷探针显著降低了生物素化探针的结合亲和力。测试是否PcGSTF12可以被PcMYB114调控,我们进一步进行荧光素酶报告基因检测(引物见补充表S9).LUC的相对活性PcGSTF12启动子的空载体对照约为6倍。这些结果表明,PCMYB114可以直接与MBS网站结合PcGSTF12启动子(图。5.e),并正调控其活性(图。5.f)。
我们也发现了很多独联体- 在植物素,乙烯 - 和胃肠杆菌素信号中涉及的元素PcGSTF12启动子。这表明,PcGSTF12可能是R2R3-MYBS的常见下游靶标,以及调节花青素和PA途径的植物素,乙烯和嗜酸甘油蛋白信号(补充表S11).总之,这些结果提供了新的线索PcGSTF12-介导的梨花青素和PA积累。
讨论
我们介绍了使用CV的年轻果实的花青素,PAS和梨基因表达谱的基因组视图。'cf'及其红色突变'rcf'。通过组合转录组和代谢分析,我们发现了与梨中的花青素和PA积累有关的20个候选基因。这些发现提高了我们对梨子梨的分子机制的理解,特别是在果实发育的早期阶段。
梨花青素和PA积累的核心候选基因包括6个类黄酮结构基因:PcCHI(PCP027877, PCP021141, PCP039844),PcCHS(PCP023048),PcF3H(PCP013732),和PcANS(PCP027029)。CHI、CHS和F3H是花青素和PA生物合成途径的共同特征[6.].ANS可以催化(+)儿茶素转化为花青素和原花青素[28.].功能分析证实了PcCHI那PcCHS,和PcF3H在花青素积累中[29.].这些研究和我们的研究结果为不同植物间花青素和PA积累模式的保守提供了证据。
在植物中,转录因子在类黄酮调控中起重要作用。r2r3 - myb是最大的TF家族之一[30.],其中大多数在类黄酮积累中起重要作用[31.].Pymyb10.是第一个鉴定参与梨中的花青素积累的R2R3-MYB TF [13].功能分析证实了Pymyb10.1.和Pymyb114.在梨中的花青素积累的调节中[14那32.的角色PBMYB10B.和PBMYB9.在梨的花青素和PA积累中的作用[4.].在该研究中,花青素和PA积累的核心候选基因组包括四种R2R3-MYB基因:PcMYB3那PcMYB86那PCMYB111和PCMYB114.它们的转录水平与花青素和PAS强烈呈正相关。虽然MYB114已经知道在梨花青素积累中起作用,但不知道哪些特定的代谢物受到了影响。我们的结果提供了证据PCMYB114六个花青素代谢物的累积功能:Pelargonidin 3-glu,Malvidin-3-半乳糖苷氯化物,Cyanidin 3-O-丙二酰己酮,Oenin,Delphinidin和PeoNidin O-己糖苷(补充表S8).我们还发现了两者之间的正相关PCMYB114和procyanidin a,procanyanidin b1和procyanidin b3(补充表S8),表明这一点PCMYB114也对梨中PA的积累起作用。除了PCMYB114,其他myb基因PcMYB3那PCMYB86,和PCMYB111新近地被确定为参与花青素和梨的PA积累的候选者。有趣的是,这些R2R3-MYBS与不同的花青素和PAS相关,表明它们经历了潜水化,以在梨中的梨蛋白和PA积累中发挥不同和特异性的作用。
其他TFS也参与了梨中的花青素和PA积累。HD家族的TFS对植物是独一无二的,其成员被提议在制发育过程中发挥关键作用,如根部发育,植物细胞分化,果实成熟和叶子和花衰老[33.那34.那35.].HD-ZIP I和HD-ZIP IV TF Subfamilies的成员还在花青素积累中发挥关键作用。Anthocyaninless2.(ANL2)是第一个被发现参与组织特异性花青素积累的HD-Zip IV基因。在Arabidopsis,ANL2影响花青素在莲座叶背面表皮组织和叶背面表皮组织中的积累[36.].最近,两个HD-Zip I基因,MdHB1和RhHB1已被证明分别影响苹果和玫瑰的花青素积累。过度表达MdHB1导致苹果果肉中花青素积累减少。MdHB1可抑制MdDFR和mdufgt.通过与MdMYB10、MdbHLH3和MdTTG1相互作用而间接[37.].与苹果的结果一致,沉默RhHB1在玫瑰导致花瓣中的花青素水平更高[38.].在这项研究中,梨中涉及花青素和PA积累的核心基因集包括HD TF基因,PcKNAT1.KNAT1是I类Knox HD基因家族的成员,被认为在营业发育和叶子形态发生中发挥作用[39.].我们发现了PcKNAT1与五种花青素和七个PA有强烈呈正相关,这意味着其功能与HD-ZIP I和HD-ZIP IV TFS中的已知功能不同,在花青素累积中的HD-Zip I和HD-Zip IV TFS。我们的研究结果表明,I类Knox HD基因家族可能在花青素和PA积累中发挥重要作用;这扩大了我们对I类Knox HD基因家族功能的了解。
在我们的研究中,bZIP TF基因,PCBZIP1,与六个花青素和五种PAS呈正呈正密切相关。Bzip TFS含有高度保守的Bzip域[40].它们是多种转录调控因子,在植物发育、生理过程和生物/非生物胁迫反应中发挥着关键作用[41.].最近,两个bzip tfs,mdhy5.和mdbzip44,显示在苹果中促进花青素积累[42.那43.].我们的结果提供了进一步的证据表明,BZIP TFS在花青素积累中充当阳性调节剂。因此,在花青素积累中的功能中,BZIP TFS也可能在PA累积中发挥重要作用。
在这项研究中,腕骨TF基因,Wrky28,与1种花青素和4种PAs呈密切负相关。WRKY41-1在芸苔属植物显著和WRKY75在拟南芥已知的花青素生物合成的阻遏物[44.那45.),而MdWRKY40在苹果是伤口诱导的花青素生物合成的正调节因子[46.].我们的结果与B. Napus.和拟南芥和苹果的相反。有可能wr在花青素积累方面进化出了不同的功能,如R2R3-MYB转录因子。例如,一些R2R3-MYB转录因子是花青素积累的正调控因子[13那14],而其他人是负调节剂[19.].需要进一步的研究来阐明复杂的作用wr在果树和其他植物中的Pa积累。
生长素可以抑制花青素的积累,并在苹果和苹果中降低花青素调控和结构基因的表达拟南芥[47.那48.].最近的一项研究表明,通过与MDMYB10相互作用并与启动子结合,疾病因子MDARF13通过与MDMYB10相互作用来调节苹果中的花青素途径MdDFR.生长素/IAA蛋白MdIAA121可抑制MdARF13向MdDFR启动子和削弱MDAFR13对花青素积累的抑制作用[21.].与生长素相反,乙烯增强了梨和苹果中的花青素和PA积累。在梨中,乙烯响应因子Pyerf3通过与Pymyb114的相互作用而增强了花青素累积[14].在Apple中,MDERF1B通过与MDMYB1,MDMYB9和MDMYB11进行互动来调节花青素和PAS [22.].在这项研究中,一种乙烯反应基因,PcERF003,与6个花青素和7个PAs正相关,一个生长素应答基因,PCIAA13,与2种花青素和4种PAs呈正相关。这些结果与前人的研究结果一致,生长素通过抑制花青素的积累国际宇航科学院基因,乙烯增加花青素的积累ERF.基因。植物激素在幼果发育中起着重要作用。嫩梨果实含有高水平的生长素和低水平的乙烯[49.].进一步的功能分析PcERF003和PCIAA13这可能有助于阐明生长素和乙烯对梨幼果花青素和/或PA积累的影响。
植物GST由大型基因家族编码,并且在细胞溶溶胶中可溶于和丰富[26.那50.那51.].它们可分为8个亚群,其中tau和phi类在类黄酮转运中起着关键作用[52.].青铜2(BZ2.)在玉米中是第一个据报道的Tau类GST参与花青素积累;BZ2.由于残疾的花青素输送到液泡中,产生黄色皮肤核[53.].花青素沉积也受到PHI类中基因的影响,例如AtGSTF12在拟南芥[54.那55.],FvRAP在草莓[26.],CsGSTF1在茶52.], 和VvGST4在葡萄藤[56.].有趣的是,这些phi类gst表现出广泛的功能多样化。例如,AtGSTF12在花青素和PA积累中起关键作用拟南芥[54.),而CsGSTF1在茶叶功能中仅在花青素累积中[52.].gst的功能差异已经通过非同义突变而出现,特别是在关键氨基酸位点[51.].例如,发现单个氨基酸突变(Arg39至Trp39)是对高酶活性的负责Populus Euphratica.pegstu30 [51.].李等人[57.结果表明,AtTT19的205位氨基酸上有一个Trp - Leu替换,导致了AtTT19的花青素缺失表型拟南芥.最近,Luo等报道在的第二个外显子中存在单核苷酸多态性(C to T)FvRAP显着降低了叶柄和草莓果实中的花青素水平[26.].在我们的研究中,一种phi类GST基因,PcGSTF12,是梨中的花青素和PA积累的核心基因中。PcGSTF12与梨中大多数研究的代谢物强烈有关:七个花青素和七个pas。相似AtGSTF12那PcGSTF12在功能性表征为花青素和PA载体。有趣的是,我们对花青素和PA进行了不同的亲和力PcGSTF12和AtGSTs在拟南芥.PcGSTF12的作用与之相反AtGSTs在Procyanidin A3和Petunidin 3,5-千兆糖苷的积累中。这些结果表明phi-class消费税在进化过程中经历了广泛的功能多样化。此外,转换时PcGSTF12影响了参与花青素和PA生物合成、调控和运输的编码蛋白的基因。这个功能分析PcGSTF12加深我们对phi类作用的理解消费税花青素和PA在梨和其他植物中的积累。
我们发现PcMYB114可以正调控PcGSTF12活性通过直接结合其启动子中的MBS基序。最近的一项研究表明,过度表达Pymyb114.在年轻的梨果上,通过上调花青素结构基因显着提高花青素积累PyDFR那PyANS,和PyUFGT[14].然而,是否MYB114PA积累的功能或影响花青素和PA运输在很大程度上。这结果提供了新的证据PCMYB114通过调控花青素和PA在梨中的转运PcGSTF12这可能进一步影响花色苷和PA的积累。此外,我们还发现了许多独联体- 在启动子中涉及生长素,乙烯和吉布林素信号传导的元素PcGSTF12.因此,我们建议PcGSTF12可能是植物素,乙烯 - 和赤霉素介导的花青素和PA累积途径的常见下游靶。
结论
在这项研究中,我们在绿色梨'CF'的年轻果实和红突变'RCF'中鉴定了4065次差异和19种差异表达的代谢物(12个花青素和7个PAS)。基于DEGS和花青素/ PAS之间的相关性分析,我们发现203个候选基因用于累积10个花青素和七种PAS。我们进一步确定了梨花孢子和PA积累20个候选基因的“核心集”。其中,PcGSTF12是梨中重要的花青素和PA载体。我们还鉴定了一个重要的梨花青素和PA调控节点,由两个核心基因组成,PcGSTF12和PCMYB114.这些结果为梨花孢子和PA积累提供了新的洞察力。这里展示的梨花蛋白和PA积累的候选基因代表了指导未来功能研究的有价值的数据。
方法
植物材料
品种‘RCF’是在美国发现的品种‘CF’的典型红梨运动品种。“RCF”的果实最初是绿色的,然后在完全开花后的1周内迅速变成红色,并保持红色直到果实成熟。“RCF”的着色模式不同于大多数梨的品种,在成熟阶段着色。因此,‘CF’和‘RCF’是研究嫩梨花青素和PA积累分子机理的理想材料。在山东省烟台市烟台农业科学院(37°5′n, 122°1′w)的试验果园中栽培了梨品种‘CF’和‘RCF’。“CF”和“RCF”的果实是2017年从嫁接到树上的6年树木上采集的Pyrus betulaefolia小苗。‘CF’和‘RCF’在5 DAFB处表现出不同的果皮颜色表型。因此,在果实发育阶段调控花青素和PA的积累对果实着色具有重要意义。我们采集了两个发育早期阶段(2个DAFB和5个DAFB)的‘CF’和‘RCF’果实进行进一步分析。简单地说,“CF”和“RCF”的类似绿色水果于2017年4月19日首次取样;这些样品分别在2个DAFB采集,命名为“CF1”和“RCF1”。“CF”和“RCF”之间颜色有显著差异的水果于2017年4月22日取样;在5 DAFB采集的样品分别命名为“CF2”和“RCF2”。在每个试验中,每个重复采集100个果实的果皮。收集三个独立的生物学重复进行分析。 The fruit skin samples were immediately frozen in liquid nitrogen and stored at − 80 °C until further metabolite, RNA-sequencing (RNA-Seq), and qPCR analyses.
代谢产物提取和分离
如王等人所述进行代谢物提取和分离。[23.].简而言之,将冷冻干燥的果皮粉碎成粉末,然后在1.0ml 70%甲醇水溶液中在4℃下萃取过夜。在10,000g离心10分钟后,通过HPLC过滤提取物并分析。
花青素和PA鉴定和量化
花青素和PA代谢物通过与公共数据库(包括KNAPSAcK, MassBank, MoToDB, METLIN和HMDB)的比较进行注释,并使用MRM进行量化,如Wang等所述[23.].
总RNA分离和RNA- seq分析
使用Trizol试剂(Invitrogen公司,Carlsbad, CA, USA)分离总RNA,使用2100生物分析仪(Agilent Technologies公司,Santa Clara, CA, USA)评估其完整性。用oligo (dT)磁珠从高质量的总rna中纯化mRNA,然后用碎片缓冲液将其破碎成短片段。利用cDNA Synthesis Kit (TaKaRa, Dalian, China)合成cDNA,并连接到两端的测序适配器。使用Illumina测序系统(HiSeq™2000,Illumina, San Diego, CA, USA)对cDNA文库进行测序。使用NGS QC工具包获得干净的检测结果[58.].差异表达分析采用DESeq R包(2012)。显著差异表达的阈值为P.< 0.05和|log 2 fold change|≥1分别鉴定两种不同cDNA文库间的差异表达基因(DEGs)。基因本体(GO)和京都基因和基因组百科全书(KEGG)使用R平台对deg进行富集分析,如其他地方所述[59.].
综合代谢物和转录组分析
计算代谢组和转录组数据之间的Pearson相关系数。用EXCEL程序计算各代谢物的log2 (fold change)和各转录本的log2 (fold change)。与系数R的相关关系2 > 0.8 were selected. Metabolome and transcriptome relationships were visualized using Cytoscape (version 2.8.2).
QRT-PCR验证
根据制造商的说明,用于RNA- seq的总RNA样本也使用PrimeScript™RT Reagent Kit (TaKaRa)进行cDNA合成。qRT-PCR分析如前所述[13],使用附录表所示的引物1.Pcactin.作为内参基因。对三个生物学重复进行了分析。
系统发育分析
PCGSTF12的系统发育树分析及其同源物由Mega 7进行,具有从1000重复分析计算的自举值。
PcGSTF12启动子分析
2000 bp的上游序列PcGSTF12在PlantCare的工具分析(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和放置信号扫描搜索数据库(https://www.dna.affrc.go.jp/place/).功能主题在补充表中列出10.myb结合位点(MBS) CAACTG序列位于启动子的−801 bpPcGSTF12由Plantcare。已知该MBS元素是R2R3-MYBS的结合序列[27.那60.].因此,我们选择了这种MBS元素序列,以进一步分析PCMyB114与启动子之间的相互作用PcGSTF12使用如下所述的电泳迁移率位移测定法(EMSA)。
电泳迁移率变速测定
根据Jiang等人的描述,EMSA是使用LightShift Chemiluminescent EMSA Kit (Thermo Scientific, Waltham, MA, USA)进行的。[61.].重组蛋白用ni琼脂糖His-Tagged protein纯化试剂盒(CWbiotech, Beijing, China)纯化。
荧光素酶报告实验
按照Wang等人的描述进行荧光素酶报告基因测定[62.].CDSPCMYB114重组成pHBT-AvrRpm1效应体。启动子的PcGSTF12插入了PFRK1-LUC-NOS记者。使用多模板读卡器检测LUC和GUS的活动(Victor X4,PerkinElmer,http://www.perkinelmer.com/).
PCGSTF12的异位表达拟南芥
对于基因转化,CDSPcGSTF12重新组合成PRI101-载体然后转化为根癌土壤杆菌gv3101使用花浸法[63.].用卡那霉素在半强度Murashige和Skoog(MS)固体培养基上选择T1转基因植物。在24℃下在16-H光/ 8-H深色光周期下的光培养箱中耐培养箱中的耐胍蛋白耐幼苗。七天历史的T2幼苗用于RNA-SEQ分析和用于花青素和PA鉴定和定量。
可用性数据和材料
转录组测序数据可从NCBI获得,GEO登录号为GSE146798。本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
缩写
- ANR:
-
花青素还原酶
- 答:
-
花青素合成酶
- CF:
-
Clapp最爱
- 气:
-
Chalcone异构酶
- CHS:
-
查耳酮合酶
- 可见:
-
差异表达基因
- DFR:
-
Dihydroflavonol还原酶
- F3H:
-
黄酮类化合物3-羟化酶
- GSTS:
-
谷胱甘肽S-transferases
- 政治:
-
leucoanthocyanidin还原酶
- 配偶:
-
多药和有毒复合挤出蛋白
- 不是:
-
Procyanidins.
- RCF:
-
红色的克拉普最喜欢的
- TFS:
-
转录因素
- UFGT:
-
UDP-葡萄糖黄酮3-七葡聚糖转移酶)
- WT:
-
野生型
参考文献
- 1.
Tuan Pa,Bai S,Yaegaki H,Tamura T,Hihara S,Moriguchi T,等。至关重要的作用PpMYB10.1在其等位基因型和肤色表型之间的桃和关系中的花青素中的积累。BMC植物BIOL。2015; 15:280。
- 2。
谢敏,黄玉梅,张玉梅,王旭,杨华,余欧,等。中国白梨果实发育成熟的转录组分析(Pyrus Bretschneideri.Rehd)。BMC基因组学。2013;14:823。
- 3.
Ngo T,Zhao Y.通过络合和聚合稳定花青素在热处理红D'Anjou梨上的稳定。食物SCI技术。2009; 42:1144-52。
- 4.
翟锐,王志强,张胜,宋磊,王志强,等。两种MYB转录因子调节梨类黄酮生物合成(Pyrus Bretschneideri.Rehd)。J Exp Bot. 2016; 67:1275-84。
- 5。
越来越高贵的AC。多酚:影响其感觉特性的因素及其对食品和饮料偏好的影响。AM J Clin Nutr。2005; 81:330-5。
- 6。
黄酮类化合物在生物化学途径调控和进化中的作用。植物科学进展。2005;10:236-42。
- 7。
植物原花青素的生物合成:豆科植物白花青素还原酶的纯化及其cDNA的分子克隆。中国生物化学杂志。2003;278:31647-56。
- 8。
谢D,Sharma SB,Paiva NL,Ferreira D,Dixon Ra。花青素还原酶在植物黄酮类生物合成中编码的植物中的作用。科学。2003; 299:396-9。
- 9。
王志强,王志强,王志强,等。植物的结构、功能和进化O.-methyltransferases。基因组。2007;50:1001-13。
- 10.
尹勇,陈洪波,陈洪波,徐勇。植物细胞壁合成相关糖基转移酶家族的进化与功能。植物杂志。2010;153:1729-46。
- 11.
黄酮类化合物的转运机制:如何去,和谁一起去。植物学报。2015;20:576-85。
- 12.
光诱导MYB基因表达调控红苹果花青素合成。植物杂志。2006;142:1216-32。
- 13。
冯绍峰,王颖,杨胜,徐勇,陈晓霞。梨花青素的合成受r2r2 - myb转录因子PyMYB10的调控。足底。2010;232:245-55。
- 14。
姚g,明米,艾伦ac,gu c,li l,wu x等。基于地图的梨基因克隆MYB114鉴定与其他转录因子的相互作用,以协调调节果实花青素的生物合成。植物j . 2017; 92:437-51。
- 15.
白葡萄是通过两个相似且相邻的调控基因的突变而产生的。植物j . 2007; 49:772 - 85。
- 16。
马基维C,罗vergeat V, Decendit A, Richard T,等。葡萄R2R3-MYB转录因子调控苯丙素途径的特性。植物杂志。2006;140:499 - 511。
- 17。
Deluc L,Bogs J,Walker Ar,Ferrier T,Decendit A,Merillon JM等。转录因子VVMYB5B有助于调节葡萄浆果中的花青素和原霉素生物合成。植物理性。2008; 147:2041-53。
- 18。
安晓华,田勇,陈克强,刘学军,刘德东,谢晓波,等。MdMYB9和MdMYB11参与了ja诱导的苹果花青素和原花青素生物合成的调控。植物生理学。2015;56:650-62。
- 19。
周H,Lin-Wang K,Wang F,Espley RV,Ren F,Zhao J,等。活化剂型R2R3-MYB基因诱导阻遏物型R2R3-MYB基因,以平衡花青素和花青蛋白积累。新植物。2019; 221:1919-34。
- 20。
Ravaglia D, Espley RV, Henry-Kirk RA, Andreotti C, Ziosi V, Hellens RP,等。油桃类黄酮生物合成的转录调控(碧桃)通过一组R2R3 MYB转录因子。BMC植物BIOL。2013; 13:68。
- 21。
王永春,王宁,徐海峰,姜树华,方慧琴,苏美美,等。生长素通过aux/ IAA-ARF信号通路调控苹果花青素的生物合成。Hortic杂志2018;5:59。
- 22。
张建军,徐洪,王宁,姜胜,方辉,张震,等。乙烯反应因子MdERF1B调控苹果花青素和原花青素的生物合成。植物学报。2018;98:205-18。
- 23。
Wang Z, Cui Y, Vainstein A, Chen S, Ma h (榕辣海参果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。前面。植物科学。2017;8:1990 . .
- 24.
赵K,赵KS,孙HB, Ha IJ, Hong SY, Lee H,等。代谢组和转录组的网络分析揭示了马铃薯色素沉着的新调控。J Exp Bot. 2016; 67:1519-33。
- 25.
李勇,方军,齐旭,林敏,钟勇,孙丽,等。结合对果实代谢组和转录组的分析,揭示了参与黄酮类生物合成的候选基因猕猴桃arguta.中华医学杂志。2018;19(5):1471。
- 26.
罗h,戴c,李y,冯j,刘z,kang c。GST花青素转运蛋白的叶柄代码中的花青素减少,这对于草莓中的叶子和果实着色至关重要。J Exp Bot。2018; 69:2595-608。
- 27.
昌C,余D,焦杰,静,舒兹 - 莱特P,沉Qh。大麦MLA免疫受体直接干扰拮抗作用转录因子以引发抗病性信令。植物细胞。2013; 25(3):1158-73。
- 28.
王志强,王志强,王志强,等。花青素合成酶的非洲菊矮牵牛催化(+)儿茶素转化为花青素和一种新的原花青素。2月。2006;580:1642-8。
- 29.
王Z,孟德,王A,李特,姜S,Cong P等人。PCMyB10启动子的甲基化与Max Red Bartlett Pear中的绿皮肤运动相关。植物理性。2013; 162:885-96。
- 30.
Riechmann JL,听到J,Martin G,Reuber L,Jiang C,Keddie J等人。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290:2105-10。
- 31.
Dubos C,Stracke R,Grotewold E,Weisshaar B,Martin C,Lepiniec L. MyB转录因子拟南芥.植物生态学报。2010;15:573-81。
- 32.
冯S,Sun S,Chen X,Wu S,Wang D,Chen X. Pymyb10和Pymyb10.1与BHLH相互作用,以增强梨的花青素积累。Plos一个。2015; 10:E0142112。
- 33.
Javelle M, Vernoud V, Rogowsky PM, Ingram GC。表皮:植物基本组织的形成和功能。新植醇。2011;189:17-39。
- 34.
苗志强,赵PX,毛建林,余丽华,袁勇,唐华,等。同源box蛋白52通过调控生长素转运相关基因的表达,介导了主根伸长过程中乙烯和生长素信号通路之间的串扰。植物细胞。2018;30:2761 - 78。
- 35.
Manavella Pa,Arce Al,Dezar Ca,Bitton F,Renou JP,Crespi M等人。乙烯和干旱信号通路之间的串扰由向日葵HAHB-4转录因子介导。工厂J. 2006; 48:125-37。
- 36。
Kubo H,Peeters AJM,Aarts MGM,Pereira A,Koornneef M.AnthocyanInless2,一种影响花青素分布和根部发育的Homeobox基因拟南芥.植物细胞。1999; 11:1217-26。
- 37。
江y,刘c,yan d,wen x,liu y,wang h等。MDHB1 Down-Crululation激活白肉体苹果品种“格兰尼史密斯”中的花青素生物合成。J Exp Bot。2017; 68:1055-69。
- 38。
吕P,张c,刘俊,刘x,江g,江x等。rhbb1在玫瑰中介导赤霉素对阿巴和乙烯的拮抗作用(罗莎矮牵牛)瓣衰老。工厂J. 2014; 78:578-90。
- 39。
关键词:同源盒基因拟南芥在营养分生组织中表达,在转基因植物中过表达时显著改变叶片形态。植物细胞。1994;6(12):1859 - 76。
- 40.
赫斯特HC。转录因子1:Bzip蛋白。蛋白质概况。1995年; 2(2):101-68。
- 41.
王Z,程克,万升,闫朗,江鹤,刘S等人。六种豆科基因组中基础亮氨酸拉链(BZIP)转录因子基因家族的基因组。BMC基因组学。2015; 16:1053。
- 42.
安建平,曲发军,姚建峰,王新宁,尤彩霞,王雪峰,等。bZIP转录因子MdHY5调控苹果花青素积累和硝酸盐同化。Hortic杂志2017;4:17023。
- 43.
安太平,姚建峰,徐瑞荣,尤春霞,王雪峰,郝玉娟。苹果bZIP转录因子MdbZIP44调控脱落酸促进花青素积累。植物学报。2018;41(11):2678-92。
- 44。
Devaiah BN, Karthikeyan AS, Raghothama KG。WRKY75转录因子是磷酸获取和根发育的调节因子拟南芥.植物杂志。2007;143:1789 - 801。
- 45。
段S,Wang J,Gao C,Jin C,Li D,Peng D等。异源表达的功能表征芸苔属植物显著用于调节花青素生物合成的WRKY41-1转录因子拟南芥.植物SCI。2018; 268:47-53。
- 46。
jp,张xw,你cx,bi sq,wang xf,hao yj。MDWRKY40促进与MDMYB1相关的伤口诱导的花青素生物合成,并经历MDBT2介导的降解。新植物。2019; 224(1):380-95。
- 47。
吉Xh,王yt,张r,wu sj,mm,li m等。蟾蜍素,细胞素和氮在红肉苹果愈伤组织培养中的血清素生物合成效果(马吕斯sieversii f.niedzwetzkyana.).acta botanica yunnanica(云南植物研究中心),2015;
- 48.
刘铮,施明忠,谢大勇。植物花青素生物合成的调控拟南芥红色的PAP1-D.由植物素代谢地编程的细胞。Planta。2014; 239:765-81。
- 49.
Cong L,Yue R,Wang H,Liu J,Zhai R,Yang J等。2,4-D诱导的梨嘌呤肽通过增强Ga 4生物合成来介导。physiol platera。2018年。https://doi.org/10.1111/ppl.12835.
- 50。
关键词:酶活性;亚细胞定位拟南芥谷胱甘肽转移酶总科。J Exp Bot. 2009; 60:1207-18。
- 51。
杨Q,汉XM,顾JK,刘yj,杨mj,曾qy。GST基因家族的功能和结构谱系从三种杨树种类揭示了正交基因的序列功能去耦。新植物。2019; 221:1060-73。
- 52。
Wei K,王L,张Y,Ruan L,Li H,Wu L等。耦合作用CsMYB75和CsGSTF1紫茶中花青素的超积累。植物j . 2018; 97:825-40。
- 53。
玉米基因Bronze-2编码的谷胱甘肽s -转移酶参与液泡转移。大自然。1995;375:397 - 400。
- 54.
谷胱甘肽转移酶在植物次生代谢中的作用。植物化学。2010;71:338-50。
- 55.
孙勇,李华,黄jr .。拟南芥TT19用作将花青素从细胞溶胶转移到调色剂的载体。莫尔植物。2012; 5:387-400。
- 56.
Gomez C, Conejero G, Torregrosa L, Cheynier V, Terrier N, Ageorges A.在葡萄体内的花青素运输涉及到囊泡介导的运输以及花青素转运体和GST的贡献。植物j . 2011; 67:960 - 70。
- 57.
李晓霞,高平,崔东东,吴立军,李晓霞,等。的Arabidopsis TT19-4突变体通过谷胱甘肽S-转移酶的3'氨基酸取代差异地累积花青蛋白和花青素。植物细胞环境。2011; 34:374-88。
- 58.
Jain M. NGS QC工具包:用于下一代测序数据质量控制的工具包。《公共科学图书馆•综合》。2012;7:e30619。
- 59.
冯S,Sun J,Sun S,Wang Y,Tian C,Sun Q等。甲基己酸酯对苹果成熟作用的转录谱。J工厂增长调节。2017; 36:271-80。
- 60.
Mu Rl,Cao Yr,Liu Yf,Lei G,Zou Hf,Liao Y等。R2R3型转录因子基因ATMYB59调节根生长和细胞周期进展拟南芥.细胞res。2009; 19:1291-304。
- 61.
姜S,陈M,他,陈X,王n,Sun Q等。MdGSTF6,由MdMYB1激活,在苹果花青素积累中起重要作用。Hortic杂志2019;40。
- 62.
王宁,徐慧,姜胜,张震,陆宁,邱洪,等。MYB12和MYB22在红肉苹果原花青素和黄酮醇合成中起重要作用(海棠).植物j . 2017; 90(2): 276 - 92。
- 63.
阵伤SJ,弯曲AF。花卉DIP:简化方法农杆菌属介导的变换拟南芥.植物j . 1998; 16:735-43。
致谢
我们感谢Jennifer Smith,Phd,Zhanz Group China(www.liwenbianji.cn/ac),以编辑本手稿的英文初稿。感谢中国农业科学院曹玉芬博士、山东省果树研究所王少民先生、华中农业大学康春英博士对水果材料选择的建议Arabidopsis TT19-7草莓种子和GST序列,麦维大雄有限公司技术支持HPLC和LC-MS / MS,Kegene科技有限公司与RNA-SEQ技术支持,以及华中博士农业大学,中国农业科学院蔬菜和鲜花研究所雪山博士,山东农业大学方义马博士有用讨论和建议。
资金
国家重点研发计划项目(no . 2018YFD1000105);国家自然科学基金项目(no . 31201593, no . 31872940);山东省农业良种工程项目(no . 2019LZGC008)。关键词:岩石力学,边坡稳定性,数值模拟,数值模拟资金用于实验性支付。没有资助者参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
构思和设计了研究:SQF。进行了ZZ, CPT, YZ, CZYL和XL的实验。对ZZ、QY、SW、XYW数据进行分析。有贡献的稿件:ZZ, XSC, SQF。所有作者均已阅读并批准论文。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1:
表S1。花青素和原霉素组成的比较“CF”和“RCF”。‘CF1’ and ‘RCF1’ refer to fruits of ‘CF’ and ‘RCF’ collected at 2 days after full bloom (DAFB), respectively, ‘CF2’ and ‘RCF2’ refer to fruits of ‘CF’ and ‘RCF’ collected at 5 DAFB, respectively.
附加文件2:
表S2。RNA-SEQ读取映射概述。
额外的文件3:
表S3。4个比较组:' RCF1 ' vs. ' CF1 ', ' RCF2 ' vs. ' CF2 ', ' RCF2 ' vs. ' RCF1 ', ' CF2 ' vs. ' CF1 '。
附加文件4:
表S4。2-1组和RCF-CF组中DEGs的GO功能注释。
附加文件5:
表S5。2-1组和rcf组差异表达基因的KEGG注释。
附加文件6:
表S6。17个花青素和原霉素代谢物的分类与203次相连。
附加文件7:
表S7。203次分类与17个花青素和原霉素代谢物相关。
附加文件8:
表S8。20个核心基因与10个花青素和7个原花青素的相关性分析。
附加文件9:
表S9。用于qPCR分析和构建的引物列表。
附加文件10:
表S10。花青素候选基因的RNA-SEQ分析和原霉素积累的候选基因tt19-7和tt19-7- 幼苗。
额外的文件11:
表S11。PcGSTF12使用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和放置信号扫描搜索数据库(https://www.dna.affrc.go.jp/place/).
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
张,Z.,Tian,C.,张,Y.et al。转录组和代谢物分析为梨中的花青素和原霉素积累提供了洞察力。BMC植物BIOL.20,129(2020)。https://doi.org/10.1186/s12870-020-02344-0
收到了:
公认:
发表:
关键字
- 梨
- 花青素
- Procyanidin.
- 代谢组和转录组分析
- PcGSTF12
- PCMYB114