- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
识别的gydF4y2Ba山嵛菜salsugineum EsMYB90gydF4y2Ba花色素苷生物合成的重要基因gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba186.gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花青素有助于不同植物组织的着色和抗氧化作用。MYB转录因子已被证实是许多植物花青素合成的关键调控因子。然而,关于盐生植物中MYB基因的信息很少gydF4y2BaEutrema salsugineumgydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
在这里,我们报告了鉴定了一个重要的花青素生物合成调节剂gydF4y2Baes.gydF4y2BaMYB90从gydF4y2BaEutrema salsugineumgydF4y2Ba,这是对多个非生物胁迫的卤素耐受性。我们的系统发育和本地化分析支持gydF4y2Baes.gydF4y2BaMYB90是一种R2R3型MYB转录因子。异位表达gydF4y2BaEsMYB90gydF4y2Ba在烟草和gydF4y2Ba拟南芥gydF4y2Ba增强色素沉着和花青素在各个器官的积累。转录组分析显示42个基因表达上调gydF4y2Baes.gydF4y2BaMYB90在gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba花青素生物合成需要烟草转基因植物。此外,我们的QRT-PCR结果表明gydF4y2Baes.gydF4y2BaMYB90促进早期(gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaCHS.gydF4y2Ba,gydF4y2BachgydF4y2Ba)迟到(gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba)茎,叶子和花的花青素生物合成基因gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba烟草转基因植物。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明gydF4y2Baes.gydF4y2BaMYB90是MYB转录因子,调节花青素合成基因控制花青素合成。我们的工作提供了新的工具,以提高在各种植物花青素生产。gydF4y2Ba
背景gydF4y2Ba
类黄酮是苯丙烷/类黄酮途径的衍生物,主要含有原花青素(PAs)、花青素和黄酮醇[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].花青素是一种重要的色素,在花、果、叶中形成红色、紫色、紫色和蓝色,决定着作物和观赏植物的经济性状[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].花青素是苯丙吡喃类/黄酮类生物合成途径中特定分支的最终产物。参与花青素生物合成的酶已在许多植物物种中进行广泛研究[gydF4y2Ba8gydF4y2Ba].在苯丙氨酸解氨酶(PAL)的催化下,类黄酮途径的第一步是苯丙氨酸转化为反式肉桂酸[gydF4y2Ba9gydF4y2Ba查尔酮合成酶(CHS)催化类黄酮生物合成的第一步,形成柚皮素查尔酮。查尔酮异构酶(CHI)将查尔酮环化形成柚皮素[gydF4y2Ba8gydF4y2Ba].然后通过黄烷酮3β-羟化酶(F3h)将鼻蛋白转化为二氢戊戊酰(DHK)。通过黄酮3'-羟化酶(F3'H)或通过黄酮3',5'-羟基化酶(F3'5'H)进一步将DHK化至二氢核凝集素(DHQ)的二氢喹啉素(DHQ)。二氢烷醇4-还原酶(DFR)将DHQ转化为白细胞蛋白,其通过花青素合酶(ANS)进一步转化为花青素。最后,UDP-葡萄糖:黄酮类化合物3-O-葡糖基三酶(UFGT)催化花青素的糖基化以形成花青素[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba].gydF4y2Ba
MYB转录因子通过形成含有MYB- bhlh - wd40 (MBW)的转录复合物,在调控调控花青素生物合成主要酶的基因表达中发挥核心作用[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba].早期生物合成基因(EBG)的表达如gydF4y2BaCHS.gydF4y2Ba和gydF4y2BachgydF4y2Ba,由MyB11,MyB12和MyB111调节,而PAP1至PAP4(gydF4y2Ba在gydF4y2Bamyb75,gydF4y2Ba在gydF4y2BaMyb90,gydF4y2Ba在gydF4y2BaMyb113,gydF4y2Ba在gydF4y2BaMyb114调控晚期生物合成基因(LBGs)的表达gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTgydF4y2Bain.gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,上调一个gydF4y2Bamyb75gydF4y2Ba,gydF4y2BaMYB90gydF4y2Ba,gydF4y2BaMYB113gydF4y2Ba和gydF4y2BaMYB114gydF4y2Ba基因足以增加嫩叶中花青素的积累[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].例如,众所周知gydF4y2BaArabidopsis AtmyB75gydF4y2Ba(gydF4y2BaPAP1.gydF4y2Ba)基因引导叶、根、花和果实中花青素的产生[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba].过度表达gydF4y2BaAtMyb75gydF4y2Bain.gydF4y2Ba拟南芥gydF4y2Ba烟草会导致gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaCHS.gydF4y2Ba和gydF4y2BaDFRgydF4y2Ba基因(gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].同样的,gydF4y2Ba在gydF4y2BaMYB75在番茄中诱导花青素生产(gydF4y2Ba茄属植物lycopersicumgydF4y2Bal)通过推广gydF4y2BaDFRgydF4y2Ba表达 [gydF4y2Ba18.gydF4y2Ba].此外,序列变异gydF4y2BaAtMYB90gydF4y2Ba(gydF4y2BaPAP2.gydF4y2Ba)是用于花青素积累天然变异因果[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba].gydF4y2Ba在gydF4y2BaMYB90可能与TTG1(一种WD40蛋白)和TT8、GL3或EGL3等不同bHLH伙伴共同作用[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba].而且,在gydF4y2Ba拟南芥gydF4y2Ba由R2R3-MYB,BHLH和WD重复蛋白形成的三元复合物激活花青蛋白积聚在种子涂层的最内部细胞层中所需的生物合成基因[gydF4y2Ba23.gydF4y2Ba].R2R3 MYB蛋白TT2 (MYB123)也是种子发育过程中原花青素积累的关键调节因子[gydF4y2Ba24.gydF4y2Ba].gydF4y2Ba
MYB转录因子参与调控许多植物的花青素合成,如gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba], 菜花 (gydF4y2Ba甘蓝病gydF4y2Ba)[gydF4y2Ba26.gydF4y2Ba],小白菜(gydF4y2Ba中国芥菜gydF4y2Ba)[gydF4y2Ba27.gydF4y2Ba], 苹果 (gydF4y2Ba马吕斯×释放有gydF4y2Ba)[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba桃子(gydF4y2BaPrunus PersicagydF4y2Ba)[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba], 梨 (gydF4y2BaPyrus pyrifoliagydF4y2Ba)[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba32.gydF4y2Ba,gydF4y2Ba33.gydF4y2Ba)、草莓(gydF4y2BaFragaria x ananassagydF4y2Ba)[gydF4y2Ba34.gydF4y2Ba),金鱼草(gydF4y2BaAntirrhinum Majus.gydF4y2Ba)[gydF4y2Ba35.gydF4y2Ba],gydF4y2Ba菊花gydF4y2Ba[gydF4y2Ba10.gydF4y2Ba]、葡萄风信子(gydF4y2BaMuscari armeniacumgydF4y2Ba)[gydF4y2Ba36.gydF4y2Ba),小道消息(gydF4y2Bavitis ViniferagydF4y2Ba)[gydF4y2Ba37.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba],中国杨树(gydF4y2BaMyrica Rubra.gydF4y2Ba)[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba],gydF4y2BaeBimedium射手图gydF4y2Ba[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba),杨树(gydF4y2Ba杨树sppgydF4y2Ba)[gydF4y2Ba42.gydF4y2Ba]和土豆(gydF4y2BaSolanum Tuberosum L.gydF4y2Ba)[gydF4y2Ba43.gydF4y2Ba].此外,一些gydF4y2BamygydF4y2Ba基因在各种压力条件下进行上调[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].然而,在耐受植物中,MYB的花青素合成的转录调节不受很好地研究。gydF4y2BaEutrema salsugineumgydF4y2Ba(盐水芹),一种应力耐受的模型嗜睡,对寒冷,盐,干旱,氧化应激和氮缺乏高度耐受性。在gydF4y2BaEutrema salsugineumgydF4y2Ba,许多应力相关的基因,如gydF4y2BaSOS1gydF4y2Ba,gydF4y2BaHKT1,gydF4y2Ba和gydF4y2Bansltp4.gydF4y2Ba,已经确定[gydF4y2Ba44.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba].通过分析差异表达的调控基因gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2BaE.Salsugineum.gydF4y2Ba,发现50个不同家族的307个转录因子的调控功能存在显著差异[gydF4y2Ba50.gydF4y2Ba].另一项研究发现gydF4y2BaESMYB96 / WAX1gydF4y2Ba从gydF4y2BaE.Salsugineum.gydF4y2Ba下gydF4y2BaRD29AgydF4y2Ba启动子通过增加角质层蜡质和抗坏血酸的积累来改善转基因植物的抗旱性gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba51.gydF4y2Ba].到目前为止,没有关于花青素合成的研究报告gydF4y2BaeSmybs.gydF4y2Bain.gydF4y2BaE.Salsugineum.gydF4y2Ba.在这里,我们报告了对MYB转录因子的功能分析gydF4y2Baes.gydF4y2BaMYB90在花青素合成中的作用。我们的系统发育和定位分析表明gydF4y2Baes.gydF4y2BaMYB90是R2R3类型的MYB转录因子。异位表达gydF4y2BaEsMYB90gydF4y2Ba在烟草和gydF4y2Ba拟南芥gydF4y2Ba导致叶子,茎和鲜花中的色素沉着和生产花青素的色素沉着和生产。我们的另外的RNA-SEQ和QRT-PCR分析表明gydF4y2Baes.gydF4y2BaMYB90促进了花青素早期生物合成基因(EBGs表达:gydF4y2BaNTCH.gydF4y2Ba,gydF4y2BaNTCHI.gydF4y2Ba,gydF4y2Bantf3h.gydF4y2Ba)和晚期生物合成基因(LBGs:gydF4y2BaNTDFR.gydF4y2Ba,gydF4y2BaNTANS.gydF4y2Ba,gydF4y2BaNtUFGTgydF4y2Ba)在35S:gydF4y2BaEsMYB90gydF4y2Ba烟草转基因植物。我们的研究确定了一种MYB转录因子,其在植物花青素生物合成中起重要作用。gydF4y2Ba
结果gydF4y2Ba
数据库挖掘识别gydF4y2Baes.gydF4y2BaMYB90,候选调节花青素合成gydF4y2Ba
Eutrema salsugineumgydF4y2Ba是一种耐胁迫的盐生植物,在春化后产生紫花芽[gydF4y2Ba52.gydF4y2Ba].自gydF4y2BamygydF4y2Ba花青素合成需要基因[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba,我们确定了gydF4y2BamygydF4y2Ba控制这种紫色表型gydF4y2BaE. Salsugineum.gydF4y2Ba.比较后gydF4y2BamygydF4y2Ba从转录组中获得的基因gydF4y2BaE. Salsugineum.gydF4y2Ba根据我们之前发表的结果[gydF4y2Ba46.gydF4y2Ba与72年),gydF4y2BamygydF4y2Ba在其他植物中称为原花青素(PA)和花青素调节剂的基因,我们发现了一个候选人gydF4y2BamygydF4y2Ba基因,命名为gydF4y2BaEsMYB90gydF4y2Ba.gydF4y2Ba
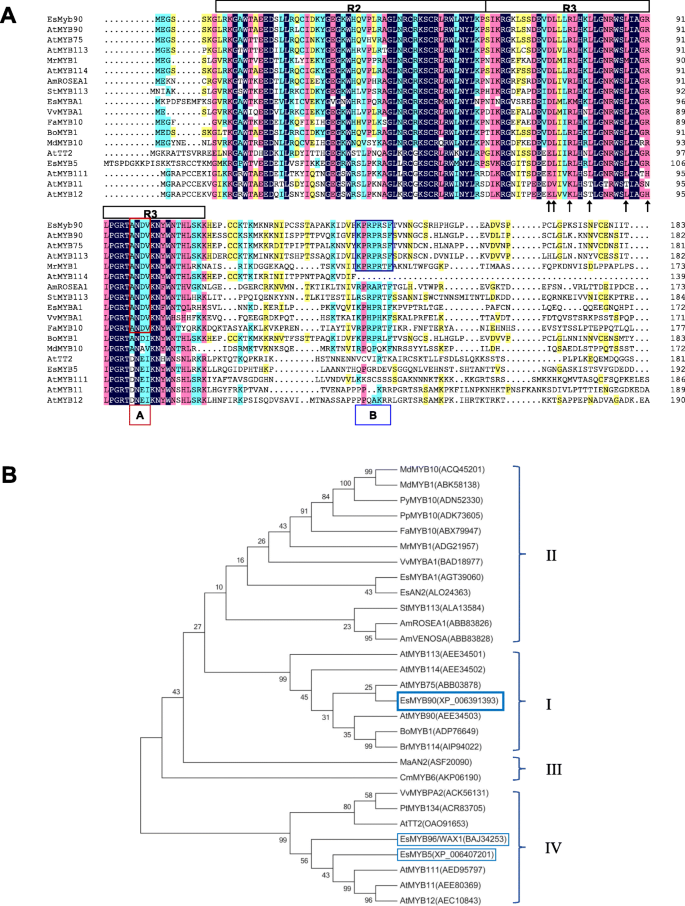
确定…的关系gydF4y2Baes.gydF4y2Ba米gydF4y2BaYBgydF4y2Ba90来表征类黄酮和PA MYBs,我们在蛋白水平上进行相似性分析。我们的结果表明gydF4y2Baes.gydF4y2BaMYB90对7个MYB蛋白分别具有80.5、78.9、78.4、74.4、69.4、65.9、50%的同源性。gydF4y2Ba薄gydF4y2Bamyb1,gydF4y2Ba在gydF4y2BaMYB90,gydF4y2BaBrgydF4y2BaMYB114,gydF4y2Ba在gydF4y2BaMYB75,gydF4y2BaCrgydF4y2BaMYB114,gydF4y2Ba在gydF4y2BaMYB113,gydF4y2Ba在gydF4y2BaMYB114(无花果。gydF4y2Ba1gydF4y2Ba一种)。另外,之间的相似性gydF4y2Baes.gydF4y2BaMYB90和其他10种MYB蛋白的范围从44.1到39.0%不等(图4)。gydF4y2Ba1gydF4y2Baa).与MYB高度相似的那些MYB蛋白gydF4y2Baes.gydF4y2BaMYB90属于R2R3-MYB类,在n端有一个保守的dna结合域(R2和R3重复序列),在c端有一个可变的区域[gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba,gydF4y2Ba54.gydF4y2Ba].andv主题(由图1中的红色标记)。gydF4y2Ba1gydF4y2Baa),在Dicots中促进花青素的特征标识符[gydF4y2Ba10.gydF4y2Ba),存在于gydF4y2Baes.gydF4y2BaMYB90,gydF4y2Ba在gydF4y2BaMYB90,gydF4y2Ba在gydF4y2BaMYB75,gydF4y2Ba在gydF4y2BaMYB113,gydF4y2Ba在gydF4y2BaMYB114,gydF4y2Ba我gydF4y2BaROSEA1,gydF4y2Ba圣gydF4y2BaMYB113,gydF4y2Baes.gydF4y2BaMYBA1 (AGT39060),gydF4y2BaVvgydF4y2BaMYBA1,gydF4y2Ba先生gydF4y2Bamyb1,和gydF4y2BaF AgydF4y2BaMYB10,而c端保守基序KPRPR [S/T] F为gydF4y2Ba拟南芥gydF4y2Baanthocyanin-promoting MYBs [gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba)(图中蓝色B方框所示。gydF4y2Ba1gydF4y2Ba答案:AgydF4y2Baes.gydF4y2BaMYB90,gydF4y2Ba在gydF4y2BaMYB75,gydF4y2Ba在gydF4y2BaMYB90,gydF4y2Ba在gydF4y2BaMYB113,gydF4y2Ba先生gydF4y2Bamyb1。而且,gydF4y2Baes.gydF4y2BaMyb90有一个保守的[D/E]Lx2[R/K]x3Lx6Lx3R motif(图中黑色箭头标记)。gydF4y2Ba1gydF4y2Ba一个),这是需要用于与交互R / B等-bHLH蛋白[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].gydF4y2Ba
序列比对和系统发育分析gydF4y2Baes.gydF4y2Bamyb90和其他myb蛋白。gydF4y2Ba一个gydF4y2Ba的gydF4y2Baes.gydF4y2BaMyB90蛋白质序列与来自10种植物物种的一组相关的R2R3-MYB蛋白对齐。相同的氨基酸在深蓝色中遮蔽,大于或等于75,50和33%的同一性分别在粉红色,浅蓝色和黄色的阴影中表示。R2和R3结构域是指MYB DNA结合结构域的两种重复。盒子(a):r3域的保守基序andv用于促进mybs的r3域;盒子(b):C末端保守的主题kprpr [s / t] f forgydF4y2Ba拟南芥gydF4y2Baanthocyanin-promoting MYBs;黑色箭头:[D/E]Lx的具体残留gydF4y2Ba2gydF4y2Ba(R / K) xgydF4y2Ba3.gydF4y2BaLxgydF4y2Ba6gydF4y2BaLxgydF4y2Ba3.gydF4y2Bař赋予对与bHLH结构的相互作用。gydF4y2BabgydF4y2Ba系统发育分析gydF4y2Baes.gydF4y2BaMYB90等28种MYB蛋白。从GenBank数据库下载MYB蛋白序列,登录号见图。gydF4y2Baes.gydF4y2BaMYB5,gydF4y2Baes.gydF4y2BaMYB90和gydF4y2Baes.gydF4y2BaMYB96来自gydF4y2BaE. Salsugineum.gydF4y2Ba,gydF4y2Baes.gydF4y2BaMYB90以蓝色加粗框突出显示,而gydF4y2Baes.gydF4y2BaMYB5和gydF4y2Baes.gydF4y2BaMYB96在薄的蓝色框中突出显示。来自的myb蛋白gydF4y2Ba十字花科gydF4y2Ba我的植物植物我有更高的身份gydF4y2Baes.gydF4y2BaMyB90比I II的Clades II在IV中gydF4y2Ba
进一步确定的关系gydF4y2Baes.gydF4y2BaMYB90给其他MYB蛋白,我们产生了一种系统发育树,其中具有29个MYB蛋白,参与16株植物中的花青素合成。我们的结果表明gydF4y2Baes.gydF4y2BaMYB90聚在枝I中(图1)。gydF4y2Ba1gydF4y2Bab),由此组成gydF4y2Ba在gydF4y2BaMYB75,gydF4y2Ba在gydF4y2BaMYB90,gydF4y2Ba在gydF4y2BaMYB113,gydF4y2Ba在gydF4y2BaMYB114,gydF4y2Ba薄gydF4y2BaMYB1和gydF4y2BaBrgydF4y2BaMyB114对花青素积累很重要[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba55.gydF4y2Ba].gydF4y2Baes.gydF4y2BaMYB90在进化支II、III和IV中与MYB蛋白有较远的系统发育关系,尽管这些MYB蛋白促进了PA和花青素的生物合成,但不包括gydF4y2Baes.gydF4y2BaMYB5(XP_006407201)还没有研究报告。gydF4y2Ba
总之,我们的研究结果表明gydF4y2Baes.gydF4y2BaMYB90为R2R3-MYB,可能参与原花青素和花青素合成。gydF4y2Ba
的表达模式gydF4y2Baes.gydF4y2BaMYB90在gydF4y2BaE.Salsugineum.gydF4y2Ba和蛋白质的亚细胞定位gydF4y2Ba
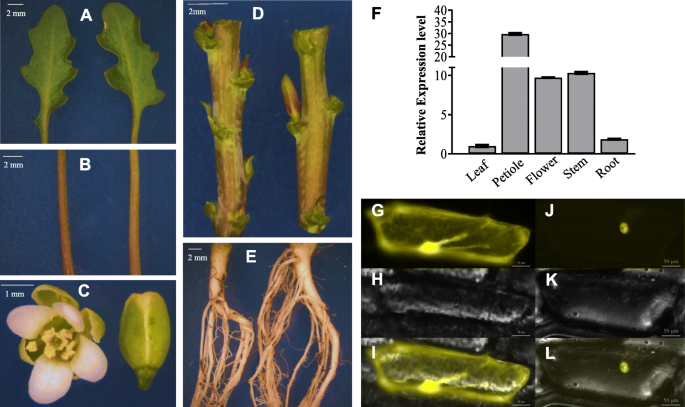
为了检测表达模式gydF4y2BaEsMYB90gydF4y2Ba,我们收集了叶子,叶柄,茎,根和花gydF4y2BaE.Salsugineum.gydF4y2Ba,进行qRT-PCR。我们的结果表明gydF4y2BaEsMYB90gydF4y2Ba在所有检查的组织中表达gydF4y2BaE.Salsugineum.gydF4y2Ba,其中在叶柄中表达量最高(图。gydF4y2Ba2gydF4y2Bab),其次是茎和花(图。gydF4y2Ba2gydF4y2Bac,d),但在叶和根中表达量相对较低(图3)。gydF4y2Ba2gydF4y2Baa,e)。该结果与观察到的不同组织的颜色表型一致,表明表达gydF4y2BaEsMYB90gydF4y2Ba与花青素的合成有关(图。gydF4y2Ba2gydF4y2BaA-F)。gydF4y2Ba
的表达模式gydF4y2Baes.gydF4y2BaMYB90在gydF4y2BaE. Salsugineum.gydF4y2Ba和蛋白质的亚细胞定位。树叶(gydF4y2Ba一个gydF4y2Ba),叶柄(gydF4y2BabgydF4y2Ba)、花(gydF4y2BacgydF4y2Ba),茎(gydF4y2BadgydF4y2Ba),和根(gydF4y2BaegydF4y2Ba)来自三十五周年gydF4y2BaE.Salsugineum.gydF4y2Ba收集植物以进行表型观察。gydF4y2BafgydF4y2Ba表达水平gydF4y2BaEsMyb90gydF4y2Ba在叶子,叶柄,茎,茎和茎,从三十五周龄gydF4y2BaE. Salsugineum.gydF4y2Ba并且垂直条表示3生物复制的标准误差。35s的瞬态表达:gydF4y2Bayfp.gydF4y2Ba-gydF4y2BaEsMYB90gydF4y2Ba在洋葱表皮细胞显示gydF4y2BaEsMYB90gydF4y2Ba在细胞核已本地化。gydF4y2BaggydF4y2Ba洋葱表皮细胞表达的洋葱表皮细胞gydF4y2Ba35 s: YFPgydF4y2Ba示出两个细胞质和细胞核YFP信号;(gydF4y2BahgydF4y2Ba洋葱表皮细胞一种表达洋葱的表皮细胞gydF4y2Ba35 s: YFPgydF4y2Ba在明亮的田野里;(gydF4y2Ba我gydF4y2Ba) G与H的合并图像;(gydF4y2BajgydF4y2Ba洋葱表皮细胞一种表达洋葱的表皮细胞gydF4y2Ba35S:YFP-ESMYB90gydF4y2Ba仅在核中展示YFP信号;(gydF4y2BakgydF4y2Ba洋葱表皮细胞一种表达洋葱的表皮细胞gydF4y2Ba35S:YFP-ESMYB90gydF4y2Ba在明亮的田野里;(gydF4y2BalgydF4y2Ba)J和K控制的合并图像为gydF4y2Ba35 s: YFPgydF4y2Ba.条:50μmgydF4y2Ba
测试亚细胞定位gydF4y2Baes.gydF4y2BaMYB90,检测YFP-的瞬时表达gydF4y2Baes.gydF4y2Ba洋葱表皮细胞MYB90融合蛋白的研究。结果表明,YFP信号在洋葱表皮细胞的细胞质和细胞核中均有表达gydF4y2Ba35 s: YFPgydF4y2Ba(图。gydF4y2Ba2gydF4y2Bag-i),而YFP信号仅在表达细胞的细胞核中检测到gydF4y2Ba35S:YFP-ESMYB90gydF4y2Ba(图。gydF4y2Ba2gydF4y2Baj-l)。我们的结果显示gydF4y2Baes.gydF4y2BaMyB90本地化为细胞核,表明作为其他MYB蛋白gydF4y2Baes.gydF4y2BaMYB90还充当转录调节。gydF4y2Ba
异位表达gydF4y2BaEsMYB90gydF4y2Ba促进花青素在烟草中的积累gydF4y2Ba拟南芥gydF4y2Ba
调查可能的功能gydF4y2BaEsMYB90gydF4y2Ba在花青素生物合成中,我们产生了gydF4y2Ba35秒:ESMYB90gydF4y2Ba构建到异位表达gydF4y2BaEsMYB90gydF4y2Ba在烟草和gydF4y2Ba拟南芥gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:无花果。gydF4y2Ba1gydF4y2Ba一个十八岁)。gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba转基因烟草和15gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba转基因gydF4y2Ba拟南芥gydF4y2Ba植物,分别获得(附加文件gydF4y2Ba1gydF4y2Ba:无花果。gydF4y2Ba1gydF4y2Ba公元前)。gydF4y2Ba
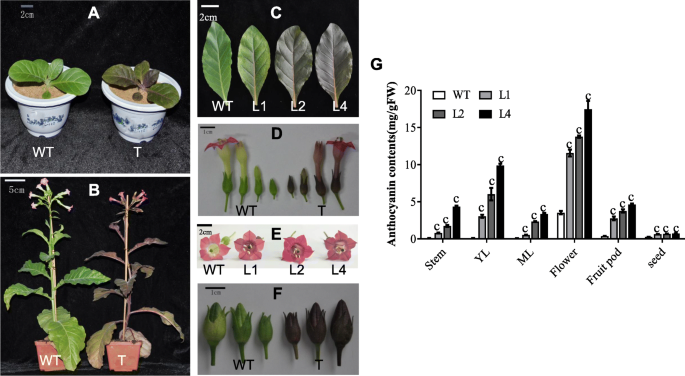
我们发现,在所有发展阶段,叶和茎中gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba烟草植物出现紫红色,颜色变得加深了发展(图。gydF4y2Ba3.gydF4y2BaA-C)。此外,gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba烟草植株的花冠为紫红色,萼片为紫黑色,果荚为紫黑色,而野生型花冠为粉红色,萼片为绿色,果荚为绿色。gydF4y2Ba3.gydF4y2Bad-f)。我们对花青素产量的测定结果表明,三种植物的总花青素含量gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba与野生型相比,烟草株系的茎、幼叶(YL)、成熟叶(ML)、花、果荚和成熟种子数量显著增加(图2)。gydF4y2Ba3.gydF4y2Bag)。在L1,L2和L4三种测试的线中,L4转基因系具有最高的花青素含量。与野生型相比,杨氏叶(Y1)中的总花青素含量,成熟叶(ml),茎,花,水果荚和成熟种子增加了95.2,45.7,48.8,4.9,17.8,和分别为2.6折(图。gydF4y2Ba3.gydF4y2Bag).这些结果表明,增强的色素沉着gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba烟草的形成是由于花青素合成的增加。gydF4y2Ba
异位表达gydF4y2BaEsMYB90gydF4y2Ba增加烟草花青素含量。gydF4y2Ba一个gydF4y2Ba5周龄野生型(WT)和烟草转基因(T)幼苗;(gydF4y2BabgydF4y2Ba9周龄WT和T烟草植株开花期;(gydF4y2BacgydF4y2Ba) 6周龄野生型和L1、L2、L4转基因烟草植株的叶片;(gydF4y2BadgydF4y2Ba)来自九周历史的WT和烟草转基因植物的萼片和花冠;(gydF4y2BaegydF4y2Ba9周野生型和L1、L2、L4转基因烟草植株的花;(gydF4y2BafgydF4y2Ba9周龄野生型和烟草转基因植株的果荚;(gydF4y2BaggydF4y2Ba) WT和L1、L2、L4转基因烟草植株茎、幼叶(YL)、成熟叶(ML)、花、8周龄植株果荚和成熟种子中花青素含量的变化。竖条表示3个生物重复的标准误差,Student的t检验值表示为c (gydF4y2BaPgydF4y2Ba < 0.001)
我们观察到相似的表型gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaESMYB90 Arabidopsis.gydF4y2Ba转基因植物。与野生型植物相比,叶、根、茎、花、果荚和种子的颜色变成浅紫色到深紫色gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaESMYB90 Arabidopsis.gydF4y2Ba植物(图。gydF4y2Ba4gydF4y2BaA-G)。特别是种子来自gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaESMYB90 Arabidopsis.gydF4y2Ba植株呈黑色(图。gydF4y2Ba4gydF4y2Bah, i)。抽薹期根、茎、叶、花、果荚及成熟种子中花青素的含量gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaESMYB90 Arabidopsis.gydF4y2Ba转基因系(L1,L2和L3)显着高于野生型植物中的那种(图。gydF4y2Ba4gydF4y2Baj)。gydF4y2Ba
异位表达gydF4y2BaEsMYB90gydF4y2Ba增加花青素内容物gydF4y2Ba拟南芥gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba) 7日龄野生型(WT)gydF4y2Ba拟南芥gydF4y2Ba转基因(T)幼苗;(gydF4y2BabgydF4y2Ba)三周大的WT和gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BacgydF4y2Ba) 7周大的WT和gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BadgydF4y2Ba)三周大的WT和gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BaegydF4y2Ba)从7周龄WT和茎gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BafgydF4y2Ba) 7周大的WT和gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BaggydF4y2Ba)和(gydF4y2BahgydF4y2Ba)来自七周龄WT和的水果豆荚gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2Ba我gydF4y2Ba) 9周龄野生型种子gydF4y2Ba拟南芥gydF4y2BaT植物;(gydF4y2BajgydF4y2Ba)在根,茎,叶,花,四周植物和成熟种子的水果荚中的花青素含量,来自wt以及l1,l2和l3gydF4y2Ba拟南芥gydF4y2Ba转基因植物。竖条表示3个生物重复的标准误差,Student的t检验值表示为c (gydF4y2BapgydF4y2Ba < 0.001)
总的来说,我们的结果表明gydF4y2Baes.gydF4y2BaMYB90作为转录因子促进植物花青素的生物合成。gydF4y2Ba
转录组分析表明gydF4y2Baes.gydF4y2BaMYB90是原霉素和花青素途径中的关键调节剂gydF4y2Ba
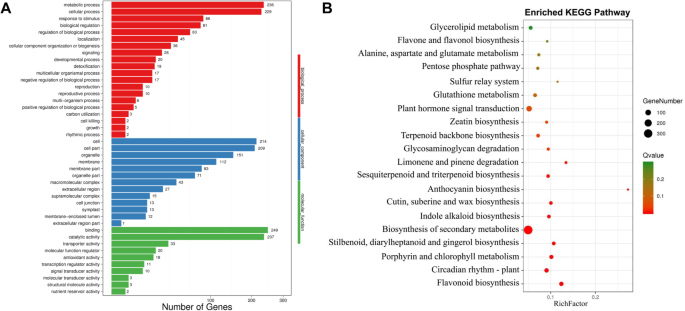
检查分子机制gydF4y2Baes.gydF4y2BaMYB90在全基因组范围内控制花青素生物合成,我们利用野生型和野生型的叶片进行了RNA-seq分析gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba烟草转基因植物。在与野生型植物的比较中,我们鉴定了51,202个差异表达基因(DEGs)gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90gydF4y2Ba转基因烟草植物,其中2446次具有LOG2折叠变化≥1或gydF4y2Ba≦gydF4y2Ba−1和Padj≤0.05(附加文件gydF4y2Ba2gydF4y2Ba).2446个基因中1199个基因表达上调,1247个基因表达下调(附加文件)gydF4y2Ba2gydF4y2Ba).此外,476个独特的deg被注释为43个GO项,其中编码结合(249个基因)、催化活性(237个基因)和代谢过程(236个基因)的deg数量排名前3位的GO项(图)。gydF4y2Ba5gydF4y2Ba一个额外的文件gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
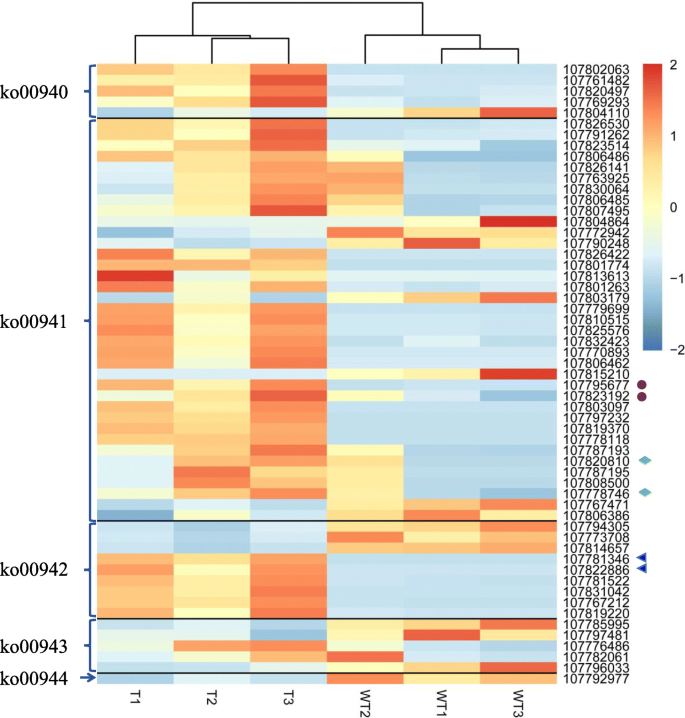
我们发现,在2446个deg中,有1023个独特的基因被注释到128个KEGG通路中(附加文件)gydF4y2Ba4gydF4y2Ba).最突出的kegg富集基因涉及次级代谢产物生物合成,其次是植物激素信号转导,类黄酮生物合成(附加文件gydF4y2Ba1gydF4y2Ba:无花果。gydF4y2Ba2gydF4y2Ba).根据Q值的Q值,富集路径的前20个包括类黄酮生物合成(KO00941),花青素生物合成(KO00942),黄酮和黄酮生物合成(KO00944),植物昼夜节律(KO04712)和谷胱甘肽代谢(KO00480;图.gydF4y2Ba5gydF4y2Bab,附加文件gydF4y2Ba5gydF4y2Ba).花青素生物合成途径富集因子最大,其次是类黄酮生物合成途径。黄酮和黄酮醇的生物合成途径也有很大的富集因子(图。gydF4y2Ba5gydF4y2Bab,附加文件gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
米一个ppin.gto the KEGG reference pathways found that a total of 57 significantly differential expression genes were assigned to five secondary metabolic pathways, i.e. phenylpropanoid biosynthesis (ko00940), flavonoid biosynthesis (ko00941), anthocyanin biosynthesis (ko00942), isoflavonoid biosynthesis (ko00943), and flavone and flavonol biosynthesis pathways (ko00944). The gene names, gene ID, and the combined functional annotations were seen in Additional file6gydF4y2Ba.在57个基因中,有42个基因编码PA和花青素生物合成酶,如PAL(107,802,063、107,761,482和107,820,497)、CHS(107,826,422、107,801,774和107,813,613)、CHI(107,779,699、107,810 5,15和107,825,576)、F3H(107,770 8,93、107,806,462)、DFR(107,803,097,107,797,232)和ANS/ LDOX(107,819,370、107,778,118、107,787,193、107787195年和107808500年)。其中,花青素生物合成途径(ko00942)中编码UFGT的6个基因(107,781,346、107,822,886、107,781,522、107,831,042、107,767,212和107,819,220)均被强烈上调(图2)。gydF4y2Ba6gydF4y2Ba,附加文件gydF4y2Ba6gydF4y2Ba).然而,在KO00940-KO00944途径中,仅15个基因,包括编码黄酮合酶/黄酮3-羟化酶(107,794,305,107,814,657),转霉醇二甲基转移酶样(107,785,995,107,797,481)和黄酮3'-O-甲基转移酶1状(107792977)被下调(图。gydF4y2Ba6gydF4y2Ba,附加文件gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
综上所述,我们的RNA-seq结果表明,所鉴定的DEGs在类黄酮和花青素合成途径(ko00941-ko00944)中显著富集,提示gydF4y2Baes.gydF4y2BaMYB90发挥原花青素和花青素合成中起重要调节作用。gydF4y2Ba
通过QRT-PCR验证RNA-SEQ结果gydF4y2Ba
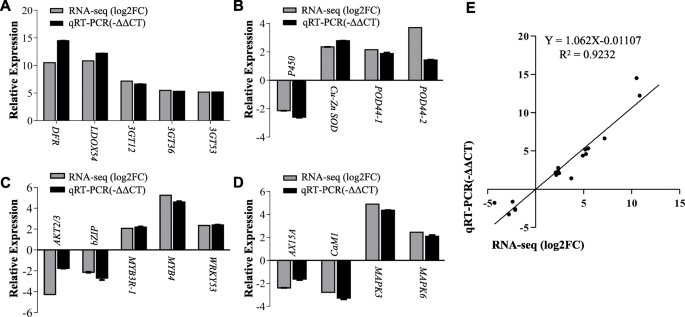
为了验证RNA-SEQ结果,我们进行定量逆转录PCR(QRT-PCR),用于被分配给在烟草有关花青素的生物合成,抗氧化剂的生产,信号转导,转录调节,和离子通道5组18个基因(附加文件gydF4y2Ba7gydF4y2Ba).我们的研究结果表明5个花青素生物合成基因的表达水平发生了变化[gydF4y2BaNTDFR.gydF4y2Ba(107803097),gydF4y2BaNtLDOX54gydF4y2Ba(107778118),gydF4y2BaNt3GT12gydF4y2Ba(107781346),gydF4y2BaNT3GT36.gydF4y2Ba(107781522),和gydF4y2Bant3gt53.gydF4y2BaQRT-PCR检测的(107831042)]与RNA-SEQ数据一致(图。gydF4y2Ba7gydF4y2Ba一种)。我们获得了类似的QRT-PCR,从检查4个抗氧化相关基因的表达[gydF4y2BaNtP450gydF4y2Ba(107772738),gydF4y2Bantcu-znsod.gydF4y2Ba(107806960),gydF4y2BaNtPOD44-1gydF4y2Ba(107827231),和gydF4y2BaNtPOD44-2gydF4y2Ba(107797651);无花果。gydF4y2Ba7gydF4y2BaB, 4个基因编码转录因子[gydF4y2BaNtbZIPgydF4y2Ba(107795590),gydF4y2BaNtMYB3R-1gydF4y2Ba(107795213),gydF4y2BaNtMYB4gydF4y2Ba(107802984),和gydF4y2BaNtWRKY53gydF4y2Ba(107825953);无花果。gydF4y2Ba7gydF4y2BaC],gydF4y2BaNTAKT2 / 3.gydF4y2Ba(107761230)编码一个钾通道蛋白(图7C),以及4个与信号转导和离子通道相关的基因[gydF4y2Bantmapk3.gydF4y2Ba(107782983),gydF4y2Bantmapk6.gydF4y2Ba(107806359),gydF4y2BaNtAX15AgydF4y2Ba(107805986)gydF4y2BaNtCaM1gydF4y2Ba(107803626);无花果。gydF4y2Ba7gydF4y2Bad]。我们在qRT-PCR和RNA-seq数据中发现了相似的差异表达模式,pearson系数(R2)较低,为0.9232。因此,qRT-PCR结果支持我们的转录组结果是可靠的。gydF4y2Ba
A-D, real-time PCR验证rna测序结果。(gydF4y2Ba一个gydF4y2Ba)花青素生物合成基因;(gydF4y2BabgydF4y2Ba)抗氧化相关基因;(gydF4y2BacgydF4y2Ba)编码转录因子和离子通道的基因;(gydF4y2BadgydF4y2Ba)信号通路相关基因。gydF4y2Bantubi2.gydF4y2Ba(gydF4y2BaNtubiquitin 2gydF4y2Ba(LOC107772211)作为内部控制。E, RNA-Seq与qRT-PCR结果的相关性分析。RNA-Seq分析的fold change (x轴)与qRT-PCR数据(y轴)的相关性。每组数据从3个重复中获得gydF4y2Ba
EsMYB90gydF4y2Ba促进花青素生物合成基因在烟草中的表达gydF4y2Ba
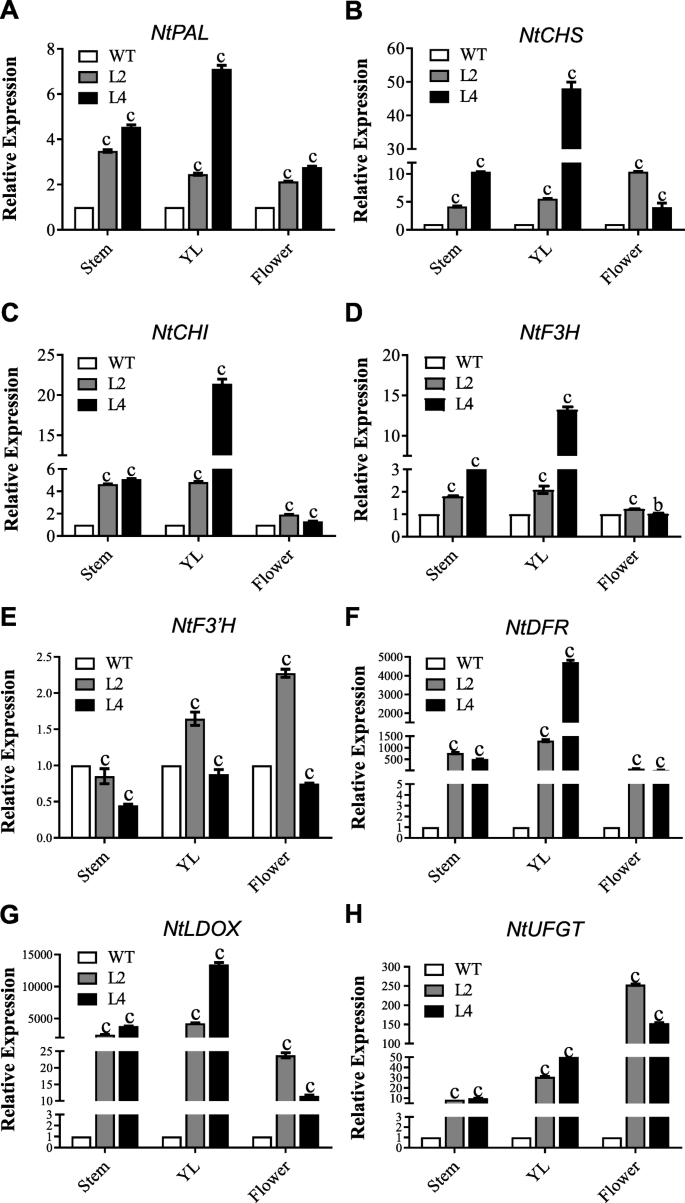
进一步阐明分子功能gydF4y2Baes.gydF4y2BaMYB90在原花青素和花青素生物合成中的表达,检测了花青素生物合成关键基因的表达gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaCHS.gydF4y2Ba,gydF4y2BachgydF4y2Ba,gydF4y2BaF3h.gydF4y2Ba,gydF4y2BaF3'H.gydF4y2Ba,gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba/gydF4y2BaLdox.gydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba在茎,幼叶(yl)和鲜花gydF4y2Ba35秒:ESMYB90gydF4y2Ba通过qRT-PCR检测烟草转基因株系(L2、L4)和野生型烟草植株的花期性状。gydF4y2Ba
PAL是苯丙醇丙烷代谢途径中的第一键酶[gydF4y2Ba9gydF4y2Ba].表达水平的gydF4y2Bantpal.gydF4y2Ba在茎、叶和花中的含量分别是野生型的4.6倍、7.1倍和2.8倍。gydF4y2Ba8gydF4y2Baa). CHS催化花青素生物合成的第一步,而CHI催化查尔酮分子环化形成柚皮素[gydF4y2Ba8gydF4y2Ba].两者的表达水平gydF4y2BaNTCH.gydF4y2Ba和gydF4y2BaNTCHI.gydF4y2Ba在茎,叶和花从L4线进行显著增加相比于野生型(图gydF4y2Ba8gydF4y2Ba公元前)。然而,在花NtF3H的相对转录物水平在转基因L4线(图24中略微下调。gydF4y2Ba8gydF4y2Bad),茎中的NTF3'H转录物在L2和L4转基因中下调(图。gydF4y2Ba8gydF4y2Bae).最后,花青素生物合成基因gydF4y2BaNTDFR.gydF4y2Ba,gydF4y2BaNTANS.gydF4y2Ba和gydF4y2BaNtUFGTgydF4y2Ba在以后的步骤中对于花青素生物合成所需的是显着上调的gydF4y2BaEsMYB90gydF4y2Ba(图。gydF4y2Ba8gydF4y2Baf-h)。gydF4y2Ba
花青素生物合成基因在茎、叶和花中的表达分析gydF4y2BaEsMYB90gydF4y2Ba开花期转基因烟草株系。WT:野生型;L2和L4是两个独立的gydF4y2Ba35秒:ESMYB90gydF4y2Ba线gydF4y2Ba.ntubi2.gydF4y2Ba(gydF4y2BaNtubiquitin 2gydF4y2Ba(LOC107772211)作为内部控制。(gydF4y2Ba一个gydF4y2Ba)gydF4y2Bantpal.gydF4y2Ba(XM_016625506.1);(gydF4y2BabgydF4y2Ba)gydF4y2BaNTCH.gydF4y2Ba(NM_001326166.1);(gydF4y2BacgydF4y2Ba)gydF4y2BaNTCHI.gydF4y2Ba(NM_001325287.1);(gydF4y2BadgydF4y2Ba)gydF4y2Bantf3h.gydF4y2Ba(NM_001325083.1);(gydF4y2BaegydF4y2Ba)gydF4y2BaNtF3'HgydF4y2Ba(NM_001325608.1);(gydF4y2BafgydF4y2Ba)gydF4y2BaNTDFR.gydF4y2Ba(NM_001325732.1);(gydF4y2BaggydF4y2Ba)gydF4y2BaNtLDOXgydF4y2Ba(nm_001326043.1);(gydF4y2BahgydF4y2Ba)gydF4y2BaNtUFGTgydF4y2Ba(nm_001325312.1)。使用了ΔΔCT方法来确定相对表达,在野生型测试基因的表达水平被设定为1。竖线代表三次生物学重复的标准差。B和C分别表现出p <0.01和p <0.001gydF4y2Ba
总之,我们的研究结果表明gydF4y2Baes.gydF4y2Ba通过促进花青素生物合成基因,特别是LBG的表达,MyB90通过促进花青素的表达来控制花青素生物合成。gydF4y2Ba
讨论gydF4y2Ba
花青素是植物着色的主要贡献者,颜色是水果和花卉质量的重要决定因素[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba56.gydF4y2Ba].花青素等类黄酮也能清除细胞产生的氧自由基,因此具有抗氧化活性[gydF4y2Ba57.gydF4y2Ba,gydF4y2Ba58.gydF4y2Ba].花青素的抗氧化活性取决于B环羟基化,酰化和糖基化的程度[gydF4y2Ba56.gydF4y2Ba].花青素作为抗氧化剂,可降低脂质过氧化,延缓细胞衰老。同时,花青素保护植物免受生物和非生物胁迫的损害,使植物适应环境变化[gydF4y2Ba59.gydF4y2Ba].在高等植物中,PAs和花青素生物合成受不同组合的MYB-bHLH-WD40 (MBW)复合物调控,而R2R3-MYBs在花青素生物合成的转录调控中起着重要作用[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba].我们的结果通过促进PA和花青素生物合成基因的表达,新的R2R3-MYB对PA和花青素生物合成的分子机制脱光。gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2BaMYB75、MYB90、MYB113和MYB114通过参与MBW (MYB-bHLH-WD40)复合物调控PA和花青素的生物合成而冗余作用。过表达这四种myb中的一种足以增加花青素在幼叶中的积累[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].gydF4y2Baes.gydF4y2BaMYB90是一个R2R3-MYB,包含一个保守的[D/E]Lx2[R/K]x3Lx6Lx3R motif(黑色箭头),是与R/ b样bHLH蛋白相互作用所必需的gydF4y2Baes.gydF4y2BaMYB15 (XP_006406061),gydF4y2Baes.gydF4y2BaMYB106 (XP_006390428),gydF4y2Baes.gydF4y2BaMYB108(XP_006407939),gydF4y2Baes.gydF4y2BaMYB -Related蛋白质340(XP_006395259)来自gydF4y2BaE. Salsugineum.gydF4y2Ba.的和v(红色框A)和KPRPR [S / T F的基序(蓝色框B)表征花青素促进MYBS在存在gydF4y2Baes.gydF4y2BaMYB90蛋白质,但不是在其他五个gydF4y2Baes.gydF4y2Bamyb [MYB5 (XP_006407201), MYB15, MYB106, MYB108, myb相关蛋白340gydF4y2Ba1gydF4y2Ba:无花果。gydF4y2Ba3.gydF4y2Ba).在gydF4y2Ba拟南芥gydF4y2Ba和其他高等植物,花青素途径是由多个MYB转录因子控制的[gydF4y2Ba1gydF4y2Ba].例如,用各种MYBS组装的至少四个MBW复合物涉及最内部细胞层的PA累积gydF4y2Ba拟南芥gydF4y2Ba种子外套[gydF4y2Ba23.gydF4y2Ba].因此,我们的结果表明,与其他植物不同的是,较少的MYBs调节花青素的生物合成gydF4y2BaE. Salsugineum.gydF4y2Ba和gydF4y2Baes.gydF4y2BaMYB90是一个主要参与者。gydF4y2Ba
黄酮类生物合成的调节机制在高等植物中保存[gydF4y2Ba1gydF4y2Ba].该MYB蛋白通常决定MBW复合物的具体途径参与[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba60.gydF4y2Ba].在MBW复合体中,与BHLH和WD40相比,MyBs具有最高的结合特异性。myb和bhlh与三个保守中的至少一个绑定gydF4y2BaCIS.gydF4y2BaMYB-core、AC-rich和E/G-box是四个lbg(晚期生物合成基因:DFR、TT19、TT12和AHA10)的启动子,这些启动子指定了它们在种皮中的表达gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba60.gydF4y2Ba].lbg的表达受MYB75、MYB90、MYB113、MYB114调控gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].我们的系统发育分析表明gydF4y2Baes.gydF4y2BaMyb90在同一个思工中gydF4y2Ba拟南芥gydF4y2BaMYB75, MYB90, MYB113, MYB114,提示gydF4y2Baes.gydF4y2BaMYB90可能在LBG的规定中发挥更重要的作用(gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba/gydF4y2BaLdox.gydF4y2Ba和gydF4y2BaUFGTgydF4y2Ba)表达,这是根据我们的研究成果。此外,我们的结果表明gydF4y2Baes.gydF4y2BaMYB90促进早期生物合成基因的表达,如PAL、CHS、CHI和F3H,这与其他植物的发现一致[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].此外,有可能gydF4y2Baes.gydF4y2BaMyB90上调表达gydF4y2Bantmyb.gydF4y2Ba和gydF4y2BaNTBHLH.gydF4y2Ba基因参与花青素的生物合成,因为表达gydF4y2BaNtMYB3gydF4y2Ba(107820930),gydF4y2BaNtMYB4gydF4y2Ba(107,802,984,107,769,018,107,815,562,107,760,435),gydF4y2BaNtMYB44gydF4y2Ba(107816351,107759750),gydF4y2BaMyB样子gydF4y2Ba(107807565, 107795213),gydF4y2BaNTBHLH.gydF4y2Ba(107791671, 107791200),gydF4y2BaNtbHLH92gydF4y2Ba(107785534),gydF4y2BaNtbHLH18gydF4y2Ba(107811232),和gydF4y2BaNTBHLH35.gydF4y2Ba(107774314)显着增加gydF4y2Ba35秒:ESMYB90gydF4y2Ba烟草转基因植物(附加文件gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
总的来说,我们的研究结果显示了小说的异位表达gydF4y2BaEsMYB90gydF4y2Ba基因可以通过促进花青素生物合成途径基因的表达,特别是在lbg中发挥作用,从而强烈诱导花青素生物合成。我们的研究也为该方法的应用铺平了道路gydF4y2BaEsMYB90gydF4y2Ba转基因作物和观赏植物。gydF4y2Ba
结论gydF4y2Ba
EsMYB90gydF4y2Ba,是一个R2R3 MYB转录因子,定位于细胞核。gydF4y2Ba35秒:ESMYB90gydF4y2Ba转基因烟草和gydF4y2Ba拟南芥gydF4y2Ba表现为紫红、紫黑表型,叶、茎、花中花青素积累量均高于野生型。结果显示异位表达gydF4y2BaEsMYB90gydF4y2Ba在烟草茎、叶和花中均能显著提高花青素生物合成基因EBGs (gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaCHS.gydF4y2Ba,gydF4y2BachgydF4y2Ba)及lbg (gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba),特别是在LBG。这项研究表明gydF4y2BaEsMYB90gydF4y2Ba在调控花青素的生物合成方面起着关键作用,为转基因植物提高花青素含量提供了新的线索。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
的种子gydF4y2BaEutrema salsugineumgydF4y2Ba(山东生态型),gydF4y2Ba拟南芥gydF4y2Ba(哥伦比亚-0)和烟草(gydF4y2Ba烟草gydF4y2Ba山东师范大学生命科学学院山东省级重点实验室保留和呈现了CV SR1。gydF4y2Ba
野生型和转基因植物gydF4y2Ba烟草gydF4y2Ba和gydF4y2Ba拟南芥gydF4y2Ba(哥伦比亚-0)在温室中的蛭石,珍珠岩和泥炭苔(1:1:1)的混合物中生长在25°C的温室中,是16小时光/ 8小时的光周期。gydF4y2BaEutrema salsugineumgydF4y2Ba以22°C的生长室生长,光周期为16小时光/ 8小时黑暗,相对湿度为70%。gydF4y2Ba
T3代生代纯合转基因和野生型烟草植物用于分析。在8-9叶期间8周的烟草植物生长后,收集转录组和QRT-PCR鉴定的野生型和转基因植物的第六叶。进行转录组和QRT-PCR的三种生物重复。在烟草,茎,幼叶(Y1),成熟的叶片(ml),花和水果荚在开花阶段,使用成熟的种子来确定花青素的含量,同时茎,幼叶(Y1)和花用于检查花青素生物合成基因的表达。同样的,gydF4y2Ba拟南芥gydF4y2Ba从4周生长的植物中的根,茎,叶,花和水果荚和成熟的种子用于确定花青素的含量。在所有情况下,样品在液氮中立即冷冻并储存在-80℃。进行了所有测试的三个重复。gydF4y2Ba
系统发育分析gydF4y2Ba
从NCBI下载一组相关的MYB蛋白序列,并使用DNAMAN软件(5.2.2版)执行多个序列对齐。使用Mega6软件与邻接方法使用Mega6软件构建系统发育树。gydF4y2Ba
亚细胞定位gydF4y2Baes.gydF4y2BaMYB90gydF4y2Ba
的编码区gydF4y2BaEsMYB90gydF4y2Ba通过YFPMYB-F和YFPMYB-R引物进行PCR扩增gydF4y2Ba囊gydF4y2Ba我和gydF4y2Ba囊gydF4y2BaII分别网站(附加文件gydF4y2Ba9gydF4y2Ba)然后克隆到YFP-PCAT向量中,导致了gydF4y2Ba35 s: YFP-EsMYB90-pCATgydF4y2Ba向量。洋葱表皮细胞随着方法转化gydF4y2Ba35 s: YFP-EsMYB90-pCATgydF4y2Ba和gydF4y2BaYFP-pCATgydF4y2Ba(对照)质粒,采用质粒轰击法[gydF4y2Ba61.gydF4y2Ba].将转化的细胞在25℃下孵育16-24小时,然后观察到荧光显微镜(BX51,7.3,Olympus,Tokyo,Japan)记录荧光信号。执行每个构建体的至少三个重复。gydF4y2Ba
RNA分离和cDNA合成gydF4y2Ba
从0.5克的年轻叶子中分离出总RNAgydF4y2BaEutrema salsugineumgydF4y2Ba和gydF4y2Ba烟草gydF4y2Ba使用TrizoL试剂(Life Technologies)或快速RNA隔离套件(Biotech Biotechnology Company,北京,中国)。用Nanodrop ND1000分光光度计(Nanodrop Technologies,Wilmington,De,USA)测量RNA浓度和纯度(A260 / A280)。使用GDNA去除剂(Toyobo,Japan)使用RECR TRA ACE QPCR RT Master Mix合成第一链cDNA。简而言之,RNA在65℃下热变性5分钟,然后立即放置在冰上进行冷却,然后将2μL4×DN主混合物,0.5pg-0.5μg的RNA模板和不含核酸酶的水加入8 μL of volume. After 5 min of incubation at 37°, 5 × RT Mater Mix II was added to make 10 μL of final volume. RT reaction was carried out at 37 °C for 15 min, 50 °C for 5 min, 98 °C for 5 min to obtain 10 μl of cDNA.
建筑发电和厂房改造gydF4y2Ba
整个编码序列gydF4y2BaEsMYB90gydF4y2Ba从中扩增了PCR扩增gydF4y2BaEutrema salsugineumgydF4y2BacDNA使用前向引物5'-ccggydF4y2BaGAATTCgydF4y2BaTTTAGAATACTTATTGGTCC-3 '和反向引物5 ' -CGCGGATCCATCAGAGACAGATATTAGTTGG-3 'gydF4y2Ba生态gydF4y2Ba我和gydF4y2BaBAMgydF4y2BaH I酶切位点分别位于5 '和3 'gydF4y2Ba9gydF4y2Ba).由此产生的gydF4y2BaEsMYB90gydF4y2Ba片段克隆到PMD18-T载体(Takara,USA)中。测序确认后,gydF4y2BaEsMYB90gydF4y2Ba片段亚克隆到gydF4y2Ba生态gydF4y2Bari -gydF4y2BaBAMgydF4y2BaPCAMBIA3301H矢量的嗨网站,在哪里gydF4y2BaEsMYB90gydF4y2Ba是在控制的控制下gydF4y2BaCaMV 35 sgydF4y2Ba启动子。表达载体(gydF4y2Ba35年代gydF4y2Ba:gydF4y2BaEsMYB90-pCAMBIA3301HgydF4y2Ba)最终被引入了gydF4y2Ba根癌土壤杆菌gydF4y2Ba菌株GV3101。gydF4y2Ba
的变换gydF4y2BaN. Tabacum.gydF4y2Ba使用卷曲等人报告的叶片盘方法进行。[gydF4y2Ba62.gydF4y2Ba].选择转基因烟草幼苗在含有6mg / L巴斯塔尔和300mg / L的Cefalexin的MS培养基上。的变换gydF4y2BaA. Thaliana.gydF4y2Ba哥伦比亚-0采用花卉浸渍方法进行[gydF4y2Ba63.gydF4y2Ba通过喷洒0.1%的混蛋除草剂来筛选转化体。使用特异性引物进一步通过PCR进一步证实转基因的存在gydF4y2BaEsMYB90gydF4y2Ba.纯合转基因gydF4y2BaN. Tabacum.gydF4y2Ba和gydF4y2BaA. Thaliana.gydF4y2Ba用于随后的表型和功能分析。gydF4y2Ba
花青素的分析gydF4y2Ba
在开花阶段,烟草的茎,幼叶(y1),成熟叶(ml),花和果皮豆荚生长约8周,分别对成熟的种子进行采样。同样,茎,叶,花,水果荚和根gydF4y2Ba拟南芥gydF4y2Ba在螺栓期间生长约4周,也收集了成熟的种子。将所有材料立即在液氮中冻结并研磨成粉末。使用Neff和Chory描述的改进方法测定花青素含量[gydF4y2Ba64.gydF4y2Ba].的测量gydF4y2Ba一个gydF4y2Ba530gydF4y2Ba和gydF4y2Ba一个gydF4y2Ba657gydF4y2Ba用分光光度计(UV-1800,岛津)进行。结果由eq. (A530-0.25 *A657)/鲜重计算。每个样品重复3次。gydF4y2Ba
RNA-seq的和生物信息学分析gydF4y2Ba
野生型和野生型第6叶片的总rnagydF4y2BaEsMYB90gydF4y2Ba利用快速RNA分离试剂盒(Bioteke Corporation, Beijing, China)对7-8叶期转基因烟草进行分离。利用bgiiseq -500平台在华大基因公司(中国深圳)进行RNA文库构建和测序。进行了三个独立的生物学重复。gydF4y2Ba
过滤低质量读取(超过20%的碱基质量低于10)、带有适配器的读取和带有未知碱基的读取(N个碱基质量超过5%),得到干净的读取。使用HISAT将干净的reads映射到参考基因组[gydF4y2Ba65.gydF4y2Ba].同时,使用Bowtie2将清洁读数映射到参考转录物[gydF4y2Ba66.gydF4y2Ba].将clean reads组装成unigenes,然后进行unigene功能注释等,计算每个样本的unigene表达水平[gydF4y2Ba67.gydF4y2Ba].最后,我们鉴定了DEGS(差异表达基因)并进行了聚类分析和功能注释。根据官方分类,通过GO和KEGG注释结果进行分类,使用R软件中的PHYPER进行GO和KEGG途径功能富集。DEG的转录因子预测:使用GetorF创立每个DEG的ORF,并使用HMMSEARP对准TF域(来自PLNTFDB)[gydF4y2Ba68.gydF4y2Ba].gydF4y2Ba
QRT-PCR基因表达分析gydF4y2Ba
为了验证转录的结果,实时定量PCR通过的LightCycler?96系统检查选择的基因的表达(附加文件执行gydF4y2Ba9gydF4y2Ba)使用用于RNA-SEQ的烟叶中提取的总RNA。通过将QRT-PCR(-ΔΔct)与RNA-SEQ(LOG2FC)的结果进行比较来验证转录组数据。gydF4y2Ba
为检测花青素生物合成基因在烟草不同组织中的表达,分别对烟草花期茎、嫩叶和花进行了取样。采用总RNA快速提取试剂盒(Biotech biotechnology company, China)提取总RNA。使用Rever Tra Ace qPCR RT Master Mix with gDNA Remover (Toyobo, Japan)合成第一链cdna。qPCR采用LightCycler®96系统(罗氏,瑞士;补充表S1)。gydF4y2Bantubi2.gydF4y2Ba(gydF4y2Ba泛素2.gydF4y2Ba(LOC107772211)作为内参基因。每个样品重复3次。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。RNA文库的原始数据可在NCBI短读取存档(Prjna609528)。gydF4y2Ba
缩写gydF4y2Ba
- PAS:gydF4y2Ba
-
原花青素gydF4y2Ba
- 朋友:gydF4y2Ba
-
苯丙氨酸氨 - 裂解酶gydF4y2Ba
- CHS:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- Chi:gydF4y2Ba
-
Chalcone异构酶gydF4y2Ba
- DHK:gydF4y2Ba
-
Dihydokaempferol \gydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3β-羟化酶gydF4y2Ba
- DHQ:gydF4y2Ba
-
DihydroquercetingydF4y2Ba
- F3'H:gydF4y2Ba
-
黄酮类化合物3'-羟化酶gydF4y2Ba
- DHM:gydF4y2Ba
-
二氢霉素gydF4y2Ba
- F3’5是什么:gydF4y2Ba
-
类黄酮3 ',5 ' -羟化酶。gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- UFGT:gydF4y2Ba
-
UDP-glucosegydF4y2Ba
类黄酮3-O-glucosyltranferasegydF4y2Ba
- MBW:gydF4y2Ba
-
MYB-BHLH-WD40gydF4y2Ba
- eBGs:gydF4y2Ba
-
早期的生物合成基因gydF4y2Ba
- lbg:gydF4y2Ba
-
晚期生物合成基因gydF4y2Ba
- YL型:gydF4y2Ba
-
年轻的叶子gydF4y2Ba
- ML:gydF4y2Ba
-
成熟的叶子gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- KEGG:gydF4y2Ba
-
Kyoto基因和基因组的百科全书gydF4y2Ba
- 去:gydF4y2Ba
-
基因Ontoloty.gydF4y2Ba
- QRT-PCR:gydF4y2Ba
-
定量逆转录PCRgydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
徐文军,王志强,王志强,等。MYB-bHLH-WDR复合物对黄酮类化合物合成的转录调控。植物科学进展。2015;20(3):176-85。gydF4y2Ba
- 2。gydF4y2Ba
娄Q,刘YL,YY齐,焦SZ,田FF,蒋丽,王YJ。转录组测序和代谢产物的分析表明飞燕草色素代谢的花色中的作用gydF4y2Ba葡萄风信子gydF4y2Ba.[J] .机器人。2014;65(12):3157-64 .]gydF4y2Ba
- 3.gydF4y2Ba
Falcone的费雷拉ML,里乌斯SP,卡萨蒂P.黄酮:生物合成,生物学功能和生物技术应用。前植物SCI。2012; 3(222):222。gydF4y2Ba
- 4.gydF4y2Ba
HICHRI I,Barrieu F,Bogs J,Kappel C,Delrot S,Lauvergeat V.最近的类黄酮化生物合成途径的转录调节的最新进展。J Exp Bot。2011; 62(8):2465-83。gydF4y2Ba
- 5。gydF4y2Ba
张永强,张志强,张志强。植物花青素生物合成的研究进展。植物学报。2014;19:81-90。gydF4y2Ba
- 6。gydF4y2Ba
牛世生,徐建杰,张文生,张博,李旭,林旺科,Ferguson IB, Allan AC,陈克勤。杨梅花青素合成的协调调控(gydF4y2BaMyrica Rubra.gydF4y2Ba)通过R2R3 MYB转录因子的果实。Planta。2010; 231(4):887-99。gydF4y2Ba
- 7。gydF4y2Ba
王志强,王志强,王志强,等。植物生殖器官中花青素合成调控的研究进展。植物科学。2011;181(3):219 - 29。gydF4y2Ba
- 8。gydF4y2Ba
Jaakola L.新的洞察到花青素合成的水果调节。趋势植物SCI。2013; 18(9):477-83。gydF4y2Ba
- 9。gydF4y2Ba
琼斯DH。苯丙氨酸解氨酶的诱导调控及其在植物发育中的作用。Phytochem。1984;23(7):1349 - 59。gydF4y2Ba
- 10。gydF4y2Ba
刘雪峰,向丽玲,尹晓荣,Grierson D,李峰,陈克勤。花青素生物合成调控MYB转录因子的鉴定gydF4y2Ba菊花gydF4y2Ba花。Sci Hortic。2015;194:278 - 85。gydF4y2Ba
- 11.gydF4y2Ba
Takos Am,JafféFW,雅各布SR,Bogs J,Robinson SP,Walker AR。光诱导的a表达gydF4y2BamygydF4y2Ba基因调控红苹果花色苷的生物合成。植物杂志。2006;142(3):1216 - 32。gydF4y2Ba
- 12.gydF4y2Ba
Pérez-Díaz JR, Pérez-Díaz J, Madrid-Espinoza J, González-Villanueva E, Moreno Y, Ruiz-Lara S.葡萄R2R3-MYB转录因子家族新成员抑制转基因烟草花色素苷的积累。acta botanica sinica(云南植物学报). 2016;40(1):63-76。gydF4y2Ba
- 13。gydF4y2Ba
冯树青,王玉玲,杨松,徐永涛,陈新世。梨花青素的生物合成是由R2R3-MYB转录因子PyMYB10调控的。足底。2010;232(1):245 - 55。gydF4y2Ba
- 14。gydF4y2Ba
周辉,彭强,赵建平,Owiti A,任飞,廖玲,王玲,邓晓波,姜强,韩艳萍。多个R2R3-MYB转录因子参与调控桃花花青素的积累。植物学报,2016;7(28):1557。gydF4y2Ba
- 15.gydF4y2Ba
Gonzalez A,Zhao M,Leavitt JM,Lloyd Am。TTG1 / BHLH / MYB转录复合物调节花青素生物合成途径gydF4y2Ba拟南芥gydF4y2Ba幼苗。植物j . 2008; 53(5): 814 - 27所示。gydF4y2Ba
- 16。gydF4y2Ba
齐默尔曼IM, Heim MA, Weisshaar B, Uhrig JF。全面的识别gydF4y2Ba拟南芥gydF4y2Ba与R / B样BHLH蛋白相互作用的MYB转录因子。工厂J. 2004; 40(1):22-34。gydF4y2Ba
- 17。gydF4y2Ba
Bac-Molenaar Ja,Fradin Ef,Rienstra Ja,Vreugenhil D,Keurentjes JJ。花青素积累的Gwa映射揭示了平衡的MYB90gydF4y2Ba拟南芥gydF4y2Ba.Plos一个。2015; 10(11):E0143212。gydF4y2Ba
- 18。gydF4y2Ba
Zuluaga DL,Gonzali S,Loreti E,Pucciariello C,Degl'Inocenti E,Guidi L,Alpi A,Perata P.gydF4y2Ba拟南芥gydF4y2BaMYB75 / PAP1转录因子诱导转基因番茄植物中的花青素产生。Funct植物Biol。2008; 35(7):606-18。gydF4y2Ba
- 19。gydF4y2Ba
Borevitz jo,xia y,blount j,dixon ra,羊肉c.活化效果鉴定了苯丙醇丙烷生物合成的保守的Myb调节剂。植物细胞。2000; 12:2383-93。gydF4y2Ba
- 20.gydF4y2Ba
Tohge T, Nishiyama Y, Hirai MY, Yano M, Nakajima J, Awazuhara M, Inoue E, Takahashi H, Goodenowe DB, Kitayama M, Noji M, Yamazaki M, Saito K.功能基因组学通过整合分析代谢组和转录组gydF4y2Ba拟南芥gydF4y2Ba植物过度表达MYB转录因子。工厂J. 2005; 42(2):218-35。gydF4y2Ba
- 21.gydF4y2Ba
ILK N,Ding J,Ihnatowicz A,Koornneef M,Reymond M.高光和低温胁迫下的花青素积累的自然变化可归因于Ag-42(Hua2)基因座的增强剂与花青素颜料1(PAP1)组合的增强剂和PAP2。新植物。2015; 206(1):422-35。gydF4y2Ba
- 22.gydF4y2Ba
李志强,李志强,李志强,等。植物种子黄酮类化合物的遗传与生物化学研究。植物学报。2006;57(1):405-30。gydF4y2Ba
- 23.gydF4y2Ba
Xu WJ, Grain D, Bobet S, Le Gourrierec J, Thévenin J, Kelemen Z, Lepiniec L, Dubos C. synthesis and stability of MYB-bHLH-WDR complexes and its靶点of MYB-bHLH-WDR complexesgydF4y2Ba拟南芥gydF4y2Ba种子。新植物。2014; 202(1):132-44。gydF4y2Ba
- 24.gydF4y2Ba
nesi n,jond c,debeaujon i,caboche m,lepiniec l。该gydF4y2Ba拟南芥TT2gydF4y2Ba基因编码R2R3 MyB结构域蛋白,其作为研制种子中原霉素积累的关键决定因素。植物细胞。2001; 13(9):2099-114。gydF4y2Ba
- 25.gydF4y2Ba
Stracke R,Werber M,Weisshaar B. R2R3-MyB基因家庭gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2001;4(5):447-56。gydF4y2Ba
- 26.gydF4y2Ba
赵丽伟,周旭,吴旭,李林。(2010)。紫色花椰菜是由MYB转录因子的激活产生的。植物杂志。2013;154(3):1470 - 80。gydF4y2Ba
- 27.gydF4y2Ba
张Y,陈刚,董T,潘Y,赵振华,天S,胡Z.花青素积累和转录regulationof花青素合成紫色白菜(gydF4y2BaBrassicarapa var.对gydF4y2Ba).JAgric Food Chem。2013; 62(51):12366-76。gydF4y2Ba
- 28.gydF4y2Ba
彭T,Moriguchi T.在苹果中调节着色的分子网络。SCI Hortic。2013; 163:1-9。gydF4y2Ba
- 29.gydF4y2Ba
Telias A, Lin-Wang K, Stevenson DE, Cooney JM, Hellens RP, Allan AC, Hoover EE, Bradeen JM。苹果皮肤模式与MYB10的差异表达相关。植物学报。2011;11(1):93。gydF4y2Ba
- 30.gydF4y2Ba
Chagné D, Carlisle CM, Blond C, Volz RK, Whitworth CJ, Oraguzie NC, Crowhurst RN, Allan AC, Espley RV, Hellens RP, Gardiner SE。定位苹果红肉和叶色候选基因MdMYB10。BMC基因组学。2007;8(1):212。gydF4y2Ba
- 31.gydF4y2Ba
王志强,王志强,王志强,等。桃果实花色苷生物合成的调控。足底。2014;240(5):913 - 29。gydF4y2Ba
- 32.gydF4y2Ba
白山,陶瑞,唐勇,尹龙,马勇,倪军,闫晓燕,杨强,吴志刚,曾勇,滕勇。B-box蛋白BBX16通过激活MYB10对光诱导花青素积累的调控作用。植物生物技术学报2019;17:1985-97。gydF4y2Ba
- 33.gydF4y2Ba
钱明,孙颖,滕勇,张东东。早苏梨的红色运动及其红条纹色素模式与PyMYB10启动子的去甲基化相关。植物化学。2014;107:16-23。gydF4y2Ba
- 34。gydF4y2Ba
麦地那-Puche L,Cumplido-拉索G,阿米尔-Ruiz的男,霍夫曼T,环L,罗德里格斯佛朗哥A,Caballero的JL,施瓦布W,谢穆尼奥斯-Blanco的Ĵ,兰科-波塔莱斯R. MYB10起着调节中起主要作用的类黄酮/苯丙的成熟过程中代谢gydF4y2BaFragaria x ananassagydF4y2Ba水果。[J] .机器人。2014;65(2):401-17 .]gydF4y2Ba
- 35。gydF4y2Ba
Schwinn K, Venail J, Shang Y, Mackay S, Alm V, Butelli E, Oyama R, Bailey P, Davies K, Martin C. myb调控基因的一个小家族控制花色素的强度和模式gydF4y2Ba金鱼草属植物gydF4y2Ba.植物细胞。2006;18(4):831 - 51。gydF4y2Ba
- 36。gydF4y2Ba
陈克良,刘海林,娄强,刘玉玲.葡萄风信子的异位表达(gydF4y2BaMuscari armeniacumgydF4y2Ba)R2R3-MYB转录因子基因,MAAN2,诱导烟草中的花青素积累。前植物SCI。2017; 8:965。gydF4y2Ba
- 37。gydF4y2Ba
梗N,Torregrosa L,Ageorges A,Vialet S,VerrièsC,Cheynier V,VvMybPA2的Romieu C.异位表达促进葡萄原花色素的生物合成和在该途径表明额外的目标。植物理性。2009; 149(2):1028至1041年。gydF4y2Ba
- 38。gydF4y2Ba
Cavallini E,Zenoni S,Finezzo L,Guzzo F,Zamboni A,Avesani L,Tornielli GB。葡萄鱼MYB5A和MYB5B在对丝氨酸的黄酮化生物合成中的功能多样化,在浮动花青素调节突变体中。植物细胞生理。2014; 55(3):517-34。gydF4y2Ba
- 39。gydF4y2Ba
刘雪峰,冯超,冯超,张敏,尹晓荣,徐CJ,陈克坤。杨梅MrWD40-1基因gydF4y2Ba(Myrica Rubra.gydF4y2Ba)与MYB和bHLH结构相互作用,提高花青素积累。植物分子生物学代表2013; 31(6):1474至1484年。gydF4y2Ba
- 40.gydF4y2Ba
黄万,太阳W,LV HY,罗米,Zeng Sh,Pattanaik S,Yuan L,Wang Y.一种R2R3-MYB转录因子来自gydF4y2BaeBimedium射手图gydF4y2Ba调节类黄酮化生物合成途径。Plos一个。2013; 8(8):E70778。gydF4y2Ba
- 41.gydF4y2Ba
黄文娟,吕海英,王颖。一种新的R2R3-MYB转录因子调控类黄酮生物合成途径的功能特性gydF4y2BaeBimedium射手图gydF4y2Ba.植物学报2017;8:1274。gydF4y2Ba
- 42.gydF4y2Ba
MYB134基因编码一个R2R3 MYB转录因子,调控杨树原花青素的合成。植物杂志。2009;150(2):924 - 41。gydF4y2Ba
- 43.gydF4y2Ba
刘毅,林王K,Espley RV,王磊,杨H,俞B,敢,Varkonyi-Gasic E,王建,张健,王d,艾伦交流。马铃薯R2R3 MYB花青素的功能多样化活化剂AN1,MYBA1和MYB113及其与碱性螺旋 - 环 - 螺旋辅助因子的相互作用。J Exp Bot。2016; 67(8):2159-76。gydF4y2Ba
- 44.gydF4y2Ba
Oh DH, Leidi E, Zhang Q, Hwang SM, Li YZ, Quintero FJ, Jiang XY, D’urzo MP, Lee SY, Zhao YX, Bahk JD, Bressan RA, Yun DJ, Pardo JM, Bohnert HJ。SOS1表达干扰导致盐生性丧失。植物杂志。2009;151(11):210 - 22所示。gydF4y2Ba
- 45.gydF4y2Ba
Inan G, Zhang Q, Li PH, Wang ZL, Cao ZY, Zhang H, Zhang CQ, Quist TM, Goodwin SM, Zhu JH, Shi HZ, Damsz B, Charbaji T, Gong QQ, Ma SS, Fredricksen M, Galbraith DW, Jenks Ma, Rhodes D, Hasegawa PM, Bohnert HJ, Joly RJ, Bressan RA, Zhu JK。食盐水芹。盐生植物和冰冻植物拟南芥相对模型系统及其在极端微生物生长发育分子遗传分析中的适用性。植物杂志。2004;135(3):1718 - 37。gydF4y2Ba
- 46.gydF4y2Ba
王俊生,张强,崔飞,侯磊,赵淑珍,夏辉,邱建军,李廷田,张勇,王新军,赵长忠。基因表达的全基因组分析为寒冷反应提供了新的见解gydF4y2BaThellungiella salsugineagydF4y2Ba.植物学报2017;8:713。gydF4y2Ba
- 47.gydF4y2Ba
Ali Z, Park HC, Ali A, Oh DH, Aman R, Kropornicka, Hong H, Choi W, Chung WS, Kim WY, Bressan RA, Bohnert HJ, Lee SY, Yun DJ。2,来自拟南芥极端微生物的HKT1同源物gydF4y2BaThellungiella salsugineagydF4y2Ba,显示K.gydF4y2Ba+gydF4y2Ba在NaCl存在下的特异性。植物理性。2012; 158(3):1463-74。gydF4y2Ba
- 48.gydF4y2Ba
孙伟,李勇,赵应祥,张辉。TsnsLTP4蛋白在蜡质沉积和胁迫耐受中的表达。植物学报2015;33(4):962-74。gydF4y2Ba
- 49.gydF4y2Ba
张Q,赵CZ,李男,孙W,刘Y,夏H,孙MN,李AQ,李CS,赵SZ,侯L,Picimbon JF,王XJ,赵YX。基因组识别gydF4y2BaThellungiella salsugineagydF4y2Ba微大稻草,具有盐应激反应的推定作用。BMC植物BIOL。2013; 13(1):180。gydF4y2Ba
- 50。gydF4y2Ba
关键词:分子生物学,分子生物学,分子生物学gydF4y2Ba芸苔栗鸟gydF4y2Ba应力相关转录因子,BNMYB44和BNVIP1,基于对比分析选择gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2BaEutrema salsugineumgydF4y2Ba转录om。MOL BIOL REP。2018; 45(5):1111-24。gydF4y2Ba
- 51。gydF4y2Ba
Zhu L,Guo J,朱J,Zhou C.增强Eswax1的增强表达改善了转基因蜡和抗坏血酸增加的干旱耐受性gydF4y2Ba拟南芥gydF4y2Ba.植物生理生化。2014;75:24-35。gydF4y2Ba
- 52。gydF4y2Ba
Griffith M, Timonin M, Wong AC, Gray GR, Akhter SR, Saldanha M, Rogers MA, Weretilnyk EA, Moffatt B。gydF4y2BaThellungiellagydF4y2Ba:一个gydF4y2Ba拟南芥gydF4y2Ba- 适用于寒冷的温度的相关模型工厂。植物细胞环境。2007; 30(5):529-38。gydF4y2Ba
- 53.gydF4y2Ba
杜伯士C,Stracke R,Grotewold E,Weisshaar B,马丁C,Lepiniec L. MYB转录因子在gydF4y2Ba拟南芥gydF4y2Ba.趋势植物SCI。2010; 15(10):573-81。gydF4y2Ba
- 54.gydF4y2Ba
Quattrocchio字楼JF,范德Woude K,分子JN,bHLH结构的Koes R.分析和MYB结构域蛋白:物种特异性的监管差异是由目标花青素基因的进化分歧造成的。工厂J. 1998; 13(4):475-88。gydF4y2Ba
- 55.gydF4y2Ba
Shirley BW,Kubasek Wl,Storz G,Bruggemann E,Koornneef M,Ausubel FM,Goodman HM。分析gydF4y2Ba拟南芥gydF4y2Ba缺乏类黄酮生物合成的突变体。工厂J. 1995; 8(5):659-71。gydF4y2Ba
- 56.gydF4y2Ba
茄子花色苷、颜色和抗氧化性能的研究(gydF4y2Ba茄属植物melongena L。gydF4y2Ba)及紫椒(gydF4y2BaCapsicum Annuum L.gydF4y2Ba)剥皮提取物。Z Naturforsch C. 2006; 61(7-8):527-35。gydF4y2Ba
- 57.gydF4y2Ba
Hernández I, Alegre L, Van Breusegem F, Munné-Bosch s类黄酮作为抗氧化剂在植物中的作用有多大?植物科学进展。2009;14(3):125-32。gydF4y2Ba
- 58.gydF4y2Ba
Nakabayashi R,Yonekura-Sakakibara K,Urano K,Suzuki M,Yamada Y,Nishizawa T,Matsuda F,Kojima M,Sakakibara H,Shinozaki K,Michael Aj,Tohge T,Yamazaki M,Saito K.增强氧化和耐旱性的增强in.gydF4y2Ba拟南芥gydF4y2Ba通过过度积累抗氧化剂类黄酮。植物j . 2014; 77(3): 367 - 79。gydF4y2Ba
- 59。gydF4y2Ba
Ahmed Nu,Park Ji,Jung Hj,Yang TJ,Z y,nou是。二氢烷醇4-还原酶(DFR)基因的表征及其与冷热胁迫的关联gydF4y2Ba芸苔属植物拉伯gydF4y2Ba.基因。2014;550(1):46-55。gydF4y2Ba
- 60。gydF4y2Ba
花青素和原花青素调控MYB因子启动子特异性进化关键氨基酸的鉴定。acta botanica sinica(云南植物学报). 2013;42(4):457 - 461。gydF4y2Ba
- 61。gydF4y2Ba
关键词:NPR1,核定位,激活gydF4y2Ba公关gydF4y2Ba基因的表达。植物细胞。2000;12(12):2339 - 50。gydF4y2Ba
- 62。gydF4y2Ba
罗斯r,fry je,hoffmann nl等。一种将基因转移到植物中的简单和一般方法。科学。1985; 227:1229-32。gydF4y2Ba
- 63。gydF4y2Ba
花的倾斜:一种简化的方法gydF4y2Ba农杆菌gydF4y2Ba介导的变换gydF4y2Ba拟南芥gydF4y2Ba.植物j . 1998; 16 (6): 735 - 43。gydF4y2Ba
- 64.gydF4y2Ba
内夫MM,光敏色素A,光敏色素B和隐花色素1during之间乔瑞J.遗传相互作用gydF4y2Ba拟南芥gydF4y2Ba发展。植物杂志1998;118(1):27-36。gydF4y2Ba
- 65.gydF4y2Ba
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT Meth。2015; 12(4):357-60。gydF4y2Ba
- 66.gydF4y2Ba
Langmead B,Salzberg SL。与Bowtie 2. NAT Meth。2012; 9(4):357-9。gydF4y2Ba
- 67.gydF4y2Ba
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12(1):323。gydF4y2Ba
- 68.gydF4y2Ba
Mistry J,Finn Rd,Eddy SR,Bateman A,Punta M.在同源性中的挑战:HMMER3和卷绕式线圈区域的收敛演变。核酸RES。2013; 41(12):E121。gydF4y2Ba
致谢gydF4y2Ba
我们感谢匿名审稿人提供的宝贵意见和建议。gydF4y2Ba
资金gydF4y2Ba
国家重大科技计划项目(no . 2018ZX08009-10B);山东省科技支撑计划项目(no . 2019GSF107089);山东省自然科学基金项目(no . ZR2014CM041)。资助机构不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
QZ构思和设计实验。QZ与CM,XW,SG和CG的贡献写的稿子。CG,YQ,SG,CL1,CZ和CL2进行了大部分的实验。CL1和CZ了植物的照顾。QZ,YQ,CG和CL2分析数据。所有作者阅读并认可的终稿。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件1。gydF4y2Ba
图1.分子鉴定gydF4y2BaEsMYB90gydF4y2Ba转基因烟草和gydF4y2Ba拟南芥gydF4y2Ba植物。图2. RNA-SEQ最丰富的KEGG DEGS的途径gydF4y2BaEsMYB90gydF4y2Ba转基因烟草。图3. ESMYB90和其他ESMYB蛋白的序列对准分析gydF4y2BaE.Salsugineum.gydF4y2Ba.gydF4y2Ba
额外的文件2。gydF4y2Ba
在RNA-Seq中符合log2 Fold Change≥1或≤−1且Padj≤0.05的差异表达基因(DEGs)gydF4y2BaEsMYB90gydF4y2Ba转基因烟草。gydF4y2Ba
额外的文件3。gydF4y2Ba
的RNA-Seq中GO术语注释的DEGsgydF4y2BaEsMYB90gydF4y2Ba转基因烟草。gydF4y2Ba
附加文件4。gydF4y2Ba
在RNA-SEQ的Kegg中注释了DEGSgydF4y2BaEsMYB90gydF4y2Ba转基因烟草。gydF4y2Ba
附加文件5。gydF4y2Ba
根据DEGs的RichFactor值排名前20位。gydF4y2Ba
附加文件6。gydF4y2Ba
DEGs富集于类黄酮和花青素的合成途径。gydF4y2Ba
附加文件7。gydF4y2Ba
实时荧光定量PCR验证RNA-Seq结果的详细数据。gydF4y2Ba
附加文件8。gydF4y2Ba
两种茎,幼叶和叶片中花青素生物合成基因表达分析的详细数据gydF4y2BaEsMYB90gydF4y2Ba转基因烟草株系和WT。gydF4y2Ba
附加文件9。gydF4y2Ba
研究中使用的引物的序列。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
齐,Y.,GU,C.,王,X.gydF4y2Ba等等。gydF4y2Ba识别的gydF4y2Ba山嵛菜salsugineum EsMYB90gydF4y2Ba基因对于花青素生物合成重要。gydF4y2BaBMC植物BIOL.gydF4y2Ba20.gydF4y2Ba186(2020)。https://doi.org/10.1186/s12870-020-02391-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02391-7gydF4y2Ba
关键词gydF4y2Ba
- 花青素gydF4y2Ba
- 黄酮类动物gydF4y2Ba
- Eutrema salsugineumgydF4y2Ba
- MYB转录因子gydF4y2Ba
- es.gydF4y2BaMYB90gydF4y2Ba
- 转录调控gydF4y2Ba
- 花青素生物合成基因gydF4y2Ba