- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
通过对水稻幼苗在不同氮素供应下的转录组和生理分析,可以深入了解腋芽生长的调控GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba197GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
n是植物开发所需的重要常见营养素,显着影响腋芽产量,这影响了水稻的分蘖和籽粒产量。然而,不同的N浓度如何影响分子和转录水平的腋芽生长仍然尚不清楚。GydF4y2Ba
结果GydF4y2Ba
本研究系统地观察了不同氮浓度下水稻幼苗腋芽生长的形态变化。为了研究N诱导腋芽生长的基因表达,我们利用RNA-seq技术,从6种不同N浓度下生长的植物的基部和腋芽两种组织类型的mRNA转录组数据。通过与NN水平下的表达量比较,发现LN和HN诱导的根底和腋芽中DEGs分别为10,221和12,180个。通过对基部和腋芽基因共表达模块的分析,揭示了氮处理下植物腋芽生长的相关生物学过程。其中,细胞分裂和扩张活性与不同施氮条件下植株腋芽生长速率呈正相关。此外,TFs和植物激素对不同氮浓度下植物腋芽的生长也有影响。我们验证了GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba通过改变分蘖数的转基因水稻植株,说明了我们转录组学数据的重要意义。GydF4y2Ba
结论GydF4y2Ba
这些结果表明,不同的N浓度影响腋芽生长速率,我们的研究表明应对不同N浓度的基因的综合表达谱,为未来的研究提供了一个重要的资源,试图确定腋芽增长如何由不同的N个提供控制.GydF4y2Ba
背景GydF4y2Ba
大米是三种主要作物物种之一,为全球人口的一半以上提供食物。分蘖数是一种重要的农艺特征,通过影响每株植物的穗数在水稻产量中发挥作用[GydF4y2Ba1GydF4y2Ba].稻米分蘖的形成可分为两个发育过程:腋芽形成和产量[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba].分蘖腋芽萌发于茎基部叶腋,随后进入休眠状态。随后,这些休眠的腋芽被内部和环境因素激活和触发,生长出来形成分蘖或分枝[GydF4y2Ba5.GydF4y2Ba].因此,腋芽形成和产物都是影响导致粮食产量的耕作数的决定性因素。GydF4y2Ba
在过去几年中,已经深入研究了管理分蘖的腋芽形成和生长的监管机制,并在鉴定关键基因和所涉及的重要激素中进行了实质性进展。GydF4y2BaMONOCULM1GydF4y2Ba(GydF4y2BaMOC1GydF4y2Ba),GydF4y2BaMONOCULM2GydF4y2Ba(GydF4y2BaMOC2GydF4y2Ba),GydF4y2BaMONOCULM3GydF4y2Ba(GydF4y2BaMOC3GydF4y2Ba),以促进腋芽的形成和生长[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].GydF4y2Ba分蘖和矮人1GydF4y2Ba(GydF4y2BaTAD1GydF4y2Ba),GydF4y2Ba墨西哥类蜀黍BRANCHED1GydF4y2Ba(GydF4y2BaOSTB1.GydF4y2Ba)/GydF4y2Ba细CULM1GydF4y2Ba(GydF4y2BaOsFC1GydF4y2Ba), PCF (TCP) TF成员负调控水稻分蘖[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].此外,据报道,LAX panicle1(LAX1)和LAX2是控制腋芽形成的调节剂[GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba].GydF4y2Ba
植物激素独角金内酯(SLs)在水稻分蘖中起负作用;SLs生物合成和信号传递缺陷突变体表现出加速分蘖生长[GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].蟾蜍蛋白抑制腋芽过度生长,突变体在生长素生物合成和运输显示器中缺陷加速了腋芽的生长[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba].而细胞分裂素(CK)促进腋芽生长,CK相关突变体随CK含量的增加或减少[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].此外,在GydF4y2Ba矮人和低GydF4y2Ba-GydF4y2Ba长出新芽GydF4y2Ba(GydF4y2BaDLTGydF4y2Ba),其产物在油菜素内酯(BRs)途径中起作用,分蘖相对较少[GydF4y2Ba20.GydF4y2Ba].最近,据报道,铜唑抵抗力1(BZR1)可以与FC1启动子和招募矮化53(D53)结合,以抑制其表达,表明BRS在分蘖调节中发挥显着作用[GydF4y2Ba21.GydF4y2Ba].GydF4y2Ba
氮(n)是植物所需的关键常规营养素之一,并且大大促进水稻植物腋芽的发育[GydF4y2Ba22.GydF4y2Ba].硝酸盐、铵和各种氨基酸可被土壤中的植物根系利用和吸收[GydF4y2Ba23.GydF4y2Ba那GydF4y2Ba24.GydF4y2Ba].植物对氮的利用存在不同的氮素转运系统,包括氮素的吸收与转运、还原与同化、转运与再动员。在水稻中,有80多个GydF4y2BaNPFsGydF4y2Ba(GydF4y2BaNRT1 / ptr: NRT1GydF4y2Ba那GydF4y2Ba低亲和力硝酸盐转运体GydF4y2Ba;GydF4y2BaPTR.GydF4y2Ba那GydF4y2Badi /三肽转运蛋白GydF4y2Ba),4GydF4y2Banrt2GydF4y2Ba和2GydF4y2BaNAR2sGydF4y2Ba基因[GydF4y2Ba25.GydF4y2Ba,其蛋白质功能已被广泛研究。最近,有报道称,一些参与硝酸盐或肽运输的基因调控水稻腋芽的生长和分蘖数[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba].通过谷氨酰胺合成酶(GS)和谷氨酸合酶(Gogat)同化氨基氨基和谷氨酸(Glu)和谷氨酸(Glu)GydF4y2Ba30.GydF4y2Ba].在水稻中,有12个AMT(铵转运蛋白)基因[GydF4y2Ba31.GydF4y2Ba],四个GS基因(GydF4y2BaOsGS1; 1GydF4y2Ba那GydF4y2BaOsGS1; 2GydF4y2Ba那GydF4y2BaOsGS1; 3GydF4y2Ba,GydF4y2BaOsGS2GydF4y2Ba)及两个GOGAT基因(GydF4y2BaOsNADH-GOGAT1GydF4y2Ba和GydF4y2BaOsNADH-GOGAT1GydF4y2Ba),参与铵的吸收和同化[GydF4y2Ba32.GydF4y2Ba].氨基酸透层(AAPs)负责氨基酸的运输,其中在水稻中有19个成员[GydF4y2Ba33.GydF4y2Ba].研究GydF4y2Baosaap3.GydF4y2Ba[GydF4y2Ba34.GydF4y2Ba] 和GydF4y2Baosaap5.GydF4y2Ba[GydF4y2Ba35.GydF4y2Ba]表明外部N状况对水稻中的腋芽生长和分蘖数具有深远的影响。先前的研究表明,当同时供应硝酸盐和铵时,植物的生长和产量增加[GydF4y2Ba36.GydF4y2Ba,但有关不同外源氮供应下腋芽形成和生长的基因调控网络和信号通路尚不清楚,特别是氮与腋芽生长相关激素之间的联系。GydF4y2Ba
我们之前报道过几个与氮肥利用有关的基因影响水稻的分蘖数和产量[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba],为不同施氮条件下植株腋芽生长的分子特征研究奠定了基础。为了鉴定与水稻腋芽生长相关的N响应基因,本研究对6种N浓度下水稻萌发后30天的腋芽和基部进行RNA测序(RNA-seq)。通过与正常N (NN)浓度下的样本比较,我们分别鉴定出10,221和12,180个差异表达基因(DEGs),并根据它们在每个N浓度下的表达模式,将它们分别聚为9和10个共表达模块。与细胞分裂和扩张、转录因子、激素转导途径以及其他营养物质运输和信号转导相关的基因与不同施氮条件下植物腋芽的生长有关。这些结果为研究施氮对水稻腋芽生长和分蘖数的调控机制提供了有价值的资源和线索。GydF4y2Ba
结果GydF4y2Ba
不同氮浓度下植株腋芽的生长速率GydF4y2Ba
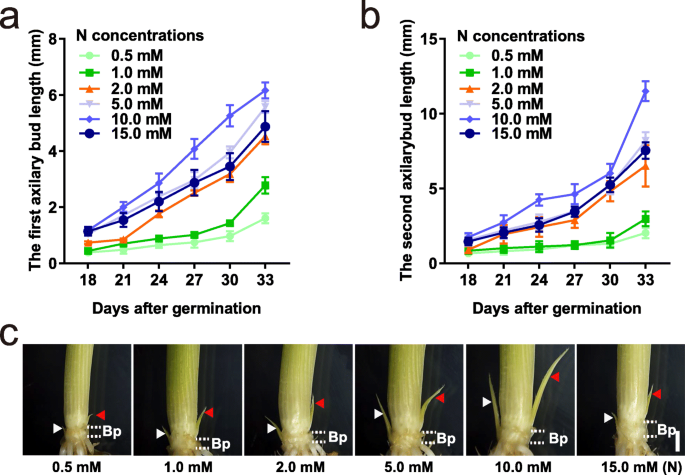
为了探讨不同N浓度对腋芽生长的影响,在水培溶液中生长水稻幼苗,其氮素氮素浓度为N源。我们定义了1.0mm N硝酸铵作为生长稻幼苗标准溶液中的对照浓度,以前的报告显示[GydF4y2Ba37.GydF4y2Ba].在LN浓度(0.5和1.0 mM)下,18 ~ 33日龄幼苗的第一和第二腋芽的长度比最佳N浓度下的幼苗短(图2)。GydF4y2Ba1GydF4y2Baa, b),而在5.0 mM和10.0 mM N浓度下生长时,第一和第二腋芽长度较长。值得注意的是,当N浓度达到15.0 mM时,水稻幼苗的腋芽比生长在5.0 mM和10.0 mM以下的幼苗短(图3)。GydF4y2Ba1GydF4y2Baa,b)。这些结果表明,不同的N浓度显着影响腋芽的产物。GydF4y2Ba
腋芽对不同N浓度的腋芽反应的生长。GydF4y2Baa - bGydF4y2Ba第一个的长度(GydF4y2BaB.GydF4y2Ba)及第二(GydF4y2BaCGydF4y2Ba萌发后18 ~ 33 d (DAG)的腋芽长度。数据是指±SD(GydF4y2BaNGydF4y2Ba= 30)。GydF4y2BaCGydF4y2Ba萌发后30天不同N浓度下腋芽生长的表型。秤栏,1毫米。30 DAG的腋芽和基底部件用于转录分析。提供0.5至15.0mm N浓度0.25-7.50mm NHGydF4y2Ba4.GydF4y2Ba没有GydF4y2Ba3.GydF4y2Ba分别为氮源。白色虚线之间的部分代表为RNA-seq切割的基础部分。白色箭头表示第一腋窝;红色箭头表示次级腋窝。Bp代表基部。Ab为腋芽GydF4y2Ba
不同氮浓度下植物基部和腋芽的转录组特征GydF4y2Ba
为了探讨在不同N浓度下生长的水稻植物的腋芽生长的监管机制,我们收集了在六种不同N浓度下生长的第一个和第二次腋芽的混合物和30天老幼苗的基础部分,用于RNA-SEQ分析(图。GydF4y2Ba1GydF4y2Bac).文库中共生成了396 - 6460万个干净reads,其中90%以上的reads被映射到参考基因组(附加文件)GydF4y2Ba1GydF4y2Ba:表S1)。以每百万reads每千碱基片段(FPKM)估算基因表达水平,将干净reads与至少一个样本中FPKM大于1的31,937个基因进行比对,包括25,378个蛋白编码基因、5028个非编码rna和1530个新转录本。主成分分析(PCA)结果显示两个重复之间具有良好的一致性(附加文件GydF4y2Ba1GydF4y2Ba:图S1A)。值得注意的是,基部部件和腋芽的表达型材通过主成分1(PC1)高度分离,并且在不同N浓度下生长的植物的腋芽的表达谱通过主成分2(PC2)分离。与Pearson相关系数(PCC)的结果一起(附加文件GydF4y2Ba1GydF4y2Ba:图S1B)总体而言,结果表明转录组谱多样化,足以识别负责对腋芽生长的N效应的基因。GydF4y2Ba
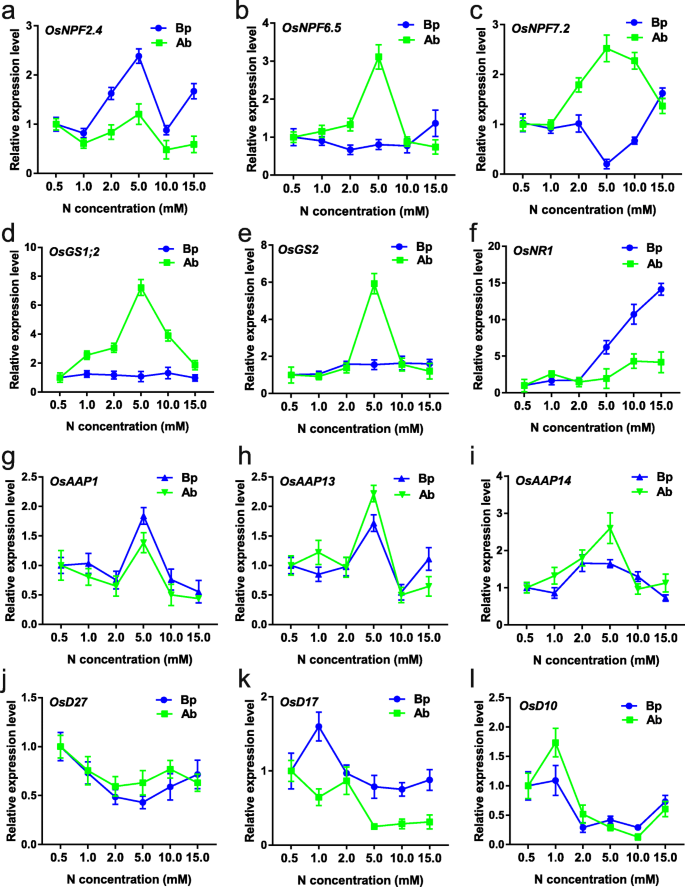
随机选取12个基因进行定量反转录PCR (RT-qPCR)分析。我们发现GydF4y2BaOsNPF6.5GydF4y2Ba那GydF4y2Baosnpf7.2.GydF4y2Ba那GydF4y2BaOsGS1; 2GydF4y2Ba,GydF4y2BaOsGS2GydF4y2Ba在5.0 mM N浓度下,腋芽中表达较高,GydF4y2BaOsNPF2.4GydF4y2Ba那GydF4y2Baosaap1.GydF4y2Ba那GydF4y2BaOSAAP13GydF4y2Ba,GydF4y2BaAAP14GydF4y2Ba在5.0mm N浓度下,在腋芽和基底部件中更高度表达,表明这些基因可能在5.0mm N浓度下在腋芽伸长中发挥重要作用。GydF4y2BaOsD27GydF4y2Ba那GydF4y2BaOSD17GydF4y2Ba,GydF4y2BaOSD10GydF4y2Ba在低N浓度下高表达,在高N浓度下低表达,这与SLs在腋芽生长中的负作用一致[GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].另外,在RT-QPCR结果和RNA-SEQ结果之间的类似表达趋势和RNA-SEQ结果示出了我们的转录组数据的良好质量(图。GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
N涉及N交通和腋芽外生长的基因的表达谱GydF4y2Ba
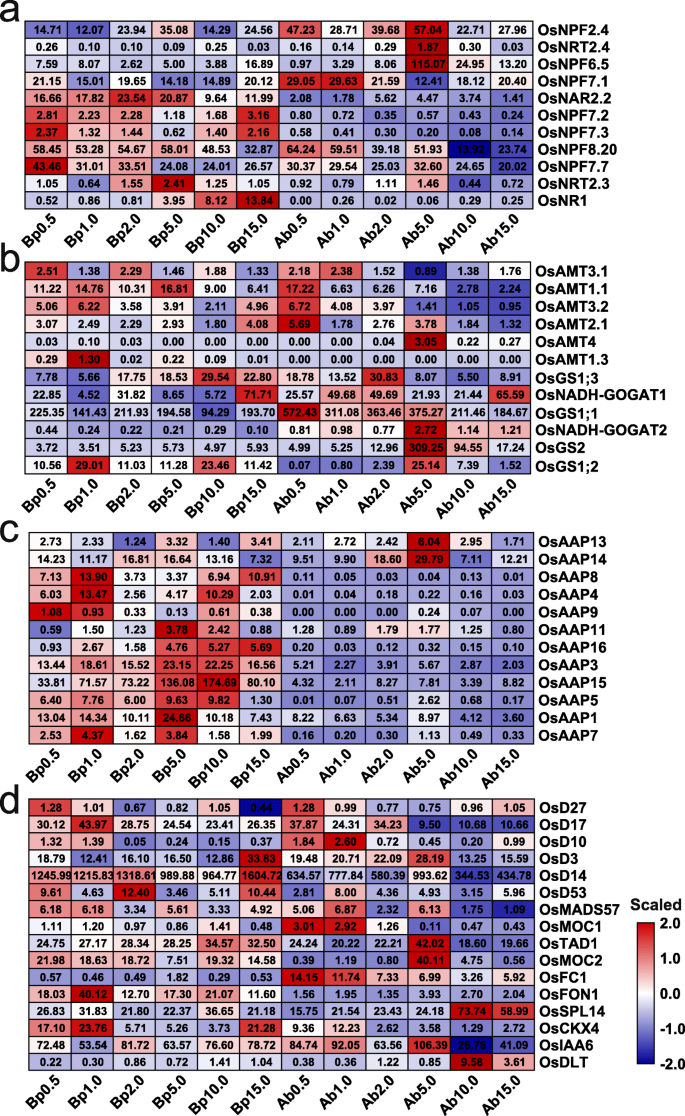
为了探讨与N利用率相关的基因的基因组响应以及在不同N浓度下生长的植物的腋芽生长,我们分析了与12个样品中的至少一个的FPKM值大于1的相关基因的表达模式。在基底部件和腋芽中,这些基因的表达水平响应于不同的N浓度而显着改变。参与硝酸盐摄取,运输和同化的基因,GydF4y2Baosnpf7.1.GydF4y2Ba那GydF4y2Baosnrt2.3.GydF4y2Ba那GydF4y2BaOsNPF2.4GydF4y2Ba那GydF4y2Baosnrf6.5.GydF4y2Ba,GydF4y2BaOsNPF7.7GydF4y2Ba在基部和腋芽中均有差异表达(图。GydF4y2Ba3.GydF4y2Baa).在基部,表示GydF4y2Baosnrf6.5.GydF4y2Ba和GydF4y2Baosnpf7.1.GydF4y2Ba在LN和HN条件下诱导;但是,表达了GydF4y2Baosnrt2.3.GydF4y2Ba和GydF4y2BaOsNPF2.4GydF4y2Ba仅在恒生条件下诱导GydF4y2BaOsNPF7.7GydF4y2Ba仅在LN条件下诱导(图。GydF4y2Ba3.GydF4y2Baa),说明这5个基因在不同氮浓度下生长的植物中都起到促进或抑制腋芽生长的作用。此外,表示GydF4y2Baosnr1.GydF4y2Ba说明在高浓度下同化硝酸盐以适应高硝态氮环境。值得注意的是GydF4y2Baosnrf6.5.GydF4y2Ba那GydF4y2Baosnpf7.GydF4y2Ba.GydF4y2Ba1GydF4y2Ba那GydF4y2Baosnpf7.2.GydF4y2Ba那GydF4y2Baosnpf7.3.GydF4y2Ba,GydF4y2BaOsNPF7.7GydF4y2Ba诱导浓度0.5mm n(图。GydF4y2Ba3.GydF4y2Baa),表明这些基因可能在激活休眠腋芽芽中以生长。GydF4y2Ba
铵态氮转运蛋白相关基因的表达GydF4y2BaOsamt1; 1GydF4y2Ba那GydF4y2BaOsamt2; 1GydF4y2Ba那GydF4y2BaOsAMT3; 1GydF4y2Ba,GydF4y2BaOsAMT3; 2GydF4y2Ba在基底部件和腋芽中诱导某些LN浓度(图。GydF4y2Ba3.GydF4y2BaB),表明这些基因在满足水稻生长基本需要的铵态氮吸收中发挥作用。的表达GydF4y2BaOsamt1; 1GydF4y2Ba那GydF4y2BaOsamt2; 1GydF4y2Ba和GydF4y2BaOsAMT3; 2GydF4y2Ba在HN条件下也诱导基部吸收额外的铵,以适应高铵环境。在一定浓度下,植物的基部和/或腋芽中诱导了铵态氮同化相关基因的表达。具体来说,表示GydF4y2BaOsGS1; 3GydF4y2Ba和GydF4y2BaOsNADH-GOGAT1GydF4y2Ba基部10.0 mM和15.0 mM诱导;的表达GydF4y2BaOsNADH-GOGAT2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba,腋芽5.0 mm和10.0毫米;和表达的GydF4y2BaOsGS1; 2GydF4y2Ba基部10.0 mM以下,腋芽5.0 mM以下。这些结果表明,铵态氮同化作用减弱可能是LN浓度抑制植物腋芽生长的原因之一。5.0 mM和10.0 mM下铵态氮同化增加可能是腋芽生长加速的原因,而15.0 mM下铵态氮毒害抑制了腋芽生长。此外,除…之外GydF4y2BaOSAAP13GydF4y2Ba和GydF4y2BaOSAAP14GydF4y2Ba,最多的表达GydF4y2Ba奥萨斯GydF4y2Ba在LN和HN条件下诱导基部部分(图。GydF4y2Ba3.GydF4y2Bac),特别是在5.0和10.0 mM N下,说明诱导GydF4y2Ba奥萨普GydF4y2Ba基因表达可能是对植物和外部环境中铵浓度的适应性,但这种诱导不是腋芽过度的主要原因。GydF4y2Ba
据报道,许多基因调节腋芽形成和产物,但这些基因是否以及如何响应不同的N浓度。在稻植物的基底部件和腋芽的某些浓度下诱导了腋芽形成和生长的所有这些基因的表达(图。GydF4y2Ba3.GydF4y2Bad)。参与SL生物合成的基因,包括GydF4y2BaDWARF27 / 17/10(OSD27GydF4y2Ba那GydF4y2BaOSD17GydF4y2Ba,GydF4y2BaOsD10)GydF4y2Ba,在基底部件和腋芽的LN浓度下高度表达,表明LN浓度可以促进SL生物合成,导致抑制腋芽生长。但是,参与SL信号传导的基因,例如GydF4y2BaDWARF3/14/53GydF4y2Ba(GydF4y2BaOsD3GydF4y2Ba那GydF4y2BaOSD14GydF4y2Ba和GydF4y2BaOsD53GydF4y2Ba),在基部部分的15.0mm N下方高度表达,表明增强的SL信号传导可能在铵毒性中发挥作用以抑制腋芽生长。GydF4y2Baosmoc1.GydF4y2Ba在0.5和1.0 mM N以下腋芽高表达,这与其激活腋生分生组织活性的功能一致[GydF4y2Ba3.GydF4y2Ba].此外,表示GydF4y2BaOsCKX4GydF4y2Ba在基底部件和腋芽中的LN条件下诱导基础部分15.0毫米N.表示上调GydF4y2BaOsCKX4GydF4y2Ba在腋芽生长中起着负面作用,这与前一项研究的结果一致[GydF4y2Ba18GydF4y2Ba].GydF4y2BaOSDLT.GydF4y2Ba,受BRs通路调控,与其在拟南芥分支中的作用一致[GydF4y2Ba38.GydF4y2Ba],在基底部件和腋芽中高于10.0毫米N的高度表达。总体而言,在不同的N浓度下这些基因的表达谱是对N反应和腋芽的生长速率负责,其与先前的研究一致,证实我们的转录组数据反映了腋芽产的动态和复杂的发育过程植物在不同的n浓度下生长。GydF4y2Ba
不同氮浓度下植物基部和腋芽中DEGs及其表达规律GydF4y2Ba
探索基因的动态表达模式,以应对不同的N浓度,我们确定度最优和每个LN的风琴浓度之间的基底部分和腋窝味蕾和识别度的表达这两个组织之间的不同具体每个N浓度。我们发现一些DEGs在LN和HN浓度之间以及两者之间具有特异性和共性(附加文件GydF4y2Ba1GydF4y2Ba:图S2)。总共10,221,12,180和21,284只响应N浓度的21,284只分别在基础部分,腋芽和那些两种组织之间鉴定在基底部件(附加文件)中鉴定GydF4y2Ba1GydF4y2Ba:表S3)。然后,我们根据这些DEGs在不同N浓度下的表达模式,将它们聚为9、10和13个共表达模块(图1)。GydF4y2Ba3.GydF4y2Bab,GydF4y2Ba4.GydF4y2Bab,额外的文件GydF4y2Ba1GydF4y2Ba:图S5B)。为了研究与N浓度和腋芽生长相关的方法,我们对每个模块进行了基因本体学(GO)富集分析(图。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba额外的文件GydF4y2Ba1GydF4y2Ba:图S3、S4、S5、S6)。GydF4y2Ba
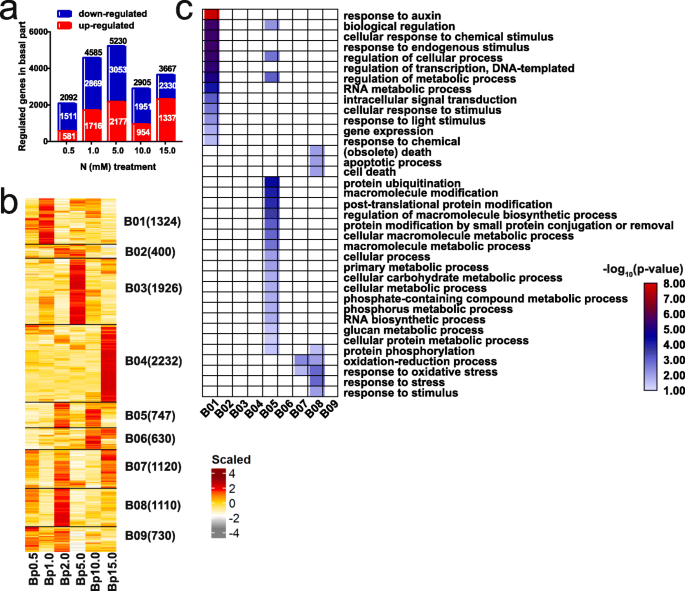
氮浓度下基部差异表达基因。GydF4y2Ba一种GydF4y2Ba各N胁迫浓度(0.5、1.0、5.0、10.0、15.0 mM)与最佳浓度(2.0 mM)之间,基部的DEGs均呈上调和下调趋势(DESeq2使> 2和padj的倍数变化< 0.05)。0.5、1.0 mM N为低氮(LN)浓度,5.0、10.0、15.0 mM为高氮(HN)浓度。显示了上调、下调和总deg的数量。GydF4y2BaB.GydF4y2Ba氮胁迫下基部总deg的聚类。在基础部分样本中对每个基因的FPKM值进行缩放,并显示为缩放表达。Bp代表基部。每一簇的基因数在簇名旁边显示。GydF4y2BaCGydF4y2Ba生物过程范畴内的丰富基因本体论(GO)术语,用于(GydF4y2BaB.GydF4y2Ba).仅显示显著的GO项(错误发现率(FDR) < 0.05)GydF4y2Ba
关于基础部分的10,221次,我们发现,与NN条件下的数量相比,在每个N浓度下比较下调更多的液位(图。GydF4y2Ba4.GydF4y2Ba一种)。基于基础部分的9个共抑制模块(B01-B09),该基因可以分为LN响应基因(B01),NN响应基因(B08)和HN响应基因(B03,B04和B06).B01,B08,B03和B04分别特异于1.0,2.0,5.0和15.0mm N条件,B06特异于10.0mm和15.0mm N条件。B01中的LN响应基因主要涉及到蟾蜍素,激素介导的信号传导途径(养蛋白),对化学刺激/刺激的细胞反应,对内源刺激/光刺激/化学,细胞过程调节/转录的响应/转录/代谢过程,RNA代谢过程和基因表达。这些结果表明,生长素在LN反应中起重要作用,以抑制腋芽产芽,这与LN条件下的缩短的腋芽一致。B08中的NN响应基因富含氧化还原过程,对氧化应激/应力/刺激,凋亡过程,死亡和细胞死亡的反应(图。GydF4y2Ba4.GydF4y2Bac). B03和B04分别在5.0 mM和15.0 mM N浓度下有较多的DEGs;然而,在错误发现率(FDR) < 0.05的临界值下,它们在显著的生物过程中没有富集(图5)。GydF4y2Ba4.GydF4y2BaC)。相反,在2.0和10.0mM条件下,B05中基因的表达上调,这些基因与蛋白质修饰,细胞大分子生物合成和代谢过程有关,磷(P)复合代谢过程,P代谢过程,RNA生物合成过程和葡聚糖代谢过程(图。GydF4y2Ba4.GydF4y2Bac).此外,B05中富集的分子功能类GO项包括氨基酸连接酶活性和泛素-蛋白转移酶活性(补充文件)GydF4y2Ba1GydF4y2Ba:图S3)。这些结果表明,在HN条件下生长的植物的腋芽生长可能是由于增强的代谢过程,涉及p和糖,这与其在腋芽生长中的功能恰恰相同[GydF4y2Ba39.GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].GydF4y2Ba
关于在N处理下生长的植物的腋芽中的12,180℃,比0.5和1.0mm N条件下的上调基因更下调的基因,但相对地发生在5.0,10.0和15.0mm N条件下(图.GydF4y2Ba5.GydF4y2Ba一种)。根据每个N浓度明确地分离N处理下的所有10个共置模块(A01-A10)(图。GydF4y2Ba5.GydF4y2Bab).在0.5和1.0 mM N条件下,lnn响应基因(以模块A01、A02和A05为代表)高表达,与一级和二级代谢相关,包括P、脂类、萜类、二萜植物抗毒素、生物胺、氨基酸、氮化合物、有机酸、胞酮、一元羧酸、说明在LN条件下生长的植物对铵态氮的吸收和同化是活跃的,主要利用铵态氮。此外,lnn应答基因还参与蛋白质修饰、蛋白质磷酸化、糖酵解过程、碳水化合物分解过程、防御反应、刺激反应、凋亡过程、死亡、RNA代谢过程、金属离子转运等。N响应基因(以模块A03表示)在2.0 mM N下高表达。过量的术语与各种物质的代谢过程有关,包括细胞壁大分子、多糖、几丁质、氨基聚糖、胺,以及氮代谢过程中大量氨基酸产生的反应,如氧化-还原等过程。hn响应基因(以模块A04和A06为代表)在5.0 mM N下高表达4000多个DEGs,参与光合作用相关过程、杂环生物合成过程、细胞氮化合物代谢过程、氧化还原过程和氧化应激响应。值得注意的是,在10.0 mM N下,A09模块中涉及微管过程、细胞周期、细胞分裂、细胞组分生物发生、DNA包装、DNA复制、核小体组织、M期、DNA和RNA代谢过程以及细胞器裂变和组织的基因表达上调。说明腋芽生长加速主要是由于细胞分裂增强。此外,在15.0 mM N下,A07模块中参与转录、发育过程和多细胞生物发育调控的基因表达上调。GydF4y2Ba
氮浓度下腋芽的差异表达基因。GydF4y2Ba一种GydF4y2Ba在每个n应激浓度(0.5,1.0,5.0,10.0,15.0mm)和腋芽中的最佳浓度(2.0mm)之间检测到的上调和下调的次数(折叠变化> 2和padj <0.05)检测到的上调的次数(折叠变化> 2和padj <0.05).0.5、1.0 mM N为低氮(LN)浓度,5.0、10.0、15.0 mM为高氮(HN)浓度。显示了上调、下调和总deg的数量。GydF4y2BaB.GydF4y2Ba氮胁迫下腋芽中总DEGs的聚类分析在基础部分样本中对每个基因的FPKM值进行缩放,并显示为缩放表达。Ab为腋芽。每一簇的基因数在簇名旁边显示。GydF4y2BaCGydF4y2Ba富集的基因本体论(GO)术语在生物过程类别中(GydF4y2BaB.GydF4y2Ba).仅显示显著的GO项(错误发现率(FDR) < 0.05)GydF4y2Ba
关于21,284个组织特异性DEG(附加文件GydF4y2Ba1GydF4y2Ba:图S5A),聚集了13个共压模块(附加文件GydF4y2Ba1GydF4y2Ba图S5b),并可明显分为两组:基底组织特异性组(BA01-BA06)和腋窝特异性组(BA07-BA13)。此外,腋窝特异性模块(BA07-BA13)在LN和HN条件下表现出相对清晰的基因表达模式(附加文件)GydF4y2Ba1GydF4y2Ba:图S5b),这与腋芽中DEGs的分布模式一致(图S5b)。GydF4y2Ba5.GydF4y2Bab)。另外,在各种生物过程中富集的基因也与基部部分中的含量一致(图。GydF4y2Ba4.GydF4y2Bac)和腋芽(图。GydF4y2Ba5.GydF4y2BaC);这些方法包括P代谢过程和对BA04中的植物蛋白的响应,BA07中的光合作用过程,BA13中的细胞周期相关过程(附加文件GydF4y2Ba1GydF4y2Ba:图S5C)。此外,我们还提供基因列表和它们涉及其涉及该重叠和每个N浓度的基底部分和腋芽之间的具体过程(附加文件GydF4y2Ba1GydF4y2Ba:图S7和表S3)。因此,这些结果不仅揭示了某些组织聚集在某些N浓度的基因簇,而且还揭示了调节腋芽生长对不同N浓度的潜在分子机制。GydF4y2Ba
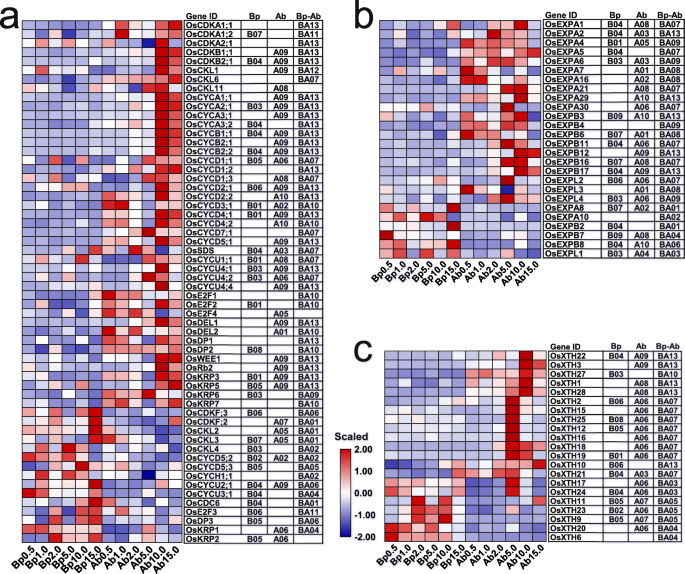
不同氮浓度下植物基部和腋芽细胞分裂和扩张相关基因表达谱GydF4y2Ba
第一和第二腋芽的生长速率随着0.5至10.0mm N的增加而增加,但在15.0mm以下下降。基于腋芽A09相关的富集的方法,我们推断细胞分裂和细胞扩张是确定腋芽的生长速率的主要过程。细胞周期和细胞分裂组织和N响应特异性所涉及的基因的表达谱(图。GydF4y2Ba6.GydF4y2Ba一种)。大多数细胞分裂相关基因在腋芽中特异性地表达(图。GydF4y2Ba6.GydF4y2Ba一种)。值得注意的是,腋芽特异性细胞分裂相关基因在HN浓度下高度表达,显示A07,A08,A09和A10图案,特别是在10.0mm下,表明细胞分裂在HN浓度下活跃,以促进腋芽生长。GydF4y2Ba
细胞壁的松弛和松弛决定了细胞扩张的程度。与细胞分裂相关基因类似,编码细胞壁松弛和松弛相关蛋白的基因,如木葡聚糖内转葡萄糖苷酶/水解酶(XTH)和膨胀蛋白(EXPs),表现出组织和n反应特异性(图)。GydF4y2Ba6.GydF4y2BaB, c) as well也;重要的是,大部分GydF4y2BaOsexps.GydF4y2Ba在除15.0 mM外的所有N浓度下,腋芽中均有高表达,表现为A01-A06和A08-A10型(图1)。GydF4y2Ba6.GydF4y2Ba此外,大多数的GydF4y2Baosxths.GydF4y2Ba在5.0和10.0mm N下的腋芽中高度表达,显示A06和A09图案(图。GydF4y2Ba6.GydF4y2BaC)。这些发现表明,细胞膨胀在0.5至10.0mm N下有效,以调节腋芽生长。总之,这些结果表明,通过细胞分裂和膨胀使腋芽的加速生长是可能的,并且细胞膨胀相关基因的低表达导致抑制在15.0mm N下生长的植物的腋芽生长。GydF4y2Ba
不同氮浓度下植物基部和腋芽中TFs的表达动态GydF4y2Ba
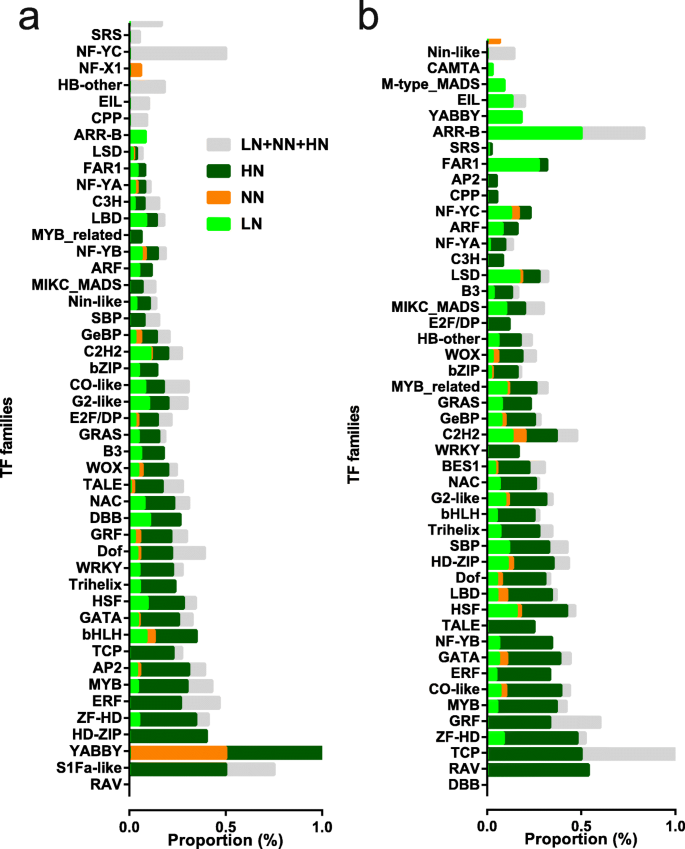
因为TFS是改变转录物表达的主要调节剂,以鉴定哪些TF家族在腋芽生长中发挥更重要的作用,响应于不同的N浓度,我们详细分析了TF基因的表达谱。在植物转录因子数据库(PlantTFDB)上的稻米中总量的1822个TF基因,52个家族内的908个TF基因差异表达;其中,599个TF基因被归类为属于B01至B09集群(附加文件GydF4y2Ba1GydF4y2Ba:图S8a), 716属于A01-A10(附加文件GydF4y2Ba1GydF4y2Ba:图S8B)。另外,在基底部件和腋芽中,这些TF基因中的一半以上(分别为52.1和55.9%),响应于HN刺激,表达水平分别为16.2和22.8%,响应LN刺激达到尖峰。为了探讨在N压力下生长的基底部件和植物腋芽中TF家族成员的表达水平,我们计算了家庭内所有TF成员的总FPKM值(附加文件GydF4y2Ba1GydF4y2Ba:图S9)。我们还通过与TF家族内的总TF成员的TF成员的比例探讨了TF家庭的表达趋势,由TF型植物提供的信息(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
对于基础部分,LSD系列中的TF基因在LN应力下诱导(图。GydF4y2Ba7.GydF4y2Baa),这可能表明在氧化应激下参与细胞死亡[GydF4y2Ba41.GydF4y2Ba].HN胁迫诱导TF家族成员的表达,包括RAV、YABBY、HOMEODOMAIN-LEUCINE ZIPPER (HD-ZIP)、ZF-HD、ERF、MYELOBLASTOSIS (MYB)、APETALA2 (AP2)、TCP、BASIC/ HELIX-LOOP-HELIX (bHLH)、GATA、HEAT stress TRANSCRIPTION FACTOR (HSF)、Trihelix、DNA BINDING WITH ONE FINGER (Dof)、生长调节因子(GRF)、双B-BOX (DBB)、NAM、ATAF1/2和CUC2 (NAC)、三氨基酸环延伸(TALE)、WUS HOMEOBOX-CONTAINING (WOX)、B3和GRAS家族成员(图)GydF4y2Ba7.GydF4y2Ba一种)。与TF家庭成员的表达水平一起(附加文件GydF4y2Ba1GydF4y2Ba:图S9), YABBY、HD-ZIP、ZF-HD、TCP和GRF转录因子在HN条件下低水平表达,而参与分生组织形成或维持的TALE和WOX转录因子[GydF4y2Ba42.GydF4y2Ba和胚胎模式[GydF4y2Ba43.GydF4y2Ba,分别在HN条件下中高表达。GATA, NAC和B3 TFs,它们参与生长素信号[GydF4y2Ba44.GydF4y2Ba]和腋芽发展[GydF4y2Ba45.GydF4y2Ba,在5.0 mM N以下高表达。三螺旋TFs在5.0和10.0 mM N下高表达。ERF, MYB, bHLH, HSF, GRAS tf,它们参与应激和乙烯反应[GydF4y2Ba45.GydF4y2Ba],磷酸盐饥饿反应[GydF4y2Ba46.GydF4y2Ba和非生物应激反应[GydF4y2Ba47.GydF4y2Ba[高于10.0和15.0mm N.RAV,AP2,DOF和DBB TF在15.0mm N下表达高度表达,表明其作用抑制在HN应激胁迫下生长的植物的腋芽生长。GydF4y2Ba
关于腋芽,在LN条件下诱导SRS,AP2,ARR-B,B3,YABBY和ARF TF系列的成员的表达(图。GydF4y2Ba7.GydF4y2Bab)。在这些TFS中,SRS和AP2 TFS高于0.5mm的高度表达,ARR-B和ARF TFS的表达分别在1.0mm N下高且低,表明它们在N应力下发挥腋芽中的各种作用.在5.0 mm n下,高度表达下,有效,GATA,NF-YB,HD-ZIP,Trihelix,NAC,BES1,GLABROUS1增强剂(GEBP)和CCCH锌指(C3H)TF系列的成员高度表达。在10.0 mm和GRF TF下的TCP TFS在10.0和15.0mm下的低水平表示。在这些TFS中,TCP和GRF TFS参与细胞增殖[GydF4y2Ba48.GydF4y2Ba那GydF4y2Ba49.GydF4y2Ba,在HN条件下生长的植物腋芽生长中支持细胞分裂的作用。GydF4y2Ba
不同氮浓度引发的植物激素信号的全球分析GydF4y2Ba
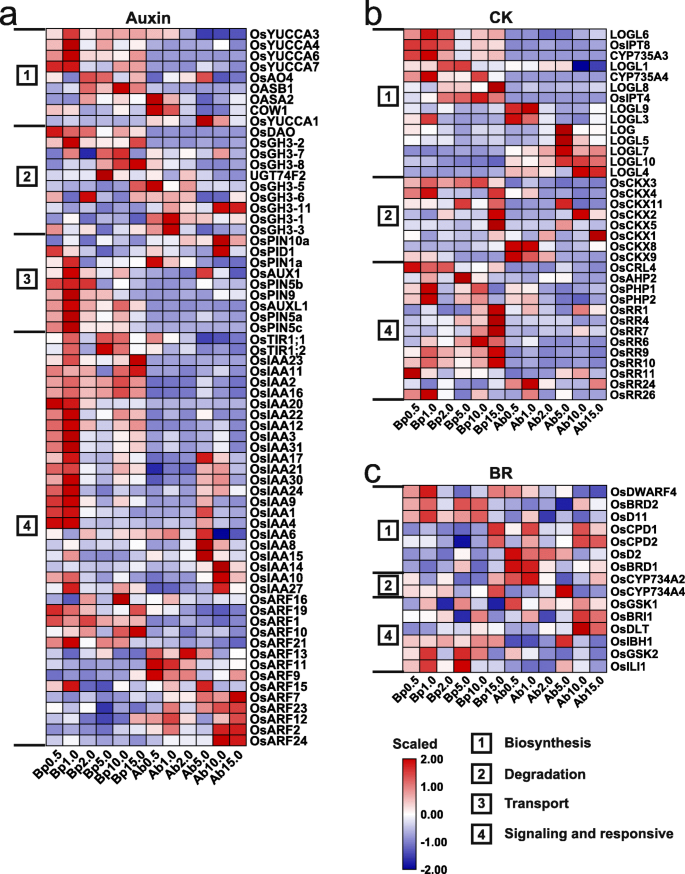
为了揭示不同氮浓度下参与植物腋芽生长的激素的功能,我们鉴定了与8种激素(生长素、CK、SLs、BRs、脱落酸、乙烯、赤霉素和茉莉酸)相关的242个DEGs;无花果。GydF4y2Ba2GydF4y2BaD,GydF4y2Ba7.GydF4y2Ba额外的文件GydF4y2Ba1GydF4y2Ba:图S10)。我们根据激素相关基因的功能将其分为4类:1-生物合成、2-降解、3-转运和4-信号传导和响应。这些激素相关基因的表达水平表现出组织特异性和N浓度特异性。此外,基部的高表达基因比腋芽高,说明不同的氮浓度可能主要通过改变基部激素信号来调控腋芽的生长。GydF4y2Ba
众所周知,SLS,蟾蜍素,CK和BRS调节腋芽形成和产卵:SLS和养蛋白作为抑制剂,而CK和BRS充当启动子[GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba].与SLs作为腋芽生长抑制因子一致,生物合成相关基因(GydF4y2BaOsD27GydF4y2Ba那GydF4y2BaOSD17GydF4y2Ba,GydF4y2BaOSD10GydF4y2Ba)在LN条件下高度表达,而信号传导相关基因,例如GydF4y2BaOsD3GydF4y2Ba和GydF4y2BaOSD14GydF4y2Ba,在15.0 mM N下高表达(图。GydF4y2Ba3.GydF4y2Bad)。对于生物合成和运输有关的基因,如GydF4y2BaOsYUCCAsGydF4y2Ba和GydF4y2Baothins.GydF4y2Ba,在1.0 mM N下,基部表达量较高(图2)。GydF4y2Ba8.GydF4y2Baa),暗示在拍摄分泌中增强的生长素生物合成和蟾蜍蛋白梯度的振荡可能涉及LN应力下的腋芽发育。这些结果与先前报道的结果重合,其中增强了增强的生物合成和蟾蜍的运输负面影响米分蘖[GydF4y2Ba50.GydF4y2Ba].此外,与与B01相关的富集的GO术语一致(图。GydF4y2Ba4.GydF4y2Bab,c),大部分GydF4y2BaAux /吲哚 - 醋酸GydF4y2Ba(GydF4y2Ba国际宇航科学院GydF4y2Ba)基因在1.0mm N下的相对较高的水平表达,但ARF的表达表现出各种变化,表明生长素可能在调节在不同N浓度下生长的植物的腋芽生长发挥复杂和关键作用。与CK生物合成相关的基因的表达在LN和HN条件下表现了基底部件和腋芽的组织特异性(图。GydF4y2Ba8.GydF4y2Bab)。其中,GydF4y2Baosipt4.GydF4y2Ba基部10.0 mM N表达量最高,2.0和5.0 mM表达量中等,GydF4y2BaOsCKX2GydF4y2Ba和GydF4y2BaOsCKX4GydF4y2Ba低于15.0毫米N,与CK作用作为腋芽生长的启动子一致[GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba].CK标志性和响应相关的基因,表达式A-Arr(GydF4y2BaOsRR1/4/7/6/9/10GydF4y2Ba)和b-arrs键入(GydF4y2BaOsRR24/26GydF4y2Ba(分别在15.0mm N下均上调和下调基础部分,表明CK信号传导在抑制HN胁迫下生长的植物腋芽生长的作用。对于BRS,生物合成和信号传导相关基因显示对不同N浓度的刚反应(图。GydF4y2Ba8.GydF4y2Bac)在这些基因中,GydF4y2BaOSDLT.GydF4y2Ba据报道对水稻分蘖数有正向调节作用[GydF4y2Ba52.GydF4y2Ba]并且响应于10.0和15.0mm N.最近,据报道了大米中最具生物活性Br的内源性Crasterone(CS)触发,以促进较高浓度下的腋芽增长[GydF4y2Ba21.GydF4y2Ba],暗示BRS可能在N响应中发挥阳性作用以调节腋芽生长。GydF4y2Ba
此外,ABA,GA,乙烯和JA还在植物开发和非生物应激反应中起重要作用。在HN条件下,在腋芽中高度表达ABA生物合成相关基因,特别是在5.0mm N下方,但它们在基部部分的低水平下表达(附加文件GydF4y2Ba1GydF4y2Ba:图S10A)。相反,在HN条件下,在腋芽的低水平下表达有关相关基因,但在基部部分的高水平表达(附加文件GydF4y2Ba1GydF4y2Ba图S10a),说明在HN胁迫下,腋芽中ABA的含量可能会增加,从而促进其生长。ABA信号转导相关基因在HN胁迫下也高表达,提示ABA可能在HN胁迫下优先发挥作用,参与腋芽生长。GydF4y2BaOsGA20ox1GydF4y2Ba编码Ga生物合成中的速率限制酶,在LN条件下生长的植物的腋芽中表达高水平(附加文件GydF4y2Ba1GydF4y2Ba:图S10b),而GA降解相关基因的表达量(GydF4y2BaOsGA2ox3GydF4y2Ba/ 4/5)在腋芽中低(附加文件GydF4y2Ba1GydF4y2Ba:图S10B)。这些结果表明,上调的生物合成基因和下调的降解基因可能导致腋芽在LN条件下增加的Ga水平。乙烯生物合成相关基因的表达GydF4y2BaACC Synthase2.GydF4y2Ba(GydF4y2Baosacs2.GydF4y2Ba) 和GydF4y2BaAcc Oxidase7.GydF4y2Ba(GydF4y2Baosaco7.GydF4y2Ba)在1.0mm n下的腋芽中上调,表达GydF4y2Baosacs2.GydF4y2Ba那GydF4y2Baosaco5.GydF4y2Ba,GydF4y2Baosaco6.GydF4y2Ba在15.0 mM N以下的腋芽中表达上调。相反,乙烯降解相关基因在15.0 mM N下低水平表达GydF4y2Ba1GydF4y2Ba图S10c),说明在1.0和15.0 mM N条件下,乙烯水平可能会增加腋芽的生长和功能,从而抑制腋芽的生长。JA生物合成基因,如GydF4y2Ba花药开裂缺陷1GydF4y2Ba(GydF4y2BaOsDAD1GydF4y2Ba; 2),GydF4y2Balipoxygenases2; 1GydF4y2Ba(GydF4y2Ba奥斯洛克斯2.GydF4y2Ba; 1),GydF4y2Balipoxygenases2; 3GydF4y2Ba(GydF4y2Ba奥斯洛克斯2.GydF4y2Ba; 3),氧化物合成酶1(GydF4y2BaOsAOS1GydF4y2Ba),GydF4y2BaOsAOS2GydF4y2Ba,氧化烯环化酶(GydF4y2BaOsAOCGydF4y2Ba),GydF4y2Bajasmonate抵抗1; 2GydF4y2Ba(GydF4y2Baosjar1.GydF4y2Ba2),在15.0mm N以下的基底部分高度表达,表明JA-异亮氨酸(JA-ILE)水平在15.0mm N下的基部部分增加,以抑制腋芽芽生长。GydF4y2Ba
在不同N浓度下生长的钾(k)和磷酸盐中所涉及的基因的动态表达GydF4y2Ba
植物发育需要矿物质营养物,特别是N,P和K.确定涉及腋芽生长的N,P和K之间的相互作用,我们检查了与p和k相关的基因的表达谱。总的来说,表达模式显示与P和K相关的基因显示不同N浓度下的不同表达模式(附加文件GydF4y2Ba1GydF4y2Ba图S11),表明不同的N浓度影响P和K的摄取和定位GydF4y2Ba高亲和性KGydF4y2Ba+GydF4y2Ba运输车GydF4y2Ba(GydF4y2BaOsHAKGydF4y2Ba)基因表现出组织特异性;例如,GydF4y2BaOsHAK12/10/4/23/7/9/27GydF4y2Ba特别是在基底部件中表达,GydF4y2BaOsHAK16/17/1/19/13/22/24/18/11GydF4y2Ba是在腋芽中明确表达的(附加文件GydF4y2Ba1GydF4y2Ba:图S11a)。几个表达GydF4y2BaOsHAKGydF4y2Ba沙GydF4y2BaOsHKTGydF4y2Bas在5.0 mm n下的腋芽中特别诱导(附加文件GydF4y2Ba1GydF4y2Ba:图S11a),表明N浓度的增加可以激活K的摄取和运输以协调促进腋芽生长。关于P运输车,GydF4y2Bapi transporter1.GydF4y2Ba(GydF4y2BaOSPT1.GydF4y2Ba)在LN胁迫下高表达,增加了磷的吸收和迁移。相反,液泡中P转运体的表达,如GydF4y2BaSYG1 / PHO81 / XPR1-MASIT FACELITY SUPERFAMILY2GydF4y2Ba(GydF4y2BaOsSPX-MSF2GydF4y2Ba) 和GydF4y2BaOsSPX-MSF3GydF4y2Ba显示组织特异性;这些基因在15.0 mM N以下的基部高度表达GydF4y2Ba空泡的处理enzyme1GydF4y2Ba(GydF4y2BaOsVPE1GydF4y2Ba) 和GydF4y2BaOsVPE2GydF4y2Ba在5.0 mm n下的腋芽中高度表达(附加文件GydF4y2Ba1GydF4y2Ba:图S11b)。诱导P信号和响应中涉及的大多数基因的表达,随着2.0至10.0 mm n的增加,浓度增加(附加文件GydF4y2Ba1GydF4y2Ba图S11c),说明增加的N浓度可能激活新的信号通路,促进腋芽生长。综上所述,氮浓度的增加促进了营养物质的吸收和定位,并触发其信号通路促进腋芽生长。GydF4y2Ba
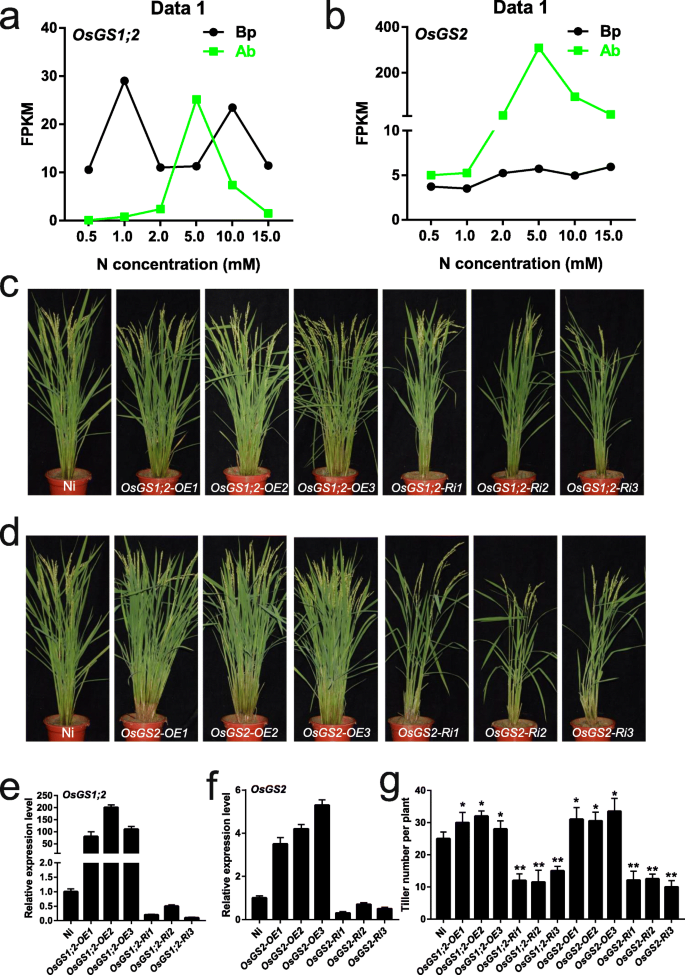
水稻分蘖数改变与铵态氮同化相关基因的鉴定GydF4y2Ba
基础零件和腋芽在不同的N浓度下的转录体组分析可以提供重要的线索,用于鉴定调节水稻中腋芽生长和分蘖数的新型基因。在本研究中,基因GydF4y2BaOsGS1; 2GydF4y2Ba(Os03g0223400)和GydF4y2BaOsGS2GydF4y2Ba(Os04g0659100)参与铵态氮同化,在5.0 mM N下腋芽中高表达。GydF4y2Ba9.GydF4y2BaA, b),表明它们可能促进腋芽生长,从而增加收获时的分蘖数。我们产生了过表达和下调表达的转基因水稻GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba,分别。三条过表达(OE)线(GydF4y2BaOE1GydF4y2Ba那GydF4y2BaOE2GydF4y2Ba那GydF4y2BaOE3GydF4y2Ba)和rna干扰(Ri)系(GydF4y2BaRi1GydF4y2Ba那GydF4y2BaRi2GydF4y2Ba那GydF4y2BaRi3GydF4y2Ba)的表达水平增加或减少GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba,分别选择进行研究(图。GydF4y2Ba9.GydF4y2Ba氟)。我们观察到OE株系抽穗期的分蘖数显著大于野生型(图2)。GydF4y2Ba9.GydF4y2Bag),而Ri系分蘖显著减少(图。GydF4y2Ba9.GydF4y2Bag),与报告的表型相一致GydF4y2BaOsGS1; 2GydF4y2Ba敲除突变体[GydF4y2Ba53.GydF4y2Ba].因此,这些结果表明GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba通过水稻中的铵同化调节腋芽生长和分蘖数,揭示了我们转录组数据的潜在价值。GydF4y2Ba
过表达系和RNAi系的鉴定和表型观察GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba.GydF4y2Baa - bGydF4y2Ba表达水平的GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba在基础部分和腋芽不同的氮浓度下。GydF4y2Bac - dGydF4y2Ba过表达的表型和RNAi系GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba在标题阶段。ni是野生类型(wt)。OE1 / 2/3代表过表达线。RI1 / 2/3代表RNAi线路。GydF4y2Bae-fGydF4y2Ba转录物水平GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba在Ni、过表达系和RNAi系中。Ni的转录水平被定义为“1”。数据是指±SD(GydF4y2BaNGydF4y2Ba= 3).GydF4y2BaGGydF4y2Ba抽穗期分蘖数的统计数据来自(GydF4y2BaE.GydF4y2Ba) 和 (GydF4y2BaGGydF4y2Ba).数据是指±SD(GydF4y2BaNGydF4y2Ba= 20)GydF4y2Ba
讨论GydF4y2Ba
腋芽的形成和分枝决定了水稻的分蘖数和穗数,从而决定了水稻的产量[GydF4y2Ba5.GydF4y2Ba].N是植物开发的重要常见营养源。虽然之前的研究阐明了n胁迫下腋芽生长的调节机制[GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba54.GydF4y2Ba,许多监管机构及其监管机制仍不清楚。本研究揭示了不同氮浓度对腋芽生长速率的影响,并通过RNA-seq整合了不同氮浓度下水稻植株基部和腋芽的转录组数据。我们证实了N相关基因参与了腋芽的生长,并且控制腋芽生长的基因对不同的N浓度有响应。分析确定了LN和hn的响应基因和调控过程在基部和腋芽,包括细胞分裂和扩张过程,转录因子,激素和其他营养物质。我们的数据为腋芽发育和氮感知的功能研究提供了新的重要线索。GydF4y2Ba
n治疗对水稻腋芽生长的调节作用GydF4y2Ba
我们的研究表明,不同浓度的N显著影响腋芽的生长。在LN浓度下,腋芽生长受到抑制。在HN浓度(5.0和10.0 mM)下,植株生长速度加快,腋芽伸长。有趣的是,当N浓度增加到15.0 mM时,腋芽的生长受到抑制,这可能是由于铵态氮的毒害。以往的研究在识别对N [GydF4y2Ba55.GydF4y2Ba那GydF4y2Ba56.GydF4y2Ba通过RNA-seq]。例如,为了了解水稻对铵态氮的早期响应,我们在处理4 h的根和茎中鉴定了对0、1.0和10.0 mM铵态氮响应的基因[GydF4y2Ba55.GydF4y2Ba].为了研究N-饥饿诱导的基因的表达,使用0.072和1.44mM硝酸铵生长的水稻植物的叶子护套和根部用于构建CDNA文库进行测序[GydF4y2Ba56.GydF4y2Ba].通过对N转运相关功能基因的鉴定,证实了N在腋芽生长调控中发挥重要作用。因此,这些结果表明,N对腋芽的生长速度有影响,但对其起始没有影响,这与之前的研究结果一致[GydF4y2Ba57.GydF4y2Ba].GydF4y2Ba
不同氮浓度下植物腋芽生长相关基因的表达模式揭示了其时空特异性和调控过程GydF4y2Ba
使用转录组分析,我们揭示了在不同N浓度下生长的植物腋芽生长的基因和生物过程的新型调节因子和生物过程。作为之前的研究表明,许多参与N途径在调节水稻腋芽生长或分蘖数中的基因[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba[我们首先鉴定了涉及N和稻米分蘖串扰的潜在的N-运输稳压因素。在N转运蛋白基因的表达中,GydF4y2BaOsNPF2.4GydF4y2Ba在5.0 mM N下诱导,这与其低亲和力获取和长距离运输功能一致[GydF4y2Ba58.GydF4y2Ba],支持这一点GydF4y2BaOsNPF2.4GydF4y2Ba在促进在HN胁迫下生长的植物的腋芽生长起作用。此外,在我们的研究中确认了许多其他报告基因的功能,例如GydF4y2Baosnpf7.1.GydF4y2Ba[GydF4y2Ba26.GydF4y2Ba],GydF4y2Baosnpf7.2.GydF4y2Ba[GydF4y2Ba27.GydF4y2Ba], 和GydF4y2Baosnpf7.3.GydF4y2Ba[GydF4y2Ba29.GydF4y2Ba],它们在基部或/和腋芽中对不同氮浓度的响应存在差异。值得注意的是,许多新的监管机构被揭露出来,例如GydF4y2Baosnpf8.20GydF4y2Ba那GydF4y2BaOsamt1; 1GydF4y2Ba/GydF4y2Ba3; 2GydF4y2Ba/GydF4y2Ba2; 1GydF4y2Ba,GydF4y2BaOsGS1; 1GydF4y2Ba,可能抑制LN条件下生长的植物腋芽的生长;此外,GydF4y2Baosnrf6.5.GydF4y2Ba那GydF4y2Baosnrt2.3.GydF4y2Ba那GydF4y2BaOsGS1; 2GydF4y2Ba那GydF4y2BaOsGS2GydF4y2Ba,GydF4y2BaOSAAP13GydF4y2Ba/GydF4y2Ba14GydF4y2Ba可以促进5.0mm N下生长的植物的腋芽生长。这些结果提供了有价值的资源,进一步调查植物在n应激下生长的植物腋芽生长的详细机制。GydF4y2Ba
动态转录组数据清晰地揭示了不同施氮条件下植物腋芽生长的响应基因簇和相关生物学过程。我们在不同氮浓度下鉴定了组织特异性基因簇,发现腋芽中有更多的DEGs对不同氮浓度的特异性响应,这可能是因为腋芽是分生组织的位置。与样本之间的表达式相关性结果一致(附加文件GydF4y2Ba1GydF4y2Ba:图S1)。基础部分特异性簇显示,参与植物素和对外部刺激的反应的基因主要在LN条件下富集,并且在HN条件下富集了与糖相关的过程,表明基底部件中的不同N浓度主要引发各种浓度应激反应,其他营养过程和激素信号传导影响腋芽生长。然而,LN条件下的腋芽特异性簇显示富集初级和次生代谢的基因。在HN条件下,参与光合作用的基因富含5.0mm,其与LN耐受品种表现出的相对高的净光合速率和电子传输速率一致[GydF4y2Ba59.GydF4y2Ba] HN施肥下的叶肉细胞的分裂增加[GydF4y2Ba60.GydF4y2Ba].值得注意的是,在我们的数据中,许多细胞分裂和扩增相关基因或/和方法富含5.0和10.0mM N浓度,以促进腋芽生长,但不是15.0mm N,表明铵毒性对细胞分裂的抑制功能以前研究支持的伸长率[GydF4y2Ba61.GydF4y2Ba].GydF4y2Ba
参与在不同N浓度下生长的植物腋芽生长的植物激素GydF4y2Ba
植物激素在植物开发和对非生物胁迫的反应中起重要作用[GydF4y2Ba62.GydF4y2Ba].据报道,SLS,Auxin,CK和BRS涉及腋芽生长[GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba].然而,尚不清楚这些激素的功能如何参与对不同N浓度的响应。在我们的数据中,在LN条件下,高表达了与SLS和毒素的生物合成相关的基因,这与腋芽增长的抑制剂的作用一致[GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba50.GydF4y2Ba].此外,在HN条件下,生物合成相关基因的上调和CK降解相关基因的下调与CK作为腋芽生长启动子的作用一致[GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba].此外,与这四种激素的信号相关的基因,例如GydF4y2BaOsD3GydF4y2Ba那GydF4y2BaOSD14GydF4y2Ba那GydF4y2BaOsPIN1aGydF4y2Ba那GydF4y2BaOsIAAGydF4y2Ba年代,GydF4y2Baosipt4.GydF4y2Ba那GydF4y2BaOsCKXGydF4y2Ba年代,GydF4y2BaOSDLT.GydF4y2Ba,由不同的N浓度特异性诱导,表明激素影响腋芽生长的复杂作用。在水稻中,参与SLS的基因会影响不同拍摄组织的n易位[GydF4y2Ba63.GydF4y2Ba[高铵水平下,自由IAA含量降低[GydF4y2Ba64.GydF4y2Ba],响应于HN治疗的腋芽和节点,所有形式的CKS的量增加[GydF4y2Ba65.GydF4y2Ba].此外,CS浓度的增加促进芽的生长,这与SLs相似[GydF4y2Ba21.GydF4y2Ba].这些结果证实了SLS,Auxin,CKS和BRS在腋芽生长和N应激反应之间的串扰中起重要作用。GydF4y2Ba
此外,在HN条件下,ABA生物合成和信号转导相关基因在腋芽中大量表达。先前的一项研究表明,ABA的信号调节因子在对铵态氮毒性的反应中发挥作用[GydF4y2Ba66.GydF4y2Ba],说明ABA参与了不同氮浓度下植物腋芽的生长。Luo等(2019)最近提出ABA抑制SL突变体的腋芽生长并调节SL介导的腋芽休眠[GydF4y2Ba67.GydF4y2Ba],提示ABA可能参与了腋芽休眠,抑制了LN条件下的芽生长。LN条件下,与GA生物合成和降解相关的基因在腋芽中分别以高水平和低水平表达。外源GA3处理通过改变内源CK、ABA、IAA含量和调控表达来抑制腋芽生长GydF4y2BaTB1GydF4y2Ba在腋芽中特别表达[GydF4y2Ba68.GydF4y2Ba那GydF4y2Ba69.GydF4y2Ba].这些结果表明,LN胁迫可提高GA含量,抑制腋芽生长。此外,乙烯生物合成相关基因在1.0和15.0 mM N下高表达,乙烯抑制根、芽和腋芽分生组织的细胞分裂和DNA合成[GydF4y2Ba70GydF4y2Ba],这表明乙烯可能抑制腋芽生长。与JA的生物合成相关的基因在15.0毫米N以下的基底部分高度表达,这可能是由于JA在Bud Dormancy中的突出作用[GydF4y2Ba71.GydF4y2Ba那GydF4y2Ba72.GydF4y2Ba],说明在15.0 mM N以下腋芽处于休眠状态。GydF4y2Ba
结论GydF4y2Ba
我们的研究提供了六种浓度对腋芽生长的影响,揭示了N受影响的腋芽过度,而不是其引发,并进行了详细的转录组分析,以提供新的功能调查的新型监管机构。基于转录组分析,我们得出结论,不同N浓度下的腋芽的出生的改变主要是由于细胞分裂和伸长率,该细胞分裂和伸长率由参与应力反应的基因调节,N / P /糖过程,激素信号传导,初级和次生新陈代谢。和光合作用。GydF4y2Ba
细胞分裂和expansion-related基因的表达水平,TFs,与荷尔蒙相关的基因,和其他nutrient-related基因在每个N浓度基底部分和腋窝味蕾的监管机制提供有益的线索和基因网络参与腋芽生长的植物生长在N压力。综上所述,我们的研究为不同氮浓度下植物腋芽的生长提供了重要信息,并为未来的功能研究提供了潜在的关键调控因子。GydF4y2Ba
方法GydF4y2Ba
植物生长条件及样本采集GydF4y2Ba
野生型水稻ZH11 (GydF4y2Bao.苜蓿GydF4y2Bal .简历。GydF4y2Ba粳稻GydF4y2Ba)被用于研究,该研究直接从中国科学院南瓷园明勇张教授收购,最初由中国农业科学院作物科学研究所培育。发芽的种子以碱性水稻营养溶液生长10天。碱性溶液的组成含有1.0毫米NHGydF4y2Ba4.GydF4y2Ba没有GydF4y2Ba3.GydF4y2Ba, 0.32 mMGydF4y2Ba2GydF4y2Ba阿宝GydF4y2Ba4.GydF4y2Ba,0.51 mm kGydF4y2Ba2GydF4y2Ba所以GydF4y2Ba4.GydF4y2Ba,1.0 mm caclGydF4y2Ba2GydF4y2Ba,1.65 mm mgsoGydF4y2Ba4.GydF4y2Ba, 8.9 μM MnSOGydF4y2Ba4.GydF4y2Ba, 0.5 μM NaGydF4y2Ba2GydF4y2BaMoo.GydF4y2Ba4.GydF4y2Ba18.4μM HGydF4y2Ba3.GydF4y2Ba博GydF4y2Ba3.GydF4y2Ba,0.14μmznsoGydF4y2Ba4.GydF4y2Ba, 0.16 μM CuSOGydF4y2Ba4.GydF4y2Ba和40.0μmfesoGydF4y2Ba4.GydF4y2Ba.然后将幼苗转移到添加以下浓度NH的基本营养液中处理GydF4y2Ba4.GydF4y2Ba没有GydF4y2Ba3.GydF4y2Ba作为唯一的N个来源:0.5 mm,1.0 mm,2.0 mm,5.0 mm,10.0 mm,15.0 mm。每3天再次营养溶液。温室中的条件为16小时(光,32°C)/ 8小时(黑暗,25°C)。在发芽后33天,21,24,33天,测量Z11的第一和第二腋芽芽。此外,分别为六个浓度中的每一个切割腋芽和基部部件,并在液体N中立即冷冻以进行总RNA提取。基底部件是腋芽出生的位置。用TRIzol试剂(Invitrogen公司,中国北京)提取总RNA。收集每个样品的两种重复,用于RNA测序。GydF4y2Ba
用于RNA测序和数据处理的文库制备GydF4y2Ba
以每个样品总RNA量3 μg作为RNA样品制备的输入材料。根据制造商的建议,使用Illumina®(NEB,美国)的NEBNext®UltraTM RNA Library Prep Kit生成测序库,并将索引代码添加到每个样本的属性序列中。根据制造商的说明,使用TruSeq PE Cluster Kit v3-cBot-HS (Illumia)在cBot聚类生成系统上对指标编码样本进行聚类。利用Illumina Hiseq平台,对文库制备进行测序,生成150 bp的配对端reads。fastq格式的原始数据(原始读取)首先通过内部perl脚本进行处理,然后通过删除原始数据中包含适配器的读取、包含ploy-N的读取和低质量的读取来获得干净数据(干净读取)。使用Hisat2 v2.0.5与Nipponbare参考基因组(Ensemble_37)进行比对。为了估计样本中基因的表达水平,使用featurecots v1.5.0-p3计算FPKM(转录本每千碱基每百万reads的片段)。PCA在网站(GydF4y2Bawww.omicshare.comGydF4y2Ba).在R软件中计算了两个样本之间的表达相关性。GydF4y2Ba
鉴别差异表达基因和聚类分析GydF4y2Ba
使用DESEQ2 R包装(1.16.1)进行两种样品之间的差异表达分析,并用调整后定义显着差异表达GydF4y2BaP.GydF4y2Ba-value < 0.05, fold change>只有在至少一个样本中FPKM值≥1的基因被用于进一步分析。将不同氮浓度下基部和腋芽差异表达基因(DEGs)定义为不同氮浓度与光强浓度之间显著差异表达基因。基部和腋芽之间的差异表达基因定义为两组织在各氮浓度下显著差异表达的基因。聚类分析和热图采用R包、circle和Complexheatmap。其他涉及某些生物过程的基因热图是使用TBtools完成的[GydF4y2Ba73.GydF4y2Ba].GydF4y2Ba
功能富集分析GydF4y2Ba
采用AGRIGOv2进行基因本体(Go)富集分析,FDR临界值≤0.05 (GydF4y2Bahttp://systemsbiology.cau.edu.cn/agrigov2/index.php.GydF4y2Ba),并使用REVIGO进行总结[GydF4y2Ba74.GydF4y2Ba].GydF4y2Ba
植物转化和转基因植物生成GydF4y2Ba
生成过度表达向量GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba的cdsGydF4y2BaOsGS1; 2GydF4y2Ba(Os03g0223400)和GydF4y2BaOsGS2GydF4y2Ba(Os04g0659100)克隆到载体中GydF4y2BaPCAMBIA1306GydF4y2Ba分别与3 × flag标签融合。产生的RNA干扰载体GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba的编码区272 bp和217 bp片段GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba被扩增并插入到GydF4y2BapTCK303GydF4y2Ba向量(GydF4y2Ba75.GydF4y2Ba分别)。粳稻种子(Nipponbare, Ni)购自华中农业大学生命科学与技术学院林勇军教授。这些向量被转换成GydF4y2Ba农杆菌属GydF4y2Ba应变GydF4y2BaEHA105GydF4y2Ba使用农杆菌介导的转化方法引入Ni的水稻愈伤组织[GydF4y2Ba76.GydF4y2Ba].使用的引物在附加文件中提供GydF4y2Ba1GydF4y2Ba:表S2。GydF4y2Ba
获得的T0转基因植株首先用0.1%的潮霉素B (Roche Diagnostic, Rotkreuz, Switzerland)筛选。用0.1%潮霉素B再次筛选T1转基因植株。采集叶片样品,使用HYG-F和HYG-R引物(GenBank: E00777.1,附加文件)进行PCR扩增,确定潮霉素B磷酸转移酶DNA序列GydF4y2Ba1GydF4y2Ba:表S2)。基于100%潮霉素B抗性和潮霉素B的DNA片段的存在来选择纯合转基因素。T2纯合转基因系用于实验。表达水平GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba通过QRT-PCR鉴定纯合转基因系中。GydF4y2Ba
实时定量rt - pcrGydF4y2Ba
进行QRT-PCR分析以检测使用与ZH11中具有RNA-SEQ的相同样品的N和SLS途径所涉及的基因的表达水平进行ZH11.QRT-PCR分析以检测表达水平GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba在它们的过表达和RNAi系中,和Ni。用TRIzol试剂(Invitrogen公司,中国北京)提取总RNA。采用SYBR master mix (Invitrogen)进行qRT-PCR。GydF4y2Ba奥特林GydF4y2Ba作为内部参考对照。引物在附加文件中提供GydF4y2Ba1GydF4y2Ba:表S2。GydF4y2Ba
分蘖数的测量GydF4y2Ba
用于过度表达和RNAi线路GydF4y2BaOsGS1; 2GydF4y2Ba和GydF4y2BaOsGS2GydF4y2Ba, 6 - 10月在贵州大学水稻实验站在稻田中种植水稻植株。抽穗期测定分蘖数。GydF4y2Ba
可用性数据和材料GydF4y2Ba
从RNA-SEQ收集的原始数据是国家生物技术信息中心(NCBI)的可用性:GydF4y2Bahttps://dataview.ncbi.nlm.nih.gov/object/prjna627316?reviewer=doaihvgnugk1nbg6359hsnjrh7.GydF4y2Ba.SRA加入:PRJNA627316。在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。GydF4y2Ba
缩写GydF4y2Ba
- aap:GydF4y2Ba
-
氨基酸permeasescccGydF4y2Ba
- AP2:GydF4y2Ba
-
APETALA2GydF4y2Ba
- bHLH:GydF4y2Ba
-
基本/ HELIX-LOOP-HELIXGydF4y2Ba
- br:GydF4y2Ba
-
BrassinosteriodsGydF4y2Ba
- BZR1:GydF4y2Ba
-
Brassinazole抗性1GydF4y2Ba
- 摘要::GydF4y2Ba
-
CCCH锌手指GydF4y2Ba
- CK:GydF4y2Ba
-
细胞分裂素GydF4y2Ba
- D53/27/10/17/3/14:GydF4y2Ba
-
DWARF53/27/10/17/3/14GydF4y2Ba
- CS:GydF4y2Ba
-
CASTASTERONE.GydF4y2Ba
- 数据备份系统:GydF4y2Ba
-
双b-boGydF4y2Ba
- 南京:GydF4y2Ba
-
NAM,ATAF1 / 2和CUC2GydF4y2Ba
- 可见:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- DLT:GydF4y2Ba
-
矮人和低分蘖GydF4y2Ba
- DOF:GydF4y2Ba
-
用一根手指结合DNAGydF4y2Ba
- 小块土地:GydF4y2Ba
-
乙烯反应因子GydF4y2Ba
- EXPS:GydF4y2Ba
-
棒曲霉素GydF4y2Ba
- FPKM:GydF4y2Ba
-
每千碱基的片段每百万次读取GydF4y2Ba
- GeBP:GydF4y2Ba
-
GLABROUS1 ENHANCER-BINDING蛋白质GydF4y2Ba
- Gln:GydF4y2Ba
-
谷氨酸GydF4y2Ba
- Glu:GydF4y2Ba
-
谷氨酸GydF4y2Ba
- 去:GydF4y2Ba
-
基因本体论GydF4y2Ba
- GOGAT:GydF4y2Ba
-
谷氨酸合酶GydF4y2Ba
- 肝:GydF4y2Ba
-
GAI, GAI和SCR的抑制因子GydF4y2Ba
- GRF:GydF4y2Ba
-
增长调节因素GydF4y2Ba
- GS:GydF4y2Ba
-
谷氨酰胺合成酶GydF4y2Ba
- HD-ZIP:GydF4y2Ba
-
HOMEODOMAIN-LEUCINE拉链GydF4y2Ba
- HN:GydF4y2Ba
-
高NGydF4y2Ba
- HSF:GydF4y2Ba
-
热应激转录因子GydF4y2Ba
- 凯西:GydF4y2Ba
-
钾GydF4y2Ba
- LAX1/2:GydF4y2Ba
-
PANICLE1/2松懈GydF4y2Ba
- LN:GydF4y2Ba
-
低NGydF4y2Ba
- MOC1 / 2/3:GydF4y2Ba
-
Monoculm1 / 2/3GydF4y2Ba
- MYB:GydF4y2Ba
-
成髓细胞瘤GydF4y2Ba
- 护士:GydF4y2Ba
-
氮GydF4y2Ba
- nn:GydF4y2Ba
-
正常的nGydF4y2Ba
- NRT1:GydF4y2Ba
-
低亲和力硝酸盐转运蛋白GydF4y2Ba
- OSACS2:GydF4y2Ba
-
ACC Synthase2.GydF4y2Ba
- osaco7:GydF4y2Ba
-
Acc Oxidase7.GydF4y2Ba
- OSAOS1 / 2:GydF4y2Ba
-
氧化物合成酶1/2GydF4y2Ba
- Osaoc:GydF4y2Ba
-
丙二烯氧化环化酶GydF4y2Ba
- OSCKX2 / 4:GydF4y2Ba
-
细胞素蛋白氧化酶/脱氢酶2/4GydF4y2Ba
- osdad1; 2:GydF4y2Ba
-
在花药缺陷缺陷1; 2GydF4y2Ba
- osfc1:GydF4y2Ba
-
细茎1GydF4y2Ba
- OsHAK / HKT:GydF4y2Ba
-
高亲和性K +转运蛋白GydF4y2Ba
- osjar1; 2:GydF4y2Ba
-
Jasmonate resistant1; 2GydF4y2Ba
- 奥斯洛克斯2; 1/2; 3:GydF4y2Ba
-
Lipoxygenases2; 1/2; 3GydF4y2Ba
- OSPT1:GydF4y2Ba
-
pi transporter1.GydF4y2Ba
- OsSPX-MSF2:GydF4y2Ba
-
SYG1 / PHO81 / XPR1-MASIT FACELITY SUPERFAMILY2GydF4y2Ba
- OSTB1:GydF4y2Ba
-
Teosinte分支1GydF4y2Ba
- OsVPE1:GydF4y2Ba
-
真空加工酶1GydF4y2Ba
- 病人:GydF4y2Ba
-
磷GydF4y2Ba
- pcc:GydF4y2Ba
-
皮尔逊相关系数的GydF4y2Ba
- PTR:GydF4y2Ba
-
迪/三肽运输车GydF4y2Ba
- RT-QPCR:GydF4y2Ba
-
定量逆转录PCRGydF4y2Ba
- SLS:GydF4y2Ba
-
StrigolactonesGydF4y2Ba
- TAD1:GydF4y2Ba
-
分蘖与矮生1GydF4y2Ba
- 故事:GydF4y2Ba
-
THREE-AMINO ACID-LOOP-EXTENSIONGydF4y2Ba
- TCP:GydF4y2Ba
-
TEOSINTE BRANCHED1, CYCLOIDEA和PCFGydF4y2Ba
- 本人:GydF4y2Ba
-
WUSCHELGydF4y2Ba
- WOX:GydF4y2Ba
-
Wuschel相关的HomeoboxGydF4y2Ba
- xths:GydF4y2Ba
-
Xyloglucan子甘蔗糖基酶/水解酶GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
Khush GS。打破米饭的屈服前沿。GEO J. 1995; 35:329-32。GydF4y2Ba
- 2。GydF4y2Ba
Janssen Bj,Drummond RSM,斯诺登kc。腋下射击发展的调节。CurrOp植物BIOL。2014; 17:28-35。GydF4y2Ba
- 3.GydF4y2Ba
李X,钱Q,傅Z,王Y,熊G,曾庆红D,王X, X,邓年代,Hiroshi F,元M, D,汉族B,李j .控制水稻的分蘖。大自然。2012;422:618-21。GydF4y2Ba
- 4.GydF4y2Ba
王颖,李军。植物构型的分子基础。植物生物学学报2008;59:53 - 79。GydF4y2Ba
- 5。GydF4y2Ba
王B,史密斯SM,李Jy。射击建筑的遗传调节。Annu Rev植物Biol。2018; 69:1-32。GydF4y2Ba
- 6。GydF4y2Ba
Koumoto T,Shimada H,Kusano H,She Kc,Iwamoto M,Takano M.抑制第二分蘖的生长的水稻单导体突变MOC2缺乏果糖-1,6-双磷酸酶。植物生物科技。2013; 30:47-56。GydF4y2Ba
- 7。GydF4y2Ba
吕志刚,邵刚,熊杰,焦勇,王军,刘刚,孟X,梁勇,熊刚,王勇,李军。水稻分蘖芽形成所必需的WUSCHEL - MONOCULM 3。中国基因工程杂志。2015;42:71-8。GydF4y2Ba
- 8。GydF4y2Ba
徐超,王勇,余勇,段军,廖志忠,熊刚,孟X,刘刚,钱强,李军。APC/C (TAD1)降解MONOCULM 1对水稻分蘖的调控。Nat Commun。2012;3:750。GydF4y2Ba
- 9。GydF4y2Ba
Takeda T,Suwa Y,Suzuki M,Kitano H,Ueguchi-Tanaka M,Ashikari M,Matsuoka M,Ueguchi C. OSTB1基因负调节水稻中的横向分支。工厂J. 2003; 33:513-20。GydF4y2Ba
- 10.GydF4y2Ba
王志强,王志强,王志强,等。水稻腋生分生组织形成中LAX PANICLE1蛋白积累的两步调控。植物细胞。2009;21:1095 - 108。GydF4y2Ba
- 11.GydF4y2Ba
Tabuchi H,Zhang Y,Hattori S,Omae M,Shimizu-Sato S,Oikawa T,Qian Q,Nishimura M,Kitano H,谢H,方X,Yoshida H,Kyozuka J,Chen F,Sato Y. Lax Panicle2水稻编码新型核蛋白,并调节腋生分生的形成。植物细胞。2011; 23:3276-87。GydF4y2Ba
- 12.GydF4y2Ba
Arite T, Iwata H, Ohshima K, Maekawa M, Nakajima M, Kojima M, Sakakibara H, Kyozuka J. DWARF10, RMS1/MAX4/DAD1同源基因,控制水稻侧芽生长。植物j . 2007; 51:1019-29。GydF4y2Ba
- 13。GydF4y2Ba
艾丽亚·米科拉姆,汉纳川,汉纳达,Maekawa M,Yamaguchi S,Kyozuka J.D14,米氏菌丝不敏感的突变体,显示出加速的分蘖的产卵。植物细胞生理。2009; 50:1416-24。GydF4y2Ba
- 14。GydF4y2Ba
林浩,王荣荣,钱强,严明,孟X,傅志华,严超,姜波,苏中,李军,王玉华。水稻分蘖芽生长发育的铁蛋白DWARF27调控。植物细胞。2009;21:1512-25。GydF4y2Ba
- 15.GydF4y2Ba
黄素类单加氧酶在生长素生物合成中的作用。科学。2001;291:306-9。GydF4y2Ba
- 16。GydF4y2Ba
徐敏,朱玲,寿华,吴鹏。水稻生长素依赖性不定根萌发和分蘖的PIN1家族基因OsPIN1。acta botanica yunica sinica(云南植物学报)2005;GydF4y2Ba
- 17。GydF4y2Ba
缺乏胞浆谷氨酰胺合成酶e1;2活性降低了水稻幼苗腋芽生长所需的细胞分裂素的氮依赖生物合成。acta botanica yunnanica(云南植物研究). 2017;58:679-90。GydF4y2Ba
- 18。GydF4y2Ba
GAO S,Fang J,Xu F,王W,Sun X,Chu J,Cai B,Feng Y,Chu C. cytokinin氧化酶/脱氢酶4整合细胞素素和毒素信号传导控制稻冠根形成。植物理性。2014; 165:1035-46。GydF4y2Ba
- 19。GydF4y2Ba
叶淑英,陈宏伟,吴超英,林超英,曾浩,李文慧,顾淑英。下调细胞分裂素氧化酶2的表达可增加水稻分蘖数,提高水稻产量。大米。2015;36。GydF4y2Ba
- 20.GydF4y2Ba
桐树,金烨,刘某,李文,方j,尹y,钱q,朱l,朱c矮人和低分蘖,克拉斯家族的新成员,在米饭中发挥了芸苔类药物信号的积极作用。工厂J. 2009; 58:803-16。GydF4y2Ba
- 21.GydF4y2Ba
方Z,吉y,胡j,gu r,太阳,王x.滴水酮和芸苔类化合物拮抗D53-osbzr1复合物的稳定性,以确定稻米分蘖中的Fc1表达。莫尔植物。2019; 13:586-97。GydF4y2Ba
- 22.GydF4y2Ba
刘艳,丁颖,王强,孟D,王松。氮素和6-苄基氨基嘌呤对水稻分蘖芽生长及内源激素和氮素变化的影响。作物科学。2011;51:786。GydF4y2Ba
- 23.GydF4y2Ba
徐国华,徐国华,徐国华,等。植物氮素营养特性的研究进展。植物学报。2017;39:57-65。GydF4y2Ba
- 24.GydF4y2Ba
Rentsch D,Schmidt S,Tegeder M.用于摄取和植物中有机氮化合物的分配的转运蛋白。费用。2007; 581:2281-9。GydF4y2Ba
- 25.GydF4y2Ba
李华,胡斌,楚聪。作物氮素利用效率的研究:拟南芥和水稻的经验教训。J Exp Bot. 2017; 68:2477-88。GydF4y2Ba
- 26.GydF4y2Ba
黄W,NIE H,FENG F,Wang J,Lu K,方Z.SOSNPF7.1和OSNPF7.4的表达改变了差异调节水稻中的分蘖和籽粒产量。植物SCI。2019; 283:23-31。GydF4y2Ba
- 27。GydF4y2Ba
王军,卢科,聂华,曾强,吴斌,钱军,方志强。水稻硝态氮转运体OsNPF7.2对分蘖数和产量的正向调控。大米。2018;数。GydF4y2Ba
- 28。GydF4y2Ba
关键词:水稻,有机氮,多肽转运体,OsNPF7.3,产量植物学报2017;8:1338。GydF4y2Ba
- 29。GydF4y2Ba
关键词:OsNPF7.7,水稻,分枝调控,氮素利用效率前面。植物科学。2018;9:300。GydF4y2Ba
- 30.GydF4y2Ba
刘勇,冯Wirén N.铵态氮信号对植物生理和形态的响应。J Exp Bot. 2017; 68:2581-92。GydF4y2Ba
- 31.GydF4y2Ba
Loqué D, von Wirén N.植物根系中铵态氮运输的调节水平。J Exp Bot. 2004; 55:1293-305。GydF4y2Ba
- 32.GydF4y2Ba
Tabuchi M,Abiko T,Yamaya T.铵离子的同化和水稻中氮的再利用(Oryza sativa L.)。J Exp Bot。2007; 58:2319-27。GydF4y2Ba
- 33.GydF4y2Ba
赵红,马辉,于磊,王鑫,赵军。水稻氨基酸转运蛋白家族的全基因组调查与表达分析。《公共科学图书馆•综合》。2012;7:e49210。GydF4y2Ba
- 34.GydF4y2Ba
陆凯,吴斌,王军,朱伟,聂华,钱军,黄伟,方志忠。阻断氨基酸转运体saap3对水稻分蘖数和分枝芽的促进作用。生物技术学报2018;16:1710-22。GydF4y2Ba
- 35.GydF4y2Ba
王军,吴斌,卢科,魏强,钱军,陈勇,方志刚。氨基酸渗透酶5 (saap5)对水稻分蘖数和产量的调控。植物杂志。2019;180:1031-45。GydF4y2Ba
- 36.GydF4y2Ba
克朗扎尔HJ。水稻中硝酸铵 - 铵协同作用。亚细胞通量分析。植物理性。1999; 119:1041-6。GydF4y2Ba
- 37。GydF4y2Ba
杨立氏,侃蝉,洪钍,HSIEH博士,王度,HSIEH WY,HSIEH MH。水稻根中早期硝酸铵响应基因的鉴定。SCI批准。2017; 7:16885。GydF4y2Ba
- 38。GydF4y2Ba
朱伟,杨辉,王雪梅,杨辉,王雪梅。独角兽内酯/ max2诱导的油菜素内酯转录效应因子BES1降解调控植物分枝。Dev细胞。2013;27:681-8。GydF4y2Ba
- 39。GydF4y2Ba
Rodríguezd,andrade fh,Goudriaan J.磷营养对小麦耕作的影响。植物土壤。1999年; 209:283-95。GydF4y2Ba
- 40.GydF4y2Ba
Ohashi M,Ishiyama K,Kusano M,Fukushima A,Kojima S,Hayakawa T,Yamaya T.通过果糖-1,6-双磷酸酶2的下调降低蔗糖内容物,导致缺乏谷氨酰胺合成酶1的水稻突变体中的分蘖生长停止; 2。米。2018; 11:65。GydF4y2Ba
- 41.GydF4y2Ba
Epple P, Mack AA, Morris VR, Dangl JL。两种相关的植物特异性锌指蛋白对氧化应激诱导的拟南芥细胞死亡的拮抗控制美国国立科学研究院2003;100:6831-6。GydF4y2Ba
- 42.GydF4y2Ba
Hamant O,Pautot V.植物开发:故事故事。C r Biol。2010; 333:371-81。GydF4y2Ba
- 43.GydF4y2Ba
van der graaff e,laux t,rensing sa。含Wus homeobox的(wox)蛋白质家庭。基因组Biol。2009; 10:241-8。GydF4y2Ba
- 44.GydF4y2Ba
Park J,Kim Ys,Kim Sg,Jung Jh,Woo Jc,Park Cm。拟南芥种子萌发过程中NAC转录因子NTM2的植物素和盐信号的整合。植物理性。2011; 156:537-49。GydF4y2Ba
- 45.GydF4y2Ba
NAKANO T,苏祖基,富士菊,夏精,Shinshi H.拟南芥和稻米ERF基因家族的基因组分析。植物理性。2006; 140:411-32。GydF4y2Ba
- 46.GydF4y2Ba
戴X,王Y,杨A,张WH。OSMYB2P-1,R2R3 MYB转录因子参与水稻中磷酸盐饥饿反应和根系结构的调节。植物理性。2012; 159:169-83。GydF4y2Ba
- 47.GydF4y2Ba
Castilhos G,Lazzarotto F,Spagnolo-Fonini L,Bodanese-Zanettini MH,Margis-Pinheiro M.基本螺旋环 - 螺旋转录因子适应干旱的可能作用。植物SCI。2014; 223:1-7。GydF4y2Ba
- 48.GydF4y2Ba
Li C, Potuschak T, Colon-Carmona A, Gutierrez RA, Doerner P. P.拟南芥TCP20连接生长调控和细胞分裂控制通路。美国国立科学院科学技术研究所2005;102:12978-83。GydF4y2Ba
- 49.GydF4y2Ba
(1)拟南芥生长调节因子9 (growth regulatory factor 9)对拟南芥叶片生长具有负调控作用。公共科学图书馆麝猫。2018;14:e1007484。GydF4y2Ba
- 50。GydF4y2Ba
生长素-细胞分裂素相互作用在控制茎分枝中的作用。acta botanica sinica(云南植物学报),2008;69:429-35。GydF4y2Ba
- 51.GydF4y2Ba
Dun Ea,De Saint Ga,Rameau C,Beveridge Ca.滴水酮和细胞素蛋白在芽外生长控制中的拮抗作用。植物理性。2009; 158:487-98。GydF4y2Ba
- 52.GydF4y2Ba
乔S,Sun S,Wang L,Wu Z,Li C,Li X,Wang T,Leng L,Tian W,Lu T,Wang X. RLA1 / SMOS1转录因子用OSBZR1调节芸苔类固醇信号和稻米建筑。植物细胞。2017; 29:292-309。GydF4y2Ba
- 53.GydF4y2Ba
Funayama K,Kojima S,Tabuchi-Kobayashi M,Sawa Y,Nakayama Y,Hayakawa T,Yamaya T.细胞溶质谷氨酰胺合成酶1; 2是稻根中铵的初次同化。植物细胞生理。2013; 54:934-43。GydF4y2Ba
- 54.GydF4y2Ba
王勇,卢军,任涛,Hussain S,郭超,王胜,丛瑞,李昕。氮素和分蘖类型对水稻产量及生理响应的影响。AoB植物。2017;9:plx012。GydF4y2Ba
- 55.GydF4y2Ba
杨少云,郝大东,宋泽忠,杨国珍,王玲,苏永华。不同供氮条件下水稻差异表达基因的RNA-Seq分析基因。2015;555:305-17。GydF4y2Ba
- 56.GydF4y2Ba
杨伟,尹建军,崔洪平,范勇,陈荣荣,安国光。水稻氮素饥饿响应基因的转录组分析。BMC Plant Biol. 2015;15:31。GydF4y2Ba
- 57.GydF4y2Ba
罗丽,潘胜,刘旭,王浩,徐刚。缺氮对水稻分蘖芽细胞分裂伸长的抑制作用。acta botanica yunnanica(云南植物研究). 2017;64:32-40。GydF4y2Ba
- 58.GydF4y2Ba
夏X,风扇X,Wei J,Feng H,Qu H,Xie D,Miller Aj,徐G.米硝酸盐转运仪OSNPF2.4在低亲和力采集和远程运输中的功能。J Exp Bot。2015; 66:317-31。GydF4y2Ba
- 59.GydF4y2Ba
吴勇,李强,金瑞,陈伟,刘旭,孔飞,柯莹,石华,袁军。低氮胁迫对不同耐低氮玉米品种光合作用和叶绿素荧光特性的影响。J integra Agric. 2019; 18:1246-56。GydF4y2Ba
- 60.GydF4y2Ba
Macadam JW,Volenec JJ,Nelson CJ。氮对高叶片叶片中叶片细胞分裂和表皮细胞伸长的影响。植物理性。1989; 89:549-56。GydF4y2Ba
- 61.GydF4y2Ba
刘Y,赖恩,高K,陈F,元L,Mi G.铵通过降低分类和伸长区的长度并降低拟南芥根顶部的元素膨胀率降低初级根生长。Plos一个。2013; 8:E61031。GydF4y2Ba
- 62.GydF4y2Ba
Verma v,Ravindran p,kumar pp。植物激素介导的应力反应调节。BMC植物BIOL。2016; 16:1-10。GydF4y2Ba
- 63.GydF4y2Ba
罗丽,王浩,刘旭,胡军,朱旭,潘松,秦瑞,王勇,赵鹏,范旭,徐光光。独角金内酯对水稻氮素转运的影响。植物科学。2018;270:190-7。GydF4y2Ba
- 64.GydF4y2Ba
李Di DW, Sun L,张X, G, Kronzucker HJ,施w .生长素参与铵公差的规定在水稻(栽培稻L .)。土壤植物。2018;432:373 - 87。GydF4y2Ba
- 65.GydF4y2Ba
徐茹,Zha M,Li Y,Ding Y,Chen L,Ding C,Wang S.氮可用性和生长素,细胞素素和胞嘧啶和胞嘧啶对水稻枝条枝条枝条的相互作用(Oryza Sativa L.)。植物细胞代表2015; 34:1647-62。GydF4y2Ba
- 66.GydF4y2Ba
太阳L, Di D,李G, Kronzucker HJ,施w .全球水稻基因表达的时空动力学(栽培稻L .)应对高铵压力。acta botanica yunnanica(云南植物研究). 2017;GydF4y2Ba
- 67.GydF4y2Ba
罗L,Takahashi M,Kameoka H,Qin R,Shiga T,Kanno Y,Seo M,Ito M,Xu G,Kyozuka J.在水稻中阶段介导的腋芽猝灭休眠的早期步骤的发育分析。植物J. 2019; 97:1006-21。GydF4y2Ba
- 68.GydF4y2Ba
庄丽,葛玉英,王静,于军,杨振华,黄博。赤霉素对高羊茅分蘖的抑制作用及腋芽生长调控基因的转录调控。植物科学。2019;287:110168。GydF4y2Ba
- 69.GydF4y2Ba
关键词:水稻,分蘖芽,生长调节剂,内源激素abstract:作物学报,2011;37:670-6。GydF4y2Ba
- 70。GydF4y2Ba
乙烯在植物生长中的作用。美国国家科学学院1973;70:591-7。GydF4y2Ba
- 71。GydF4y2Ba
Rubio-Moraga A, Ahrazem O, Pérez-Clemente RM, Gómez-Cadenas A, Yoneyama K, López-Ráez JA, Molina RV, Gómez-Gómez L.藏红花的顶端优势和分支酶CCD7和CCD8在控制芽发芽中的作用。BMC Plant Biol. 2014;14:171。GydF4y2Ba
- 72。GydF4y2Ba
东Z,小义,Govindarajulu R,Feil R,Siddoway ML,Nielsen T,Lunn Je,Hawkins J,Whipple C,Chuck G.核心玉米驯化模块控制芽休眠和生长抑制的监管景观。NAT Communce。2019; 10:1-15。GydF4y2Ba
- 73。GydF4y2Ba
Chen C,夏R,陈H,何Y.TBOOLS,生物学家的工具包与用户友好的界面集成了各种生物数据处理工具。生物XIV。2018年:289660。GydF4y2Bahttps://doi.org/10.1101/289660.GydF4y2Ba.GydF4y2Ba
- 74。GydF4y2Ba
Supek F, Bošnjak M, Škunca N, Šmuc T. REVIGO总结和可视化基因本体论术语的长列表。《公共科学图书馆•综合》。2011;6:1-9。GydF4y2Ba
- 75.GydF4y2Ba
王Z,陈C,徐y,江r,韩y,xu z,chong k。实际载体为水稻基因表达有效敲低的实用载体。植物mol biol。2004; 22:409-17。GydF4y2Ba
- 76.GydF4y2Ba
Hiei Y,Ohta S,Komari T,Kumashiro T.稻瘟病的高效转化(Oryza sativa L.)由土壤杆菌和T-DNA界限介导的序列分析。工厂J. 1994; 6:271-82。GydF4y2Ba
致谢GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
国家自然科学基金项目(no . 31301250);中国科学院华南植物园广东省应用植物学重点实验室项目(no . AB2018022);桂大专集和子(2019)07 (no . 702646193301)。资助方没有参与研究的实验设计、数据收集、分析和解释,也没有参与手稿的撰写。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
ZF构思设计项目,进行转基因实验和qRT-PCR分析;JQ收集RNA-seq样本;RW和FZ进行转录组分析并撰写手稿;ZF和JT对手稿进行了修改。所有作者都已阅读并批准了本手稿的最终版本。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表S1。GydF4y2Ba
RNA-SEQ数据读数计数的统计数据。GydF4y2Ba表S2。GydF4y2Ba我们研究中使用的引物。GydF4y2Ba表S3。GydF4y2Ba所有表达基因和deg的表达水平。GydF4y2Ba图S1。GydF4y2BaRNA-SEQ样本的表达相关性。(a)主成分分析(PCA)显示组织和N浓度特异性样品(重复)。AB代表腋芽,BP代表基础部分。(b)两个样品之间的表达相关性揭示了腋芽芽和基部部分之间的差异,以及不同的N浓度之间的差异。_1和_2代表两次重复。GydF4y2Ba图S2。GydF4y2Ba在低N和高N条件下基底部和腋芽之间的具体和常见基因。(a)venn图,显示基部部分和低N条件下的基底部分和腋芽的响应基因之间的重叠。(b)(a)所示的四个数据集中的总和和TF基因的总数和TF基因的数量。(c)低N和高N条件下腋芽和基底部的常见基因数。GydF4y2Ba图S3。GydF4y2Ba在图1中的十个表达模式(B01-B09)中的细胞组分(A)和分子函数(B)的类别中富集的GO术语。GydF4y2Ba4.GydF4y2Ba湾仅显示显着的GO术语(错误发现率(FDR)<0.05)。GydF4y2Ba图S4。GydF4y2Ba在细胞组分(a)和分子函数(b)中富集的GO术语在图9中的九个表达模式(A01-A10)中的DEGS的分子函数(B)。GydF4y2Ba5.GydF4y2Ba湾仅显示显着的GO术语(错误发现率(FDR)<0.05)。GydF4y2Ba图S5。GydF4y2Ba在每个N浓度下基底部和腋芽之间的差异表达基因。(a)与六氮浓度下的基底部分相比,在腋芽中检测到腋芽上调和下调的次数(折叠变化> 2和PADJ <0.05)的数量。显示了每个N浓度的上调,下调和总待遇的数量。(b)聚集在六氮浓度下腋芽和基底部分之间检测到的总次数。在基础部分样本中对每个基因的FPKM值进行缩放,并显示为缩放表达。(c)(b)在(b)所示的十三个集群的生物过程类别中富集的阶段。仅显示显着的GO术语(错误发现率(FDR)<0.05)。GydF4y2Ba图S6。GydF4y2Ba在附加文件1中的十三个表达模式(BA01-BA13)中的细胞组分(A)和分子函数(b)类别中富集的术语。图S5b。仅显示显着的GO术语(错误发现率(FDR)<0.05)。GydF4y2Ba图S7。GydF4y2Ba在每个n浓度下基底部和腋芽之间的重叠和特定基因。(a)在每个n浓度下基部和腋芽之间的重叠和特定基因的Venn图分析。(b)在重叠和特定基因(a)的生物过程类别中富集的阶段。仅显示显着的GO术语(错误发现率(FDR)<0.05)。GydF4y2Ba图S8。GydF4y2Ba在基础部分(a)和矛盾(b)下的差异上表达的TF基因在不同的n条件下。LN代表低氮,NN代表普通氮,HN代表高氮。B01-B09和A01-A10表示基部(A)和轴芽(B)中的DEGS簇。热图显示了使用缩放的FPKM值的表达式模式。没有显示任何12个样品的FPKM值的TF基因。GydF4y2Ba图S9。GydF4y2BaTF家族的表达动态。热图显示TF家族的表达模式,使用每个家族中总TF基因的比例FPKM值。GydF4y2Ba图S10。GydF4y2Ba与ABA(A),Ga(B),乙烯(C)和JA(D)相关的基因的表达谱和N浓度下的腋芽。热图显示了使用缩放的FPKM值的表达式模式。所有样本中FPKM值小于1的基因均未显示。GydF4y2Ba图S11。GydF4y2Ba不同氮浓度下基部和腋芽中钾转运体(a)、磷酸盐转运体(b)和信号转导相关基因的表达谱所有样本中FPKM值小于1的基因均未显示。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
王锐,钱军,方忠。GydF4y2Baet al。GydF4y2Ba通过对水稻幼苗在不同氮素供应下的转录组和生理分析,可以深入了解腋芽生长的调控。GydF4y2BaBMC植物BIOL.GydF4y2Ba20.GydF4y2Ba197(2020)。https://doi.org/10.1186/s12870-020-02409-0GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-02409-0GydF4y2Ba
关键字GydF4y2Ba
- 米GydF4y2Ba
- 氮GydF4y2Ba
- 腋芽生长GydF4y2Ba
- 分蘖号码GydF4y2Ba
- 转录组GydF4y2Ba
- 细胞扩张GydF4y2Ba
- 转录因素GydF4y2Ba
- Phytohormone信号传导GydF4y2Ba