抽象的
背景
N6-甲基腺苷(M6A)是最广泛的RNA改性,可在基因和基因组稳定性调节中起作用。含有含有域的RNA结合蛋白的YT521-B同源性(YTH)是重要的RNA结合蛋白,其通过结合M6A影响含M6A的RNA的命运。几乎是众所周知的YTH普通小麦的基因(Triticum aestivum.L.)是人类最重要的作物之一。
结果
一共有39TaYTH在普通小麦中鉴定出的基因由13个同源三联体组成,可定位于21条染色体中的18条。系统发育分析表明,tayth可分为两组:YTHDF (TaDF)和YTHDC (TaDC)。同组的tayth具有相似的模态分布和域组织,这表明密切相关的tayth之间存在功能相似性。TaDF蛋白只有一个共享的结构域,即YTH结构域。相比之下,tdcs除了中心YTH结构域外,在n端有3个c3h1型锌指重复序列。在TaDFs中,与m6A的甲基赖氨酸残基结合的预测芳香笼袋由色氨酸、色氨酸和色氨酸组成(WWW)。相比之下,TaDCs中的芳香笼袋由色氨酸、色氨酸和酪氨酸(WWY)组成。除了一般的天冬氨酸或天冬酰胺残馀物用来与N形成氢键外1M6a,组氨酸可用于一些塔德菲蛋白。使用在线RNA-SEQ数据和定量实时PCR验证的表达分析显示TaDFa和TaDFb基因在各种组织/器官中高度表达,与TaDFcs和TaDCs.此外,表达式的TaYTH基因在不同的非生物胁迫下发生变化。
结论
在这项研究中,我们发现39TaYTH基因来自普通小麦。系统发育结构,染色体分配,而这些基因和它们的蛋白质结构的表达模式进行分析。我们的研究结果提供的功能分析奠定了基础TaYTH在未来。
背景
n6 -甲基腺苷(N6-Methyladenosine, m6A)是最受关注的真核rna转录后修饰,对基因调控和维持基因组稳定性至关重要[1].m6A是一种可逆的动态修饰,由甲基转移酶复合物(writer)催化,如metttl3, metttl14, WTAP,和RBM15/RBM15B,并被去甲基酶(Erasers)去除,包括FTO和ALKBH5。m6A的修饰在多种生理过程中起着重要作用。例如,MTA、MTB、FIP37和VIR,这些植物中甲基转移酶复合物亚基的同源体,在调控茎干细胞的命运、根的生长、向地性反应和胚胎发育中发挥作用[2那3.那4.那5.].M6a通过影响二次RNA结构的形成,在分子水平下发挥作用,在此期间M6a修饰控制RNA结合蛋白的结合位点的可访问性(读取器)[6.].读者识别M6A对于RNA的新陈代谢,处理和折叠以及蛋白质翻译是重要的。已经鉴定了许多M6A读取器蛋白质,并且最多含有YT521-B同源(YTH)结构域,具有特异性识别GG(M6A)C序列的芳族笼子[7.].鉴定了五个含有的含有人的RNA结合蛋白质,并且它们可以基于它们的序列分为三类:YTHDC1(含型域蛋白质1),YTHDC2(含型域蛋白2),以及Ythdf(含有型域的家庭蛋白质)家庭[8.].YTHDF蛋白(DF1,DF2和DF3)在细胞质中局部化并含有C末端YTH结构域和大,低复杂性区域。已经表明,YTHDFS在mRNA中结合所有M6A位点。Ythdc1是核化的,并在其中心部分含有yth结构域,并且由其他多功能域组成。相反,YTHDC2是含有C末端yth结构域和死箱RNA螺旋酶结构域的核细胞质蛋白质。YTHDC1与MRNA中的某些M6A位点结合,并非编码RNA,而YTHDC2主要与非编码RNA结合[9.].许多YTH基因已经在多种植物中被鉴定出来,包括拟南芥蒂利亚纳那奥雅萨苜蓿那马吕斯有明显那柑橘sinensis.和Cucumis sativus[10那11那12那13].13等基因的A. Thaliana.,同源物的ythdfs.,被鉴定,其中一些功能在控制第一个真实叶片形成,适当的叶形形态和培养的分支的时序中的作用[14那15那16那17].Ect2可以在体内与M6a的RNA交互,表明Yth域是M6a读取域拟南芥[15].ATCPSF30是人hyTDC的同源物,其是在氧化和硝酸盐信号中起作用的裂解和多腺苷酸特异性因素[18那19].在A. Thaliana.那M. hppehensis.和c .巨大成功那YTH基因参与植物对病原体,植物激素(水杨酸和脱落酸),和非生物胁迫(水,温度和盐度)10那11那12那13那20.那21那22].这些研究表明,含有亚域的蛋白质在植物发育和生物和非生物应激反应中起重要作用。小麦是世界上主要的谷物作物之一。我们的知识,常见小麦的Yth蛋白质家庭(Triticum aestivum.尚未详细分析。本研究在普通小麦中鉴定了39个编码YTH结构域蛋白的基因,并分析了它们的系统发育关系、在不同组织/器官中的表达以及对不同胁迫的响应。
结果
常见小麦yth蛋白的鉴定和系统发育分析
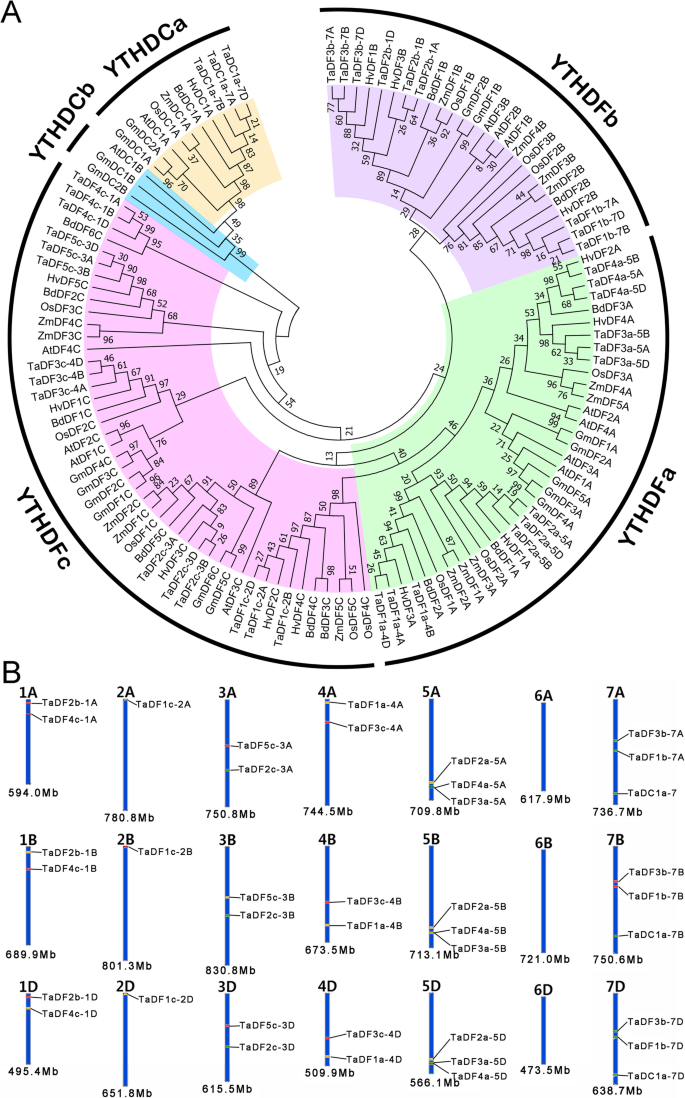
识别TaYTH利用YTH域的隐马尔可夫模型谱(PF04146)作为查询条件,对普通小麦(https://www.ebi.ac.uk/tools/hmmer/search/hmmsearch.)已下载面包小麦的本地蛋白质数据库。此外,云天化的保守域也被用于经BLASTp由小麦基因组的网站上编码的蛋白质云天化http://plants.ensembl.org/Multi/Tools/Blast[8.].此外,我们对当地的小麦蛋白数据库(e值< 1 × 10)进行了BLASTP分析- 5)通过使用含Yth结构域的蛋白质序列拟南芥蒂利亚纳和奥雅萨苜蓿作为疑问。除去冗余序列后,鉴定了总共39个推定的母蛋白并用于进一步分析(附加文件1).他们的编码基因是13套和13套YTH每个亚基因组中的基因。另外,13,17,12,15,12,13YTH基因A. Thaliana.那大豆那o.苜蓿那玉米那Broachypodium distachyon.,Hordeum Vulgare.分别在本研究中的相同策略和其他研究中识别出鉴定[15].39个无根的系统发育树TaYTH基因基于39次塔的yth结构域与来自的82次蛋白质的音乐会构成A. Thaliana.那o.苜蓿那G. Max.那z梅斯那b . distachyon,H.Vulgare.(附加文件2)分析塔蛋白的进化关系(图。1a).系统发育分析显示,TaYTH结构域蛋白聚类为YTHDF (TaDF)和YTHDC (TaDC)两类。YTHDF家族包含YTHDFa、YTHDFb和YTHDFc三个子组,分别包含12、9和15个成员。YTHDC家族又可分为YTHDCa和YTHDCb两个子群。在普通小麦中未发现YTHDCb蛋白,这与之前单子叶植物中不存在b类ythdc的假设一致[15].所有已鉴定的39个YTH蛋白都根据它们与其他植物中鉴定的YTH蛋白的系统发育关系重新命名[15].基因所在的亚基因组(A、B或D)包含在名称中,亚基因组前的编号表示染色体的序列号。染色体位置信息TaYTH从小麦基因组GFF3参考文件中提取基因,利用在线分析工具KnetMiner (https://knetminer.rothamsted.ac.uk/Triticum_aestivum/).绘制的地图显示塔泰除染色体6a,6b和6d外,位于所有染色体上。有三种TaYTH染色体5A、5B、5D、7A、7B和7D上的两个基因,以及染色体1A、1B、1D、3A、3B、3D、4A、4B和4D上的两个基因。相比之下,只有一个TaYTH基因分别位于2A、2B和2D染色体上(图。1b)。
基因结构与共生性TaYTH基因
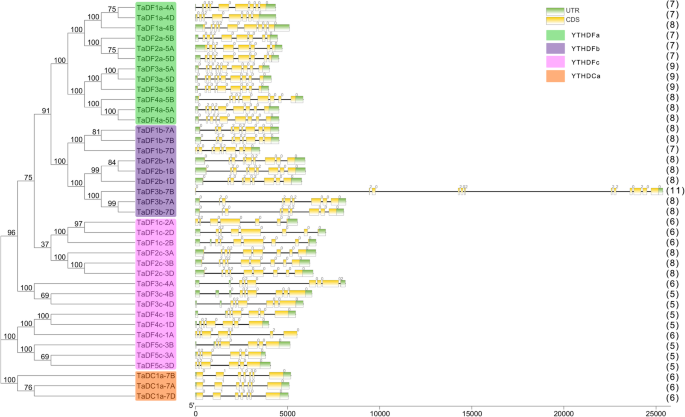
外显子系统结构提供了对基因家族的演变和额外证据支持系统发育分组的识别。然后我们分析了外显子内部结构TaYTH基因基于进化分类。所有TaYTH基因含有内含子,并且从五到八个内含子中含有的大多数基因(图。2).相比之下,TaDF3b-7B包含最大数量的内含子(11),包括未发现的三个长(> 4 kB)YTH其他植物的基因[11那12] (图。2).分布的格局TaYTH在系统发育树中的每组内的构件中,外显子/内部内含子。内含子相1,2和0的比例分别为2.55,23.3和74.2%TaYTH基因(图。2).有类似的内含子阶段的模式TaYTH与那些的基因YTH基因A. thaliana, O. sativa其他物种[11[即,内含子的最大比例在相0中,含量为1(图。2).
基因组复制事件经常导致基因家族在Angiospers的演变过程中导致基因家族的扩展[23].三对基因,tadf3a-5a.和tadf4a-5a.那tadf3a-5b.和TADF4A-5B.,Tadf3a-5d.和tadf4a-5d,分别位于染色体5A、5B和5D的200kb范围内(图。1B,表格1).此外,这些基因份额份额类似的外显子结构(图。2).这表明,这些YTH基因可以通过串联基因复制产生。同时性图YTH小麦与其他植物的基因(A. Thaliana.;o .漂白亚麻纤维卷;z梅斯;Medicago truncatula和b . distachyon)透露了YTH小麦基因含有最多数量的同源基因对b . distachyon,然后是米饭和玉米(图。3.).不YTH小麦和麦子之间的同源基因对拟南芥.在小麦和小麦之间只鉴定出两个同源基因对m . truncatula.与此相反,18,21,21,和24YTH大麦与小麦、水稻与小麦、玉米与小麦、b . distachyon对小麦的三个预期同源对应物进行匹配(图1)。3.额外的文件3.).我们的结果显示有类似的副本YTH基因在不同物种和数量相似YTH不同物种和小麦的基因对,这表明了YTH基因家族是保守的,在植物进化过程中承受着很强的选择压力。
塔雷的蛋白质特征
TaYTHs长度范围为588 ~ 767个氨基酸残基。TaYTH蛋白的分子量(MW)和等电点(pI)分别为63.9 ~ 82.1 kDa和5.40 ~ 8.54 kDa1).TaYTH蛋白的亚细胞定位通过在线工具PSORT (https://www.psort.org/).TaDF1b-7D、TaDF2c-3A、TaDF2c-3B、TaDF2c-3D和TaDF4c-1B被预测定位于细胞质,而其他TaYTHs定位于细胞核(表1).
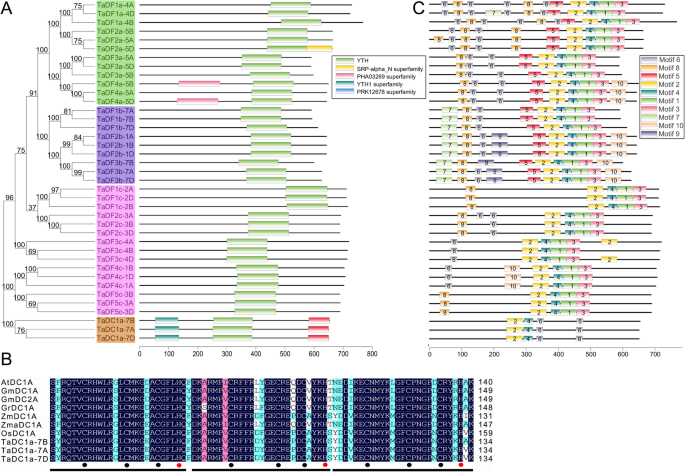
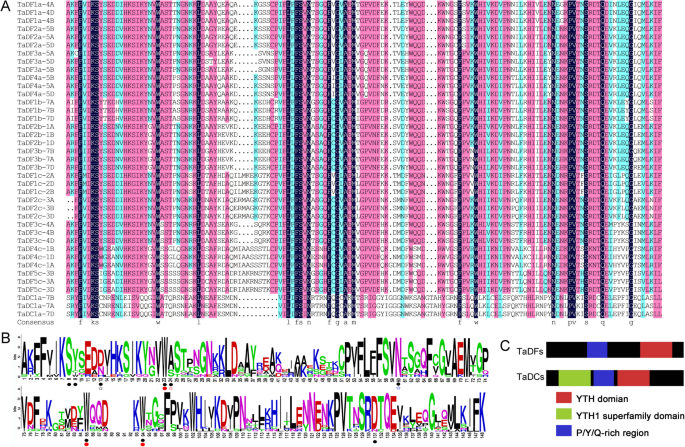
序列比对显示,塔泰蛋白仅占30.85%的身份,高度保守的区域位于yth结构域中,具有69.57%的身份(附加档案4.),与其他物种的YTH结构域蛋白类似[6.].在大多数TADF蛋白中,YTH结构域是其C-末端的唯一可识别模块(图。4.一个),其与其他物种的类似[11].相比之下,除了在中间部分的yth结构域外,所有三个塔德蛋白涉及两种额外的结构域,N末端Yth1超家族结构域和C末端PRK12678超家族域。YTH1超家族结构域由三个重复的C3H1型锌手指组成[13] (图。4.b).所有这些TaDC蛋白均为YTHDC -a型(图1)。1).其他植物中的YTHDC在其N-Terminus上具有Yth1超家族域,但它们的C-Terminus Harbors不同类型的域(附加文件5.和6.).相反,双子叶植物中的B型YTHDCS除了yth结构域之外的额外域不会像动物中的YTHDC1S(附加文件)5.和6.).为了进一步分析在TaYTH蛋白质结构的多样性,在TaYTHs保守结构域使用的在线工具MEME(鉴定http://meme-suite.org/tools/meme)(额外的文件7.).所有塔蛋白含有图案2,4和6.在TADFS中,YTH结构域由三个图案(2,4和1)组成,然后在其C-Termini上进行图案3。相比之下,塔斯科的yth结构域由三个图案(2,4和6)组成,然后在其C-Termini处进行另外的基序6(图。5.c). YTH域上游,第5、6、8位基序被TaDFa子群共享;在TaDFb子组中包含motif 5、6、7和8,在TaDFc子组中包含motif 6和/或8。4.C)。
YTHDF和YTHDC YTH域的一个芳香笼袋被用来结合m6A的甲基赖氨酸残基[6.那8.].这个带正电荷的口袋是由人类YTHDF1中的色氨酸(W411)、色氨酸(W465)和色氨酸(W470)的侧链形成的;人类YTHDC1中的色氨酸(W377)、色氨酸(W428)和亮氨酸(L439)。在本研究中,我们发现TaDFs的芳香笼是由色氨酸、色氨酸和色氨酸(WWW)组成,而TaDCs的笼是由色氨酸、色氨酸和酪氨酸(WWY)组成(图)。5.A和B)。除了依赖性相互作用之外,M6a还与yth蛋白形成基本特异性氢键[7.].比较YTHDF1和YTHDC1与m6A的结合亲和力,发现YTHDC1中的天冬酰胺(N367)与N形成氢键1结果表明,与含N的D401残基相比,m6A残基较强1在Ythdf1中的M6a。在这项研究中,我们发现所有塔德如何,六躯干和三个塔德富蛋白使用天冬氨酸形成氢键与n1m6a;然而,天冬氨酸已被六核苷酸,三个TADFC和三个TADC蛋白中的芦笋取代(图。5.此外,组氨酸在三个TaDFb蛋白的相应位置被使用(图1)。5.a和b),而在植物物种中鉴定的其他YTH蛋白中未发现该模式[15].TADF蛋白的N-末端具有含有Y / P / Q的区域的低复杂性区域(图。5.C,附加文件8.);然而,塔氏富含Y / P / Q的地区位于锌指重复(YTH1超家族域)和yth结构域之间(图。5.C)。
的表达式分析TaYTH不同组织/器官和非生物胁迫下的基因
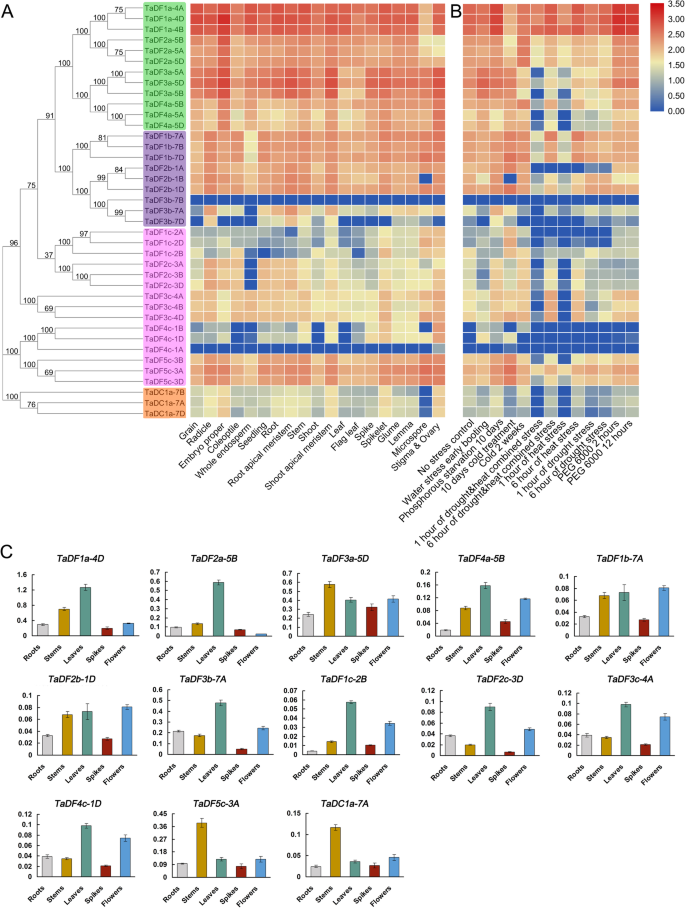
为了分析的模式TaYTH表达,我们从小麦表达浏览器网站(http://www.wheat-expression.com/)[24]. 19个组织器官(籽粒、胚根、胚体、胚芽鞘、胚乳、幼苗、根、根尖分生组织、茎、芽、茎尖分生组织、叶、旗叶、穗、小穗、颖片、外稃、小孢子、柱头、,在不同的发育阶段和非生物/生物胁迫条件下,我们的分析包括卵巢和卵巢。结果显示,所有的TaDFa和TaDFb在19个组织/器官中,基因高度表达,除了TADF3BS.(图。6.一种)。相比之下,表达的水平TaDFcs和塔德卡斯在各种组织/器官中,除了TADF3C和TaDF5cs(图。6.一种).大部分的TaYTH基因表现出响应于非生物应激的明显变化,例如磷饥饿,冷应激和热应激(图。6.b).此外,TaDF3b-7B和TaDF4c-1A分析所有组织/器官和应激条件的较低(图。6.A和B)。TaDFa和TaDFb在生物应激下表现出高度表达的基因,除了TaDF3b-7B(附加文件9.).相比之下,TaDFc和TaDCa低表达,除了TaDF5c生物胁迫下的高表达(附加文件9.).
确认组织表达TaYTH普通小麦的基因,我们在冬小麦品种Jimai22的五种不同组织/器官中进行了QRT-PCR分析,包括植物,茎,叶子,植被发育的根,茎和鲜花。共13个基因(TADF1A-4D,TADF2A-5B,TADF3A-5D,TADF4A-5B,TADF1B-7A,TADF2B-1D,TADF3B-7A,TADF1C-2B,TADF2C-3D,TADF3C-4A,TADF4C-1D,TADF5C-3A,和TaDC1a-7A),每组同卵等位基因中均有一组纳入分析。TaDF1a-4D在13种组织中,5种组织的表达水平最高TaYTH基因(图。6.c),与基于RNA-Seq数据的结果一致(图5)。6.a).我们的结果显示13个中有11个TaYTH除了tadf5c-3a.,TaDC1a-7A(图。6.c).此外,TaDF3a-5D,TaDF1b-7A,TaDF5c-3A和TaDC1a-7A在茎和TaDF3a-5D,TaDF4a-5B,TaDF1b-7A,TaDF2c-3D,和TaDF3c-4A在花中的水平相对较高。相比之下,只有TaDF3b-7A和TaDF3c-4A分别在根和尖峰中表现出更高水平的表达(图。6.C)。
讨论
在我们的研究中,共鉴定了共常见的小麦含有39个含有的含有典型的典型域蛋白质基因。岳等。在小麦中鉴定了41个M6A读蛋白[25],其中38个包含YTH域。我们鉴定了一个额外的小麦基因TaDC1a-7D (TraesCS7D02G450100.1),该基因在其中间编码一个含有YTH结构域的蛋白,并被指定为小麦YTHDC组成员(表1)1).在Yue等人(2019)的研究中[25],TACPSF30-2(TRAESK6A01G138900.1)和TACPSF30-5(TRAESK6B01G167200.1)被指定为YTHDC蛋白。但是,在这两种蛋白质中没有鉴定过yth结构域。Tacpsf30-2和Tacpsf30-5定位于6A和6B染色体[25].然而,在我们的结果中,没有YTH鉴定以任何形式的染色体6(A,B和D)定位的基因。这些差异可能是由小麦基因组(IWGSC Refseq Annotations V1.0和V1.1)的不同版本1和1.1的注释产生的。染色体分布图显示了TaYTH基因被分散在所有三个小麦子的基因组与分散的染色体6.一种类似的模式之外的所有的染色体中还发现YTH基因A. thaliana O. sativa和M. Domestica.,但它不同于c .巨大成功,其中CsYTH基因位于三分之三的c .巨大成功染色体(13].
据报道,亚域蛋白质YTHDF和YTHDC利用保守机制来识别M6A,识别M6A的甲基部分的芳族笼子[6.那8.].YTHDF家族的蛋白质有一个WWW笼子,而ythdc在人类中有一个WWW类型的笼子。在本研究中,我们发现TaDFs的芳香笼由WWW组成,而TaDCs的芳香笼由WWY组成。这一规律适用于来自其他植物的YTHDC蛋白。这些分析表明,植物ythdc与动物ythdc在m6A结合方面存在差异。在动物中,ythdc被鉴定为两种类型,YTHDC1和YTHDC2。在YTHDC1中,YTH结构域位于蛋白质的中心部分,而YTH结构域位于YTHDC2的c端。在植物种类中,还鉴定出两种类型的YTHDC。而植物ythdc的YTH结构域均定位于蛋白质的中心部位,这与动物YTHDC1s相似。这说明植物YTHDC1s与动物YTHDC1s具有相似的分子机制。 In humans, YTHDC1 mediates pre-mRNA splicing by interacting with splicing factor [26].前mRNA拼接参与植物发育,性繁殖和非生物应激反应的调节[27那28那29那30.那31.那32.那33.那34.那35.].因此,植物YTHDC在前mRNA剪接优异进一步研究中的功能。另外,植物Ythdfs的N-Termini没有锌指域,如植物Ythdcs中的发现。这与建议一致,除了他们保守的yth结构域之外,YTHDC基于氨基酸序列与YTHDFS无关[6.].动物YTHDF蛋白在c端有YTH结构域,在n端有一个低复杂度区域。在这个低复杂度区域,在动物YTHDF蛋白中发现了几个富含P/Q/ n的斑块。本研究还在TaYTHs中发现了P/Q/ n富斑块。P/Q/ n富区被认为通过将YTH结构域蛋白定位到RNA衰减位点来调控含有m6a mrna的稳定性[36.那37.那38.].M6a与yth蛋白形成基碱基氢键,这些蛋白质增强了这些相互作用[7.].在人的YTHDF1和YTHDC1中,使用天冬酰胺或天冬氨酸与N形成氢键1虽然天门冬酰胺与N相互作用更强1m6a比天冬酸酸。然而,在一些小麦yth蛋白中,组氨酸可用于与n的相互作用1M6a。天冬酰胺和天冬氨酸是中性氨基酸,而组氨酸是碱性的。因此,M6a与小麦中的蛋白质的结合可能与其他植物和动物物种中的那些具有显着差异[6.那15].人YTHDC2是除C-末端yth结构域外,含有死箱RNA螺旋酶结构域的核细胞质蛋白。死箱RNA直升酶域域的蛋白质在展开双链RNA中的蛋白质中函数[39.].事实上,YTHDC2蛋白在展开5'-UTR中发挥作用,并增加靶基因的平移效率[40].然而,在植物界中尚未发现含有DEAD-box RNA解旋酶结构域的YTH蛋白。因此,读者对m6A的识别是否需要yth - related unwind仍是未知的。
小麦是世界上,它提供了蛋白质和热量摄入的人超过20%,围绕重要的作物。小麦的产量是尖刺的发展和结构密切相关的。许多信号通路已确定,参与秒杀的发展和建筑小麦的调控[41.],在此期间对基因表达和激素信号传导的调节发挥着关键作用。在我们的研究中,一套YTH在尖峰和小麦花的发展期间,基因在更高的水平表达。因此,这些高度表达YTH小麦穗中的基因可能与穗的发育和结构有关。耐生物和非生物多重胁迫的小麦种质资源的选择和创造是小麦育种面临的关键挑战[42.那43.那44.那45.那46.那47.那48.那49.那50.那51.那52.那53.那54.那55.那56.].我们的结果和先前研究的结果表明表达了YTH基因参与对各种胁迫的响应和植物发育[10那13那15那17那21].因此,小麦的功能YTH对非生物胁迫的反应中的基因值得进一步研究,以及这些YTH基因在小麦遗传改良中具有重要的应用价值。
结论
在这项研究中,39TaYTH在普通小麦(Triticum aestivum.l .)。系统发育分析表明,tayth可分为YTHDF (TaDF)和YTHDC (TaDC)两组。分析了基因的染色体位置和外显子-内含子结构,以及蛋白质的基序分布和结构域组织。此外,预测了TaYTH蛋白的芳香笼袋。TaDFs的芳香笼袋由色氨酸、色氨酸和色氨酸组成(WWW)。相比之下,这个口袋由TaDC蛋白质中的色氨酸、色氨酸和酪氨酸(WWY)组成。除一般的天冬氨酸或天门冬酰胺残基外,用来与N形成氢键1在M6A中,一些TADFB蛋白质可以利用该作用中的组氨酸。表达分析的结果揭示了TaDFa和TaDFb基因在各种组织/器官中高度表达。另外,表达了TaYTH基因在不同的非生物胁迫下发生变化。本研究结果为功能分析提供了基础TaYTH在未来。
方法
鉴定YTH基因在小麦
小麦YTH蛋白家族被鉴定为Yan等[57.].利用YTH域的保守序列建立隐马尔可夫模型,用于BLAST同源搜索。小麦的参考基因组序列和注释(GFF文件)从集合植物数据库(IWGSC RefSeq v2.0)下载。http://plants.ensembl.org/triticum_aestivum/).保守的Yth结构域也用于将小麦基因组编码的yth蛋白质爆破在网站上http://plants.ensembl.org/Multi/Tools/Blast[8.].此外,对本地小麦蛋白质数据库的BLASTP分析(E值<1×10- 5)通过使用来进行拟南芥和米yth结构域的蛋白质序列作为查询(附加文件2).
系统发育分析,基因结构和染色体位置
ClustalX2.1用于使用默认参数进行多个序列对齐。利用MEGA 6.0 (https://www.megasoftware.net/)和1000个引导复制。系统发育树由FigTree (http://tree.bio.ed.ac.uk/software/).tbtools软件[58.]和在线分析工具KnetMiner (https://knetminer.rothamsted.ac.uk/Triticum_aestivum/)用于在染色体中映射HTY基因的位置,并构建外显子系统结构的地图。
氨基酸序列分析
在线工具PSORT (https://www.psort.org/)被用于预测TaYTH蛋白质的亚细胞定位。在TaYTH蛋白的分子量和等电点进行使用网络工具EXPASY(预测https://web.expasy.org/compute_pi/).使用Web Tools CDD分析塔白蛋白的结构域(https://www.ncbi.nlm.nih.gov/)和expasy(https://prosite.expasy.org/).最后,利用TBtools对域图进行可视化[48.].通过模因(http://meme-suite.org/tools/meme)使用TBTools软件展出。使用DNAMAN8进行多种蛋白质序列比对。使用weblogo创建蛋白质保守基序的序列标志(http://weblogo.berkeley.edu/logo.cgi.).
数字基因表达模式分析
每百万表达值的成绩单TaYTH19组织/器官中的基因(谷物,胚根,胚胎,胚芽糖,胚乳,幼苗,根,根顶部分生成,茎,芽,射击顶端分类,叶子,旗帜离开,穗,小穗,引诱,小孢子,柱头和卵巢)和响应各种压力从小麦表达浏览器下载(www.wheat-expression.com)[24].使用TBtools构建相对表达水平的热图。
植物材料和生长条件
本研究中使用的常见小麦是Jimai22,冬小麦品种广泛种植在华北地区。Jimai22的种子由Yu秀东博士(山东农业大学)提供。小麦幼苗在山东农业大学的16小时光/ 8小时黑暗周期中在22℃下生长。从7天的幼苗中取样根,茎和叶子。为了对尖峰和花进行采样,Jimai22种子在4℃下首先在土壤中富集30天。然后将葡萄酒幼苗转移到温室中。尖峰和花卉分别从植物中取样30天和温室40天。
表达式的TaYTH基因分析采用qRT-PCR
如Zhao等人所述,使用Trizol试剂(Invitrogen,北京)提取总RNA。[59.].根据制造商的说明,使用Primescript RT试剂盒(Takara,Dian)的Primescript RT试剂盒(Takara,大连)逆转,总RNA逆转。使用合成超微克(Transgen,China)合成QRT-PCR的第一股CDNA。如Zhao等人所述进行QRT-PCR扩增。[60].利用3个生物重复和3个技术重复。Actin基因作为内对照。本研究中使用的引物序列列于附加文件10.
数据和材料的可用性
本研究中生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。在当前研究期间生成和分析的数据集可从相应的作者获得合理的请求。
缩写
- MW:
-
分子量
- M6A:
-
N6甲基腺苷
- PI:
-
等电点
- yth:
-
YT521-B同源性
参考
- 1.
杨y,hsu pj,chen y-s,杨yg。动态转录组体M.6.装饰:RNA代谢的作家,橡皮擦,读者和功能。细胞res。2018; 28(6):616-24。
- 2.
沉L,梁Z,古X,陈Y,张志贤ZWN,侯X,蔡WM,PC澳贝利克,刘升,俞H. N6甲基腺苷RNA修饰拍摄时调节干细胞命运拟南芥.DEV细胞。2016; 38(2):186-200。
- 3.
博迪Z,钟S,梅赫拉S,宋Ĵ,李H,格雷厄姆N,五月S,弗赖RG。腺苷甲基化拟南芥mRNA与3 '端相关,水平降低导致发育缺陷。植物科学,2012;3:48。
- 4.
钟S,李H,Bodi Z,按钮J,Vespa L,Herzog M,FRY RG。MTA是AN.拟南芥信使RNA腺苷甲基化酶并与性别特异性剪接因子的同源物相互作用。植物细胞。2008;20(5):1278 - 88。
- 5。
růžičkak,张m,campilho a,bodi z,kashif m,saleh m,eeckhout d,el-showk s,李h,zhong s.鉴定M6a mRNA甲基化所需的因素拟南芥揭示了保守的E3泛素连接酶HAKAI的作用。新植醇。2017;215(1):157 - 72。
- 6.
阅读转录组中的m6A: m6A结合蛋白。细胞生物学杂志。2018;28(2):113-27。
- 7.
徐C,王X,刘k,圆环素Ia,Qupel W,Li Y,Lu Z,He C,Min J. YTHDC1 YTH结构域选择性结合M6A RNA的结构基础。NAT CHEM BIOL。2014; 10(11):927-9。
- 8.
关键词:N(6)-甲基腺苷(m(6)a)读子族,YTH结构域关键词:生物信息学,基因组学,蛋白质组学,生物信息学
- 9.
迈耶KD,Jaffrey的SR。反思米6.读者,作家和橡皮擦。Annu Rev Cell Dev Biol。2017; 33:319-42。
- 10.
李D,张h,洪y,黄l,李x,zhang y,oou yang z,歌曲f。含有亚域的RNA结合蛋白家族的基因组鉴定,生化特征和表达分析拟南芥和米饭。Plant Mol Biol Rep. 2014;32(6): 1169-86。
- 11.
关键词:柑橘,YTH结构域,rna结合蛋白家族,全基因组鉴定,表达分析中华医学会神经科学分会。2019;144(2):79-91。
- 12.
Wang N,Yue Z,Liang D,Ma F.苹果和表达分析它们对衰老和非生物胁迫的反应性的含有yth结构域的RNA结合蛋白家族的基因组鉴定。基因。2014; 538(2):292-305。
- 13。
周y,胡L,江L,刘S.含有黄瓜中含有亚域系RNA结合蛋白家族的基因组鉴定及表达分析(Cucumis sativus).基因组织。2018; 40(6):579-89。
- 14。
洛克哈特J.三项研究的故事:揭示了M的关键作用6.一个读者。植物细胞。2018; 30(5):947。
- 15.
Scutenaire J,Deragon J-M,Jean V,Benhamed M,Raynaud C,Favory J-J,Merret R,Bousquet-Antonelli C.是yth结构域蛋白质Ect2是m6.所需的正常毛状体分支中的一位读者拟南芥.植物细胞。2018; 30(5):986-1005。
- 16。
魏L-H,宋P,王Y,吕Z,汤问,俞Q,小Y,张X,段H-C,佳G. m个6.通过影响mRNA稳定性,读者Ect2控制培养体形态拟南芥.植物细胞。2018;30(5):968 - 85。
- 17.
Arribas-Hernández L, Bressendorff, Hansen MH, Poulsen C, Erdmann S, Brodersen P. m6A-YTH模块控制发育时间和形态发生拟南芥.植物细胞。2018;30(5):952 - 67。
- 18.
张杰,艾德波,云凯,亨特AG,徐瑞,饶S,李qq,法尔肯DL。一种多聚腺苷酸化因子亚基,涉及调节氧化信号转导拟南芥蒂利亚纳.Plos一个。2008; 3(6):E2410。
- 19.
李忠,王锐,高原,王超,赵磊,徐宁,陈珂,齐森,张敏,蔡玉峰,等。的拟南芥CPSF30-L基因在硝酸盐信号中发挥着重要作用,并调节硝酸盐转化剂基因NRT1.1。新植物。2017; 216(4):1205-22。
- 20.
王楠,郭涛,孙旭,贾旭,王萍,邵勇,梁波,龚翔,马峰。二函数Malus hupehensis.(Pamp时)。Rehd。YTPs (MhYTP1和MhYTP2)在生物和非生物胁迫响应中的作用。植物科学。2017;261:18-27。
- 21.
王N,Guo T,Wang P,Sun X,Shao Y,jia x,梁b,qon x,ma f.mhytp1和mhytp2从苹果赋予多种非生物胁迫的耐受性拟南芥蒂利亚纳.植物科学与技术,2017;
- 22.
关键词:转基因苹果,MhYTP1, ABA,抗旱性,水分利用效率植物科学。2019;280:397 - 407。
- 23.
亚当斯KL,温德尔JF。植物的多倍体与基因组进化。植物生物学杂志。2005;8(2):135-41。
- 24.
Ramírez-gonzálezr,borrill p,lang d,Harrington S,Brinton J,Venturini L,Davey M,Jacobs J,Van Ex F,Pasha A.多倍体麦的转录景观。科学。2018; 361(6403):eaar6089。
- 25。
乐H,啮X,颜Z,维宁S. N6甲基腺苷调节机械在植物中:组合物中,功能和进化。植物Biotochnol J. 2019; 17(7):1194-208。
- 26。
肖伟,陈永胜,郝永杰,孙宝芳,孙海英,李安,平秀林,赖维英。核m6A解读器YTHDC1调控mRNA的剪接。摩尔细胞。2016;61(4):507 - 19所示。
- 27。
熊飞,任建军,余强,王莹莹,孔丽娟,Otegui MS,王小龙。AtBUD13影响pre-mRNA的剪接,对胚胎发育至关重要拟南芥.植物杂志2019; 98(4):714-26。
- 28。
熊F,任JJ,Yu Q,Wang Yy,Lu CC,Kong LJ,Otegui Ms,Wang XL。ATU2AF65B通过调节ABI5和FLC的前体信使RNA剪接,在脱粘酸中的开花中的开花拟南芥.新植物。2019; 223(1):277-92。
- 29.
王Y-Y,熊楼仁Q-P,王X-L。U2的辅助因子的作用:开花选择性剪接过渡的调控。J Exp Bot。2020; 71(3):751-8。
- 30.
撒切尔SR,周W,伦纳德A,王B-B,比蒂男,察斯特罗 - 海耶斯G,赵X,鲍姆加滕A,在玉米选择性剪接的李B.全基因组分析:景观和基因调控。植物细胞。2014; 26(9):3472-87。
- 31。
关键词:FT剪接,内源线索,温带禾本科植物abstract: Qin Z, Wu J, Geng S, Feng N, Chen F, Song G, Chen K, Li A, Mao L.Nat Commun。2017;8(1):1 - 12。
- 32.
朱财,陈MX,叶NH,石L,马KL,杨JF,曹YY,张Y,吉田T,弗尼AR。Proteogenomic分析揭示了可变剪接和翻译如脱落酸响应的一部分拟南芥幼苗。植物j . 2017; 91(3): 518 - 33所示。
- 33.
陈茂祥,朱凤英,王凤忠,叶乃华,高斌,陈欣,赵树松,范涛,曹玉玉,刘天佑。选择性剪接和翻译在水稻缺氧萌发过程中起着重要作用。实验机器人。2019;70(3):817-33。
- 34.
任RC,王立,张立,赵yj,吴jw,魏ym,张xs,赵xy。DEK43是一种p型五戊肽重复(PPR)蛋白,其负责玉米线粒体中NAD4的顺式剪接。J Intent Plant Biol。2019年。https://doi.org/10.1111/jipb.12843.
- 35.
Laloum T,马丁G,非生物胁迫响应杜克P.可变剪接控制。趋势植物SCI。2018; 23(2):140-50。
- 36.
傅Y,Dominissini D,Rechavi G,他C.通过可逆m介导的基因表达调节6.RNA甲基化。NAT Rev Genet。2014; 15(5):293。
- 37。
杨勇,孙保峰,肖伟,杨欣,孙海英,赵永林,杨永刚。动态的米6.一种修饰及其在mRNA剪接中的新兴调控作用。Sci公牛。2015;60(1):21-32。
- 38。
王X,吕Z,戈麦斯A,GC汉,粤Y,韩d,富Y,巴黎人男,傣族Q,贾G.ñ6.-甲基腺苷依赖的信使RNA稳定性调节。大自然。2014;505(7481):117。
- 39。
Zhu Dz,赵XF,刘CZ,MA FF,Wang F,Gao X-Q,张Xs。RNA直升酶的相互作用缺陷1和配子蛋白系数1涉及雌性配子体发育拟南芥.实验机器人。2016;67(19):5757-68。
- 40。
Tanabe A,Tanikawa K,Tsunetomi M,Takai K,Ikeda H,Konno J,Torigoe T,Maeda H,Kutomi G,okita K.RNA Helicase Ythdc2通过提高HIF-1αmRNA被翻译的效率来促进癌症转移.癌症吧。2016; 376(1):34-42。
- 41。
高X-q,王n,王x-l,张xs。小麦花序建筑:米饭的见解。趋势植物SCI。2019; 24(9):802-9。
- 42。
Gou J-Y, Li K, Wu K, Wang X, Lin H, Cantu D, Uauy C, Dobon-Alonso A, Midorikawa T, Inoue K. Wheat stripe rust resistance protein WKS1 reduces the ability of the thylakoid-associated ascorbate peroxidase to detoxify reactive oxygen species. Plant Cell. 2015;27(6):1755–70.
- 43。
关键词:面包小麦,JAZ蛋白,ABI5,种子萌发拟南芥.新植物。2019; 223(1):246-60。
- 44.
孙鑫,刘涛,宁涛,刘凯,段鑫,王鑫,王倩,安毅,关鑫,田建昌。利用籽粒大小和蛋白质相关性状的条件QTL定位进行小麦籽粒硬度的遗传分析。Plant Mol Biol Rep. 2018;36(1):1 - 12。
- 45.
关键词:小麦,苗期和成熟期,磷效率,QTL, QTL定位植物科学与技术,2017;
- 46.
张M,Gao M,郑,袁y,周X,gu y,张g,zha y,kong f,施氮中的qtl映射,在小麦幼苗和成熟阶段的农艺性状。mol繁殖。2019; 39(5):71。
- 47.
王S,Li QP,Wang J,等。YR36 / WKS1介导的PSBO磷酸化,光束II的外在构件,抑制了小麦的光合作用和赋予条纹耐抗抗性。莫尔植物。2019; 12(12):1639-50。
- 48.
张超,黄磊,张辉,等。一个具有重复3'UTRs的NB-LRR基因具有抗小麦和大麦条锈病的能力。Nat Commun。2019;10(1):4023。
- 49。
Chovancek E,Zivcak M,Botyanszka L等。瞬态热波可能会影响由于电容不足而导致的易感小麦基因型的光合容量。植物(巴塞尔)。2019; 8(8):282。
- 50。
郑敏,陈杰,石勇,等。密度对小麦木质素代谢的调控及其与抗倒伏性的关系。Sci众议员2017;7:41805。
- 51。
张克,张米,赵Z,任y,李Q,王W.小麦小吃1通过提高抗氧化能力来调节植物干旱胁迫性。SCI批准。2017; 7(1):7549。
- 52。
刘S,Sehgal SK,林M,Li J,Trick HN,Gill BS,白G. Taphs1中的独立错误拼接突变导致小麦驯化期间的预达发芽(PHS)抗性丧失。新植物。2015; 208(3):928-35。
- 53。
Yu G,Hou W,Du X,Wang L,Wu H,Zhao L,Kong L,王H.鉴定抗寒耐受性的小麦非特异性脂质转移蛋白。植物细胞批准。2014; 33(10):1757-66。
- 54。
田F,龚杰,张俊,张米,王G,李安,王W.增强蛋白膜蛋白的稳定性和抗氧化能力的稳定性促进了Tasg1小麦寿命突变体的干旱胁迫性。J Exp Bot。2013; 64(6):1509-20。
- 55。
Biswas DK,徐H,Li Yg,Ma Bl,Jiang Gm。对升高的CO的光合作用和生长响应的修改2通过臭氧在两种冬小麦中,不同年份的释放。J Exp Bot。2013; 64(6):1485-96。
- 56.
Bie X,Wang K,She M,Du L,Zhang S,Li J,Gao X,Lin Z,Ye X.编码Fructan生物合成酶的三个小麦基因的组合转化赋予了烟草中非生物胁迫的果实含量和耐受性胁迫。植物细胞批准。2012; 31(12):2229-38。
- 57.
Yan J,Su P,Wei Z,Nevo E,孔L.小麦和Aegilops Tauschii蛋白激酶基因家族的基因组鉴定,分类,进化分析和基因表达模式。植物mol biol。2017; 95(3):227-42。
- 58.
Chen C,夏R,陈H,何Y.TBOOLS,生物学家的工具包与用户友好的界面集成了各种生物数据处理工具。生物XIV。2018; 289660。
- 59.
赵学勇,洪平,吴建勇,陈晓波,叶兴国,潘云英,王军,张学森。tae- mir408介导的TaTOC1基因转录调控是小麦抽穗期调控所必需的。植物杂志。2016;170(3):1578 - 94。
- 60.
关键词:小麦,分蘖数,TaD27-B基因,六倍体小麦植物营养与肥料学报;2010;
致谢
我们要感谢审稿人的评论和有益的建议。
资金
中国国家自然科学基金(91935302)支持这项工作,重点是小麦产量特征的关键基因的鉴定和机制,以及国家转基因科学技术方案(2019ZX08010-003),重点是产量特征的遗传改善在小麦。资金机构没有参与数据的研究和收集,分析和解释和撰写稿件。
作者信息
从属关系
贡献
XQG,XSZ构思和设计了研究。JS,XMB,XQG执行了生物信息学分析。JS,NW进行了基因表达分析。XQG,XSZ,JS起草了稿件。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
太阳,J.,Bie,X.M.,Wang,N.et al。常见小麦中含亚域RNA结合蛋白家族的基因组型鉴定及表达分析。BMC植物BIOL.20.351(2020)。https://doi.org/10.1186/s12870-020-02505-1
收到了:
公认:
发表:
关键词
- 小麦
- 含有型域的RNA结合蛋白
- 表达分析
- 发展
- 非生物压力