- 研究文章
- 开放访问
- 发表:
小麦发育后期热激转录因子家族的热响应模式(Triticum aestivum.L.)和热容调节TaHsfA2-10
BMC植物生物学卷20.文章编号:364.(2020.)
摘要
背景
热休克转录因子(HSF.S)在大多数植物中存在,并在热能,转基因热敏和许多其他压力反应中起着中心作用。我们之前的论文识别至少82H.SF成员在小麦的基因组研究中(Triticum aestivum.L.)。在这项研究中,我们分析了HSF.在小麦发育后期的表达谱中,分离出明显的热响应基因TaHsfA2-10(GenBank登录号MK922287),并对该基因及其在水稻幼苗耐高温调控中的作用进行了分析拟南芥蒂利亚纳(L. Heynh。).
结果
在先进的发展阶段,小麦HSF.家族转录谱在叶和根中表现出不同的表达模式和不同的热响应HSF.S在正常生长条件下有不同程度的结构性表达。总的来说,A组和B组的大多数HSF.s的树叶,而表示C组HSF.S在根中表达量较高。几个人的表情HSF.无法检测到基因。热冲击(HS)引起叶片和根部四分之一基因的上调,而响应于HS,多种基因下调。高热响应基因TaHsfA2-10通过部分同源克隆分离出来。定量RT-PCR结果显示,TaHsfA2-10在正常生长条件下在小麦的各种组织和器官的各种组织和器官中表达。与非压力治疗相比,TaHsfA2-10高度上调,回应HS,H2O.2,和水杨酸(SA),并通过脱落酸(ABA)处理在两叶龄幼苗下调。烟草表皮细胞的瞬时转染揭示的亚细胞定位TaHsfA2-10在正常生长条件下的核中。表型观察表明TaHsfA2-10可以改善基底热能和获得转基因的热能拟南芥蒂利亚纳并修复T-DNA插入突变体的耐热性缺陷阿斯法布2在海关。与野生型(WT)幼苗相比TaHsfA2-10-Overxpressing线均显示出更高的叶绿素内容物和更高的存活率。酵母单杂交测定结果显示TaHsfA2-10transactivation活动。表达水平与热耐受性有关AtHsps当TaHsfA2-10替补拟南芥蒂利亚纳高于HS后的wt。
结论
小麦HSF.在正常情况下,家庭成员在高级发育阶段和HS之后表现出转录表达模式的多样化和特异性。作为HS,SA和H的显着敏感的转录因子2O.2,Tahsfa2-10涉及植物的热能调节,通过与相对的启动子结构域中的HS响应元件结合HSPS.并上调表达HSP.基因。
背景
由于温室气体排放,全球平均气温从1956年到2005年增加了约0.65°C [1].上升的温度已成为限制世界各地作物生长和发展的主要气候灾害之一[2].小麦(Triticum aestivum.禾谷是世界上许多国家的主要粮食作物,高产稳产是最重要的育种目标。然而,小麦作物经常遭受高温和干燥风的交叉胁迫,导致近期产量和质量双双下降[3.].因此要分析耐热的分子机制和开发小麦品种与热应力(HS)高电阻必要的。
植物热激转录因子(Hsfs)在调控植物耐热性方面起着重要作用。Hsfs可通过与启动子内HS响应元件(HSEs)结合,激活热休克蛋白(Hsp)基因及热耐受相关基因的表达[4.那5.那6.那7.].自克隆以来HSF.在20世纪80年代,许多慧聪一最近在许多物种的基因组范围内被发现[8.那9.那10.那11.那12.],包括第一植物HSF.来自番茄的基因(Solanum lycopersicum.L.)[13.].植物Hsfs分为A、B、C组,并根据不同的蛋白质结构进一步分为几个亚组[4.].的数量HSF.基因家族成员物种之间差别很大。到目前为止,研究确定了21个慧聪一in.拟南芥蒂利亚纳,16慧聪一番茄和82慧聪一在小麦[7.那14.].
最先前的研究慧聪一仅限于A1和A2HSF.在模式植物中的子类拟南芥蒂利亚纳和Solanum。Lycopersicum(S. lycopersicum)[15.那16.那17.那18.].当S. Lycopersicum HSFA1基因在低水平下组成型表达,并且在正常生长条件下,由基因编码的蛋白质定位于核和细胞质。HSFA2由于强细胞质定位信号而定位在细胞质中,而其核进入依赖于HSFA2至HSFA1的结合,以在HS期间形成杂寡寡项8.那17.].HSFA2.表达是严格诱导HS和HsfA2蛋白质之后连续或反复HS和从HS [恢复过程中可以积累8.那17.].只有一个HSFA2.在两者中存在拟南芥蒂利亚纳和番茄[13.].
拟南芥蒂利亚纳HsfA2定位于细胞核和细胞质,并可激活下游HSP.基因表达在athsfa1结合和激活后。什么时候Athsfa1.被删除,阿斯法布2可以进入核心并调节一系列的表达HSPS.和伴侣基因[18.].Athsfa1主要作为转录因子,而Athsfa2通过激活与活性氧和碳水化合物和碳水化合物和脂质代谢相关的基因的表达来调节获得的热能,以保持细胞膜稳定性在HS的后期[19.].此外,阿斯法布2能部分地执行某些功能Athsfa1.暴露于不同的热范围和氧气的压力和罐救援过程中Athsfa1.突变体的表型(20.那21.那22.].最近,AtHsfA2被发现调节HS诱导的跨代热记忆拟南芥蒂利亚纳通过直接激活H3K27ME3去甲基酶REF6(相对于早期流动6)[23.],建议HSFA2可以参与不同的热能调节[15.那16.那20.那21.那24.].
确定小麦Hsf基因的特性和功能的研究直到最近才开始。2008年,七TaHsfs在小麦中发现,其中一种基因被HS显著上调,表明这些TaHsfs帮助调节耐热[25.].此外,TaHsfA4a被镉胁迫上调并参与镉耐受性[26.].表达式的TaHsfA2d基因拟南芥蒂利亚纳幼苗的热能,盐度耐受性和耐旱性,幼苗在中等高温下呈现出呈现的生物质和产量[27.].对于幼苗的拟南芥蒂利亚纳表达TaHsf3,耐热性和耐寒性均有可能得到改善[28.] 2014年,56HSF.A、B、C家庭成员T. Aestivum.,其中许多是组成型表达,以及其他在子群A2,B2,和A6都显著由HS [上调29.].Tahsfa6f直接调节基因的表达TaHsps那TaGAAP(高尔基抗凋亡蛋白,GAAP)TaRof1(一种伴生伴侣),从而增强幼苗的耐热性[30.].TaHsfs在表达水平和对非生物胁迫包括热,盐度,干旱,冷[灵敏度变化31.].tahsfc2a.在小麦灌浆期高表达,其过表达上调了干旱、热和脱落酸(ABA)响应相关基因的表达,tahsfc2a.还通过aba介导的调控途径在发育小麦粒中提供主动的热保护[32.].
我们之前报道过Tahsfb2d.可以通过水杨酸(SA)信号通路调节HS反应,该通路依赖于H2O.2水平(33.].基础耐热性和获得耐热性均得到改善拟南芥蒂利亚纳过度表达TaHsfA2e,表达倍数增加HSP.不同的基因HSF.组[34.].HSP基因可以改善转基因的热能拟南芥蒂利亚纳虽然表达响应于HS是不同[34.].在另一个最近的报告中,我们确定了82小麦HSF.全基因组研究中的基因。这些塔希在渗透胁迫下,如SA、H2O.2和ABA在二叶老小麦幼苗中的表达。在82个小麦Hsf基因中,新鉴定出9个A2亚类成员和17个其他亚类成员[14.].然而,目前对这些基因的特性和功能知之甚少。
2006 - 2015年陆地平均气温比1850 - 1900年高1.53°C,气温升高导致作物产量下降[35.].据估计,全球气温每升高1℃,全球小麦产量就会下降6% [36.].因此,非常重要的是彻底调查HSF.小麦发育后期的基因表达谱,了解个体的耐高温调节功能HSF.HS反应期间的成员。这与A2亚类尤其相关,此前有报道称,该亚类对小麦发育后期获得耐热性非常重要[20.].这项研究的目的是调查小麦的表达特征HSF.并进一步阐明了小麦个体的耐热调节功能HSF..结果可以使生物功能和分子机制的进一步理解HSF.家庭成员和确定改进的小麦品种耐热性的靶基因。
结果
HS中HS中HSF基因的表达模式T. Aestivum.
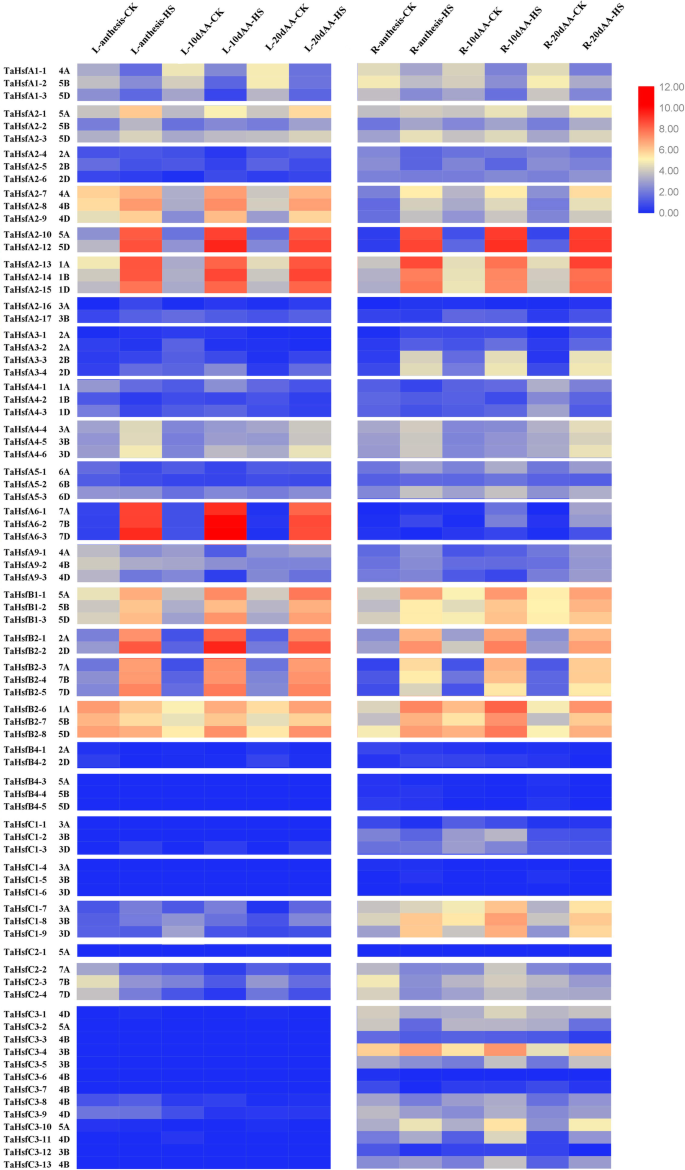
选取正常生长条件下和37℃HS后小麦花期、花期后10 d和20 d的旗叶和根,分析小麦的表达谱HSF.通过RNA-SEQ基因(图。1).八十小麦HSF.叶和根中均检测到家族基因,除TaHsfA2-11和TaHsfA2-18.转录的TaHsfs揭示了叶和根的复杂表达模式。正常情况下,小麦叶片和根系中大部分基因的表达谱在不同时期没有差异。部分基因在小麦开花期叶片中的表达量高于后两个发育阶段。这些基因包括A2亚类成员TaHsfA2-7那TaHsfA2-8那TaHsfA2-9那TaHsfA2-13,TaHsfB1成员,B2子类成员TaHsfB2-6那TaHsfB2-7那TaHsfB2-8,以及C2子类成员TaHsfC2-2那TaHsfC2-3,和TaHsfC2-4.表达水平Tahsfa1-1那Tahsfa1-2,和Tahsfa1-3在波动后两次发展阶段的叶子中增加,以及类似的表达轮廓TaHsfB1-1那TaHsfB1-2,和TaHsfB1-3在小麦根中观察到。总的来说,大部分是A类和B类慧聪一C慧聪一在基层较高水平表达。
小麦的基因转录概况HSF.在正常情况下,在先进发育期的叶子(L)和Roots(R)中的家族和热应激(HS)。绘制了Heatmap以说明80的相对表达谱TaHsfs由TBtools version0.66831。不同的颜色对应log2变换后的值。红色和蓝色分别表示每个转录本在每个样本中的相对丰度较高或较低。小麦仓6005幼苗在日光温室22°C/18°C(昼/夜)、光周期16 h/8 h/暗、湿度50%的条件下终生生长。在花期(fekes 10.5.2)热处理后60 min和90 min及随后10d (10d AA)、20d (20d AA)分别取样旗叶和根,进行RNA-Seq分析。每组分别采集3个花盆共50株单株,立即冷冻于液氮中提取RNA
HSF.表达式T. Aestivum.期间先进发展阶段表现出的多个HS反应模式(图1).在这两种叶和根,HSF.HS的表达水平有不同程度的提高,尤其是A2、B1和B2亚类基因的表达水平。特别是,TaHsfA2-10和TaHsfA2-12在HS下增加最明显。相比之下,三个TaHsfA1s在三个发展阶段中的树叶和小麦的根HS期间下调。三个A6子类成员的表达水平显着分别由HS叶上调,但不是在根。此外,部分同源基因TaHsfC1-7那TaHsfC1-8那tahsfc1-9,和两个TaHsfC3-4和HsfC3-10在根通过HS上调,但不是在树叶。此外,这些基因的表达均在正常和HS条件,包括所有子类成员B4,六亚类C1成员,在小麦叶片所有子类成员C3,所有子类成员B4和三个子类成员C1在根中检测不到。
扩增TAHSFA2-10 cDNA和编码蛋白的结构分析T. Aestivum.
的cDNA序列TaHsfA2-10克隆了来自年轻叶子的家乡克隆T. Aestivum.在37°C的HS后Cang 6005。全长序列TaHsfA2-10is 1119 bp long and encodes 372 amino acids.TaHsfA2-10,位于5AL染色体上,与之前鉴定的同源TaHsfA2-12染色体5DL [14.].Tahsfa2-10的氨基酸序列含有DNA结合结构域(DBD),寡聚域(OD),核定位信号(NLS),核输出信号(NES)和活化剂肽基序(AHA)。蛋白质相似性分析表明Tahsfa2-图10是高度相同AtHsfA2a状从山羊草属tauschii, HvHsfA2a大麦芽, BdHsfA2a二穗短柄草, PhHsfA2a来自Panicum Hallii.(图。2).
小麦TaHsfA2-10与其他植物HsfA2蛋白序列比对将TaHsfA2-10蛋白序列在NCBI (www.ncbi.nlm.nih.gov).将鉴定的蛋白序列用Clustal X 2.0软件进行比对,然后用DNAMAN 8.0 (www.lynnon.com.)软件。Tahsfa2-10:HSFA2-10来自Triticum aestivum.L., GenBank登录号:QEQ56178;AtHsfA2a-like: HsfA2a-like从山羊草属tauschii,GenBank登录号:XP_020200656;HVHSFA2A:HSFA2A来自大麦芽,Genbank登录号:Baj88237;BDHSFA2A:HSFA2A来自二穗短柄草,GenBank登录号:XP_003559435;phhsfa2a:hsfa2a fromPanicum Hallii., GenBank登录号:XP_025817582。DBD: dna结合域;HR-A和HR-B:七核苷酸重复;OD:寡聚化域;NLS:核定位信号;NES:核出口信号;AHA:激活肽基序。黑框代表HR-A,绿框代表HR-B。黑色:相同的氨基酸;白色:不同的氨基酸
Tahsfa2-10不同组织和器官的表达T. Aestivum.在非生物压力下
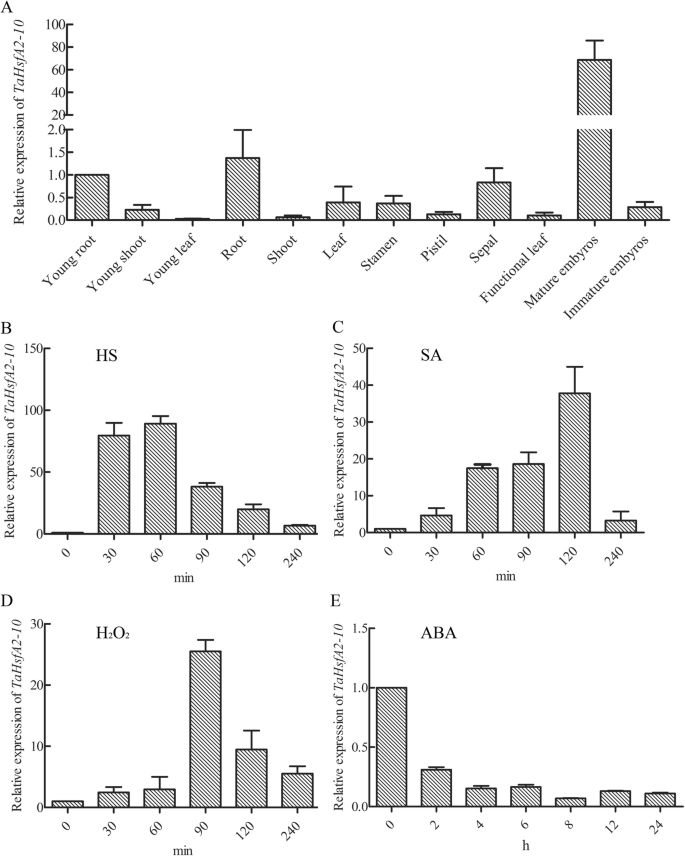
QRT-PCR分析显示TaHsfA2-10在不同的发展阶段许多组织和器官中组成型表达T. Aestivum.,具有成熟胚胎的最高表达水平,其他组织和器官的表达水平相对较低,表明这一点HSF.基因表达存在组织特异性变化(图。3.一个)。TaHsfA2-10HS上调了叶片中的表达水平,在90 min时达到峰值(图)。3.b)。TaHsfA2-10施用外源SA后,其水平也增加了(图。3.C)和H2O.2(图。3.d)分别在120分钟和90分钟后,峰值水平近40倍和25倍,然后在经受不同的应力后90分钟。相比之下,表达TaHsfA2-10由外源aba下调(图。3.e)。
表达水平TaHsfA2-10在组织和器官(一)在HS的不同时间处理的叶子中(b),SA(c)H2O.2(d)和阿巴(e).当two-leaf-old wheat seedlings grown in a growth chamber were subjected to the following treatments: 37 °C HS(b),0.8 mm sa(c),10毫米h2O.2(d)对于30,60,90,120,240分钟,分别为200μmaba(e)for 2, 4, 6, 8, 12, 24 h. The new expanding leaves were sampled in different time interval of treatments. Each treatment was repeated three times with totally 40 individual plants sampled each biological experiment, and each biological experiment included three technical replicates. The values of young root and 0 h were normalized as 1 for A and B-E, respectively. The reference gene wastarp15。每个柱值代表三次生物实验的平均值±SD。原始数据参见附加文件2
TaHsfA2-10亚细胞定位
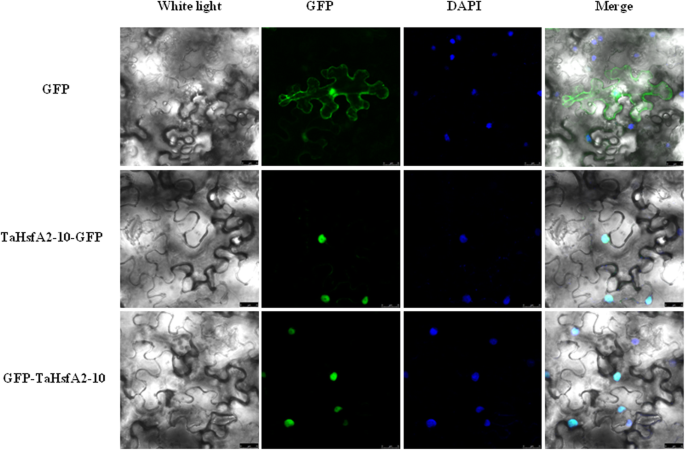
的重组载体TaHsfA2-10用GFP融合的N-末端(PCAMBIA1300-TAHSFA2-10-GFP)和重组载体TaHsfA2-10以GFP融合的c端(pCAMBIA1300-GFP-TaHsfA2-10)构建。两个结构体和空载体pCAMBIA1300-GFP分别渗入烟草(尼科尼亚塔哈瓦姆分别为表皮细胞。观察结果显示,TaHsfA2-10在正常生长条件下为细胞核定位(图2 - 10)。4.).
酵母中TaHsfA2-10反式活化活性分析
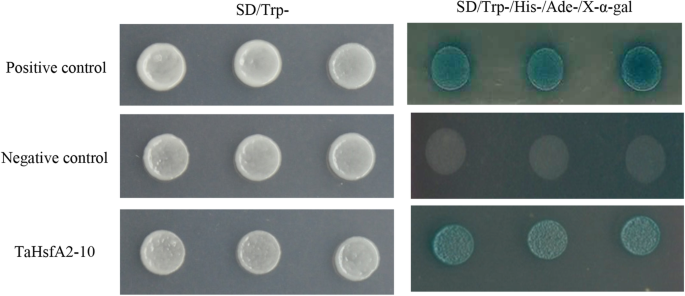
TaHsfA2-10的反式激活活性,评价在酵母培养基SD /色氨酸−/他−/ ade.−/ x-α-gal。如图1所示。5.其中,含pGBKT7-53的阳性对照生长良好,而阴性对照生长缓慢。pGBKT7-TaHsfA2-10转化的酵母生长与阳性对照相似(图)。5.).提示TaHsfA2-10在酵母中具有反式激活活性。
TaHsfA2-10基因对转基因植物耐热性调控的评价拟南芥蒂利亚纳
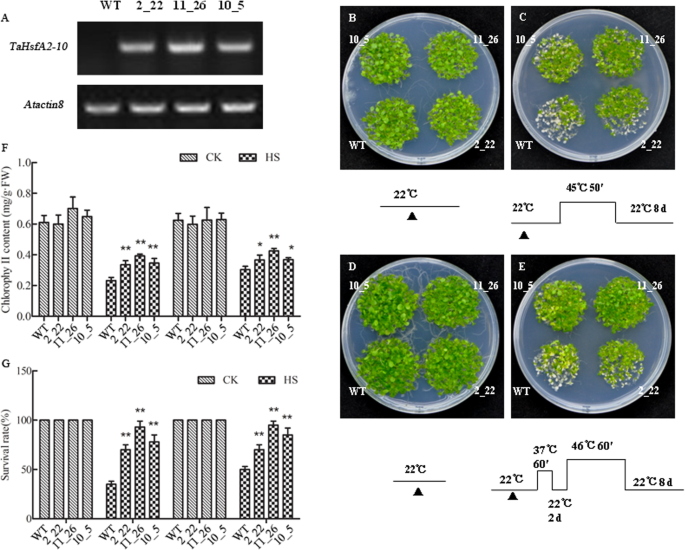
三个转基因拟南芥行overexpressingTaHsfA2-10选择T3代,具有SEMI-RT-PCR确认TaHsfA2-10表达(图。6.一个)。接下来,基础和获取的热能TaHsfA2-10- 表达拟南芥用WT幼苗评价幼苗。在正常生长条件下观察到三种转基因系和WT植物之间没有明显的表型差异(图。6.B,D);但是,所有的生长活力TaHsfA2-10- 在两种类型的HS制度治疗后,植物植物高于WT对照。在产生的转基因中,线11_26显示出最强的基础(图。6.c)和获得的热能表型(图。6.e)。随着散热性的增加,叶绿素水平和存活率降低,但转基因系具有显着更高的叶绿素含量(图。6.f)和存活率(图6.g)与HS条件下的WT相比。线11_26的幼苗具有最高的叶绿素含量(图。6.f)和存活率(图6.克)不同基因型中。
耐热表型、成活率和叶绿素含量TaHsfA2-10转基因拟南芥在正常条件下幼苗和野生型(WT)并进行HS。A.TaHsfA2-10半rt - pcr检测WT和3个转基因株系T3代的相对表达量。每个平板每行共50株,试验重复3次。单、双星号表示WT与过表达品系在P.< 0.05和P. < 0.01 level (t检验),分别。B-E: WT控制和三条线TaHsfA2-10过表达拟南芥(第2_22线,线10_5和线11_26)用于分析基础(BT)和获取的热能(AT)。五天幼苗(在温室中生长,温度为22°C / 18°C,16小时光/ 8小时黑暗循环和100 mmol光子的灯- 2年代- 1)用在每个表型图像下列出的不同HS制度处理,并且在22℃下回收幼苗8天,然后观察到表型并拍摄。B-C.:BT的测定,D-E.: AT的测定。B,D:在正常情况下的幼苗;c、e:用不同的HS制度治疗幼苗。以上为生存率(G)测量并收集每根线的玫瑰花胶以测量叶绿素含量(f).将每个株系50株单株分为3部分进行叶绿素含量测定;每次热处理需要三个板。每个柱值代表三次重复实验的平均值±SD;原始数据参见附加文件2和其他文件3..单一和双星号表示P <0.05和P <0.01级WT和过表达线之间的显着差异(t检验),分别
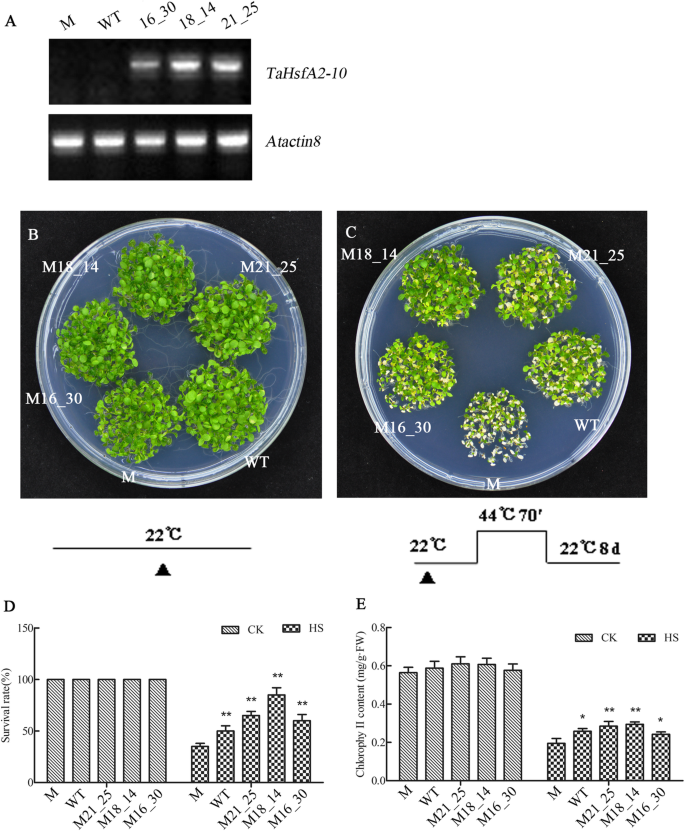
救出的热能拟南芥蒂利亚纳突变体athsfa2 by tahsfa2-10
三个TaHsfA2-10/阿斯法布2创建互补线M16_30,M18_14,M21_25,并用于调查热能。半rt-PCR分析证实了表达TaHsfA2-10在三个T3转基因品系,而WT和突变阿斯法布2缺乏TaHsfA2-10表达(图。7.一个)。表型观察显示wt的生长活力,阿斯法布2,和TaHsfA2-10/athsfA2线在正常生长条件下相似(图。7.b)。然而,在HS处理后,在恢复期间枯萎于不同程度的幼苗(图。7.c)。wt的增长活力比那个更好阿斯法布2而互补系M16_30和M21_25的生长活力与WT相似,且M18_14的变色量最小,说明TaHsfA2-10可以拯救突变体的热能缺陷阿斯法布2.与野生型相比,M18_14的存活率和叶绿素含量也更高,athsfA2突变株M16_30和M21_25株系7.d,E)HS治疗后。
耐热表型、成活率和叶绿素含量atHsfA2-10恢复拟南芥幼苗和wt在正常情况下和hs。A.TaHsfA2-10在突变体(M),WT和通过半RT PCR T3代三条互补线相对表达;B-C.WT,athsfA2突变体及其三个TaHsfA2-10采用互补纯合品系(16_30、18_14和21_25)测定其恢复耐热性。对5日龄幼苗进行不同HS处理,每个表型图如下所示。在22℃下恢复幼苗8天后,观察和拍照表型。以上为生存率(d)计算,收集每根线的玫瑰花叶,以测量叶绿素含量(e).B-C.幼苗正常情况下和HS;将每个株系50株单株分为3部分进行叶绿素含量测定;每次热处理需要三个板。每个柱值代表三次重复实验的平均值±SD;原始数据参见附加文件2.单一和双星号表示P <0.05和P <0.01级WT和过表达线之间的显着差异(t检验),分别
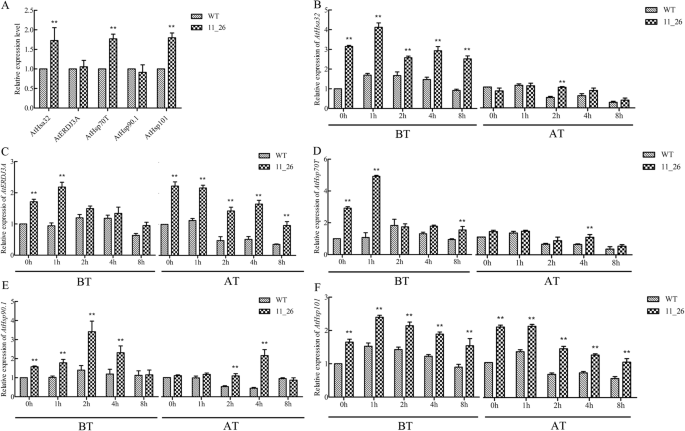
Tahsfa2-10-调节HSP基因表达与HS有关拟南芥蒂利亚纳
的表达水平HSPS.,包括AtHsa32那AtERDJ3A那Athsp70t.那AtHsp90.1,和AtHsp101,通过QRT-PCR测量。结果表明,这五个表达水平AtHsps当TaHsfA2-10转基因线11_26略高于正常条件下WT植物中的转基因线11_26(图。8.一个)。个人HSP.HS后各基因均有不同程度的表达上调,治疗1小时或2小时后出现表达高峰。的表达水平AtHsfa32和Athsp70t.在HS中被4-5次上调TaHsfA2-10与WT相比(图。8.B-F)。通过HS生产获得的热电势之后,最多的表达水平HSP.除了用于的基因和转基因线11_26中,基因逐渐降低,除外Athsp90.1,HS后4h, 11_26表达量高于WT。然而,在恢复期间,AtHsp90.1在转基因株系中含量高于野生型株系。总的来说,HSP.HS诱导基础热耐受性后表达水平高于HS诱导获得性热耐受性后表达水平。
当拟南芥WT和HSP基因表达tahsfa2-10-在正常条件下过表达的线(一)和BT和AT的HS(B-f)表示.5日龄T3代幼苗TaHsfA2-10在琼脂平板上的转基因系11_26和WT进行HS,然后,莲座叶物在用于qRT-PCR分析不同时间间隔取样。同时,对在莲座叶TaHsfA2-10在两种热处理之前分别进行转基因线11_26和WT。对于在正常条件下转基因系的HSP基因表达,WT的值标准化为1(一).用于基因表达的热处理(B-f)表示,0小时的值归一化为1.每个条形值代表三次实验的平均值±SD,在每个实验中进行三种技术复制,并将原始数据引用附加文件2.双星号表示P <0.01级(P <0.01)的WT和过表达线之间的显着差异(t检验)
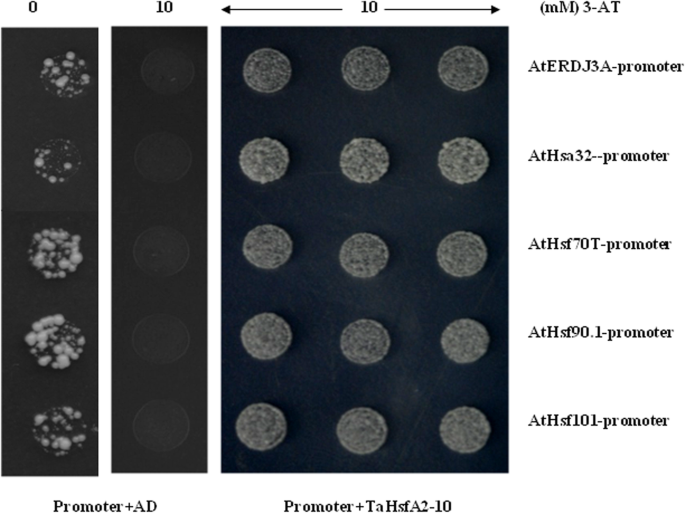
五个AtHsps然后选择在使用酵母单杂交测定法在正常条件下研究HSE在促进剂中的直接结合HSE与TAHSFA2-10。结果表明,Tahsfa2-10可以与所有测试的启动子中的HSE结合AtHsps(图。9.);进一步表明TaHsfA2-10可以调控HSP.通过与HSEs结合来表达基因。
讨论
增加全球气温对植物生长,发展和繁殖引起多样化和深远的影响[37.那38.],大大威胁到全球作物产量。植物已经进化了复杂的表观遗传机械,以快速响应加热[39.].的表达可以产生耐热性HSP.HS诱导的基因。在小麦发育后期,获得性耐热性是决定HS反应的主要因素[40].从模式植物报告显示的子类,成员HSFA2S.在调整所获得的热能的中央角色,从HS恢复以及转基因的ThermomeMory中进行恢复[8.那23.].因此,在本研究中,我们鉴定了在中晚期发育阶段表达的基因T. Aestivum.和评估个体的耐热性调节作用HSF.基因家族成员。
我们的转录组测序结果显示,普通小麦的Hsf基因在小麦发育的高级阶段表现出复杂的表达曲线和热响应模式(图。1).多数类A和B的HSF.S在麦子叶中主要表达,而C类HSF.S在小麦根中表达较高。正常情况下,各发育阶段的基因表达无明显差异。然而,TaHsfA2-7那TaHsfB2-6那TaHsfC2-2并且它们在叶子的开花阶段更高度表达了它们的两个同种型基因。表达水平的三个TaHsfA1观察了三个相同的趋势小麦的后期发育阶段的叶成员增加,TaHsfB1小麦根的成员。这些结果表明塔希S在组织类型中不同地表达。薛等人的研究。[29.结果表明,成员A2b/c/e、A5b、A6c/d/e主要在胚乳中表达,B1亚类成员在生殖器官中表达量高于幼叶和幼根,C1和C2成员在小麦胚中表达量较高。在我们的实验中,这些基因在叶和根中的表达都很低。然而,我们的研究结果表明,B4亚类成员和3个C1成员在根系中几乎检测不到,而Xue的研究表明,B4亚类成员在小麦的根和胚中都有表达。我们推测,这些差异可能是由所检测的特定小麦品种的差异造成的。像子类B4成员,13TaHafC3s在正常情况下,在我们的实验中,在叶片中显示出非常低的表达水平,但在我们的实验中检测到三个先进的开发阶段。
HS下RNA测序结果表明,3的表达TaHsfA1sHS处理下,小麦叶片和根系的基因表达均下调(Fig。1),这可能与采样时间有关,因为HsfA1s始终比早期的热量响应HSFA2S.并且在HS的早期阶段的功能[15.].三者的表达HSFA6S.HS仅在小麦花期及之后两个检测阶段表达上调,表现出组织特异性表达。小麦TaHsfA6f在绿色器官中组成型表达,但在HS期间明显上调。TaHsfA6f是一种转录激活因子直接调节TaHsps那TaGAAP,和TaRof1小麦基因及其基因调控网络对耐热性有积极影响[30.].拟南芥AtHsfA6b作为ABA介导的应激反应的下游调节剂,对热胁迫抗性是必需的,尽管它对ABA而不是热响应[41.].目前还没有更多的报道HSFA6S..此外,在我们的实验中,同系物的表达TaHsfC1-7那TaHsfC3-4,和TaHsfC3-10仅在小麦根中上调,并且亚类B4构件的表达水平,亚类C1的六个成员和13个亚类C3构件在HS期间几乎不可检测,而亚类B4和三个C1成员的表达在根中几乎不可检测三个检测到的小麦阶段。这些结果扩展了使用段和共同作者报告的双叶老小麦幼苗,其中子类HSFC3S.主要对ABA有反应[14.],提示这些基因可能主要参与ABA信号转导。这些结果进一步支持了积极主动的存在TaHsfC2介导的保护机制,涉及ABA依赖性途径,用于调节小麦粮食中的热保护[32.].我们的研究结果丰富了小麦的表达特征慧聪一通过对小麦的时间和空间表达提供多个底层perceivementHSF.家庭。顺式元素分析结果表明大多数Tahsfcs.启动子含有ABA响应的主题,只有启动子TAHSFC3-1,TAHSFC3-2和TaHsfC3-11包含热敏感基序(附加文件1).此外,TaHsfB1s和最Tahsfb2s.在叶片和根中都上调,表明它们参与了小麦的热反应。所有TaHsfB1s和Tahsfb2s.在他们的推动者中包含HSE(附加文件1),这表明这些基因可以由上游调控慧聪一.到目前为止,很少有基因是已知的泰姆斯参与耐热性调控作用,以往的研究表明,他们担任的共调节因子或阻遏HSFA.缺少定义的激活域[42.].赵等人。报道了Tahsfb2d.能同时提高转基因植物的基础和后天耐热性吗拟南芥蒂利亚纳[33.),拟南芥幼苗改变了CaHsfB2从鹰嘴豆表现出较高的抗旱性和耐热性[43.].需要对类的特征和功能进行大量工作HSFBS..
模型植物的研究表明,HSFA2.其成员参与许多渗透胁迫的响应,包括热、盐、氧、干旱,以及ABA和sa介导的信号转导。一旦激活HSFA1.那HSFA2.诱导许多的表达HSP.基因作为密钥耐热调节因子HS期间[27.].其中82HSF.在我们以前的研究中发现的基因TaHsfA2s基因表现出多样化的响应模式来渗透胁迫[14.].在这项研究中,作为A2成员之一,TaHsfA2-10在小麦开花期和发育后期的叶和根中均有明显的表达。1)和成熟胚胎(图。3.a)中,也显著通过热,SA,和H上调2O.2在两叶龄幼苗(图3.B-d),这表明TaHsfA2-10也许涉及小麦不同显影阶段的热能调节作为关键因素。据报道SA令人兴奋阿斯法布2表达取决于h的存在2O.2[44.],Tahsfb2d.通过植物中的SA介导的信号通路来调节HS响应,这取决于H的存在2O.2[33.].tahsfc2a.似乎在通过ABA介导的调节途径开发小麦粒度的热保护中的积极作用[32.].在我们的结果和Duan的报告中[14.],TaHsfA2-10ABA在二叶老苗和小麦发育后期的表达降低,推测TaHsfA2-10也许通过SA介导的信号通路参与多样化的热调节调节,但不涉及ABA介导的信号转导,虽然是启动子TaHsfA2-10包含热量和ABA响应性CIS元素(附加文件1).但是,这个途径是否依赖于h2O.2需要更多的研究。
只有一个HSFA2.基因在两个番茄和拟南芥,番茄HSFA2局部化在细胞质中,HSFA2的核易位需要依赖于在HSFA2和HSFA1之间形成的芳杉α[17.],虽然拟南芥HsfA2定位于细胞核和细胞质。与上述不同的是,通过GFP融合的N端和C端两个结构体,证实TaHsfA2-10定位于核内。我们推测,也许核定位使Hsf能够更快地诱导下游基因表达,从而提高耐热性。尽管它们都包含诸如DBD、NLS、NES、AHA等功能域,但同一子类的不同本地化HSF.存在于不同的物种,这表明的多样性和复杂性HSF.特点和功能。
进一步的表型观察为上述假设提供了令人信服的证据(图。6.和7.).通过表达TaHsfA2-10in.拟南芥,我们发现TaHsfA2-10既提高了幼苗的基底耐热性和获得性耐热性的转基因Arbidopsis thaliana..此外,TaHsfA2-10可以拯救突变体的热能缺陷阿斯法布2在海关。生长的活力TaHsfA2-10/阿斯法布2互补线优于WT,建议Tahsfa2-10 Perthap具有比Athsfa2更强的热能监管能力。存活率和叶绿素含量测量结果同时提供强大的证据。以前的研究表明,热耐受性,盐度耐受性和耐旱性TaHsfA2d- 表达拟南芥与野生型相比,在中等高温下生长的幼苗可以积累相对较多的生物量和产量[27.].到现在为止,没有任何报告TaHsfA2-10.更多样化的基因功能TaHsfA2s需要在未来的研究中深入调查。
作为分子伴侣,HSP.在保护免受应激损伤和协助蛋白质折叠、细胞内分布和降解方面起着核心作用[45.那46.那47.].HSF.S可以特异性地与启动子区域中的HSE结合HSP.基因作为关键调节因子HSP.基因[4.].功能性HSEs的约束TaHsfA2b以前在启动子区域确定Tahsp17.那TaHsp26.6那tahsp70d.,和Tahsp90.1-A1,暗示Tahsp17.和Tahsp90.1-A1可能的直接目标是TaHsfA2b[29.].在这项研究中,定量RT-PCRAtHsp90.1那Athsp70t.那AtHsp101那AtERDJ3A,和AtHsa32表明,这些HSP.基因在WT和转基因中升高到HS的4小时内的不同程度(图。8.).AtHsp101和AtHsa32出现涉及长期收购在耐热拟南芥[20.那48.那49.]我们的结果表明他们还参加了基础热能。事实上,TaHsfA2-10可诱发HSP.在转基因的表达拟南芥虽然最终的表达水平相对较低(图。8.转基因的)。拟南芥细胞系,AtHsfA2激活的表达HSP.基因喜欢AtHsp101那AtHsfa32,和ATHSP-CI.但不是AtHsp90在没有的情况下HSFA1.在非重读条件下的成员表达式[22.].TaHsfA2e和TaHsfA2f大幅上调Athsp70t.与基底的提高表达或获得耐热性[32.那50.],和ZmHsf05可以激活AtHsp21和AtHsp90HS期间的表达[24.]揭示不同的HSFS通过激活特殊性涉及热响应HSPS.表达式。酵母单杂交分析进一步表明这些检测HSP.基因为TaHsfA2-10的直接靶基因。9.).这些结果证实TaHsfA2-10上的调节作用HSP.提示不同的基因表达HSF.同一子类的成员只激活某些表达HSP.不同基因对热耐受性的调节。
结论
我们的结果扩展了小麦的表达特性HSF.通过在管理小麦的时间和空间表达的基本机制获取新的见解HSF.家庭成员。TaHsfA2-10是HS的一些明显反应的基因之一。Tahsfa2-10在酵母中显示出反式激活活性,并激活了与热能相关套件的激活表达HSP.基因在转基因拟南芥蒂利亚纳植物。TaHsfA2-10改良了基础耐热性,获得了转基因植株的耐热性拟南芥幼苗并救出突变体的热能表型缺陷阿斯法布2在海关。这些调查结果丰富了解多样性和特异性HSF.表达的小麦。这一结果也有助于进一步研究其生物学功能和分子机制HSF.小麦耐热性遗传改良的家族成员及靶基因鉴定。
材料和方法
植物材料,生长条件,以及胁迫处理
当T. Aestivum.在本研究中使用的品种苍卡6005由河北省省农业和林业科学院(E116.83,N38.33)提供。这种小麦品种是冬小麦,总增长期为约244天。它的热量和耐盐声誉,主要种植在河北省东南部。选择的种子在0.1%HgCl中灭菌表面210分钟,反复蒸馏水冲洗,然后在托盘中发芽。当芽尺寸约为1厘米时,它们分为两组。将一个约30个芽移植到一个含有Hoagland营养溶液的网状物中的一个罐中,并将其他组芽在4℃下富含40d,然后转移到盆栽土壤(土壤:蛭石,3:1)中的大盆中转移到大盆中每壶8株植物。在22℃/ 18℃(日/夜)的温室中培养植物,具有16 h / 8h光/暗循环,50%湿度约为150μmol光子m- 2年代- 1光强度。对于应力处理,用HS,H处理带有两片叶子的幼苗2O.2, SA或ABA在不同的时间遵循赵的论文中描述的方法[33.].对于HS处理,将40个幼苗进入含有在另一个腔室中在37℃下预热的Hoagland营养溶液的新锅中,然后处理30,60,90,120,240分钟。对于H.2O.2治疗,将40个幼苗放入含有Hoagland营养液的新锅中,终浓度为10mm H.2O.2对于30,60,90,120,240分钟。对于SA治疗,将40个幼苗放入含有Hoagland营养液的新锅中,终浓度为10mm SA,30,60,90,120,240分钟。对于ABA治疗,将40个幼苗进入含有Hoagland营养溶液的新锅中,终浓度为10mm ABA 2,4,6,8,12,24小时。在应激处理后,将第二膨胀叶从每个处理的所有实验中获得。年轻根,幼小射击和幼叶被取样在小麦生长阶段令人畏惧6.0。在小麦生长阶段Feekes 10.5.2时对根,芽,叶,雄蕊,雌蕊,萼片和功能叶(旗叶)进行取样。在小麦生长阶段令人毛11.1和Feekes 11.4中获得未成熟的胚胎和成熟胚胎。所有QRT-PCR结果来自三个生物实验,每个实验都包括三种技术复制。在花序中(Feekes 10.5.2),10Aa和20 daa,每壶8株植物的罐子在37℃下转移到新的生长室。在热处理60分钟(叶子)和90分钟(根)和90分钟(根)中的样品在液氮中冻结的样品进行采样,用于RNA-SEQ分析HSF.家人表达。
的T-DNA插入突变体线SALK_008978通过绮容嫦娥博士(农业生物技术研究中心,中央研究院,台北),将其命名为提供阿斯法布2来自拟南芥生物资源中心(俄亥俄州州立大学,美国)。WT(生态型哥伦比亚)的种子,阿斯法布2将转基因株系进行表面灭菌,在含1% (w/v)蔗糖和0.8%凝胶的MS培养基上播种,4℃保存3 d。植物在22°C/18°C(昼/夜)、16 h/8 h的光/暗循环和50%的湿度条件下,在约100 μmol photons m下生长- 2年代- 1光强度。
RNA提取
小麦的不同组织的总RNA和拟南芥蒂利亚纳was extracted using the RNarose Reagent Systems kit (Shanghai Huashun Biotechnological Co., Ltd.) according to the manufacturer’s protocol, and genomic DNA contamination was removed by RNase-free DNase I. A NanoDrop 2000 (Thermo Fisher Scientific, Rockford, USA) was used to detect the RNA concentration and quality.
小麦家庭HSF的RNA-SEQ分析
对胁迫处理后的开花小麦(fekes 10.5.2)和开花后小麦旗叶和根进行RNA-Seq分析。RNA-Seq分析方法如下[14.].各样品的总RNA,50株植物提取并通过无RNase的DNase I的安捷伦2100生物分析仪(安捷伦科技,CA,USA)去除基因组DNA用于检测RNA的完整性。For RNA sample preparation, about 2 μg RNA of each sample was used as input material. The sequencing libraries were prepared for Illumina by VAHTSTM mRNA-seq V2 Library Prep Kit. The paired-end sequencing of the library was carried out by the HiSeq Xten sequencers (Illumina, San Diego, CA, USA). The sequenced data quality was evaluated by FastQC (version 0.11.2). And the raw reads were selected by Trimmomatic (version 0.36). The clean reads to the wheat reference genome was mapped by HISAT2 (version 2.0) using default parameters. The gene expression abundance of the transcripts was calculated by String Tie (version 1.3.3b). DEGs (differentially expressed genes) were determined by DESeq2 (version 1.12.4). Each sample was detected by RNA-Seq analysis once. A heatmap was drawn to illustrate the relative expression profiles of wheatTaHsfs被TBtools version0.66831 [51.].
TaHsfA2-10 cDNA和序列分析的克隆
使用SuperScript IV第一链合成系统(Invitrogen)合成1 μg纯化的RNA。引物为:正向引物:5 ' -CGGGTTTGGTTCTTTGGA-3 ';反向引物:5 ' - CCTTCATCTTCTTTCGCTCA-3 '。采用高保真度酶Pyrobest (TaKaRa)进行PCR扩增。PCR体系和反应步骤参照[33.].当reaction mixture contained 1× reaction buffer, 2.5 mM dNTP mixture, 1 μL first-strand cDNA, 20 μM forward primer, 20 μM reverse primer and 2 U DNA polymerase in a total volum of 50 μL. The reaction procedure were: 1 min at 94 °C, 32 cycles of 10 s at 98 °C, 30 s at 56 °C, 1 min at 72 °C, and final extension 5 min at 72 °C.
通过实时定量PCR表达分析
用于表达分析TaHsfA2-10在小麦中,用于扩增的特定引物TaHsfA2-10基于5'-UTR的序列设计(正向底漆:5'-caccttcgggtagccccctg-3',反向引物:5'- gaaaatgtcgccctc-3')。内部参考基因是tarp15(f:5'-gcacacgtgcttttgcagataag-3'; R:5'-GccctcaagctCaAccataact-3')[29.].将幼根的表达量设为1进行组织特异性表达分析,小麦胁迫处理0 h的表达量设为1。的表达式AtHspsin.拟南芥蒂利亚纳,TaHsfA2-10转基因品系11_26 (T3代纯合子)。5日龄莲座叶拟南芥幼苗在热处理后0 h、1 h、2 h、4 h和8 h取样,如耐热试验部分所述。五个拟南芥选择Hsp基因进行表达分析。内部参考基因是atactin8.并且0小时的WT的表达水平设定为1.使用的引物在附加文件中列出4..
PCR反应为20 μL, SYBR Premix Ex为10 μLTaq.II, 0.8 μL 10 μM正向引物,0.8 μL 10 μM反向引物,1 μL cDNA第一链,7.4 μL ddH2O. PCR反应采用7500 Real-time PCR系统(Applied Biosystems, USA)进行,反应步骤参照[33.].P.CR reactions were predenaturated at 95 °C for 30 s, then performed 40 cycles of 5 s at 95 °C and 34 s at 60 °C. The data were analyzed using the 2-ΔΔCT反应后的方法。每组实验包括3个生物学重复,每个生物学样品包括3个技术重复。数据用每次实验三个生物重复的平均值±标准误差表示。
利用烟草表皮细胞瞬时表达测定TAHSFA2-10亚细胞定位
对于具有GFP的TAHSFA2-10的N末端融合,特异性引物(正向引物是5'-GacgagctgtacaAgGagctcATGGACCCCTTTCAC-3'和反向引物是5'-cgatcgggggaatcgagctcTCATGGTAGCTGCGGG-3'。带下划线的字母是限制酶网站囊我分别和粗体字属于编码序列TaHsfA2-10。)被设计通过PCR扩增TaHsfA2-10的编码区。PCR的产物连接到载体pCAMBIA1300-GFP消化用限制性酶囊我(质粒图是附加文件6.B).对于TaHsfA2-10与GFP的c端融合,需要特异性引物(正向引物为5 ' -GAGAACACGGGGGACTCTAGA)ATGGACCCCTTTCAC-3'和反向引物为5'-GCCCTTGCTCACCATGGATCCctggtagctgcggggggc.-3'。带下划线的字母是限制酶网站XBA.我和Bam嗨,分别,粗体字母属于编码序列TaHsfA2-10。)用于扩增编码序列TaHsfA2-10然后用限制酶消化后,将其连接到表达载体载体pcambia1300-gfp中XBA.我和BamHI(质粒图谱是附加文件6.C).使用ClonExpress II试剂盒(Vazyme, Nanjing, China)根据制造商的方案构建35S CaMV启动子驱动的重组子,并转化为CaMV启动子根癌土壤杆菌EHA105细胞,用于烟草表皮细胞浸润。空载体pCAMBIA1300-GFP作为对照,研究仅表达GFP的地方。处理后的烟草幼苗在温室中生长,在150 μmol s下,昼夜循环16 h/8 h(23°C/19°C)- 1米- 2光强度和50%的相对湿度为3天。在烟草表皮细胞用10μg/ ml dapi染色5分钟并用生理盐水冲洗后,使用Confocal Zeiss Microsystems Meta510(Zeiss,Oberkochen,Germany)检查染色表皮的荧光。
酵母中的转录激活活性和单杂化测定
根据制造商的酵母进行转录激活活性测定法(Takara,China)。编码区TaHsfA2-10通过引物PCR克隆(正向引物为5'-GAGGAGGACCTGCATATGATGGACCCCTTTCAC-3'和反向引物是5'-gttatgcgcgcggcagtcactggtagctgcg.-3'。带下划线的字母是限制酶网站濒死经历我和PST.我分别,粗体字母属于编码序列TaHsfA2-10。)由酵母表达载体pgbkt7消化濒死经历我和PST.我(质粒图是附加文件6.d)。由T7启动子驱动的构建体,PGBKT7-53作为阳性对照或空载体PGBKT7分别用PGAdT7的阴性对照转化为AH109,酵母细胞。指数增长中的酵母细胞稀释至OD600在SD/Trp缺陷培养皿上生长−/他−/ ade.−/ x-α-gal。然后将板置于30℃直至酵母细胞增长良好。最后,3-5天后拍摄酵母细胞。
进行酵母单杂化测定以检测TAHSFA2-10和启动子之间的结合活性AtHsps根据由Li等人描述的方法。[24.].简单地说,利用引物(正向引物为5 ' -GCCATGGAGGCCAGTGAATTC)进行PCR,获得TaHsfA2-10的编码区ATGGACCCCTTTCAC-3 ',反向引物为5 ' -CAGCTCGAGCTCGATGGATCCtcactggtagctgcg.-3'。带下划线的字母是限制酶网站生态ri和Bam分别为HI,黑体字母属于编码序列TaHsfA2-10)构建载体pGADT7生态ri和BamHI(质粒图谱是附加文件6.E).不同的启动子序列AtHsps使用PCR使用引物克隆(附加文件5.)并构建成载体phis2.1消化生态ri和囊我(质粒图是附加文件6.F)。所述pGADT7中-TaHsfA2-10由T7启动子和pHIS2.1启动子由最小HIS3启动子驱动的不同构建体驱动的转化到酵母细胞Y187。该SD /色氨酸−/亮氨酸−/他−在测定中使用含有3-氨基-1,2,4-三唑)的选择性培养基。酵母细胞在拍摄拍摄前3-5天在30℃下增长3-5天。
代的转基因拟南芥蒂利亚纳线
WT和T-DNA插入突变体阿斯法布2(SALK_008978,拟南芥生物资源中心,俄亥俄州立大学拟南芥蒂利亚纳(哥伦比亚生态型)用于遗传转化。Seeds were surface sterilized with 75% alcohol for 30 s then with 10% sodium hypochlorite for 10 min. Sterile seeds were sown on 0.5x Murashige and Skoog (MS) medium (containing 1% sucrose and 0.8% gelrite, San-EiGenFFI Inc., Osaka, Japan, 1x MS salts and vitamins, pH 5.8) in plastic Petri dishes. After incubation for 3 days at 4 °C in the dark to ensure synchronized germination, plants were grown in a growth chamber under normal conditions (22 °C/18 °C with 16 h light/8 h dark cycles and light intensity at 100 mmol photons m- 2年代- 1).
编码区TaHsfA2-10通过使用引物PCR扩增(正向引物:5'-GAGAACACGGGGGACTCTAGAATGGACCCCTTTCACGGC.-3 ',反向引物:5 ' -CGATCGGGGAAATTCGAGCTCTCACTGGTAGCTGCGGGG-3'。带下划线的字母是限制酶网站XBA.我和囊我分别,粗体字母属于编码序列TaHsfA2-10)。PCR产物经纯化,将目的质粒经酶切后克隆到双元载体pCAMBIA1300中XBA.我和囊我(质粒图是附加文件6.a)。由35s Camv启动子驱动的所得构建体转化为根癌土壤杆菌应变GV3101。然后将结构转化为WT和拟南芥蒂利亚纳突变体阿斯法布2如克劳等所描述的真空条件下使用花浸法使用花卉浸渍方法。[52.].在含有25mg / ml氢霉素的MS板上选择所有转基因植物,直至筛选T3代纯合。
RT-PCR分析转基因素
将纯化的mRNA样本100 ng,使用逆转录RT试剂盒(Invitrogen公司,Carlsbad, CA, USA)合成第一个cDNA链。所有聚合酶链反应均使用Pyrobest DNA聚合酶(Takara Biotech Co. Ltd)进行,反应混合液共25 mL,其中10 × Pyrobest缓冲液,2.5 mL;2.5 mM dNTP混合物,2 mL;cDNA第一链,2 mL;20 mM正向引物,0.25 mL;20 mM反向引物,0.25 mL;Pyrobest DNA聚合酶,0.25 mL;ddH2o,17.75ml(前底漆,5'-Acgcccttcctgaac-3',反向引物,5'- atctgctgctgctttctgc-3')。内部参考基因是atactin8.(正向底漆:5'- CTATTGTCTGTGACAATGG-3';反向底漆:5'-aaccctcgtagataggca. − 3′). The reaction program was as follows: 98 °C for 10 s; 55 °C for 5 s; 72 °C for 2 min, 30 cycles. The products were ligated into the T-vector (pEasy-blunt simple cloning kit, TransGen Biotech, Beijing, China) for sequencing (Shanghai Biotech Co.).
耐热性分析
对于基底热能测定,WT,突变体阿斯法布2,和三个独立的T3代纯合转基因拟南芥使用线。对于基底热能,WT和WT的5天幼苗TaHsfA2-10在45℃下对转基因系和琼脂平板进行热冲击50分钟。对于获得的热能测定,WT和WT的5天幼苗TaHsfA2-10琼脂平板上的转基因系在37℃下保持60分钟,然后在22℃下回收2d,并在46℃下进行HS 60分钟。用于救出的热能测定,5天大的WT,突变体阿斯法布2,和TaHsfA2-10琼脂平板上的互补线幼苗在44℃下进行HS 70分钟,然后在22℃下允许在22℃下生长8天,并取得照片。每平方线的50多种植物被每块板使用,实验重复三次。
叶绿素含量测定
如先前由Li等人描述的,叶绿素含量被分光光度测量。[53.].大约0.2克鲜叶拟南芥蒂利亚纳被纳入含有20ml丙酮和乙醇混合物的封端试管(丙酮:乙醇:DDH2o,4.5:4.5:1.0)。在叶片完全柔和后过滤匀浆。根据滤液的A645和A663的值计算叶绿素A和叶绿素B的含量。
可用性数据和材料
支持本文的结论的数据集可在NCBI-SRA存储库中获得[Prjna604299https://www.ncbi.nlm.nih.gov/bioproject/prjna604299.],文章和其他文件。
缩写
- HSF:
-
热冲击转录因子
- HS:
-
热休克
- SA:
-
水杨酸
- 阿坝:
-
脱盐酸
- WT:
-
野生型
- HSP:
-
热休克蛋白
- HSE:
-
HS响应元素
- DBD:
-
dna结合域
- OD:
-
寡聚化域
- nls:
-
核定位信号
- 新经济学院:
-
核输出信号
- 啊哈:
-
活化剂肽图案
参考资料
- 1。
朴松,蔡鹏,黄宇,沈志,彭松,李军,周林,刘华,马勇,丁勇。气候变化对中国水资源和农业的影响。大自然。2010;467:43-51。
- 2。
所罗门S,秦DH。物理科学依据。剑桥:IPCC:气候变化,剑桥大学出版社;2007年。
- 3.
姜志强,刘志强。由于气候变化和灌溉,华北平原受到致命热浪的威胁。Nat Commun。2018;9:2894。
- 4。
Nover L,Scharf Kd,Gagliardi D,Vergne P,Czarnecka-Verner E,Gurley WB。HSF世界:植物热应激转录因子的分类和性质。细胞应激伴侣。1996; 1:215-23。
- 5。
Nover L,Bharti K,Doring P,Mishra Sk,Ganguli A,Scharf Kd。拟南芥和热应激转录因子世界:我们需要多少热应激转录因子?细胞应激伴侣。2001; 6:177-89。
- 6。
李尤,冯。科斯库尔-多林P,维林E,沙夫。植物热应激反应的复杂性。植物学报。2007;10:310-6。
- 7。
郭敏,刘建华,马旭,罗德兴,龚振华,卢明辉。植物热胁迫转录因子(HSFs)的结构、调控和响应非生物胁迫的功能。植物学报2016;7:114。
- 8。
沙夫KD,海德H,霍菲尔德I,Lyck R,施密特E,新的参数在线L的番茄的Hsf系统:HsfA2需要相互作用HsfA1高效核输入,并且可以在细胞质热应激颗粒进行本地化。Mol Cell Biochem。1998; 18:2240-51。
- 9。
拟南芥转录抑制因子的研究进展。acta botanica yunnanica(云南植物研究). 2009;
- 10。
米塔尔d,查克拉巴蒂S,萨卡A,辛格A,格罗弗A.热休克因子基因家族在水稻:基因组组织和转录物表达响应于高温,低温和氧化胁迫仿形。植物生理学生物化学。2009; 47:785-95。
- 11.
林YX,江鹤,楚兹,唐XL,朱谟,程富。玉米热休克转录因子家庭的基因组鉴定,分类及分析。BMC基因组学。2011; 12:76。
- 12.
唐R,朱W,宋X,林X,蔡Ĵ,王男,杨问:全基因组热休克转录因子的识别和功能分析的山芋。前植物SCI。2016; 7:490。
- 13。
沙夫KD,玫瑰S,Zott W,Schoffl女,新的参数在线L.三番茄对热应激转录因子具有显着的同源性的酵母HSF的DNA结合结构域的区基因编码。EMBO J. 1990; 9:4495-501。
- 14。
段S,刘B,张Y,Li G,Guo X. Guo X. Triticum Aestivum L. BMC基因组学中热休克转录因子家族的基因组型鉴定和非生物应激响应模式。2019; 20:257。
- 15.
刘春春,廖海涛,常云云。A1类热激因子(HSFA1s)在拟南芥中响应热和其他胁迫的作用。植物学报2011;34:738-51。
- 16。
西泽A,薮田Y,吉田E,丸田T,吉村K,Shigeoka S.拟南芥热休克转录因子如A2响应于几种类型的环境胁迫的关键调节剂。植物杂志2006; 48:535-47。
- 17。
Heerklotz D,Doring P,Bonzelius F,Winkelhaus S,Nover L.核进出口的平衡决定了番茄热应激转录因子HSFA2的细胞内分布和功能。Mol Cell Biochem。2001; 21:1759-68。
- 18。
Mishra Sk,Tripp J,Winkelhaus S,Tschiersch B,Theres K,Nover L,Scharf Kd。在复杂的热应激转录因子家族中,HSFA1在番茄中的热能调节器具有独特的作用。基因开发。2002; 16:1555-67。
- 19。
李力,陈QJ,高XQ,齐BS,陈妮,徐SM,陈j,王XC。热冲击转录因子AthSFA2调节与应力相关的基因表达,并增加拟南芥中热量和氧化应激的耐久性。科学中国塞尔C浆液科。2005; 35:398-407。
- 20.
张艳艳,刘慧聪,刘玉宁,迟文涛,王正恩,常胜,王天涛。热诱导转录因子HsfA2在拟南芥获得的耐热性的扩展中是必需的。植物杂志。2007;143:251 - 62。
- 21.
Schramm F,Ganguli A,Kiehlmann E,Englich G,Walch D,Von Koskull Douring P.热应激转录因子HSFA2用作拟南芥中热应激反应中的基因子集的调节放大器。植物mol biol。2006; 60:759-72。
- 22.
刘健康,Charng Yy。拟南芥A1和A2热冲击因子在不同的非生物应激反应和发育中的常见功能。植物理性。2013; 163:276-90。
- 23.
刘杰,冯立,古X,邓X,邱q,李琦,张y,王m,邓y,王E.H3K27ME3脱甲基化酶-HSFA2调节循环在拟南芥中策划转基因热敏。细胞res。2019; 29:379-90。
- 24.
李国良,张海宁,邵辉,王国英,张云英,张玉杰,赵丽娜,郭晓丽,Sheteiwy MS. ZmHsf05,玉米热激转录因子ZmHsf05改善拟南芥atsfa2突变体的耐热性,修复atsfa2突变体的耐热性缺陷。植物科学。2019;283:375 - 84。
- 25.
在热敏感和宽容的小麦秦d,吴H,彭H,姚Y,倪Z,李Z,周C,太阳Q.热应激反应转录组分析(小麦L.)利用小麦基因组阵列。BMC基因组学。2008; 9:432。
- 26.
shen D, huang JU, Lee J, Lee S, Choi Y, An G, Martinoia E, Lee Y. anologo of a class A4 heat shock transcription factor HsfA4a (HsfA4a)植物细胞。2009;21:4031-43。
- 27.
从小麦Chauhan保持H,库拉纳N,瓦尔P,库拉纳JP,库拉纳P.种子优先热休克转录因子提供非生物胁迫耐受性和产量增加的转基因拟南芥热应激环境下。Plos一个。2013; 8:e79577。
- 28。
张SX,许ZS,李PS,杨升,魏YQ,陈男,李LC,张GS,马YZ。在转基因拟南芥TaHSF3的表达增强耐受极端温度。植物mol biol报告。2013; 31:688-97。
- 29。
薛gp,sadat s,drenth j,mcintyre cl。来自Triticum Aestivum的热休克因子家族响应于热和其他主要的非生物胁迫及其在热休克蛋白基因调节中的作用。J Exp Bot。2014; 65:539-57。
- 30.
薛桂平,邓德思J,陈志强。TaHsfA6f是一种转录激活因子,调控小麦(Triticum aestivum L.)的一系列热胁迫保护基因,包括之前未知的Hsf靶标。J Exp Bot. 2015; 66:1025-39。
- 31。
关键词:小麦,HSFs,高温,非生物胁迫功能整合基因组学。2019;19:497-513。
- 32。
胡XJ,陈d,林恩麦金太尔C,费尔南达Dreccer男,张ZB,DrenthĴ,Kalaipandian S,常H,薛GP。热休克因子C2A充当在通过ABA介导的监管途径发展籽粒热保护主动的机制。植物细胞ENVIRON。2018; 41:79-98。
- 33。
赵LN,刘ZH,段SN,张YY,李GL,郭XL。克隆和热休克转录因子基因TaHsfB2d的表征和耐热性的调节作用。Acta Agron Sin。2018; 44:53-62。
- 34。
张yj,张yy,张hn,qin n,li gl,guo xl。小麦热休克转录因子基因Tahsfa2e热能传导中的特征与调节作用。Acta Agron Sin。2018; 44:1659-69。
- 35。
核心创作团队。In: Arneth AF, Denton F, editors。特别报道:气候变化与土地。农业与环境:IPCC:气候变化与土地,剑桥大学出版社;2019.
- 36。
Asseng S, Ewart F, Martre P, Rotter RP, Lobell DB, Cammarano D, Kimball BA, Ottman MJ, Wall GW, White JW,等。气温上升降低了全球小麦产量。Nat Clim Chang. 2014; 5:143-7。
- 37。
Pauli H,Gottfried M,Duleringer S.最近的植物多样性变化欧洲的山峰。科学。2012; 336:353-5。
- 38。
Lobell DB,Schlenker W,Costa-Roberts J.自1980年以来的气候趋势和全球作物生产。科学。2011; 333:616-20。
- 39。
刘继,冯立,李茹,肝毒素热响应的遗传和表观遗传控制。前植物SCI。2015; 6:267。
- 40.
LarkindaleĴ,霍尔JD,奈特MR,拟南芥突变体的Vierling E.热胁迫表型牵涉在采集耐热的多种信号途径。植物理性。2005; 138:882-97。
- 41.
黄玉春,牛超英,杨华荣,金忠良。HsfA6b热胁迫因子连接ABA信号通路和ABA介导的热响应。植物杂志。2017;172:1182 - 99。
- 42.
ikeda m,mitsuda n,ohme-takagi m. rapidopsis hsfb1和hsfb2b充当用于表达热诱导的HSF的阻遏物,但积极调节所获得的热能。植物理性。2011; 157:1243-54。
- 43.
Ma H,Wang Ct,杨B,Cheng Hy,Wang Z,Mijiti A,Ren C,曲Gh,张H,MA L. carhsfb2,B类热冲击转录因子,参与不同的发育过程和各种应力响应在鹰嘴豆(Cicer Arietinum L)。植物mol biol报告。2016; 34:1-14。
- 44.
Snyman男,Cronje MJ。热休克因子的调制伴随Hsp70的番茄幼苗水杨酸介导的增强。J Exp Bot。2008; 59(8):2125-32。
- 45.
阿加勒·冯,哈普尔福。分子伴蛋白在细胞质蛋白折叠中的作用。Semin Cell Dev Biol。2000; 11:15-25。
- 46.
倒下CA,Heckathorn SA。线粒体小型热休克蛋白保护NADH:在植物中热应激期间电子传输链的泛醌氧化还原酶。费用。1998年; 430:246-50。
- 47.
Heckathorn SA,Downs Ca,Sharkey Td,Coleman JS。富含甲硫氨酸的致氯化体热冲击蛋白在热应激期间保护光系统II电子传输。植物理性。1998; 116:439-44。
- 48.
Charng Yy,Liu HC,Liu Ny,HSU FC,KO SS。拟南芥HSA32是一种新型热休克蛋白,对于在适应后在长期恢复期间获得的热电势至关重要。植物理性。2006; 140:1297-305。
- 49.
林美,柴国强,高善,匡丽华,鲁赫,张洋洋。热激蛋白101和热胁迫相关的32-KD蛋白之间的正反馈回路调节长期获得的热耐受性,说明水稻品种对热胁迫的不同反应。植物杂志。2014;164:2045-53。
- 50。
张yy,赵立,张yj,段sn,li gl。小麦(Triticum aestivum)热冲击转录因子基因Tahsfa2f的生物学特性和耐热调节作用。Jagri Biotech。2019; 27:825-35。
- 51。
TBtools是一个为生物学家提供的工具箱,它集成了各种hts数据处理工具和用户友好的界面。BioRxiv 289660。2018年,10.1101/289660。
- 52。
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16:735-43。
- 53。
李慧聪,张海宁,李国良,刘振华,张义明,张慧敏,郭小林。玉米热激转录因子基因ZmHsf06的表达增强了转基因拟南芥的耐热性和抗旱性。植物生态学报。2015;42:1080-90。
确认
感谢张宜勇博士(台北中央研究院农业生物技术研究中心)的支持阿斯法布2突变体的种子。
资金
这项工作是由中国的国家重点研究发展计划(2018YFD0300504),河北省自然科学基金项目河北省自然科学基金重点项目(C2016301085),(C2019301133),以及技术创新工程的支持河北省(494-0402-JBN-S2XB,494-0402-JBN-C7GQ)的现代农业。所有拨款,仅供资金,但不影响研究设计和实验结果。
作者信息
从属关系
贡献
GL和XG设计实验和写文章。SY,HZ和YZ1进行的大多数实验。YZ2进行载体构建和亚细胞定位实验。GW和YL修改了文章。作者阅读并同意最终的文本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
竞争利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
郭,Xl。那Yuan, Sn., Zhang, Hn.等。小麦发育后期热激转录因子家族的热响应模式(Triticum aestivum.L.)和热容调节TaHsfA2-10.BMC植物BIOL.20.364(2020)。https://doi.org/10.1186/s12870-020-02555-5
收到:
接受:
发表:
关键词
- 热冲击转录因子
- 小麦
- Eexpression模式
- 耐热性
- 转录活性
- 绑定活动