抽象的
背景
病毒感染植物会干扰植物蛋白的表达和亚细胞定位。potyvirus是植物感染RNA病毒中最大、最具经济破坏性的一类。在病毒感染的细胞中,至少有两种potyvirus蛋白定位于细胞核,但原因仍部分未知。
结果
在本研究中,我们检测了一个二倍体马铃薯株系(茄属植物tuberosumL.)感染马铃薯A病毒(PVA;属potyvirus.;并与健康叶片所得数据进行了比较。采用无凝胶液相色谱-串联质谱联用技术鉴定了马铃薯v2-108株中807个核蛋白;在这些蛋白质中,至少在两个健康叶子样本中检测到了370种。在至少两个健康和pva感染的叶片样本中,共有313种蛋白质;其中8个蛋白有差异积累。从pva感染的叶片样品中检测到16种蛋白质,而其他16种蛋白质是健康叶片所特有的。Dnajc14蛋白仅在健康叶片中检测到,而不同的核糖体蛋白、核糖体生物发生蛋白和RNA剪接相关蛋白在pva感染叶片的细胞核中大量表达。在pva感染的叶片样品中鉴定了两个病毒编码蛋白。
结论
结果表明,PVA对马铃薯叶片核糖体和剪接相关蛋白的影响尤为显著。这些数据增加了我们对potyvirus感染和细胞核在感染中的作用的理解。据我们所知,这是对马铃薯叶片核蛋白组的首次研究,也是对植物病毒侵染后核蛋白组发生变化的少数研究之一。
背景
病毒感染改变植物的稳态,包括基因表达,抑制植物的抗病毒防御,增强病毒倍增并在整个植物组织中传播。在这方面,植物细胞蛋白质蛋白质的分析可以在伴随病毒攻击中涉及的宿主途径上揭示,以及病毒利用的途径来规避宿主防御。实际上,分析方法的改进允许监测病毒感染后植物蛋白质蛋白质的变化[1那2那3.那4.那5.那6.那7.].
potyviruses(属potyvirus.;Potyviridae)是感染植物的RNA病毒中最大、最具经济危害的一类[8.].例如,马铃薯病毒A (PVA)和马铃薯病毒Y (PVY)感染马铃薯(茄属植物tuberosumL.,家庭Solanaceae),这是世界上三个最重要的食物作物,米饭和小麦。PVA造成的产量损失高达40%[9.].potyvirus引起整个细胞以及细胞器(如叶绿体)蛋白质组的变化[10].在马铃薯品种Desiree和表达水杨酸盐羟化物的转基因和转基因的转基因中,比较了响应于PVY菌株NTN(PVY-NTN)感染的转录组和蛋白质组的动态变化。表达水杨酸盐羟基化酶的转基因,催化了NADH依赖性转化水杨酸盐到儿茶酚[4.那11].Stare等人的转录组分析[11]强调了病毒诱导的变化的动态,特别是关于光反应和糖代谢相关基因的调节。他们对马铃薯叶片蛋白质组的分析显示,共有339种蛋白质主要参与光合作用、糖酵解、氧化还原电位调控、翻译后修饰、RNA调控和DNA合成[4.].在这些蛋白中,有21个蛋白的细胞水平在PVY感染后发生了改变。差异蛋白主要参与初级光合作用,还参与氮代谢、DNA合成、辅助因子和维生素代谢,以及蛋白质的合成、降解和转运。蛋白质组和转录组分析结果显示两者没有明显的相关性[4.].
病毒感染可能影响植物蛋白的亚细胞定位,并诱导细胞膜的形态变化[12那13].例如,一些植物蛋白,包括翻译真核起始因子4E (eIF4E)、聚(A)结合蛋白、热休克蛋白70和翻译延伸因子1A,被重新分配到potyvirus 6k2诱导的膜性复制囊泡中[14那15那16那17].类似地,宿主细胞之间的poty病毒的运动涉及植物细胞壁在植物细胞壁上对蛋白质的特异性靶向,包括病毒编码的圆柱夹杂蛋白和p3n-pipo蛋白[18].
感染植物的RNA病毒在细胞质的膜结构中复制。然而,由于未知的原因,它们的一些蛋白质定位于病毒感染细胞的细胞核[19].例如,Potviruses的RNA依赖性RNA聚合酶(复制酶)(也称为核包容蛋白B,NIB)和核包容蛋白A(NIA,病毒蛋白酶,负责加工大型疗法多蛋白中大多数蛋白水解蛋白)发现在植物细胞核中。NIA的核定位由蛋白质的N近端部分控制,所述蛋白质含有二分核定位信号[20那21]. NIa的N-近端部分还编码病毒基因组连接蛋白(VPg),该蛋白通过一个次优的裂解位点与NIa分离[20].VPg与核仁和Cajal小体中的纤颤素相互作用[21]在核和核仁中,核糖体蛋白S6激酶[22].此外,VPg和/或NIa将植物poly(A)结合蛋白、DEAD-box RNA解旋酶样蛋白、decapcap蛋白2 (DCP2)、eIF4E和eIF(iso)4E招募到细胞核[14那15那23那24那25].靶向核的靶向细胞质DCP1 / DCP2颗粒的形成,这可能破坏萝卜染色叶片病毒RNA的降解损伤[24].
进一步了解病毒感染过程中植物细胞核蛋白组发生的变化,有助于理解核在RNA病毒感染过程中的作用。然而,据我们所知,关于这一主题的研究只有一项已发表,即报道了辣椒植物核蛋白组(甜椒L.)用烟草马赛克病毒挑战(TMV,属Tobamovirus),它会引发辣椒植物的超敏抗性反应[26]. 结果表明,TMV接种叶片细胞核中含有6种对照植株模拟接种叶片细胞核中未发现的蛋白质[26].
本研究的目的是比较分析健康和potyvirus感染马铃薯植株叶片的核蛋白组。栽培马铃薯是一种杂合子同源四倍体,有48条染色体。为了简化分析,我们选用了一个二倍体(2n = 2x = 24)的PVA易感种间马铃薯株系。采集系统感染的叶片,获得pva感染细胞比例最高的叶片样本。研究结果将有助于我们进一步了解细胞核在病毒感染中的作用,进而为控制作物病毒感染提供新的策略。
结果
核蛋白质组S. Tuberosum.
本研究所选用的二倍体马铃薯系v2-108的家系中含有茄属植物物种phureja、tuberosum chacoense那sparsipilum.和stenotomum[27那28]. 用系统感染PVA的植物进行了三个实验,从叶片细胞中分离出核蛋白。从健康马铃薯叶片中分离的核蛋白作为对照。利用马铃薯基因组参考序列,在健康马铃薯和PVA侵染马铃薯叶片的核蛋白样品中,共鉴定出807个差异蛋白S. Tuberosum.组Phureja,克隆DM1-3(注释v3.4)[29].当两种或更多种肽(包括至少一种独特的肽)匹配已知的蛋白质序列时,认为蛋白质以假发现率(FDR)<0.05鉴定为蛋白质。
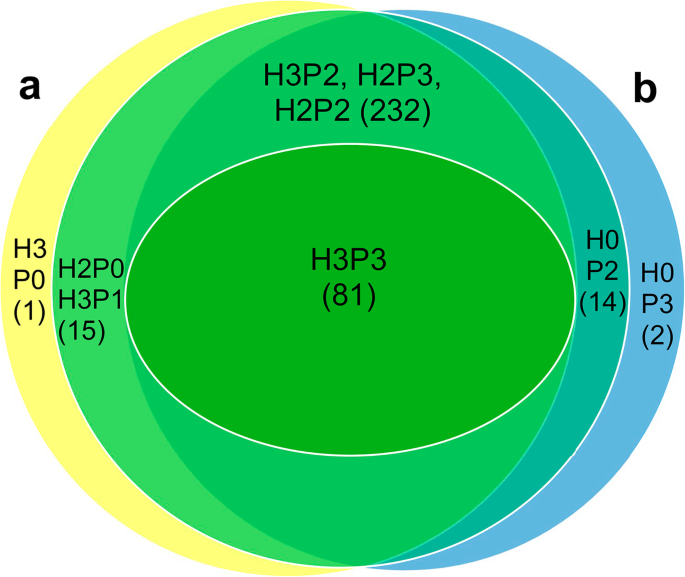
从健康叶片中提取的核蛋白样品鉴定出370种蛋白质,这些蛋白质在三个实验中至少有两个是相同的(图。1一种;表S.1),而在三个实验中都检测到了104个。与实验H1相比,实验H2和H3鉴定出了更多的蛋白质。在三个实验中有两个被鉴定为相同的蛋白质中,93%的蛋白质在实验H2和H3中具有相同的蛋白质,但在实验H1中却没有(表S1).健康马铃薯叶片中最丰富的核蛋白是各种组蛋白,如H4、H2A和H2B,占总光谱计数的47%(表S1).另外,检测到几种叶绿体或光系统的蛋白质,但可能在制备核提取物期间获得的污染物,因此在分析中不考虑。不同的组蛋白H1和H3蛋白和核仁常见(表S1),如预期。组蛋白H2A、H2B、H3和H4构成核小体的核心,而组蛋白H1占据连接不同核小体的连接区。其他常用检测的蛋白包括核糖体蛋白和核糖核蛋白、剪接相关蛋白、茎28-kDa糖蛋白(酸性磷酸酶1-like)、诱导诱导蛋白egg - j7、磷酸甘油酸激酶、甘油醛-3-磷酸脱氢酶亚基、基质附着区(MAR)结合蛋白、一个内质酶同源物,一个纤颤素同源物,热休克伴侣,8个14-3-3蛋白的异构体和3个ALY蛋白的异构体(表S1).
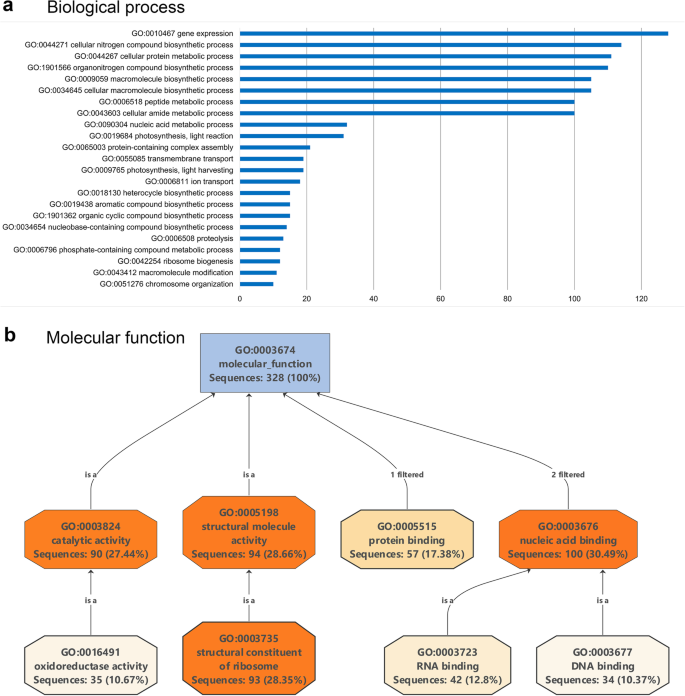
利用Blast2GO软件,根据蛋白质的生物学过程、分子功能和细胞定位对其进行分类。马铃薯叶片的核蛋白质组包括与生物过程(GO水平2)相关的蛋白质,例如细胞成分的组织、生物发生、对各种刺激的反应以及生物调节和定位。许多已鉴定的蛋白质参与基因表达、翻译、肽的代谢过程和核糖体的生物发生(图。2a) 是的。具有分子功能的蛋白质主要可分为核酸结合蛋白或蛋白质结合蛋白、核糖体结构成分或催化活性(图。2b) 是的。
PVA感染细胞细胞核中的植物蛋白
pva感染和健康样本中共有313种蛋白质(图中H3P3、H3P2、H2P3、H2P2组)。1)和81在所有核蛋白样品中常见(H3P3组 - 三个PVA感染叶片样品和3种健康叶子样品;图。1).对健康和pva感染样本(图中H3P3、H3P2、H2P3、H2P2组)中检测到的常见蛋白进行蛋白质组学比较分析。1)使用归一化谱丰度因子 - 电力法全局误差模型(NSAF-PLGEM)[30]. 分析表明,8种蛋白质的积累存在差异(表1)1). 在PVA存在下诱导了6种蛋白质(Kunitz胰蛋白酶抑制剂、核糖体蛋白L13、L18和L27a、组蛋白脱乙酰酶复合物亚基sap18样蛋白和剪接体蛋白),而两种蛋白质(组蛋白H2B和核糖体蛋白L23)的水平降低。
pva感染的叶片中有16种蛋白质(表1)2). 三种PVA样品中均检测到2种蛋白(H0P3组;图。1), 3个PVA样品中有2个检测到14个蛋白(H0P2组;无花果。1).然而,所有这三种健康样品都不存在所有这16种蛋白质。
三个PVA样品(所有健康叶片都没有)特有的蛋白质是前mRNA剪接因子SF2和60S核糖体蛋白L8(表1)2、组H0P3)。2个PVA样本所特有的蛋白质(所有健康样本中都没有)包括5个核糖体蛋白质(RPL12, RPL13a, RPL14, RPS26, P2-like), 2个mrna前剪接相关蛋白(剪接因子3B亚基和植物特异性丝氨酸/精氨酸蛋白),小核蛋白E,谷胱甘肽-s -转移酶,rRNA加工蛋白UTP23、ras相关小GTPase蛋白、铁蛋白、分段独立蛋白转位酶HCF106、微粒体信号肽酶亚基(表)2;组H0P2)。除了上述核糖体和剪接相关蛋白外,小核糖体蛋白E也参与了pre-mRNA的剪接。rRNA加工蛋白UTP23参与rRNA加工和核糖体生物发生。这些结果表明,在PVA样品中发现的蛋白中,与核糖体和pre-mRNA剪接相关的蛋白非常丰富。
除了S. Tuberosum.Phureja组(克隆DM1-3) [29],对质谱/质谱多肽数据进行NCBI基因组注释检索S. Tuberosum.(版本100)。数据库搜索识别专门在PVA样品中发现的17个蛋白质,其中一个是在所有三种PVA样品中发现的剪接因子3B相关蛋白质。另外16个PVA感染样品中的其他16个蛋白质被检测到,但在所有健康样品中缺失(表S.2).11种蛋白质与pva感染样本中独特的蛋白质相匹配或同源(S. Tuberosum.集团Phureja DM1-3)。有三种蛋白质之前是未知的:rps27 - 2样蛋白、赖氨酸特异性去甲基化酶/转录因子和分段独立的蛋白质转位酶蛋白TATB(表S2).
植物蛋白质不存在于PVA感染细胞的核
在健康样品中仅发现11个蛋白质(表3.).一种蛋白(Dnajc14蛋白)在所有三个健康样本中都存在,但在所有pva感染样本中缺失(见表1)3.H3P0组)。在两个健康样品中发现10种蛋白质,包括两种叶绿体蛋白质(图中H2P0组)。2;表格3.)除了所有PVA感染的样品中缺席。由于病毒在叶子中不均匀地分布,则H3P1组(图。1;表格3.),包括所有三个健康样本共有的五种蛋白质,但只存在于一个pva感染样本中,也可能值得注意。所有或大部分pva感染样本中缺失的蛋白包括组蛋白H2B、calreticulin、pinin/SDK/memA蛋白、打结样同源盒蛋白、剪接因子3b亚基、4个小核糖体核蛋白、延伸因子P、2个60S核糖体蛋白(RPL12和RPL14)和snake -2(表1)3.).
还通过与NCBI基因组注释中的肽和蛋白质进行比较来鉴定核蛋白S. Tuberosum.100年释放。该研究鉴定了14种蛋白质,它们只在健康的土豆叶子中发现:Dnajc14在所有三个样本中都存在(在肽搜索中也得到了相同的发现S. Tuberosum.在两个样本中发现了7种蛋白质。在所有三个健康样本和一个pva感染样本中发现了6种蛋白质(表S3.).所有蛋白质中的一半是表达蛋白质的同源物S. Tuberosum.Phureja组,但也有新鉴定的蛋白质,包括brefeldin A、一种抗性样蛋白、一种预测的钙调素结合蛋白和一种双音频C同源物1样蛋白(表S)3.).
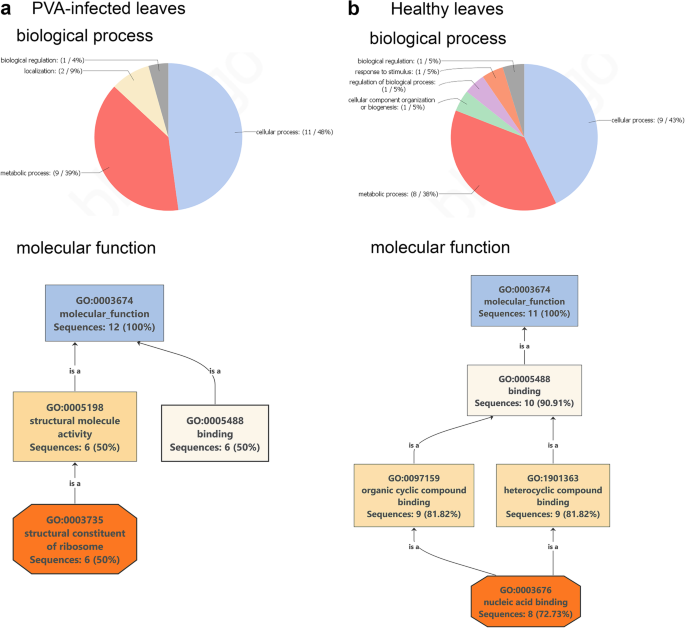
为了预测核蛋白控制的生物过程和分子功能,我们对PVA感染后存在或不存在的蛋白进行了Blast2GO分析,并在寻找中确定了这些蛋白S. Tuberosum.Phureja组。响应PVA感染的蛋白质属于生物过程(氧化石墨烯水平2),如细胞或代谢过程、定位和生物调控。更具体地说,检测到的蛋白质被发现参与基因表达、代谢、大分子和多肽的生物合成和翻译。主要的分子功能与核糖体的结合或结构成分有关(图。3.一种)。另一方面,响应于PVA感染而消失的蛋白质代表细胞或代谢过程(特别是基因表达),组织细胞组分,生物发生,生物过程调节,以及对各种刺激的反应。主要分子函数由参与核酸结合的蛋白质支配(图。3.b) 是的。
在被病毒感染的叶片核蛋白组中检测到病毒蛋白
除植物蛋白外,PVA感染样品中还检测到两种病毒编码蛋白的特异性多肽,而健康样品中没有。所鉴定的蛋白质为PVA的CP、NIa和VPg。根据光谱计数,CP是最丰富的病毒蛋白,其次是VPg。CP是基于10种独特的肽进行鉴定的,肽覆盖率为38%(图。4.).NIa包含两个域:n -近端VPg包含一个强的双部核定位信号[21]和一个C型近端蛋白酶。四种独特的肽与NIA有关。所有肽源自PVA多蛋白的VPG区域(图。4.).
ras相关小GTPase蛋白在健康和PVA侵染叶片细胞中的定位
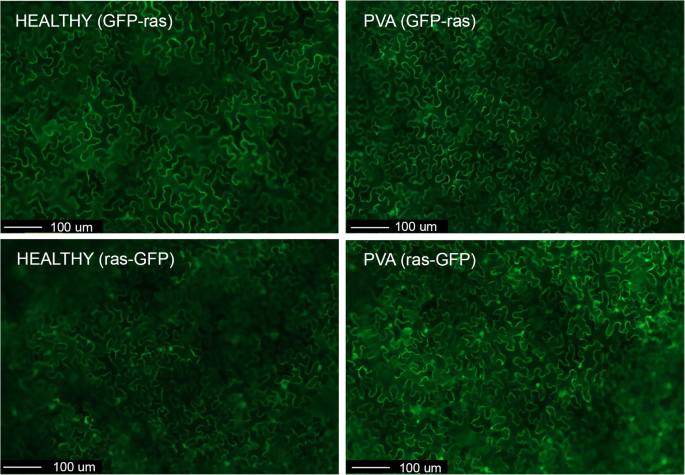
在pva感染细胞的细胞核中发现的一种独特的蛋白质是rablike GTPase(表2). Rab-GTPases在内膜转运中起重要作用[31].病毒利用主体膜贩运途径和以前的研究致命对RAB GTP酶在病毒感染中的作用[32那33那34那35].在辣椒植株的核中也发现了一种类似rabp的GTPase,以应对TMV感染[26].因此,将RAS相关的小GTPA酶蛋白Rabe1a克隆为与GFP的融合,以验证其在健康和PVA感染细胞中的定位。为了鉴定用PVA感染的细胞,我们使用标记的PVA标记为RFP(PVA-RFP)。健康的叶子烟草benthamiana用GFP融合蛋白对系统感染PVA-RFP的植物和叶片进行农渗,并对融合蛋白进行定位。在健康叶片中,GFP-rabE1a主要存在于细胞质中(98.8%),而在pva感染的细胞中,GFP-rabE1a同时存在于细胞质和细胞核中(36.7%)或仅存在于细胞质中(63.3%)(表1)4.,无花果。5.).在Rabe1A-GFP(即C-末端标签)的情况下,在许多细胞的细胞质和细胞核中检测到荧光,并且在健康和PVA感染细胞之间没有观察到差异(表4.).
讨论
一些蛋白质组学的研究已经在茄科植物中进行,但是只有很少的研究具有核蛋白质组的特征[36].番茄的特性(茄属植物lycopersicum果实成熟过程中的核蛋白质核蛋白质表现出参与基因调节,翻译,蛋白水解,结构和排毒的蛋白质普遍性[37].此外,还对感染卵菌后的番茄核蛋白质组进行了分析Phytophthora Capsici.揭示了核蛋白组成的动态变化,包括参与免疫的蛋白质[38]. 本研究首次对马铃薯核蛋白质组进行了分析。我们在二倍体马铃薯v2-108的健康叶片中鉴定了370个核蛋白,40个核蛋白对PVA侵染的反应不同。马铃薯叶片的健康核蛋白组和PVA感染核蛋白组中最丰富的蛋白质包括参与染色质组装和重构的蛋白质(组蛋白H2A、H2B、H3、H4和H1的变体)和组蛋白脱乙酰酶。此外,我们在健康和PVA感染样本中鉴定了大量翻译相关蛋白,包括各种核糖体蛋白。这些结果与水稻核蛋白质组相似,后者含有大量组蛋白[39那40].但是,我们对马铃薯核蛋白质组的结果不同于观察到的拟南芥(L.)海恩。还有鹰嘴豆(中投arietinumL.),观察到信号传导和基因调控相关蛋白的相对优势[41.那42.].我们也发现在马铃薯的核蛋白质组上几种蛋白质同源的核仁蛋白质组A. Thaliana.[43.].
在pva感染马铃薯叶片核糖体蛋白质组中,我们鉴定了健康马铃薯叶片核糖体中缺失或积累较少的几个核糖体蛋白和参与核糖体生物发生的蛋白。以往的研究表明,potyvirus感染增加了一组蛋白质合成相关基因的表达,特别是转录水平上编码核糖体蛋白的基因[44.那45.那46.那47.]. 因此,在PVA侵染叶片细胞核中鉴定的大量核糖体蛋白与转录组数据一致。
在植物中,核糖体蛋白质由多基因小家族编码,家族成员的功能专一性与单个核糖体蛋白质的多个拷贝有关[48.那49.]. 一些核糖体蛋白突变体具有特定的表型,这可能表明核糖体的组成在植物发育中起着重要的作用[48.].的感染期间核糖体蛋白家族成员(如RPL13)的差异诱导A. Thaliana.芜菁花叶病毒属potyvirus.)也已记录过[45.].当健康的核糖体组,农杆菌肿瘤术-感染和pva感染的叶片n benthamiana比较[50.]. 核糖体蛋白质主要存在于核糖体的表面,而rRNA分子形成复合物的核心,并可能直接与mRNA相互作用[48.].因此,已经推测了核糖体的异质性以反映功能多样性[49.].支持这一点的是,缺乏某些核糖体蛋白质的核糖体优先翻译无领导mrna大肠杆菌[51.],而缺乏核糖体蛋白S25的核糖体在某些病毒MRNA的翻译中有缺陷[49.那52.].在我们的研究中,我们发现在平移相关蛋白质的细胞丰度中的改变,这表明PVA诱导植物细胞代谢的一般性重编程,并提出了PotyViruses可以改变核糖体的组成,以增强病毒编码的RNA的翻译。
某些核糖体蛋白质在核糖体外也有功能。它们可以调节宿主基因的转录,调节转录调控因子的活动,或控制mRNA向核糖体外的翻译[53.].例如,RPL22果蝇黑胶基与连接蛋白(组蛋白H1)结合,与浓缩染色质共定位,其过表达抑制转录[54.].在哺乳动物中,RPL13控制在3'非转化区域中具有特定结构的MRNA的翻译[55.].磷酸化的RPL13a从核糖体释放并与eIF4G结合,这阻止了43S核糖体复合体的进入[55.].在植物中,RPL13的沉默降低了potyvirus感染的效率[56.]. 在我们的研究中,在PVA感染叶片的核蛋白质组中发现了RPL13的变体,而在健康叶片中没有发现。此外,在PVA存在下,RPL13的另一变体被诱导,这也表明RPL13在病毒感染中的作用。
发现在PVA感染的叶片的细胞核中发现在PVA感染的叶片中累积的第二类蛋白质与健康叶片包含与前mRNA剪接相关的蛋白质。在PVA样品中三种拼接因子和一个拼接相关蛋白质是独特的,并且在健康样品中未发现。在健康样品中唯一地检测到两种拼接相关蛋白质,并且一个拼接相关蛋白质显示出差异累积。各种非生物和生物应力可能影响植物中的替代剪接[57.那58.].选择性剪接是增强蛋白质组多样性的主要机制[59.].剪接因子引导剪接体复合体剪接前mrna的剪接位点,并决定在每种条件下剪接位点的选择。许多编码具有调节功能的蛋白质的基因,包括剪接因子,以及参与植物对胁迫反应的基因都是选择性剪接的目标[58.那59.]由不同的应力引起或调节的。另外,一些植物抗性基因受选择性剪接调控,需要不同的蛋白质形式来建立完整的植物抗性[58.].PVA感染与健康叶细胞的核中不同剪接相关基因的积累可能表明potvirus感染或病毒感染一般影响植物中的替代剪接。为了支持这一点,在植物中的替代剪接方面的广泛变化Broachypodium distachyon.用Panicum马赛克病毒(属胰腺病毒)和它的卫星病毒已被记录为利用高通量RNA测序与健康植物进行比较[60.].
在PVA感染叶片的核蛋白质组中发现的一种蛋白质是类似RAB样GTP酶蛋白(Rabe1)。该蛋白质可能在细胞内囊泡贩运中具有重要作用,包括外毒性和内吞作用[31]. 因此,与对照相比,在TMV感染辣椒的细胞核中发现了一种类似Rab的GTPase[26].植物病毒诱导膜重构,而膜运输是病毒感染的必要条件[12那13].先前的研究表明,不同的Rab GTPases在动植物病毒的细胞内运动和复制中发挥作用[32那33那34那35].通过分析gfp标记融合的亚细胞定位,我们在pva感染和健康叶片中发现了rabE1a的不同亚细胞定位。该蛋白在pva感染细胞的细胞核和细胞质中均可检测到,但主要存在于健康细胞的细胞质中。因此,亚细胞定位数据与核蛋白组学的结果是一致的。使用GFP-rabE1a在亚细胞定位上差异明显,而健康细胞和pva感染细胞的胞浆和细胞核均存在rabE1a-GFP。rabp样GTPases通常定位于细胞膜内[61.[保守,C末端戊烯化基序介导靶向[62.].因此,c -末端标记的rabE1a可能定位错误,类似于c -末端标记的酵母ras2蛋白,它存在于细胞核和细胞质中,而n -末端标记的rabE1a蛋白定位于细胞膜内[63.].
potyvirus编码的蛋白NIa和NIb主要聚集在病毒感染细胞的细胞核中[20那21那64.那65.].在pva感染的叶片核蛋白样品中检测到几种特异性于NIa VPg结构域的肽段,但在健康叶片样品中没有。这些数据表明VPg/NIa存在于pva感染的马铃薯叶片核蛋白组中,与预期一致。令人惊讶的是,没有发现特异性的NIb肽,即使NIa和NIb都被报道在细胞核中大量积累。它们也可能形成核内含物[64.那66.那67.]. NIb可能存在于PVA感染叶片的细胞核中,其含量太低而无法检测到,例如,由于其快速降解或与核内含物的聚集体有关。
对PVA-CP的特异性多肽也进行了检测。除了一项发现PVY(属)粒子的研究外,potyviral CP在细胞核中的定位尚未见报道potyvirus.)靠近核孔复合体和核内[68].因此,在某些细胞条件下,CP可能驻留在细胞核中。然而,它也可能代表核提取物的叶绿体污染物。
结论
我们的特征是,第一次是马铃薯的核蛋白质组并在Potyvirus感染期间分析了该蛋白质组中发生的变化。该数据表明potyvirus感染特别影响细胞核中的核糖体和剪接相关蛋白质。因此,这些蛋白质是有趣的,用于进一步研究和分析,以更具体地了解病毒感染是如何改变翻译和/或前mRNA剪接的。
方法
植物材料
pva感病马铃薯v2-108系按上述方法繁殖[69].该系为二倍体(2n = 2x = 24) F1杂种,其家系包括茄属植物tuberosum无性系种群。andigena那S. Tuberosum.无性系种群。块茎那S毛囊那美国phureja那美国sparsipilum和S. Stenotomum.[27那28].植物通过生根茎切屑乘以用于在生长室[光周期16h,光强度110μEm的生长中的生长− 2.年代− 1.,温度22–24 °C(轻度),18–20 °C(黑暗),相对湿度40%]。肥料(N:P:K) = 16:9:22,芬兰雅拉)混合在水中(0.3 g/L),每次浇水时使用。
病毒接种与检测
以马铃薯为研究对象,采用机械接种的方法,从马铃薯叶片中提取汁液烟草benthamiana感染感染性克隆PVA-BUIII [70]. 为了检测系统感染,在未接种的叶片上部的小叶进行了20%的测试 用PVA外壳蛋白(CP)特异性单克隆抗体58/0进行双抗体夹心酶联免疫吸附试验(ELISA);SASA,爱丁堡,英国)以及碱性磷酸酶结合的单克隆二级抗体,如前所述[71].用手术刀从每个小叶中切除中间肋一侧的叶片组织,称重,每3ml 1 g的酶联免疫吸附试验样品缓冲液中研磨。Aliquots (100 μL)转移到涂有抗pva - cp的微量滴定板上。如果传单pva呈阳性,则保留另一半用于分离细胞核。以模拟接种植株的小叶为阴性对照,进行酶联免疫吸附试验,并分离细胞核,比较pva感染和健康叶片的核蛋白组。
核的分离和蛋白质的提取
4个pva阳性的马铃薯小叶(总重3 ~ 4 g),分别来自不同的植株,组合在一起制备核蛋白。模拟接种的健康马铃薯植株在相同位置取小叶作为对照。核提取物的制备采用我们的方案优化马铃薯叶片[69].使用Trizol试剂(Invitrogen,Carlsbad,Ca)提取核蛋白。用丙酮沉淀蛋白质,重悬于6米脲,并分析12%SDS-PAGE,然后进行银染色。通过蛋白质印迹检查核蛋白质(组蛋白H3)的存在和不存在非核蛋白质(腔结合蛋白2,称为BIP2)的情况下检查每种核蛋白质制剂(图。6.,图.. s1),如上所述[69].
质谱
调整样品中批量核蛋白的浓度,基于A260和A280测量相当。通过用50mM Tris(2-羧乙基)盐酸盐(Sigma-Aldrich,St.Louis,Mo)在37℃下将蛋白质的半胱氨酸键减少20分钟,并用0.15μm碘乙胺(Sigma)烷基化减少的加合物(Sigma-aldrich)室温。通过加入1μg胰蛋白酶(测序级修饰的胰蛋白酶,promega)消化样品。用C18微磷脂柱(哈佛装置,霍敏茄料,MA)纯化所得肽片段并溶于30μl缓冲液(0.1%三氟乙酸和1%乙腈中的质谱级水)。用易于NLCII系统(Thermo Fisher Scientific,Wilmington,DE)进行肽片段的液相色谱偶联至串联质谱(LC-MS / MS),连接到Velos Pro-orbitrap Elite ETD混合质谱仪(Thermo Fisher Scientific使用Xcalibur版本2.2 SP 1.48(Thermo Fisher Scientific)的纳米电泡离子源。使用由2cm C18-A1捕集柱(Thermo Fisher Scientific)组成的两列LC系统分离样品,然后是10cm C18-A2分析柱(易列10cm×75μm,3μm,120Å;热渔民科学)。洗脱缓冲剂是:缓冲液A,0.1%的甲酸,0.01%三氟乙酸和HPLC级水中的1%乙腈;缓冲剂B,0.1%甲酸和0.01%三氟乙酸在98%乙腈中。分离梯度的程序由5%缓冲液B组成5分钟,35%缓冲液B,60分钟,80%缓冲液B,5分钟,100%缓冲液B 10分钟。流速为0.3μL/ min。 A single sample (4 μL) was injected per LC-MS/MS run. The analyses were performed in data-dependent acquisition mode using collision-induced dissociation. A full MS scan was acquired with a resolution of 60,000 at normal mass range in the Orbitrap mass spectrometer. The method was designed to fragment the 20 most intense precursor ions produced by collision-induced dissociation (energy 35 eV). Data were acquired using using the Xcalibur version 2.7.0 SP1 (Thermo Fisher Scientific).
蛋白质数据分析
利用LC-MS/MS获得的数据(即Orbitrap Elite的峰值文件),使用Proteome Discoverer软件,采用SEQUEST搜索算法(1.4版,Thermo Fisher Scientific)对相应的蛋白进行识别。搜查的顺序是S. Tuberosum.Phureja DM1-3基因组(PGSC_DM_v3.4_pep_non-redundant, 52,925个蛋白质,http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml) [29那72].此外,搜索LC-MS / MS数据以抵抗蛋白质数据S. Tuberosum.国家生物技术信息中心(NCBI;S. Tuberosum.注释版本100;ftp://ftp.ncbi.nlm.nih.gov/genomes/Solanum_tuberosum/protein/).前驱体离子和片段在0.8 Da的质量误差为15ppm。对氨基甲甲基+ 57.021 Da (C)半胱氨酸残基进行静态残基改性。甲硫氨酸氧化被设定为+ 15.995 Da (M)的动态修饰。只考虑全胰蛋白酶肽进行评分,最多允许有一次切割缺失。肽假发现率(FDR)设置为< 0.05。此外,只有包含至少一个独特肽的两个或多个肽匹配的蛋白质被认为已经被鉴定。
使用Bioconductor包PLGEM version 1.60.0,比较了pva感染和健康样本(H3P3、H3P2、H2P3和H2P2组)中pva感染诱导的常见蛋白丰度差异。从原始光谱计数中计算每个鉴定蛋白的归一化光谱丰度因子(NSAF)计数,并将它们用作PLGEM的输入值。差异表达蛋白通过排列的信噪比测试统计来鉴定[30].Blast2GO 5.2.5版本(http://www.blast2go.org.),对GO注释检测到的蛋白按其生物学过程、分子功能和细胞成分(http://www.geneontology.org).使用Blast2GO InterProScan工具检测蛋白质结构域,并在Pfam网站(http://pfam.sanger.ac.uk).
编码绿色荧光蛋白(GFP)融合蛋白的质粒构建
从马铃薯的叶子中提取总RNA(S. Tuberosum.栽培品种浮子冠,与三唑试剂(Invitrogen)。CDNA使用1至2μg总RNA合成Moloney鼠白血病病毒逆转录酶(200 U/μL;普罗梅加,麦迪逊,威斯康星州)和随机六聚体。利用Phusion high-fidelity DNA聚合酶(芬兰埃斯波Finnzymes)和含有适当限制性位点的引物从cDNA中扩增编码小GTPase rabE1a(PGSC0003DMP400015542)的基因。将PCR产物克隆到pRT-GFP载体中[21],得到了pRT-GFP-rabE1a和pRT-rabE1a-GFP质粒。随后,将包含35S启动子的表达盒从pRT载体主链转移到双链载体pKOH200,制备双链载体hDIII。
农业渗透和荧光显微镜
主管细胞农杆菌肿瘤术(pGV2260)用冻融法进行二元载体转化[73].农渗入叶n benthamiana如前所述进行[21].渗流荧光显微镜(AxioImager M2,Carl Zeiss Microscopy GmbH,Jena,Germany)和GFP兼容和RFP(红色荧光蛋白) - 兼容过滤器立方体用于可视化GFP和RFP融合构建体的表达。
数据和材料的可用性
本研究中产生的所有数据均包含在本文及其附加文件中。
缩写
- CP:
-
外套蛋白质
- EIF4E:
-
真核起始因子4E
- ELISA:
-
酶联免疫吸附试验
- 绿色荧光:
-
绿色荧光蛋白
- 去:
-
基因本体论
- LC-MS / MS:
-
液相色谱-串联质谱法
- NIa:
-
核包含蛋白A
- 笔尖:
-
核包容蛋白B.
- NSAF:
-
标准化光谱丰度因子
- PCR:
-
聚合酶链反应
- PLGEM公司:
-
幂律全局误差模型
- PVA:
-
马铃薯病毒A
- PVY:
-
马铃薯Y病毒
- 招标书:
-
红色荧光蛋白
- 烟草花叶病毒:
-
烟草花叶病毒
- VPg:
-
病毒genome-linked蛋白质
参考文献
- 1.
Di Carli M, Benvenuto E, Donini M.最近通过蛋白质组学分析发现植物-病毒相互作用。蛋白质组学杂志2012;11:47 - 80。
- 2.
Cerna H, Cerny M, Habanova H, Safarova D, Abushamsiya K, Navratil M, Brzobohaty B.蛋白质组学提供了洞察背后的机制Pisum sativum.L.对豌豆花叶病毒(PSbMV)的反应。蛋白质组学杂志2017;153:78-88。
- 3.
陈H,Cao Y,Li Y,Xia Z,谢J,Carr JP,Wu B,扇子Z,周T.鉴别差分调节玉米蛋白质调节甘蔗马赛克病毒系统性感染。新植醇。2017;215:1156 - 72。
- 4.
斯塔尔T,斯塔尔K,维克沃斯W,维恩库普S,格鲁登K。马铃薯蛋白质组与转录组反应的比较(茄属植物tuberosumL.)留下马铃薯病毒Y(PVY)感染。蛋白质。2017年。https://doi.org/10.3390/proteomes5030014.
- 5。
Novákovás,Dancankoko M,Skultety L,Fialovái,leškováa,eake g,flores-ramírezg,glasa m.光合和rence响应蛋白更有效地改变烟草benthamiana感染了李子痘病毒侵略性的PPV-CR与温和的PPV-C樱桃适应分离株。蛋白质组学杂志2018;17:3114-27。
- 6。
DAS PP,Chua Gm,Lin Q,Wong S-M。基于ITRAQ的叶片蛋白质组的分析鉴定了次级代谢物生物合成和防御键道中的重要蛋白,以对TMV的交叉保护。J蛋白质组。2019A; 196:45-56。
- 7.
达普,林强,王思敏。烟草花叶病毒感染的蛋白质组学比较烟草植物鉴定了参与光系统和植物防御的主要宿主蛋白。J蛋白质组。2019B; 194:191-9。
- 8.
亚当斯·MJ, Zerbini FM, French R, Rabenstein F, Stenger DC, Valkonen JPT。家庭Potyviridae。入选:King AMQ, Adams MJ, Carstens EB, Lefkowitz EJ, editor。病毒分类学,国际病毒分类学委员会第九次报告。伦敦:Elsevier学术出版社;2012.p . 1069 - 89。
- 9
妓女wj。马铃薯疾病的纲要。植物植物疗法:圣保罗,Mn;1981年。
- 10.
Diaz-Vivancos P, Clemente-Moreno MJ, Rubio M, Olmos E, Garcia JA, Martinez-Gomez P, Hernandez JA。在响应李子痘病毒的豌豆植株中,叶绿体代谢的改变导致ROS积累。[J] .实验机器人,2008;59:2147-60。
- 11.
Stare T,Ramšakž,Blejec A,Stare K,Turnšekn,Weckwerth W,Wienkoop S,Vodnik D,Gruden K.对耐受耐腐害马铃薯 - 马铃薯病毒Y相互作用的初级代谢相关反应的双峰动态。BMC基因组学。2015; 16:716。
- 12
雷切尔C,比奇RN。烟草花叶病毒侵染引起内质网的严重形态变化。美国国家科学研究院1998;95:11169-74。
- 13
魏T,黄T-S,麦克尼尔J,拉利伯特J-F,洪J,纳尔逊RS,王A。植物马铃薯y病毒复制的内质网和叶绿体的连续招募。维罗尔。2010;84:799–809.
- 14
Beauchemin C, Boutet N, Laliberté jf。VPg前体间相互作用的可视化,VPg是与基因组相连的病毒蛋白芜菁花叶病毒翻译真核生物起始因子iso4e在车前.J微生物学报。2007;81:775 - 82。
- 15.
Beauchemin C,Laliberte J-F。聚(a)结合蛋白在病毒诱导的囊泡中内化,或者在萝卜镶嵌病毒感染期间重新分布于核心。J病毒。2007; 81:10905-13。
- 16。
Dufresne PJ、Thivierge K、Cotton S、Beauchemin C、Ide C、Ubalijoro E、LalibertéJ-F、Fortin MG。热休克70与蛋白质的相互作用芜菁花叶病毒病毒诱导的膜囊泡中的RNA依赖性RNA聚合酶。病毒学。2008; 374:217-27。
- 17.
Thivierge K, Cotton S, Dufresne PJ, Mathieu I, Beauchemin C, Ide C, Fortin MG, Laliberté J-F。真核伸长因子1A与芜菁花叶病毒病毒诱导囊泡中RNA依赖的RNA聚合酶和VPg-pro病毒学。2008;377:216-25。
- 18.
反转F,加西亚JA。potyvirus的分子生物学。Adv Virus Res. 2015; 92:101-99。
- 19
Taliansky ME,Brown JWS,Rajamäki M-L,Valkonen JPT,Kalinina NO.植物核仁参与病毒和类病毒感染:与动物病理系统的相似性。在:马拉莫罗什K,沙特金AJ,墨菲足总,编辑。病毒研究进展77。伯灵顿:学术出版社;2010年。119–58.
- 20.
Schaad MC,Haldeman-Cahill R,Cronin S,Carrington JC。烟草蚀刻盆腔编码的VPG-蛋白酶(NIA)分析:突变对亚细胞转运,蛋白水解加工和基因组扩增的影响。J病毒。1996; 70:7039-48。
- 21.
Rajamäki M-L, Valkonen JPT。小核糖核酸样核包涵蛋白a的核和核仁定位控制马铃薯病毒A在尼古利亚娜物种。植物细胞。2009; 21:2485-502。
- 22.
RajamäkiM-L,Xi D,Sikorskaite S,Valkonen Jpt,Whitham SA。核糖体蛋白S6和核糖体蛋白S6激酶的差异要求用于植物病毒的植物病毒累积和S6激酶与PotViral VPG的相互作用。Mol植物微生物相互作用。2017; 30:374-84。
- 23.
宿主RNA解旋酶样蛋白AtRH8与potyvirus基因组连接蛋白VPg相互作用,与病毒积累复合物相互作用,是病毒感染的基础。植物学报。2010;152:255 - 66。
- 24
李福,王安。RNA衰变是植物的一种抗病毒防御,被病毒RNA沉默抑制物抵消。公共科学图书馆。2018https://doi.org/10.1371/journal.ppat.1007228.
- 25
Ala-Poikela M,RajamäkiM-L,Valkonen JPT。在蛋白质水平的病毒 - 宿主相互作用中使用的新型相互作用网络。病毒。2019年。https://doi.org/10.3390/v11121158.
- 26
Lee Bj,Kwon Sj,Kim Sk,Kim Kj,Park CJ,Kim Yj,Park Ok,Paek Kh。辣椒26s蛋白质组亚单位RPN7诱导的功能研究烟草花叶病毒来自核蛋白质组分析。生物化学生物物理研究委员会,2006年;351:405–11.
- 27。
Valkonen JPT, Slack SA, Plaisted RL, Watanabe KN。马铃薯对Y-O病毒的超敏抗性是上位性的茄属植物tuberosum无性系种群。andigena-derived马铃薯基因型。工厂说。1994;78:1177 - 80。
- 28。
Hämäläinen JH, Kekarainen T, Gebhardt C, Watanabe KN, Valkonen JPT。隐性和显性基因干扰血管运输马铃薯病毒A在二倍体马铃薯中。植物与微生物相互作用。2000;13:402–12.
- 29.
Sharma SK、Bolser D、de Boer J、Sønderkær M、Amoros W、Carboni MF、D'Ambrosio JM、de la Cruz G、Di Genova A、Douches DS、Eguiluz M、Guo X、Guzman F、Hackett CA、Hamilton JP、Li G、Li Y、Lozano r、Maass A、Marshall D、Martinez D、McLean K、MejíA N、Milne L、Munive S、Nagy I、Ponce O、Ramirez M、Simon r、Thomson SJ、Torres Y、Waugh r、Zhang Z、,Huang S、RGF V、CWB B、Sagredo B、Feingold SE、Orjeda G、Veilleux RE、Bonierbale M、JME J、Milbourne D、DMA M、Bryan GJ。马铃薯参考染色体级伪分子的构建:马铃薯基因组与遗传图谱和物理图谱的整合。G3:基因|基因组|遗传学。2013;3:2031–47.
- 30.
Pavelka N,Pelizzola M,Vizzamelli C,Capozzoli M,Splendiani A,GranuciAR F,Ricciardi-Castagnoli P.一种动力律全球误差模型,用于鉴定微阵列数据中的差异表达基因。BMC生物信息学。2004年。https://doi.org/10.1186/1471-2105-5-203.
- 31.
Takai Y, Sasaki T, Matozaki T小gtp结合蛋白。杂志启81:153 2001;208年。
- 32.
Agbeci M,Grangeon R,Nelson Rs,Zheng H,Laliberte J-F。寄主细胞内运输机械对萝卜叶片病毒的细胞间运动的贡献。PLOS POAROG。2013年。https://doi.org/10.1371/journal.ppat.1003683.
- 33.
Huang YP, Jhuo JH, Tsai MS, Tsai CH, Chen HC, Lin NS, Hsu YH, Cheng CP. NbRABG3f, Rab GTPase成员,参与了该研究竹花叶病毒感染烟草benthamiana.Mol Plant Pathol. 2016; 17:714-26。
- 34.
Xu K, Nagy PD。正链RNA病毒通过吸收核内体rab5小GTPase在病毒复制室中富集磷脂酰乙醇胺公共科学图书馆杂志。2016;14:e2000128。
- 35.
斯皮尔曼P。病毒与宿主细胞Rab-GTPases的相互作用。小型GTPases。2018;9:192–201.
- 36
Ghatak A,Chaturvedi P,Paul P,Agrawal GK,Rakwal R,Kim St,Weckwerth W,Gupta R. Ranaceae家族的调查:现状和面临的挑战。J蛋白质组。2017; 169:41-57。
- 37
王Y,王W,Cai J,张Y,秦G,田S.番茄核蛋白质组揭示了特定E2泛素缀合酶在果实成熟中的参与。基因组Biol。2014; 15:548。
- 38
关键词:番茄,核蛋白组,核蛋白质组,定量分析Phytophthora Capsici.感染揭示了免疫调节剂。新植物。2017; 215:309-22。
- 39。
水稻染色质相关蛋白的蛋白质组和磷酸化蛋白质组分析(栽培稻).蛋白质组学。2007;7:4511-27。
- 40。
李G,纳拉米米尔BRR,TAN F,PENG Z.去除高丰度蛋白在水稻中核亚甲基研究(栽培稻)胚乳。电泳。2008;29:604–17.
- 41。
水稻蛋白质组学:核蛋白的研究进展与分析。植物化学,2004;65:1671 - 81。
- 42.
Pandey A, Choudhary MK, Bhushan D, Chattopadhyay A, Chakraborty S, Datta A, Chakraborty N.鹰嘴豆核蛋白组(中投arietinuml)揭示预测的和未预料到的蛋白质。J Prot res 2006; 5:3301-11。
- 43.
Pendle AF,Clark GP,Boon R,Lewankowska D,Lam Yw,Andersen J,Mann M,Lamond Ai,Brown JW,Shaw PJ。蛋白质组学分析拟南芥核仁显示新的核仁功能。《细胞生物学》2005;16:26 - 9。
- 44.
Dardick C.比较表达剖析烟草benthamiana叶子系统地感染了三种果树病毒。Mol植物微生物相互作用。2007; 20:1004-17。
- 45.
杨超,郭锐,杰F, Nettleton D, Peng J, Carr T, Yeakley JM, Fan J, Whitham SA。空间分析的拟南芥基因表达响应萝卜镶嵌病毒感染。Mol植物微生物相互作用。2007; 20:358-70。
- 46.
Alfenas-Zerbini P,Maia Ig,FávaroRd,Cascardo Jc,Brommonschenkel Sh,Zerbini FM。盆腔卵巢番茄感染早期阶段差异表达基因的基因组分析。Mol植物微生物相互作用。2009; 22:352-61。
- 47.
Vuorinen A, Gammelgard E, Auvinen P, Somervuo P, Dere S, Valkonen JPT。在携带病毒特异性R基因的马铃薯基因型中,影响响应性和更高水平的病毒抗性的因素。Ann Appl Biol. 2010; 157:229-41。
- 48
Schippers JHM,Mueller Roeber B。核糖体组成与叶片发育的调控。植物科学。2010;179:307–15.
- 49
吉尔伯特wv。核糖瘤的功能专业化?趋势Biochem SCI。2010; 36:127-32。
- 50.
Eskelin K,Varjosalo M,Ravantti J,MäkinenK.核糖体谱和健康的核糖蛋白酶马铃薯病毒A- - -农杆菌属来华的烟草benthamiana植物。莫尔植物途径。2019; 20:392-409。
- 51
Kaberdina AC,Szaflarski W,Nierhaus Kh,Moll I. Kasugamycin诱导的意外类型的核糖体:看看蛋白质合成的祖先时期。Mol细胞。2009; 33:227-36。
- 52。
Esquerra J,Warringer J,Blomberg A。高分辨分型显示单个rrna2′-O-核糖甲基化的功能重要性。核糖核酸。2008;14:649–56.
- 53。
核糖体蛋白在基因特异性转录和翻译中的新兴功能。生物化学生物物理研究委员会,2009年;379:167–70.
- 54.
关键词:果蝇,核糖体蛋白,组蛋白H1,转录抑制基因Dev。2006;20:1959 - 73。
- 55.
DAS P,Basu A,Biswas A,Poddar D,Andrews J,Barik S,Komar AA,Mazumder B.在核糖体生物发生期间核糖体掺入核糖瘤L13A蛋白的机制。Mol细胞Biol。2013; 15:2829-42。https://doi.org/10.1128/MCB.00250-13.
- 56.
Yang C, Zhang C, Dittman JD, Whitham SA。不同翻译起始策略的植物RNA病毒对核糖体蛋白S6的不同需求。病毒学。2009;390:163 - 73。
- 57.
植物中可选剪接景观的复杂性。植物细胞。2013;25:3657 - 83。
- 58.
Staiger D,棕色JWS。生物定时,发展和应力响应交叉处的替代拼接。植物细胞。2013; 25:3640-56。
- 59.
杜克P。SR蛋白在植物逆境反应中的作用。电厂信号行为。2011;6:49–54.
- 60.
Mandadi KK, Scholthof KB。植物-病毒互作过程中可变剪接景观的全基因组分析Broachypodium distachyon..植物细胞。2015;27:71 - 85。
- 61.
Zerial M, McBride H. Rab蛋白作为膜组织者。《细胞生物学》2001;2:107-17。
- 62.
杨振小GTPases:植物中的多功能信号开关。植物细胞。2002;14:s375 - 88。
- 63
Huh W-K, Falvo JV, Gerke LC, Carroll AS, Howson RW, Weissman JS, O 'Shea EK。芽殖酵母蛋白定位的全局分析。大自然。2003;425:686 - 91。
- 64。
Restrepo MA,Freed DD,卡灵顿JC。植物病毒蛋白的核转运。植物细胞。1990;2:987–98.
- 65。
李旭,卡灵顿JC。烟草蚀刻马铃薯y病毒RNA依赖性RNA聚合酶的核转运对序列改变高度敏感。病毒学。1993;193:951–8.
- 66.
Knutsen H,Hiebert E,Purcifull D.烟草蚀刻病毒诱导的核内包涵体的部分纯化和某些性质。病毒学。1974;61:200–9.
- 67.
Dougherty工作组,Hiebert E。兔网织红细胞裂解物中马铃薯y病毒RNA的翻译:鉴定作为烟草蚀刻病毒RNA翻译产物的核包涵体蛋白和作为马铃薯y病毒基因组产物的圆柱形包涵体蛋白。病毒学。1980;104:174–82.
- 68.
关键词:马铃薯病毒,y型,烟草,互作,细胞器植物保护学报。2014;36(5):557 - 564。
- 69.
Sikorskaite S, Rajamäki M-L, Baniulis D, Stanys V, Valkonen JPT。方案:从茄科和蔷薇科植物的叶片中分离核的优化方法。工厂方法。2013。https://doi.org/10.1186/1746-4811-9-31.
- 70.
Paalme V,Gammelgårde,järvekülgl,valkonenjpt。在体外两个几乎相同的盆腔分离物的重组分离物在植物中表达新的毒力和症状表型。J Gen Virol。2004; 85:739-47。
- 71.
rajamäkim-l,rabenstein f,andrejeva J,Paulin L,Kekarainen T,Kreuze JF,Forster RLS,Valkonen JPT。马铃薯分离株的生物学,血清学和分子差异。植物病理学。1998年; 88:311-21。
- 72.
马铃薯基因组测序联盟。块茎作物马铃薯的基因组序列和分析。自然。2011; 475:189-95。
- 73.
Wise AA, Liu Z, Binns AN。将外源DNA导入农杆菌的三种方法。见:王凯主编。农杆菌属协议。2版,Totowa: Humana出版社;2006.43-54页。
致谢
感谢Sini Miettinen对LC-MS/MS分析的帮助。
资金
这项研究得到了芬兰科学院对JPTV的资助(资助1102003、1118766和1134759),以及芬兰国际流动中心(CIMO)对MLR的资助(资助TM-10-7284),以获得SS奖学金。这些资助机构在研究设计、数据收集和分析或手稿撰写方面没有任何作用。
作者信息
从属关系
贡献
MLR、SS、MV和JPTV的设计研究;MLR、SS和NS进行了实验;MLR和MV对数据进行分析。MLR, MV和JPTV写了这篇文章。所有作者均已阅读并批准稿件。
相应的作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益.
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
在来自马铃薯系V2-108的健康叶子细胞核中发现的蛋白质。
附加文件2:表S2。
仅在PVA侵染马铃薯叶片的细胞核中检测到蛋白质。
附加文件3:表S3。
蛋白质仅在健康马铃薯叶片的细胞核中检测到。
附加文件4:图S1。
图的原始图像。6..
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
rajamäki,ml。,sikorskaite-gudziuniene,s。,sarmah,n。et al。病毒感染与健康马铃薯叶片核蛋白组研究。BMC植物BIOL.20.355(2020)。https://doi.org/10.1186/s12870-020-02561-7.
收到了:
公认:
发表:
关键字
- 马铃薯病毒A
- potyvirus.
- 土豆
- 茄属植物
- 核
- 蛋白质组