摘要
背景
颜色形成Hylocereus SPP。火龙果被认为是由甜菜碱的积累引起的。然而,已有多篇研究报道了火龙果中存在花青素,其在颜色形成中的潜在作用尚未被探索。在本研究中,我们分析了三个果肉颜色(红色、粉色和白色)不同品种的果实的代谢组和转录组,以研究其营养品质和花青素颜色形成的机制。
结果
结果表明,火龙果富含氨基酸、脂类、碳水化合物、多酚、维生素等生物活性成分,且3个品种间差异显著。果肉中检测到花青素,其中Cyanidin 3-glucoside、Cyanidin 3-rutinoside、Delphinidin 3-O-(6-O-malonyl)-beta-glucoside 3-O-beta-glucoside和Delphinidin 3-O-beta- d -glucoside 5-O-(6-香豆素-beta- d -glucoside)的积累量与红色着色呈正相关。转录组数据显示,白色品种倾向于抑制花青素的生物合成途径,并将底物转移到其他竞争途径。这与观察到的红色品种完全相反。然而,粉红色品种似乎保持了花青素生物合成途径和竞争途径之间的平衡。我们在MYB和bHLH家族中鉴定了几个活性转录因子,这些转录因子可以作为花青素生物合成基因的潜在调控因子进行进一步研究。
结论
统称,我们的结果表明花青素部分有助于筏果实的颜色形成。旨在操纵花青素和玻璃糖苷的生物合成途径的未来研究将更好地阐明每种途径在脱皮中的颜色形成的确切贡献。这将促进努力改善筏果实质量和上诉。
背景
作为人类饮食的重要组成部分,水果是营养素和植物化学品的水库,具有广泛的健康益处[1].Hylocereus SPP。火龙果是一种具有异国情调的审美特征的新型水果作物,深受消费者欢迎。2].它属于仙人掌科和石竹科[3.].这些物种源于中美洲[4.]但随着需求不断增长,日益增长的地区现在已经在整个热带和亚热带地区扩大,特别是在马来西亚,越南,泰国和中国等国家的国家[5.].
脱皮栽培扩增的主要决定因素是对干燥环境和贫困土壤的高度适应[3.].此外,对筏果实的营养品质的检查显示,它富含维生素C,糖,有机酸,植物白蛋白,氨基酸和矿物质的各种营养素6.那7.那8.].此外,火龙果中甜菜碱、多酚和黄酮含量较高[9.已被证明能预防一些与氧化应激相关的疾病[10那11]降低胆固醇浓度,治疗孕妇的贫血,预防结肠癌,抑制焦虑和加强肾功能[8.那12那13那14].
贝纳索在脱皮中被广泛表现了[15那16那17那18那19].β只有在某些种类的血涡轮虫中发现,并包括Betacyanin(红紫色)和betaxanthins(黄色)[20.].贝然萘和花青素的发生(显性植物天然色素)被认为是在同一植物种类或组织中未检测到两种颜料的相互排他性[21那22那23那24.].有几个机制被用来解释这种在产甜菜碱的植物中不常见的现象,如花青素基因的转录下调[25.那26.那27.]非功能性的花青素生物合成基因[28.],丧失的阴茎素调节途径的MYB-BHLH-WD40转录复合物[29.]以及酪氨酸途径(导致甜菜碱生物合成)和苯丙氨酸来源途径(导致花青素生物合成)之间的基本失衡[30.].记录筏果皮或肉色素沉着是由于高水平的贝辛蛋白存在,这通过代谢物和转录组调查显示[17那31.那32.那33.].奇怪的是,一些研究也检测到火龙果中存在花青素,尽管具体的花青素化合物尚未被鉴定[34.那35.那36.那37.].这表明玻璃糖苷和花青素都可能存在Hylocereus SPP。因此,花青素也可能部分有助于果实色素沉着。不幸的是,没有研究探索了在果实开发期间或具有对比色的果实之间的参与和调节筏中的基因的表达水平的变化。
水果的颜色是管理消费者偏好和确定市场价值的主要质量标准[38.].有大量的水果颜色Hylocereus SPP。但红彩色品种(Hylocereus polyrhizus)最受消费者青睐。不幸的是,详细的代谢分析揭示了重要的生物活性成分Hylocereus polyrhizus非常有限[17那19那39.].同样地,其他彩色品种的代谢潜力如Hylocereus undatus一直被忽视。在本研究中,我们采用了广泛靶向的代谢组学方法,全面检测和比较了三种代谢产物之间的数百种代谢物Hylocereus SPP。具有对比色果实果肉的品种。通过整合转录组数据,我们进一步研究了花青素代谢产物和相关生物合成基因对火龙果颜色形成的可能贡献。
结果
代谢物质分析三Hylocereus spp.畴
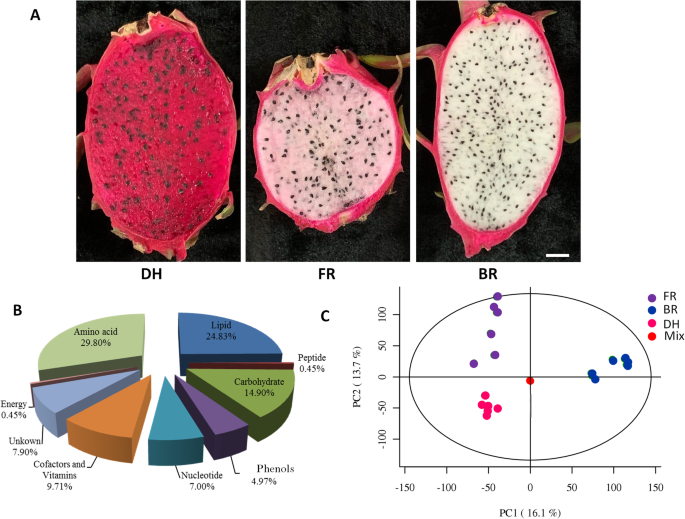
在目前的工作中,三个Hylocereus SPP。含有不同表型的栽培品种(表1)被用于广泛的靶向代谢组学,基于6个生物重复。选用大红(DH)、粉柔(FR)和白柔(BR)品种主要是因为其果肉颜色不同。1a).样品中共检测到443个不同种类的代谢物。氨基酸、脂类、碳水化合物、辅助因子和维生素类的代谢产物最为丰富Hylocereus SPP。水果(图。1b).利用R (v3.3.2)的XCMS包进行代谢物峰鉴定、过滤、比对。各代谢物的峰面积(强度)见表S1.为了评估代谢谱数据的质量,我们对所有重复进行了主成分分析(PCA)和质量控制(QC)样本。PCA中所有QC样本聚在一起,变异性很小,说明数据是可靠的。另外,前两个pc可以明显区分三个品种,表明其果实代谢组存在较大差异。
三个品种间果实代谢组的变异
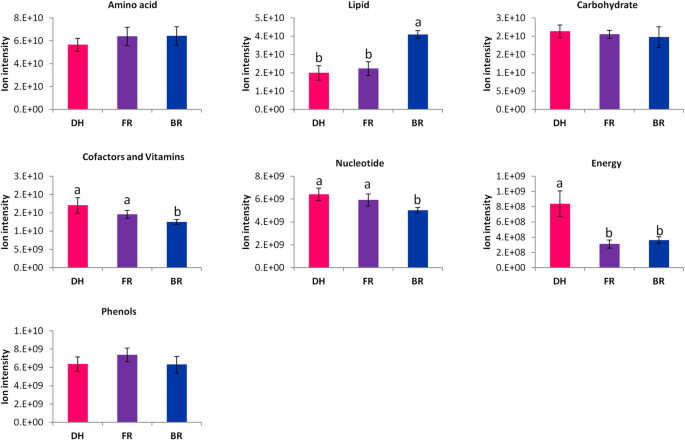
为了探讨三个品种果实的营养品质,我们比较了三个品种主要代谢产物的浓度。总的来说,红色样品(DH)所含氨基酸和脂质代谢物比粉色和白色样品少(图。2).相比之下,与FR和BR样品相比,DH样品更加赋予碳水化合物,能量,核苷酸和辅助剂和维生素相关代谢物;FR显示出强烈含酚代谢物的含量。这些结果表明这三种品种的营养性质的高度变化。
与黄酮类化肺素途径相关的代谢物分析
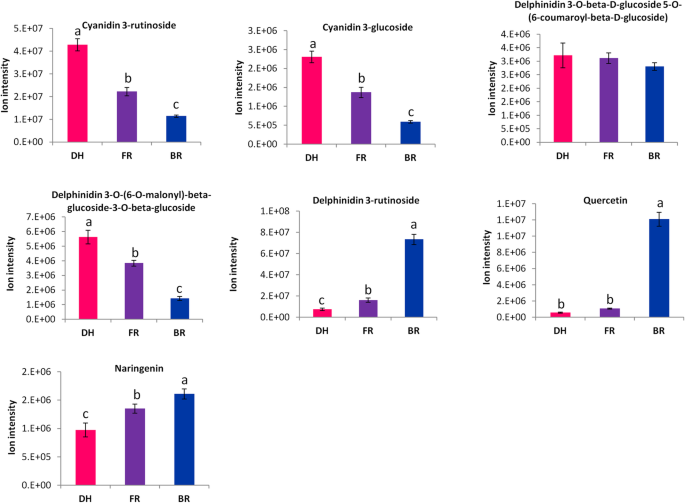
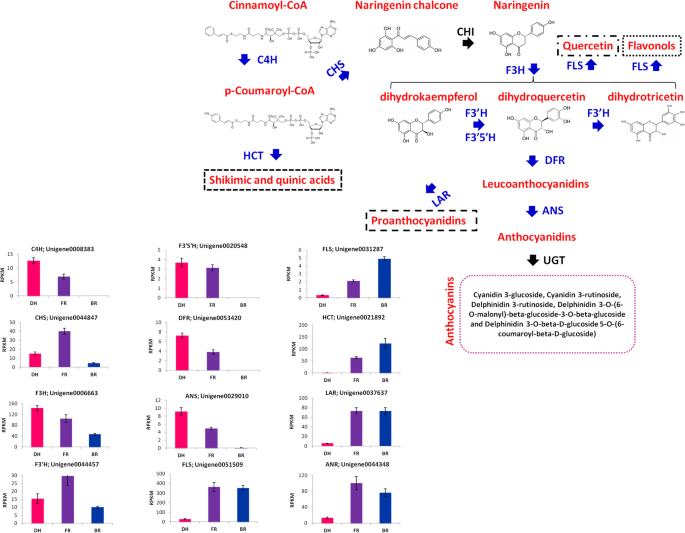
三个品种间主要的表型差异是肉色。花青素是植物的主要色素[15].要了解花青素对鳕鱼肉色的贡献,我们研究了三种品种之间与黄酮类花青素途径相关的代谢物浓度的变化。我们鉴定了五种花青素化合物,包括Cyanidin 3-葡糖苷,Cyanidin 3- rutinoside,Delphinidin 3- rutinoside,Delphinidin 3-O-(6-O-丙基) - β-葡糖苷-3-O-β-葡糖苷和德尔菲啶3-O-Beta-D-葡糖苷5-O-(6-香豆酰基-D-葡糖苷)。此外,鉴定了两种上游代谢物:柚皮素和槲皮素。如图1所示。3.,除蛋白蛋白3-芦丁苷除了在白色肉制栽培品种(BR)中更富集的3-芦丁苷除外,其他四种花青素在红色样品(DH)和粉红色样品(FR)中更浓缩,在DH中具有更明显的积累。关于两种上游代谢物,我们观察到与FR和DH相比,它们在BR中更积累。我们进一步确定了三种选定的花青素,即使用电喷雾电离/高效液相色谱/串联质谱(ESI-HPLC-MS / MS)方法,Cyanidin 3-葡糖苷,Cyanidin 3-葡糖苷,Cyanidin 3-葡萄糖苷和蛋白质3-芦丁苷3-芦肽。如图S所示1,基于ESI-HPLC-MS/MS分析,这些花青素的积累模式与广泛靶向代谢组学的报告完全吻合(图。3.).
转录组测序和组装
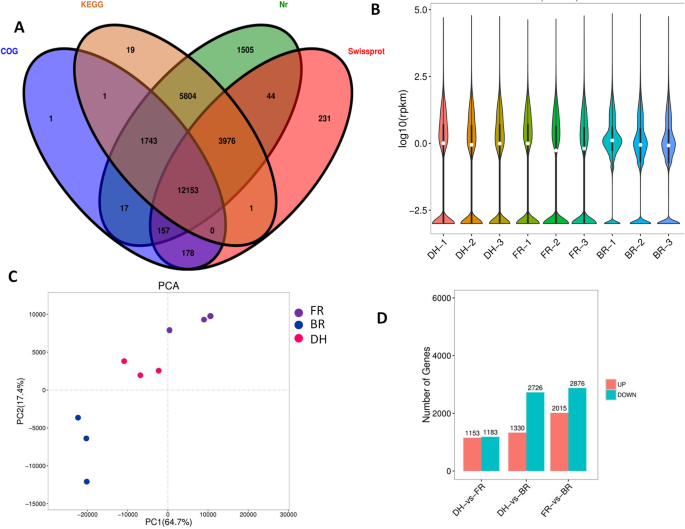
为了了解不同筏品种之间的花青素生物合成基因的表达模式,我们在肉样品中分析了基因表达(三种生物重复)。共生成85.70 GB原始数据。在删除低质量读取后,将99%的原始数据保存为下游分析的清洁数据(表2).总体而言,测序的质量很高,如高Q30得分(> 91%)和对未知核苷酸的准不存在(n)所示。使用Trinity工具,我们共组装了49,212,589bp序列,其中含有53,850个ungenenes,N50长度为1647 bp(表3.;图2).通过基准通用单拷贝立即(BUSCO)V.3 [40].De Novo转录组中出现了70%的完整Buscos,表明了质量优良的装配(图)3.).使用kegg,swissprot,cog和nr数据库获得25,830个unigenes的功能注释,其中包含12,153个未在所有这些数据库中注释(图。4.一种)。对已发表的基因组序列的转录物进行爆炸检索表明Hylocereus SPP。和甜菜属(图4.).基因表达是基于Reads Per kb Per Million Reads (RPKM)方法估计的。总的来说,DH和FR表现出与BR相似的基因表达谱(图。4.b).基于基因表达谱,我们对9个样品进行主成分分析,以评估3个品种的生物重复和聚类模式的质量。数字4.C表明,大多数生物复制密切相关,并且可以观察到三种品种的清晰分离,表明在这三种品种中存在转录活性的大差异。比较成对的品种,以检测差异表达基因(DEGS)。在红色(DH)和粉红色(FR)样品之间获得最低数量的液位,而在有色样品(DH和Fr)和白色肉品种(Br)之间检测到最高数量的含量(图。4.d)。特别地,我们观察到与DH和FR相比,BR倾向于压制数百个基因的表达水平,该机构可以与差动肉着色相关联。
类黄酮 - 花青素途径的基因分析
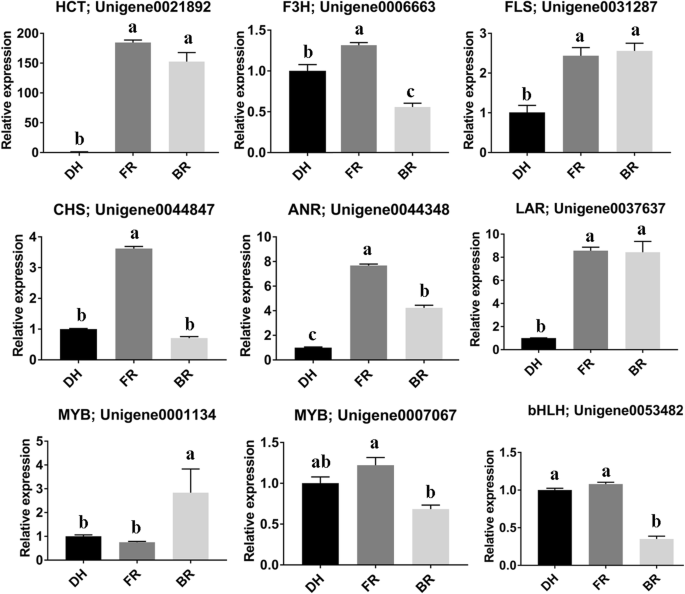
已知各种结构基因催化植物中花青素的生物合成。总共有33种参与黄酮类花青素途径的基因被注释Hylocereus SPP。转录组。其中12个基因在3个品种间有差异表达。然后基于这些DEGs重建类黄酮-花青素途径(图。5.).结果表明,参与花青素生物合成早期和晚期的结构基因受到不同程度的调控。所有直接参与花青素生物合成的基因,如反式肉桂酸4-单加氧酶(C4H:Unigene0008383.),Chalcone合成酶(CHS:Unigene0044847.),Naringenin 3-Dioxygenase(F3h;Unigene0006663.),黄酮类化合物3'-单氧化酶(F3'H:Unigene0044457.),黄酮类化合物3',5'-羟化酶(F3'5'H:Unigene0020548.),二氢烷醇4-还原酶(DFR:Unigene0053420.)、花青素合酶(ANS;Unigene0029010),在红色(DH)和粉色(FR)样品中表达量高于白色(BR)样品。显然,C4H、DFR、F3’5’h和ANS在BR中不表达,这可能是限制花青素生物合成的一个机制。花青素的生物合成途径与莽草和奎尼酸的生物合成、黄酮醇的生物合成、槲皮素的生物合成和原花青素的生物合成等其他相关途径相互竞争[41.].在这里,我们鉴定了几个DEGs (shikimate O-hydroxycinnamoyltransferase, HCT:Unigene0021892),黄酮合成酶(FLS:Unigene0031287;Unigene0051509.),白藻藻蛋白还原酶(LAR:Unigene0037637.)和花青素还原酶(ANR:Unigene0044348.),催化这些竞争的途径和这些基因在FR和BR样品中表达比DH样品更高。
黄酮类化花青素生物合成基因Hylocereus spp.样本间表达差异和不受调控的基因分别以蓝色和黑色突出显示。肉桂酸4-羟化酶(C4H)、查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、类黄酮3 ' -单加氧酶(F3 ' h)、类黄酮3 '、5 ' -羟化酶(F3 ' 5 ' h)、二氢黄酮醇4-还原酶(DFR)、花青素合酶(ANS)、亮色花青素还原酶(LAR)、shikimate O-hydroxycinnamoyltransferase (HCT)、花青素还原酶(ANR)、udp -类黄酮葡萄糖转移酶(UGT)。直方图显示了不同样本中的基因表达。数据代表三个生物重复的平均值。误差条代表三个生物重复的标准差。DH、FR和BR分别代表红色、粉色和白色的肉样
转录因子在三个品种间表达差异较大
转录因子(Transcription factor, TF)是调节其他基因表达水平的特殊基因,是决定时空转录活性的主要角色[42.].在12,153个注释的unigenes中,编码tf的基因有921个,大部分为bHLH、bZIP、C2H2、ERF、MYB和WRKY家族成员(图S)5.).检索了所有编码TFs的DEGs(223个基因),结果表明bHLH、MYB和ERF是较活跃的TFs,它们可能不同程度地调节参与颜色形成的结构基因Hylocereus SPP。果肉(表S2).值得注意的是,与红色栽培品种(DH)相比,大多数这些TFS在白色和粉红色品种(BR和FR)下发现,表明需要高转录活性来形成红颜色。
QRT-PCR验证所选基因
九次可包括在类黄酮 - 花青素途径中涉及六次(图。6.)和三个TF编码基因(Unigene0001134(MYB),Unigene0007067(MYB),Unigene0053482.(bHLH)),通过qRT-PCR检测其转录水平。所有被测基因在品种间均有显著差异表达,表达倍数变化趋势与RNA-seq报告相符(图1)。6.).该结果表明,本研究提出的RNA-SEQ报告和随后的解释是可靠的。
讨论
本研究的目的是研究三种植物的果实代谢组特征Hylocereus SPP。并探讨花色苷在颜色形成中的作用。开花后30天的果实,由于颜色变化主要发生在这一阶段,所以在本研究中采收并使用[19].虽然之前的研究调查了代谢物Hylocereus SPP。果实,他们没有向这种异国情调物种中提供的初级和继发生物活性成分的多样性提供深刻的见解[17那19那34.].通过使用广泛靶向的代谢组学方法,我们确定和量化了广泛的代谢物Hylocereus SPP。我们的研究结果表明含有高浓度的氨基酸、脂类、碳水化合物、多酚、维生素和其他生物活性分子。有趣的是,检测到的主要代谢产物的浓度Hylocereus SPP。水果高于一些常用的水果,如goji [43.枣[44.],使它成为一个优秀的营养果实。红色的Hylocereus polyrhizus尤其受到消费者,本研究中使用的品种Da Hong在中国广泛种植和高度消耗。然而,我们的结果表明它具有低水平的几种氨基酸和脂质。在三种品种中观察到的营养成分的多样性很有趣,因为它可以在旨在产生增强的营养质量的育种计划中利用育种计划[33.那45.].最近,基于代谢物的基因组宽协会研究(MGWA)作为定位与植物中代谢物浓度的变异相关的功能基因的有效方法[46.].因此,作为我们研究的视角,我们将设计一个全面的mGWAS,包括一个大型和多样化的面板Hylocereus SPP。解读果实营养品质遗传基础的品种[47.].
水果的颜色是消费者偏好和市场价值的主要决定因素[38.].花青素是负责在植物器官(如水果和花)中观察到各种颜色的主要次生代谢产物[48.].然而,在一些自核糖植物种类中,已经提出贝甲是主要颜料,取代花青素[49.].由于在同一植物或组织中没有检测到这两种色素,因此就提出了它们相互排斥的假设[21那22那23那24.].但是,没有提供明确的证据,以迄今为止解释植物王国的这种好奇现象。以前的研究表明着色Hylocereus SPP。果皮和果肉归因于甜菜碱的存在,特别是甜菜青素[17那31.那32.那33.].与此同时,其他研究也报道了在Hylocereus SPP。[34.那35.那36.那37.].这表明两种色素在Hylocereus SPP。,反驳了花青素和甜菜碱在同一物种/组织内相互排斥的范式。在本研究中,我们从三种不同的果皮样品中鉴定了五种不同的花青素Hylocereus SPP。品种(无花果。3.),证明除了具有良好特征的甜菜碱外,Hylocereus SPP。水果还含有花青素。因此,需要深入的生化和功能基因组学研究来探索和阐明花青素和贝妥加的机制Hylocereus SPP。水果。这些花青素的积累水平,特别是花青苷3-葡萄糖苷、花青苷3-芦丁苷、飞燕花青素3-O-(6- o -丙二酰)- β -葡萄糖苷3-O- β -葡萄糖苷和飞燕花青素3-O- β - d -葡萄糖苷5-O-(6-香豆素- β - d -葡萄糖苷)与红肉着色呈正相关,这意味着这些化合物是红色的部分原因。为了证明这一论断,我们进一步对三个品种的转录组进行了测序和从头组装。在最近的转录组组装中Hylocereus polyrhizus茎,徐等人。[50.)奇怪的报道vitis Vinifera虽然两个物种的距离相对较远,但它们共享的转录本数量最多。甜菜属与我们组装的转录组具有最高的转录组相似性,这一结果与这两个物种都属于石竹目相一致。值得注意的是,所有参与早期和晚期类黄酮-花青素生物合成途径的基因编码酶都已被鉴定Hylocereus SPP。转录om,表明存在功能途径。
植物组织中花青素含量的变化归因于参与生物合成途径的关键基因表达水平的差异[51.].通过比较不同品种的果肉颜色,我们可以鉴别出不同表达的花青素生物合成基因,这些基因可能会影响颜色的形成,正如之前在萝卜中所记载的[52.],李属米拉[53.] 和lagerstromemia indica.[54.].有趣的是,本研究突出了12个关键基因,其中7个直接参与花青素生物合成途径,在有色品种(红色和粉色)中显著高于白色品种。相反,我们观察到参与花青素生物合成竞争途径的其他5个基因(莽草和奎尼酸途径、黄酮醇生物合成途径、槲皮素生物合成途径和原花青素生物合成途径)在红色品种中均受到抑制,而在粉色和白色品种中显著增加。在全球范围内,很明显,白色品种倾向于抑制花青素生物合成途径,并将底物转移到其他竞争途径。柚皮素含量高,是花青素途径的关键上游底物[55.];高水平的槲皮素,其生物合成与白花青素生物合成竞争[56.,花青素含量低完全支持了我们的结论。相比之下,红色品种的花青素生物合成途径优先于其他途径,花青素的产量高,柚皮素和槲皮素的产量低。3.).最后,粉红色的材料似乎在花青素生物合成途径和竞争途径之间保持平衡。这些涉及花青素生物合成和其他途径之间的竞争的机制也在植物种(如萝卜)中报告[52.],Mimulus lewisii[57.],矮牵牛[58.那59.]和lisianthus [60.].
花青素生物合成基因的分子调控在植物中得到了广泛的研究,是定制着色工程材料的有效途径[61.那62.].转录因子(TF)是一种特殊的基因,它调节其他基因的表达水平[42.].据报道,MYB和BHLH是控制花青素生物合成基因的表达水平的主要TFS [63.那64.那65.].在我们的研究中,我们还观察到几个MYB和bHLH基因在三个品种间的差异表达,其中大部分在红色品种中表达上调。这表明它们对花青素生物合成基因具有正向控制作用。预测这些MYB和bHLH转录因子的特异性靶基因,有助于筛选调控肉色的候选基因Hylocereus spp.如Qiao等人提出的那样。[54.],构建连接候选调控因子及其靶标的基因共表达网络可能是一种有效的方法。
结论
三种代谢谱Hylocereus SPP。果肉颜色差异较大的品种在果实营养品质上存在大量的代谢物。我们在三个品种中检测到不同水平的花青素分子,并通过转录组综合分析表明它们可能对肉色有贡献。这涉及到花青素生物合成和其他途径之间的竞争。本研究为进一步深入剖析花青素与甜菜碱在植物色素形成中的重要作用提供了重要的理论基础Hylocereus SPP。这项研究的发现将有助于分子育种人员努力提高水果的吸引力和质量Hylocereus spp.
方法
植物材料
三Hylocereus SPP。,包括Hylocereus polyrhizus简历。达香港(DH),Hylocereus undatus cv。白油(BR)和杂交Hylocereus polyrhizus x Hylocereus undatus简历.本研究中使用了各种肉颜色的FEN ROU(FR),并由广东省农业科学院果树研究所提供,中国广州,广州。本文的相应作者(新鑫张教授)进行了植物材料的正式鉴定。没有这种材料的凭证样本已被沉积在公开的植物标本中。广东广州市广东省农业科学院果树研究所的农场种植了所有品种。在2019年9月5日开花后30天收获水果。从每种品种的六个果实(生物重复)中切割肉样品,并立即在液氮中冷冻以供以后使用。
代谢分析
按苏州市标准程序进行提取物制备、代谢物提取、鉴定和定量Bionovogene.苏州,中国代谢组织平台.
代谢物提取
共18个样品(6个生物重复)进行代谢物提取。每个样品约200mg被准确称重并插入2ml EP管中。然后,加入0.6 mL 2-氯苯丙氨酸(4ppm)甲醇(−20℃),涡旋30 s;加入100 mg玻璃珠,将样品放入tissue elysis II组织研磨机中。样品在25 Hz下研磨60 s。将试管置于室温超声浴中15分钟;25℃1750 g离心10 min,上清液经0.22 μm膜过滤,得到制备的样品进行液相色谱-质谱(LC-MS)分析;每样20 μL混匀作为质量控制样品(用于监测各混匀池分析结果的偏差,并与分析仪器本身产生的误差进行比较)。其余提取液进行LC-MS检测。
色谱条件
色谱分离在配备有AcquityULLC®HSST3(150×2.1mm,1.8μm,水)柱的热能终极3000系统中进行,保持在40°C的柱。自动进样器的温度为8°C。分析物的梯度洗脱在水(D)中的0.1%甲酸和0.1%甲酸中,以0.25ml /分钟。在平衡后,将在2μL中注射2μL。溶剂A(v / v)的增加的线性梯度如下使用:0〜1分钟,2%a / c;1〜9分钟,2%〜50%a / c;9〜12分钟,50%〜98%a / c;12〜13.5分钟,98%a / c;13.5〜14分钟,98%〜2%A / C;14〜20分钟,2%C阳性模型(14〜17分钟,2%A阴性模型)。
代谢物数据分析
样本数据处理按照Smith等人的描述进行[66].原始数据通过Proteowizard软件(v3.0.8789)转换成mzXML格式(xcms输入文件格式)。基于公共代谢组数据库中的代谢物信息和自建的MetWare数据库(http://www.metware.cn/),用次要光谱信息定性分析代谢物。使用Liu等人所述的XCMS封装进行峰鉴定,过滤,对准。[67].主成分分析(PCA)采用R包(http://www.r-project.org/).
使用ESI-HPLC-MS / MS测定选定的花青素
三种花青素的标准,包括Cyanidin 3-葡糖苷(CAS编号:7084-24-4),Cyanidin 3- rutinoside(CAS编号:18719-76-1)和德尔司蛋白3-罗丁诺苷(CAS号15674-58-5)从默克(德国)购买。如上所述,使用电喷雾电离/高性能液相色谱/串联质谱(ESI-HPLC-MS / MS)方法在1260 Infinity II HPLC(Agilent Systems,USA)上进行样品制备,代谢物提取和定量。
转录组测序和分析
RNA提取、文库构建和测序
采用Trizol试剂盒(Invitrogen公司,Carlsbad, CA, USA)提取RNA。RNA质量检查、富集和文库构建遵循Gene Denovo Biotechnology Co (Guangzhou, China)的标准程序进行,之前由Zhuang等人描述[52.].测序在Illumina HiSeqTM 4000平台进行。
过滤原始读取和DE Novo组装
原始读取被fastp过滤[68](版本0.18.0),所获得的清洁读数是使用Trinity组装的De Novo [69] 软件。基准通用单拷贝Orthologs(Busco)v.3 [40]用于转录组装配验证。
接下来,重新调整成绩单以构建未成原并在不同的数据库中注释,包括NR,Swiss-Prot,Kegg和Cog / Kog。提交给植物TFDB的蛋白质编码序列(http://planttfdb.cbi.pku.edu.cn/)来预测转录因子。计算单基因表达并归一化为Reads Per kb Per Million Reads [70].
微分表达式
差异表达分析由edgeR Bioconductor package进行[71]基于假发现率(FDR)<0.05的两个样品和绝对折叠变化≥2。
实时定量pcr (qRT-PCR)的基因表达
采用qRT-PCR方法从3个品种的肉样品(3个重复)和特异性引物中提取RNA(表S3.)以下描述Dossa等人。[72].我们使用了肌动蛋白基因作为基因表达标准化的内源控制。基因相对表达量根据2-ΔΔct方法 [73].
统计分析
进行差异分析,然后进行Tukey HSD的平均比较试验,比较三种品种。使用R 3.6.2进行数据分析。
数据和材料的可用性
本研究期间产生的RNA-SEQ数据集已提交给NCBI SRA:SRP250877。
改变历史记录
2021年5月20
缩写
- DH:
-
大宏,皮特亚品种
- FR:
-
Fen Rou,Pitaya品种
- BR:
-
白肉、火龙果品种
- PCA:
-
主成分分析
- QC:
-
质量控制
- ESI-HPLC-MS / MS:
-
电喷雾电离/高效液相色谱/串联质谱
- RPKM:
-
每百万千克读数读取
- DEG:
-
差异表达基因
- QRT-PCR:
-
实时定量逆转录PCR
参考文献
- 1.
Drieher ml。全水果和水果纤维出现健康效果。营养素。2018; 10:1833。
- 2.
Rebecca Ops,Boyce AN,Chandran S.颜料鉴定和红龙果的抗氧化特性(Hylocereus polyrhizus).生物技术学报2010;9:1450-4。
- 3.
Le Bellec F,Vaillant F,Imbert E. Pitahaya(Hylocereus.一种新的水果作物,一个有前途的市场。水果。2006;61:237-50。
- 4.
Bauer R等人。仙人掌系统系统倡议。2003; 17:3-63。
- 5。
红火龙果不同提取物的抗氧化活性Hylocereus polyrhizus)种子。Int J Food Prop. 2011; 14:1171-81。
- 6。
紫火龙果(Hylocereus.spp)基因型。Zeitschrift fur Naturforschung C. 2007; 62:636-44。
- 7.
龙果品种形态、同工酶和维生素C含量的变化。生物科学。2009;1:131-7。
- 8.
Sonawane MS。龙果的营养和药物价值。亚洲j os。2017; 12:267-71。
- 9.
3 .红火龙果和白火龙果的抗氧化和抗增殖活性及其与黄酮类化合物和多酚含量的相关性。食品科学。2011;76:38-45。
- 10.
Strack D,Vogt T,Schliemann W.贝纳兰研究的最新进展。植物化学。2003; 62:247-69。
- 11.
泡沫克拉,萨蒂马,阿卜杜拉·纳,阿卜杜拉MH,Salman Im,Rathore Ha,Johns EJ。龙果提取物对大鼠链脲佐菌素诱导糖尿病氧化应激和主动脉僵硬作用的影响。医教室。2010; 2:31-5。
- 12.
吃火龙果治疗各种疾病。金光锡箔;2006.15至21页。
- 13。
wiyaningsih A, Setiyani O, Umaroh U, Sofro MA, Amri fHylocereus costaricensis.)孕妇中血红蛋白和红细胞水平的果汁。Belitung护理J. 2017; 3(3):255-64。
- 14。
Lira SM, Dionísio AP, Holanda MO, Marques CG, Silva G, Correa LC, Santos G, de Abreu F, Magalhães F, Rebouças EL, Guedes J, Oliveira DF, Guedes M, Zocolo GJ。火龙果(Hylocereus polyrhizus(F.A.C. Weber) Britton & Rose), UPLC-QTOF-MSE.评估成人斑马鱼中毒性和抗寒性效果。食物res int。2020; 127:108701。
- 15.
Stintzing Fc,Carle R.花青素和植物,食物和人类营养的玻璃糖苷的功能性质。趋势食品SCI技术。2004; 15:19-38。
- 16。
Jain G, Gould KS。甜菜碱色素是植物花青素的功能同系物吗?Environ Exp Bot. 2015; 119:48-53。
- 17.
徐德辉,李淑娟,许德,金永祥,赵志刚,李淑娟。红白火龙果甜菜碱合成及抗氧化活性的代谢谱分析。食品科学,2014;62(34):8764-71。
- 18.
植物甜菜碱:化学和生物化学。植物化学,2015;117:267 - 95。
- 19.
吴勇,徐军,何勇,石敏,韩旭,李伟,张旭,闻旭(Hylocereus polyrhizus)。分子。2019;24(6):1114。
- 20。
Montoya-Arroyo A,Schweiggert RM,Pineda-Castro Ml,Sramek M,Kohlus R,Carle R,Esquivel P.紫色斗鱼细胞壁多糖的表征(Hylocereus.sp)果皮。食物Hydrocoll。2014;35:557 - 64。
- 21.
斯塔福德公顷。花青素和甜菜碱:相互排斥途径的进化。植物科学。1994;101:91-8。
- 22.
Clement JS, Mabry TJ。石竹科色素的进化:系统综述。神物铺子学报。1996;109:360-7。
- 23.
石竹科植物中复杂色素的进化。新植醇。2011;190:854 - 64。https://doi.org/10.1111/j.1469-8137.2011.03687.x.
- 24.
冯志刚,张志刚,张志刚,等。甜菜碱在石竹科植物中生物合成的研究进展。新植醇。2019;224:71 - 85。
- 25。
Shimada S,Inoue Y,Sakuta M.Anthocyanidin合酶在非花青素的血芳基氏种类。工厂J. 2005; 44:950-9。
- 26。
王志强,王志强,王志强,等。石竹科植物花青素合成基因的转录调控。J Exp Bot. 2007; 58:957-67。
- 27。
Shimada S,Takahashi k,Sato Y,Sakuta M.二氢萘酚4-还原酶C c cDNA在血上的非花青素生品。植物细胞生理。2004; 45:1290-8。
- 28。
黄志刚,李志刚,李志刚,等。甜菜碱作物和观赏植物抗灰霉病能力、抗氧化能力和色素积累研究进展。中国科学技术大学学报2017;114:9062-7。
- 29.
Hatlestad GJ, Akhavan NA, Sunnadeniya RM等。甜菜Y位点编码花青素myb样蛋白,激活甜菜碱红色素途径。Nat麝猫。2015;47:92-6。
- 30。
杨勇,罗沛智,王敏,冯涛,Smith SA, Brockington SF, Maeda HA。酪氨酸通路调控的放松是石竹科植物色素沉着进化的基础。新植醇。2018;217:896 - 908。
- 31。
Wybraniec S, Platzner I, Geresh S, Gottlieb HE, Haimberg M, Mogilnitzki M, Mizrahi Y.从藤仙人掌中提取甜菜青素Hylocereus polyrhizus.植物化学。2001;58:1209-12。
- 32。
丁p,ahmad hs,razak ara,saari n,mohamed mtm。塑体超微结构,叶绿素内容物和色彩表达在卡住的香蕉成熟期间(Musa Acuminata.'威廉姆斯')在18°C和27°C。n z j作物霍尔科科学。2007; 35:201-10。
- 33.
Tel-zur n, mizrahi y, cisneros a, mouyal j, schneider b, Doyle jj。藤本仙人掌(仙人掌科)的表型和基因组特征。植物资源学报。2011;58:1075-85。
- 34.
Vargas MD,Cortez Ja,Duch Es,Lizama AP,MéndezCh。龙果皮中存在的花青素的提取与稳定性(Hylocereus undatus).食品Nutr Sci。2013; 4:1221-8。
- 35.
Sudarmi S,Subagyo P,Susanti A,Wahyuningsih A.简单地提取龙果(Hylocereus polyrhizus)剥落为天然染料着色剂。eksergi。2015; 12(1):05-7。
- 36.
Abang ZD,Makhtar N,Mohd Jy,Muhamad I.使用微波辅助技术从红龙果(Hylocereus Polyrhizus(Weber)Britton&Rose)的封装花青素的效率和热稳定性。Chem Eng Trans。2015; 43:127-32。
- 37。
Prabowo I, Utomo EP, Nurfaizy A, Widodo A, Widjajanto E, Rahadju P.红龙果皮(Hylocereus polyrhizus)提取物花青素部位特征及抗氧化活性研究今日药物发明。2019;12:670-8。
- 38。
消费者对具有信用属性的水果和蔬菜的偏好:一篇综述。Int Food Agribusiness Manage Rev. 2011; 14:121-42。
- 39。
华奇珍,陈朝朋,祖天宁,王加聪,吴建勇,陈建勇,张志科,赵廷堂,胡国宝,秦庆华。不同果肉颜色红皮火龙果的代谢组学特征。植物生理生化。2018;126:117-25。
- 40。
Waterhouse RM, Seppey M, Simão FA, Manni M, Ioannidis P, Klioutchnikov G, Kriventseva EV, Zdobnov EM. BUSCO从质量评估到基因预测和系统基因组学的应用。2018; 35:43 - 8。
- 41。
黄酮类化合物:介导植物对其栖息地适应的代谢网络。植物科学学报。2014;5:620。
- 42。
Banerjee N, Zhang MQ。在酵母中鉴定控制细胞周期的转录因子之间的协作性。核酸Res. 2003; 31:7024-31。
- 43。
关键词:代谢组学,枸杞,营养品质,代谢组学,中国代谢物。2020;星期日晚上。
- 44。
张Q,王L,刘Z,赵Z,赵j,王z,周g,刘p,柳m。转录组和代谢谱析出机制Ziziphus Jujuba.磨皮的颜色。食品化学。2020;312:125903。
- 45.
Tel-Zur N,Dudai M,Raveh E,Mizrahi Y.各种藤蔓仙人掌杂种的选择(Hylocereus.spp)自交。植物品种。2012;131:681-5。
- 46.
罗J.植物中代谢物的基因组宽协会研究。CurrOp植物BIOL。2015; 24:31-8。
- 47.
方C,罗杰,王科。营养代谢物的多样性:源自作物育种的起源,解剖和应用。前植物SCI。2019; 10:1028。
- 48.
何乔,阿志兰,邓街,林思敏。花青素和花青素:色素作为食品、医药成分的潜在健康益处。食品营养学报2017;61:1361779。
- 49。
红紫色素的新分类及其系统发育意义。纽约:罗兰出版社;1964.
- 50。
徐M,刘C-L,罗杰,齐Z,燕Z,傅y,魏S-S,唐·转录组脱皮田脱诺分析Pitaya(Hylocereus polyrhizus)溃疡病引起Neoscytalidium Dimidiatum..BMC基因组学。2019;20:10。
- 51。
郑涛,谭伟,杨华,李涛,刘斌,张丹,林辉。MYB75/HAT1/ tpl转录抑制对花青素积累的调控作用。公共科学图书馆麝猫。2019;15:e1007993。
- 52。
庄H,娄Q,刘H,韩H,王Q,唐Z,MA y,王H.副转录组组合揭示的绿色和紫色萝卜中的花青素差异调节。int j mol sci。2019; 20:4387。
- 53。
赵飞,崔玉英,曾晓霞。转录组学和代谢组学分析对野生桃mira Koehne果实发育和果肉着色的新认识。BMC Plant Biol. 2019;19:463。
- 54。
奇Z,刘某,曾h,李y,王x,陈y,王x,cai n。探索稳定紫红色叶片表型下面的分子机制在Lagerstroemiaindica cv中。乌木余烬。int j mol sci。2019; 20(22):5636。
- 55。
德克松·雷克林。黄酮类化合物和异黄酮 - 一种代谢工程的金矿。趋势植物SCI。1999年; 4:394-400。
- 56。
Crozier A, Jaganath IB, Clifford MN。膳食酚:化学、生物利用度和对健康的影响。Nat Prod rep 2009; 26:01 - 43。
- 57.
元yw,rebbocho ab,sagawa JM,Stanley Le,Bradshaw HD JR.Hy族蛋白和黄酮化合物生物合成之间的竞争产生了模拟物种之间花卉颜料的空间模式变化。Proc Natl Acad Sci U S A. 2016; 113(9):2448-53。https://doi.org/10.1073/pnas.1515294113.
- 58.
Davies KM, Schwinn KE, Deroles SC, Manson DG, Lewis DH, Bloor SJ, Bradley JM。通过改变黄酮醇合成酶和二氢黄酮醇4-还原酶对底物的竞争,提高花青素产量。Euphytica。2003;131:259 - 68。
- 59.
SAITO R,Kuchitsu K,Ozeki Y,Nakayama M.在Marginal Picotee花瓣开发过程中的花青素和相关化合物的时空代谢调节矮牵牛织布达(茄科)。植物学报2007;120(4):563-8。
- 60.
Nielsen K,Deroles Sc,Markham Kr,Bradley MJ,Podivinsky E,Manson D.反义黄黄烷醇合成酶在Lisianthus改变共色性和花朵颜色。mol品种。2002; 9:615-22。
- 61。
JAAKOLA L.新见解果实中的花青素生物合成调节。趋势植物SCI。2013; 18:477-83。
- 62。
眼见为实:工程花青素和类胡萝卜素生物合成途径。《生物技术》2008;19:190-7。
- 63。
Allan Ac,Hellens Rp,Laing Wa。MYB转录因子颜色的果实。趋势植物SCI。2008; 13:99-102。
- 64。
Gonzalez A,Zhao M,Leavitt JM,Lloyd Am。在拟南芥幼苗中TTG1 / BHLH / MYB转录复合物调节花青素生物合成途径。工厂J. 2008; 53:814-27。
- 65。
Lloyd A,Brockman A,Aguirre L,Campbell A,Bean A,Cantero A,Gonzalez A.在MyB-BHLH-WD重复(MBW)颜料调节模型中的进步:添加腕子因子和一个花青素MYB的共同选项对于贝纳坦法规。植物细胞生理。2017; 58:1431-41。
- 66。
史密斯CA,WANT EJ,O'Maille G,Abagyan R,Siuzdak G.XCMS:使用非线性峰对准,匹配和识别处理代谢物分析的质谱数据。肛门化学。2006; 78:779-87。
- 67。
关键词:大黄酚-8- o -β- d -葡萄糖苷,L-02细胞,代谢组学杂志。2019;9:1530。
- 68。
陈氏,周Y,陈Y,Gu J. Fastp:超快速的一体化FastQ预处理器。生物信息学。2018; 34(17):I884-90。https://doi.org/10.1093/bioinformatics/bty560.
- 69.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q等。没有参考基因组的RNA SEQ数据全长转录组件。NAT BIOTECHNOL。2011; 29:644-52。
- 70。
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold B.用RNA-SEQ进行测绘和量化哺乳动物转录om。NAT方法。2008; 5(7):621-8。https://doi.org/10.1038/nmeth.1226.
- 71.
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010; 26:139-40。
- 72.
张晓霞,周瑞,周强,杨敏,西赛N,迪乌夫D,王磊,张晓霞。不同DNA甲基化程序对干旱和淹水的响应。植物科学。2018;277:207-17。
- 73。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据−ΔΔCt方法。方法。2001;25:402-8。
致谢
不适用。
资金
这项工作得到了科学创新战略专项基金的补助金,高级农业科学院(R2019YJ-XD001)。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备手稿。
作者信息
从属关系
贡献
zx设计实验,F r进行材料采集和qRT-PCR分析;S q提供了所有的Hylocereus SPP。材料;Z X.,Z J.和F R.分析了数据并写了稿件。Z J.提供了改进稿件的建议。所有作者都阅读并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
本文已撤回。有关详细信息,请参阅退缩通知:https://doi.org/10.1186/s12870-021-03005-6“
补充信息
附加文件1:图S1。
三个中选择的花青素数量的测定Hylocereus SPP。利用ESI-HPLC-MS/MS方法鉴定品种。DH、FR和BR分别代表红色、粉色和白色的肉样。数据代表三个生物重复的平均值。误差条代表三个生物重复的标准差。条形图上不同的字母表示在P.< 0.05。
附加文件2:图S2。
单基因的长度分布。
附加文件3:图S3。
评估通过基准标记通用单拷贝外科(BUSCO)确定的转录组完整性。
附加文件4:图S4。
NR数据库同源物种分布分析。
附加文件5:图S5。
编码转录因子的基因数。
附加文件6:表S1。
在三个中检测到444个代谢物的离子强度Hylocereus SPP。品种。数据代表六个生物重复的平均值。DH,FR和BR分别代表红色,粉红色和白色的肉体样本。
附加文件7:表S2。
三种转录因子的差异表达基因Hylocereus SPP。品种。DH、FR和BR分别代表红色、粉色和白色的肉样。
附加文件8:表S3。
基因引物序列用于实时定量PCR。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
风扇,R.,Sun,Q.,Zeng,J.等等。缩回的文章:花青素途径对脱皮果肉着色的贡献。BMC植物BIOL.20,361(2020)。https://doi.org/10.1186/s12870-020-02566.2.
已收到:
公认:
发表:
关键词
- 花青素
- Betalains
- 植物的颜色
- 水果品质
- RNA-SEQ.
- Widely-targeted代谢组学