抽象的
背景
果皮颜色在黄瓜商业价值中起重要作用,主要由叶绿素和花青素的含量和组成决定。因此,了解果实肤色组成中涉及的相关基因和代谢组合对于黄瓜质量和商品价值至关重要。
结果
结果表明,果皮中叶绿素A,叶绿素B和类胡萝卜素含量高于果皮上白(浅绿色皮肤)。细胞学观察表明LV的果皮细胞中存在更多的叶绿体。通过代谢分析,在两种基因型的果皮之间存在总共162种显着不同的代谢物,包括40种黄酮,9香兰酮,8黄酮,6个花青素和其他化合物。与LV相比,在白果皮中,检测到果皮的果皮颜色至关重要的花青素和黄酮醇。通过RNA-SEQ测定,在两个品种之间鉴定了4516个差异表达基因(DEGS)。进一步分析表明叶绿素生物合成基因的低表达水平,例如chlM那p和n在白皮书果皮中引起叶绿素或叶绿体。同时,建立了一种预测的花青素生物合成的监管网络,以说明涉及许多次数4CL.那CHS.和UFGT..
结论
该研究在使用代谢物和RNA-SEQ分析中发现了不同果实颜色的两种黄瓜基因型之间的显着差异。我们奠定了了解黄瓜肤色形成的分子调控机制,探索有价值的基因,这有助于黄瓜育种和果皮颜色的改善。
背景
果实肤色是商业价值的基本特征,主要由花青素和叶绿素的含量和组成决定[1那2].叶绿素提供绿色色素沉着,并包含叶绿素A和叶绿素B分子。叶绿素代谢可以分为三个主要步骤:叶绿素合成,叶绿素循环和叶绿素降解。一系列重要的酶参与叶绿素代谢,例如谷氨酸-TRNA还原酶(HEMA),卟啉合酶(HEMB),镁嵌合酶亚单位H(CHLH),镁原激蛋白O-甲基转移酶(CHLM),蛋白氯化物还原酶(POR),叶绿素B还原酶(NOL)[3.那4.].果皮主要由叶绿素代谢引起,在果实发育早期呈现绿色,而在果实发育后期以黄色、橙色和红色为主[5.那6.那7.那8.].
花青素,影响果子颜色的最突出的颜料,由来自苯基丙醇和黄酮类化合物生物合成途径的复杂酶催化。广泛的建设性基因参与了花青素生物合成,如苯丙氨酸氨裂解酶(朋友), 4-香豆酸:辅酶a连接酶(4CL.),Chalcone合成酶(CHS.)和花青素合成酶(答) [9.那10那11].他们之中,朋友是花青素合成期间的重要因素[12].类黄酮次生代谢产物由黄酮醇和花青素合成的分支途径合成。以往的研究报道,各种类黄酮在抵御紫外线和植物病原体、雄性生殖能力的发展以及生长素的运输等方面发挥着至关重要的作用[13].参与花青素和黄酮合成的酶是多酶复合物[14,色素倾向于在液泡(花青素和原花青素)或细胞壁(phlobaphenes)中积累[15].
黄瓜果皮肤色对商品销售和品种改进具有很大的影响。以前关于黄瓜果皮的研究主要关注遗传和基因初级映射,如白果皮基因(W.),深绿果皮基因(DG.),绿色水果表皮基因(DG.),黄绿色水果表皮基因(yg.),沉闷的果皮浅绿色果皮基因[16那17].这W.通过两个基于SNP的标记,ASPCR39262和ASPCR39229快速映射到33.0-KB区域。18].然而,黄瓜果皮颜色的分子机制和色素代谢尚不清楚。
不同OMIC的组合有助于我们深入了解植物生长,发育和对不同压力的反应的几个关键基因[19那20.].例如,组合的转录组和代谢组学分析在解释植物表型中提供了一些提示[21.那22.那23.].通过比较转录组分析,报告显示,黄酮类化合物涉及几种新的基因功能[24.其他生化途径[25.].此外,代谢物有效地分析了代谢途径中参与的基因作用,并提供了有关探索基因的基本信息[21.].比较OMICS已成功应用于水果中,以阐明不同次生代谢物与表达基因之间的关系[23.].然而,到现在为止,通过转录组和代谢组学分析黄瓜果实肤色的调控机制的报告依旧缺乏。
本研究的目的是利用联合分析方法挖掘黄瓜果实果皮颜色发育的相关基因。选用华南型黄瓜品种的两个高自交系“绿”和“白”。结果表明,吕果皮中花青素、黄酮和黄酮醇的含量明显高于白果皮。此外,我们还检测到了叶绿素和花青素生物合成过程中的关键结构基因、转录因子和其他调控因子。本研究为黄瓜果皮颜色及其对果实品质的复杂影响提供了重要信息。
结果
LV和Bai的表型分析
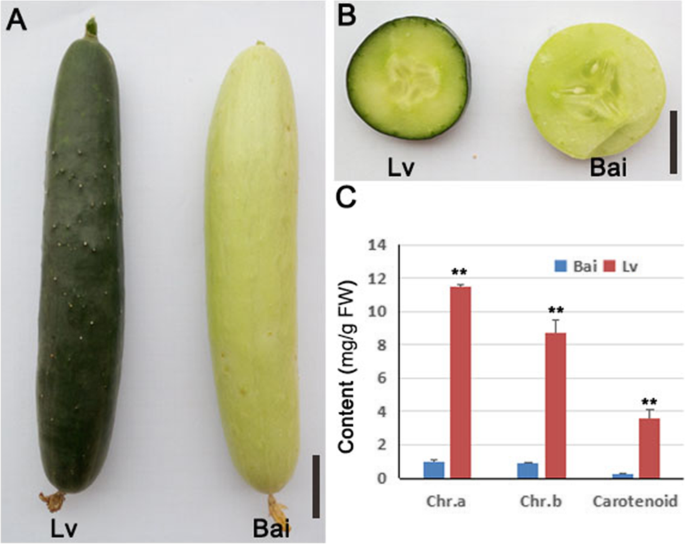
在幼果肤色的LV和白皮肤上发现了明显的差异,LV的果皮肤色是深绿色,但白细是浅绿色(图。1a,b)。叶绿素A和叶绿素B的含量分别为0.99mg / g和0.90mg / g,其显着低于LV(图。1C)。类胡萝卜素的结果由叶绿素A和叶绿素B组成,类胡萝卜素含量高于白皮素(图。1C)。这些结果表明在LV果皮中累积了更多颜料。
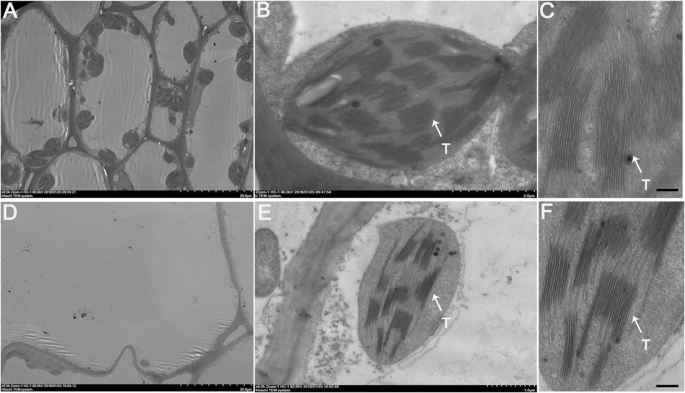
以上结果说明吕氏果皮中色素积累较多,这促使我们进一步确定吕氏与白氏细胞中叶绿体是否存在差异。通过透射电镜(TEM)分析,我们发现白细胞中叶绿体的存在比Lv细胞少(图。2a-c)和Bai叶绿体中类囊体的数量(图。2D-F)小于LV,这些结果与叶绿素A和叶绿素B的定量分析一致。
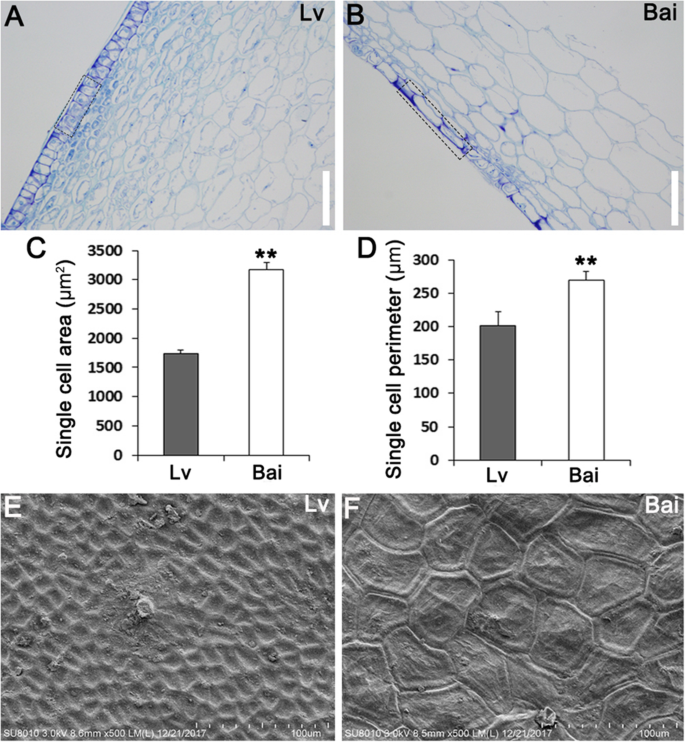
石蜡切片法进行观察皮肤表皮细胞的布置。结果表明,在吕表皮细胞更紧密地布置成比白(图3.Bai的单细胞面积和单细胞周长均大于Lv(图2)。3.C,D)。另外,通过扫描电子显微镜(SEM)测定,LV果皮上的表面细胞小于相同视野中的Bai(图。3.e,f,s1).
代谢物鉴定
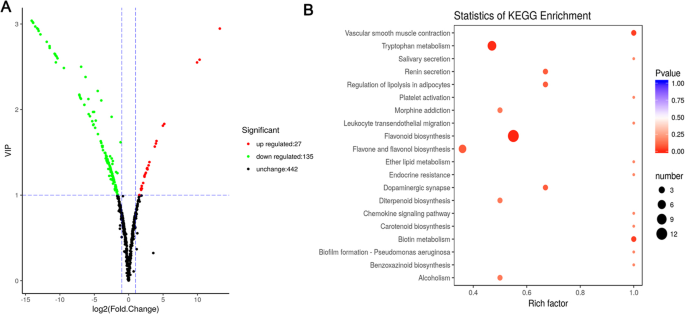
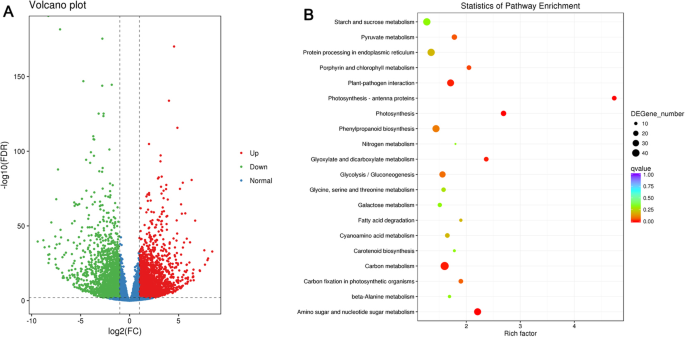
为了在黄瓜果实发育过程中挖掘代谢物(图。1),在本研究中进行了代谢程序。梳理总离子电流(TIC)和多重反应监测(MRM)型材的检测,我们最终鉴定了LV和白样之间的162个显着的代谢物(135次调节,27个下调)(图。4.一个),其包括:40种黄酮,黄烷酮9,7种黄酮醇,6个花青素,和其它化合物(表S =1).代表代谢物,特别是花青素,黄酮,和黄酮醇于表中列出1.
代谢产物的功能分析
经鉴定,白果皮中6种花色苷含量均显著低于吕氏果皮。在白中,芍药苷和花青素o -丙二酰己苷分别比Lv减少了0.00035-和0.16倍,说明花青素含量的降低部分导致白的色度较低(表)1).除烟蛋白外,大多数黄酮醇的增量在Bai中有0.006-至0.16倍,而Bai的含量占据突出981.85倍。检测黄酮是代谢物中的最大代谢物的最大数量,其两种黄瓜基因型之间的显着含量变化。其中,Chryseeriol O-Hexosyl-O-Rutinoside和Tricetin O-丙二酰己糖苷,Luteolin O-Sinapoylhexoside在LV中显示出显着较高的含量,而Tricin O-葡萄糖醛酸在Bai增加3.62倍(表1).此外,KEGG (Kyoto Encyclopedia of Genes and Genomes)分析显示,不同代谢物主要富集类黄酮生物合成和色氨酸代谢,表明类黄酮在一定程度上影响了果皮颜色的发育(图2)。4.b)。
通过转录组鉴定不同表达的基因(DEGS)
来自黄瓜果皮的总RNA用于CDNA文库的构建。除了含有适配器的原始读取和低质量读取后,LV和Bai的清洁读数的总数约为2400万(表S.2).随后将这些清洁读数映射到黄瓜9930基因组(Huang等,2009)。将大约90%的清洁读数映射到参考黄瓜基因组,超过98%唯一映射(表S.2).基因表达水平的相关系数来自每根的三种生物学重复的含量大于0.84(图。2A),主成分分析(PCA)显示生物复制聚类在一起(图S2b)。的相关系数和PCA建议表达图案具有重复样品之间的相似性(图:S2).总共4516只具有2417个上调和2099个下调基因的4516次,LV VS Bai鉴定出来。(图。5.一种;表S.3.).结合转录组分析,204个DEGs属于44个家族的转录因子(TFs),其中87个DEGs表达下调,118个DEGs表达上调(图S3.).在AP2 / ERF,bHLH结构,MYB,NAC和WRKY家庭均DEGS前五TF(图:S3.).选择总共15个基因通过使用QRT-PCR来确认RNA-SEQ数据,包括9和6个基因分别从下调节蛋白和上调。QRT-PCR结果与RNA-SEQ数据一致(图。4.).此外,Csa3G904140在LV和Bai中检测到不同的表达,以及Csa3G904140是控制栽培黄瓜的未成影果实[26.].
二基因的功能分析
为了了解Degs在形成果皮的形成中的作用,分类为包括生物学过程,分子功能和使用GO(基因本体)的细胞组分的标准化分类系统,并且总共67次进行了显着富集。在生物过程中,46个GO术语显着富集,例如囊体膜组织,光合作用和叶绿素生物合成过程。在分子函数类别中,发现两个GO类别,包括颜料结合和叶绿素结合富集。在细胞组分类别中,19个术语,如光系统I,光源II,塑性化板,叶绿体包膜,叶绿体,微管,叶绿体,叶绿体,叶绿体类囊体,以富集(表S4.).然后,我们使用了Kegg Pathway数据库来检查DEGS相关的路径。在LV和BaI的比较上富集的推注DEG的前20个途径在图2中示出。5.湾强烈富集碳机制,氨基糖和核苷酸糖代谢,光合作用,卟啉叶绿素代谢和苯丙烷生物合成的相关基因(图5.b)。
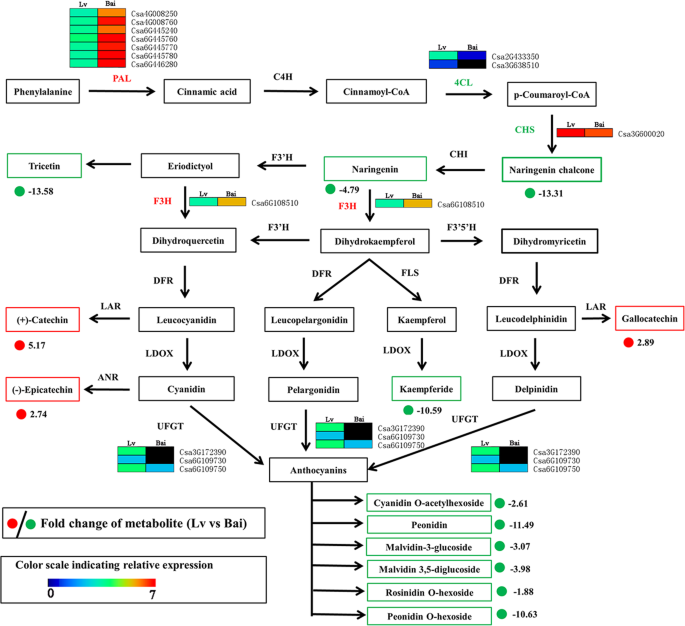
GO和KEGG分析结果表明,DEGs参与了叶绿素代谢相关途径,这些结果与吕和白的叶绿素a和叶绿素b差异一致。因此,我们进一步详细研究了DEGs参与叶绿素代谢,并建立了预测的叶绿素生物合成途径(图)。6.).在叶绿素生物合成途径中鉴定了十四次Degs。有趣的是,与LV相比,大多数这些DEG在BAI中被抑制的表达,除了一个DEG(Csa7G068600).
对参与叶绿素代谢途径DEGS的详细信息。HEMA,谷氨酰-tRNA还原酶;HEML,谷氨酸-1-半醛2,1-氨基变位酶;HemB,胆色素原合酶;HEMC,hydroxymethylbilane合酶;HEMD,尿卟啉原-III合成酶;血红素,尿卟啉原脱羧酶HEMF,粪卟啉原III氧化酶;CHLH,镁螯合酶亚基H;CHLM,镁 - 原卟啉O-甲基转移酶; chlE, magnesium-protoporphyrin IX monomethyl ester; por, protochlorophyllide reductase; DAR, divinyl chlorophyllide a 8-vinyl-reductase; CAO, chlorophyllide a oxygenase; chlG, chlorophyll/bacteriochlorophyll a synthase; NOL, chlorophyll(ide) b reductase; HCAR, 7-hydroxymethyl chlorophyll a reductase; CLH, chlorophyllase
预测类黄酮的调控网络,以及花青素生物合成途径
为了更好地了解吕和白预测的类黄酮合成代谢产物与基因之间的关系,我们将代谢产物与基因结合,建立预测网络(图)。7.).Lv和Bai之间的13个代谢物表达差异显著,其中10个代谢物表达下调(柚皮素查尔酮、柚皮素、三黄素、山奈花苷)和6个花青素(花青素o -乙酰己苷、芍药苷、Malvidin 3- o -glucoside、Malvidin 3,5 -二葡萄糖苷、芍药苷o -己苷、和Rosinidin O-hexoside))以及三种上调的代谢物((+)-儿茶素,(-)-表儿茶素,没食子儿茶素)。七个朋友基因(CSA4G008250那CSA4G008760那CSA6G445240那Csa6G445760那Csa6G445770那Csa6G445780和Csa6G446280)和一个F3h.(CSA6G108510)基因在白族中表达上调,而在吕族中表达上调。此外,还有两个结构基因4CL.(CSA2G433350.和Csa3G638510)的- 2.44倍和- 1.70倍的下降CHS.(Csa3G600020)是 - 1.14倍下调,这可能在很大程度上解释了LV中柚皮蛋白醌和柚皮蛋白的高积累。同时,三UFGT.基因(Csa3G172390那CSA6G109730和Csa6G109750)表现出−5.30-、−5.86-和−1.65倍的下调,这也支持6种花色苷在白花中明显低于吕花。
讨论
组合各种遗传资源的OMIC分析为理解植物特征的分子基础提供了重要信息,如无花果颜色[22.],Lilium“Tiny padhye”双色发育[23.]花生抗盐胁迫[27.].黄瓜显示出果实肤色的大变异,如深绿色,黄色,浅绿色和牛奶白色,这些颜色是物种或特定基因型的特征。特别是,深绿色和浅绿色的肤色黄瓜品种对客户产生了极大的兴趣。在该研究中,使用RNA-SEQ和代谢物在果皮颜色(LV和Bai)上表征了两种不同的黄瓜。LV施加深绿色,叶绿素含量更多,更紧密地排列表皮细胞。通过分析不同代谢物,黄酮,黄酮,黄酮和花青素主要是对肤色差异的原因。此外,通过RNA-seq的结合转录水平,我们发现与叶绿素合成的几个度的视角,花青素合成和TFS都可能参与了色。
LV和Bai中皮肤颜色叶绿素合成途径的调节网络
叶绿素是决定许多水果果皮颜色的重要色素。叶绿素合成已经得到了很好的研究,在叶片和果实中已经发现了叶绿素合成的重要相关基因[8.那28.].刚等人。[29.)发现,BpGLK1生理和超微结构分析对叶绿素含量降低和叶绿体发育缺陷的作用。此外,编码酶的许多关键基因参与叶绿素合成途径,如哈哈那萱草那chlH那chlM那p那n[3.那4.].例如,哈哈,这是在塑体中引发叶绿素合成的酶,催化来自谷氨酸-TRNA的5-氨基乙酰丙酸的生物合成[30.].这CHLH.催化原因卟啉IX以形成Mg-原卟啉IX。镁原子霉素IX单甲基酯形成催化叶绿素合成途径的镁原子卟啉IXChlm.[31.].这p是一种重要的酶,其催化氯化氯化物产生叶绿素,并且该步骤是转化叶绿素的关键中间步骤[32.].在此,在叶绿素合成途径中鉴定了14只次数。在叶绿素合成途径合成中的表达,包括一个哈哈,一个萱草,一个麻,两个血红素,一个HEMF.,一个chlH,一个c.高级别,一个ch,一个p,一个克,两个n与吕氏相比,白氏的比例有所下降。这些与叶绿素合成途径有关的关键基因的表达下调可能导致叶绿素a和叶绿素b合成受到抑制。这些结果与绿比白的叶绿素和叶绿体积累量高是一致的。
花青素和黄酮醇合成分析果皮颜色
代谢产物是细胞生物调节过程的最终产品[33.]代谢组分分析使我们能够调查生物过程与植物特征之间的关系[34.]。花青素和黄酮类化合物的含量对果实的色泽和口感有重要影响[22.那35.].组合与转录组分析的新代谢数据被发现参与花青素和黄酮醇合成的基因,从而寻找有用的信息,以说明黄瓜果实中不同颜色的现象。花青素是类黄酮生物合成途径的最终产品,我们的搜索显示在该途径中的LV和Bai之间的不同表达了许多Degs,例如上游4CL.那CHS.那F3h.和UFGT..以前的研究表明4CL.基因在分化点黄酮醇合成中起重要作用[36.].这CHS.已被发现在花瓣着色过程中负责花青素的生物合成马吕斯红果(37.].我们的研究确定了两个4CL.(CSA2G433350.和Csa3G638510) 和CHS.(Csa3G600020)与LV相比,Bai中的基因下调,以及两种代谢物(Naringenin Chalcone和Naringenin)在Bai中调节。它表明了CHS.在白皮书中受到大幅压抑,导致在花青素合成中的两个重要代谢物的下调。此外,我们检测到六种类型的花青素在白和LV之间表达不同。在花青素生物合成中,糖基是一种至关重要的进展,其催化UFGT.在拟南芥[38.].这UFGT.表达与不同植物花青素积累相关联39.那40].我们的结果表明三个UFGT.白中花青素的表达被抑制,这可能解释了与绿中相比,白中花青素表达下调的六种类型。其他研究者发现花青素-3- o -鼠李糖苷,一种花青素是主要的花青素,在无花果皮中起重要作用[41.那42.]。,虽然在我们的数据中未检测到Cyanidin-3-O-rhamnoglucoside,但表明它可能不是黄瓜果皮中的主要花青素。
患有植物皮肤白细胞生物合成的TFS分析
花青素和类黄酮的合成是由几个结构基因和TFS如MYB,bHLH结构和WDR蛋白调节。bHLH结构蛋白可以与来自不同子组R2R3-MYBS相互作用,并且形成具有WDR的三元复合物。的MBW(MYB-的bHLH-WDR)配合物参与黄酮,花青素,原花色素和(PAS)生物合成途径[43.那44.那45.].其中,MYB作为花青素累积调节的主要决定性元素,可以通过分别与BHLH相互作用来激活一些枢轴花青素生物合成基因[46.那47.].梨的异位表达Pymyb10.在拟南芥导致其在未成熟的种子中的色素沉着,表明Pymyb10.作为调节花青素积累的正因素[48.].过度的桃子PpMYB10.1在烟草中可以增加表达UFGT.,导致转基因烟草中更高的花青素积累和更深的红花[49.].同样,MyB可以通过调节表达来调节花青素生物合成UFGT.在葡萄中[50.]和苹果[51.].在我们的研究中,通过转录组检测到16个MYB转录因子,其中8个MYB在Lv果皮中的表达水平高于Bai,说明Lv果皮中MYB参与花青素合成相关基因的表达。
BHLH通过形成综合体与MYBS形成复合物在花青素合成中发挥着重要作用[41.].过度表达SlPRE2,非典型的BHLH,加速幼苗形态发生,并在番茄果实中产生了叶绿素和类胡萝卜素的降低的成熟果实[52.].OverexpressingArabidopsis Glabra3.(BHLH)表现出比番茄果实的对照样品更高的花青素积累[53.].在本研究中,与Bai相比,Lv果皮中有11个bHLHs上调,7个bHLHs显著下调,表明bHLHs在花青素生物合成中的作用不同。
结论
总的来说,首先通过代谢物和RNA-SEQ进行黄瓜果皮颜色的调节机制。LV的叶绿素A,叶绿素B和类胡萝卜素的含量高于Bai,并且在LV中存在细胞学观察结果。存在更多的叶绿体。负责果皮肤色发育的至关重要的花青素和黄酮醇在代谢物中显示出两种黄瓜基因型之间的显着不同。几个基因,特别是p和n那CHS.和UFGT.在白细胞和LV果皮之间分别在叶绿素合成和花青素生物合成途径中起重要作用。在一起携带这些不同的代谢物和在我们研究中发现的基因为黄瓜肤色中的叶绿素合成和花青素生物合成途径提供了重要的代谢和功能作用。
方法
植物材料和生长条件
本研究选用2个黄瓜高自交系(吕白),为本课室经多代自交后选育的自交系。吕和白均为华南型品种,果皮颜色差异较大。种子在培养皿中黑暗的环境中发芽。然后在14 h/10 h、28°C/18°C、白天/晚上的培养室内培养。当植物生长到两个真正的叶期,并转移到空旷的田野,中国广州市白云地区。
白果皮中叶绿素和类胡萝卜素含量分析白皮肤皮肤
基于谢等人描述的程序,测量来自LV和Bai的果皮的叶绿素和类胡萝卜素含量。(2019)[6.].Approximately, 0.2 g fruit skin were placed in 5 ml solution (9:1 = acetone: 0.1 M NH4.哦)。将样品以3000 r离心20分钟,收集上清液。重复相同的方法,并使用己烷收集上清液。最后,通过分光光度计在663nm和645nm(Beckman Coulter Du-800,USA)的吸收波长下通过分光光度计测量混合上清液。用生物学重复进行测量。
扫描和透射电子显微镜
黄瓜果皮风干后,用日立SU8020变压扫描电镜(HITACHI SU8020 variable pressure SEM, HITACHI, Japan)观察表皮细胞。对于透射电镜分析,将果皮切成小块,收集固定,过程按照Wang et al. (2019) [54.].
代谢物分析
使用武汉Metuke生物技术有限公司(中国武汉)(武汉)(武汉)使用众所周置的代谢物方法进行代谢物分析。(武汉)(http://www.metware.cn/).使用搅拌机(MM 400,RetSch)将冷冻干燥的果皮粉碎成粉末。果皮(纵向沿果实1厘米宽和0.2厘米)在雌性花朵张开后10-15天进行果皮(宽度为0.2厘米),并且三个重复了LV和Bai。将总共100mg粉末在4℃下用1.0ml 70%甲醇水溶液萃取过夜,然后以10,000g离心10分钟。之后,这些提取物被LC-ESI-MS / MS系统吸收,过滤并分析并分析。分析条件是基于Wang等人所述的程序。(2017)[22.].使用MRM方法进行代谢物的定量[33.].将具有显着差异差异的代谢物设置在投影(VIP)≥1的可变重要性的阈值和折叠变化≥2或≤0.5[55.].
转录组分析
果皮(沿着果皮宽度宽0.2厘米厚的果皮,沿着中间部分厚度为0.2厘米),在女性花朵开放后10-15天进行了采样。基于Trizol试剂(Takara,Japan)的指示,为RNA提取制备了总共12种样品(每种LV和Bai复制)。RNA提取后,使用RNEasy Minelute Clean Up套件(Qiagen,德国)纯化并浓缩RNA。然后,制备来自每种样品的约2.5μg的RNA用于构建测序文库,并且通过安捷伦生物分析仪2100系统检测文库质量。在Illumina Hiseq2500平台上测序图书馆准备,并产生125/150bp配对末端读数。使用Bowtie V2.2.3建造参考基因组的指数,并使用TOPHAT V2.0.12对准与参考基因组对齐[56.].
基因表达水平通过FPKM分析(每百万千次读数的每千碱基碎片)方法[57.].基因的FPKM通过铆钉和袖带(V2.2.1)(V2.2.1)计算[58.].DESeq2 was used to identify DEGs according to the two criteria(fold change ≥2 or ≤ 0.5and q ≤ 0.01). WEGO software and KEGG database were employed to GO enrichment and bigological pathway enrichment, respectively [59.那60.].
定量实时PCR(QRT-PCR)验证
通过使用SYBR预混物(Takara,Japan)对Abi Prism 7900HT机(Applied Biosystems,USA)对QRT-PCR反应进行QRT-PCR反应,并根据Wang等人进行QRT-PCR反应过程。(2019)[54.].qRT-PCR所用引物均列于表S5..
数据和材料的可用性
在RSCADION NUMBER PRJNA647135下提交到NCBI序列读取存档数据库的所有序列数据。
缩写
- QRT-PCR:
-
定量实时聚合酶链反应
- DEG:
-
差异表达基因
- TEM:
-
透射电子显微镜
- SEM:
-
扫描电子显微镜
- Tic:
-
总离子电流
- MRM:
-
多重反应监测
- Kegg:
-
京都基因和基因组百科全书
- PCA:
-
主成分分析
- TF:
-
转录因子
- HEMA:
-
谷氨酰-tRNA还原酶
- HEML:
-
谷氨酸-1-半醛醛2,1-氨基醛酶
- 麻线:
-
卟酚in合成酶
- HEMC:
-
Hydroxymethylbilane合酶
- HEMD:
-
尿卟啉-III合成酶
- 血红素:
-
尿卟啉原脱羧酶
- HEMF:
-
Coproporphyrinogen三世氧化酶
- chlh:
-
镁切酶亚单位H.
- chlM:
-
镁原激霉素O-甲基转移酶
- chle:
-
镁原卟啉IX单甲基酯
- POR:
-
蛋白氯化物还原酶
- 敢:
-
二乙烯基氯化物A 8-乙烯基还原酶
- 曹:
-
叶绿素加氧
- chlG:
-
叶绿素/菌胆油1合成酶
- NOL:
-
叶绿素(IDE)B还原酶
- HCAR:
-
7-羟甲基叶绿素还原酶
- clh:
-
叶绿素
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- C4h:
-
Trans-Cinamate 4-羟化酶
- 4CL:
-
4-香豆素:COA Ligase
- CHS:
-
Chalcone合成酶
- Chi:
-
Chalcone异构酶
- F3h:
-
黄烷酮3-hydroxylase
- F3'H:
-
黄酮类化合物3'-羟化酶
- DFR:
-
二氢烷醇4-还原酶
- 弗尔斯:
-
黄酮醇合成
- LDOX:
-
Leucoanthocyanidin Dioxygenase.
- UFGT:
-
UDP葡萄糖 - 类黄酮3-O-曲糖基转移酶
- LAR:
-
白芯苷素还原酶还原酶
- ANR:
-
花青素还原酶
参考文献
- 1.
Rosianskey Y,Dahan Y,Yadav S,Freiman Ze,Milo-Cochavi S,Kerem Z,Eyal Y,Flaishman Ma。在开发和成熟中授予授粉的叶绿素代谢与普通术植物。Planta。2016; 244(2):491-504。
- 2。
Kayesh E,Shangguan L,Korir NK,Sun X,Bilkish N,Zhang Y,Han J,Song C,Cheng Z,方J.果皮颜色和花青素的作用。acta physiol植物。2013; 35(10):2879-90。
- 3.
Tanaka R,Tanaka A.高等植物中的四吡咯生物合成。Annu Rev植物Biol。2007; 58:321-46。
- 4.
Tanaka A,Tanaka R.叶绿素新陈代谢。CurrOp植物BIOL。2006; 9(3):248-55。
- 5。
Lee Sb,Kim Je,Kim Ht,Lee G,Kim B,Lee JM。遗传映射C1.基于GBS的BSA-SEQ的基因座透露伪响应调节器2作为控制胡椒果色的候选基因。Al Appl Genet。2020; 133(6):1897-910。
- 6。
解Ĵ,姚S,明Ĵ,邓L,在叶绿素和类胡萝卜素含量和参与柑桔类水果色素代谢响应于oleocellosis基因的表达曾K.变异。食品化学。2019; 272:49-57。
- 7。
孟尔,扇子z,张q,王c,gao y,deng y,zhu b,zhu h,chen j,shan w等。BEL1-LIKE HOMEODOMAIN 11调节番茄果实中叶绿体开发和叶绿素合成。工厂J. 2018; 94(6):1126-40。
- 8。
关键词:荔枝,成熟,果皮,转录组分析,叶绿素降解,类黄酮合成BMC基因组学。2015;16(1):225。
- 9。
黄酮类化合物:生物合成、生物功能和生物技术应用。植物科学学报2012;3:222。
- 10.
黄酮类化合物双加氧酶:生物合成黄酮醇和花青素拟南芥蒂利亚纳L. Phytochemistry。2010; 71(10):1040-9。
- 11.
Pelletier MK,Murrell Jr,雪莉BW。黄酮合成酶和白藻藻胺二恶英酶基因的表征拟南芥(进一步证明差异调节“早期”和“晚期”基因)。植物理性。1997年; 113(4):1437-45。
- 12.
花青素通路基因在葡萄果实发育中的表达及其调控的意义。植物杂志。1996;111(4):1059 - 66。
- 13。
黄酮类化合物的生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物杂志。2001;126(2):485 - 93。
- 14。
Saslowsky D,Winkel-Shirley B.黄酮类化酶的定位拟南芥根。工厂J. 2001; 27(1):37-48。
- 15.
移动化学物质在细胞内和细胞外的挑战:洞察植物天然产物的运输。足底。2004;219(5):906 - 9。
- 16。
皮尔斯LK,Wehner Tc。审查黄瓜中的基因和联动基团。Hortscience。1990; 25(6):605-15。
- 17。
Call A,Wehner T. Gene List 2010用于黄瓜。葫芦科合作社批准。2010; 33-34:69-103。
- 18。
刘华,孟H,潘勇,梁旭,焦健,李勇,陈胜,程志忠。白幼果颜色基因的精细遗传定位W.在黄瓜的33.0千克地区(Cucumis sativusl .)。Al Appl Genet。2015; 128(12):2375-85。
- 19。
Moreno-risueno ma,Bulch W,Benfey Pn。OMICS符合网络 - 使用系统方法来推断植物中的监管网络。CurrOp植物BIOL。2010; 13(2):126-31。
- 20.
代谢组学,基因组学,蛋白质组学,酶及其底物和产物的鉴定。植物学报。2005;8(3):242-8。
- 21.
李y,方j,qi x,林m,zhong y,sun l,崔w。果实代谢物和转录组的综合分析显示了类黄酮生物合成中的候选基因Actinidia Arguta..int j mol sci。2018; 19(5):1471。
- 22.
Wang Z, Cui Y, Vainstein A, Chen S, Ma h (榕辣海参果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。前面。植物科学。2017;8:1990。
- 23.
徐L,杨P,冯y,徐H,曹y,唐y,元s,刘x,明j.时尚转录ome分析为百年百合“微小麦利”中的双色冠状发育提供了见解。前植物SCI。2017; 8:398。
- 24。
Yonekura-Sakakibara K, Tohge T, Matsuda F, Nakabayashi R, Takayama H, Niida R, Watanabe-Takahashi A, Inoue E, Saito K拟南芥.植物细胞。2008;20(8):2160。
- 25。
SAITO K,Hirai My,Yonekura-Sakakibara K.用共表达网络和代谢组学解码基因 - “Provogs的大多数报告”。趋势植物SCI。2008; 13(1):36-43。
- 26。
唐海,东X,王杰克,夏杰,谢f,张y,姚x,xu yj,王zj。黄瓜白色未成熟果皮的精细映射和候选基因预测(Cucumis sativusl .)。int j mol sci。2018; 19(5):1493。
- 27。
崔飞,隋宁,段国华,刘艳,韩艳,刘爽,万胜,李国栋。花生盐胁迫与恢复相关代谢产物的鉴定。植物学报。2018;9:217。
- 28。
文昌,林树华,楚峰。亚热带落叶乔木的转录组分析:台湾胶秋叶衰老基因表达谱。植物生理学报。2015;56(1):163-74。
- 29。
刚H,李R,赵Y,刘G,陈S,GLK1转录因子的功能江J.损失揭示了叶绿素合成和叶绿体发育的新见解。J Exp Bot。2019; 70(12):3125-38。
- 30.
王志强,王志强,王志强,等。植物叶绿素合成与降解的研究进展。植物学报。2004;56(1):1 - 14。
- 31。
王志强,洪旭,胡凯,王永强,杜胜,李艳,胡德,程凯,安斌,等。受损的镁原卟啉IX甲基转移酶(Chlm.)将叶绿素合成和植物生长阻止了水稻中。前植物SCI。2017; 8:1694。
- 32.
关键词:原叶绿素氧化还原酶(POR), NADPH,水稻,环境适应大米。2017;10(1):1。
- 33.
Fiehn O.代谢组学 - 基因型和表型之间的联系。植物mol biol。2002; 48(1-2):155-71。
- 34.
杨D,张建,李米,Shi L.代谢组科分析揭示了甘氨酸Soja中的耐盐机制。J工厂增长调节。2017; 36(2):460-71。
- 35.
吴SB,Dastmalchi K,龙C,肯内利EJ。嘉宝果的代谢谱(myrciaria cauliflora.)和其他暗色的果汁。JAgric Food Chem。2012; 60(30):7513-25。
- 36.
孙辉,李永华,冯绍峰,邹伟,郭科,范超,司胜,彭磊。水稻4-香豆酸辅酶a连接酶活性及其对木质素和类黄酮合成的胁迫响应。Biochem Bioph Res Co. 2013;430(3): 1151-6。
- 37。
太极拳,田俊,张俊,歌曲t,姚y。玉米蟹苹果chalcone合成酶基因,mcchs.,调节红色花瓣颜色和黄酮类生物合成。Plos一个。2014; 9(10):E110570。
- 38。
Saito K,Yonekura-Sakakibara K,Nakabayashi R,Higashi Y,Yamazaki M,Tohge T,Fernie AR。黄酮类化合物生物合成途径中拟南芥:结构和遗传多样性。植物生理学。2013;72:21-34。
- 39。
王辉,王C,番W,杨洁,Appelhagen我,吴Y,张P.一种新型糖基转移酶催化葡萄糖转移到糖化花青素的紫色甘薯。J Exp Bot。2018; 69(22):5444-59。
- 40。
宋C,Zhao S,Hong X,Liu J,Schulenburg K,Schwab W.在草莓(Fragaria X ananassa)中的丙烯酰氯葡萄糖糖苷和花青素生物合成中的UDP-葡糖基转移酶。工厂J. 2016; 85(6):730-42。
- 41。
Ercisli S, Tosun M, Karlidag H, Dzubur A, Hadziabulic S, Aliman Y.几种新鲜无花果(榕辣海参L.)从土耳其东北部的基因型。植物食品嗡嗡声。2012; 67(3):271-6。
- 42。
所罗门A,Golubowicz S,Yablowicz Z,Grossman S,Bergman M,Gottlieb He,Altman A,Kerem Z,Flaishman Ma。抗氧化活性和普通果实的抗氧化活性和花青素含量(榕辣海参l .)。中国农业科学。2006;54(20):7717-23。
- 43。
许W,杜伯士C,通过MYB-的bHLH-WDR络合物类黄酮合成的Lepiniec L.转录控制。趋势植物SCI。2015; 20(3):176-85。
- 44.
徐W,粮食D,Bobet S,Le Gourrierec J,泰文·j,克莱门Z,Lepiniec L,Dubos C.通过综合分析MYB-BHLH-WDR复合物及其目标揭示了类黄酮转录监管网络的复杂性和鲁棒性拟南芥种子。新植物。2014; 202(1):132-44。
- 45.
Koes R,Verweij W,Quattrocchio F.FlavOnoids:一种彩色模型,用于生化途径的调节和演变。趋势植物SCI。2005; 10(5):236-42。
- 46.
Petroni K,Tonelli C.最近关于生殖器官中的花青素合成的调控的进展。植物SCI。2011; 181(3):219-29。
- 47.
Allan Ac,Hellens Rp,Laing Wa。MYB转录因子在水果上的颜色。趋势植物SCI。2008; 13(3):99-102。
- 48.
冯S,王Y,阳,徐y,陈X.梨中的花青素生物合成受R2R3-MYB转录因子调节Pymyb10..Planta。2010; 232(1):245-55。
- 49。
Tuan Pa,Bai S,Yaegaki H,Tamura T,Hihara S,Moriguchi T,ODA K.至关重要的作用PpMYB10.1在桃和其等位基因型与肤色表型之间的关系花青素积累。BMC植物BIOL。2015; 15:280。
- 50。
Koyama K,Numata M,Nakajima I,Goto-Yamamoto N,Matsumura H,Tanaka N.新葡萄园MYB转录因子的功能性表征,葡萄中原花青素生物合成的调节。J Exp Bot。2014; 65(15):4433-49。
- 51。
林旺,王志强,王志强,等。一个古老的复制苹果MYB转录因子负责新的红色水果果肉表型。植物杂志。2013;161(1):225 - 39。
- 52。
朱Z,陈刚,郭X,尹W,俞X,胡Ĵ,胡Z.表达SlPRE2,是一种非典型bHLH转录因子,影响番茄植株形态和果实色素积累。Sci众议员2017;7(1):5786。
- 53。
Nukumizu Y,Wada T,Tominaga-Wada R.番茄(Solanum Lycopersicum)的同源物Triptychon.(滑动) 和glabra3.(SlGL3)参与花青素的积累。植物信号学报。2013;8(7):e24575。
- 54。
王M,江B,刘开,林y,梁Z,他x,彭Q.转录组分析在Chieh-qua中提供了对热应激反应的新洞察(Benincasa HispidaCogn。var Chieh-Qua如何)。中华医学杂志。2019;20(4):883。
- 55。
云y,梁f,邓b,赖g,vicentegonçalvescm,lu h,yan j,huang x,yi l,梁玉。基于随机变量组合的可变重要性分析的信息代谢物鉴定。代谢组学。2015; 11(6):1539-51。
- 56。
Fehlmann T, Reinheimer S, Geng C, Su X, Drmanac S, Alexeev A, Zhang C, Backes C, Ludwig N, Hart M,等。表观遗传学。2016;8:123。
- 57.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。
- 58.
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,Salzberg SL,Wold BJ,RNA-SEQ的成绩单组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。
- 59.
叶建军,方磊,郑华,张勇,陈建军,张震,王军,李胜,李锐,Bolund L .,等。WEGO:一个用于绘制GO注释的网络工具。核酸学报2006;34:W293-7。
- 60.
Kanehisa M, Araki M, Goto S, Hattori M, Hirakawa M, Itoh M, Katayama T, Kawashima S, Okuda S, Tokimatsu T,等。KEGG将基因组与生命和环境连接起来。核酸学报2008;36:D480-4。
致谢
作者感谢其他实验室成员提供帮助。
资金
国家重点研发计划项目(no . 2018YFD0100700);广东省自然科学基金项目(no . 2018A030310196);公益性行业(农业)科研专项(no . 201503110-07);高水平农业科学院科技创新战略建设专项(R2019YJ-YB3004),广东省科技计划项目(2020B020220001),广东省农业科学院“十三五”学科团队建设项目,广州市农业产业发展专项资金(1710023);国家农业科学院蔬菜研究所重点实验室开放基金项目(201701)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
MW和Yel设计了实验。MW,LC,XMH,WLL,BJ,ZJL,JQY,PYS,ZQC执行了大部分实验。LC和MW写了这篇论文。QWP编辑了稿件。所有作者都阅读并批准了稿件的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
平均单细胞在吕氏和白氏之间。
附加文件2:图S2。
LV和白果中的相关分析和主成分分析(PCA)。
附加文件3:图S3。
属于LV和Bai中检测到的不同转录因子家族的次数。
附加文件4:图S4。
与转录因子相关基因的相对表达。数据以均数±标准差(N = 9).
附加文件5:表S1。
LV和白果皮肤的差异代谢物。
附加文件6:表S2。
概述从吕和白果皮由RNA-seq的读取。
附加文件7:表S3。
吕氏果皮与白氏果皮的差异表达基因。
附加文件8:表S4。
LV和白果皮DEG的富集分析。
附加文件9:表S5。
qRT-PCR引物列表。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
王,M.,Chen,L.,Liang,Z.et al。代谢物和转录组分析显示叶绿素和花青素代谢途径与黄瓜果皮肤色相关。BMC植物BIOL.20.386(2020)。https://doi.org/10.1186/s12870-020-02597-9.
已收到:
公认:
发表:
关键字
- Cucumis sativusL.
- 代谢物
- RNA-SEQ.
- 叶绿素
- 花青素