摘要
背景
蔗糖磷酸合酶(SPS)基因在不同植物的蔗糖生产中起着重要作用。现代甘蔗品种是高糖品种间杂交而来的蔗糖officinarum和高耐受性物种甜根子草它产生了所有作物中最复杂的基因组之一。尽管甘蔗SPS对糖产量有着深远的影响,但其基因组学仍处于研究阶段。
结果
本研究共鉴定了8条和6条SPS基因序列美国officinarum和美国spontaneum分别地系统发育分析表明SPSD是在禾本科植物谱系中新进化出来的,最近从SPSA进化枝。基于Ka/Ks比值的分子进化分析表明,多倍性降低了水稻的选择压力SPS基因在糖为了探索潜在的基因功能SPS基于RNA-seq和蛋白质组数据分析表达模式,利用代谢组学分析检测糖含量。所有的SPS在库源转换过程中,成员在叶片发育梯度上的表达量呈增加趋势,表明SPSs都参与光合作用吗蔗糖年代它们在双子叶植物中的作用。此外,SPSs的高表达式美国spontaneum并且在stem (SPSA)和叶子(SPSB),推测它们可能参与了这两种植物碳水化合物代谢的差异糖物种,需要进一步的实验验证。
结论
SPSA和SPSB两种基因表现出较高的表达量和差异表达模式糖物种,表示这两个物种SPSs调控网络的形成和蔗糖性状在两者中是重要的吗糖物种。SPSB这表明它是糖积累的主要贡献者,因为它表现出最高的表达水平,并且其表达与糖含量呈正相关。最近复制的SPSD2呈现了两种不同的表达水平糖种属和相对蛋白质含量均以茎部最高,支持新功能SPSD亚科的糖.
背景
植物叶片在光合作用后和其他碳水化合物一起产生蔗糖。关键有机化合物构成了最丰富的可溶性贮藏碳水化合物形式,可直接通过糖酵解利用或通过韧皮部从光合组织运输到非光合组织[1].因此,蔗糖作为固定碳的来源,可以系统地分布在整个植物中,为直接能源生产或长链生物聚合物(如淀粉)的生物合成提供基础资源[2]及纤维素[3.].
蔗糖在细胞质中合成,首先从叶绿体输出磷酸二羟丙酮和磷酸甘油醛。以下过程由一系列酶催化[4]蔗糖磷酸合成酶(SPS)是其中最重要的一种,它催化果糖-6-磷酸(F-6-P)和UDP-葡萄糖(UDP-G)转化为蔗糖-6-磷酸(S-6-P),为蔗糖磷酸磷酸酶(SPP)提供底物。在最后一步中,通过去除磷酸基生成蔗糖。除了众所周知的SPS在源叶蔗糖生物合成中的作用外,SPS在参与蔗糖净降解的异养细胞中也起着重要和关键的作用[5].例如,在发芽过程中观察到内源蔗糖库的显著变化蓖麻子叶(6].蔗糖的这种转换被认为与同时合成和裂解的无效循环有关,这是由SPS磷酸化激活率的变化引起的[7].因此,在许多生理和发育过程中,SPS通过调节淀粉生产和碳水化合物(蔗糖)积累之间的碳分配,在碳水化合物代谢中发挥着至关重要的作用。
首先在Leloir和Cardini提取的小麦胚芽中证实了SPS的作用[8一些植物有多重SPS这些拷贝的基因和表达因发育阶段、组织类型和环境信号而异[9,10,11,12),这表明SPS基因在不同的条件下起着不同的作用。最近的研究表明SPS基因分为三个不同的家族(A、B和C),这些基因在双子叶植物(A家族)和单子叶植物(B家族)中似乎具有不同的进化历史[4].尽管其中一个SPS甘蔗的同型体及其与大麦密切相关的部分序列被归为一个家族,它们比其他双子叶植物的分化程度更高SPSs[4].SPS转化实验表明,SPS是光合作用固定碳在叶片和全植物中分配的主要决定因素[13,14]最近,Mark同时提高了转基因烟草中的SPS和谷氨酰胺合成酶(GS)活性,并发现蔗糖是生长发育的主要决定因素[15].
甘蔗是世界上最重要的食糖作物,占世界食糖产量的80% [16]先前的甘蔗SPS研究表明,所有研究品种的成熟节间SPS活性和转录表达均高于未成熟节间[17].与此同时,相比the low sugar species of sugarcane, the high sugar species showed increased transcript expressions and enzyme activities of SPS at all developmental stages [17].此外,早熟甘蔗品种CoJ64相比,早熟甘蔗品种BO91的SPS表达量显著降低[18].SPS成员是根据公共EST数据库预测的[19,20.],并对Q165和IJ76-514品种扩增产物的DNA片段进行了鉴定,以便鉴定所有可能的等位基因[19,20.].最近的研究表明,甘蔗SPS的n端区域在变构调控中起重要作用[21].尽管SPS在甘蔗中的作用已经有了广泛的文献记载,但由于其复杂的基因组,SPS成员在甘蔗中的基因组序列和生物学功能尚未被确定。美国officinarum和美国spontaneum两个是最重要的吗糖物种不仅因为它们是现代甘蔗品种基因组的主要贡献者,而且它们在制糖方面也存在很大的差异[22].在本研究中,全面描述SPS在分子和进化水平上的家族以及SPS家在两大主要糖物种,我们分析了SPS基因家族在美国officinarum和美国spontaneum并通过对转录组、代谢组和蛋白质组数据的组合分析,阐述了它们的进化历史、结构和表达差异以及可能的调控因子。
结果
的识别SPS基因家族在美国officinarum和美国spontaneum
紫色(美国officinarum, 2n = 80)和AP85-441 (SES208单倍体无性系,2n = 4x = 32)美国spontaneum,2n = 64) [23]代表两大糖物种用于构建BAC文库。八加六SPS-从中分离到含有BAC的菌株美国officinarum和美国spontaneum分别为(表1,平均长度为68.6 kb,最大长度为127.2 kb (BAC id: SES23E05)。TE注释提示,长末端重复序列(Long Terminal Repeats, LTRs)是大多数分离的BACs的主要重复序列(表)1)。推测的基因包括14个甘蔗SPS从选定的bac中注释序列(附加文件1)。在14日SPS其中11个基因包含完整的ORF(开放阅读框),编码序列的长度在1404到1404之间 英国石油公司呼叫3321 为了进一步验证,这些假设SPS基因遭到猛烈攻击高粱SPS在氨基酸水平上,同源性从91到100%不等2)。在本研究中,我们指的是甘蔗SPS基因的使用SPSA来SPSD根据序列相似度与高粱SbSPSs前缀为“So美国officinarum和“党卫军”美国spontaneum.我们还发现了SPS来自最近发表的基因天然蔗糖基因组(24].与6个BAC序列相比,5个无等位基因的基因相似性超过91%(附加文件)2)。有三个基因SPSD2(Sspon.004A0021251, Sspon.004A0021261和Sspon.004A0021270)美国spontaneum基因组。来识别三个的重复SPSD2引用Wang et al.的研究,MCScanX程序被用于分析[25].结果表明Sspon.004A0021251可能是全基因组复制(WGDs)产生的主基因,而Sspon.004A0021261和Sspon.004A0021270是两个串联重复的基因。此外,为了增强序列的可靠性,Sspon.007C0001731, Sspon.004A0021270和Sspon.004A0021251被重新注释(附加文件3.)。
水稻同源基因及等位基因单倍型分析SPS
识别SPS所选bac的同源基因和等位基因,进行保守共同基因分析(附加文件)4)。我们观察到五个高度相似的同向块美国officinarum,美国spontaneum和高粱二色的,表示两个糖种类有5种SPS基因家族成员。比较三个物种的每一个同位块,发现在DNA水平上具有较高的序列一致性和保守的基因顺序(附加文件)4)。例如,三个SPSD1的BAC contigs (LA110E11, SES32E01和SES69 K24)糖,其中两个是等位单倍型美国spontaneum和一个来自美国officinarum.同时,在美国二色的这些序列具有相似的共线性区组,表明SES32E01和SES69 K24为等位基因单倍型美国spontaneum.相似的结果在SPSA,SPSB和SPSC(表1)。的SPS这两个物种的直系同源体非常相似,在成对比较下,序列同源性在95.6%到100%之间(另附文件)5)。
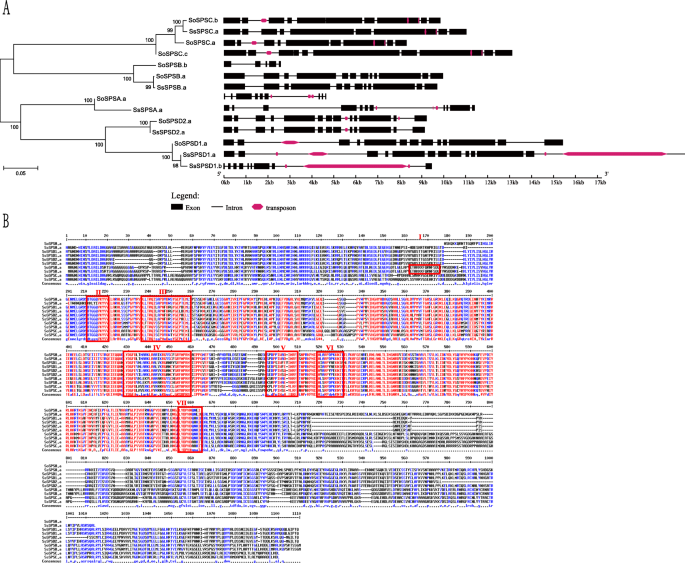
为了进一步比较SPS我们比较了14个等位基因单倍型的外显子-内含子结构SPS序列在美国officinarum和美国spontaneum(无花果。1一个)。SPS基因聚集在一起,等位基因用a、b或c表示。正如预期的那样,大多数同源/旁同源对显示出相似的外显子-内含子结构。例如,三个SPSC等位基因(SoSPSC.a,SoSPSC.b和SoSPSC.c)在美国officinarum和一个等位基因(SsSPSC.a)在美国spontaneum.虽然这些蛋白在氨基酸水平上高度保守,但在同源型和单倍型之间也存在着频繁的差异。我们观察到更长的基因长度和更多的外显子(11 vs . 9)SsSPSA.a相比SoSPSA.a.值得注意的是,一个外显子插入第二个外显子之后SsSPSA.a这个基因似乎在序列的末尾有一个额外的外显子。此外,我们还确定了三个SPSB序列(SoSPSB.a,SoSPSB.b和SsSPSB.a)美国officinarum和美国spontaneum.SoSPSB.a和SsSPSB.a显示出高度相似的外显子-内含子结构,而等位基因为单倍型SoSPSB.b和其他人相比有很大的不同SPSBs.SoSPSB.b基因长度短,外显子少SoSPSB.a和SsSPSB.a.这可能是由于等位基因变异,或者更有可能是由于不完整的基因组组装。相似的结果也在SPSD1.外显子在SsSPSD1.b在数量上比在数量上更短SsSPSD1.a和SoSPSD1.a。
基因结构(一个)及多重比对分析(b)SPS.Ss和So表示2糖物种,包括美国spontaneum和美国officinarum分别为。2b,感兴趣的区域被红色矩形掩盖:光调节磷酸化丝氨酸(I),假定的F-6-P结合位点(II), 14-3-3调节磷酸化丝氨酸和UDP-G结合域(III),渗透调节磷酸化丝氨酸(IV)和各种天冬氨酸-脯氨酸对(DP motif, V, VI, VII)
此外,我们还对基因内含子中的转座因子(TE)进行了注释SPS基因(图。1四)。SPS成员除外SPSB被发现含有TE。的第二个内含子中存在TE插入SPSC最后一个内含子是什么SPSD2在美国officinarum但是在美国spontaneum此外一个large TE was present inSPSD1从美国spontaneum,表明基因组的扩展SPS基因存在于美国spontaneum.
多重比对分析
我们进行了多重比对分析蔗糖SPS相关基因和区域用红色矩形标记,包括光调节磷酸化丝氨酸、推测的F-6-P结合位点、14-3-3调节磷酸化丝氨酸和UDP-Glu结合域、渗透调节磷酸化丝氨酸和各种天冬氨酸-脯氨酸对(图)。1b). SPS蛋白中部序列相似性较高。正如预期的那样,F-6-P结合位点和UDP-Glu结合域在氨基酸水平上高度保守(图2)。1b, II和III)在大多数甘蔗SPS蛋白中。同样,渗透调节的磷酸化丝氨酸(IV)和各种天冬氨酸-脯氨酸对(V, VI和VII)也被保存,表明这些区域在糖生产中发挥重要作用。我们还观察到一些可能分化SPS蛋白功能的突变。例如,SsSPSA F-6-P结合域(II)的一些突变可能修改了其F-6-P结合活性。SPSD家族中丝氨酸(S)向亮氨酸(L)的转化可能影响其在UDP Glu结合中的功能(III)SPS基因在光调节中起着不同的作用独联体- 14种促销员的基本要素SPS基因(额外的文件6)。独联体-与昼夜时钟相关的元素,如昼夜节律和E-box蔗糖SPSs此外独联体在启动子区域预测了参与非生物胁迫的-元素。例如,ABREs (aba响应元件)在6SPS在11个myb中发现启动子和myb结合位点SPS发起人。这些结果表明蔗糖SPS基因可能受生物钟和非生物胁迫的调节。
系统发育与进化分析SPS基因在植物
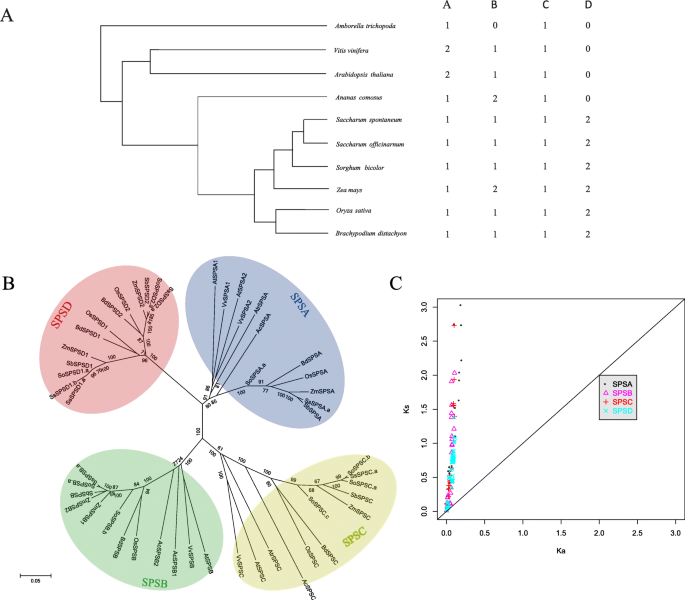
进一步研究甘蔗的进化史SPS我们首先分析了基因SPS来自两种双子叶植物(包括拟南芥和葡萄),五种单子叶植物(包括菠萝comosus,美国二色的,Brachypodium distachyon,玉米和栽培稻)和所有其他开花植物中唯一幸存的姐妹物种(Amborella trichopoda)(图。2所有的)。蔗糖SPS系统发育分析包括本研究中发现的基因(包括等位基因)。2b) 。结果表明,所选植物SPSs被分成4类(SPSA、SPSB SPSC和SPSD)。与先前的研究相似[4],SPSA, SPSB和SPSC亚科存在于单子叶植物和双子叶植物中;而SPSD基因家族只存在于单子叶植物中。这一结果表明SPSD基因是在单子叶和双子叶分化后出现的。此外,SPSD基因家族与亲缘关系较近SPSA比SPSB和SPSC在里面答:trichopoda在美国,我们只确定了两个SPS基因(SPSA和SPSC)(图。2一个)。
非同义取代率(Ka/Ks)是选择压力的一个指标。A Ka/Ks比值< 1与负选择史一致,而Ka/Ks比值> 1表示强正选择[26].我们在每个项目中进行了两两比较SPS基因从选择的植物(图。2c),几乎所有SPS基因的Ka/Ks值均小于1,表明该家族成员处于强纯化选择中。以进一步确定作用于甘蔗的进化力量SPS基因分化后美国officinarum和美国spontaneum的Ka/Ks值SPS基因在美国二色的,美国officinarum和美国spontaneum(附加文件7)。
基因表达谱SPS基因在不同组织的三个发育阶段
研究的表达模式SPS使用两个转录组数据库(详见资料和方法)对其中两个基因家族进行表达分析糖种类(美国spontaneum和美国officinarum)。
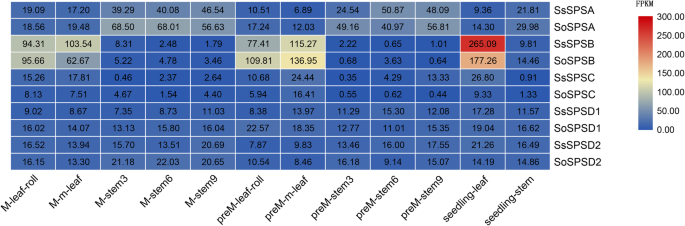
表达SPS3个不同发育阶段(苗期、早熟期和成熟期)的基因聚类为两种趋势,表明两种植物的茎或叶具有显著的表达偏好(图2)。3.)。一种趋势是,与茎相反,这些基因在叶子上的表达要高得多,包括SPSB和SPSC这三个发育阶段的基因,与先前的研究一致[27].此外,SPSB表达量高于对照组SPSC,这表明SPSB显性基因是否在叶片中表达,并在两者的绿色组织中发挥作用糖物种。另一个趋势是,特别是在所有发育阶段,这些基因在茎中的表达水平明显高于叶片中的表达水平SPSA, SPSD1和SPSD2在美国officinarum和美国spontaneum。同样的,SPSA主基因是否在茎中特别表达,特别是在成熟期,这与之前对甘蔗的研究相似SPS基因在节间表达[17].与此同时,SPSA表达量最高SPS和更高的美国officinarum比在s . spontaneum建议SPSA可在甘蔗的运输和贮藏中发挥重要作用。
有趣的是,SPSB叶片中表达量较高美国officinarum相比之下,美国spontaneum在早熟阶段,而更多SPSA转录本在节间积累美国officinarum在成熟阶段比美国spontaneum(无花果。3.),表示的不同表达SPSA和SPSB可能导致了糖产量的差异美国officinarum和美国spontaneum.
基因表达谱SPS叶片发育梯度片段中的基因
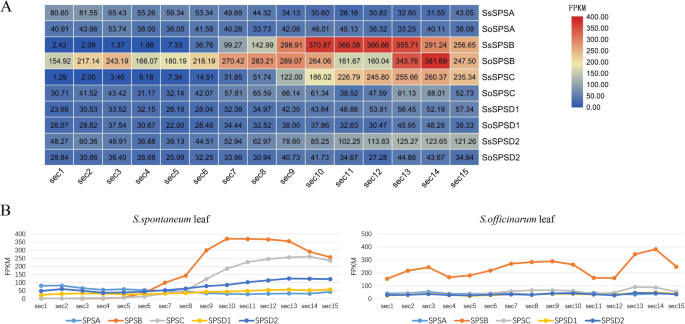
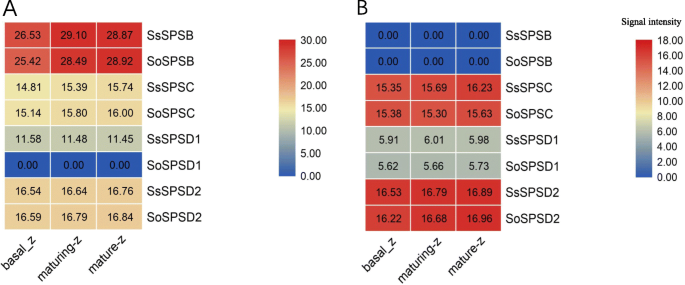
基于上述发现,本研究进一步分析了SPS在叶片发育梯度片段中的表达模式,并发现这两个物种中几乎所有基因的某些表达模式(图。4我们发现了SPS基因表达美国spontaneum与叶片的连续发育梯度一致,而美国officinarum(无花果。4b).另外,更高的特异性表达SPSB在两种植物的叶片中进行了研究(图。4)。
有趣的是,SPSC表达水平低于对照组SPSB虽然表达模式相似,但表明其功能SPSB和SPSC是互补的。此外,本研究还发现SPSA,SPSC和SPSD2基因在美国spontaneum比在s . officinarum相对而言(图。4一个)。
两者的SPS蛋白水平糖物种
为了进一步探索糖合成源组织(叶)和蔗糖积累库组织(茎)中的SPS蛋白水平,我们对发育中的叶和成熟茎组织进行了梯度蛋白质组学分析(图。5)。在叶片中,SPSB的相对蛋白含量(log2,蛋白强度)在各基因家族中最高,这与转录组数据一致。SPSD2的含量远高于SPSB,但仅略高于SPSC。SPS的蛋白质含量在两者之间的差异非常有限糖除SPSD1外,其他物种。茎中SPS基因家族的蛋白质含量与叶组织中的差异很大,支持SPSs参与糖分布的理论。重要的是,茎组织中SPSC和SPSD2的蛋白质水平与叶组织相似,而SPSB和SPSD1的蛋白质水平远低于叶组织ese结果表明,SPSB和SPSD1有助于糖的合成,而不是SPSC和SPSD2。此外,在这两种组织中检测不到SPSA蛋白糖种,表明SPSA的贡献有限。
两者的糖含量糖物种
为了进一步分析甘蔗中SPS的功能,进行了代谢组学分析和与蔗糖性状表型密切相关的小分子浓度的变化糖物种进行。根据幼苗叶片和成熟期茎的两组代谢组数据,发现有两种代谢产物与SPS酶直接相关,即F-6-P (SPS催化蔗糖合成的底物)和蔗糖(SPS催化途径的最终产物)。
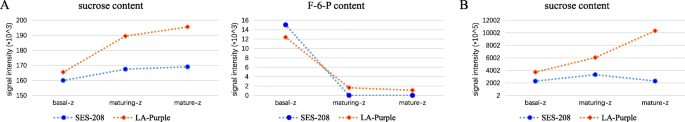
在叶片发育的梯度上,蔗糖含量呈上升趋势美国officinarum和美国spontaneum当叶子成熟时(Fig。6a),而F-6-P含量总体呈下降趋势,说明SPS在两个品种的蔗糖合成过程中发挥着相同的作用。在不同发育阶段的茎秆中,蔗糖含量呈现出不同的趋势,如蔗糖含量显著增加美国officinarum从幼茎到成熟区逐渐增加,然后从成熟区到成熟区逐渐下降美国spontaneum(无花果。6b). F-6-P的水平几乎没有检测到三个茎节美国officinarum和美国spontaneum.苗期叶片和茎中蔗糖含量较高美国officinarum比在美国spontaneum。
讨论
基因进化SPS家庭
在这项研究中,我们使用了广泛收集的植物SPS对基因成员进行系统发育分析,结果证实了以前的分类[4],并揭示了三个群体的存在(SPSA / B / C),包括单子叶植物和双子叶植物,并有一种禾本科特有种SPSD(无花果。1b)。答:trichopoda只包含两个SPS基因(AtrSPSA和AtrSPSC),这表明SPSB新演化的答:trichopoda和其他开花植物(图。2a).进化史蔗糖SPS,按时间顺序从古代到近代进行排序SPSA / SPSC SPSB SPSD1 / SPSD2.
之前的研究表明SPSD基因出现在单子叶-双子叶分化之后[28].在我们的研究中,系统发育分析更准确地表明SPSD基因可能是从SPSA分支(图。2B)和被分成两组,SPSD1和SPSD2,有意思,SPSD基因只存在于禾本科植物中,而不存在于植物中科摩苏,属禾本科谱系外群禾本目订单(29),这表明SPSD在禾本科分支中,基因是单独进化的。在编码区域内,的Ka/Ks比值SPSD基因数远小于1,表明纯化选择是驱动进化的主导力量SPSD基因形成后的两种糖物种。分子进化分析表明,负选择驱动了这些基因的进化,表明它们的功能重要性。
高粱在二倍体属中最近的亲属是糖.对比分析了两种类型的直射影像高粱和糖使研究多倍体化后的具体进化事件成为可能糖.先前的研究表明,多倍体在加速进化适应过程中发挥了强大的作用[30.]一个研究小组检测到四倍体酵母中有益突变的快速传播,以响应在低碳源上的生长[31].研究…的进化压力SPS多倍体中的基因糖,我们计算了美国二色的,美国officinarum和美国spontaneum(附加文件7)。几乎所有具有统计学意义的Ka/Ks两两比较均小于1 (Fisher检验,p < 0.05),表示SPS基因在高粱和糖正在进行净化筛选。然而,Ka/Ks比值在糖显著高于两组高粱和糖(平均 = 0.22对平均值 = 0.12,Mann-Whitney-Wilcoxon检验,p= 0.01775)。这一结果表明,多倍体的选择压力松弛SPS基因在糖这是多倍体中基因冗余的预期结果。
TEs影响的进化SPS基因
TE是大多数开花植物基因组的主要特征,极大地促进了基因组的进化和多样性[32].te是已知的独联体-对基因调控的影响,因为可能的DNA和组蛋白甲基化通常与重复序列有关。先前的研究表明,在两种基因之间观察到高水平的TE变异美国officinarum和美国spontaneum[33].在我们的研究中,比较SPS两个甘蔗种之间的基因TE变异频繁,说明TE在甘蔗中起重要作用SPS进化前后的分化美国officinarum和美国spontaneum. 例如,两个相邻的TEs被插入到基因的第七外显子中SoSPSC.a,SoSPSC.b和SsSPSC.a,表明这些事件发生在两个甘蔗品种分化之前(图。2a).然而,另一个TE插入事件仅在第2内含子中观察到SoSPSC.a和SoSPSC.b而不是SsSPSC.a,表示SPSCs在两者分道扬镳之后,是否正在经历独立的演变糖物种。
SPSD基因在单子叶植物中是独一无二的,我们的研究结果揭示了它们可能经历了完全不同的进化命运。SoSPSD2.a和SsSPSD2.a在外显子-内含子顺序、基因长度和TE分布上都是保守的(图。2然而,它的基因结构似乎SPSD1是不是更保守,最后一个外显子SsSPSD1.a被一个大TE插入中断。此外,SsSPSD1.b与等位基因单倍型相比,其外显子-内含子结构差异较大,TE变异较大SsSPSD1.a。这些结果表明,两个副本新进化SPS甘蔗亚家族的功能趋于多样化,TE变异可能是导致这种多样性的原因,这为TE参与甘蔗基因进化提供了第一个证据糖.
功能分化SPS基因之间的美国officinarum和美国spontaneum
RNA-seq分析显示SPSB在美国officinarum树叶比树叶高美国spontaneum叶片在早熟期(图。3.).此外SPS在叶片中,两者表现出一致的趋势糖种作为发育梯度进行(图。4),表示SPS对幼苗叶片光合作用的响应。
SPSB持续高表达美国officinarum这与基于蛋白质组学分析的SPSB蛋白质的最高相对含量一致,表明SPSB可能是叶片中蔗糖合成的主要基因。结合代谢组数据,我们发现苗期叶片中蔗糖增加,F-6-P减少,这与表达的趋势一致SPS(特别是SPSB因此,在源组织叶片中,我们推测SPS基因在蔗糖合成中起关键作用,这与这两个组织叶片的发育有关糖物种。进一步的相关分析显示,表达之间存在显著的整体相关性SPSB蔗糖含量(阳性,r2= 0.97或0.93)或F-6-P(负,r2= 0.84或0.90)都在美国officinarum而在美国spontaneum(附加文件8)。由于栽培甘蔗的高糖和低糖特性分别是由美国officinarum和s . spontaneum的基因表达SPSB可能对蔗糖的合成和积累起重要作用。这些结果表明SPSB在甘蔗叶片中起着至关重要的作用,它们可能是甘蔗生长生产过程中糖分差异的原因。然而,考虑到相关分析的数据点有限,需要进一步验证实验数据以支持这一推测。
除了SPSB,SPSA在苗期和成熟期也表现出不同的表达模式(图2)。3.)。SPSA在美国officinarum茎比美国spontaneum茎中有9个外显子,可能是由不同的基因结构引起的SoSPSA11个外显子SsSPSA(无花果。1有趣的是,当表达SPSA在发育茎的不同节段和代谢产物的比较中,3种植物之间均存在显著的非线性负相关关系,但有一种例外美国spontaneum其中蔗糖含量与表达有一定的相关性SPSA(右2= 0.84或0.90)8)。这说明茎组织中可能存在其他调控蔗糖合成的基因或其他影响因素,从而导致三种植物茎中蔗糖含量的差异。考虑较低的表达式SPS基因在茎组织中的表达量高于在叶组织中的表达量SPS基因在美国officinarum比在s . spontaneum茎中较低的蔗糖合成水平和较高的蔗糖含量主要是通过糖转运而非糖合成获得的。
结果显示SPSD在禾本科谱系内复制。基因表达数据显示SPSDs具有相似的表达模式,表明该基因亚家族功能相似。此外,SPSD甘蔗各组织的表达水平均保持在较低水平,且无特异性表达特征,这与小麦不同SPS基因,但与甘蔗研究一致[34].然而,这两个SPSD基因拷贝的Ka/Ks比值< 0.4,表明该基因拷贝处于强纯化选择状态7),证明了这两个SPSDs在功能上不是多余的吗糖.因此,我们假设两个SPSD亚家族具有相似的基因功能,但具有不同的关键功能糖.蛋白质组学数据表明,SPSD2蛋白在发育茎中含量最高,叶片和茎节间未检测到SPSA蛋白。与最近的复制事件相结合SPSD进化而来SPSA以及高水平的SPSA基因在茎中的表达,我们怀疑高SPSA在茎组织中的表达水平调节高度同源基因的翻译SPSD,这导致两种植物茎组织中SPSD2蛋白水平和SPSA游离蛋白含量较高。
有趣的是,目前的研究发现SPS表达受光合作用的影响,受昼夜节律的调节。在发育叶片梯度上,所有SPS均表现出不同的表达模式SPS表达与光同化以种特异性的方式同步(图)。4)。因此,我们假设SPS促成了两者之间的糖积累差异糖物种。值得注意的是,SPS的表达有时会受到其他酶的调控,例如,当可溶性酸转化酶(SAI)较低时,SPS具有潜在的功能,有助于蔗糖的合成[35].
同时,基于高时空特异性SPSB和SPSA在SPS同时对基因家族和转录组、代谢组和蛋白质组进行比较分析,推测其调控SPSB和SPSA基因表达是不同种间蔗糖性状调控网络形成的重要环节糖精。此外,蔗糖积累是一个复杂的过程,需要多个基因参与糖的合成、转运和靶向调控。就这样,不同的表达方式SPS不同的甘蔗品种之间可能会形成不同的基因,导致不同的光合固碳水平,甚至不同的糖性状。
结论
我们提出了一个全面的分析SPS两个基因糖物种,包括美国spontaneum和美国officinarum.通过分析比较SPS我们总结了三个主要发现。首先,观察到频繁的结构变异和突变SPS同系物以及等位基因单倍型。此外SPS两者之间的基因糖物种表现出多个TE插入/删除事件,表明TE可能在这一过程中发挥重要作用SPS两个物种分化前后的进化。第二,SPSD亚科的糖是由SPSA经过禾本科物种的世代。分子进化分析表明SPS基因在多倍体过程中处于负选择状态,减少了选择压力。第三,RNA-seq、代谢组和蛋白质组数据揭示了不同的表达模式SPS基因家族之间的美国officinarum和美国spontaneum,表示SPSA和SPSB可能是造成不同阶段糖产量根本差异的原因。的高表达SPSB在叶片发育过程中,蔗糖的合成可能在源组织中起到直接和关键的作用,而高水平蔗糖的积累在茎中可能存在一个更为复杂的调控网络SPSA和SPSD基因是间接的。
方法
植物材料及RNA提取
甘蔗品种LA-Purple [36,37) (美国officinarum,2n = 8x = 80,起源于美国)和SES208[38) (美国spontaneum, 2n = 8x = 64,起源于美国)[39,40本研究利用云南国家甘蔗种质资源库。在福建农林大学甘蔗试验田的标准栽培条件下(14:10 L/D, 30°C L/22°C D, 60%相对湿度),在塑料盆中种植甘蔗。为研究不同发育阶段和梯度发育叶片分析试验,如前所述[41].Li等人在L期3 h收集发育叶片的组织。42]Ming等人详细介绍了其他组织的收集情况[29]
根据制造商的协议,使用Trizol (Invitrogen,美国)从各种甘蔗组织样本中提取RNA。用DNase I (NEB,美国)消化RNA,使用Agilent Bio-analyzer 2100系统(Agilent Technologies, CA,美国)评估RNA的完整性。
美国银行图书馆
从单倍体基因组中构建BAC文库美国spontaneum(AP85-441, 2n = 4x = 32)美国officinarum(LA Purple, 2n = 80)。从嫩叶组织中按照[43].简单地说,提取高分子量DNA,用酶切酶切成片段HindIII.大约100 分离kb片段并将其插入pSMART BAC载体(Lucigene,LA)中SPS使用Illumina Hiseq 2500测序。以平均插入大小为150 kb的195 ~ 384孔板构建的LA Purple BAC文库共获得74,880个克隆,八倍体基因组覆盖率为1.5倍,单倍体基因组覆盖率为12倍。AP85-441的BAC文库由38400个克隆组成(在100-384孔板中,平均插入大小为120 kb),单倍体(四倍体)基因组覆盖率约为1.5倍,单倍体基因组覆盖率约为6倍。
组装、注释BAC读数和识别SPS基因家族
原始读取使用SPAdes 3.6.2和默认参数组装[44].首先,我们设计了使用高粱SPS序列(额外的文件9),并将探针与甘蔗BAC库进行比对。然后对选定的bac进行从头组装和基因注释.为了得到更好的注释,对te和串联重复序列进行了鉴定。使用重复遮罩对组装的contigs进行筛选[45]以作TE注释及DNA地铁系统(http://dnasubway.iplantcollaborative.org/),使用“注释基因组序列”的模式,参照网页上的提示(https://github.com/CyVerse-learning-materials/dnasubway_guide)。对于TE标识,如果至少有60%的标识,且最小长度为50,则确认注释 bp与先前注释的电厂TEs(ftp://ftp.plantbiology.msu.edu/pub/data/TIGR_Plant_Repeats/)。的corresponding coding sequences were translated into protein by the EXPASy-translate tool (http://web.expasy.org/translate/)。
SPS从NCBI下载拟南芥、玉米等植物的同源基因http://www.ncbi.nlm.nih.gov/).进行了基于blast的搜索,以从中识别SPS基因家族美国officinarum和美国spontaneum,以及在附加文件中列出的选定植物5.截止值设置为e值小于10−20和同一性高于85%。
基因结构、系统发育和进化分析
从DNA subway生成的基因注释数据中提取外显子-内含子结构,并在GSDS (gene Structure Display Server)中显示[46].此外,MultAlin [47]该程序用于说明甘蔗SPS基因的氨基酸和感兴趣域的多序列比对。植物护理(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)用于预测中顺式元素SPS启动子。
为了生成系统发育树,预测的蛋白质序列来自7种植物,其中包括两种糖种类(美国officinarum和美国spontaneum),玉米,高粱二色的,拟南芥,Brachypodium distachyon,葡萄,稻属植物和Amborella trichopoda最初基于Clustal W2.0进行对齐[48].然后我们重建了SPS使用MEGA4.0程序实现的JTT氨基酸矩阵估计的邻接法基因[49].在NJ树重建中设置了成对缺失选项,并通过1000个重采样重复的bootstrap分析来评估树拓扑的准确性。
基因的SPSA、SPSB SPSC和SPSD最初使用Clustal W2.0进行对齐[48].对齐的序列以KaKs_计算器为准[50]来计算Ka和Ks值。
使用RNA-seq数据进行表达分析
第一批样品分别来自3个不同发育阶段(幼苗期、早熟期和成熟期)的不同组织,包括2片叶片(成熟叶和叶卷)和3根茎(成熟、成熟和不成熟茎)。另外,第二批样品是梯度发育叶片的片段,分为基部(基部、库组织)、过渡区(经过库源过渡)、成熟区和成熟区(活性C4光合带,完全分化)。
双端测序(100 使用HiSeq 2500平台执行bp读取长度(bp reads length)。原始数据从RNA序列库列表中获得,并使用Triommatic进行初步筛选[51],使用默认参数。然后执行Tophat程序绘制干净的reads,组装BAC contigs,并使用袖扣计算每个SPS基因的FPKM值[52].
代谢组学实验
以la -紫色(LA-Purple) (美国officinarum),SES 208(美国spontaneum),分别。在不同发育阶段的叶片样品中,我们选择了0 ~ 2个叶片段(基部带)、7 ~ 9个叶片段(成熟带)和13 ~ 15个叶片段(成熟带)。对于茎样品,选择的节间与RNA-seq实验相同,分为三个区(基部区、成熟区、成熟区),茎3、6、9中美国spontaneum茎3,9,15英寸美国officinarum.采集样品,用液氮预冷的球磨机研磨,带回提取和衍生代谢物。衍生样品的色谱分析使用随机注射序列,安捷伦7890B气相色谱(安捷伦,亚特兰大,GA,美国),与Pegasus HT飞行时间质谱(LECO, St. Joseph, MI,美国),配备Gerstel多用途取样器(MPS) (Gerstel, Mülheim an der Ruhr,德国)。每个组织5个实验重复进行测试。使用ChromaTOF(版本4.51.6,LECO, St. Joseph, MI, USA)对原始数据进行处理,以识别代谢物。人工校正每个代谢物的信号冗余,并基于所选离子的归一化平均面积,在归一化后使用IS对分析物进行定量测量。接下来,通过与真实标准、公共和商业数据库(NIST、Fiehn和Golm代谢组数据库)的质谱进行匹配,确定代谢物。化学标准购自Sigma(圣路易斯,MO, USA)或Fluka(密尔沃基,WI, USA)。为了比较代谢产物的丰度,将质谱特征和峰面积值组成的数据矩阵从色谱导出到Excel中。对IS进行归一化后,计算了5个技术重复的平均峰面积丰度值[53].
蛋白质组学实验
为了研究两种甘蔗的蛋白质组学变化,分析的叶和茎样品与代谢组学实验所用的样品处于同一阶段。为制备蛋白,采集1克新鲜组织,实验方法参照FASP程序[54]和制造商说明(赛默费雪科学公司)遵循TMT标签程序。然后,我们制备样品,如前所述,通过强阳离子交换(SCX)色谱分离[55].采用纳米流高效液相色谱法(Proxeon Biosystems,现为Thermo Fisher Scientific),我们进行了RP-HPLC分离。MS/MS光谱分辨率设置为17500 m/z 200,标准化碰撞能量为29%。报告离子定量基于MaxQuant软件提取每个肽的TMT报告离子信号。然后通过summin对具有峰面积值的蛋白质含量进行定量所有肽匹配中的g报告离子计数,然后通过假设所有样本中的蛋白质负载量相等进行标准化。
数据和材料的可用性
14个组装好的BAC contigs与候选材料KU685404-KU685417提交NCBI。系统发育数据(比对和系统发育树)已存入TreeBase,可通过URL访问:http://purl.org/phylo/treebase/phylows/study/TB2:S19156.
缩写
- 上:
-
ABA-responsive元素
- 发展障碍:
-
基底带(基底-z)、成熟带(成熟-z)、成熟带(成熟-z)
- 发展:
-
幼苗(苗)、早熟(pre-M)、成熟(M)
- F-6-P:
-
果糖-6-磷酸
- 一般事务:
-
谷氨酰胺合成酶
- 德牧:
-
基因结构显示服务器程序
- LTR:
-
长末端重复
- 按揭证券:
-
MYB-binding网站
- Ka / Ks:
-
非同义替换率
- 子:
-
开放阅读框
- SPS:
-
蔗糖磷酸合成酶
- S-6-P:
-
蔗糖-6-磷酸
- SPP:
-
蔗糖磷酸磷酸酶
- Ss:
-
Saccharum officinarum, S. officinarum
- 所以:
-
Saccharum spontanum, S. spontaneum
- 赛:
-
可溶性酸性转化酶
- te:
-
转座的元素
- UDP-G:
-
UDP-Glucose
参考文献
- 1.
《植物中碳水化合物调节的基因表达》。植物生理学与植物分子生物学年鉴。1996;47:509–40。
- 2.
马鹏,袁勇,沈强,姜强,华鑫,张强,张敏,明锐,张军。玉米淀粉合酶基因家族的进化与表达分析。acta botanica yunnanica(云南植物研究). 2019;12(3):158-73。
- 3.
马洛尼VJ,帕克JY, Unda F,曼斯菲尔德SD。蔗糖磷酸合酶和蔗糖磷酸磷酸酶在植物体内相互作用,促进植物生长和生物量积累。J Exp Bot. 2015;66(14): 4383-94。
- 4.
Langenkamper G, Fung RW, Newcomb RD, Atkinson RG, Gardner RC, MacRae EA.植物中的蔗糖磷酸合酶基因分别属于三个不同的家族。中国科学(d辑:地球科学)(英文版)。
- 5.
Huber SC, Huber JL。蔗糖-磷酸合酶在高等植物中的作用及调控。植物生理学报1996;47:431-44。
- 6.
在萌发子叶中,蔗糖合成和降解的“无效”循环参与调控蔗糖淀粉和呼吸之间的分配蓖麻当韧皮部运输被抑制时。足底。1991;1991(185):81 - 90。
- 7.
Huber SC, Huber JL。蔗糖-磷酸合酶在叶片蔗糖代谢中的作用。植物杂志。1992;99(4):1275 - 8。
- 8.
Leloir LF, Cardini CE。磷酸糖的生物合成中国生物化学杂志。
- 9.
Reimholz R、Geiger M、Haake V、Deiting U、Krause K-P、Sonnewald U、Stitt M等。植物细胞环境。1997;20:291–350。
- 10.
卢恩我。植物蔗糖-磷酸酶基因家族。基因。2003;303:187 - 96。
- 11.
Lutfiyya LL, Xu NF, D'Ordine RL, Morrell JA, Miller PW, Duff SMG。植物蔗糖磷酸合酶同工酶的系统发育与表达分析。acta botanica sinica(云南植物学报),2012;
- 12.
小贩JS。玉米、蚕豆和蓖麻种子中蔗糖合成和转化的相关酶。植物化学。1971;10:2313-22。
- 13.
高尔蒂尔N,Foyer CH,Huber J,Voelker TA,Huber SC.蔗糖磷酸合成酶活性升高对番茄光合作用、同化物分配和生长的影响(Lycopersicon esculentum var UC82B).植物生理学.1993;101(2):535-43。
- 14.
米切列夫·BJ,哈斯金斯·卡,范德维尔·PJ,卢武铉·K-S,舍马克·CK,夏基TD。改变了蔗糖合成能力增强的转基因番茄植株的光合作用、开花和结果。车前草。1995;1995:327–34.
- 15.
王志强,王志强,王志强,等。外源谷氨酰胺合成酶(GS1)和蔗糖磷酸合成酶(SPS)对转基因烟草生长发育的影响[J]。足底。2014;2015(241):69 - 81。
- 16.
张军,周敏,Walsh J,朱玲,陈勇,明锐。甘蔗遗传与基因组学。甘蔗:生理学、生物化学与功能生物学;2013.623 - 43页。
- 17.
7 . Verma AK, Upadhyay SK, Verma PC, Solomon S, Singh SB. .甘蔗(Saccharum)品种中蔗糖磷酸合酶(SPS)和蔗糖合酶(SS)的功能分析。植物医学杂志。2011;13(2):325 - 32。
- 18.
Chandra A, Verma PK, Islam MN, Grisham MP, Jain R, Sharma A, Roopendra K, Singh K, Singh P, Verma I,等。甘蔗(Saccharum spp.杂交种)蔗糖积累相关基因的表达分析。植物医学杂志。2015;17(3):608 - 17所示。
- 19.
McIntyre CL, Jackson M, Cordeiro GM, Amouyal O, Hermann S, Aitken KS, Eliott F, Henry RJ, Casu RE, Bonnett GD。甘蔗蔗糖磷酸合酶家族III等位基因的鉴定与特征。摩尔品种。2006;18(1):39-50。
- 20.
McIntyre CL, Goode ML, Cordeiro G, Bundock P, Eliott F, Henry RJ, Casu RE, Bonnett GD, Aitken KS。甘蔗蔗糖磷酸合酶基因家族等位基因的特征及其与糖相关性状的关系摩尔品种。2015;35(3):98。
- 21.
Sawitri WD,成田H,石崎池田E,Sugiharto B,Hase T,Nakagawa A.在大肠杆菌和昆虫Sf9细胞中表达的重组甘蔗蔗糖磷酸合酶的纯化和表征:N端结构域对变构调节特性的重要性.生物化学杂志.2016;159(6):599-607。
- 22
黄志强,刘志强,刘志强,等。甘蔗属间杂交种的分子标记和DNA原位杂交鉴定。中国科学(d辑:地球科学)1995;91(2):320-6
- 23
单倍体Saccharum spontaneum L.的生产。圆锥花序分枝冷培养和花药悬浮培养培养基的比较。植物生理学报,1984;117(2):169-78。
- 24
张杰,张X,唐H,张Q,华X,马X,朱F,Jones T,朱X,Bowers J,等位基因定义的同源多倍体甘蔗基因组自然基因。2018;50(11):1565-73。
- 25
王毅,唐H,Debarry JD,Tan X,Li J,王X,Lee TH,Jin H,Marler B,郭H,等。MCScanX:基因共线性和共线性检测和进化分析工具包。核酸研究,2012年;40(7):e49。
- 26
杨泽,Bielawski JP。检测分子适应性的统计方法。生态学报。2000;15(12):496-503。
- 27
甘蔗组织中蔗糖转运体、代谢物和蔗糖磷酸合酶的研究。中国生物医学工程学报。2017;23(3):703-12。
- 28
Castleden CK, Aoki N, Gillespie VJ, MacRae EA, Quick WP, Buchner P, Foyer CH, Furbank RT, Lunn JE。小麦和其他牧草中蔗糖-磷酸合酶基因家族的进化和功能。植物杂志。2004;135(3):1753 - 64。
- 29
明锐,范布伦,韦明明,唐华,Schatz MC, Bowers JE, Lyons E,王明良,陈杰,Biggers E,等。菠萝基因组与CAM光合作用的进化。Nat麝猫。2015;47(12):1435 - 42。
- 30.
Schoenfelder KP, Fox DT。多倍性的扩展意义。细胞生物学杂志。2015;209:485-91。
- 31.
Selmecki AM, Maruvka YE, Richmond PA, Guillet M, Shoresh N, Sorenson AL, De S, Kishony R, Michor F, Dowell R, et AL。多倍体能促进酵母的快速适应。大自然。2015;519(7543):349 - 52。
- 32.
Oliver KR, McComb JA, Greene WK。转座因子:被子植物进化和多样性的强大贡献者。基因组生物学进展。2013;5(10):186 - 901。
- 33.
garsmur O, Charron C, Bocs S, Jouffe V, Samain S, Couloux A, Droc G, Zini C, Glaszmann JC, Van Sluys MA, et al.;在极端同源多倍体冗余情况下,甘蔗同源基因的高度保存。新植醇。2011;189(2):629 - 42。
- 34.
Grof C,So C,Perroux J,Bonnett G,Forrester R.研究说明:甘蔗属植物中的五个蔗糖磷酸合成酶基因家族在叶和茎中有差异表达。功能植物生物学。2006;33(6):605–10.
- 35.
Yun J,Zhu EK,Paul H.Moore:可溶性酸性转化酶和蔗糖磷酸合成酶活性的差异调节甘蔗茎中蔗糖的积累。植物生理学。1991;115:609–16.
- 36.
Guimarães CT、Sills GR、Sobral BW。雄果科的比较定位:甘蔗及其与高粱和玉米的关系。自然科学进展。1997;94(26):14261–6.
- 37.
Guimarães CT, Honeycutt RJ, Sills GR, Sobral BW。Saccharum officinarum L.和Saccharum robustum Brandes & Jew的基因图谱。草原动物。中华医学杂志。1999;22(1):125-32。
- 38.
Al Janabi SM,Honeycutt RJ,McClelland M,Sobral B.遗传连锁图谱甜根子草l“SES 208”。遗传学。1993;134(4):1249 - 60。
- 39.
张杰,Nagai C,Yu Q,Pan Y-B,Ayala Silva T,Schnell RJ,Comstock JC,Arumuganathan AK,Ming R.三种甘蔗属植物的基因组大小变异。胡杨属。2012;185(3):511–9.
- 40.
关键词:蔗糖合酶,基因家族,单倍型BMC基因组学。2013;14:314。
- 41.
张强,胡伟,朱飞,王磊,于青,明锐,张军。蔗糖转运蛋白家族的结构、系统发育、等位基因单倍型及表达。BMC基因组学。2016;17:88。
- 42.
Li P, Ponnala L, Gandotra N, Wang L, Si Y, Tausta SL, Kebrom TH, Provart N, Patel R, Myers CR, et al.;玉米叶片转录组的发育动态。Nat麝猫。2010;42(12):1060 - 7。
- 43.
王志强,王志强,王志强,等。Theor Appl Genet. 2001; 102:892-9。
- 44.
Bankevich A, Nurk S, Antipov D, Gurevich AA, Dvorkin M, Kulikov AS, Lesin VM, Nikolenko SI, Pham S, Prjibelski AD,等。一个新的基因组组装算法及其在单细胞测序中的应用。中国生物医学工程学报。2012;19(5):455-77。
- 45.
Smit A,Hubley,R,绿色P:RepeatMasker Open-4.0。http://www.repeatmasker.org. 2013-2015.
- 46
胡斌,金军,郭爱华,张华,罗军,高国刚。gss2.0:一种改进的基因特征可视化服务器。生物信息学,2015,31(8):1296 - 7。
- 47
基于层次聚类的多序列比对。核酸学报1988;16(22):10881-90。
- 48
等。clusteral W和clusteral X 2.0版本。生物信息学。2007;23(21):2947 - 8。
- 49
Tamura K, Dudley J, Nei M, Kumar S. MEGA4:分子进化遗传学分析(MEGA)软件4.0。中国生物医学工程学报。2007;24(8):1596-9。
- 50.
王东,张勇,张震,朱建军,于建军。kachs_calculator 2.0:一个集成了伽玛级数方法和滑动窗口策略的工具箱。基因组学与蛋白质组学。2010;8(1):77-80。
- 51.
Trimmomatic:用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。
- 52.
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L. TopHat和袖扣RNA-seq实验的差异基因和转录表达分析。Nat Protoc。2012;7(3):562 - 78。
- 53.
岳伟,孙伟,饶可瑞朋,叶宁,杨铮,陈敏。非靶向代谢组学研究表明,不同品级白牡丹白茶的化学成分存在差异。食品化学。2019;277:289 - 97。
- 54.
基于itraq的黑稻籽粒发育定量蛋白质组学分析揭示花色苷生物合成相关代谢途径。《公共科学图书馆•综合》。2016;11 (7):e0159238。
- 55.
Borchert N, Dieterich C, Krug K, Schutz W, Jung S, Nordheim A, Sommer RJ, Macek B.蛋白质基因组学揭示了太平洋Pristionchus pacificus线虫模型独特的蛋白质组结构。基因组研究》2010;20(6):837 - 46。
致谢
感谢冯小敏博士的宝贵见解和语言编辑。
声明
我们宣布两个糖用于本研究的物种无需申请特殊许可。
资金
广东省科技种植项目(no . 2019B020238001);国家重点研发计划项目(no . 2018YFD1000104);国家自然科学基金项目(31201260,31760413,31660420);广西科技重大项目(GK2018-266-Z01);基金资助:福建省教育厅;JA12082)。资助方在研究设计、数据收集和分析、决定发表或手稿准备方面没有作用。
作者信息
从属关系
贡献
JZ设计了这个项目。PM、LC、QY、MZ、XH和JZ进行了实验分析。PM、XZ、QZ、QZ、ZW、JZ进行生物信息学分析。稿件由XZ、JZ、PM、ZW、HT撰写。所有的作者都已经阅读了手稿并通过了提交。
相应的作者
道德声明
道德认可和参与同意
不适用。
同意出版
不适用。
竞争利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
BAC组装的基因注释。
额外的文件2。
基因鉴定SPS基因的美国spontaneum基因组的序列SPSBAC文库中的基因。两个基因(Sspon.007C0001731和Sspon.004A0021251reannotated)。
额外的文件3。
SPS基因的蛋白序列美国spontaneum基因组。
额外的文件4。
包含基因组DNA的共线比较SPS基因之间的美国officinarum,美国spontaneum和S.bicolor.同源物用相同颜色的箭头表示。星号表示所选基因集中的单拷贝基因。
额外的文件5。
两两比较服务提供商S同系物糖.
附加文件6。
独联体-元素SPS启动子。
额外的文件7。
Ka,Ks的比较SPS中的直系同源基因/等位基因S.bicolor,美国officinarum和美国spontaneum。
附加文件8。
相关分析的表达SPS植物梯度发育叶(A,左)和茎(B,右)中代谢物的基因和含量糖.相关系数(R2),并在相关曲线附近标出各组数据的相关方程。R2 > 0.9被认为是显著相关的。
补充文件9。
用于识别的探针的信息SPS包含•巴。
权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
马鹏,张旭东,陈丽。et al。蔗糖磷酸合酶(SPS)基因家族的比较分析蔗糖officinarum和甜根子草.BMC植物杂志20.422(2020)。https://doi.org/10.1186/s12870-020-02599-7
收到了:
接受:
出版:
关键字
- 甘蔗
- 美国officinarum
- 美国spontaneum
- 蔗糖磷酸合酶
- 多倍性
- 美国银行图书馆
- 转录组
- 代谢物