摘要
背景
几乎不知道的最初,无症状(潜在)阶段的毁灭性小麦疾病小麦斑病。然而,关于它在田间对真菌成功和疾病严重程度的影响的推测表明,长期潜伏期对宿主有利,并能在生长季节减少田间的接种量积累。冬小麦品种stig是由一种合成的六倍体小麦衍生而来,含有野生四倍体小麦的渐渗基因小麦亚种。野生二粒小麦,这有助于CV。STIGG的卓越的STB阻力,由长期潜在的阶段标记。我们比较了早期的转录组反应Zymoseptoria tritici个人简历。以感病小麦品种Stigg为研究对象,探讨两种寄主对病原菌识别和病害反应的机制及其差异。
结果
STB易感品种长弓响应z. tritici.用压力反应感染,包括激活激素响应转录因子,翻译后修饰和对氧化应激的反应。在CV中激活与这些途径相关的关键基因。基于独立的基因表达研究,在第二次易感小麦品种中独立地观察了长弓。通过比较,CV。STIGG响应于STB而持催化,并且似乎无法激活一系列CV的防御途径。长弓采用。STIGG还显示出一些副基因组偏见的证据z. tritici.感染,而易感cv。长弓呈均匀分布z. tritici.三个小麦亚基因组的应答基因。
结论
我们鉴定了一套与感病小麦品种的早期病原反应有关的疾病反应基因,这些基因可能最终导致感病。相比之下,我们的假设是,与积极的防御反应相比,cv。Stigg的防御策略是分子嗜睡,或者是一种较低幅度的病原体识别,可能源于cv。斯蒂格的野生小麦血统。总的来说,我们提出了对简历的见解。Stigg对STB的异常抵抗,并提出了进一步描述该病理系统的关键生物学过程。
背景
小麦,小麦,是世界上最重要的作物之一,是欧洲的主要作物。更多土地致力于欧洲联盟的小麦产量,而不是任何其他植物物种,2017年欧盟欧盟(FAOSTAT)在欧洲联盟中增长了1.5亿吨小麦。然而,小麦产量受到一系列压力,包括真菌病原体,可以严重降低小麦作物的产量和质量[1].在欧洲,面包小麦生产的主要拮抗剂之一是Septoria Tritici Blotch (STB) [2],一种由单倍体病原真菌引起的叶面疾病Zymoseptoria tritici(原名球腔菌属graminicola;鉴定:小麦七星虫). STB症状在叶片上表现为褪绿和坏死斑点,这降低了植物的光合能力,在缺乏适当控制的情况下导致产量损失高达20%[3.].
目前,种植者依赖化学方法来控制STB(以四种主要杀菌剂的形式提供:醌外抑制剂(QoIs)、甾醇14α-脱甲基抑制剂(DMIs)、琥珀酸脱氢酶抑制剂(SDHIs)和多位点抑制剂)[4]). 事实上,欧洲的STB问题的严重性是显而易见的,因为高达70%的杀菌剂使用是为了控制STB[5].然而,这种对杀菌剂的高度依赖已经成为欧洲选择的强大驱动力z. tritici.,导致抗菌剂的广泛出现,从而降低了抗菌剂在田间的效力[6,7].类似地,对stb抗性品种的引入,推动了农业系统的进化z. tritici.克服宿主阻力[8].因此,现在多方刻录控制STB疾病的策略,组合抗性基因/遗传基因座发现和育种育种[9,10,11]、综合病虫害管理系统[12]、杀菌剂化学创新[4]和生物控制的探索[13].
最重要的是要确定新的遗传抗性来源是需要充分了解病原体的生命周期及其与宿主的相互作用。与叶表面接触约3小时后,z. tritici.孢子萌发,真菌通过气孔渗透到叶片的任何地方 h和10 感染后天数(DPI)[14,15].真菌在亚气孔腔中生长,并通过旋转气体传播到相邻的内或分子空间[16]在宿主细胞开始死亡,真菌开始以坏死营养为食之前[14,17].这是潜伏期的功能和影响,之前的坏死转变,仍然是难以捉摸的。
事实上,有人认为潜伏期可能是进化的产物z. tritici.与其他病原菌相比,内生菌的遗传相似性更大[18]. 几乎没有证据表明在潜伏期从寄主那里获得养分[14,19),驳斥了这种真菌以生物营养性为食的说法。然而,潜伏期似乎影响了病原体的无性繁殖能力;通过沉默植物同源结构域蛋白TaR1来缩短潜伏期,使疾病更早地进展为坏死,但减少了真菌的无性孢子形成[20,而缺少一些z. tritici.辅助染色体还将开关转发到虚构乒乓,但导致Pycnidia的数量增加[21].与之相反,stb抗性品种的长期潜伏期并没有使其产生的孢粉的最终水平高于感病品种;但它增加了锥虫形成所需的时间,从而减少了整个生长季节的接种量[22]. 考虑到潜伏期影响无性孢子的产生和丰度,并且高达70%z. tritici.生长季结束时田间的种群是无性繁殖的结果[3.[潜在阶段期间宿主和病原体之间的相互作用无疑是阐明STB电阻机制的重要考虑因素。然而,多种因素影响潜在阶段的持续时间,包括当感染,环境条件,鞘内分离物和接种物密度时的宿主基因型,品种生长阶段[14,22].
在低、中、高压环境中表现出高效田间抗性的一个基因型是综合衍生(来自人工创造的六倍体)品种(cv.)Stigg[22].cv中潜伏期的长度。高压场环境下的stig平均36天,导致STB疾病进展较低。相比之下,简历。长弓易受STB感染[23],潜伏期短得多(~ 12天)。本研究旨在探讨六倍体冬小麦STB侵染早期抗病易感性的分子机制,并阐明六倍体冬小麦的转录组响应。感染期间的stig可能有助于其对STB的特殊抗性。基于cvs的RNAseq。STB感染早期(接种后6 ~ 96 h)z. tritici.),我们鉴定了这两个品种对STB反应的差异,并鉴定了可能与STB抗性和易感性有关的生物学过程。
结果
Stigg和longbow的疾病评估z. tritici.
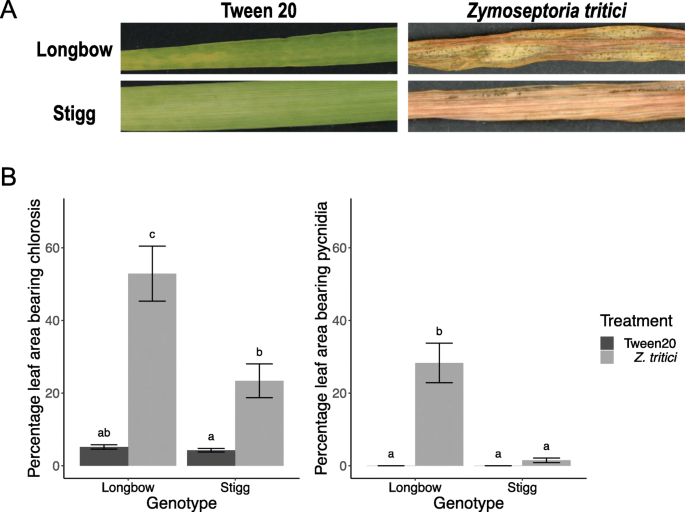
对植物进行的疾病评估与用于RNA测序的植物一起验证,验证疾病在进行的试验中被预期发育,即CV。STIGG比CV更耐受STB。长弓。此外,我们观察到CV。斯蒂格的抵抗反对侵略性的爱尔兰孤立z. tritici.,'软木塞罗德莱4“。在28 dpi下,平均叶面积的52.8%在CV中。长弓是褪色的,显着高(P < 0.05)。斯蒂格,23.3%。叶表面积的28%。长弓植物被绿藻所覆盖,显著高于其它植物(P < 0.05)。Stigg,其中cv的1.5%。Stigg叶子在这个时候生了pycnidia。对照植株(用吐温20处理)上未出现pycnidia,在两个品种中,处理植株的退绿叶面积和有pycnidia的叶面积显著高于对照植株(图。1).在前96小时(收集组织进行RNA测序的期间)没有观察到任何症状。
RNA测序和差异表达
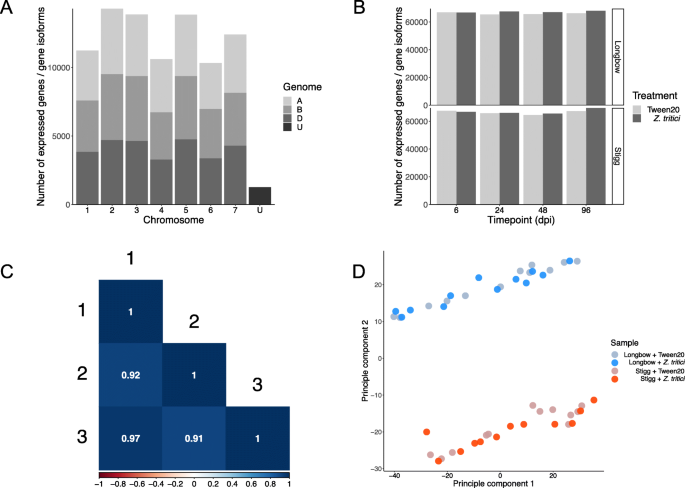
超过96份文件(2 x基因型,2 x治疗,4 x TimePoints,3 x试验x成对末端读数),共有59亿份读数读数,平均每种样本读取6090万读数。所有样品在每个读数中的每个碱基中的平均捕获得分为30或更高。读取与包含小麦基因注释的参考指标(IWGSC V1.1 t . aestivum高置信度基因注释,每个基因的每个转录本(基因变体)表示)和z. tritici.(z. tritici.MG2参考cDNA注释)和读丰度Kallisto计算。映射的RNAseq数据用表达的基因数和每个基因表达的独特基因变异数表示。对于每个样本,如果一个基因具有百万分之转录本(TPM)值> 0.5,则认为该基因表达了[24]三次试验中有两次。在所有样本中,表达了87888个基因/基因亚型(71636个独特的小麦基因),每个基因平均表达2.45个变体。表达t . aestivum转录物均匀分布在三个小麦基因组(A,B和D)上分布,从A基因组32.8%,从B基因组32.8%,与B基因组32.9%。剩余的1.4%的转录物未分配给染色体。类似地,转录物均匀地分布在7个染色体基团(1-7)上。组2,3和5的表达基因数量最多(图。2a) ,反映了基因在整个小麦基因组中的染色体分布(其中第2、3和5组染色体包含的基因最多)。在所有的样本中,表达基因的数量是均匀的(图。2b) 平均每个样本表达66699个基因/基因亚型(基因型x治疗x时间点组合)。皮尔逊相关分析用于检验三个试验之间基因表达的相关性。相关性强(相关系数) > 0.9,P < 0.05)。2C)。原理分析显示样品分裂成两个主要组。这些组代表基因型,并且似乎基于治疗,时间点或试验似乎没有透明分裂样品(图。2d) 是的。
从病原菌角度来看,共8961例z. tritici.基因在所有样本中都有表达,平均有2554个基因表达。表达的数量z. tritici.经过处理的样本的基因在不同的试验中有所不同(附加文件1),在使用的序列深度,病原体转录本的丰度为总reads的1.7%(即映射到z. tritici.参考),以及每百万价值的平均转录物z. tritici.基因为6.4 TPM(平均和中位数))。小麦reads的平均TPM较高,平均TPM为657个,中位数为34个。在模拟处理的样本中,低背景平均值为39z. tritici.基因被表达,表明要么是低水平的背景污染,要么是小麦和小麦之间保守的基因错位z. tritici.因此可以映射到错误的引用。
总共586个高信心小麦基因/基因同种型,代表575个小麦基因显着表达(DEGS)( - 1> = log2折叠变化> = 1;FDR调整P-价值< 0.05)z. tritici.与Tween20的模拟解决方案,在每个品种和每个时间点的治疗之间的至少一个比较中(附加文件2). 在差异表达的转录本中,230个仅在cv中差异表达。Longbow和196只在cv中有差异表达。斯蒂格。其余160个在这四个时间点中的一个或多个时间点在两个品种中差异表达(表1)1).
差异表达基因(通过处理)分布在所有三个小麦亚基因组(A、B和D)中。A基因组衍生基因占DEGs的37%,而B基因组和D基因组衍生基因分别占25.6%和35.2%。每个基因组中DEGs的亚基因组比率与预期的32:32:32(χ2P-Value = 0.01)。当在两种品种之间检查DEG的基因组分布时,观察到CV的分布。长弓与预期比率不同,但它处于CV。stigg(χ.2P-价值 = 0.02). 尽管DEGs的总体分布有利于A基因组,但在cv。Stigg,我们观察到上调的a基因组衍生的DEG减少,B和D基因组的DEG数量高于预期,尤其是在6和48 h接种后。
各条件下前5个差异表达基因见表2.
转录反应z. tritici.不同品种之间
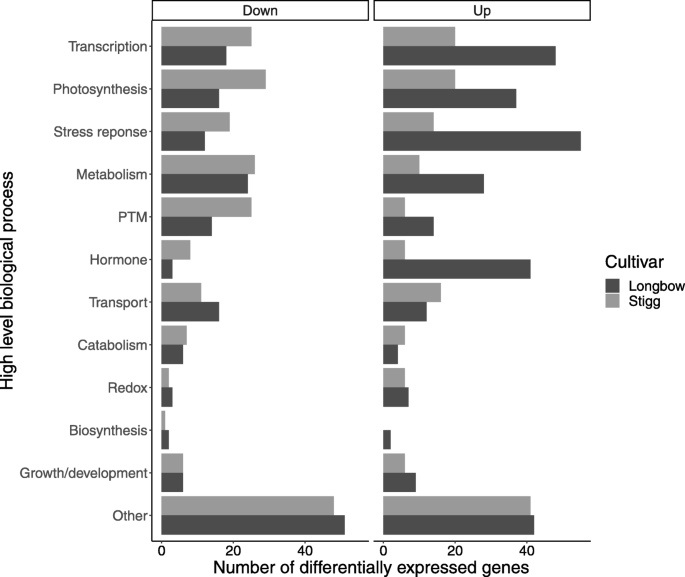
为了表征每个品种在每个时间点的响应,我们用Blast2Go(附加文件3.),随后被指定为一个生物过程。根据生物过程的一般作用,将每个品种x时间点组合的生物过程分为12个高水平组。这些分类包括:生物合成、分解代谢、生长/发育、激素反应、代谢、光合作用、翻译后修饰、氧化应激、应激反应、转录、运输等。统计了各品种中差异表达量的变化,并比较了两个品种在各品种间的反应。对于这些类别,我们挖掘了一个公开的易感和抗药小麦品种(分别是Gallant和stig)的微阵列研究z. tritici.[25]来独立验证参与这些关键过程的基因差异表达(附加文件4). 在这两个数据集中,基因表达有差异的地方,我们对它们进行了比较。在没有进行比较的情况下,相关基因在微阵列数据中没有差异表达。在这项微阵列研究中,易感cv。Gallant在10岁时出现了STB症状 接种后28天,叶面积达25%以上 接种后天数。这是一个类似于简历。长弓,在这个实验中,显示出20%的叶面积在28 dpi的pycnidia。同样地,在这两个实验中,抗性变异系数。斯蒂格说< 在微阵列研究中,有5%的叶面积含有绿泥蛇,在本研究中,有1.5%的叶面积含有绿泥蛇。在简历中。勇敢的,如在简历中。其中差异表达的主要生物学过程是氧化还原过程、应激反应、翻译后修饰和转录调控。
通常,CV中有更高调节的过程。长弓与CV相比。Stigg。事实上,涉及最占主导地位的生物学过程的次数,来自CV的更多下调基因。剧本比简历。长弓(147个与117)和CV中更加上调的基因。长弓比简历。STIGG(160与110)(图。3.).
品种Stigg和Longbow对STB侵染的反应都与翻译后修饰(PTM)相关基因的调控有关,特别是与蛋白磷酸化、去磷酸化、糖基化和蛋白泛素化有关的基因。在所有时间点,在cv中PTM相关基因的表达似乎都较高。长弓,表明植物对压力的反应中发生了更高水平的PTM。参与蛋白质磷酸化(PP)的基因在cv的4个时间点均下调。Stigg,但仅在长弓6hpi处,表明cv对这种PTM有主动抑制作用。斯蒂格。在上调蛋白磷酸化的基因中,3个都具有蛋白激酶活性的基因在6 h在cv中是唯一的。Stigg、TraesCS3B02G238800.7、Traescs3B02G2424200.3和TraesCS5B02G528300.2。其中一个激酶基因TraesCS3B02G238800.7在cv中上调。斯蒂格6岁 h、 然后在24小时下调 H这种表达模式反映在cv中。长弓,但有一个时间延迟;该基因在cv中表达上调。24岁的长弓 h、 然后降到96 H另外两个基因TraesCS3B02G424200.3和TraesCS5B02G528300.2在cv中没有差异表达。长弓。相反,在24小时有8个PP基因表达上调的高峰 但此时Stigg中没有PP基因上调。
蛋白质普华定位,第二种类型的翻译后修饰,在CV中受到下调。STIGG接种后6小时。这种下调持续到接种后48小时。但是,在CV中。长弓,蛋白质萎缩的下调直到24 hpi直到24 hpi,并且在小于cv的程度上。Stigg。也就是说,泛素化过程的下调在CV中继续进行。长弓在接种后96小时,它在其中止了一点。Stigg。在任何一种品种中,ubiquitination工艺中没有参与泛素化的基因。 The data suggest a slight time-lag in the down-regulation of PTM-related genes in cv. Longbow compared to cv. Stigg, and an overall reduction in activity of PTM-related genes in cv. Stigg. One of the PTM-related genes, a gene involved in protein glycosylation (TraesCS1A02G361100.1) was up-regulated in cv. Longbow at 96 h (log2 fold change = 1.2) and was also up-regulated in the STB-susceptible cv. Gallant at 24 hpi withz. tritici.,基于独立的微阵列研究(log2折叠变化= 1.7)[25].
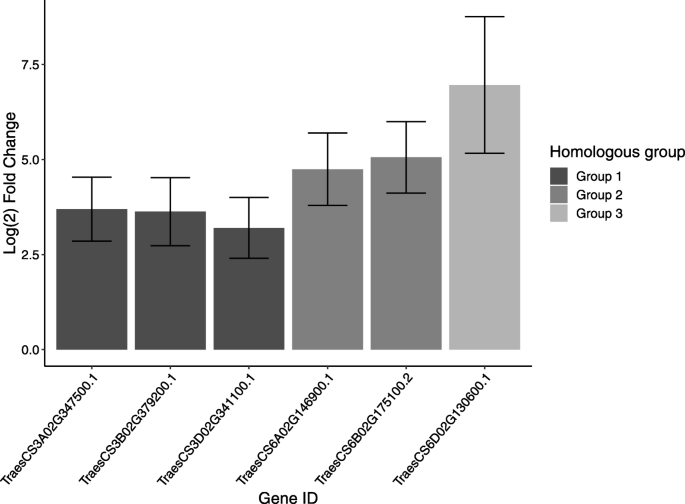
在易感cv。长弓,参与植物激素反应的生物学过程,激素反应信号通路上调。在6、24和48 h,涉及生长素、茉莉酸、水杨酸、脱落酸和赤霉酸响应的转录本在cv中表达上调。而这些过程的上调在cv中几乎完全不存在。只有2个基因在变异株中差异表达。Stigg)。在24 hpi时,cv中上调的激素应答转录本有一个峰值。6个上调的激素应答基因在cv中没有差异表达。Stigg(无花果。4;额外的文件5).这些转录物中的五种落入两个同源群;三个在第三组染色体上,两种染色体上的两个染色体,第6次在染色体6D上,但不属于同源族的一部分。第3组激素响应基因是基于它们对Wrky33基因的高同源性的推定腕表转录因子样T乌拉尔图和山羊草属tauschii三种同源基因在24岁时均在长弓上调 H.6组激素反应基因也被认为是WRKY转录因子样基因,尽管Longbow中只有A和B拷贝在24 h时上调。其中两个wrky样基因TraesCS3A02G347500.1和TraesCS6B02G175100.2也在stb敏感cv中上调。在24 hpi的勇敢z. tritici.基于微阵列研究(Log2折叠变化 = 分别为1.3和2.1)。
染色体6D上的基因是一种推测的SAUR71样生长素反应蛋白。对激素反应基因的进一步观察是在cv。长弓,反应没有超过24 接种后48小时或96小时,即没有激素相关基因差异表达。然而,两个基因在cv中的表达存在差异。斯蒂格48岁 hpi均预测TIFY-11e样转录因子。TraesCS7A02G201300.1在cv中上调。在cv中调节长弓和下摆。24岁的斯蒂格 h,随后在cv中上调。斯蒂格48岁 H第二个TIFY-11e样基因TraesCS7D02G204700.1在两个cv中均上调。斯蒂格和长弓在24岁 h、 在cv中也上调。斯蒂格48岁 H激素反应基因在96%时没有差异表达 这两个品种的hpi,表明这些基因对STB感染的早期反应是特异的。
cv中参与光合作用(这类生物过程包括光合作用、电子传递链和氧化还原)的基因调控对病原菌反应较早。斯蒂格,与cv相比。长弓。此外,简历。stig在下调这些生物过程方面表现出更积极的反应。在大部分时间点上,氧化-还原(OR)过程是DEGs中最主要的生物过程。在接种6 h后,cv中参与氧化还原过程的上调基因数量较高。长弓(5比在cv。Stigg [3.],且在cv中下调的氧化还原基因数量较高。Stigg [6比在cv。长弓(4].氧化还原基因数量在油菜中上调。Longbow在24 hpi时增加到11个基因,而cv中增加到2个。Stigg。在cv中上调的6个基因48h后,这个数量再次增加。表现出与cv中观察到的模式相反的波动。长弓。此外,氧化还原过程在cv中上调较少。与cv相比。长弓,更多参与这一过程的基因在cv中被积极下调。 Stigg, compared to cv. Longbow. By 96 hpi there are no oxidation-reduction genes down-regulated in cv. Longbow, compared to 6 down-regulated in cv. Stigg. TraesCS2A02G438200.1, a putative Ubiquinol oxidase gene that is involved with photosynthesis, was up-regulated in cv. Longbow at 48 h (log fold change =3.5) and in cv. Gallant at 24 h in the microarray study (log2折叠变化= 3.7)。
类别的“应力响应”包括用生物过程“防御反应”(对任何生物或非生物应激),“防御反应调节”或“发病机制”的基因。跨越数据,CV。Longbow显示出比CV的应激响应基因更大的上调。STIGG;7基因在CV中上调。长弓与1 in cv。Stigg。在24小时的CV。长弓两种同源过氧化物酶基因,Traest2a02g107600.1和Traescs2b02g125300.1上调,并且在stigg中没有差异表达。这些过氧化物酶基因中的一种,TRAESK2A02G107600.1也是上调的z. tritici.在简历中。勇敢于8天的8天接种基于微阵列数据(日志2折痕变化= 4.5)。第三个可能的过氧化物酶基因TraesCS6A02G047200.1在cv中表达上调。在96 h时,stig基因是唯一一个在cv中上调的“应激反应”基因。斯迪格在检查的时间点。变异株中NPR4基因TraesCS3A02G354800.1上调。长弓96 h (log2倍变化= 1.77);在微阵列研究中,24小时后的加朗(log2倍变化= 2.2)。
品种特异性反应z. tritici.感染
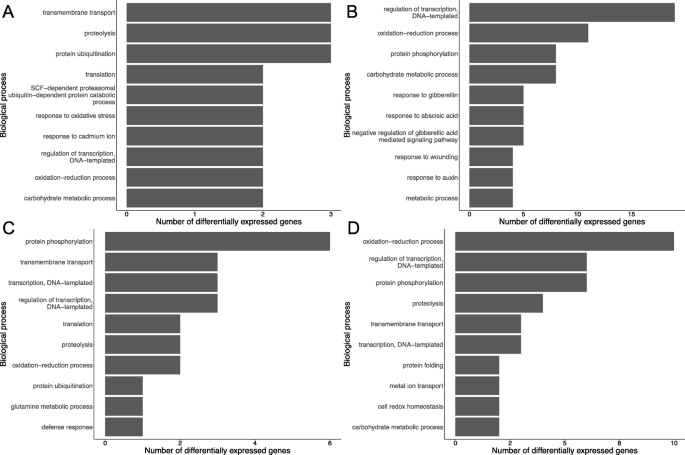
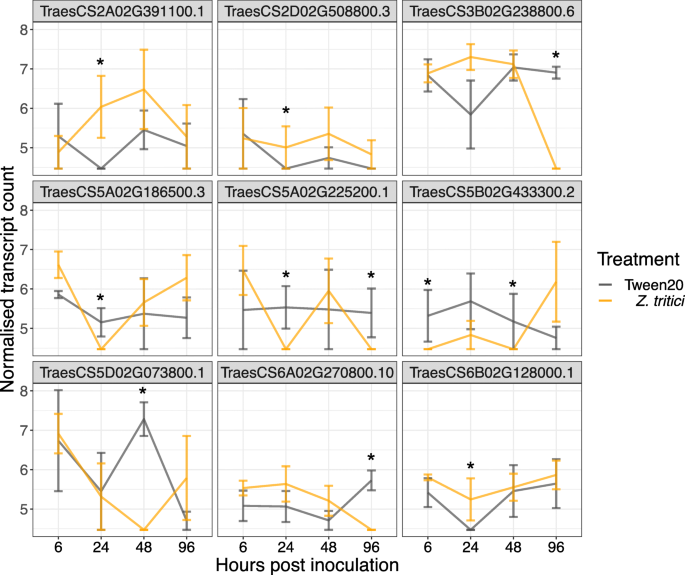
此外,还探讨了各品种对z. tritici.感染,还检查了每种品种独特的DEG,并进行基因本体学分析。在简历中。长弓,最丰富的下调生物过程是跨膜运输,蛋白水解和蛋白质萎缩,最丰富的上调过程是转录,氧化还原和蛋白质磷酸化的调节。在简历中。STIGG,蛋白质磷酸化是最常见的下调过程,其次是跨膜运输和转录。氧化还原过程是最常见的上调过程,其次是转录和蛋白质磷酸化的调节。就下调的生物过程而言,两种品种之间最引人注目的差异在类别蛋白磷酸化和跨膜运输中(图。5).参与蛋白质磷酸化的六个基因在CV中下调。STIGG,而在CV中没有参与PP的基因下调。长弓。这些基因是所有预测的激酶:Traescs3b02g238800.6和Traescs5b02g433300.2预测酪蛋白激酶1样蛋白,Traest5a02g186500.3是一种预测的Lemk1.1蛋白,Traest5a02g225200.1是一种预测的CBL相互作用蛋白激酶,Traests5d02g073800.1是预测的壁相关的受体激酶样14和Traescs6a02g270800.10是预测的丝氨酸/苏氨酸蛋白激酶ppK15样(基于NCBI Blastn)。这些基因在CV中唯一地下调。STIGG;它们在CV中没有上调。STIGG或差异在CV中表达。 Longbow at any of the timepoints examined. In transmembrane transport, at 24 hpi, three transcripts involved in transport were up-regulated in cv. Stigg that were not differentially expressed anywhere else in the data. These genes had predicted transporter functions based on homology to山羊草属tauschii.TraesCS2A02G391100.1是一个预测的金属烟胺转运体YSL9, traescs2d02g5088003 .3可能是一个硫酸盐转运体3.3,而TraesCS6B02G128000.1可能是一个锌转运体2-like(图。6).
除了蛋白磷酸化和跨膜转运外,品种特异性的二甲基化镓在最丰富的氧化石墨烯类别中没有大的差异。因此,进一步探索cv。stigg特异性反应、高级生物过程的“其他”类别得到了扩展,cv中出现了特定的氧化石墨烯术语。斯蒂格,不在简历里。长弓被确定。8个GO项与5个stigg特异性deg相关,但没有出现在履历中。长弓度。其中一个基因在cv中下调。stig与对红光或远红光的反应有关。其余4个基因均上调,参与铁硫簇组装、RNA加工和蛋白质折叠。
Stigg和longbow的共同转录变化
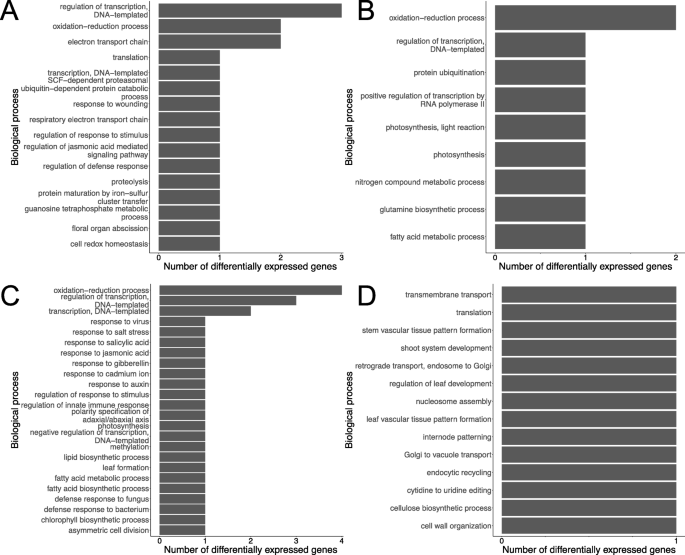
除了品种特定的反应z. tritici.,我们探索了两个品种间差异表达的生物学过程(图。7). 共有160个基因在两个品种中差异表达。这些DEG分为四个子集:“长弓向上和Stigg向上”、“长弓向下和Stigg向下”、“长弓向上和Stigg向下”以及“长弓向下和Stigg向上”。在“长弓向上斯蒂格向上”、“长弓向下斯蒂格向下”和“长弓向上斯蒂格向下”类别中,主要的生物过程是转录调控和氧化还原过程。在“长弓向上-斯蒂格向下”的范畴中,有许多与防御反应相关的生物过程,包括前面提到的激素反应过程、对刺激和防御反应的调节。因此,似乎不仅这些类别的基因在cv中上调。长弓和不上调cv。Stigg(如前所述),这些基因在cv中上调。在cv中调节长弓和下摆。斯蒂格。在“长弓向下-Stigg向上”这一类别中,存在着与生长和发育有关的生物过程,例如茎维管组织模式的形成、芽系统的发育以及叶片发育的调节。
基因本体富集分析
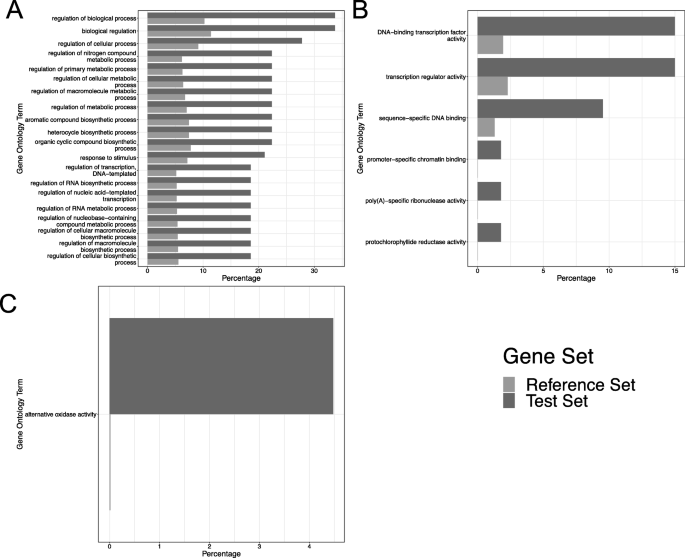
对数据的所有子集进行基因本体浓缩分析(即所有4个时间点的品种,由下调和上调基因分开)。将差异表达的基因集进行比较与数据中表达的所有基因集进行比较,以识别代表的GO类别。在简历中。在接种后24和48小时的长弓,鉴定了代表的GO术语(图。8).在任何CV中没有发现过度代表的GO术语。STIGG数据集。在CV中的24 HPI。长弓,84个生物过程和6个分子函数在上调基因中表示。最多的代表的GO术语是对生物过程,细胞过程,代谢过程和生物合成过程的调节。“对刺激措施”的“回应”也被过度代表。超代表的分子功能包括转录因子活性,转录调节剂活性,DNA结合和染色质结合。在CV中的48 HPI。长弓,一个分子功能超过了代表性的“替代氧化酶活性”。
一般来说,虽然响应中存在许多相似之处z. tritici.在CV之间。Stigg和Longbow的研究表明,不同生物过程中差异表达的基因数量和表达方向(上下)存在明显差异。如前所述,简历。长弓显示出比cv更多的应激反应的证据。与过氧化物酶活性、发病机制和防御反应调控相关的基因表达上调,而在cv中只有一个基因表达上调。斯蒂格。同样,植物激素相关基因的反应在cv中也较高。长弓比在cv。与生长素、茉莉酸、水杨酸、脱落酸和赤霉素相关的基因都在cv中上调。斯蒂格很少活动的长弓。此外,还观察到来自这些应激反应相关生物过程的一些基因在cv中上调。长弓在cv中也表达下调。斯蒂格。然而,也有一些明显的变异。Stigg特异性反应,如在cv中不明显的蛋白磷酸化相关基因的下调。以及跨膜转运的上调。另外在简历中。Stigg说,很少有证据表明在cv中观察到激素介导的防御途径、对氧化应激的反应和防御基因的转录。长弓。因此,似乎这两个CV。长弓和斯蒂格对z. tritici.早在6 hpi感染一系列基因的转录改变,有许多品种特异性的转录反应,可能需要进一步的研究来阐明cv。斯迪格对STB的超强抵抗力
加权基因共表达网络分析
鉴定共表达基因模块,通过差异表达分析确定stb反应基因的潜在互作因子,表达矩阵t . aestivum和z. tritici.通过R.中的“WGCNA”包分析所有样品的基因。网络分别为CVS构建网络。Stigg和Longbow识别和描绘共同和品种的共同表达网络。共有94,707个基因来自两个t . aestivum和z. tritici.基于其共表达形成RNASEQ数据,将基因组分配给模块。在简历。识别了长弓网,185个子网络或“模块”(附加文件6),在CV内。识别STIGG网络209模块(附加文件7).
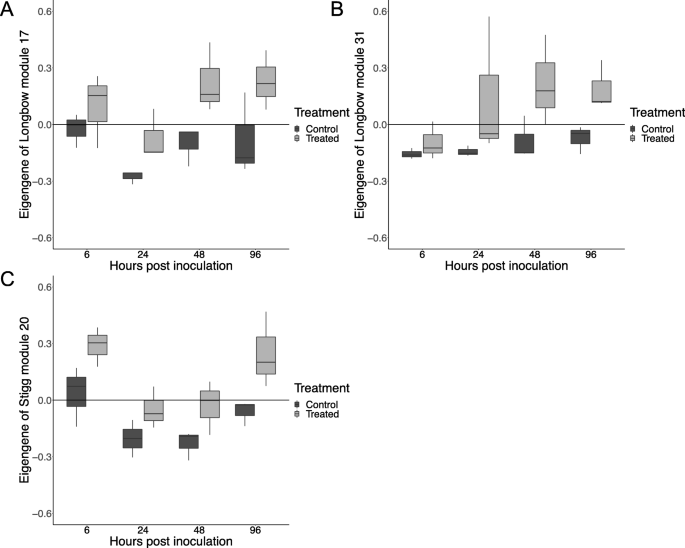
在185个模块的简历。Longbow共表达网络,6个模块与治疗显著相关:模块L3 (Cc = 0.68),L17(C)c = 0.588),L31(C)c= 0.55), l103 (cc= 0.50), l155 (cc= 0.52)和L177 (Cc= 0.51)。在简历。stig共表达网络,三个cv。柱头模组与处理、模组S2 (Cc = 0.62), S20 (Cc = 0.56)和S31(Cc = 0.59). 通过对NCBI非冗余核苷酸数据库的BLASTn搜索,确定了中心基因(即每个模块中连接最紧密的基因)并对其进行了表征。所有六个人的简历。长弓模块和两个cv。Stigg模块由t . aestivum和z. tritici.基因(表3.).
对于CV。长弓模块L17,L31和CV。被大多数小麦基因填充的STIGG模块S20,模块EIGENGENS(模块的第一个原理组分)在处理的样品中显着高于对照(Kruskal-WallisP-价值< 0.05; 图。9).模块内的差异表达基因与治疗明显相关并主要包含T。计数夏末基因。一般来说,这些模块包含更多的病原体应答基因。长弓比在cv。斯蒂格,包括简历。S20 Stigg模块。这些模块中差异表达基因的存在表明,基因网络正确地聚集了对病原体敏感的基因。模块L17的31个DEGs中,有18个在cv中被病原体下调。Longbow, 7 in cv。两个品种中都有4个。两个基因在cv中表达上调。 Longbow. L31 comprised 38 differentially expressed genes, of which 19 were pathogen up-regulated in cv. Longbow, 14 in cv. Stigg and four in both cultivars. One gene was pathogen down-regulated, in cv. Stigg. The cv. Stigg module S20 contained 20 DEGs, 14 of which were pathogen up-regulated cv. Longbow, 6 were up-regulated in cv. Stigg, one was up-regulated in both cultivars and one was down-regulated in Longbow. The hub genes, TraesCS5B02G056700.1 (L17), TraesCS7A02G198300.1 (L31), and TraesCS5D02G472000.1 (S20) are not differentially expressed.
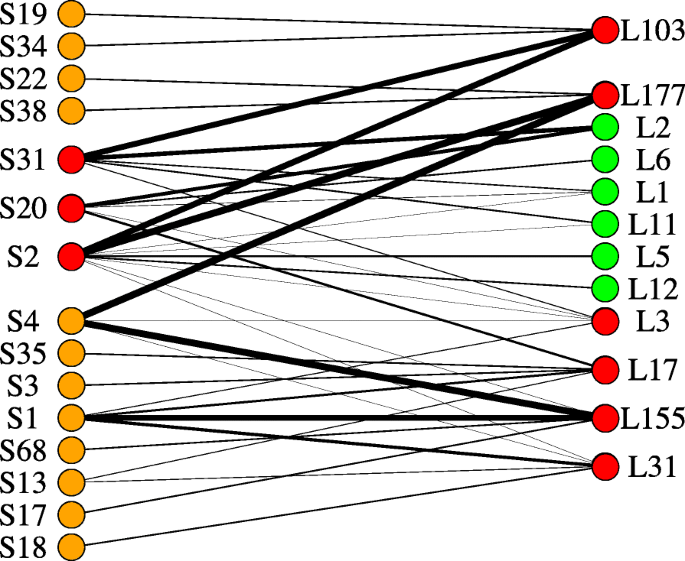
在两个网络(cvs)之间计算模块保存。(Longbow和Stigg)来确定哪些模块在两个品种之间是保守的,哪些是品种特异的。根据Langfelder和Horvath[26],具有保存(Z)得分> = 10的模块被认为保留,分数在2到10之间被认为是适度保存的,并且得分<2的那些被认为不保留数据集之间。在简历。长弓组,平均Z分数为9.8。在184个模块中,保存完全52(24.7%),温度保存了66(31.4%),不保留68(32.3%)。CV的平均Z分数。STIGG模块为8.7。保存了五十四(25.7%)模块,温度保存了54(25.7%),不保留102(48.5%)。所有六个简历。与处理相关的长弓模块(模块l3(cc = 0.68),L17(C)c = 0.588),L31(C)c= 0.55), l103 (cc= 0.50), l155 (cc= 0.52)和L177 (Cc= 0.51))。stig组:5只保存完好,1只保存适度。三份简历。与处理相关的stig模块(S2 (Cc = 0.62), S20 (Cc = 0.56)和S31(Cc = 变异系数为0.59)。长弓套装。对于每个保存的模块,在相反的数据集中对应的模块被识别(即包含与参考模块相同的基因的模块)(图。10). 总的来说,两个品种中与处理相关的模块彼此保存得很好,表明这些模块中的基因对处理有相似的反应Z小麦。然而,模块L3(从cv。长弓(Longbow)和简历的联系并不紧密。与治疗相关的stig模块,表明该模块内的基因具有更特定于cv的表达模式。长弓比到cv。Stigg。该模块的主导生物学过程是蛋白磷酸化(352个基因),随后是氧化还原(166个基因)和转录调控(137个基因)。该模块中表现出的前三种分子功能分别是atp结合、蛋白结合和蛋白激酶活性。
讨论
z. tritici.是整个欧洲小麦生产的严重威胁,因此,阐明了z. tritici.是至关重要的基因鉴定和告知育种实践。在这项研究中,我们描述了对z. tritici.在STB抗性和STB易感小麦品种。每次样本的产生6090万读数等同于〜25 x的完整小麦和覆盖z. tritici.转录组(约2.4亿个碱基在合并转录组中)的检测z. tritici.基因是可能的。平均而言,2554年z. tritici.在处理样本中检测到基因,占总图谱reads的1.7%。当所有的植物都生长在同一生长室内时,可能发生了某种程度的背景污染,然而,在对照样本中定位的这些病原体基因可能是由于保守基因的错位。检出的病原菌基因数占总数的23%z. tritici.基因组,是Rudd等人(2015)检测到的三分之一。但是,映射到z. tritici.基因组类似:平均读数的总读数的1.4%映射到z. tritici.前4项中的参考 感染天数,覆盖深度为每个样本4500万次读取[27]相比之下,在这项研究中,每个样本6000万次读取中,有1.7%的读取被映射到病原体。此外z. tritici.在这项研究中绘制的读取数比在白粉病病原体的双RNAseq研究中检测到的病原体读取数还要多皮斯丹毒在其Medicago trunculata主机(28,其中0.5%的检测reads属于病原体,每个样本覆盖深度为9500万reads(相比之下,本研究中的每个样本覆盖深度为6000万reads)。本实验室正在对一个stig x Longbow分离群体进行双rnaseq研究,以确定特定宿主基因与STB抗性遗传之间的关联;本研究和本研究的结果还将提供一个全面的病原体转录组数据集,用于挖掘这些小麦宿主的病原体响应信息。
差异表达分析,比较治疗与对照样品在每个基因型x时分组合中显示出差异表达响应于治疗的500个高置信小麦基因。鉴于表达基因总数的染色体分布,其中每个基因组(A,B和D)导致相同数量的表达基因,我们预期的比例为32:32:32%的实验中的差异表达基因的比例(剩余的4%的基因未分配给染色体)。在检查各个数据集的情况下,两种品种跨越两个比例的比例,我们观察到在CV中上调的转录物中的预期比率显着偏差。Stigg。该结果表明CV中亚基因组偏倚的一些证据。斯蒂格的回应z. tritici.; 来自A基因组的基因转录增加和来自B基因组的DEG数量低于预期。在多倍体植物物种中,亚基因组偏向是一种众所周知的现象,可能是由于功能冗余同源基因的缓冲作用,或是由于同源基因特异性变异而导致的遗传优势[29,30].更具体地,已经显示亚基因组偏差对于对植物对应力的反应特别普遍;例如,在小麦中感染真菌病原体Fusarium pseudogroinearum.,B和D基因组的响应大于A基因组的响应[31].除了CV的应力响应中的总体偏差。STIGG,我们看到了一种特异性特异性的偏差,其在一个基因组DEG减少,并且在接种后6小时和48小时的B基因组DEG增加。简历。STIGG((BESCAY X LW96-2930)X油轮)衍生自合成六倍体小麦(SHW),并含有至少3个用于SEMEMORIA抗性的定量性状基因座(QTL),其最强的染色体1B和3B [10].最初创建合成六倍体小麦(SHW)以通过在四倍体(AABB)之间人工生成肥沃的杂交物来引入遗传多样性。膨胀小麦二倍体山羊草山羊草属tauschii[32].在现代四倍体之间产生了两种合成六倍体t . turgidum单一共享平台。杜伦姆(基因组AABB)和A. Tauschii.(基因组DD),或野生四倍体t . turgidum单一共享平台。野生二粒小麦(AABB)和A. Tauschii.(日)[33].简历。STIGG的合成祖先(LW96-2930)来自at . turgidum亚种.野生二粒小麦衍生了SHW (S. Berry,个人通讯)。因此,与许多主要包含d -基因组遗传变异的SHW相比,LW96-2930提供了所有三个亚基因组的遗传变异。该SHW是一个septoria抗性系,因此被认为贡献了很大比例的cv。stig对STB的特殊抗性可能解释了在cv中观察到的亚基因组偏倚。与cv相比,stig。长弓。b基因组衍生反应的减少可以解释为合成衍生的渐渗现象的存在,这可能与现代小麦的同源位点对病原体的反应不同。此外,由于该位点的基因组序列可能与cv不同,野生基因渗入可能导致RNAseq reads对参考基因的比对减少。中国春小麦,参照序列的来源[34]. 在鉴定抗性候选基因方面,进行了遗传作图和cvs间等位基因多样性调查。Stigg和Longbow用于鉴定和描绘cv中的染色体渐渗。来自这个合成亲本的Stigg可能有助于精确定位导致抗性的特定位点和基因。
为了鉴定~ 500个差异表达基因,我们将它们分配到高水平的生物学过程中,以促进识别反应的重要机制z. tritici.感染。从这些数据中最普遍的观察是STB易感cv。长弓回应z. tritici.在cv中未观察到的具有早期防御反应的感染。斯蒂格。特别是24 hpi似乎是cv的一个重要时点。长弓;在这个时候的过程上调表明,简历。Longbow已经识别并对病原体做出反应。八个基因参与翻译后修饰(PTM),这个过程可以影响下游防御信号[35],在这个时间点上调。关于植物的病原体攻击,PTM可以通过与病原体识别一致的反应性氧物种(ROS)突发来诱导[36]. 支持病原体介导的活性氧爆发的证据是24小时两个过氧化物酶的上调 cv中的h。长弓。过氧化物酶是一种酶,催化活性氧的产生,以应对植物中的病原体攻击[37]. 这是一种也能被植物防御相关激素(如水杨酸和茉莉酸)刺激的反应,已知这些激素会在病原体攻击时积累[38]. 这说明cv中可能存在一些激素活性。长弓回应z. tritici..证实这是两种激素敏感腕骨转录因子样基因和生长素响应的Saur7样基因的表达。衣物激素和茉莉酸诱导腕骨转录因子的表达[39,这些转录因子已被证明在抗病原菌中起重要作用拟南芥蒂利亚纳[40]和大米奥雅萨苜蓿[41].这些wrkey基因的上调虽然增加了对其他物种的抗性,但并不能使水稻对STB产生抗性。长弓。有人建议z. tritici.可能从宿主ROS的产生中获益,并且可以操纵宿主ROS的产生,特别是H2O2[19,23].因此,早期的ROS在CV中爆裂。长弓可能无意中用于使病原体受益,通过减少潜伏的长度(CV中〜12天的长度)来促进其性别成功。并促进切换到病症。除了CV中基因的上调。长弓,还有涉及植物防御响应的许多生物过程中涉及的基因的下调,例如转录,应力反应,光合作用和新陈代谢。这是Rudd等人的支持支持。,2015年[27,他看到了对z. tritici.在易感CV的STB感染的前4天内效应基因。riband,以及小麦宿主中这些植物防御相关过程的下调。作者表明,这些植物方法可能被病原体抑制,以及植物转录组的真菌干扰的可能性。
与cv相反。长弓,cv。Stigg对这个问题的反应不那么剧烈z. tritici..事实上,在CV中的24 HPI观察到PTM基因,与激素相关的转录因子和一般防御反应基因进行抑制。Stigg。因此,它似乎而不是早期发现和激活防御反应,以对抗病原体,CV。STIGG的乐观响应攻击可能会导致其长期阶段,积极缺乏病原体。观察到的CV之间的差异。STIGG和CV。长弓的防御战略支持这个想法z. tritici.已经发展以操纵自己的成功的主持人防御[17],并建议在抗击STB疾病时,越少越好。事实上,抑制一种反应和避免ROS爆发可以避开病原体并延长疾病发展到坏死营养阶段的时间,在此期间真菌可以开始繁殖。虽然从潜伏期到坏死营养期的转换的触发因素仍然是未知的,并且在一定程度上依赖于宿主[21),真菌对潜伏期的长度和向坏死的转变有一定的遗传主权。染色体组成z. tritici.是13个染色体,最多8个辅助/可分配的染色体,其显示在真菌的不同分离物之间存在/不存在多态性[18]. 这些辅助染色体的适应功能尚未完全阐明,但它们的缺失部分地赋予了病原体的适应性,表现为早期转向坏死营养,随后增加了pycnidia的数量[21]. 对这种真菌铅坏死的一种解释是,真菌分泌富含半胱氨酸的小蛋白质,称为“效应物”[42].这些效应器可以在工厂中诱导细胞死亡[43],并在坏死开关前后达到表达高峰[19].来自真菌的效应器的流出可以响应病原体相关的分子模式(PAMP) - 触发的免疫(PTI)[36]. 在长弓和z. tritici.在本研究中使用的菌株似乎发生了突出的触发响应,但这导致易感性。如生物术中所记录的[36], necrotrophs [44]和血管术[45]这种敏感性可能是触发的效应器,因为植物病原体分泌效应蛋白来克服或抑制突出的触发反应。因此,我们建议在长弓中观察到的易感性可能是由于潜在地操纵主机响应的真菌,如前所述z. tritici.[17].
如果是cv。Stigg,PAMP触发反应或ROS爆发的证据很弱。PAMP触发的反应依赖于对病原体的识别,这表明cv缺乏识别。或识别和随后的PAMP反应下调。如前所述,简历。Stigg是人工合成的,因此含有一个野生小麦亲本的基因导入。人工合成的六倍体小麦对STB有很好的抗性[46因此,我们假设这些基因渗入是cv之间缺乏识别的原因。斯迪格和病原体。z. tritici.是一种小麦特有的病原体,与驯化小麦共同进化,可能以内生真菌开始[18].专业化的z. tritici.对于小麦而言,发生在六倍体和四倍体小麦早期驯化过程中,约10000个 几年前[47],在此期间,这些物种内的遗传多样性减少了[30]. 像这样的,z. tritici.只能感染少数物种小麦属[48],还有一些物种,尤其是T单球菌,表现出对STB的抵抗力,其特征在于完全停止真菌柱进入气孔[49].因此,我们假设来自脊髓源性相对的染色体迟发在脊柱中的相对突出可能已经取代了来自现代小麦的轨迹,这通常是病原体识别所需的。
为了进一步研究cvs的转录组反应。我们构建了小麦STB基因表达网络z. tritici.进入共同表达基因的模块。在两个品种中,与治疗相关的模块完全保存,这表明许多疾病响应基因在这些品种之间是一致的。但是,某些CV。与治疗相关的长弓模块没有表现出与CV的强烈关系。STIGG模块也与治疗相关联。这表明,尽管这些模块保存在品种之间,但它们的功能不是,表明其成分基因的品种特异性响应。该分析进一步支持CV。长弓的防御反应。此外,来自CV的更多模块。与治疗相关的长弓于CV。 Stigg, further strengthening the evidence that Longbow is more active in its response to STB than cv. Stigg.
结论
总之,我们提供了stb敏感cv的证据。长弓响应z. tritici.用PAMP触发的反应感染,最终导致易感性。相比之下,在STB抗性CV中。STIGG有较少的PAMP相关的上调基因,以及关键生物过程的下调的一些证据。这种方法可能允许它避开疾病进展并延长疾病的潜在阶段。我们假设Sememoria抗性野生小麦亲属的血液可能降低对病原体的宿主反应。进一步调查CV的基因组。STIGG,正在进行的双RNASEQ研究Stugg X Longbow隔离群体,以及对感染早期阶段的生理学研究z. tritici.在这个品种可能进一步揭示防御机制,并允许描绘负责cv的确切位点。斯迪格对病原体的识别(或缺失)。
方法
种质资源
六倍醇冬小麦品种(CVS。)在本研究中使用了长弓和STIGG。长弓(谱系:TJB-268-175 / HOBBIT)于1980年发布,易于STB [23]. Stigg(系谱:(BISCAY/LW-96-2930//carner)于2010年发布,对STB有很高的抗性[22]. 两个品种的种质均由英国诺里奇利马格兰有限公司的西蒙·贝里博士提供。这两个品种的种子可从约翰因内斯中心种子库获得(https://www.seedstor.ac.uk),长弓:商店代码W4115,斯蒂格:商店代码W10052。
真菌材料和接种物制备
的z. tritici.本研究中使用的分离物是软木Cordiale 4号,这是从小麦品种中采集的田间分离物。2016年,爱尔兰科克郡的Cordiale。甘油库存由Thomas Welch和Stephen Kildea(爱尔兰卡洛公司橡树园Teagasc作物研究中心)提供。z. tritici.通过将马铃薯右旋糖琼脂(PDA)与10μl甘油股票接种,并在接近紫外线下在20℃下孵育培养皿,12:12 H光:深循环)。如Zhou等人所述制备接种物。,(2020) [50], ,and adjusted to a solution of 1 × 106孢子ml− 1. + 0.02% Tween20. (Fisher Bioreagents, USA). A 0.02% Tween20 solution was used to inoculate the control plants.
小麦斑病试验
cvs的种子。Stigg和Longbow分层3个月 第4天 °C发芽5 第19天 °C,用铝箔包裹的皮氏培养皿中潮湿的Whatman 1号滤纸(英国Whatman国际有限公司)。幼苗被灌入约翰因内斯堆肥2号(韦斯特兰园艺,英国)在7 × 7. 厘米盆,每盆两株。对于每个基因型x处理x时间点组合,每个收获时间点种植3盆(6株)进行RNA序列分析,3盆用于疾病表型分析。花盆被放在塑料托盘中,并在19岁时放入生长室 °C,在16:8光照条件下:黑暗条件下,湿度为90%。在托盘内,随机分配了包含两种基因型和所有时间点的植物的盆的位置,但处理过的植物和对照植物总是放在不同的托盘中,以避免污染。植物用1 每三天在盘子里放一杯水。在第4片叶片出苗时,每株第3片叶片上都有标记,并用2 毫升1 × 106z. tritici.孢子ml− 1.+ 0.02%的Tween20或0.02%的Tween20对照溶液(每正、背面各1ml)。在用于RNA序列分析的植株中,接种后6、24、48或96小时,用无菌镊子和剪刀将接种的叶片全部切除。接种时间分别为上午10时、晚上6时、次日上午10时、次日上午10时、次日2时、第24、48、96小时。生物复制(即6片叶子)汇集到一个50毫升的猎鹰管中,在液氮中快速冷冻,并在-80°C保存。对于表型植株,第3叶的病害以接种后第28天发生坏死和pycnidia的叶面积百分率(dpi)进行评分。STB实验包括三个独立的试验,一个接一个进行,不重叠。
RNA提取和测序
用无菌杵和研钵在液氮中研磨叶片组织。从100个细胞中提取总RNA 根据制造商的方案,使用TriZol方案(美国加利福尼亚州Invitrogen)的研磨组织mg。RNA颗粒用冰镇的70%乙醇洗涤两次,再悬浮在40%乙醇中 μl无核酸酶无菌水。使用TURBODNase(Ambion,美国)消化gDNA,并使用Qiagen(Hilden,德国)的RNeasy迷你试剂盒清洁和浓缩RNA样品。使用BiodropμLITE(英国剑桥Biochrom有限公司)和Bioanalyzer 2100(美国加州圣克拉拉安捷伦)检查RNA质量和完整性。RNA浓度调整为100 ng/μl和30 μl转移至无菌0.5%溶液中 ml Eppendorf管。共48个样本(2种基因型) × 2个处理 × 4个时间点 × 3个独立试验)(在干冰上)送到香港北京基因组研究所。对48个RNA样本进行条形码编码,并在Illumina HiSeq 2500(美国加利福尼亚州圣地亚哥Illumina)的16条通道上进行拆分,并产生配对末端100碱基对读取。
RNASEQ数据的预处理和映射读取参考基因组
对Reads进行多路分离,对适配器进行裁剪,去除含有5%以上未知核苷酸的Reads和Phred评分低于10的30%以上碱基的Reads。FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc)用于为每个成对末端FASTQ文件生成质量度量(48个样本,成对末端读取x) = 96个FASTQ文件)。使用MultiQC将单个质量报告文件整理成一个摘要报告[51].IWGSC Refseq版本1.1 cDNA注释[34]从IWGSC URGI门户访问(https://urgi.versailles.inra.fr/download/iwgsc/IWGSC_RefSeq_Annotations/v1.1/). 每个基因的每一个转录本都在参考文献中。参考基因组包含137056个基因和基因亚型,代表110790个高置信度基因。这个Zymoseptoria triticiMG2参考CDNA注释从Ensemblfungi检索(http://fungi.ensembl.org/Zymoseptoria_tritici/Info/Annotation).两个参考索引文件(t . aestivum仅和的组合引用t . aestivum加z. tritici.)使用kallistov0.44.0创建[52]指数函数,使用默认的K-mer大小31。干净的RNAseq读数被映射到参考指数,基因丰度用Kallisto Quant函数,使用默认参数估计。使用的命令是kallisto quant-i index-o sampleID Sample_1.fq Sample_2.fq,其中Sample_1.fq和Sample_2.fq都是来自同一RNAseq Sample的成对结束读取。基因丰度矩阵是用R程序包“tximport”导入R的[53],使用命令和选项tximport(files,type = ““卡利斯托”,富兰克林伯爵 = “scaledTPM”,忽略AfterBar = 是的,txIn = 是的,txOut = 是的)。选项“txIn=TRUE”和“txOut = TRUE“指定读取被映射到单个基因变体,而不是基因。此分析的所有脚本都可以在GitHub上获得https://github.com/hbenbow/RNAseq.
读取计数和差异表达分析
读数分析在R V3.5.2中完成[54].首先,建立所有基因转录本x所有样本的转录本丰度矩阵,并对样本进行试验分割。然后对转录本进行筛选,这样对于一个给定的样本(即stig, Control, 6 hpi),该转录本在3次试验中有2次表达。Pearson相关分析采用R函数“rcorr”进行。使用R包“DESeq2”[55],创建了一个dds对象,其设计公式为:治疗+时间点+基因型+试验+治疗:基因型。对dds对象进行方差稳定变换,并以治疗、时间点、基因型和试验作为分组变量进行主成分分析。微分表达式分析t . aestivum表达数据是用R软件包“DESeq2”完成的[55].为每个样品估计大小因子,并且读数计数由大小因子标准化。围绕所有数据拟合分散估计和方差,并且在每个时间点根据基因型之间的治疗之间进行差异表达测试。
独立基因表达研究用于差异表达基因的独立生物学验证。本研究详细介绍了Affymetrixt . aestivum61k基因芯片。stig和stb敏感cv。格兰特(25]. 从Affymetrix网站检索探针序列。IWGSC refseq版本1.1使用BLAST+格式化为BLAST核苷酸数据库[56, Affymetrix探针序列在IWGSC refseq BLAST数据库中进行BLASTn搜索。提取BLASTn top hits(最低e值和最高百分比识别查询和主题序列之间),每个Affymetrix探针分配一个IWGSC基因ID。Blast2Go用于从Microarray中识别stig和Gallant的生物学过程,并将RNAseq研究中与关键生物学过程相关的差异表达基因与Microarray数据进行比较,以验证它们的响应表达z. tritici..
加权基因共表达网络分析
基因网络分析用R包“WGCNA”进行[26,57]. 该分析是使用读取对齐的组合参考t . aestivum和z. tritici.所有48个RNAseq样本中的基因。首先,利用DESeq2对表达式数据进行方差稳定变换,将数据转置到表达式集;数据被分成两个表达矩阵,一个是stig样本,一个是Longbow样本(每个矩阵24个样本)。这两个表达式矩阵被添加到一个多数据结构中,“goodSamplesGenes”功能被用于检测和删除有许多缺失值或方差为零的基因和样本。然后过滤后的表达式矩阵被连接回一个矩阵,以选择一个软阈值权力,这是适合的两个子集的数据。使用函数' pickSoftThreshold '选择软阈值功率(β),测试候选功率1-10。选择软阈值功率作为最小值,使无标度拓扑指数达到0.9。一旦确定了合适的β值,就在表达数据子集(分别为stig和Longbow)上进行网络构建,对两组数据使用相同的β值。由于表达矩阵的大小较大,利用分块网络构建和模块检测功能,将基因预聚为块,最大块大小为20000个基因。然后在每个区块单独进行网络分析,最小模块大小为30。 Module eigengenes (the first principle component of a module) were calculated. Modules were clustered and any modules with a maximum dissimilarity <= 0.25 were merged. To identify modules that are associated with treatment, each sample was given a binary designation of 0 or 1, where control samples were given a 0, and samples treated withz. tritici.模块特征基因与这些性状值相关,模块间相关系数显著(P < 0.05; 0.5 < =Cc< =−0.5)。模块集枢纽(即每个模块中连接最紧密的基因)是使用“chooseTopHubInEachModule”函数确定的。模块保存Stigg和长弓之间的网络计算WGCNA包中使用“ModulePreservation”函数,首先使用长弓表达矩阵作为参考,和Stigg表达矩阵作为测试集,其次使用Stigg数据集和长弓的引用数据作为测试集。对于每个保存模块,相应的模块在其他数据集(例如Stigg模块对应一个保存完好的长弓模块,反之亦然)定义通过识别的基因在该模块中,将每个基因分配给相应的模块,和过滤的五大模块(即5模块最基因)。这些相应的模块被可视化在R包“igraph”中,使用两个模块之间共享的基因数量作为边缘的权重。
基因注释与本体分析
所有基因本体分析和基因富集分析在Blast2Go V5.2.5中进行了[58,59].对于基因富集分析,测试组是来自感兴趣条件的基因列表(即6小时的长弓,上调,上调),参考组是在RNAseq数据中检测到的完整表达基因。BLASTN搜索是针对NCBI非冗余核苷酸数据库进行的。
统计分析
所有统计检验在R v3.5.2中进行分析[54].表型数据的分布采用Shapiro Wilks检验。数据向正态转化不成功,因此表型数据采用Kruskall-Wallis检验分析。所有两两比较均采用两两Wilcox检验进行校正P-使用错误发现率的值[58]. 利用卡方检验函数在microsoftexcel中进行卡方分析。此项目中用于分析的所有脚本都可以在GitHub上获得https://github.com/hbenbow/RNAseq.
数据和材料的可用性
支持本手稿结论的原始数据(FASTQ文件)可在NCBI SRA数据库中获得,生物项目编号为PRJNA656427。
在此手稿中分析和讨论的所有数据都可以在线补充数据中使用。
缩写
- ATP:
-
三磷酸腺苷
- 爆破:
-
基本的局部比对搜索工具
- BP:
-
完全
- Cc:
-
相关系数
- 简历:
-
品种
- 度数:
-
差异表达基因
- DMI:
-
14 a-demethylation甾醇抑制剂
- 新闻部:
-
接种后的日子
- 罗斯福:
-
假发现率
- H2O2:
-
过氧化氢
- 现病史:
-
接种后的小时
- IWGSC:
-
国际小麦基因组测序联合会
- NCBI:
-
国家生物技术信息中心
- 或者:
-
氧化还原
- PAMP:
-
病原相关分子模式
- 页码:
-
蛋白质磷酸化
- PTI:
-
PAMP-triggered免疫力
- PTM:
-
后平移修改
- Qoi:
-
醌外抑制剂
- RNAseq:
-
核糖核酸(RNA)测序
- ROS:
-
活性氧
- SDHI:
-
琥珀酸脱氢酶抑制剂
- SDW公司:
-
无菌蒸馏水
- SHW:
-
合成六倍体小麦
- 机顶盒:
-
Septoria tritici污斑
- 子类别:
-
亚种
- t . aestivum:
-
小麦
- TPM:
-
百万分之成绩单
- 乌尔吉:
-
Unité de Recherche Génomique信息
- WGCNA公司:
-
加权基因共存网络分析
- z. tritici.:
-
Zymoseptoria tritici
工具书类
- 1.
黄建平,张建平。小麦病害的田间研究进展。Mol Plant Pathol. 2018;19(6): 1523-36。
- 2.
小麦与塞普托利亚的冲突:开辟了一条新的战线?植物生态学报,2014;
- 3.
小麦黑斑病的研究进展。真菌遗传生物学。2015;79:3-7。
- 4.
Heick TM,Justesen AF,Jorgensen LN。杀菌剂对小麦病原菌Zymoseptoria tritici的抗药性策略,以DMI杀菌剂为重点。作物保护。2017;99:108–17.
- 5.
Torriani SF、Melichar JP、Mills C、Pain N、Sierotzki H、Courbot M。Zymoseptoria tritici:小麦生产的主要威胁,综合控制方法。真菌基因生物学。2015;79:8–12.
- 6.
Heick TM,Justesen AF,Jorgensen LN。北欧-波罗的海地区小麦病原菌小麦酵母菌对DMI和QoI杀菌剂的抗性状况。植物病理学杂志。2017;149(3):669–82.
- 7.
冷却HJ, Fraaije BA。中氮唑耐药机制研究进展Mycosphaerella Graminicola.以及对未来控制的影响。害虫管理科学。2013;69(2):150–5.
- 8.
McDonald BA,Stukenbrock呃。农业生态系统中病原体的迅速出现:对农业可持续性和粮食安全的全球威胁。Philos Trans R Soc B-Biolog科学。2016;371(1709):9.
- 9.
Saintenac C, Lee WS, Cambon F, Rudd JJ, King RC, Marande W等。小麦受体激酶样蛋白Stb6控制着对真菌病原体Zymoseptoria tritici的基因转换抗性。Nat麝猫。2018;(3):368 - +。
- 10。
Odilbekov F,他XY,Armoniene R,Saripella GV,Henriksson T,Singh PK等。QTL测绘和转录组分析,以鉴定小麦Sememoria Tritici斑斑疾病诱导的差异表达基因。农学 - 巴塞尔。2019; 9(9):15。
- 11.
查特兰L,布雷丁P,马克皮斯J,布朗J。抗药性来源小麦七星虫小麦斑点病及其育种意义。植物病理学。2004;53(4):454–60.
- 12
病原体种群生物学知识如何通知管理小麦七星虫斑点。植物病理学。2016;106(9):948–55.
- 13
Latz Mac,Jensen B,Colline DB,LyngsJørgensenHJ。用结构化筛选方法鉴定防止田间蛋白质斑点的两种内生真菌。BIOL控制。2020; 141:104128。
- 14
Brennan CJ、Benbow HR、Mullins E、Doohan FM。小麦黑斑病早期已知未知因素综述。植物病理学。2019;68(8):1427–38.
- 15
Kema GH,Yu D,Rijkenberg FH,Shaw MW,Baayn RP.糖尿病发病机制的组织学Mycosphaerella Graminicola.在小麦。植物病理学。1996;86(7):777 - 86。
- 16
邓肯克,霍华德rj。叶片污染病原体Mycosphaerella Graminicola的小麦感染细胞学分析。Mycol Res。2000; 104:1074-82。
- 17
Keon J,Antoniw J,Carzaniga R,Deller S,Ward JL,Baker JM,等。基因转录适应Mycosphaerella Graminicola.对其感病小麦宿主的程序性细胞死亡(PCD)进行了研究。植物与微生物的相互作用。2007;20(2):178-93。
- 18
Goodwin SB,M'Barek SB,Dhillon B,Wittenberg Ah,Crane CF,Hane JK等人。真菌小麦病原体的完成基因组Mycosphaerella Graminicola.揭示了染色体结构、染色体可塑性和隐性发病机制。公共科学图书馆麝猫。2011;7 (6):e1002070。
- 19.
Rudd J,Kanyuka K,Hassani Pak K,Derbyshire M,Devonshire J,Saqi M,等。病毒感染周期的转录组和代谢物分析Zymoseptoria tritici对小麦(小麦)揭示了与植物免疫的双向相互作用,涉及不同的病原体染色体贡献,以及半生物营养生活方式定义的变化。植物杂志。2015;167(3):1158 - 85。
- 20
李等[1]分析了该方法的应用前景。对小麦同源结构域蛋白TaR1的功能分析表明,宿主染色质重塑影响了植物病原真菌向坏死生长转换的动态Zymoseptoria tritici.新植物。2015; 206(2):598-605。
- 21
habig m,quade j,stukenbrock eh。前瞻性遗传方法揭示了真菌小麦病原体唑类麦芽素菌中辅助染色体的宿主基因型依赖性重要性。MBIO。2017; 8(6):E01919-7。
- 22
Hehir JG, Connolly C, O'Driscoll A, Lynch JP, Spink J, Brown JKM等。时间和空间田间评价突出了症状前阶段支持小麦对小麦Zymoseptoria tritici强部分抗性的重要性。植物病理学研究。2018;67(3):573 - 83。
- 23
关键词:小麦,亲和和不亲和互作,小黑麦,早期分子标记植物病理学研究。2016;3:450-59。
- 24.
Ramirez Gonzalez RH,Borrill P,Lang D,Harrington SA,Brinton J,Venturini L等。多倍体小麦的转录景观。科学。2018;361(6403):662–+.
- 25.
Brennan CJ,Zhou B,Benbow HR,Ajaz S,Karki SJ,Hehir JG,等。分类限制小麦基因与小分泌真菌蛋白相互作用,增强对小麦赤星病菌斑点病的抗性。前植物科学。2020;11:433.
- 26。
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9:13。
- 27。
陆克文JJ、Kanyuka K、Hassani Pak K、Derbyshire M、Andongabo A、Devonshire J、,小麦上小麦酵母菌侵染周期的转录组和代谢物分析揭示了与植物免疫的双相相互作用,包括不同的病原体染色体贡献和半生物营养生活方式定义的变化。植物生理学。2015;167(3):1158–85.
- 28。
参考文献:Gupta M, Sharma G, Saxena D, Budhwar R, Vasudevan M, Gupta V等。双RNA-Seq分析发现,苜蓿和豌豆白粉病在不相容和相容的相互作用和病原体候选效应中有不同的宿主转录特征。基因组学。2020;112(3):2130 - 45。
- 29
赵瑞瑞,李军,杨军,王国平,等。六倍体小麦GPC-1基因的功能研究。足底。2014;239(2):313–24.
- 30.
基因组可塑性是多倍体小麦驯化成功的关键因素。科学。2007;316(5833):1862 - 6。
- 31。
Powell JJ,Fitzgerald TL,艾斯特J,Berkman PJ,Gardiner DM,Landers JM等。六倍体小麦的防御相关转录组显示同源表情表达和感应偏压。植物Biotechnol J. 2017; 15(4):533-43。
- 32。
Ogbonnaya FC, Abdalla O, Mujeeb-Kazi A, Kazi AG, Xu SS, Gosman N等。合成六倍体:利用小麦原始基因库的品种改良。正确答案:Janick J,编辑。植物育种综述,第37卷。奇切斯特:威利;2013.35 - 122页。
- 33。
MujeebKazi A、Rosas V、Roldan S。六倍体小麦(T-turgidum L s lat x T-tauschii)中小麦(Coss)Schmalh(Aegilops squarrosa auct non L)遗传变异的保守性;2n=6x=42,AABBDD)及其在小麦改良中的应用潜力。基因资源作物进化。1996;43(2):129–34.
- 34。
IWGSC。利用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361(6403):661。
- 35。
植物防御信号转导中宿主蛋白的翻译后修饰。Mol Plant Pathol. 2008;9(4): 545-60。
- 36
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444(7117):323 - 9。
- 37
川野T。活性氧生成过氧化物酶反应在植物防卫和生长诱导中的作用。植物细胞代表2003;21(9):829–37.
- 38
巴里,琼斯。植物激素在植物防御反应中的作用。植物分子生物学。2009;69(4):473–88.
- 39
Rushton PJ, somsich IE, Ringler P, Shen qxij。WRKY转录因子。植物生态学报,2010;
- 40.
郑泽,阿布·Qamar S,陈ZX,Mengiste T.拟南芥Wrky33转录因子是抗病性真菌病原体所必需的。工厂J. 2006; 48(4):592-605。
- 41.
彭XX,王浩,姜济慈,小T,何HH,江D等人。OSWRKY80-OSWRKY4模块作为针对Rhizoctonia Solani耐水稻抗性的正调节电路。米。2016; 9:63。
- 42.
在小麦中,真菌孢子菌graminicola LysM效应介导的隐形发病机制通过CERK1和CEBiP同源物颠覆了识别。植物与微生物的分子相互作用。2014;27(3):236-43。
- 43
Ben M'Barek S,Cordewener JHG,Ghaffary SMT,van der Lee TAJ,Liu ZH,Gohari AM,et al.FPLC和液相色谱-质谱法从真菌小麦病原菌发酵受孢子培养滤液中鉴定候选坏死诱导蛋白。真菌基因生物学。2015;79:54–62.
- 44
刘zh,福尔摩斯DJ,Faris JD,Chao Sm,Brueggeman Rs,Edwards MC,等。病重养殖的效应触发的易感性(网)是大麦 - 比蛋白植物的底层F.特定于染色体6小时特异性的互动。莫尔植物途径。2015; 16(2):188-200。
- 45
Park Ch,Chen Sb,Shirsekar G,周B,Khang Ch,Songkumarn P等人。Magnaporthe Oryzae效应子AVRPIZ-T靶向环E3泛素连接酶APIP6以抑制水稻中的病原体相关的分子触发免疫。植物细胞。2012; 24(11):4748-62。
- 46
Ghaffary Smt,Faris JD,Friesen TL,Visser RG,Van der Lee Ta,Robert O,等。新的广谱耐受性小麦七星虫从合成的六倍体小麦中提取的斑点。理论应用基因。2012;124(1):125–42.
- 47
Stukenbrock EH,Bataillon T,Dutheil JY,Hansen TT,Li R,Zala M,et al.《一种新病原菌的产生:来自驯化小麦病原菌比较群体基因组学的见解》Mycosphaerella Graminicola.还有它的野生姊妹种。基因组研究,2011年;21(12):2157–66.
- 48.
Seifbarghi S、Razavi M、Aminian H、Zare R、Etebarian H。伊朗谷物和一些野生禾本科植物七鳃鳗寄主范围的研究。地中海植物病。2010;48(3):422–9.
- 49.
Jing HC, Lovell D, Gutteridge R, Jenk D, Kornyukhin D, Mitrofanova OP等。小麦单球菌-禾草芽孢杆菌互作的表型和遗传分析。新植醇。2008;179(4):1121 - 32。
- 50
周BB,Benbow Hr,Brennan CJ,Arunachalam C,Karki SJ,Mullins E等人。小麦编码小,分泌的蛋白质,有助于抵抗Semencoria tritici斑点。前群体。2020; 11:469。
- 51
Ewels P,Magnusson M,Lundin S,Kaller M. MultiQc:在单个报告中总结多个工具和样品的分析结果。生物信息学。2016; 32(19):3047-8。
- 52。
Bray NL,Pimentel H,熔化P,Pachter L.近乎最佳概率RNA-SEQ定量。NAT BIOTECHNOL。2016; 34(5):525-7。
- 53。
岩音C,Love M,Robinson M. RNA-SEQ的差分分析:转录物级估计改善基因级推断[版本2;同行评审:2批准]。F1000res。2016; 4:1521。
- 54。
r核心团队。一种统计计算的语言和环境。维也纳:统计计算基金会;2018年。
- 55。
安德斯,休伯W。序列计数数据的差分表达式分析。基因组生物学。2010;11(10):R106。
- 56。
关键词:聚类,聚类,聚类,聚类BLAST plus:架构和应用。Bmc生物信息学。2009;10:9。
- 57。
张B,霍瓦思S。加权基因共表达网络分析的一般框架。统计应用基因分子生物学。2005;第四条:第十七条。
- 58。
Blast2GO:一种用于功能基因组学研究的注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674 - 6。
- 59。
Gotz S,Garcia-Gomez JM,Terol J,Williams Td,Nagaraj Sh,Nueda MJ,等。高吞吐功能注释与BLAST2GO套件的数据挖掘。核酸RES。2008; 36(10):3420-35。
致谢
作者感谢科学基金爱尔兰项目14/1A / 2508。作者感谢Thomas Welch博士和Stephen Kildea博士(Teakgasc作物研究,橡树园,Carlow,爱尔兰)提供z. tritici.分离,和Katarzyna I。UCD的Ślęczka、Jianguang Jia、Brian Fagan、Liam Kavanagh和Bredagh Moran提供技术支持。
资金
这项工作由爱尔兰科学基金项目14/1A/2508和爱尔兰农业部项目VICCI(14/S/819)支持。STB实验、所有实验室工作和RNASEQ均由爱尔兰科学基金项目14/1A/2508和爱尔兰农业部项目VICCI(14/S/819)资助。HB和CB由爱尔兰科学基金项目14/1A/2508资助,BZ和TC由爱尔兰农业部项目VICCI(14/S/819)资助。资助者没有参与研究的实验设计、数据收集、分析和解释,也没有参与撰写手稿。
作者信息
从属关系
贡献
HB, SB, CU, EM和FD设计实验,CB, BZ, TC, HB进行实验室工作,HB分析数据,HB和FD撰写稿件,SB, CU和EM审核实验和分析,提供指导和指导,并参与讨论。所有作者均已阅读并批准稿件。
通讯作者
道德宣言
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Benbow,H.R.,Brennan,C.J.,Zhou,B。et al。人工合成小麦对小麦赤星病菌斑点病抗性的研究:少即是多。BMC植物生物学20,407(2020)。https://doi.org/10.1186/s12870-020-02612-z
已收到:
接受:
出版:
关键字
- 小麦1
- eptoria2
- 转录组学3.
- 潜伏期4
- Zymoseptoria tritici5