摘要
背景
小道消息(葡萄L..),具有重要的营养价值和健康益处,是全球培养的最经济上最重要的水果作物之一。几项研究显示了涉及葡萄生长和发育调节的大量MicroRNAS(VVMIRNA),许多VVMIRNA家族都有多个成员。然而,来自同一MiRNA家族工作的各种成员的方式尚不清楚,特别是在葡萄中。
结果
在该研究中,将重要的保守的VVMIR172系列(VVMIR172S)及其靶标被设定为阐明来自同一miRNA家族的不同成员的相互作用程度,机制和时空性状的良好实例。MIR-RACE和茎环RT-PCR用于鉴定VVMIR172S各种成员的时空表达;进一步验证了与RLM-RACE,PPM-res,Western Blot,转基因技术,互动程度和调节机制一起。VVMIR172C的表达显着高于VVMIR172A,B和D的表达,并显示出与丰度的正相关VvAP2劈理的产品。这些结果表明,VvmiR172可能是花发育过程中VvmiR172家族的主要作用因子之一。VvmiR172c切割靶基因的能力因与的互补程度的差异而不同VvAP2以及不同成员的表达水平。在VvmiR172转基因株系中,我们观察到35S::VvmiR172c导致开花时间最早且开花量丰富,说明VvmiR172c具有较强的功能。与之相反的是,在不同品种间的表型变化不显著VvAP2转基因素。QRT-PCR和Western Bolt结果表明,VVMIR172C在靶向方面发挥着重要作用VvAP2.
结论
VvmiR172上调表达n并降低了表达量ntflc..VVMIR172C的上/下调是最明显的。葡萄四个VVMIR172成员的功能不同,MIR172C具有最强的规定亚太地区2.
背景
在植物中,miRNAs在许多生理过程中发挥着重要作用,如生长发育和生物和非生物胁迫响应[1那2那3.那4.那5.];它们可以通过切割调节其靶基因的表达水平。其他MIRNAS作为植物育种应用的有希望的方法,例如作物改善策略[6.那7.].
许多植物miRNAs已经被鉴定出来[8.那9.那10,但这些mirna的大部分特征仍然不明确。miRNA表达谱的快速变化可能有助于植物功能[11那12那13那14那15那16[Allotetraploid棉()已描述此类变化陆地棉l .) [17].此外,许多miRNA在很大程度上是保守的并且属于多烯家族[18].成熟序列的这些差异可能导致靶基因的各种类型或改变裂解水平。预测多岛家族以靶向相同或重叠的基因集,表明miRNA之间具有实质功能冗余的可能性。其他研究人员展示了MiRNA家族成员,在监管中发挥特定作用[19那20.那21].MiR156C可以通过调节其下游基因来参与压力耐受过程,SPL9和DFR.,通过影响花青素的代谢来参与这一过程[21].上述研究表明,一个完整的miRNA家族的作用尚未得到全面系统的研究,因此很难深入了解miRNA家族的作用。
在葡萄中,虽然有几项研究已经确定了大量的VVMIRNA [16那22那23那24[这些作品专注于在一些特殊组织/器官处鉴定VVMIRNA序列及其表达谱。少数研究一个MiRNA家族的报告研究。我们以前的研究表明,同一VVMIRNA系列的各种成员具有差异表达谱,并在葡萄开发过程中表达其表达水平的动态变化[16]. VvmiRNA家族各成员与其靶基因互补程度的差异可能影响VvmiRNA对靶基因的作用程度和调控机制。然而,同一mirna家族不同成员的序列差异可能是影响mirna对靶基因裂解程度的重要因素。不同成员的差异表达谱可能是影响相互作用的另一个因素。迄今为止,系统研究同一miRNA家族中不同成员对靶基因的作用程度和调控机制的研究尚不多见。以往的研究大多集中在miRNA家族的作用上。因此,为了更全面地认识具有多个成员的miRNA家族的作用,对一个miRNA家族的每个成员进行系统的分析是非常必要和有意义的。
在之前的研究中,mirna的实验验证主要是通过Northern blotting和/或RT-PCR来确定其表达。有趣的是,虽然这两种技术可以证明mirna的存在和大小,但它们并不能确定其完整的精确序列[23那24那25那26].特别是对于有多个成员的miRNA家族,检测的只是多个成员的表达混合,而不是每个成员的表达混合。如前所述,来自同一个miRNA家族的不同成员序列的变异可能会影响其与相应靶基因的互补程度。因此,这些变异可能是mirna对其靶基因的作用程度和调控机制。我们开发了一种整合策略,将miR-RACE和茎环RT-PCR与RLM-RACE、PPM-RACE和Western blot相结合,可以准确地测定来自同一miRNA家族的每个成员的全精确序列。这个策略也会检测表达式。
通过对来自同一miRNA家族的每个成员的水平和分裂产物的分析,准确识别每个成员的作用程度和调控机制。
个体miRNA成员的功能探索对于理解miRNA的功能具有重要意义。本研究以VvmiR172家族为典型案例进行调查,以发现来自同一miRNA家族的多个成员的调节机制和功能。miR172在花发育过程中起重要作用;它通过调控基因表达来影响开花时间、花器官属性和花的特性AP2样基因[27那28那29].目前,几项研究表明,大多数葡萄麦芽醛属于多烯烯家族,几个成员只有一个到几个核苷酸[8.那16那23那24].现在重要的是描述VVMIRNA家族成员更好地了解MIRNA如何为葡萄开发有助于发展。
在植物中,许多mirna属于一些多基因家族,其中成员在成熟序列上与单个或多个核苷酸不同[18].序列的差异导致了与目标基因匹配水平的差异。不同的家庭成员有不同的时空表现特征。这些成熟序列的差异可能导致目的基因类型的变异或切割水平的改变。以前的许多报告都是关于一名成员的;然而,这些研究只表明了表达特性和转基因功能[22那30.那31].而对其他miRNA家族成员的功能和强度研究较少。大多数研究集中于整个miRNA家族的调节功能[32那33那34].这些作品没有研究每个家庭成员。在本研究中,使用miR-race,Step-Loop RT-PCR,RLM族,PPM族和转基因技术来研究四种miR172成员和靶基因的功能AP2样基因。这项工作可以在葡萄开发期间阐明miRNA家族成员靶基因的表达和调控机制,提供了一种有效的策略,可用于揭示不同miRNA家族成员的作用。
结果
来自MiRNA家族的成员多样性及其与目标的匹配度
最近,基于小RNA测序数据的高通量测序分析表明,许多miRNA家族并不是单一的序列。miRNA家族是由一系列不同长度/序列的miRNA组成。在本研究中,VvmiR172家族有4个成员,且4个成员的序列都不同(图1)。1).四个VVMIRNA家族成员的对准分析揭示了整体保守的共识,几乎没有变化。miRNA系列具有多个成员,其序列主要存在于5'或3'末端的一个或多个碱基差异。miRNA序列的差异可能导致靶基因的互补变化。在四个成员中,VVMIR172C具有靶基因最少的不匹配碱基VvAP2,其次是VvmiR172d、VvmiR172b和VvmiR172a(图。1).miRNA序列碱基的微小变化可以改变其调节靶mRNA的能力。
MiRNA系列各种成员在葡萄花开发期间的动态变化
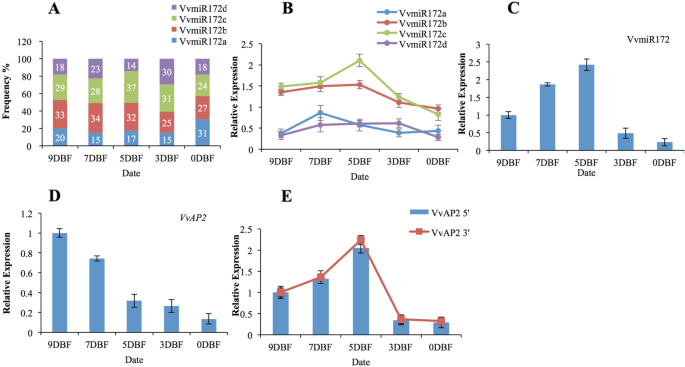
在葡萄的同一MiRNA系列中有许多成员可能导致功能冗余或具有空间 - 时间特异性的函数,但个别贡献仍然是未知的。因此,我们检查了每个成员是否在花发育中发挥着特定的功能。miR-race和茎环RT-PCR用于分析同一VVMIRNA系列中不同成员的表达水平。不同VVMIR172成员之间的表达趋势在花发育中显示出特异性(图。2A,B,C)。然而,总体表达中miR172b和c的比例相对高于其他比例(图。2a、b);这一发现与我们之前的高吞吐量结果相似[16].VvmiR172c表达趋势与VvmiR172家族一致,但VvmiR172b在花发育过程中表达下调(图)。2A,B,C),从而指示VVMIR172家族的各种成员在葡萄花开发期间可能具有各种调节机制,并且VVMIR172B和C可能在该过程中发挥关键作用。
个体miRNA成员在调节靶基因表达中的作用
植物mirna通过mirna介导的分裂在转录后控制基因的表达。目的基因的时空表达谱可为葡萄的生长发育提供重要信息。验证哪些miRNA成员正在对一个目标进行工作,以及该事件何时发生,对于更好地理解miRNA在花发育中的作用非常重要。
考虑到VvmiR172家族成员在干环RT-PCR和miR-RACE检测中表现出不同的转录水平,我们分析了每个VvmiR172家族成员在调控靶基因表达中的作用。目标基因的真实性VvAP2,对于VVMIR172家族,已被验证[8.那16].在这里,我们测量了多种miRNA成员/靶mRNA对的丰度。我们发现这些裂解片段在花期间发生变化。
VvmiR172的转录水平从9DBF上升到5DBF/7DBF,然后下降(图。2a、b、c)。VvmiR172b与c的表达比例具有一定的优势(图5)。2a、b)。VvAP2是VVMIR172的典型靶基因,参与调节花卉发育。除了VVMIR172B的表达之外,剩余的三个VVMIR172成员的表达与产量正相关VvAP2切割产品(图。2d, e).这一现象可以归因于VvmiR172a、c和d共同参与或只有一名VvmiR172成员参与了管制VvAP2表达(图。2d)。为了进一步了解VVMIR172的调节机制,进行了额外的转基因研究以探索VVMIR172的家庭特定功能。此外,VVMIR172家族的四个成员很容易区分。转基因检测分析中的可变控制是可能的。
中每个Vvmi172家族成员的功能分析烟草
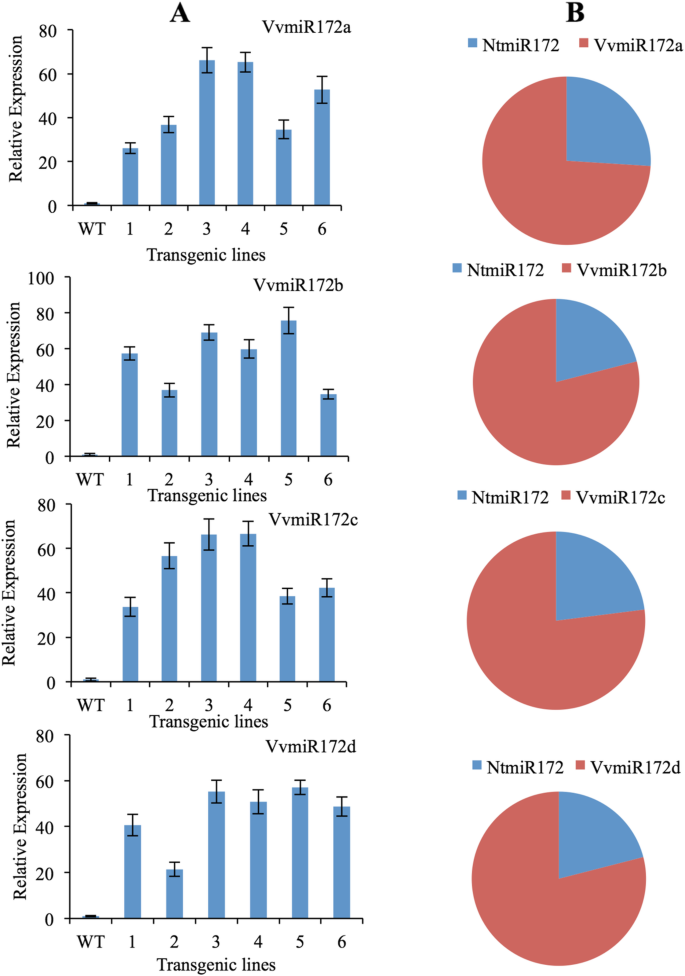
为了确定每个VVMIR172家族成员的靶基因AP2的调控模式,我们构建了VVMIR172家族成员的四个过表达载体,并将其转化为烟草(N. Tabacum).通过茎 - 环RT-PCR和MIR族分析VVMIR172的烟草转基因系中的积累。每个VVMIR172构件在35S :: VVMIR172线中可检测到烟草(图。3.).
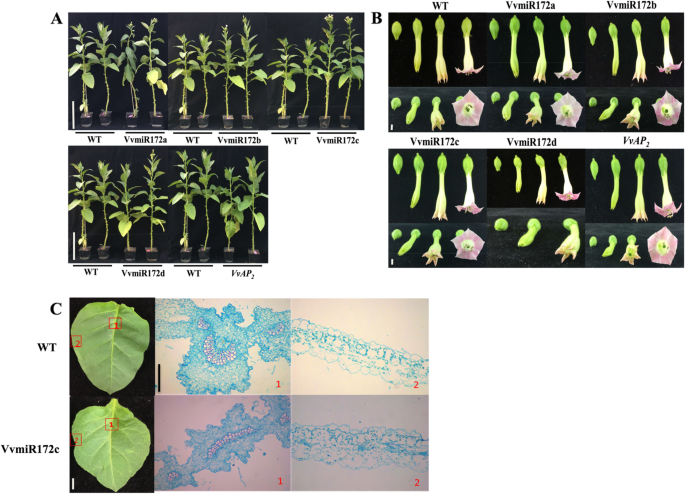
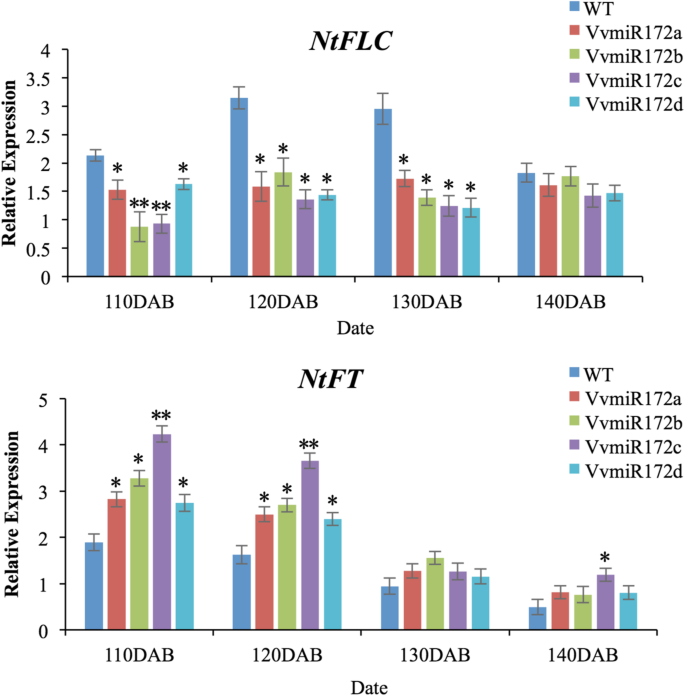
miR172的功能与花卉图案的形成有关[28那29]. 有趣的是,每个VvmiR172成员的异位表达提前了开花时间(图。4.).花图案缺陷,包括萼片到花瓣,没有观察到。35S::VvmiR172c株系与其他成员的转基因株系和野生型(WT)相比较,开花早,节点数增加。VvmiR172c叶片起皱,石蜡切片显示维管组织细胞异常。VvmiR172b的株高,c和d与WT相比明显增加。然而,VvmiR172c株高较高而VvmiR172b和d。通过转基因烟草的表型观察,我们可以判断,VvmiR172c发挥了重要作用的发展花和其他植物的表型特征。有趣的是,VvAP2转基因植株的表型没有明显的变化(图。4.).
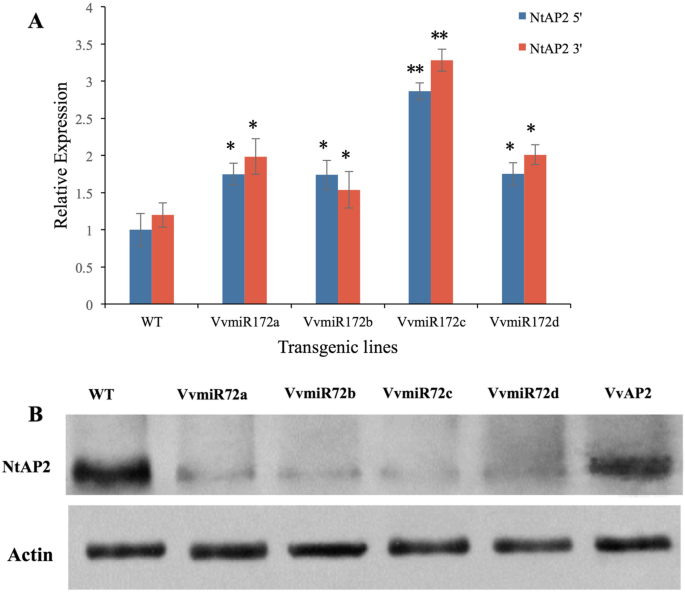
为了进一步确定每个VVMIR172家庭成员的监管作用,烟草丰富亚太地区2(ntap2.)对VvmiR172个体转基因株系的降解片段进行了研究(图。5.).虽然其他3个VvmiR172成员转基因株系的NtAP2降解产物的表达均高于WT,但仍低于35S::VvmiR172c。在所有四个转基因系中,35S::VvmiR172c的剪切产物表达量最高(图1)。5.一个)。ntap2.35S::VvmiR172a降解片段在所有VvmiR172转基因株系中均弱表达。此外,在四个VvmiR172转基因株系中,NtAP2蛋白在每个株系中都以较低水平累积(图。5.b).这些结果证明了VvmiR172c在调节中起着关键作用亚太地区2.转基因植物具有早期开花表型。在转基因烟草中检测到与花卉发育有关的一些基因的转录水平。这n四种转基因烟草中VvmiR172基因的表达均高于WT烟草,且VvmiR172基因的表达均高于WT烟草ntflc.低于WT烟草(图。6.).同样,最高表达n被发现在35年代:: vvmir172c。但是,差异ntflc.四个VvmiR172转基因成员之间表达不明显(图。6.).每个VvmiR172成员在花发育过程中具有不同的功能,而VvmiR172c在花发育过程中起着重要的调节作用亚太地区2转录。
讨论
MIRNAS广泛地致力于调节植物开发的许多方面,包括花卉开发,从花卉诱导到花式器官规范。然而,miRNA属于多核家族,并且来自相同miRNA系列的各种构件的差异仅存在于少数不同的核苷酸或单核苷酸中。在模型植物中,一些报道表明,不同的miRNA家庭成员具有不同的表达水平,并在其功能中具有差异或冗余。例如,对所有三个MiR164家族成员突变的研究表明,MIR164C在更大程度上导致对拍摄开发的控制而不是其两个姐妹MIRNA [19].
在本研究中,我们通过Stem-Loop RT-PCR和miR-RACE观察了葡萄中mirna及其家族成员的高度动态变化(图。2a, b, c)。VvmiRNA的表达模式与靶基因的预期表达呈一定程度的反比关系,从而提示这些基因可能被VvmiRNA主动剪切。VvmiRNA家族的表达与家族任何成员的表达都不相同。降解产物的表达与miRNA表达的变化存在正相关关系,可以作为评价miRNA功能的标准[35].不同miRNA成员的时空分布可以决定靶基因的时空分布。VvmiR172c/b的表达量高于VvmiR172ad,且与切割产物的丰度呈正相关,说明VvmiR172c在花发育过程中起着重要作用(图1)。2a, b, c)。其他报告也表明miR172c是一种重要的发育调节剂[29那36].根据我们的研究结果,我们提出了同一VVMIRNA MiRNA系列的不同成员在葡萄开发期间执行不同的任务,某些关键会员作为主要监管机构。VVMIR172C的丰富是最高的,其调节能力最高VvAP2有很大的优势。具有较强的裂解AP2 mRNA的功能。这表明miRNA的表达水平与其切割mRNA的能力呈正相关。有趣的是,调控显著的miRNA成员具有较强的裂解AP2 mRNA的功能,与靶基因低错配率(图)。1).AtmiR172可以在翻译水平上抑制AtAP2 [37]. 然而,AtmiR172与AtAP2, VvmiR172的不匹配率较低VvAP2.在以前的报告中,miR172与靶标的错配碱基最少亚太地区2,它可以通过miR172诱导的AP2裂解来调节根和花卉开发[36那38那39].VvmiR172c对目标基因只有一个错误率VvAP2,而其他三种与目标基因有三到四种不匹配。miRNA与靶基因的不匹配度较低,对靶基因的降解能力可能较强。
由于VVMIR172家族的四个成员的序列不同,因此可以区分它们,并且在花中的每个成员的表达并不明显。最重要的是,VVMIR172与烟草和葡萄相匹配亚太地区2一模一样。
利用转基因烟草进一步研究VvmiR172家族成员对靶基因的调控作用。miR172通过降解和抑制花期和花器官的形成来调控开花时间和花器官的形成亚太地区2表达式[27那28那29].MiR172的过度表达可能导致早开花(表1,无花果。4.).观察MIR172家族四个成员的烟草异位表达显示出早开花和开花量的增加。然而,尚未观察到花器官形成的表型。这种发现可能是因为VVMIR172的抑制作用ntap2.在烟草中比miR172弱。通过转基因表型可以看出,35S::VvmiR172c开花时间最早,开花量最大(图。4.),说明VvmiR172c的功能最强。
miRNAs在葡萄藤中被大量研究,但是miRNAs及其家族成员还没有被完全描述。我们还分析了在转基因烟草植株中积累的AP2降解产物和AP2蛋白的丰度(图。5.).VVMIR172C对裂解效应最大NtAP2。无明显表型变化VvAP2转基因植物。我们建议亚太地区2单独表达不能起到调控作用,在一定范围内,其过表达并不影响植物的表型。AP2的破坏导致其功能减弱,表型导致开花时间异常。miR172可以下调具有开花抑制活性的靶基因(如TOE1、SMZ等),最终融合到FT,从而导致早期开花[40].FLC.可以通过削弱表达式来抑制开花英国《金融时报》和SOC1[40那41].
根据我们的数据,一个家族的成员在葡萄藤发育过程中可能会执行不同的任务。我们提供了证据,表明同一家族miRNA成员的表达水平和降解靶基因的能力在葡萄藤中是不同的。由此,我们推断这些成员的表达是由复杂的机制调控的。
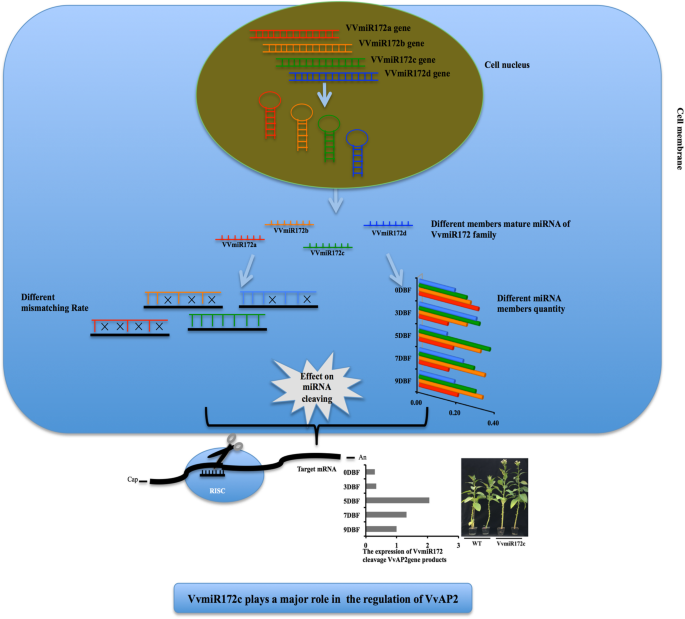
基于我们的发现,我们提出,mirna及其家族成员的作用超出了其最初的表达,并在随后的发育阶段继续活跃。我们也报道了miRNA成员表达水平的巨大差异(图。7.).这项工作有助于我们对葡萄开发的监管网络的理解。
结论
VvmiR172上调表达n并降低了表达量ntflc.(图。6.).VvmiR172c的上调/下调调控最为明显。以上结果表明,葡萄中4个VvmiR172成员的功能不同,其中miR172c的调控最强亚太地区2.
方法
植物材料
在花发育的每个阶段收集植物组织。从6岁的桌子葡萄'眨眼中收集组织(V.vinifera)在标准条件下成长。本研究中使用的葡萄是来自中国南京农业大学的水果实验农场。收集后,将样品在液氮中冷冻并储存在-80℃直至使用。这烟草benthamiana从果树遗传育种与基因组学实验室(NJAU)获得。所有植物材料均免费提供,并非濒危材料或物种。
RNA分离,cDNA合成
使用标准分子生物学协议和遵循制造商的指示,从葡萄植物组织中分离RNA,如前所述[5.].
microRNA表达模式的验证
首先,如前所述扩增非基因特异性产物,细微修改[25].5'种族和3'赛克隆测序[42[分析了每个VVMIRNA序列的相对丰度。结果表达为相对表达。
成熟miRNA的茎环定量qRT-PCR
葡萄花RNA(1μg)使用MiRNA特异性反向茎环转录引物逆转录并标准化为行动(补充表格S1).使用2计算相对表达水平-△△CT.方法和三种生物重复。
VVMIR172和AP2总表达的实时PCR
Polya尾矿测定用于检测VVMIR172的表达[43].我们的mirna富集文库用作RT-PCR的模板。利用VvmiR172序列(GAATCTTGATGATGCTACA)作为正向引物,R16328 (ATTCTAGAGGCCGAGGCGGCCGACATG)作为反向引物,从反转录cdna中扩增VvmiR172基因[23].成熟miRNA的表达与5.8S rRNA的表达一致。VvmiR172靶基因AP2的表达如前所述(补充表)S1) [23].
采用比较Ct法计算相对表达量,并将数据归一化至2-△△CT.方法。
VVMIR172靶基因预测
mirna以完全或近乎完美的序列互补地结合到其mRNA靶点的蛋白质编码区。VvmiR172目标预测策略参照Song等人报道的方法[25].这些标准包括:在miRNA 5 '端与1-9核苷酸互补的区域允许不超过两个错配,10和11位置不允许错配,12和21/24位置允许另外两个错配。miRNA序列与潜在的mRNA靶点之间的互补位点允许错配的数量不超过4个,互补位点不允许有间隙。
一种新的RLM-RACE + PPM-RACE的qRT-PCR裂解生产方法
我们开发了一种新的miRNA靶mRNA验证技术,该技术有六个步骤:(1)文库制备(2),巢式RLM-RACE和PPM-RACE,(3)扩增子克隆和测序,(4)切片位点检测,(5)miRNA剪切靶mRNA的qPCR,(6)产物克隆和测序以验证[25那44].
植物转化和生长条件
烟草(尼古兰·阿布拉内克)叶片外植体利用农方法 [45].在24℃下,16 h-light/8 h-dark周期再生植株,并鉴定出对卡那霉素的抗性。根诱导后,将植株转移到土壤中,在25°C下生长。
蛋白质提取和免疫印迹
从60天转基因烟草和WT的叶子中脱胶的蛋白质在标准的长期(较小的暗度和8小时,黑暗的8小时)条件下。通过在50mmtris-HCl,pH8.0,10mMMNAc1,0.1M PMSF和0.1MDTT中均化进行蛋白质的分离,随后在4℃下以13,000g以13,000g离心30分钟。在用硝酸纤维素膜上电光进行电,使用针对NTAP2的抗体进行蛋白质凝胶印迹分析。植物肌动蛋白用作载荷控制。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。如有要求,可与通讯作者联系。本研究中基因的登录数:VvAP2(MT912541),ntap2.(MT912542)。VvmiR172序列数据也可以从miRBase获得(http://www.mirbase.org/summary.shtml?org=vvi)(VVMIR172登录号:MI0006544,VVMIR172B登录号:MI0006545,VVMIR172C登录号:MI000546,VVMIR172D登录号:MI0006547)。
缩写
- miRNA:
-
微
- AP2:
-
Apet Ala2.
- RLM赛车:
-
RNA连接酶介导的5'CDNA的快速扩增
- PPM-RACE:
-
聚(A)聚合酶介导的cDNA末端3′快速扩增
- miR-RACE:
-
c cNA结束的miRNA - 快速扩增
- RT-PCR:
-
逆转录-聚合酶链反应
- QRT-PCR:
-
定量实时PCR
- RT-PCR:
-
逆转录聚合酶链反应
参考文献
- 1.
吴G.植物microRNA和发展。j遗传基因组。2013; 40:217-30。
- 2.
Choi K,Kim J,MüllerSy,ohm,upderwood c,亨德德I,lee i. swr1染色质重塑复合物在拟南芥中的Swr1染色蛋白改良复合物调节MicroRNA介导的发育变化。植物理性。2016; 171:1128-43。
- 3.
Ferdous J, Sanchez-Ferrero JC, Langridge P, Milne L, Chowdhury J, Brien C, Tricker PJ。干旱胁迫下大麦microrna的差异表达及其潜在靶点。植物细胞环境。2017;40:11-24。
- 4.
黄W,彭S,Xian Z,Lin D,Hu G,Yang L,Ren M,Li Z.过表达番茄MiR171靶基因SIGRAS24通过调节嗜酸性胃泌素和养肝稳态来影响多个农艺性状。植物生物科技J. 2017; 15:472-88。
- 5.
王M,Sun X,Wang C,Cui L,Chen L,张C,张C,Shangguan LF,Fang J.Sivem.Supiance in对外源性胃纤维酸的葡萄树及其靶基因的表征及其靶基因。Funct综合基因组学。2017; 17:537-49。
- 6。
孟Y,黄F,Shi Q,Cao J,Chen D,张J,Ni J,Wu P,陈M.基因组 - 微稻草和微润松靶对中的微生物抗性突变体根系的基因组调查。Planta。2009; 230:883-98。
- 7。
刘Q,陈YQ。植物工程新机制:MicroRNA在作物改善中分子育种的潜在作用。Biotechnol Adv。2010; 28:301-7。
- 8。
关键词:葡萄,microrna,高通量测序,降解分析植物j . 2010; 62:960 - 76。
- 9.
刘虎,秦c,陈z,zuo t,杨x,周h,徐m,cao s,沉y,刘开,他x,zhang y,li l,ding h,lübberstedt,张z,潘g。通过组合小RNA和降低测量测序鉴定MIRNA及其在玉米耳中造成玉米耳的靶基因。BMC基因组学。2014; 15:25。
- 10
程海燕,王勇,陶翔,范玉凤,戴勇,杨辉,马晓荣。番茄外源脱落酸响应microrna的基因组谱(Solanumlycopersicum.).BMC基因组学。2016; 17:423。
- 11
JR,郑国祥,Burge CB, Sharp PA。miRNA表达在细胞有序发育中的动态调控。基因Dev。2007;21:578 - 89。
- 12.
关键词:mirna -靶点相互作用秀丽隐杆线虫发展。发展。2009; 136:3043-55。
- 13.
通过对小RNA文库的深度测序,揭示了家蚕发育过程中保守的和新的microrna和microRNA-stars的动态调控。BMC基因组学。2010;11:52。
- 14.
Schack DV,Agostino MJ,Murray BS,Li Y,Reddy PS,Chen J,Choe Se,Strassle BW,Li C,Bates B,Zhang L,Hu H,Kotnis S,Bingham B,Liu W,Whiteside G,Samad Ta那Kennedy JD, Ajit S. Dynamic changes in the microRNA expression pro le reveal multiple regulatory mechanisms in the spinal nerve ligation model of neuropathic pain. PLoS One. 2011;6:E17670.
- 15.
Kirigin FF,Lindstedt K,Sellars M,Ciofani M,Low Sl,Jones L,Bell F,Pauli F,Bonneau R,Myers RM,Littman Dr,Chong Mm。动态MicroRNA基因转录和T细胞发育过程中的加工。J免疫酚。2012; 188:3257-67。
- 16。
王C,冷XP,张Y,凯伊什E,张Y,孙X,方JG。葡萄发育过程中microRNAs对目标基因调控模式动态变化的转录组分析。植物分子生物学。2014;84:269–85.
- 17。
Pang MX,Woodward AW,Agarwal V,Guan X,Ha M,Ramach-Andran V,Chen X,Triplett Ba,Dstelly DM,Chen ZJ。基因组的分析显示了MiRNA和siRNA序列的快速和动态变化,在胚轴和纤维发育过程中的表达和纤维棉花(陆地棉L.)。基因组生物学。2009;10:R122。
- 18。
Leng X,Fang J,Pervaiz T,Li Y,Wang X,Liu D,Zhu X,Fang J.使用MicroRNA互补DNA的MicroRNA快速扩增表达模式的表达模式。植物基因组。2015; 8(2):1-9。
- 19。
Sedber P,Wellmer F,Gheeyelinck J,Riechmann JL,Meyerowitz Em。植物小罗车冗余和专业化:MIR164家族在发育稳健性中的作用。发展。2007; 134:1051-60。
- 20.
miR169家族成员受高盐胁迫诱导并瞬时抑制NF-YA转录因子。中国生物医学工程学报。2009;10:29。
- 21.
崔玲,单建祥,石敏,高建平,林慧霞。miR156-SPL9-DFR通路协调植物发育与非生物胁迫耐受性之间的关系。植物j . 2014; 80:1108-17。
- 22
Velasco R,Zharkikh A,Troggio M,Cartwright da,Cestaro C.一种高质量的杂合葡萄种基因组的共识序列。Plos一个。2007; 2:E1326。
- 23
王聪,上官利夫,柯瑞克,王学成,韩军,宋cn,方建国。通过miR-RACE对计算预测的葡萄miRNAs进行验证,鉴定了一个餐桌葡萄品种中的microRNAs。《公共科学图书馆•综合》。2011;6:E21259。
- 24
王超,王新成,Kibet NK,宋聪,张超,李晓燕,韩军,方建国。对葡萄花和浆果短RNA文库进行深度测序,以发现新的microRNAs,并验证miRBase中存储的葡萄microRNAs的精确序列。杂志Planturm。2011;143:64 - 81。
- 25.
关键词:柑橘,表达序列标签,microrna,计算鉴定,靶标分析植物医学杂志。2010;12:927-34。
- 26.
关键词:植物,microrna,靶基因,鉴定,验证引用本文:杂志杆菌。2014;152:203-18。
- 27.
acta botanica botanica(云南植物研究中心),云南植物研究中心,云南植物研究中心。生物物理学报。2007;354:585-90。
- 28。
关键词:miR156, miR172,发育时间,miR156, miR172拟南芥. 牢房。2009;138:750–9.
- 29。
miR172对开花时间和花模式的调控。实验机器人2011;62:487-95。
- 30.
王春英,张珊,于勇,罗永昌,刘强,鞠超,张永昌,曲丽华,卢卡斯文杰,王琛,陈永强。MiR397b通过调节一种参与木质素生物合成的漆酶来调节拟南芥的木质素含量和种子数量。植物科学与技术;2014;
- 31.
太阳Z,Su C,云J,江q,王l,王y,ca d,zhao f,zhao q,张m,周b,zhang l,kong f,liu b,tong y,li x.遗传改进通过GMMIR156B操纵射击建筑与大豆植物产量。植物生物科技J. 2019; 17:50-62。
- 32.
Sharma D,Tiwari M,Pandey A,Bhatia C,Sharma A,Trivedi PK。microRNA858是亚苯基丙醇途径和拟南芥植物发育的潜在调节因子。植物理性。2016; 171:944-74。
- 33.
刘杰,程×,刘平,孙杰。miR156靶向SBP盒转录因子与DWARF53相互作用,调控面包小麦中Teosite BRANCHED1和贫瘠茎秆1的表达。植物生理学。2017;174:1931–48.
- 34
Nguyen STT, Greaves T, McCurdy DW。转染细胞的异种成细胞发育受microRNA miR156/SPL模块控制。植物杂志。2017;173:1676 - 91。
- 35
王C,汉族,Korir NK,王X,刘H,Li X,Leng X,方J.具有改进的RLM群体综合策略的葡萄柚微大研讨的靶MRNA的特征,新开发的PPM族和QPCR。j植物植物素。2013; 170:943-57。
- 36
Nova-Franco B,Iniguez LP,Valdes-Lopez o,Alvarado-Firantranger X,Leija A,Fuentes Si,Ramirez M,Paul S,Reyes JL,Girard L,Hernandez G.Themicro-RNA72C-Apetala2-1节点作为一个关键常见的豆类Rhizobiumetli氮固定共生的调节因子。植物理性。2015; 168:273-91。
- 37.
陈XM。一种MicroRNA作为Apetala2中Apetala2的翻译阻遏物。科学。2004; 303:2022-5。
- 38.
François L, Verdenaud M, Fu X, Ruleman D, Dubois A, Vandenbussche M, Bendahmane A, Raymond O, Just J, Bendahmane M. A miR172靶缺陷ap2样基因与双花表型相关。Sci Rep-UK。2018; 8:12912。
- 39.
唐敏,白欣,牛丽娟,柴欣,陈敏珊,徐福忠。miR172调控多年生木本植物的营养发育和生殖发育麻疯树.植物生理学杂志。2018;59:2549-63。
- 40。
李我,李继。条例和功能SOC1,开花途径整合子。实验机器人。2010;61:2247-54。
- 41。
jung hj,seo yh,seo pj,reyes jl,yun j,chua nh,park cm。这巨蜥-调控的microRNA172介导的光周期开花独立于君士坦斯在拟南芥.植物细胞。2007; 19:2736-48。
- 42.
Ioannidi E,Rigas S,Tsitsekian D,Daras G,Alatzas A,Makris A,Tanou G,Argiriou A,Aexandrou D,Poethig S,Hatzopoulos P,Kanellis AK。毛滴形成控制涉及与SPL转录因子的TTG1相互作用。植物mol biol。2016; 92:675-87。
- 43.
史尔,蒋VL。实时PCR定量microRNA表达的简便方法。生物技术。2005;39:519–25.
- 44.
Moxon S,Jing R,Szittya G,Schwach F,Pilcher RL,Moulton V等人。番茄短RNA的深度测序鉴定了参与果实成熟的MicroRNA靶向基因。Genome Res。2008; 18:1602-160。
- 45.
Mlotshwa S、Verver J、Sithole Niang I、Prins M、Van Kammen AB、Wellink J。表达HC-Pro的转基因植株表现出增强的病毒敏感性,而沉默转基因则产生抗性。病毒基因。2002;25:45–57.
确认
我们感谢王晨博士的帮助和感谢大家的讨论。
基金
国家重点研发计划项目(no . 2018YFD1000200);国家自然科学基金项目(no . 31872047);青岛农业大学高水平科研基金项目(no . 665/1119002)。关键词:抗剪强度,抗剪强度,抗剪强度,数值模拟
作者信息
从属关系
贡献
FJ和LG构思和设计了这项研究。SX分析了数据并写了稿件。WM执行实验并分析了数据。LX和ZK执行了数据分析。所有作者均阅读并批准了手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
孙歆,王敏,冷歆。et al。葡萄植株microRNA172家族成员在花发育过程中的调控机制BMC植物杂志20.409(2020)。https://doi.org/10.1186/s12870-020-02627-6
收到了:
公认:
发表:
关键字
- 小道消息
- VVMIR172家庭成员
- 监管机制
- VvAP2
- 花