摘要
背景
Pomelo是柑橘三种主要种类之一。水果积累了各种影响风味的丰富的次要代谢物。UDP-糖基转移酶(UGT)涉及次级代谢物的糖基化。
结果
在本研究中,我们对柚子进行了全基因组分析UGT基于保守的植物二级产物糖基转移酶(PSPG)基序,共鉴定出145个ugt。这些UGT通过其他植物UGT(A-P)通过这些基因的系统发育分析聚集到16个主要组中。Pomelo UGTs在染色体中不均匀地分布。在这些中观察到至少10个内含子插入事件UGT其中I-5基因的保守性最高。柚子的表达谱分析UGT利用RNA-seq技术对不同果实组织发育和成熟过程中的基因进行了分析。
结论
我们通过转录组数据和柑橘基因组数据库确定了柚子果实中的145 UGT。我们的研究提供了有关Pomelo的UGTS研究的可用信息,并为筛选和识别功能提供了重要的研究基础UGT基因。
背景
植物在不同的发育阶段产生各种各样的次生代谢产物,这些次生代谢产物参与重要的代谢机制。糖基化是一种重要的修饰反应,通常是植物次生代谢产物生物合成的最后一步。糖基化与甲基化、羟基化和酰化协同作用,促进了植物次生代谢产物的多样性和复杂性[1].糖基化是稳定和增强植物代谢物溶解度的主要机制,从而调节植物信号通路和细胞内稳态[2,3.].
糖基转移酶催化糖基化[4].2020年,共有110个糖基转移酶(GT)超级家族被纳入CAZy数据库(http://www.cazy.org),其中GT1家族的基因成员最多,主要分布在植物中。GT1家族通常被称为udp -糖基转移酶(UGT),因为它主要催化udp -糖转移到特定受体,包括植物激素、次级代谢物和外源性药物[5].植物UGT在c端有一个由44个氨基酸组成的保守序列,命名为植物二级产物糖基转移酶盒(Plant secondary product glycosyltransferase box, PSPG box),负责糖基的结合[5].n端序列差异很大,负责识别不同的受体分子[1].
参与植物次生代谢的ugt通常表现出广泛的底物特异性。一些UGT基因在功能性地表征糖基化的萜类化萜类化合物,苯丙醇丙烷和水果中的黄酮类化合物。在苹果中鉴定了甘氨酸特异性糖基转移酶UGT88F1 [6].VvGT5和VvGT6 from grapevine [7, FaGT6和FaGT7源自strawberry [8,被鉴定为参与黄酮类化合物的糖基化。AdGT4被鉴定为猕猴桃中的糖基化萜醇[9],而F3GT1参与猕猴桃花青素的生物合成[10].在桃果中,PpUGT85A2被鉴定为糖基化萜和苯丙素[11]和ppgt78a1和ppgt78a2负责花青素的糖基化[12].在柑橘中,已经报道了一些催化类黄酮糖基化的UGT成员,包括Cm1_2RhaT [13源自pomelo, CsUGT76F1 [14]及Cs1,6RhaT [15,16],另外三种ugt被认为是假定的萜类糖基转移酶[17].
迄今为止,为许多植物物种提供完整和几乎完全的基因组测序计划,为基因组研究提供了基础UGT基因家族。人们已经发现UGT以多基因家族的形式存在于植物中,并在许多植物物种中扩展。超过100UGT成员已确定身份拟南芥,甚至更多UGT在其他植物物种中也发现了家族成员。例如:147、179、180ugt已在玉米[18],Triticum aestivum.[19),而奥雅萨苜蓿[5),分别。此外,对于水果,全基因组分析UGT基因家族也有报道,包括马吕斯x有明显[5],葡萄[5),而碧桃[20.].然而,其他水果中UGT的信息仍然有限。
柚子是我国重要的经济柑桔品种之一,果实具有特殊的风味,富含对人体健康有益的类黄酮。在这项研究中,145UGT通过对柚子基因组数据库的分析,确定了其基因成员。进行系统发育分析、染色体定位和外显子-内含子基因结构分析。柚子的表达模式UGT通过RNA-SEQ分析在发育和成熟过程中各种水果组织的基因。基因组分析UGT基因家族为今后柚ugt的筛选和功能鉴定提供了思路。
结果
柚子UGTs的鉴定
在柚子果实中共鉴定出145个ugt蛋白,其c端含有PSPG box。这些UGT基因编码的预测蛋白质范围从144到680个氨基酸(平均459个氨基酸)(表S1).分子量16.39 ~ 76.87 kDa(平均Mw = 51.26 kDa),等电点(pI) 4.82 ~ 9.18(平均pI = 5.81)。这些基因的亚细胞定位表明,88个UGT成员(61%)可能位于细胞质中,35个(24%)和17个(12%)UGT最可能位于质膜和叶绿体中。只有一个UGT (Cg7g000340)被预测位于线粒体中,两个UGT (Cg6g025740和Cg8g023190)位于细胞核中,两个UGT (Cg3g014800和Cg3g014820)位于细胞外(图S)1,表2).
柚子UGTs的系统发育分析
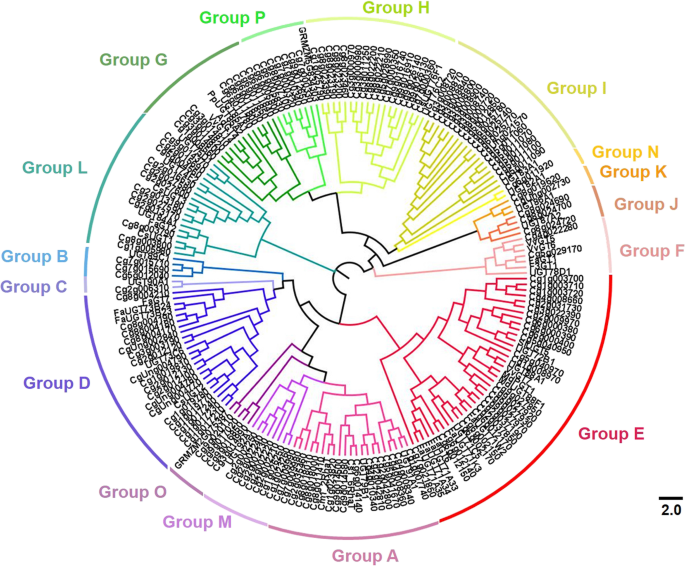
为了探索植物UGT家族的进化关系,基于柚子和其他植物UGT蛋白序列构建系统发育树,包括拟南芥柑橘、玉米、番茄、葡萄藤、桃子、苹果、猕猴桃和草莓。1).所有UGT成员分为16个系统发育基团,其中包含14个保守群体(A-N)拟南芥[2],以及在其他植物(如葡萄藤)中发现的O和P两种新发现的类群[5].柚子中的Cm1_2RhaT(与Cg1g023820氨基酸序列100%一致)和甜橙中的Cs1,6RhaT鉴定为类黄酮7-O-UGTs [13,15,16,聚类在a组。CsUGT76F1位于H组,被鉴定为参与类黄酮7-的生物合成O糖甙和7 -O-甜橙中的鼠李糖苷[14].拟南芥UGT73C6(FlaVonol-3-O-rhamnoside-7 -O葡糖基转移酶)21]和草莓FaGT7(黄酮醇-3-O葡糖基转移酶)8]位于d组。其他与黄酮醇-3-有关的ugtO-糖基化位于F组,包括UGT78D1拟南芥[22,以及来自葡萄藤的VvGT5和VvGT6 [7].
在'valencia'甜橙中分离出三个推定的三萜UGTS,Csugt1和Csugt3在L组中聚集,而Csugt2在D组中聚集[17].几个UGT73(属于D组)和UGT71家族成员(属于E组)在花青素的生物合成和挥发性代谢物的糖基化,包括萜类[23,24].G组中的其他ugt也被功能表征为参与萜类糖基化并影响水果风味,如猕猴桃AdGT4 [9,葡萄藤[]25]和桃子ppugt85a2 [11].
植物UGTs在系统发育基团中的分布
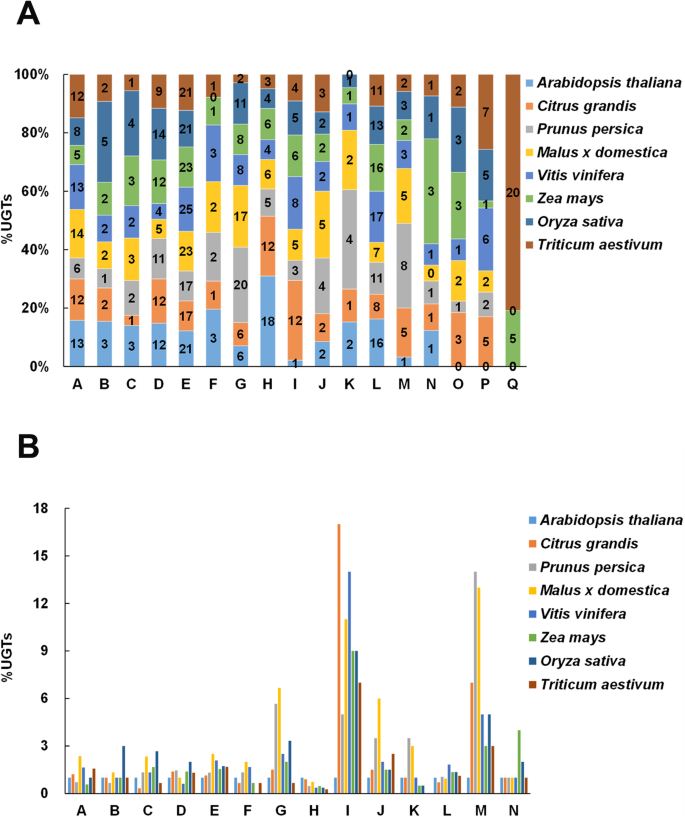
植物的进化模式UGT通过比较ugt在不同系统发育类群中的分布来分析ugt基因家族(表)1).在高等植物的演变期间,五个系统发育基团A,D,E,G和L似乎比其他系统扩展更多,尽管这些组中发现的基因的数量在物种之间存在广泛而变化。在柚,六个系统发育基团,A,D,E,H,I和L比其他组扩增。G组只有9个柚UGTS,超过拟南芥(6个ugt),但远低于其他植物,尤其是桃和苹果,g组ugt分别高达34个和40个。2a). H组柚子UGTs的比例(约占柚子总UGTs的12%)远高于其他水果,如桃(碧桃)、苹果(马吕斯x有明显)和小道消息(葡萄) (图。2一个)。
值得注意的是,通过比较各系统发育组的植物ugt数量与文献报道的相比,I组和M组的植物ugt数量显著增加拟南芥(无花果。2b)。拟南芥,组I只有1个UGT成员,其他植物有5-17个成员,其中柚子的UGT数量最高(表2)1;无花果。2b).在M组中,ugt的数量为1拟南芥桃子中的14岁,差异为7倍拟南芥和柚子。此外,一些组的柚子ugt的数量相对较少拟南芥,包括C组,F,H和L.
染色体的位置UGT基因在柚子
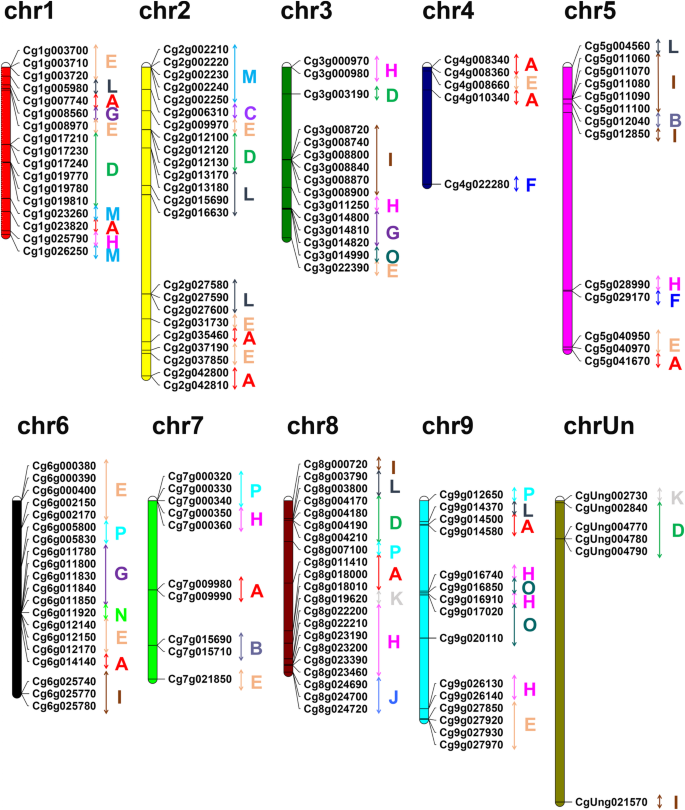
综述了柚子的基因组分布UGT基因,染色体的位置UGT基于从柚子基因组数据库中检索到的基因组注释信息(图。3.;表S.3.).总计139UGT9条染色体上的基因分布不均匀,其余6条染色体上的基因分布不均匀UGT基因定位于未知染色体(chrUn),包括CgUng002730K,组CgUng021570第一组和第四组UGT在柚子基因组中,2号染色体包含的基因最多UGT基因(23个成员),8号染色体上21个成员,6号染色体上20个成员。只有5个成员分布在4号染色体上,这是染色体数量最少的UGT基因。
由于柚子ugt可以分为16个组,我们观察到这些组在染色体上的定位(图。3.).的UGTE组成员最多的基因(25个基因)随机分布在8条染色体上(1-7号和9号染色体),I组的3号和5号染色体各有6条UGT基因,6号染色体有三个UGT基因,其余两个成员均位于8号染色体和未知染色体上。M组有7个UGT其中5个位于2号染色体,2个位于1号染色体。
结构分析UGT基因在柚子
为了更好地探讨柚子的结构与功能之间的关系UGT基因,并进一步阐明了内部的进化关系UGT基因家族,外显子/内含子结构分析。在145个柚子中UGT基因,70ugt(48%)无内含子,63个ugt(43%)含有1个内含子,其余8个ugt包含两个内含子,三个ugt包含三个内含子,只有一个UGT含有八个内含子(表2;图。S.2).为UGTB组、C组和O组中内含子缺失的基因数量最多,分别为22个、15个和13个。大部分的ugt在H组和I组中,每组17个成员中有14个UGTs(82%)包含一个内含子。
对75个内含子序列进行搜索,并将内含子与氨基酸序列进行比对,发现柚子中有10个独立的内含子插入事件UGT基因家族成员(图。4).根据蛋白序列中的位置,将这些插入事件从I-1到I-10依次编号。内含子5 (I-5)是一种保守性最高的内含子,是目前应用最广泛的内含子ugt,包含48UGT成员(内含子的64%ugtF、K、J、N、P组的所有成员以及G、H、I组的大部分成员都含有内含子5。9个中有8个ugtG组内含子5,I组17个内含子中13个,h组17个内含子中12个。L组以内含子6为主。
共鉴定出96个内含子中的大多数UGT柚基因结构处于第1阶段,占64%(61个内含子),第0阶段占28%(27个内含子),第2阶段仅占8%(8个内含子)(图2)。4).高度保守的内含子5中,0期和2期各有1个内含子,而1期占所有内含子的96%。9个内含子中的4和7的所有成员ugt内含子6处于0期。这些结果表明,大多数高度保守的内含子是古老的元素,在进化过程中其阶段保持稳定。
不同果实组织在发育和成熟过程中的表达谱
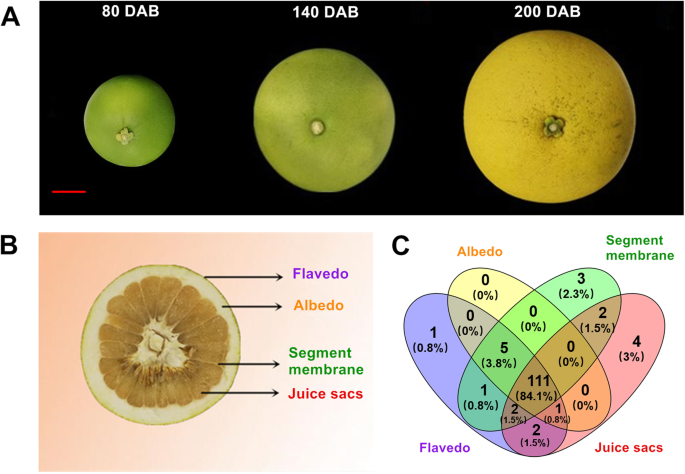
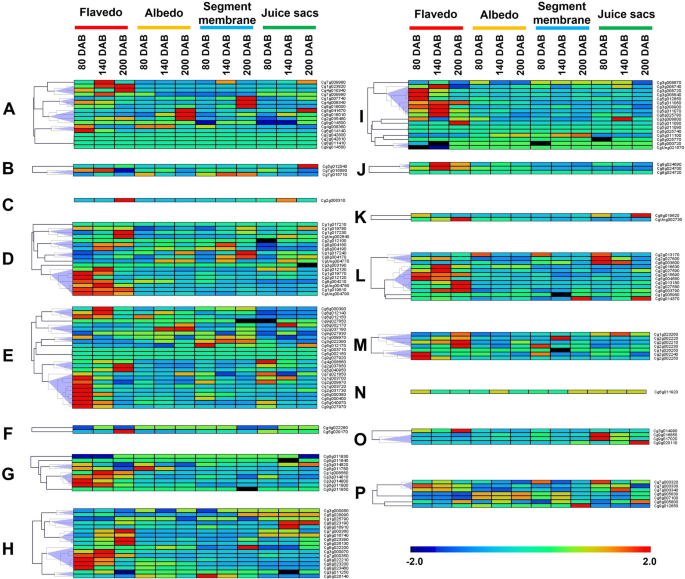
检测145个柚子的表达谱UGT基因,转录本丰度ugt利用RNA-seq数据分析了不同果实组织在发育和成熟过程中的变化。5;无花果。6).柚子果实的四个不同组织分别是黄皮、反照率、节膜(SM)和汁囊(JS)。5a, b).总共111个UGT基因(占柚子总数的84.1%)ugt)在四个果实组织中均有表达。此外,4UGT基因(占3%),3UGT基因(2.3%)UGT基因(0.8%)分别在JS、SM和flavedo中特异表达,但在albedo中没有特异表达(图2)。5c)。
对于不同发育阶段的柚子果实,近一半(71个成员)UGT黄舌鱼中转录水平最高的基因(图。6).其中,13ugt(52%)属于e组,10ugt(56%的D组成员)属于D组,8ugt(47%)在H,9组ugt(53%)ugt柚子中29个成员在绿期(80 DAB)表达量最高,其次是破色期(140 DAB) 23个成员,成熟期(200 DAB) 19个成员。Cg1g023820A组的氨基酸序列与A组的氨基酸序列一致100%Cm1_2RhaT从柚子中,鉴定出了一种类黄酮7-Ougt [13,15,16],在柚子黄腥果的破色期(140 DAB)和成熟期(200 DAB)的转录水平最高。这一发现与之前的研究一致。考虑到最多的柚子UGT在E组中,进一步分析不同果实组织在发育和成熟过程中的表达模式。6).总共九UGT转录丰度最高的基因为黄尾草绿期(80 DAB)、黄尾草破色期(2个)和成熟期(2个)。只有一个UGT的基因,CG2G037190在反照率的破色期和成熟期表达量最高CG3G022390.和Cg6g012170在柚节膜(SM)中表达量最高,在果汁囊(JS)中主要表达3个基因。
讨论
植物糖基转移酶属于一个功能多样的大的酶家族,特征为糖基转移酶家族1,也称为udp -糖基转移酶(UGT) [1].植物UGTS催化广泛的糖基化反应底物,包括植物激素,植物次级代谢物和生物均匀/异源物质(如氰基糖苷和除草剂)。植物次级代谢产物通常分为三类:酚,萜烯和含氮有机化合物。这些化合物中的一些是化学改性的,并且糖基化是重要的改性反应之一。一些UGT基因在植物中的功能特征,如拟南芥[5],玉米[18],Triticum aestivum.[26],芸苔属植物拉伯[27),碧桃[20.].在柑橘中,只有三种UGTS已经在功能上鉴定,来自Pomelo,CS1,6Rhat和Csugt76F1的Cm1_2Rhat,与黄酮糖基化相关的甜橙色[13,14,15,16],以及三种推测的萜类UGTs, CsUGT1, CsUGT2和CsUGT3 [17].然而,在柑橘中没有发现大规模的分析。
在这项研究中,共145名UGT在柚子果实中发现了基因,约占柚子基因产物的0.5%,低于桃子的0.6% [20.].柚子的UGT基因被聚类为16个组,包括14个高度保守组(A-N)和2个新发现的O和P组(表1)1).在玉米和小麦中发现了一个新的类群Q,这表明该类群可能只存在于单子叶植物中,并在单子叶植物中发挥重要作用UGT单子叶植物的基因进化。相比之下,K组只有一个UGT在玉米和水稻中有成员,而在小麦中没有成员,这表明K组可能扩大双子叶植物中的成员。在柚子群N中仅鉴定出1个成员,这与双子叶植物如拟南芥,苹果和桃子。这一发现为之前的猜测提供了额外的证据,即N组主要在单子叶植物中被放大[18,20.].此外,E组的含量最多UGT基因,占所有人的17%UGT基因在柚子。此外,UGTe的基因占该研究比较八种物种中最高比例的,表明e在各种植物物种中已经扩展。此外,很多植物UGTE组的基因成员已被功能识别,包括小分子挥发性化合物的糖基化,以及类黄酮苷、根皮苷、花青素的合成[6,23,24],表明E组对植物次生代谢产物的糖基化有重要贡献。
内含子的基因的一个重要组成部分,尽管他们不参与蛋白质的编码,插入收益或损失事件和内含子的插入位置相对于蛋白质序列通常被认为是关键的线索理解基因家族的进化或多样化28].145个柚子的内含子定位ugt透露48%UGT成员缺乏内含子,比桃的数量(43%)多[20.),而少于在美国的人数(58%)拟南芥[5].在柚子中共鉴定出10个内含子插入位点UGT与桃相同的基因[20.].在这些内含子中,除E、L、M组和B、C组没有内含子外,内含子5 (I-5)被认为是分布最广泛的内含子。为了桃子ugt[20.179年,小麦ugt[26[范例玉米ugt[18,内含子5也是最古老的内含子。其余内含子中,有一些主要在某些系统发育组中观察到,如内含子6主要在L组中观察到,这与桃中观察到的类似[20.].有趣的是,大量的内含子5处于期1,而大量的内含子6处于期0,且期0和期1的内含子数量大于期2的内含子数量。这一发现与之前的研究一致,表明保守的内含子是古老的元素,在进化过程中,内含子的相一般是保守的,可以保持多年不变,因为任何小的DNA片段的删除和插入都可能导致相的改变,从而导致基因功能的改变。并被自然选择所淘汰[29].
在之前的研究中,有三个UGT的基因,Cm1_2RhaT柚子(柑橘最大值),CsUGT76F1和Cs1 6小红帽来自甜橙色(素类)的功能特征表明其参与类黄酮的生物合成7-O糖甙(15,16].CsUGT76F1与Cg7g000360、Cs1、6RhaT和Cg6g014140的氨基酸序列同源性分别为98.69%和81.26%。值得注意的是,Cg1g023820、Cg7g000360和Cg6g014140在水果黄酮中特异表达,这与黄酮中糖基化类黄酮的高积累是一致的[30.,31].另外,许多(〜50%)的柚子UGT黄舌鱼基因转录水平最高,说明ugt在糖基化次级代谢物的生物合成中起重要作用。
结论
本研究为研究柚子udp -糖基转移酶的进化、分布、基因结构和表达谱提供了有益的见解。在柚子果实中共鉴定出145个UGTs。这些基因在9条染色体上分布不均匀,聚为16个系统发育群(A-P)。在柚子中观察到10个内含子位置UGT这表明它们在进化和分化中起着重要的作用UGT基因家族。通过RNA-seq分析,发现ugt在柚子发育和成熟过程中的组织特异性表达,表明ugt在柚子中的重要作用。本研究将有助于筛选候选基因,进一步鉴定其底物特异性和生物学功能。
材料和方法
植物材料
玉环(c .茅(l)玉环奥斯贝克柚子果实采自浙江省玉环县科豪果品专业合作社,并获得取样许可。果实采后的发育阶段分别为绿期、花期后80天、140 DAB断色期和200 DAB成熟期。在每个采样时间,果实被分为四个不同的部分:黄皮(外皮),反照率(内髓),节膜和汁囊。3个生物重复,每个重复5个果实,收获后在液氮中冷冻,并在-80℃下保存oC直到进一步分析。
鉴定UGT基因
在转录组数据的功能注释结果中,以“udp -糖基转移酶”作为查询,筛选基因,确定柚子ugt。UGTs的进一步确认是基于植物次生产物糖基转移酶盒(PSPG box)的44个氨基酸保守基序。柚子的UGT基因序列及相关信息ugt,包括从柑橘基因组数据库中获得染色体位置,外显子内部结构和描述(http://citrus.hzau.edu.cn/orange/).利用在线程序ExPASy (https://web.expasy.org/compute_pi/).使用在线分析工具CELLO v2.5系统预测UGT蛋白的亚细胞定位(http://cello.life.nctu.edu.tw分子生物信息学中心。染色体的分布UGT用MapChart (v2.32)软件进行测序。
系统发育分析
利用ClustalX v2.0程序,采用neighbor-joining (NJ)方法对ugt的氨基酸序列进行比对。利用FigTree v1.4.2程序构建了145个柚子ugt的系统发育树,这些ugt包括:VvGT5 (GenBank XP_002271025)、VvGT6 (NC_012017)、VvGT7 (XP_002276546)和葡萄藤VvGT14 (XP_002285770)。葡萄);MDPGT1(XP_008339149)和来自Apple的MDugt88F1(EU246349)(马吕斯x有明显);SLUGT5(XP_004231207)来自番茄(茄属植物lycopersicum);来自猕猴桃F3GT1 (A0A2R6Q8R5) (猕猴桃对);AdGT4 (KF954944) from猕猴桃(猕猴桃deliciosa);FaGT1(AY663784),FaGT2(AY663785),FaGT6(DQ289587),FaGT7(DQ289588),FaUGT71A33(XP_004303953.1),FaUGT71A34(XP_004303954.2),FaUGT71A35(XP_004303955.1),FaUGT71W2(XP_011468178.1),FaUGT73B23(XP 0043040221),FAUGT73B24(XP 0043040222.1)和FAUGT71K3(XP 004294260.1)来自草莓(草莓属xananassa.);PpUGT85A2 (XP_007227474.1) from peach (碧桃);GRMZM5G834303 (NP_001148991.2)和GRMZM2G075387 (XP_008670630.1)源自玉米(玉米);Cm1, 2hat (AY048882) from柚子(柑橘最大值);CsUGT1 (GQ221686), CsUGT2 (GQ221687),和CsUGT3 (GQ221688) from sweet orange (素类).19个UGT序列来自拟南芥请从http://获取www.p450.kvl.dk UGT.shtml.
基因内区映射
柚子的UGT通过确定内含子的长度、剪接位置、相位和位置,构建内含子图谱。的外显子-内含子结构UGT使用在线基因结构显示服务器2.0程序(http://gsds.cbi.pku.edu.cn/)使用基因组序列和CDS序列。通过对齐所有柚子UGT,根据其在氨基酸序列中的位置进行序列号。基于它们的阶段分为三种类型:相0,阶段1和相位2。如果内含子位于两个三重胶囊之间,则它被定义为阶段0;如果在密码子的第一和第二基座之后的内含子定位,则其定义为阶段1和第2阶段[20.,32].
基因表达分析
根据Zhang等人,使用约0.3g的Flavedo,0.3g玻璃膜,0.3g分段膜和1g汁囊和1g果汁囊。[33].用NanoDrop One分光光度计以A260/A280的吸光度比测定RNA样品的质量和浓度。凝胶电泳验证RNA的完整性。高通量Illumina链特异性RNA-Seq文库的制备如前所述[34].该数据通过每千碱基/百万映射读(RPKM)值作为转录丰度计算。3个生物重复进行基因表达分析。
数据分析
使用Multi Experiment Viewer (version 4.6.0)进行热图分析UGT柚子的基因转录本丰度及基因簇的构建。VENNY 2.1在线程序(https://bioinfogp.cnb.csic.es/tools/venny/index.html)用来绘制维恩图。
数据和材料的可用性
该研究中的转录组数据的原始测序读取可用于序列读取存档(SRA)数据库,附加号码Prjna663973。本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。
缩写
- UGT:,
-
UDP-glycosyltransferase
- PSPG:
-
植物二次产物糖基转移酶
- 轻拍:
-
盛开后的日子
- cd:
-
编码序列
- RNA-Seq:
-
RNA测序
参考
- 1.
植物天然产物合成中的糖基转移酶:一个表基因家族的特性。植物科学进展2000;5:380-6。
- 2.
Li Y, Baldauf S, Lim EK, Bowles DJ。马来酸-糖基转移酶多基因家族的系统发育分析拟南芥.中国生物化学杂志。2001;276(6):4338-43。
- 3.
Ross J, Li Y, Lim EK, Bowles DJ。高等植物糖基转移酶。基因组医学杂志。2001;2(2):1 - 6。
- 4.
1家族糖基转移酶的功能多样性。植物j . 2011; 66(1): 182 - 93。
- 5.
通过对udp -糖基转移酶家族1的全基因组系统发育重建,揭示了该家族在植物适应陆地生活过程中的扩展。植物j . 2012; 69(6): 1030 - 42。
- 6.
Dare AP, Yauk YK, Tomes S, McGhie TK, Rebstock RS, Cooney JM等。沉默根色素特异的糖基转移酶会干扰一般的苯丙素生物合成和植物发育。植物j . 2017; 91(2): 237 - 50。
- 7.
小野E,黄志明,高桥,等。葡萄中促进生物活性黄酮醇苷化学多样性的糖基转移酶的功能分化(葡萄).植物细胞。2010; 22(8):2856-71。
- 8.
Griesser M, Vitzthum F, Fink B, Bellido ML, Raasch C, Munoz-Blanco J,等。草莓多底物黄酮醇-葡萄糖基转移酶(草莓属xananassa.瘦果和花托。中国生物医学工程学报。2008;59(10):2611-25。
- 9.
王美玲,王美玲,王美玲,等。利用对萜醇具有特异性的糖基转移酶对风味和香气化合物的分离和释放的操作。植物j . 2014; 80(2): 317 - 30。
- 10.
Montefiori M, Espley RV, Stevenson D, Cooney J, Datson PM, Saiz A,等。红肉猕猴桃中负责花青素生物合成的两种糖基转移酶F3GT1和F3GGT1的鉴定和特性(猕猴桃对).植物j . 2011; 65(1): 106 - 18。
- 11.
吴斌,曹雪梅,刘洪,朱超,张博,等。udp -葡萄糖基转移酶PpUGT85A2控制桃挥发性糖基化。acta photonica sinica, 2019; 40(3): 925-36。
- 12.
程军,魏刚,周洪,顾超,廖林,等。阐明桃花色苷糖基化和甲基化的机制。植物杂志。2014;166(2):1044 - 58。
- 13.
fridman A, Weisshaus O, Bar-Peled M, Huhman DV, Sumner LW, Marin FR,等。柑桔果苦味基因的分离及功能特征研究Cm1 2小红帽编码1,2鼠李糖基转移酶,柑橘类苦黄酮生物合成的关键酶。植物j . 2004; 40(1): 88 - 100。
- 14.
刘旭,林超,马旭,谭艳,王静,曾敏。甜橙类黄酮糖基转移酶的功能表征(素类).植物科学学报。2018;9:166。
- 15.
acta optica sinica, 2010, 31 (4): 457 - 462 . acta optica sinica, 2010, 31(4): 457 - 462。柑橘果实苦味/非苦味的分子和酶基础:驯化下形成分支的鼠李糖基转移酶的进化。植物j . 2013; 73(1): 166 - 78。
- 16.
陈建军,袁志,张华,李伟,史敏,彭志,等。cit1,2rhat.和两个小说CitdGlcTs参与柑橘果实发育过程中与风味相关的类黄酮代谢。J Exp Bot. 2019;70(10): 2759-71。
- 17.
范俊,陈超,余强,李志刚,Gmitter FG。瓦伦西亚甜橙中三个萜类糖基转移酶基因的特征分析(素类l .等)。基因组。2010;53(10):816 - 23所示。
- 18.
Li Y, Li P, Wang Y, Dong R, Yu H, Hou B.玉米家族-1 UDP糖基转移酶的全基因组鉴定及系统发育分析(玉米).足底。2014;239(6):1265 - 79。
- 19.
何勇,张旭,张勇,吴磊,姜鹏,等。家族-1 UDP糖基转移酶(UGT)全基因组分析和鉴定UGT小麦抗赤霉病基因(Triticum aestivum.l .)。植物学报。2018;18(1):67。
- 20.
吴斌,高丽,高军,刘辉,曹旭,等。桃UDP糖基转移酶家族的全基因组鉴定、表达模式及功能分析(碧桃l .蟠桃。植物学报。2017;8:389。
- 21.
关键词:UGT73C6, UGT78D1,糖基转移酶,黄酮醇苷生物合成拟南芥.生物化学学报。2003;27(4):43910-8。
- 22.
尹志强,王志强,王志强,等。一般苯丙素和黄酮醇生物合成途径对妥协黄酮醇3- o -糖基化的反馈抑制。中国生物医学工程学报。2012;63(7):2465-78。
- 23.
宋超,洪旭,赵胜,刘建军,黄福成,等。草莓果实中关键风味化合物4-羟基-2,5-二甲基-3(2H)-呋喃酮的糖基化反应植物杂志。2016;171(1):139 - 51。
- 24.
宋超,赵松,洪旭,刘军,刘建军,赵松,刘建军。一种udp -葡萄糖基转移酶在草莓酰间苯三酚糖苷和花青素生物合成中的作用(英文)草莓属xananassa.).工厂J. 2016; 85(6):730-42。
- 25.
Bönisch F, Frotscher J, Stanitzek S, Rühl E, Wüst M, Bitz O, et al.;基于生理苷元文库的活性分析揭示了葡萄家族1 udp -糖基转移酶的糖受体混乱性。植物杂志。2014;166(1):23-39。
- 26.
刘敏,马智,孙伟,黄磊,吴强,唐智,等。苦荞NAC转录因子家族的全基因组分析(Fagopyrum tataricum).BMC基因组学。2019;20(1):113。
- 27.
于建军,胡芳,王志强,柯涛。谷氨酰胺-糖基转移酶超家族的全基因组分析芸苔属植物拉伯和芸苔属植物oleracea揭示了它的演化历史和功能特征。BMC基因组学。2017;18(1):474。
- 28.
Rogozin IB, Lyonsweiler J, Koonin EV。保守基因家族中的内含子滑动。趋势麝猫。2000;16:430-2。
- 29.
内含子丢失和获得的比率:对早期真核生物进化的影响。美国国家科学研究院2005;102:5773-8。
- 30.
张米,南H,王Y,江X,李Z。黄酮化合物在两种Pummelo品种的黄酮和果汁中的比较(植物中国不同栽培地区的不同植物。分子。2014;19(11):17314 - 28。
- 31.
王胜,杨超,杜华,周军,刘旭,程勇,等。柑橘属植物黄酮类化合物的特征及代谢多样性。Sci众议员2017;7(1):10549。
- 32.
基于Barvkar VT、Pardeshi VC、Kale SM、Kadoo NY、Gupta的UDP糖基转移酶1多基因家族系统基因组学分析亚麻属植物usitatissimum具有不同表达模式的基因。BMC基因组学。2012;13:175。
- 33.
张斌,陈克勤,鲍文,等。内部的差异表达液态氧成熟猕猴桃的基因家族。中国农业科学。2006;57(14):3825-36。
- 34.
张博,铁eman DM,焦超,徐勇,陈凯,费志,等。冷藏诱导的番茄风味损失与挥发性合成的改变和DNA甲基化的瞬态变化有关。中国科学(d辑:地球科学)2016;
确认
我们要感谢Ross Ferguson教授(植物与食品研究,新西兰)对手稿的批判性阅读和修改,以及李少佳博士对修改的帮助。
资金
国家重点研发计划项目(no . 2016YFD0400101);国家自然科学基金项目(no . 31672100); 111项目(no . B17039);资助机构为研究项目提供资金支持,但在研究的设计、数据收集和分析以及手稿的撰写方面没有作用。
作者信息
从属关系
贡献
BW和BZ设计了实验。XL和BW进行了大部分实验。BW对数据进行了分析。BW和KX撰写了手稿。作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
吴斌,刘旭东,徐凯。et al。柚子糖基糖基转移酶系列的基因组特征,演化与表达谱分析(植物)水果。BMC植物杂志20.459(2020)。https://doi.org/10.1186/s12870-020-02655-2
收到了:
接受:
发表:
关键字
- UDP-glycosyltransferase
- 表达分析
- 柚子
- 进化
- 糖基化