摘要
背景
尽管我们对硅藻光合作用的认识在过去的几年里取得了巨大的进展,但关于它们的光合装置的许多方面仍然是谜。根据已发表的资料,硅藻类囊体膜的空间组织和生化组成与高等植物明显不同。
结果
本文研究了硅藻的色素蛋白复合物这种pseudonana采用阴离子交换色谱法分离。采用梯度洗脱法得到5个分离良好的色素蛋白组分,并对其进行了详细的表征。通过分离含有岩藻黄质叶绿素蛋白(fucoxanthin叶绿素蛋白,fps)的光系统(photosystem, PS)核心复合物组分,可以区分不同的FCP配合物:与PSI和PSII核心复合物关系更密切的FCP配合物和构成外周天线的FCP配合物。质谱分析表明,PSI和PSII核心配合物的FCP复合物含有多种Lhcf蛋白,包括Lhcf1、Lhcf2、Lhcf4、Lhcf5、Lhcf6、Lhcf8和Lhcf9蛋白,而外周FCP复合物仅由Lhcf8和Lhcf9组成。Lhcr蛋白,即Lhcr1、Lhcr3和Lhcr14,被鉴定为包含PSI核心复合物亚基的组分。Lhcx1、Lhcx2和Lhcx5蛋白与PSII蛋白亚基共洗脱。第一部分含有额外的Lhcx蛋白,Lhcx6_1,并进一步表征了高浓度的光保护叶黄素循环色素。
结论
本研究的结果证实了现有的数据,如在硅藻中观察到由Lhcr蛋白组成的psi特异性天线复合物。它们补充了其他数据,如21kda FCP带的蛋白质组成或FCPa和FCPb复合物的Lhcf组成。它们还提供了有趣的新信息,比如在含有lhcx的PSII组分中存在二二氧杂黄质脱环氧酶,这可能与非光化学猝灭过程有关。最后,主要FCP部分的高负电荷可能对天然硅藻类囊体膜的组织和结构起作用。因此,这些结果对我们理解硅藻天线系统的复杂性质有重要贡献。
背景
由光系统(PS) II和PSI核心复合物及其特定的光捕获复合物(LHC)组成的光合色素蛋白复合物嵌入类囊体膜中。与高等植物相反,类囊体膜系统分化为基粒膜和基质膜[7],硅藻类囊体通常以三层膜的规则堆叠排列[29].尽管近期结果已经提出了硅藻和基质膜存在的PsiI和PSI的异质分布,也存在于硅藻囊体膜中。根据Lepetit等人的模型。[22PSI及其特异的FCP复合物主要位于外周膜区,并富集带负电荷的膜脂磺基喹啉二酰基甘油(SQDG)。内膜区域优先被PSII和PSII特异性FCP复合物占据,这些复合物被富含中性半乳糖单半乳糖二酰基甘油(MGDG)的脂质相包围。PSII和PSI空间分离的进一步证据来源于Bina等人的工作[4]谁证明了羽状硅藻的类囊体膜p . tricornutum当藻类在低光强度的红光下培养时,含有大量专门由PSI及其相关的由Lhcr蛋白组成的天线所占据的区域。Flori等人[10],利用生物化学、结构和生理的结合数据能够表明类囊体膜的三维网络p . tricornutum远比简单地布置三层松散连接的膜复杂。此外,作者还发现了两个光系统分隔的证据。根据Lepetit等人的模型[22它们提出psii位于核心膜中,而Psi富集在外周,基质面向膜中。
硅藻的捕光天线系统是由膜内固有的FCP蛋白组装而成。由于它们在类囊体膜中的分布和它们的特殊功能,这些蛋白被分为三类,即Lhcf、Lhcr和Lhcx蛋白。Lhcf蛋白构成了一个主要的光捕获天线,即所谓的外周FCP复合体[13,15,23,27它为两个光系统提供激发能。Lhcr蛋白优先与PSI结合,形成PSI特异性天线复合物[18,33].Lhcx蛋白被认为在叶绿素(Chl) a荧光的非光化学猝灭(NPQ)过程中起重要作用[2]光合生物中的基本光保护机制[11].在硅藻中,Lhcx蛋白只与lhccf蛋白的亚化学计量比相比较[16]并且显示出在高光或温度胁迫下诱导一些这些基因的表达[36].在中心硅藻中T. Pseudonana;发现至少30种FCP蛋白[1,其中只有6个属于Lhcx家族。这与它们在光保护调节中的作用是一致的,这一功能在pennate硅藻中也可以观察到p . tricornutum[31,32].正如Lhcx蛋白所证明的,硅藻天线系统的lhccf组成取决于培养期间的光强([12,13]T. Pseudonana.[15,16]p . tricornutum和C. Meneghiniana分别)。
本地囊泡膜内的不同FCP蛋白的基本结构是FCP三聚体,其可以在Pennate和以中心的硅藻中找到[13,15,16,24].这个单元被称为FCPa, FCP配合物的亚分馏后的详细分析显示了不同的三聚体亚型,它们的化学计量甚至单个Lhcf组成不同[15,16].在C. Meneghiniana最近进行了四种亚型,并称为FCPA1-4,LHCF1是FCPA1,FCPA3和FCPA4中的主亚基,而LHCF4 / LHCF6富集在FCPA2三聚体中[16].在天然膜中,特定的三聚体似乎也形成了更高的低聚结构[5].这些六聚体或非四聚体构建了外围天线系统,被称为FCPb或FCPo(低聚态FCP)。在中心硅藻中C. Meneghiniana描述了FCPb1和FCPb2两个低聚亚型[16, Lhcf3支配着两个天线复合体。然而,如图所示为pennate硅藻p . tricornutum[24]和中心的C. Meneghiniana[23],这些低聚物结构对溶解条件敏感,即对所用洗涤剂的类型和浓度敏感。Lepetit和同事只能通过将洗涤剂(正十二烷基β- d -麦芽糖甙(β-DM))浓度从2降低到0.5%来保留FCPo结构。有趣的是,在中心硅藻中,这些低聚结构似乎更能抵抗溶解条件。Nagao等[27]能够在三种不同中心的硅藻中检测FCPO结构,而在Pennate中可以观察到FCPO结构p . tricornutum。溶解条件对于保存天然色素-蛋白质复合物结构的重要性最近也被Calvaruso等人证实。6].借助于与洗涤剂α-DM非常温和的处理,纯化各种照相天线的超复合物T. Pseudonana.这是可能的。根据这些结果,发现光保护性lhcx61蛋白与PSII结合,而Lhcr蛋白优先与PSI结合。此外,作者还发现Lhcf8/9是外周FCP天线系统的主要天线蛋白。关于FCP三聚体作为硅藻触角蛋白的基本单位的概念,这一想法最近受到了第一次详细的冷冻电子显微镜和X射线晶体学研究硅藻色素蛋白复合物的挑战。利用低温电子显微镜,Wang等人[35]从中心硅藻中解决了一个psii天线超复合体Chaetoceros股薄肌并报道了PSII附近的FCP蛋白的四聚体组织。Lhcf3和Lhcf4蛋白的x射线晶体学数据表明,FCP蛋白的分子结构和化学计量组织p . tricornutum在1.8 Å显示一个二聚体组织[34].
本研究旨在为中心硅藻类囊体膜的天然色素蛋白复合物的预纯化提供一种快速、可重复的方法T. Pseudonana..该方法采用阴离子交换色谱(AEC)分离FCP配合物,同时允许PSII和PSI核心配合物的预纯化。预纯化的PSII和PSI核配合物可以作为进一步纯化步骤的起始材料。然而,更重要的是,观察到目前的纯化方法保留了FCP配合物与光系统核心配合物之间的一些相互作用。因此,它可以区分与PSI或PSII核心复合物紧密相关的FCP蛋白和仅松散连接并形成周边主要光捕获复合物的FCP蛋白T. Pseudonana..采用高效液相色谱法对分离得到的AEC组分进行了光谱表征,并对其色素进行了测定。最后,利用质谱分析了不同FCP亚群的Lhcf、Lhcr和Lhcx蛋白组成。
结果
AEC法分离色素蛋白复合物
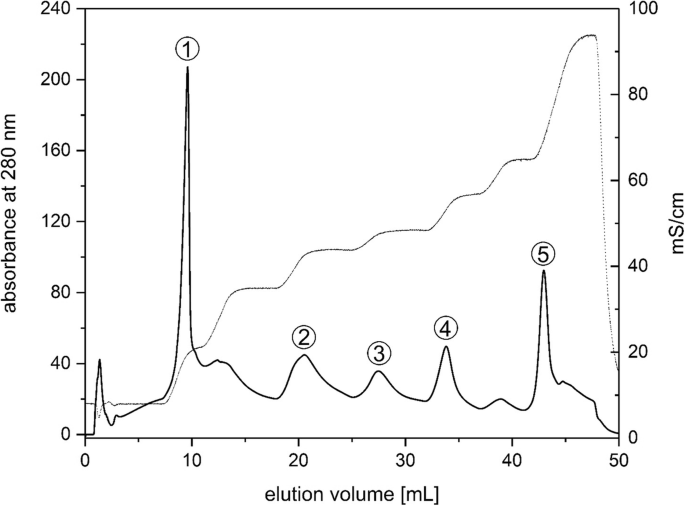
的可溶性T. Pseudonana.类囊体膜被AEC在8个分辨良好的峰中分离(图。1).第一个峰由在初始低盐浓度下洗脱的可溶性物质组成。Gundermann等人也观察到这一假定的游离色素组分[16[本研究未进一步分析。在每次逐步增加盐浓度从30至500mM KCl后,检测到以下五个主要和两种次要峰。增加保留时间表明最可能是各种颜料蛋白的更高的负面电荷。对于以下实验,将对应于五个主要峰的级分合并并将级分1至5级(图。1).所有组分均含有类囊体膜的色素蛋白复合物T. Pseudonana.在不同的纯度状态下用不同的蛋白质和色素浓度。而吸光度在280 组分1和5的nm表示蛋白质和色素浓度高,组分2、3和4可能含有减少的蛋白质和色素量。通过吸收光谱、荧光光谱、色素含量测定和蛋白质组成分析,对组分1-5进行了进一步的表征。保留时间在10到15之间的峰 mL是可变的,取决于培养年龄和生长光照条件的轻微差异,或多或少是显著的。因此,没有通过质谱法进行研究。然而,本研究中采用的其他测量技术提供了证据,表明它代表了PSII核心复杂部分。
分离的色素蛋白复合物的光谱特征
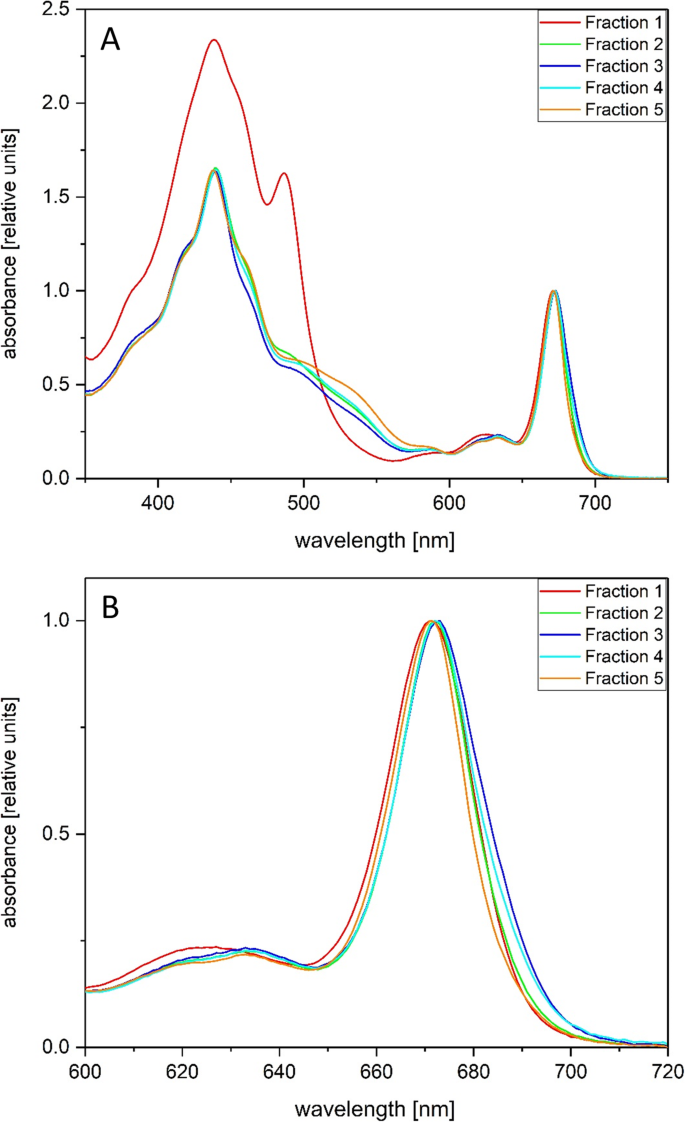
馏分1(图。1)的特征是在吸收光谱的蓝色到蓝绿色区域有较高的吸收(图。2a).在440和490 nm左右观察到明显的吸收极值,在460 nm处伴有一个肩带。在440和460 nm处的峰肩处分别对应Chl a和Chl c的蓝色吸收峰,490 nm处的显著峰肩处与该波长区域的类胡萝卜素强吸收有关。它对应于类胡萝卜素分子的吸收光谱的第三个吸收最大值,在光谱的蓝色到蓝绿色部分通常有三条确定的吸收带。类胡萝卜素吸收谱的第一和第二吸收谱带被Chl a和Chl c吸收谱带所掩盖,不能作为定义的最大吸收带可见。光谱中蓝色至蓝绿色部分的高吸收,在490 nm左右有明显的类胡萝卜素峰,说明组分1富含类胡萝卜素。硅藻中主要的类胡萝卜素类藻藻黄质(fucoxanthin, Fx)具有较宽的、未明确的吸收光谱特征,在490 nm处有明显的最大吸收峰,表明叶黄素循环色素(diadinoxanthin) DD对第一部分的吸收有很强的贡献。第2 ~ 5组分的吸收光谱以Chl a吸收为主,蓝色部分和红色部分。而Chl a(单线态2跃迁)的Soret带位于440 nm左右,Qy在大约670 nm处发现了吸收带(单线态1跃迁)。Chl - c可见于光谱的蓝色部分,位于约460 nm处。此外,与组分1相比,在490 ~ 550 nm波长区域明显检测到蛋白结合Fx的吸收。第5组分中Chl - c肩和Fx吸收明显,说明这些色素中各自的色素蛋白复合物富集。从图中所示的数据可以得出进一步有趣的观察结果。2b更详细地描述了不同AEC组分吸收光谱的红色部分。很明显,Qy叶绿素a的吸收,位于670左右 组分1、2和5的波长在组分3和4向长波方向移动,这表明在组分3和4分离的色素蛋白复合物中存在长波吸收的chla分子。
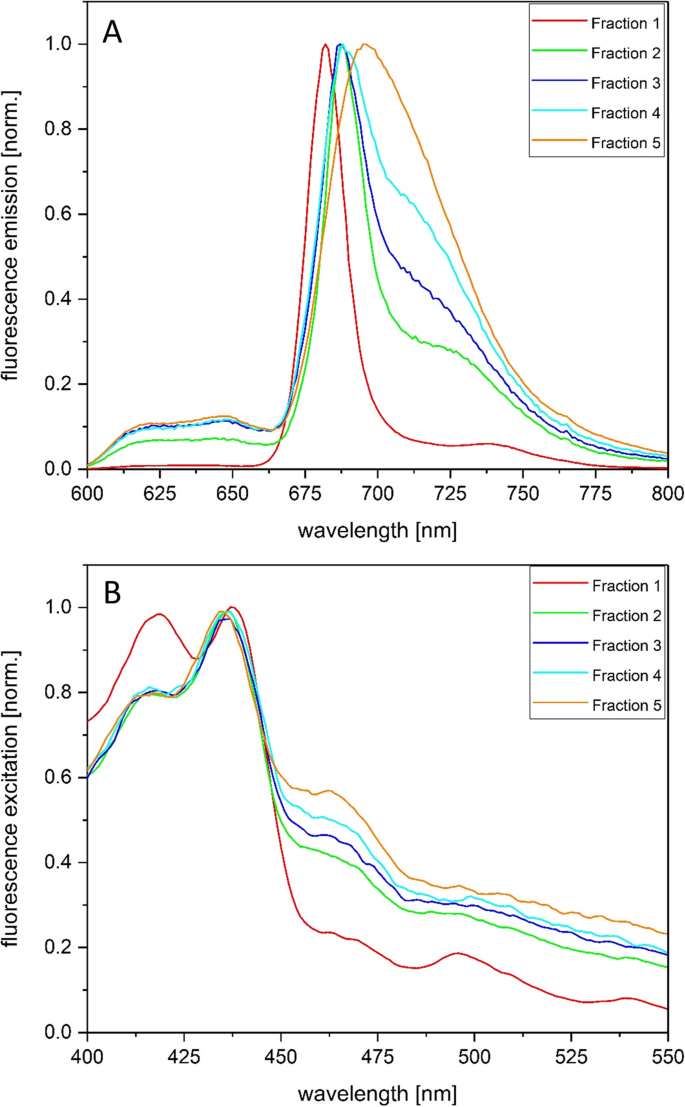
在440 nm的激发下,AEC组分的77 K荧光发射光谱出现了差异,对应的是光谱中蓝色部分Chl a吸收最大(图1)。3.a).组分1在682 nm左右具有均匀的峰形和最短的发射最大值。组分2、3和4的最大发射波长向更长的波长移动,通常在687-688 nm附近。与组分1相比,这些组分在700 nm以上的波长范围内表现出明显的荧光发射贡献。这个观测结果与Q的位移相对应y在这些组分中,Chl a对较长波长的吸收最大(图1)。2b).组分5的荧光发射光谱是可变的,有时以较短的波长贡献为主,有时以较长的波长贡献为主(图5)。3.一个,附加文件8).
不同组分的荧光激发光谱(图。3.B)对各自的吸收光谱显示了有趣的差异。组分1具有明显的类胡萝卜素吸收带,Chl a在蓝光激发下仅在682 nm附近有较强的Chl荧光发射。Chl - c和类胡萝卜素分子在450 nm以上的光激发下只能诱导微弱的Chl - a荧光发射。这证明了类胡萝卜素是存在于大量在第1部分中,主要根据吸收光谱DD,不能有效地激发能转移到背影。激发光谱的峰值在420纳米左右的分数5月1日此外表明脱镁叶绿素的存在在这个分数。2 ~ 5组分Chl a、Chl c和Fx激发后荧光发射。Chl - c激发在460 nm左右达到最大值,而Fx激发在490 ~ 550 nm范围内。组分5中Chl c和Fx激发后的Chl a荧光最明显,与组分5中Chl c和Fx吸收带最明显相对应。
色素蛋白复合物的色素组成
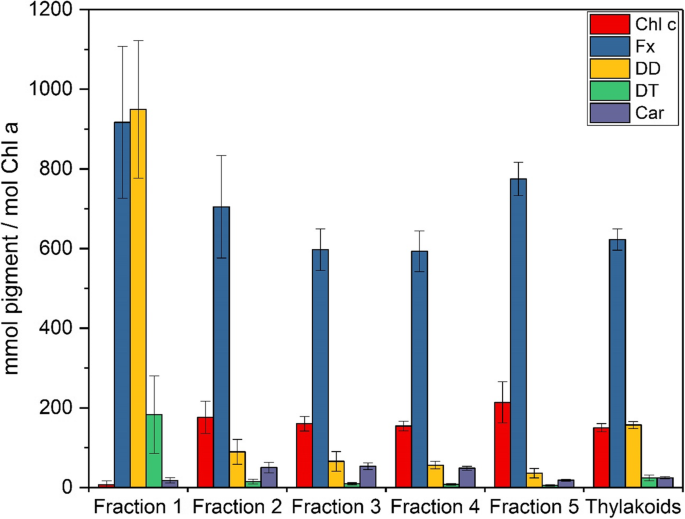
不同AEC级分的颜料分析(图。4和附加文件1)支持从光谱测量结果中的发现。馏分1含有大量的主要光收获Xanthophyl1 FX和Xanthophyll循环颜料DD。特别是高浓度的DD,其略微超过该级分中的FX浓度,是值得注意的。通过在这些样品中存在的显着浓度的分胍原素(DT),还记录了第一部分中的磷酸酯循环颜料的富集。所有级分存在DT,因为T. Pseudonana.在制备类囊体膜之前,在用于藻类培养的光/暗循环的光期收集细胞。另一方面,β-胡萝卜素在组分1中仅观察到低浓度。大量DD的存在支持了分数1 490 nm吸收峰对DD第三个最大吸收峰的注释(图1)。2a).第二种Chl, Chl c的浓度甚至低于β-胡萝卜素。分数2至4显示出类似的色素组成。除Chl a外,Fx为主要色素,Chl c和DD次之,Dt浓度较低。有趣的是,随着分数的增加,Fx浓度略有下降。与组分1相比,β-胡萝卜素在组分2至4中浓度更高。AEC分离馏分5中含有大量的典型硅藻捕光色素Fx和Chl c. DD、Dt和β-胡萝卜素,而β-胡萝卜素仅以低浓度存在。2 ~ 5组分的色素组成与各组分的吸收光谱一致,除Chl a吸收外,Chl c和Fx吸收为主。组分5中Chl c和Fx对总吸收光谱的贡献最大,与该样品中最高的Fx和Chl c浓度相对应。
蛋白质组成分离色素蛋白复合物
的FCP复合体T. Pseudonana.在sds -gel上可见明显的21和18 kDa条带(图。5和附加文件7A和B)。数字5显示代表SDS-gels;所有AEC分离均采用SDS-PAGE蛋白分析。额外的文件7A和B显示两个分离的SDS-凝胶,从而允许通过SDS-PAGE判断AEC分级和蛋白质测定的再现性。在级分1中,18kDA FCP带是弱彩色的带,而在凝胶中无法检测到21kDa带。级分2至4显示较低分子量Fcp带的强度增加,而级分5的特征在于21kDa Fcp带的几乎单一存在。除了FCP条带之外,在不同的级分中可见在较高的表观分子量下的带。对于级分1,染色25至30kDa范围中的带。级分2和3含有30至35kDa区域中的附加条带,其表明存在Psii反应中心蛋白D1和D2的存在和氧不适的复合物(OEC)的33kDa(PsbO)蛋白。在左右45kDa观察到其他条带,其可以代表内天线蛋白CP43和CP47。在级分4和5中,不能检测到30至35kDA范围内的带。在级分2,3和4中的69kDa蛋白标记上方可见的条带可以代表PSI核心蛋白PSAA和PSAB或D1 / D2异二聚体。由于不存在PSII蛋白,这些条带在级分3和4中突出。 Fraction 5 was clearly dominated by bands that correspond to the FCP proteins. PSII proteins could not be detected in this fraction and the intensity of the protein bands corresponding to the PSI core proteins was significantly lower than for Fractions 3 and 4.
用质谱分析2 ~ 5馏分中18和21 kDa谱带中的蛋白质(质谱分析1,表1)1)仅考虑至少两个自信和独特的肽鉴定的蛋白质和蛋白质得分≥1000。所有已识别的天线和光系统蛋白都列于附加文件5.由于馏分1仅显示了弱18kDa带,而21kDa带完全缺失,但是通过质谱分析1未分析。然而,通过质谱分析2测定馏分1的蛋白质组成(见下文)。18 kDa馏分2含有LHCF1,LHCF2,LHCF4,LHCF5,LHCF6,LHCF8和LHCF9,而在相应的级分3和分数4中检测到LHCF1,LHCF2,LHCF5和LHCF6。18 KDA带级分5仅包含LHCF8和LHCF9。21 KDA带,代表级分5的主要FCP蛋白条带,含有LHCF8和LHCF9,对于显示21kDa带的所有其他级分也是如此。在任何21kDa带中未鉴定其他LHC蛋白。
分析扩展到第1 - 4部分的完整蛋白组成,特别强调Lhcr/Lhcx蛋白和PSI和PSII核心复合物的蛋白亚基(质谱分析2,表2和附加文件6).质谱分析2中省略了组分5,因为第一次分析显示该组分仅由Lhcf8和Lhcf9天线蛋白组成。部分1含有PSII的三个蛋白亚基,即内天线蛋白CP43 (psaC),即Cytb559PSII反应中心(psbE)和psbV的亚单位,代表OEC的一个亚单位,而其他部分同时包含PSII和PSI的蛋白质亚单位。第2部分除含有两个反应中心蛋白D1 (psbA)和D2 (psbD),以及psbE和psbV亚基外,还含有CP43 (psbC)和PSII内天线第二蛋白CP47 (psbB)。除这些PSII蛋白外,还检测到PSI的较小的蛋白亚基psaD、psaF和psaL。第3部分鉴定了PSII蛋白psbA、psbC、psbD、psbE和psbV以及PSI蛋白psaD、psaF和psaL。OEC最重要的蛋白亚基,锰稳定蛋白PsbO,在第2和3部分被检测到(见附加文件6),但不符合表中列出的标准2,也许是因为在溶解期间的部分损失。级分4含有三个PSI蛋白亚基PSAD,PSAF和诗歌。与级分2和3相反,PSII蛋白的数量较低,仅在级分4中检测到PSBC和PSBE。
除PSII和PSI核心蛋白外,还鉴定了FCP蛋白。值得注意的是,切割成12片的整个凝胶条带的分析没有区分18和21 kDa条带。然而,上述两个条带的分离分析都得到了证实,并确定了一些进一步的蛋白,即第2部分中的Lhcf7和第3和4部分中的Lhcf4。其中,分数3含有Lhcr3和Lhcr14蛋白,分数4含有Lhcr1和Lhcr3蛋白,分数2含有Lhcr3蛋白。在光保护Lhcx蛋白方面,Lhcx1、Lhcx2和Lhcx5分别在分数1的分数2和分数1的分数6_1中被检测到。值得注意的是,Lhcx蛋白不存在于18 kDa FCP带或21 kDa FCP带中,而是存在于相对分子质量在21 kDa FCP带以上和29 kDa标记蛋白带以下的凝胶片中(图)。5).其他没有确定的蛋白质在附加文件中列出6,例如PSI核心复合体的主要蛋白质亚基,即psaA和psaB,其蛋白质得分略低于1000,在分数2到4中包含了自信地确定的PSI亚基psaD, psaF和psaL(表2).在不代表PSI或PSII色素蛋白复合物的蛋白质中,应该提到二二黄质循环酶二二黄质去环氧化酶(DDE)(附加文件6).DDE存在于组分2中,富集于PSII核心复合物和Lhcx蛋白的亚基。
讨论
分配分离的AEC分数
通过SDS-PAGE和质谱分析,将AEC组分2 ~ 4划分为PSII和PSI。虽然组分1含有PSII的蛋白质亚基,但该组分中蛋白质含量低,而色素浓度高,这使得组分1不太可能包含特定的色素蛋白复合物。组分2中PSII蛋白亚基的优势说明该组分中存在大量的PSII核心复合物。组分3包含PSII和PSI的蛋白质亚基,似乎代表了PSII和PSI核心复合物的混合群体。另一方面,相比于分数2和3,分数4的特点是PSII蛋白数量较少,但仍然包含三个PSI亚基,这在本研究中是常见的。这说明分数4中PSI核心复合物的浓度更高。片段5代表AEC色谱的主峰,其特征是FCP蛋白的强富集,因此很可能代表FCP的外周复合物T. Pseudonana..PSII核配合物在馏分2和馏分4中的富集符合这些馏分的光谱表征。组分2在光谱的红色部分含有吸收波长较短的Chl a分子,这是典型的PSII。另一方面,组分4的特征是存在较长的波长吸收和荧光发射Chl分子的典型的PSI。组分5在光谱的红色部分含有吸收波长较短的Chl a分子,这与该组分中存在FCP配合物是一致的。组分5在长波长区域的高荧光发射很可能是由于像Schaller等人的实验一样,洗脱所需的高盐浓度导致fcp的强聚集。[30.他使用Mg2+离子聚集FCP配合物。在某些情况下,可以观察到分数5的短波长发射。在这种情况下,我们有理由相信分数5中的FCP配合物显示出较弱的聚集。分数5中FCP配合物聚集状态的差异可能是由于类囊体膜溶解条件的微小差异造成的,一般情况下,类囊体膜不能像菠菜类囊体那样具有很高的重现性。组分5显示出每Chl a和每DD的Fx比率很高,这是具有初级集光功能的FCP复合物的典型特征。虽然5号组分所含的FCP配合物最多T. Pseudonana., FCP配合物也存在于分数2 ~ 4中。2 ~ 4组分中β-胡萝卜素含量较高,说明这些组分中富集的是PSI和PSII核心配合物,而不是FCP配合物。本研究中观察到的分离PSII核配合物中存在FCP配合物与Nagao等人的研究一致[26,28].在这些研究中,中心硅藻的类囊体膜C股薄肌用tritonx-100溶解,差速离心分离出含氧的PSII核心复合物[26].这些含有PSII的FCP制剂可以通过阴离子交换色谱进一步纯化[28].就像我们现在的AEC分离Ikeda等人一样。[17,18]从中心硅藻中分离出PSI核配合物和相关FCP配合物C股薄肌和T. Pseudonana.在蔗糖梯度离心和尺寸排除色谱的帮助下[17]或蔗糖梯度离心与AEC结合[18].分离程序导致纯化PSI核心配合物与两个不同的FCP配合物,称为FCPI-1和FCPI-2。FCPI-2似乎与PSI核心复合物紧密相关,而FCPI-1在更严格的洗涤剂处理后丢失。池田等人[18]提出,FCPI-2复合物介导了更外围的FCPI-1和PSI核心之间的激发能量转移。
根据Gundermann等人最近的数据[16他纯化了中心硅藻的FCP复合物C. Meneghiniana将AEC和蔗糖密度梯度离心结合,在本研究中描述的AEC分离过程中,FCPa配合物、PSII和PSI核心配合物的共洗脱是可能的。Gundermann等人提出的AEC洗脱图谱[16]显示了一个显著的峰值在高盐浓度,已分配给FCPb复合体。额外的小峰在较低的盐浓度下从柱中洗脱,并已被描述为所谓的FCPa配合物的不同亚型。虽然高盐浓度下的FCPb峰很可能对应于当前AEC分离的第5部分,但较小的FCPa峰表现出的保留时间与我们的蛋白质分离的PSII和PSI组分(即2到4)的保留时间相当。《反海外腐败法》的可能co-elution复合物和PSII / PSI分数很难判断中的冷冻铸造目前PSII和PSI分数代表天线蛋白紧密相关的光系统核心复合物或如果这些蛋白质亚基的《反海外腐败法》的复合物T. Pseudonana..
色素蛋白复合物的分离T. Pseudonana.将本研究中提出的方法与菠菜的光合色素蛋白分离进行比较(附加文件2A).菠菜色素蛋白的分离导致出现一个主峰和几个小峰。主峰在12-15 mL洗脱,在光谱的蓝色和红色部分显示明显的Chl a和Chl b最大值,可以明确地归为LHCII(附加文件3.). LHCII的保留时间短,说明高等植物主要的集光复合物表现出较低的负净电荷,因此可以用低盐浓度的AEC柱洗脱。的外围FCPT. Pseudonana.分离的硅藻色素蛋白复合物保留时间最长,且仅在高浓度NaCl下洗脱,表明FCP复合物具有较高的负电荷。比较LHCII和外周FCP复合物,可能是与AEC柱的正电荷基质相互作用的蛋白质暴露区域显示出负电荷的差异。也有可能是捕光复合物的寡聚化状态的不同导致了不同的负电荷,从而导致了不同的保留时间。高等植物的LHCII通常被分离为三聚体LHCII。高寡聚态的FCP配合物是典型的中心硅藻C. Meneghiniana或者是目前研究中使用的硅藻,T. Pseudonana..在这些藻类中,FCPb复合物,这代表了AEC纯化FCP复合物的最后一个蛋白质组分[16[因此,与本分离的级分5相当,似乎由FCP壬酯组成,而FCPA复合物显示三聚体结构[3.,13,27].fcp表面负电荷的增加可能与硅藻类囊体膜中负电荷脂质SQDG的高浓度有关[22].FCP和SQDG之间的显着排斥可能导致PSI分离成SQDG富含SQDG的外层膜区和PSII,并且将周边FCP与主要MGDG组成的内膜薄膜。Lepetit等人已经提出了照相的这种分离。[22,最近得到了Bina等人的数据支持[4和Flori等人[10].
介绍了目前AEC分离方法的适用性
本研究提出的AEC方法可以对中心硅藻的PSI、PSII核和FCP配合物进行预纯化T. Pseudonana..还测试了分离特异性为中心的硅藻色素蛋白的分离C. Meneghiniana.这些分析产生了可比较的溶解类囊体膜的分离(见附加文件2b)。使用单独的蛋白质纯化方法,例如诸如尺寸排阻色谱或蔗糖密度梯度离心的单独的蛋白质纯化方法,分离的颜料蛋白质复合物可以作为最终纯化相应的复合物的原料。The partial purification, i.e. the isolation of PSI and PSII core complex fractions which contain FCP complexes, makes it possible to differentiate between FCP complexes which are more closely associated with the PSI and PSII core complexes and FCP complexes which build-up the peripheral antenna complexes, providing that the occurrence of FCPs in the PSI and PSII fractions does not represent a co-elution of FCP-A complexes and PS core complexes.
异质性的铸造
本AEC分离的级分5含有与PSI和PSII核心复合物无关的外周FCP络合物。外周FCP复合物通过21kDa蛋白质带的存在来支配,并且仅在低浓度下检测到18kDa Fcp带。根据质谱法的分析,21kDa带仅由LHCF8和LHCF9蛋白分别组成。有趣的是,LHCF8和LHCF9也发现在18 kDa带中,但基于本研究的分析1的数据,而不是在AEC的所有部分中。在外周FCP中未检测到另外的LHC蛋白。根据Gundermann等人呈现的AEC分离。[16分数5对应于FCPb配合物C. Meneghiniana.Gundermann等人[16]检测到FCPb复合物中最显著的Lhc蛋白是Fcp5/Lhcf3。Lhcf3伴低浓度Lhcf1和Lhcf4/Lhcf6。而后者仅在FCPb2复合物中发现。考虑到这一点T. Pseudonana.对于相同的蛋白质,类似的LHCF 3,LHCF8和LHCF9基因编码,本发明对外周FCP复合物的蛋白质组成的数据的数据与Gundermann等人的数据一致。[16]关于FCPb。除Lhcf蛋白外,Gundermann等[16]观察到从高光培养中纯化的FCPb中存在Lhcx1和Lhcx6_1蛋白。在本研究中未检测到这些蛋白作为外周FCP的成分。Lhcf8蛋白在21 kDa FCP带的出现与Nagao等发表的数据一致[27),他检测到Lhcf8蛋白在21 kDa带的寡聚和三聚FCPT. Pseudonana..Lhcf9蛋白是本研究中检测到的21 kDa带的另一个成分,但Nagao等人没有观察到[27].然而,该蛋白可能与Lhcf8基因产物相同。的低聚FCPT. Pseudonana.,由Nagao等人纯化[27),其特征是21kda FCP带的单一存在。因此,它可与本研究中分离的外周FCP复合体相比较,后者也以21 kDa带为主。本研究的发现也与Calvaruso等人最近的观察结果一致。6的外围FCPb复合体T. Pseudonana.由Lhcf8/Lhcf9蛋白组成。与分数5的21 kDa带一样,其他AEC组分的21 kDa带中只含有Lhcf8和Lhcf9。除Lhcf8和Lhcf9只在2和5的18 kDa条带中发现外,18 kDa条带与21 kDa条带相似。Lhcf1、Lhcf2、Lhcf5和Lhcf6在所有组分中都存在,似乎代表了Lhcf在18kda带中的主要蛋白。在本研究中进行的第一次质谱分析中,Lhcf4仅在分数2的18 kDa带中检测到,而第二次质谱分析表明Lhcf4蛋白存在于分数2到4的18 kDa带中。Lhcf5在18 kDa FCP波段的存在与Nagao等人的数据一致[27的三聚体FCP配合物的18kda区域观察到了两条FCP带T. Pseudonana..根据质谱分析,主要的18kda波段含有Lhcf5,另外还有Lhcf1和Lhcf4。在本研究中,Lhcf1和Lhcf4也在2 ~ 4馏分的18 kDa波段中被检测到。Nagao等人研究的次要18kda谱带[27]的特征是额外存在Lhcf6、Lhcf7和Lhcf11。Lhcf6是目前AEC分离的2 ~ 4组分,而Lhcf7仅在第二次质谱分析中检测到,仅出现在2组分中。然而,在本研究的各个组分中没有观察到Lhcf11。Lhcf11缺失的原因可能是目前SDS-PAGE分离的蛋白中有一小段18 kDa FCP带没有被分离。Lhcf4在第2馏分18 kDA带的存在,似乎富集于PSII中,这与最近分离出的PSII- fcp超配合物相符C股薄肌[35].基于结构数据,我们提出了FCP-E单体代表lhcf4类亚基,它与PSII核配合物联系紧密,并介导了FCP-A四聚体与核的相互作用。有趣的是,FCP-D单体似乎是lhca相关的LHC蛋白,它也参与了外周FCP-A与PSII核心复合物的相互作用。
考虑到在本研究的AEC分离过程中可能会发生PSII和PSI核心配合物以及FCPa配合物的共洗脱,将其与Gundermann等人发表的不同FCPa配合物的蛋白质组成进行比较[16]似乎有价值。在本研究中,LHCF1,LHCF2,LHCF5和LHCF6,似乎代表了AEC级分2至4的主要蛋白质,其对应于不同的FCPA络合物。Gundermann等人[16]发现FCPa的复合物C. Meneghiniana以Lhcf1、Lhcf4/Lhcf6和Lhcf3蛋白为主。质谱分析表明,fca1、fca3和fca4中Lhcf1是Lhcf的主要蛋白,而fca2中Lhcf4/Lhcf6的浓度较高。
Gundermann等检测到的其他FCP蛋白[16]作为FCPa复合物的组分是Lhcx1和lhcx61蛋白。在本研究中发现了四种不同的Lhcx蛋白,即Lhcx1、Lhcx2、Lhcx5和LHCx61。在AEC分离的组分2中观察到了Lhcx1、Lhcx2和Lhcx5蛋白,根据其蛋白质组成,它们代表了富含PSII核心复合物的组分。lhcx61是组分1的一个组成部分,由于其高浓度的DD,Dt和Fx,必须视为一个混合蛋白质和游离色素组分。
组分3和组分4不含Lhcx蛋白,但除Lhcf蛋白外,每个组分中均存在两个Lhcr蛋白。组分3中含有Lhcr3和Lhcr14,组分4中含有Lhcr1和Lhcr3。此外,在分数2中检测到Lhcr3。含有PSI核心复合物蛋白的AEC组分中Lhcr蛋白的存在与文献中描述的Lhcr蛋白为PSI特异性天线蛋白的数据一致[13,18].在本研究中,检测到LHCR1,LHCR3和LHCR14,Grouneva等。[13]在类囊体蛋白质组分析中发现Lhcr1、Lhcr3、Lhcr4、Lhcr7、Lhcr10、Lhcr11和Lhcr14T. Pseudonana..PSI-FCPI配合物的分析T. Pseudonana.蔗糖梯度离心与AEC联合分离[18]表明存在Lhcr1、Lhcr3、Lhcr4、Lhcr10、Lhcr13和Lhcr14作为PSI天线蛋白。
其他重要蛋白质的分配
在PSII核心复合物中富集的目前AEC分离物的第2部分包含另一种有趣的蛋白质,即DD去环氧化酶(DDE)。DDE是催化硅藻叶黄素循环正向反应,DD脱环氧成Dt的酶(叶黄素循环和NPQ的综述见[11])。DT是负责NPQ过程的组件之一。NPQ的另一个重要因素是存在LHCX蛋白,其也发生在AEC梯度的含PSII的级分2中。DT和LHCX蛋白被认为在位于PSII核心复合物附近的淬火部位Q2中发挥作用,并且与淬火部位Q1一起提供PSII的保护,这是由过度激发能量引起的损坏。
结论
本研究的结果为硅藻天线系统的大难题增加了一点。他们证实了现有的数据,比如在硅藻中观察到由Lhcr蛋白组成的psi特异性天线复合体。它们补充了其他数据,如21kda FCP带的蛋白质组成或FCPa和FCPb复合物的Lhcf组成。这里的数据表明中心硅藻FCPa复合物的Lhcf组成T. Pseudonana.和C. Meneghiniana既有相似之处也有不同之处。目前的数据还提供了一些有趣的新信息,如PSII组分中DDE酶的存在,这可能与PSII特异性Lhcx蛋白有关,以及叶黄素循环和Lhcx蛋白在NPQ建立中的作用。此外,高等植物和硅藻主要大型强子对撞机的净电荷存在显著差异,这可能是由于高级强子对撞机结构不同所致。主要FCP部分的高负电荷可能是导致这些FCP复合物被限制在三种典型硅藻类囊体膜层内的主要原因。进一步研究硅藻光合蛋白复合物的天然结构还应关注膜脂的作用,特别是在硅藻类囊体膜中发现的高浓度带负电荷的SQDG的意义。
方法
植物材料
T. Pseudonana.培养(培养收集藻类和原生动物,菌株CCAP 1085/12)在F/2培养基中生长14),硅酸盐浓度加倍,含盐量降低50%。在20°C的温度下进行无菌气升培养。生长光条件为14/10 h的光/暗条件和40 μmol光子m的入射光强−2年代−1.为了制备类囊体和色素蛋白复合物,在对数生长期收集细胞。
类囊体和色素蛋白复合物的分离
类囊体膜的T. Pseudonana.按Lepetit等人的方法分离[24],并在−80℃保存,待进一步使用。根据Jeffrey和Humphrey[2][3]对分离的类囊体膜的叶绿素浓度进行了90%丙酮测定[19].
为制备色素蛋白复合物,将类囊体膜溶解于2 mM KCl、5 mM EDTA和10 mM MES (pH 6.5,室温)的培养基中。将增溶过程中的Chl浓度调整为1 mg mL−1并且洗涤剂N-十二烷基β-D-麦芽糖苷(β-DM)与β-DM / CHL比为20,对应于约40mm的β-DM浓度。溶解在黑暗中在冰上进行20分钟,轻轻搅拌样品。通过在4℃(Allegra 64R,Beckman Coulter,USA)以21.380g离心10分钟除去溶解的未溶解的巯基状片段。然后使用配备有Monoq 5/50 GL柱(Sigma-Aldrich,USA)的NGC色谱系统(BiORAD),通过AEC分离含有溶解的颜料蛋白复合物的上清液。通过梯度从洗脱液A(30mM KCl,0.03%β-DM,20mM HEPES,pH 7.5,RT)到洗脱液B(500mM KCl,0.03%β-DM的梯度,从梯度溶液溶液在黑暗中在10℃下,20mM Hepes,pH 7.5,rt),流速为1mL min−1(见附加文件)4).在280nm处记录吸光度检测蛋白质。在AEC分离过程中,收集体积为1 mL的馏分。AEC运行后,收集含有分离色素蛋白复合物的馏分,用孔径为10 kDa的超滤管(Amicon Ultra-4, Merck Millipore, USA)聚合和浓缩,在4℃下以3000 g离心(Thermo Scientific 400R, USA)。
吸收和77k荧光光谱
不同AEC组分的吸收光谱记录在Specord M250光度计(Zeiss,德国),波长范围为350 - 750 nm,带通设置为1 nm。采用Fluoromax 4P荧光仪(Horiba Jobin Yvon,法国)对AEC馏分进行了77 K荧光光谱分析。调整各组分的吸光度为0.1,在光谱的红色部分达到最大值,然后用甘油进一步稀释,最终得到60%的甘油浓度。在600 ~ 800 nm波长范围内记录荧光发射光谱,激发波长为440 nm。发射光和激发光的带宽分别调整为2 nm和5 nm。荧光激发光谱的波长范围为400 ~ 550 nm,发射波长为不同AEC组分各自的荧光发射最大值。激发光谱中,发射光和激发光的带宽分别为5 nm和2 nm。这个装置是按照制造商的说明校准的。激发光谱根据光源的光谱自动校正。
色素提取及高效液相色谱法测定
采用添加色素提取介质(CHCl)提取总色素3.:甲醇:NH3.(以1:2:0.004,v/v的比例)与等体积的不同AEC馏分。在涡旋和16.000 g 2.5 min (Sigma 1-14 K, Sigma,德国)的短时间离心后,可以观察到水相和有机相之间的清晰分离。收集含有颜料的较低有机相,在温和的氮气流下干燥,在−20°C下保存,直到采用高效液相色谱法进行颜料分析。
将不同AEC组分的色素提取液分别溶于90%甲醇/0.2 M乙酸铵(9:1,v/v)和10%乙酸乙酯的培养基中。然后在Waters 600-MS色谱系统上分析这些色素,该色谱系统使用Waters 996光电二极管阵列检测器(Waters,美国),配备有Nucleosil ET 250/8/4, 300-5, C-18柱(Macherey & Nagel,德国)。用于分离的洗脱液和梯度程序源自Kraay等人首次描述的方法[20.].分离后,根据LOHR和WILHELM量化颜料[25].
SDS-PAGE蛋白分析
根据Laemmli的SDS-Page分析AEC分数[21使用Mini-PROTEAN Tetra Cell系统(BioRad, USA)。分别以丙烯酰胺浓度为4和15%制备堆垛和分离凝胶。样品被加载在Chl含量为0.5 μg的凝胶上。根据Dyballa和Metzger的研究,用考马斯亮蓝胶体G-250溶液对蛋白质进行染色[8].
蛋白质质谱分析
对两种蛋白凝胶进行质谱分析。在第一次分析中,使用ExQuest™点切割器(Bio-Rad Laboratories, Hercules, California, USA)将代表fcp的AEC组分的18和21条kDa条带切除,并转移到不同的0.5 ml反应管(Eppendorf Vertrieb Deutschland GmbH, Hamburg, Germany)。在第二次分析中,人工将AEC馏分的整个凝胶通道切成12个同等大小的凝胶块,并转移到不同的0.5 ml反应管中。用ExQuest™斑点切割器切割的凝胶片在50 mmol/L碳酸氢铵中清洗3次(5分钟,100 μL 30% (v/v)乙腈),然后用乙腈脱水(5分钟,100 μL)。同样的方案应用于手工切割的凝胶片,但应用的体积增加了一倍。凝胶片分别用2 μL胰蛋白酶溶液(Serva电泳有限公司,海德堡,德国,50 ng/μL在3mmol /L碳酸氢铵水溶液中)和18 μL(手工切割用38 μL) 3mmol /L碳酸氢铵水溶液再水合,并在37℃孵育。4 h后将每个样品的上清转移到一个新的0.5 ml反应管中。剩余凝胶片用含0.1%甲酸和乙腈的60% (v/v)水乙腈清洗(每管20 μL,手工切片每管40 μL, 5分钟,RT)。上清液转移到包含第一个上清液的反应管中,并在5301真空浓缩器(德国汉堡Eppendorf Vertrieb Deutschland GmbH, Germany)中在60℃干燥1小时。
NanoRP-UPLC-ESI-QTOF-MS/MS按照描述执行[9].数据分析采用Protein Lynx Global server (PLGS, version 3.0.3)。使用了以下处理和工作流参数。Apex3D依赖于LE数据的120个计数和HE数据的30个计数。数据库Uniprot”这种pseudonana(54.905序列,2018年11月14日下载),两个缺失的切割位点,胰蛋白酶_p作为“消化试剂”和蛋氨酸氧化作为可变修饰。
数据和材料的可用性
本研究中使用和/或分析的数据集可在合理要求下从通讯作者处获得。
缩写
- AEC公司:
-
阴离子交换色谱
- 车:
-
β-胡萝卜素
- 排名:
-
叶绿素
- 弟弟:
-
Diadinoxanthin
- DDE:
-
Diadinoxanthin de-epoxidase
- βdm:
-
N-十二烷基β-D-麦芽糖苷
- Dt:
-
Diatoxanthin
- FCP:
-
墨角藻黄素叶绿素蛋白质
- FCPO:
-
低聚态FCP
- 外汇:
-
墨角藻黄素
- 大型强子对撞机:
-
光收获复杂
- PSMGDG:
-
Monogalactosyldiacylglycerol
- 小姐:
-
质谱分析
- 净产品质量:
-
非光化学猝灭
- OEC:
-
氧气不断发展的复杂
- PSII:
-
光系统II
- PSI:
-
光系统I
- SQDG:
-
Sulfoquinovosyldiacylglycerol
参考
- 1.
Armbrust EV, Berges JA, Bowler C, Green BR, Martinez D, Putnam NH等。硅藻的基因组这种pseudonana:生态,进化和新陈代谢。科学。2004; 306:79-86。
- 2.
等。光捕获复合应激相关蛋白家族的一个非典型成员调节硅藻对光的反应。美国国家科学院学报2010;107:18214-9。
- 3.
关键词:硅藻,岩藻黄质,叶绿素,亚基组成,色素沉着,二氧杂黄质生物化学。2006;45:13046-53。
- 4.
Bína D, Herbstová M, Gardian Z, Vácha F, Litvín R.光系统I在红光增强光照下的横向分离。科学报告。2016;6:25583。
- 5.
Büchel C.藻黄质-叶绿素蛋白在硅藻:18和19 kDa亚基组装成不同的寡聚态。生物化学。2003;42:13027-34。
- 6.
Calvaruso C, Rokka A, Aro EM, Büchel C.特定的Lhc蛋白与硅藻中的PSI或PSII超复合体结合这种pseudonana. 植物生理学。2020;183:67–79.
- 7.
Dekker JP, Boekema EJ。绿色植物类囊体膜蛋白的超分子组织。生物化学学报,2005;
- 8.
快速和灵敏的Coomassie G-250胶体染色在聚丙烯酰胺凝胶中的蛋白质。J Vis Exp. 2009; 30:1431-4。
- 9.
基于血清型特异性血凝蛋白sigma-1检测小鼠中哺乳动物正呼肠病毒3型(Reo-3)感染。性研究j . 2018; 15:1-11。
- 10.
Flori S, Jouneau P-H, Bailleul B, Gallet B, Estrozi LF, Moriscot C等。质体类囊体结构优化了硅藻的光合作用。Nat Commun。2017;8:15885。
- 11.
关键词:生物多样性;生物多样性;植物生理学杂志。2015;
- 12.
关键词:硅藻,类囊体蛋白,相对丰度,波动光这种pseudonana.J Prot res 2016; 15:1649-58。
- 13.
Grouneva I,Rokka A,Aro Em。两种海洋硅藻的类囊体膜蛋白质组概述了光合作机的硅藻和特异性特征。J Prot Res。2011; 10:5338-53。
- 14.
吉拉德RR。海洋无脊椎动物的浮游植物养殖。在:史密斯WL,香奈儿MH,编辑。海洋无脊椎动物的养殖。纽约:全会;1975年。29–60.
- 15.
关键词:pennate硅藻,光收获蛋白,亚群体,生物信息学Phaeodactylum Tricornutum..Biochim Biophys Acta。2013; 1827:303-10。
- 16.
关键词:中心硅藻,藻黄质,叶绿素,蛋白质复合物Cyclotella meneghinianaLhcx1和Lhcx6_1含量不同。植物杂志。2019。https://doi.org/10.1104/pp.18.01363.
- 17.
Ikeda Y, Komura M, Watanabe M, Minami C, Kioke H, Itoh S,等。与海洋中心硅藻岩藻黄质叶绿素结合蛋白相关的光系统I复合体,Chaetoceros股薄肌.生物化学学报,2008;
- 18.
ikeda y,yamagishi a,komura m,suzuki t,dohmae n,shibata y等。两种类型的岩藻素 - 叶绿素结合蛋白质,我紧紧地与照相融合在海洋中心硅藻中的核心复合物。Biochim Biophys Acta。2013; 1827:529-39。
- 19.
杰弗里·SW,汉弗莱女友。测定高等植物、藻类和自然浮游植物叶绿素a、b、c1、c2的分光光度方程。生物化学与生物物理。1975;167:191 - 194。
- 20.
Kraay GW, Zapata M, Veldhuis MJW。反相- c18高效液相色谱分离海洋浮游植物叶绿素c1、c2和c3J Phycol。1992;28:708-12。
- 21.
Laemmli英国。T4噬菌体头部组装过程中结构蛋白的裂解。大自然。1970;227:680-5。
- 22.
Lepetit B,Goss R,Jakob T,WILHELM C.不同光条件下硅藻囊膜的分子动力学。Photosynth Res。2012; 111:245-57。
- 23.
Lepetit B, Volke D, Gilbert M, Wilhelm C, Goss R.硅藻中存在一种与天线相关的脂溶性和两种蛋白质结合的二苯胺黄素循环色素。植物杂志。2010;154:1905-20。
- 24.
Lepetit B, Volke D, Szabo M, Hoffmann R, Garab GZ, Wilhelm C,等。硅藻寡聚体天线的光谱和分子表征Phaeodactylum Tricornutum..生物化学。2007;46:9813-22。
- 25.
硅藻中叶黄素的合成:推测中间体的定量和色素转换动力学与模型推导的速率常数的比较。足底。2001;212:382 - 91。
- 26.
长尾,石井,田田,铃木等。海洋硅藻中含氧类囊体膜和光系统II粒子的分离与表征Chaetoceros股薄肌.生物化学学报,2007;
- 27.
Nagao R, Takahashi S, Suzuki T, Dohmae N, Nakazato K, Tomo T.比较不同硅藻种类岩藻黄质叶绿素a/c结合蛋白复合物的寡聚态和多肽组成。Photosynth杂志2013;117:281-8。
- 28.
Nagao R,Tomo T,Noguchi E,Nakajima S,Suzuki T,Okumura A等。纯化和表征船舶中以海洋为中心的稳定氧化光系统II复合物,Chaetoceros股薄肌.生物物理学报,2010;
- 29.
硅藻光系统I和岩藻黄质叶绿素-a/c集光复合物的免疫细胞化学定位Phaeodactylum Tricornutum..原生质。1992年; 166:208-17。
- 30.
关键词:pH值,Mg值,pH值2+与维管植物的LHCII相比,硅藻FCP的聚集状态和脂质组成的变化。Photosynth杂志2014;119:305-17。
- 31.
Taddei L, Chukhutsina VU, Lepetit B, Stella GR, basi R, van Amerongen H等。两个lhcx相关能量猝灭位点之间的动态变化控制着硅藻的光适应。植物杂志。2018。https://doi.org/10.1104/pp.18.00448.
- 32.
Taddei L, Stella GR, Rogato A, Bailleul B, Fortunato AE, Annunziata R等。海洋硅藻LHCX蛋白家族表达的多信号控制Phaeodactylum Tricornutum..J Exp Bot。2016; 67:3939-51。
- 33.
韦思T、布劳恩斯J、韦谢特W、米塔格M、比切尔C。硅藻光系统Ⅰ捕光复合物中一种特异性岩藻红素叶绿素蛋白的鉴定Cyclotella meneghiniana.Biochim Biophys Acta。2009; 1787:905-12。
- 34.
王W,YU LJ,XU C,Tomizaki T,Zhao S,Umena Y,Chen X,Qin X,Xin Y,Suga M,Han G,Kuang T,Shen Jr。硅藻中蓝绿光收割和能量耗散的结构基础。科学。2019; 363:eaav0365。
- 35.
关键词:硅藻,光系统ii,集光天线,结构特征2020年2月j。https://doi.org/10.1111/febs.15183.
- 36.
朱胜辉,绿色BR。硅藻中的光保护这种pseudonana: li818样蛋白在应对高光胁迫中的作用。生物化学学报,2010;
确认
我们承认莱比锡大学的支持开放访问发布。
资金
由Projekt DEAL支持和组织的开放获取资金。
作者信息
从属关系
贡献
mk -计划和执行实验,分析数据,写和修正稿件,dv -计划和执行实验,分析数据,写和修正稿件,ls -计划和执行实验,分析数据,cw -分析数据,修正稿件,rh -分析数据,修正稿件,rg计划实验,分析数据,撰写并修改手稿。所有作者已经阅读并批准了本手稿的最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1。
不同AEC组分的颜料组成(以颜料M表示−1Chl a).描述三种独立制剂的平均值和各自的标准偏差。A: AEC各馏分Chl c含量,B: AEC各馏分岩藻黄质含量,c:各馏分二氧基黄质含量,D:各馏分二氧基黄质含量,E:各馏分β-胡萝卜素含量。
额外的文件2
黄芪色素蛋白复合物洗脱谱的比较T. Pseudonana.和菠菜(A)和T. Pseudonana.和学习的中心硅藻c . meneghinina(B)通过阴离子交换色谱(AEC)分离。在分离前,将分离的菠菜类囊体或两种硅藻的类囊体以β-DM / Chl 20的比例溶解。星号表示吸收光谱显示在附加文件中的菠菜的比例3..
额外的文件3。
菠菜分离的色素蛋白复合物主要组分的吸收光谱(在附加文件中以星号标记)2).吸收光谱归一化为Qy在测量中,调整分离的色素蛋白复合物的Chl浓度,使其在光谱的蓝色部分的吸收不超过吸收值1。
额外的文件5。
对不同AEC组分的18和21 kDa FCP谱带进行了质谱分析。对比表1在结果部分,只描述了用至少两个多肽确定的FCP蛋白,并且蛋白质覆盖率超过1000,附加文件5列出了所有在质谱分析中检测到的FCP蛋白。此外,该文件提供了最重要的PLGS蛋白和肽数据的所有检测蛋白。
额外的文件6。
通过质谱分析不同AEC组分的FCP和PSII和PSI核心复合物的蛋白质亚单位的蛋白质组成的详细信息。与桌子形成对比2在结果部分中,其仅描绘与至少两种多肽和蛋白质覆盖率大于1000的蛋白质覆盖率确定的FCP,PSI和PSII蛋白,附加文件6列出了在MS中检测到的所有FCP,PSI和PSII蛋白分析。此外,该表提供了所有检测到的蛋白质最重要的PLG蛋白和肽数据。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Kansy, M., Volke, D., Sturm, L.。et al。硅藻颜料蛋白复合物的预纯化提供了对FCP络合物的异质性的洞察力。BMC植物杂志20.456(2020)。https://doi.org/10.1186/s12870-020-02668-x
收到了:
接受:
发表:
关键字
- 阴离子交换色谱
- 墨角藻黄素叶绿素蛋白质
- LHCX.
- 质谱分析
- 光系统I
- 光系统II