摘要
背景
作物质量和产量受非生物和生物应激的影响,以及热休克转录因子(hsf)被认为在调节植物对各种胁迫的耐受性方面起着重要作用。调查的反应Cucurbita Moschata.对于非生物胁迫,我们分析了水稻的基因组c . moschata.
结果
在这项研究中,共36岁c . moschata Hsf(CmHsf),根据氨基酸序列同源性将其划分为3个亚科(I、II、III)。这hsf同样的亚家族通常表现出类似的基因结构(内部外显子分布)和保守结构域(DNA结合和其他功能域)。染色体定位分析表明36CmHsfs在21个染色体中的18个(CM_CHR00,CM_CHR08和CM_CHR20)中不均匀分布,其中18个基因形成了9个重复的基因对,该对具有经历的节段性重复事件。Ka / ks比率显示重复CmHsfs主要经历了较强的净化选择。观察到高水平同步性c . moschata和别的葫芦科物种.
结论
表达剖面CmHsfs在根、茎、子叶和真叶上显示出CmHsfs表现出组织特异性。分析CIS.-作用元件和定量实时聚合酶链反应(qRT-PCR)揭示了一些关键CmHsfs冷应激、热应激、激素和水杨酸激活。本研究为揭示其作用奠定了基础CmHsfs在抗各种应力方面,对耐应力性的选择具有重要意义c . moschata.
背景
植物在生长和发展阶段期间持续经历各种不良环境压力,因此,它们已经开发了应对不利条件的特殊机制[1那2].转录因子通常在压力响应的调节中发挥着重要作用[3.].热休克转录因子(hsf)是最重要的转录调控因子[4.].它们是信号转导链的末端组成部分,可介导响应各种非生物压力(干旱胁迫、热胁迫和大量化学胁迫因子)的基因激活[4.].
首先Hsf基因被酵母克隆[5.那6.],后跟一些哺乳动物[7.那8.那9.那10].第一个工厂Hsf基因从番茄中克隆[11].与排序的奥雅萨苜蓿和拟南芥基因组,Hsf也已经确定了基因o.苜蓿和A. Thaliana.[12那13].随后,研究人员确定了31、25、21、26、35、29、27、19和35Hsf基因在杨树trichocarpa[14],Zea Mays.[15],Cucumis漂白亚麻纤维卷[16],大豆[17],芸苔属植物拉伯ssp。学报[18],Pyrus bretschneideri[19],Solanum Tuberosum.[20.],vitis Vinifera[21),芸苔属植物oleracea[22]基因组分别。
典型的HSF通常含有四个保守结构域:N-末端的DNA结合结构域(DBD),疏水性低聚结构域(HR-A / B或OD),核定位信号(NLS)和核导出信号(nes)[23].DBD是HSF中最保守的结构域结构,主要负责与靶基因启动子的热冲击元件(HSE)结合,而HR-A / B结构域是疏水性七孔,形成螺旋线圈结构是转录的先决条件[23].NLS富含Arg (R)和Lys (K)残基,NES富含Leu (L)残基,NLS被相应的NES识别,与核孔蛋白相互作用,帮助含有核定位信号的蛋白通过核孔到达细胞核[24那25那26].DBD与HR-A/B域之间有一条灵活的链路。根据保守DBD和HR-A/B结构域的结构特点,对其进行了分析hsf被分为三组(A、B和C)。三组之间的主要区别如下:B组蛋白表现出7个氨基酸残基在他们HR-A / B域,而A组有28个氨基酸残基在相关领域和C组有14个氨基酸残基在同一领域。此外,c末端的转录激活域(AHA)是A组的特征,这保证了该基因的正常转录hsf通过结合一些基本转录蛋白质复合物。然而hsf由于缺乏AHA基序,B组和C组的激活活性无法维持[26那27].抑制域(RD)是c端含有保守氨基酸(LFGV)的多肽,主要存在于B族[28].
HSFS可以专门调节热休克蛋白的转录(Hsp)的基因,特异性地结合到一个启动子的HSEHsp基因,和Hsp反过来,保护细胞免受应力并参与蛋白质折叠[29那30.].一些研究证实了这一点hsf参与热应激反应。例如,沉默的HsfA1a在番茄中减少了热应激诱导的伴侣酮和HSFA1A蛋白的合成,从而提高了敏感性HsfA1a-对高温胁迫的沉默番茄植株[31.].在37°C,答:芥HsfA2- 比野生型植物更敏感,植物比野生型植物更敏感,这可以通过引入来逆转HsfA2基因[32.].这OsHsfA4d -突变体在高温胁迫下表现出坏死损伤的表型[13].表达OsHsfA2e提高耐高温和耐盐性A. Thaliana.[33.].除了热应激,hsf参与植物生长和其他生物和非生物的胁迫反应。人们发现HsfA9参与胚胎发育和种子成熟A. Thaliana.和Helianthus Annuus.[34.].四个Hsf基因(HsfA1e那HsfA3那HSFA4A那HSFB2A.和HsfC1) 在A. Thaliana.被盐,冷和渗透胁迫强烈诱导[35.那36.那37.].这HsfA2在A. Thaliana.与氧化应激反应有关[38.].这HSFA4A在A. Thaliana.可以用作H2O.2传感器(35.那39.].这oshsfa4a.在o.苜蓿与镉耐受相关[40].迄今为止,没有关于克隆和功能分析的报道Cucurbita Moschata HSFS..
c . moschata富含各种氨基酸,维生素,多糖,果胶和矿物质,含有三合植物,类胡萝卜素和其他生物活性物质和营养素[41.].根据联合国的粮食和农业组织(http://www.fao.org/home/en/),南瓜在世界不同蔬菜作物的产值中排名第九,年销售价值为40亿美元。中国和印度是世界上两个主要的南瓜生产国。中国的培养地区在世界上排名第二,其总产量在世界上排名第一[42.].在增长和发展期间,不利的压力往往对南瓜的生长造成巨大危害,导致南瓜产量和质量下降[41.].因此,南瓜抗性相关基因的研究对南瓜育种和生产具有越来越重要的意义。因为c . moschata(rifu.)基因组已发表[43.],慧聪家庭c . moschata现在可以进行系统和全面的分析。本研究对36株植物的基因结构特征、基因复制、染色体位置、进化分化和系统发育关系进行了研究c . moschata Hsf基因。此外,我们分析了36的数字表达概况CmHsfs响应许多应力。这项研究强调了这个功能hsf在各种压力条件下,提高了我们对多重化事件对慧聪家族演变的影响的理解。
结果
鉴定Hsf基因在c . moschata及其物理和化学特征
共36岁CmHsf在剔除假阳性后与相同的基因进行鉴定(表1),他们被指定了CMHSF1至CMHSF36.根据这些基因在染色体上的起始位置(从Cmo_Chr00到Cmo_Chr20,从上到下)。每个的物理化学参数CmHsf生成,并且预测的开放阅读帧(ORF)范围为543 BP(CMHSF32.)至4380 bp (CMHSF13),预测蛋白质为179-1458个氨基酸。这些基因的物理和化学参数与在A. Thaliana.和o.苜蓿[44.].此外,还计算了它们的分子量(MW)CmHsfs从20.5642到161.5554 KDA(kDa)(表1).虽然推导出的热激转录因子在上述参数方面呈现多样性,但大部分的热激转录因子CmHsfs显示低等电点(π)(平均6.3)(表1).亚细胞定位预测显示,只有2个热休克转录因子(CmHsf12和CmHsf17)预测定位于细胞膜、细胞质和细胞核,其余的CmHsfs预测定位于细胞核。
36 cmhsfs的分类和保守域分析
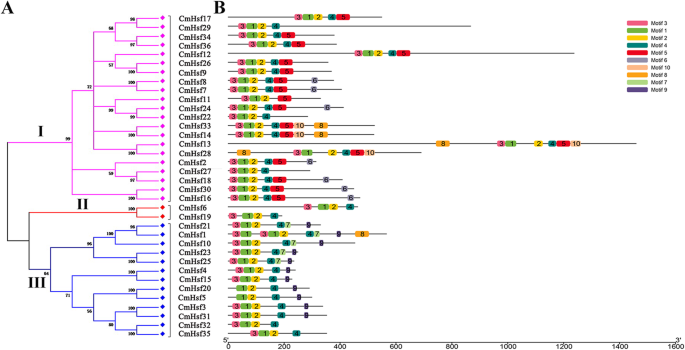
为了鉴定36种CmHsfs的系统发育关系,建立了一棵无根系统发育树。这些CmHsfs可分为3个亚家族(亚家族I、亚家族II和亚家族III;无花果。1a)根据氨基酸序列同一性。子家族I(包含21名成员)是最大的集团,亚家族III包括13名成员,而亚家族II呈现出最少的成员(2个成员)(图。1a).此外,根据保守DBDs和HR-A/B域的结构特征,我们可以将36个CmHsfs分为三组(A,B和C)(表2).所有CmHsfs包含一个DBD和一个HR-A/B域(表2), DBD由大约100个保守氨基酸组成(附加文件2:图。S1)。此外,除CMHSF27和CMHSF32外,所有CMHSF都包含NLS。A组中的CMHSF包含AHA域,而B组和C组中的CMHSF不含AHA域,并且只有B组中的蛋白质包含RD(表2).为了进一步揭示保守结构域,将所有CmHsfs提交给MEME,鉴定出10个不同的基序(图5)。1B;附加文件2:图。S2)。总的来说,CMHSF在所有CMHSF蛋白中显示出4-9个图案,并且术语1,2和4存在。除CMHSF20和CMHSF5外,所有蛋白质中存在图案3。另外,我们发现图案仅存在于亚家族I中,而MOTIF 9仅在亚家族III中出现(图。1b)。来自同一思工的CMHSF通常存在保守的结构域或类似的基序组合物,表明这些蛋白质中的功能性相似性。
外显子内含子分析36hsf在c . moschata
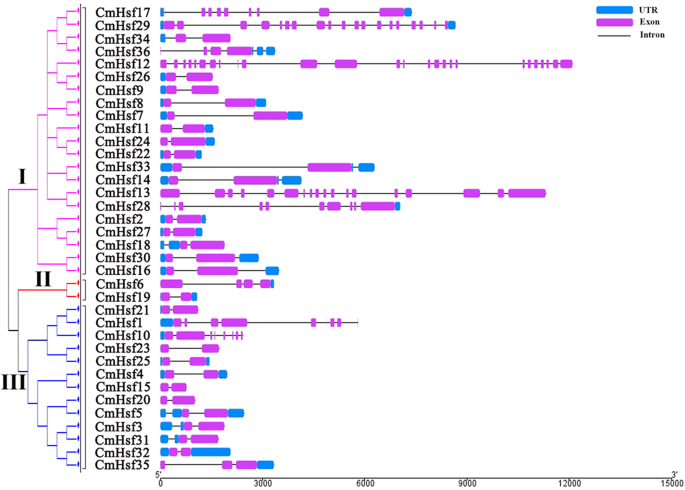
一个外显子-内含子组织图36CmHsf g也产生了eNES(图。2).在36个基因中发现了不同数量的外显子(从2个到26个)CmHsf基因,这表明CmHsfs是相当多样的。在Subfamily III中,除了CMHSF1那CmHsf10和CmHsf35,分别包含9、8和3个外显子CmHsf所有基因都包含2个外显子。CmHsf同一分支上的基因通常表现出相似的内含子-外显子分布CMHSF26._CMHSF9..同一家族中的一些基因表现出显着不同的内外内外分布。例如,CMHSF12.包含26个不同的外显子CmHsfs,表明这一点CMHSF12.可能有一个特殊功能。
染色体分布和基因重复Hsf基因在c . moschata
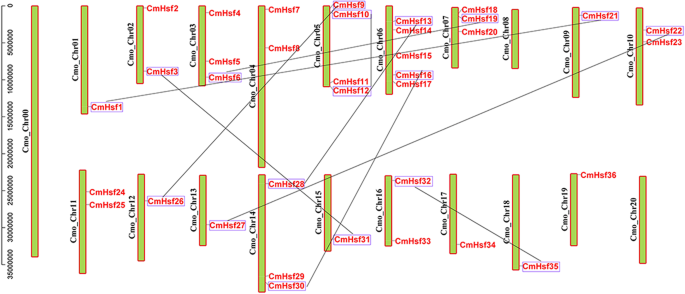
染色体在基因组中的分布分析表明,36CmHsf基因在21条染色体中的19个中不均匀地分布(图。3.).Cm_Chr06染色体显示最多CmHsf基因,具有5个基因,然后是染色体CM_CHR05,具有4个基因。在每种染色体CM_CHR03,CM_CHR07和CM_CHR14中存在总共3个基因,并存在于每种染色体CM_CHR02,CM_CHR04,CM_CHR10,CM_CHR11和CM_CHR16上存在2个基因,同时在染色体CM_CHR00,CM_CHR08和CM_CHR20上分配任何基因。
这两个基因被定义为最近重复的基因对,它们的氨基酸身份是> 85%,基因比对覆盖率是> 0.75 [45.那46.].将总共18个重复基因鉴定并分为九个基团,其中每个组含有两个重复的基因。八个重复的基因对分布在不同的染色体上(图。3.),这表明分段重复事件涉及扩展CmHsf基因。CMHSF10和CMHSF12.结果表明,所有重复的基因对都发生了片段重复事件。这卡和Ks比率小于1.0,这表明对主要在具有负面或净化选择的功能约束下进化(表3.).我们还计算了复制的进化次数和发散次数c . moschata Hsf从1017万年前到6574万年前(玛雅),平均21.11个玛雅(表3.).
HSFS的系统发育关系c . moschata那c .漂白亚麻纤维卷和A. Thaliana.
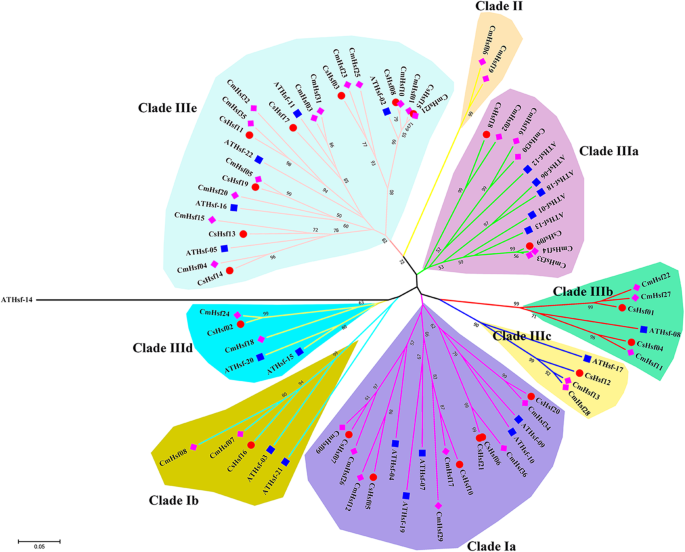
为了更好地评估植物HSF的分子演化和系统发育关系,79 HSF蛋白的系统发育树c . moschata那c .漂白亚麻纤维卷和A. Thaliana.建立了。根据以前的分类c . moschataHsf蛋白质(图。1a),它们分为9个碎片(疏水层Ia-B,Clade II和Clade IIIA-E)(图。4.).亚科I分为枝Ia和枝Ib,亚科III分为枝IIIa-e。这种分类与AtHsf蛋白的系统发育分类一致[44.].总的来说,来自I亚家族(Clade Ia和Clade Ib)的基因(包括51个Hsfs)构成了最大的分支,占总Hsfs的65%。亚家族II包含2个蛋白。剩下的Hsfs属于III亚家族,共包含26个Hsf蛋白。从系统发育分支的角度来看,Hsfs之间的同源性c . moschata和c .漂白亚麻纤维卷高于之间c . moschata和A. Thaliana.,这与三种物种的进化规则一致。
同步分析Hsf基因在c . moschata
根据共时性分析hsf在c . moschata和5种其他物种(A. Thaliana.;Lagenaria siceraria;Cucumis sativus;Cucurbita Maxima;Citrullus lanatus.),我们发现C. lanatus.展出了最多Hsf同源基因(56)次之l . siceraria(52),c .最大值(51)和c .巨大成功(51)。A. Thaliana.呈现最少(18)个同源基因(图。5.).此外,同期基因CmHsfs可以在所有染色体上找到A. Thaliana.那l . siceraria那c .巨大成功那c .最大值,C. lanatus.,表明CmHsfs在进化过程中一直与这五种动物密切相关。此外,我们还发现CmHsf染色体上的基因CM_CHR02,CM_CHR06,CM_CHR08和CM_CHR016对应于两个或更多个Hsf基因在A. Thaliana..这一现象在共线图中体现得更为充分c . moschata和l . siceraria那c .巨大成功那c .最大值和C. lanatus..一般来说,共线关系c . moschata和l . siceraria那c .巨大成功那c .最大值或C. lanatus.)更接近A. Thaliana.暗示这些物种可能来自同一个祖先。共线分析表明c . moschata和l . siceraria那c .巨大成功那c .最大值,C. lanatus.频繁的共线性(图。5.),表明具有共线关系的基因可能具有相似的功能。
表达式模式Hsf基因在c . moschata
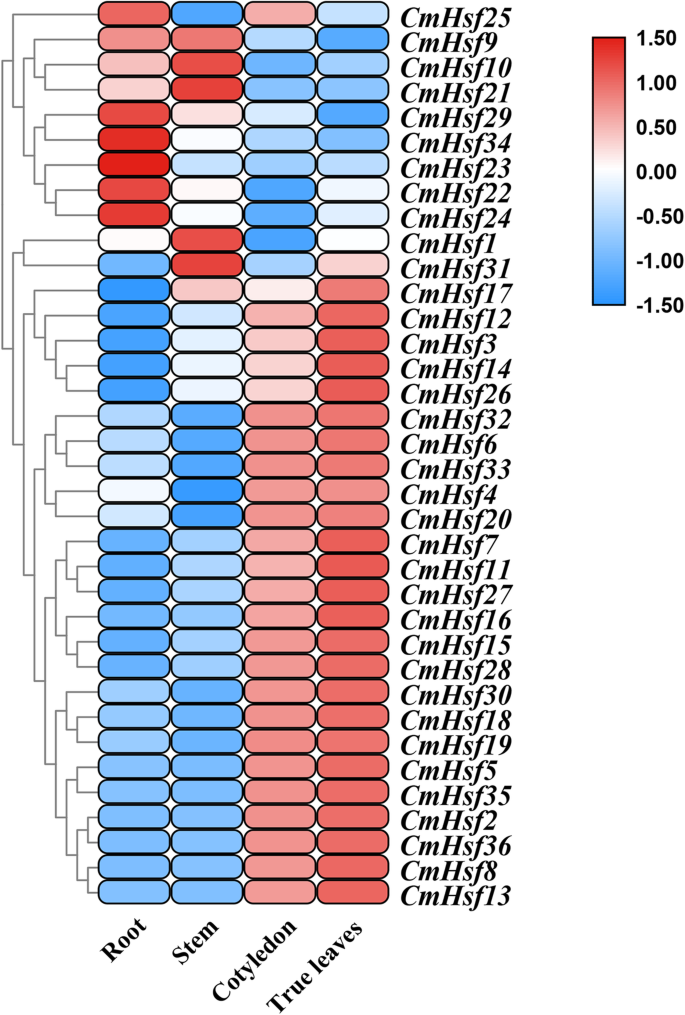
了解生理作用CmHsfs结果表明,36个热激转录因子在黄瓜根、茎、子叶和真叶中的表达模式不同c . moschata通过定量实时PCR。转录丰度为36c . moschata热休克转录因子可以从这四种组织中的至少一种中获得。6.;附加文件1:表S1)。热图和群集分析表明21 cmhsfs.在子叶和真实的叶子中高度表达,如CMHSF4.那CMHSF32.那CMHSF35.那CMHSF19和CMHSF15.两个基因(CMHSF9.和CMHSF10)在根和茎中的表达量高于在子叶和真叶中的表达量。一些基因只在一个组织中高表达。例如,CMHSF23.主要在根中表达,相对表达量为其他组织的100-258倍。根据以上分析,36个热休克转录因子具有组织特异性。
CIS.作用元素分析Hsf基因在c . moschata
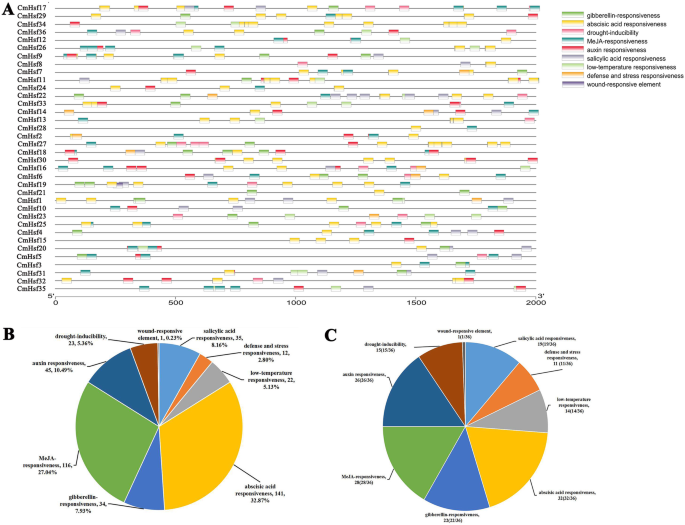
探讨。的势函数hsf, 这CIS.-Elements在启动子(起始密码前2 kB)的36Hsf基因在c . moschata预测。共有429个CIS-元素CmHsf年代。他们参与9非生物压力,包括水杨酸反应,国防和压力反应,低温反应、脱落酸反应,赤霉素响应性,惩罚响应性,生长素响应性,干旱可诱导性和伤口反应(无花果。7.一个;附加文件1:表S2)。总共31%的429CIS.- 传递元素参与脱落酸反应性,其中36中存在于32中存在CmHsfs(图。7.b,c)。此外,27和45%的CIS.- 分别为MEJA响应元件(封存CGTCA和TGACG基序)和助长响应元素(图。7.b). 36个热激转录因子中,28个基因参与了MeJA应答,22个基因参与了生长素应答。14个热激转录因子均表现出低温响应元件。自Hsf参与脱落酸反应性,低温响应性,MejA响应性和生长素响应性的基因,旨在实现这些基因的高比例,我们推测这些基因可能在这些压力中起重要作用。
的分布CIS.- 在36中的元素CmHsfs和9个应激响应元件中相应基因的比例。一种。这CIS.36个热激转录因子的作用元件c . moschata。他们被Plantcare计划预测(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),并通过TBtools中的Simple BioSequence Viewer进行可视化。右边的方块表示CIS.-作用元素,响应总共9个应力。不同的颜色表示CIS.- 参与不同应力的元素。图底部的坐标表明了基因启动子的长度。启动子序列在起始密码子之前定义为2kb。湾429的分布CIS.-与9个非生物胁迫相关的作用元素。C。比例36CmHsfs与9个非生物胁迫有关
通过分析CIS.- 为单个基因的元素,我们发现都是CMHSF34和CMHSF27.包含12个脱落酸响应元素(附加文件1:表S2)。此外,CMHSF17那CMHSF26.那CMHSF9.和CMHSF35.包含8个Meja响应元素,CMHSF23.和CMHSF35.包含的低温响应元件最多(3),说明这些关键CmHsfs可能在相应的应力响应中发挥重要作用。
对的响应CmHsf温度胁迫的基因
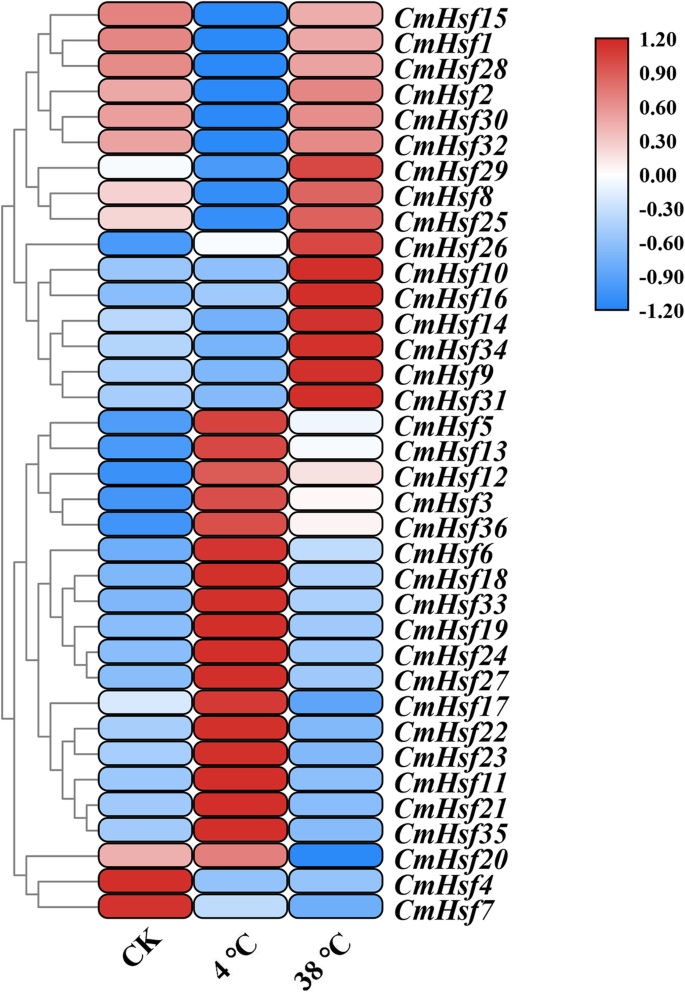
探索响应CmHsfs对于温度压力,我们进行了培养c . moschata4℃和38℃的幼苗。在冷治疗下,44%的CmHsfs(16个基因)显着上调,27%CmHsfs(10个基因)显着下调(图。8.;附加文件1:表S3)。例如,CMHSF3那CMHSF5.那CMHSF23.那CMHSF24那CMHSF27.那CMHSF35.和CMHSF36.冷胁迫下表达量高。此外,CMHSF4.那CMHSF15那CMHSF31.和CMHSF32.基因在冷应激下表现出低表达水平。同时,两个基因(CMHSF28和CMHSF30.)在冷应激下没有表达,表明这些基因的表达可以在冷应激下限制。在热处理下,显着上调24个基因,下调12个基因(图。8.;附加文件1:表S3)。表达水平CMHSF9.和CMHSF31.在热应激下分别在对照植物中分别为128.38和66.39倍,表明这两个基因可能在热应激下发挥重要作用。一些基因在热处理下呈现低表达水平,例如CMHSF17那CMHSF11那CMHSF21那CMHSF22那CMHSF23.和CMHSF35..考虑到表达水平CmHsf我们发现,在低温和高温胁迫下的基因CMHSF9.那CMHSF11那CMHSF21那CMHSF23.那CMHSF31.那CMHSF34和CMHSF35.在两个胁迫下表现出相反的趋势,因此我们推测这些基因可能在温度应激中起重要作用。
对的响应CmHsf基因转化为激素和水杨酸
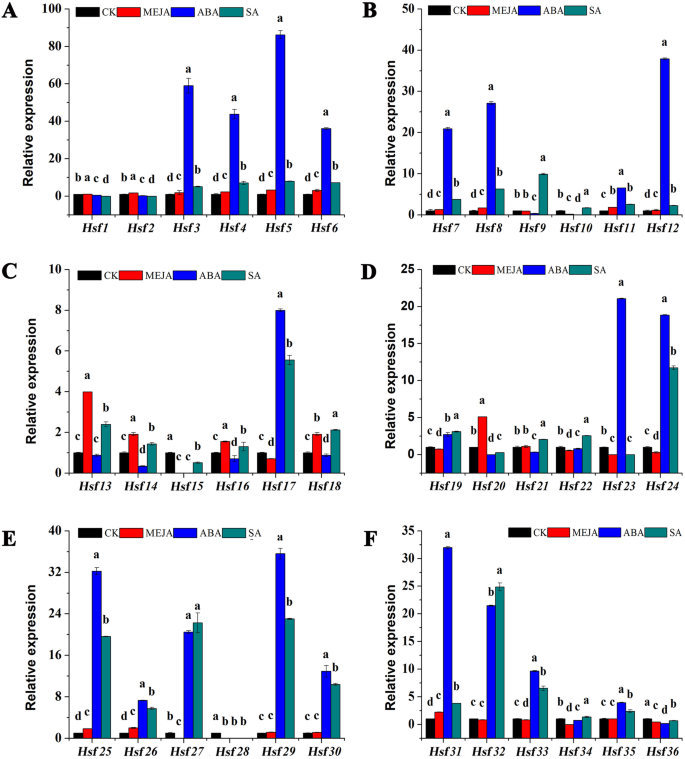
根据预测CIS.中的-acting元素CmHsfS启动子,共28,32和19CmHsf研究发现,MeJA基因、脱落酸基因和水杨酸基因分别参与了MeJA应答、脱落酸应答和水杨酸应答。7.;附加文件1:表S2)。因此,我们分析了这些基因对Meja,ABA和SA的反应。QRT-PCR分析结果表明31CmHsfs对MeJA有不同程度的反应,表达CMHSF20是对照组的5.1倍。9.;附加文件1:表S4)。在ABA处理下,21CmHsfS被显着上调,15个基因显着下调。表达水平CMHSF3那CMHSF4.那CMHSF5.那CMHSF6那CMHSF7.那CMHSF8.那CMHSF12.那CMHSF25那CMHSF29.和CMHSF31.表明这些基因在ABA胁迫下发挥着重要作用。所有CmHsfs回应SA,其中CMHSF25那CMHSF27.那CMHSF29.和CMHSF32.在SA治疗下显着增加,而CMHSF1那CMHSF2那CMHSF23.和CMHSF28在SA处理下显著降低。通过以上分析,我们得出结论CmHsf家族基因参与多种应激,并可能在这些应激中发挥不同的作用。
讨论
热激转录因子广泛存在于所有植物中,被认为是重要的非生物胁迫调节因子。对Hsf家族进行了全面、系统的分析G. Max.[17],B. Rapa.[18],p . bretschneideri[19],S. Tuberosum.[20.],V. Vinifera[21),b . oleracea[22].然而,Hsf家族尚未被广泛研究c . moschata.
在我们的研究中,我们确定了36个Hsf基因在c . moschata通过全基因组分析(表1).对基因家族的物理和化学性质的分析可以显示进化过程中每个成员的多样性[45.].我们的结果表明,36 cmhsfs的MW和氨基酸的数量广泛变化(表1),表示这一点c . moschata进化过程的变化。大多数CMHSF都表现出低等电点(π)(平均6.3),这一结果与中报道的Hsf相似c .漂白亚麻纤维卷[16].无论蛋白质的大小和结构域组成如何,其特性都很低π通过对亚细胞定位的预测分析,发现大多数的CmHsfs被预测定位于细胞核(表1),表明它们确实具有转录因子的功能。而来自同一亚家族的CmHsf12和CmHsf17被预测定位于细胞膜、细胞质和细胞核,说明同一亚家族的CmHsf成员不一定对应于同一亚细胞位置,可能具有其他特殊功能。
系统发育树划分36CmHsfs亚家族分为3个亚家族(亚家族I、亚家族II和亚家族III),该亚家族内的大多数基因在外显子长度和内含子数量上都具有相似的基因结构(图1)。2).因此,我们推测CmHsfs其中一个分支可能具有类似的功能,这一特征与之前报道的其他物种相似[16那18].一些结构特征CmHsfs在同一个分支中不同于其他分支CmHsf基因,表明这些基因可能具有功能多样性。除此之外CmHsfs根据DBD和HR-A/B结构域的保守结构特征,分为A、B、C三组(表2).亚家族II对应于C组和亚家族III对应于B组,亚组I不仅含有基因,还包含C基因。由于基因在同一分支上的近似性,我们推测了这种进化的路径CmHsfs一直在改变。
对CmHsfs蛋白的保守基序也进行了预测和分析。1).发现所有CMHSF蛋白质中存在基序1,2和4(图。1).根据主题位置和保守域位置的综合分析36 cmHSF蛋白,我们发现图案1,图案2和图案3在一起形成DBD,而MOTIF 4形成为HR-A / B结构域(图。1;桌子2).结果与之前的报告一致Z. Mays.[15],c .漂白亚麻纤维卷[16],B. Rapa.SSP。学报[18],S. Tuberosum.[20.],表明这一点CmHsfs可能具有类似的功能特征。
在某些物种中,特定基因家族成员的数量被认为是自然进化的结果。同时,基因家族成员的多样性一般是由于基因组的重组和扩增[46.].染色体节段性重复和个体基因重复是基因组进化过程中的主要驱动力[47.].与报道的25例相比ZmHsfS [15), 21CsHsfS [16]和31.Pthsf.S [14],我们发现的数量Hsf基因在c . moschata比那些更大玉米,玉米和p . trichocarpa.这些物种的基因组大小差异显著;例如,基因组的大小c . moschata是197.83 Mb,而Z. Mays.是2300 Mb。玉米基因组大小是c . moschata。然而,玉米的数量Hsf基因的数量远远低于Hsf基因在c . moschata.这种差异的原因可能是虽然虽然发生了两轮基因重复Z. Mays.基因组在其进化期间[48.那49.),Hsf基因Z. Mays.经历了大量的基因丢失。此外,基因组的c . moschata在物种系统发育过程中也经历了全基因组复制(WGD)事件[43.].为c .漂白亚麻纤维卷,基因组大小为350 MB,但21CSHSFS.不到数量CmHsfs.我们推测基因重复促进扩增CmHsf基因(43.或基因的退化和突变促进了数量的减少CsHsf基因(16],最终导致数量CmHsf比其他植物的基因更多。
在这项研究中,所有CmHsf发现基因对发生了片段复制事件,而没有串联重复事件,表明片段复制在基因进化中起着重要作用c . moschata Hsf基因家族(图。3.).这卡和Ks所有重复对的比例表明这些基因对在纯化选择下。另外,相对高的Ka / Ks比率CMHSF12.-CMHSF10表明它们经历了快速的演变(表3.).
一项研究提出了三种假说来解释重复基因的命运:(1)在植物进化过程中,有时会发生基因的退化和突变,这往往会导致一些重复基因的复制功能丧失。(2)由于突变的多样性和方向性,在进化过程中,重复基因的一个副本可能发生突变并保留新的功能,而另一个副本则保留原有的功能。这个过程被称为新功能化。(3)重复基因的两个拷贝可能发生突变而获得不同的功能,这称为亚功能化[50.].根据不同的表达模式CMHSF26.和CMHSF9.基因,可以推断,复制基因之间存在差异。CMHSF26.在子叶和真叶中高度表达,而CMHSF9.基因在根和茎中高度表达(图。6.).它们的基因结构和基序组成相似,表明重复基因的亚功能化CmHsf基因家族可以改变基因表达模式(图。1;无花果。2).此外,重复的基因CMHSF30.和CMHSF16具有相似的内含子-外显子结构、相同的基序成分和相似的组织表达模式,但在温度胁迫和激素处理下存在明显差异(图1)。2;无花果。6.;无花果。8.;无花果。9.),表明重复基因的新功能化CmHsf基因家族可能起着关键作用。共线分析表明c . moschata有频繁的共线l . siceraria那c .巨大成功那c .最大值,C. lanatus.(图。5.),表明具有共线关系的基因可能具有相似的功能。
CIS.- 为基因表达至关重要,它们的数量与基因表达强度相关[51.那52.].CMHSF23.和CMHSF35.包含三个低温响应元件(图。7.),这意味着CMHSF23.和CMHSF35.可能在低温应力下发挥关键作用。QRT-PCR结果表明CMHSF23.那CMHSF21那CMHSF11,CMHSF35.在低温条件下,这些基因的表达量显著上调,而在高温胁迫下,这些基因的表达谱呈现相反的趋势,进一步验证了这些基因对温度胁迫的响应(图5)。8.).然而,CMHSF13那CMHSF36.那CMHSF3和CMHSF5.在冷胁迫和热胁迫下均显著诱导(图。8.),并且在冷应激下,它们的反应更加突出,这表明这些基因对温度非常敏感,并且可能在温度胁迫下发挥关键作用。预测CIS.-作用元素表明,28CmHsf基因中含有MeJA反应元件(图。7.), qRT-PCR分析结果显示,MeJA处理下,31个基因的表达水平发生了不同程度的变化(图8)。9.).但是,从相对表达值中,我们发现了CmHsfs对Meja的反应而不是ABA和SA(图。9.).因此,我们得出结论c . moschataHsf家族基因主要参与了对ABA和SA的响应。
结论
总之,我们确定了36hsf在Cucurbita Moschata.基因组基于彻底的分析,并提供遗传信息,如染色体位置和外显子内部结构,保守的结构域和重复的基因。我们专门检查了这些表达方式CmHsfs在不同的组织。与此同时,我们研究了CmHsfs对多重胁迫,几个关键基因被发现对不利的环境作出反应。
方法
序列检索葫芦基因组学数据库和物理化学表征
目的:鉴定热休克转录因子家族c . moschata,基因组从中下载了葫芦基因组学数据库(CuGenDB,http://cucurbitgenomics.org/)[43.].共25岁答:芥Hsf基因id从NCBI数据库中获得A. Thaliana.参考 [26].我们使用25个AtHsf蛋白作为查询查询葫芦基因组数据库的BLASTPE.-Value截止1×e- 10..为了消除误报,如果序列的比例小于70%,则将其丢弃A. Thaliana.HSF蛋白质。聪明的 (http://smart.embl-heidelberg.de/)[53.]及MARCOIL (http://toolkit.tuebingen.mpg.de/marcoil)[19]用于预测DBDs和HR-A/B结构域。去除相同的基因后,剩下的基因被鉴定为CmHsf基因。每个CMHSF的编码序列和蛋白质序列信息被示出在附加文件中1:表S6。
热休克转录因子的物理和化学特征,包括其理论分子量(MW),理论等电点(π)和氨基酸数量,用ExPASy (http://web.expasy.org/tools/)[54.].有关的信息CmHsf包括染色体分布的基因,它们的开始和染色体上的末端位置被从中提取葫芦基因组学数据库,植物MPLOC预测了它们的亚细胞位置[55.].
系统发育树建设
揭示系统发育关系Hsf基因在c . moschata,由Mega 5.0构建一个大型的系统发育树[56.[36 cmHSF的全长氨基酸序列的相似性。此外,HSF蛋白的系统发育关系来自c . moschata那c .漂白亚麻纤维卷和A. Thaliana.也由Mega 5.0构建。基于先前的文献获得了21例CSHSF和22个ATHSF的蛋白质序列[44.那57.].用于构建系统发育树的大邻邻 - 加工(NJ)方法,使用1000重复与成对删除选项获得引导值。
保守结构域和基因结构分析
HSF的保守主题c . moschata通过多重期望最大化或Motif Elicitation (MEME,http://meme-suite.org/)[58.]使用蛋白质序列和徽标(附加文件2:图S2)。利用cNLS Mapper预测热休克转录因子的nls和NESs [59.和NetNES 1.1服务器[60.], 分别。从GSDS获得外显子系统结构(基因结构显示服务器,http://gsds.cbi。pku.edu.cn/)[61.]通过比较CmHsfs成员的cDNA序列及其相应的基因组DNA序列。
基因重复和基因共同分析
染色体的位置CmHsf使用可视化工具映射和成像基因(http://visualization.ritchielab.psu.edu/home/index.)基于从其获得的初始位置信息c . moschata(Cugendb,http://cucurbitgenomics.org/).识别基因重复,所有CDS序列c . moschata Hsf对彼此进行喷射的基因(同一性> 85%,E值<1E- 10.),使用本地爆破程序。然后通过之前计算的成对比对方法获得基因比对覆盖率:基因比对覆盖率=(比对长度-错配)/较长的基因长度。当基因比对覆盖率大于0.75时,对被认为是重复。此外,在一个100kb内被几个基因分开的两个基因被命名为串联重复基因[62.].估计这些重复的散度CmHsf,我们使用KaKs计算器计算同义词替代比率(Ks),根据五jo-bori和Nei的方法[63.].为了避免替换的饱和,我们要求k值> 2.0必须被丢弃[64.那65.].发散时间T根据公式(T = Ks/2λ × 10)计算- 6百万年前(Mya),λ= 1.5×10- 8)。[66.].鉴定基因共同性的标准基于先前的报告[67.],以及热激转录因子之间的共时关系c . moschata和其他物种的那些(A. Thaliana.那c .巨大成功那c .最大值那C. lanatus.那l . siceraria)在TBTOOLS中使用先进的CIRICOS计划构建[68.].
分析CIS.- 为...的元素CmHsf基因启动子
所有的启动子序列(起始密码子之前2 kB)CmHsf基因是从葫芦基因组数据库(http://cucurbitgenomics.org/),我们预测了启动子CIS.- 为...的元素CmHsfs通过使用PlantCare计划(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[69.]通过TBTools中的简单生物酶观众可视化[68.].
植物材料、生长条件和胁迫处理
这c . moschata以品种“天密1号”为研究材料。种子由河南科技学院园艺与园林学院南瓜队提供。将种子播种在含有蛭石基质(2:1)混合物的托盘中,并在植物生长室中生长。人工生长条件为光照强度350 μmol/m2/秒,25℃16小时光/ 16°C 8 H黑色和65%相对湿度。我们对两个月大的幼苗进行了采样和分析了不同的组织(根,茎,子叶和真叶)。另外,将一些幼苗转移至38℃以进行6小时热处理,或转移至4℃以进行6小时冷处理。将另一部分幼苗在1/2的Hoagland溶液中培养,pH6.5。在适应5天后,用以下处理培养植物:(1)对照(未处理的植物);(2)1毫米Meja;(3)5mM水杨酸(SA);(4)100μM脱落酸(ABA)[70].在上述处理后10小时收集叶样品。将控制和应力处理的样品在液氮中冷冻并储存在-70℃以进一步分析。
RNA提取、逆转录及qRT-PCR分析
按照RNA试剂盒(天根,北京)的说明提取冷冻样本的总RNA。提取RNA,用Prime Script RT试剂试剂盒(TaKaRa, Dalian, China)将其逆转录成cDNA。最后,使用SYBR Premix ExTaq试剂盒(TaKaRa,大连)进行实时荧光定量PCR。验证基因引物、目的基因和内参基因的特异性(β-Actin)引物(附加文件1:表S5)对齐在葫芦基因组数据库。QRT-PCR分析在ABI7500实时PCR系统(Applied Biosystems)上进行了以下循环轮廓:第1阶段,95℃20s;第2阶段,95°C 3 S,60°C 30s(40个循环);第3阶段,95°C 15 S,60℃1分钟,95°C 15秒。第3阶段用于进行熔化曲线。实验重复为三种技术和三个生物重复。根据2计算相对基因表达-ΔΔct方法。
数据和材料的可用性
这Cucurbita moschata Hsf从中下载基因和蛋白质序列葫芦基因组学数据库(CuGenDB,http://cucurbitgenomics.org/).支持我们的研究结果的所有数据和材料包含在手稿的方法部分。附加文件中提供了详细信息。
缩写
- hsf:
-
热休克转录因子
- DBD:
-
DNA结合结构域
- OD:
-
寡聚化域
- NLS:
-
核定位信号
- 新经济学院:
-
核出口信号
- HSE:
-
热休克元件
- 理查德·道金斯:
-
阻遏域
- HSP:
-
热休克蛋白
- 厘米:
-
c . moschata
- KDA:
-
千道户
- π:
-
等电点
- WGD:
-
全基因组重复
- 兆瓦:
-
分子量
- MEME:
-
多重期望最大化或主题启发
- CD:
-
编码域序列
- Ks:
-
同义替代率
- 米娅:
-
几百万年前
- 山:
-
水杨酸
- 阿巴:
-
脱落酸
参考
- 1.
王敏,范诺齐A,王刚,梁永红,托涅利GB,泽诺尼S,卡瓦里尼E,佩佐蒂M,程志明。葡萄藤的基因组及转录组分析(vitis Vinifera L.) WRKY基因家族。Hortic杂志2014;1(1):1 - 16。
- 2.
戈麦斯 - 牧师r,burchfiel et,thiele dj。调节热休克转录因子及其在生理和疾病中的作用。NAT Rev Mol Cell Biol。2018; 19(1):4-19。
- 3.
Kotak S,Larkindale J,Lee U,Koskull-döringPV,Vierling E,Scharf Kd。植物中热应激反应的复杂性。CurrOp植物BIOL。2007; 10(3):310-6。
- 4.
Baniwal Sk,Bharti K,Chan Ky,Fauth M,Ganguli A,Kotak S,Mishra Sk,Nover L,Port M,Scharf Kd,Tripp J,Weber C,Zielinski D,Koskull DP。von。植物中的热应激反应:具有伴侣的复杂游戏和超过20个热应激转录因子。j biosci。2004; 29(4):471-87。
- 5。
Wiederrecht G,Seto D,Parker CS。分离编码的基因酿酒酵母热休克转录因子。细胞。1988年,54(6):841 - 53。
- 6。
Sorger PK,Pelham HRB。酵母热休克因子是表现出温度依赖性磷酸化的基本DNA结合蛋白。细胞。1988; 54:855-64。
- 7。
一种六聚体果蝇热应激负调控因子的克隆与表达。细胞。1990;63(5):1085 - 97。
- 8。
Rabindran SK,Giorgi G,Clos J,Wu C.分子克隆和人热应激因子的表达。P美国国家科学研究院。1991年; 88(16):6906-10。
- 9.
Sarge KD, Zimarino V, Holm K, Wu C, Morimoto RI。两种具有独特诱导性和构成性DNA结合能力的小鼠热应激因子的克隆和表征。基因Dev。1991;5(10):1902 - 11。
- 10.
Schuetz TJ,Gallo GJ,Sheldon L,Tempst P,金斯敦Re。分离cDNAHSF2:人类中两个热应激因子基因的证据。P美国国家科学研究院。1991年; 88(16):6911-5。
- 11.
Scharf KD,Rose S,Zott W,Schǒfflf,Nover L.三个番茄基因代码用于热应激转录因子,与酵母HSF的DNA结合结构域具有显着同源性的区域。Embo J. 1990; 9(13):4495-501。
- 12.
Huhel A,Schoffl F.拟南芥热休克因子:基因和重组蛋白的分离和鉴定。植物生物学杂志。1994;26(1):353-62。
- 13.
Yamanouchi U,Yano M,Lin H,Ashikari M,Yamada K.稻米斑点叶基因,Spl7,编码热应激转录因子蛋白。P美国国家科学研究院。2002年,99(11):7530 - 5。
- 14。
张赫兹,杨杰,陈英,毛XL,王ZC,李世。热冲击转录因子的鉴定和表达分析(HSF.)基因家族p . trichocarpa.植物常规。2013; 6(6):415-24。
- 15.
林YX,江鹤,楚兹,唐XL,朱谟,程富。玉米热休克转录因子家庭的基因组鉴定,分类及分析。BMC基因组学。2011; 12:1-14。
- 16。
陈XZ,王Y,Shi JL,朱LJ,王克,徐J。黄瓜热休克因子(HSFS)的基因组鉴定,序列特征及表达分析。秘密人。2014; 36(4):376-86(中文)。
- 17。
郑e,金凯明,李建华。热休克转录因子家族的全基因组分析和分子鉴定大豆.j遗传学基因组学。2013; 40(3):127-35。
- 18。
宋XM,刘GF,段WK,刘特克,黄泽,仁J,李义,侯XL。大白菜中热冲击转录因子家庭的基因组识别,分类及表达分析。Mol Gen Genomics。2014; 289(4):541-51。
- 19。
乔X,Li M,Li L,Yin H,吴家,张S.全基因组鉴定与对比分析中国白梨热休克转录因子家庭(Pyrus bretschneideri)和其他五个蔷薇科物种。中国生物医学工程学报。2015;15(1):1 - 16。
- 20.
唐RM,朱WJ,宋XY,林XZ,蔡j,王M,杨Q.马铃薯热冲击转录因子的基因组型鉴定与功能分析。前植物SCI。2016; 7:1-18。
- 21.
刘桂特,柴福明,王勇,蒋建忠,段伟,王永涛,王芳芳,李胜辉,王丽娟。葡萄HSF家族的全基因组鉴定和分类及其在热适应和热胁迫下的转录分析园艺植物杂志2018;4:7-17。
- 22.
Lohani N, Golicz AA, Singh MB, Bhalla PL.全基因组分析Hsf基因家庭b . oleracea并进行了比较分析Hsf基因家庭b . oleracea那B. Rapa.和显著.Funct综合基因组。2019; 19:515-31。
- 23.
Scharf Kd,Berberich T,Ebersberger I,Nover L.植物热应激转录因子(Hsf)家族:结构、功能和进化。mba - gene Regul Mech. 2012;1819(20): 104-19。
- 24.
Gorlich D,Kutay U.在细胞核和细胞质之间运输。Annu Rev Cell Dev Bi。1999; 15(1):607-60。
- 25.
Heerklotz D, Doring P, Bonzelius F, Winkelhaus S, Nover L.核进出口平衡决定了番茄热胁迫转录因子在细胞内的分布和功能HsfA2.mol cel biol。2001; 21(5):1759-68。
- 26.
Kotak S, Port M, Ganguli A, Bicker F, Koskull-Doring PV。的c端域的表征拟南芥热应激转录因子(hsf),并鉴定了一种新的植物a类Hsfs与AHA和NES基序的特征组合,这对激活剂功能和细胞内定位至关重要。植物j . 2004; 39(1): 98 - 112。
- 27.
关键词:番茄,热胁迫,转录因子,AHA基序,激活因子HsfA1和HsfA2.植物细胞。2000; 12(2):265-78。
- 28.
一种新的转录抑制因子拟南芥.植物细胞生理。2009; 50(5):970-5。
- 29.
关键词:双函数函数,双函数函数,双函数函数引用本文拟南芥转录因子DREB2A水胁迫和热胁迫应答基因的表达。P美国国家科学研究院。2006; 103(49): 18822 - 7。
- 30.
秦F,Kakimoto M,Sakuma Y,Maruyama K,Osakabe Y,Tran LS,Shinozaki K,Yamaguchi-Shinozaki K.调节和功能分析ZmDREB2A对干旱和高温胁迫的反应Zea Mays L..工厂J. 2007; 50(1):54-9。
- 31.
Mishra SK, Tripp J, Winkelhaus S, Tschiersch B, there K, Nover L, Scharf KD。在热应激转录因子的复杂家族中,HsfA1在番茄中有一个独特的热能调节器。基因开发。2002; 16(12):1555-67。
- 32.
charyy, Liu HC, Liu NY, Chi WT, Wang CN, Chang SH, Wang TT。一种热诱导转录因子,HsfA2,以延长获得性耐热性拟南芥.植物理性。2007; 143(1):251-62。
- 33.
Yokotani N,Ichikawa T,Kondou Y,Matsui M,Hirochika H,Iwabuchi M,ODA K.水稻热应激转录因子的表达OsHsfA2e增强转基因中的环境应激的耐受性拟南芥.Planta。2008; 227(5):957-67。
- 34.
Almoguera C,Rojas A,Diaz-Martin J,Prieto-Dapena P,Carranco R,Jordano J.一种种子特异性热冲击转录因子,参与向日葵胚胎发生过程中的发育调控。J Biol Chem。2002; 277(46):43866-72。
- 35.
热激转录因子在植物中是否可以作为过氧化氢传感器?安机器人。2006;98(2):279 - 88。
- 36.
Kilian J ., Whitehead D ., Horak J ., Wanke D ., Weinl S ., Batistic O ., D'Angelo C ., Bornberg-Bauer E ., Kudla J ., Harter K. . AtGenExpress全球胁迫表达数据集:UV-B光、干旱和寒冷胁迫响应的协议、评估和模型数据分析。植物j . 2007;(2): 347 - 63。
- 37.
张杰,刘波,李建波,张丽,王颖,郑汉强,卢明忠,陈杰。Hsf和Hsp杨树基因家族的全基因组鉴定、组织及其在发育和胁迫反应中的相关表达。BMC基因组学。2015;16(1):1 - 16。
- 38。
Nishizawa A,Ybuta Y,Yoshida E,Maruta T,Yoshimura K,Shigeoka S.拟南芥热冲击转录因子A2作为关键调节器,响应于几种类型的环境压力。工厂J. 2006; 48(4):535-47。
- 39。
Davletova S,Rizhsky L,Liang H,Shengqiang Z,Oliver DJ,Coutu J,Shulaev V,Schlauch K,Mittler R.细胞溶质抗坏血酸过氧化物酶1是反应性氧基因网络的中心分组分拟南芥.植物细胞。2005;17(1):268 - 81。
- 40.
Shim D, Hwang JU, Lee J, Lee S, Shoi Y, An G, Martinoia E, Lee Y. A4类热休克转录因子的同源性HSFA4A赋予小麦和水稻耐镉性。植物细胞。2009;21(12):4031 - 4。
- 41.
周建国,朱云龙,杨丽芳,刘兆林,张桂枝。植物器官对无机离子的吸收与积累特性Cucurbita Moschata.公爵。和C. Ficifolia.Bouche。在NaCl压力下。J植物Nutr肥料。2008; 14(3):546-51。(用中文(表达)。
- 42.
太阳王JP, PC,李YX,刘YZ,杨NS,詹,马XL,孙老,夏,刘XJ,通用电气,罗SN,刘YM,香港欧美,崔XB, Lei泰,王L,张建平,Ge WN张L,歌XM,元M,郭D,金,陈W,潘YX,刘T,杨GX,肖Y,太阳JS,张C,李ZB,徐总部,段XQ,沈平方,张古银,王黄西南,XY。一个被忽视的古四倍化葫芦科.《生物学报》2018;35:16-26。
- 43.
关键词:古异源四倍体,核型稳定性,无偏分异,核型稳定性Cucurbita.基因组。莫尔植物。2017; 10(10):1293-306。
- 44.
关键词:水稻,热激转录因子,转录因子,全基因组分析拟南芥.j遗传学基因组学。2008; 35:105-18。
- 45.
宋晓明,刘tk,段伟坤,马庆华,任杰,王智,李勇,侯晓林。大白菜gras基因家族的全基因组分析Brassica Rapa.SSP。学报).基因组学。2014; 103(1):135-46。
- 46.
王C,段WK,Riquicho Ar,Jing Zg,Liu Tk,Hou XL,Li Y.大白菜中酒吧家庭的基因组调查和表达分析(Brassica Rapa.SSP。pekinesis.).Mol Gen Genet. 2015; 290:2241-60。
- 47.
Du JC,田ZX,隋Y,赵MX,歌曲QJ,大炮某人,Cregan P,马JX。古多倍体大豆中复基因的分化、保留和表达模式是由聚点周围的效应决定的。植物细胞,2012;24(1):21-32。
- 48.
Swigoňová Z,赖静,马静。高粱和玉米基因组前体细胞的紧密分裂。基因组研究》2004;14(10):1916 - 23所示。
- 49.
Wei FH,Coe EH,Nelson W,Bharti AK,Engler F,Butler E,Kim H,Goicoechea JL,Chen Ms,Lee S,Fuks G,Sanchezvilleda H,Schroeder SA,Fang Zw,McMullen MS,Davis GL,Bowers Je,帕特森啊,舍富马ml,加德纳·杰姆,锥kc,弄乱j,soderlund c,翼ra。玉米基因组的物理和遗传结构反映了其复杂的进化史。Plos Genet。2007; 3(7):1254-63。
- 50。
bHLH转录因子SPATULA通过控制根分生组织的大小来调节根的生长。中国生物医学工程学报,2013;
- 51。
Saeed AI, Bhagabati NK, Braisted JC, Liang W. Quackenbush。TM4微阵列软件套件。方法Enzymol。2006;411(2):134 - 93。
- 52。
彭S,Huang ZC,Ou Ylj,Cheng J,Zeng FH。人工启动子在植物基因工程中的研究进展。J植物理性。2011; 47:141-6。
- 53。
LeetUnic I,Deerks T,Bork P. Smart 7:蛋白域注释资源最近的更新。核酸RES。2012; 40:302-5。
- 54。
Elisabeth G,Alexandre G,Christine H,Ivan I,Appel Rd,Amos B. Expasy:用于深入蛋白质的蛋白质组织的知识和分析。核酸RES。2003; 31(13):3784-8。
- 55.
周凯奇,沈海斌。plant - mploc:一种自上而下的策略,用于增强预测植物蛋白亚细胞定位的能力。《公共科学图书馆•综合》。2010;5 (6):e11335。
- 56.
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33(7):1870-4。
- 57.
黄瓜热激转录因子家族的全基因组鉴定与分析(英文)Cucumis sativusl .)。植物组学研究进展[j];
- 58.
先验知识在模因发现母题中的价值。Proc Int Conf Intell system Mol Biol. 1995; 3:21-9。
- 59.
Kosubi S,Hasebe M,Tomita M,Yanagawa H.通过预测复合基序预测酵母细胞周期依赖性核黄素血液过血蛋白的系统鉴定。P美国国家科学研究院。2009; 106(25):10171-6。
- 60。
关键词:富亮氨酸核输出信号;中国生物医学工程学报。2004;17(6):527-36。
- 61。
胡湾,金吉,郭艾,张H,罗杰,高G. GSD 2.0:升级基因特征可视化服务器。生物信息学。2015; 31(8):1296-7。
- 62。
王LQ,GUO K,LI Y,TU YY,HU HZ,Wang BR,CUI XC,PENG LC。大米CESA / CSL超家族的表达分析及整合分析。BMC植物BIOL。2010; 10(1):1-16。
- 63。
张Z,李继,赵XQ,王家,黄阁,宇J.Kaks计算卡和Ks通过模型选择和模型平均。Genom Proteom Bioinf。2006; 4(4):259-63。
- 64.
布兰科G,伍尔夫KH。从重复基因的年龄分布推断模式植物物种广泛的古多倍性。植物细胞。2004;16(7):1667 - 78。
- 65.
李泽,江蜂,周丽,邓立,林毅,彭·XJ,燕鹤,程富。豆类基因组中HD-ZIP I基因家族的分子演变。基因。2014; 533(1):218-28。
- 66.
Emanuelsson O,Nielsen H,Brunak S,Heijne GV。基于其N-末端氨基酸序列预测蛋白质的亚细胞定位。J Mol Biol。2000; 300(4):1005-16。
- 67.
吴敏,李勇,陈丹,刘慧,朱丹,向阳。一种新型抗肿瘤基因的全基因组鉴定与表达分析IQD莫斯竹子的基因家庭(植被类型).SCI批准。2016; 6(1):1-14。
- 68.
Chen CJ,陈H,张Y,Thomas Hr,Frank Mh,He Yh,夏R.TBTools:为大生物数据的交互分析开发了一种综合工具包。莫尔植物。2020; 13(8):1194-202。
- 69.
Lescot M, Déhais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouzé P, Rombauts S. PlantCARE,植物数据库CIS.-作用调控元件和启动子序列硅分析工具的门户。中国生物医学工程学报,2002;30(1):125 - 125。
- 70.
巴里R,琼斯JDG。植物激素在植物防御反应中的作用。中国生物医学工程学报,2009;
确认
不适用。
资金
这项工作由科研基金会为高级人才(103010620001/015和2017034)提供资金。
作者信息
从属关系
贡献
CS和JY构思,设计和监督实验;CS和JY写了稿件;CS和JY进行了实验;CS和JY在实验室实验和数据分析中提供了支持。CS和JY分析了数据。所有作者均阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
表达水平的数据36CmHsf根,茎,子叶和真叶中的基因。通过2−ΔΔCt方法。表S2。统计的数量CIS.- 在36中的元素CmHsf基因启动子。表S3。表达水平的数据36CmHsf在温度胁迫下叶片的基因。CK在25℃下提到未处理的植物。数据表示表达水平CmHsf冷应激(4℃)和热应激(38℃)后6小时的基因。通过2−ΔΔCt方法。表S4。表达式概况的数据为36CmHsfMeJA、ABA和SA处理下的真叶基因。CK为图中未处理植株。数据表示表达水平CmHsfMeJA、ABA和SA处理10 h后的基因。通过2−ΔΔCt方法。表S5。用于组织特异性分析的引物序列列表36CmHsf基因。表S6。每个CMHSF的编码序列和蛋白质序列信息。
附加文件2:图。S1。
CmHsf蛋白中DBD的多序列比对分析及二级结构元件。使用Clustal X 2.0进行序列比对。不同的背景颜色表示不同的氨基酸。“*”表示不同Hsf蛋白的氨基酸序列高度一致。DBD的二级结构要素(α.1-β1-β2-α.2-α.3 -β3 -β4)显示在对准之上。通过SOPMA二级结构预测软件预测二次结构。圆柱形管代表一种螺旋或β- 表格。数字S2。CmHsf蛋白中10个基序的详细信息。通过多重期望最大化(Multiple Expectation Maximization)或Motif Elicitation (MEME,http://meme-suite.org/).
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
南瓜热激转录因子家族的全基因组特性及表达分析(英文)Cucurbita Moschata.).BMC植物BIOL.20.471(2020)。https://doi.org/10.1186/s12870-020-02683-Y.
收到了:
公认:
发表:
关键词
- Cucurbita Moschata.
- 热激转录因子
- 基因复制
- 守恒的域
- CIS.表演元素
- 表达式模式