抽象的
背景
由于其丰富的营养和高生物活性类黄酮含量,Tartary Buckwheat在食品市场中获得了普及。然而,其困难的剥离过程严重限制了其食品加工行业发展。稀土荞麦,一种罕见的局部品种,非常容易被脱落,但对这种易脱落的细胞,生理和分子机制仍然很大程度上不清楚。
结果
在这项研究中,我们综合分析对比较细胞,生理,转录组和基因共同表达网络的分析,深入了解水稻荞麦易脱离的原因。与正常的甘皇荞麦相比,大米荞麦在船体硬化血管细胞中具有明显的布里特和较薄的船体和较薄的细胞壁。此外,纤维素,半纤维素和木质素含量分别显着低于全部或部分经过测试的正常水龙荞麦品种的木质素含量,以及水稻荞麦和水稻荞麦之间的纤维素和半纤维素含量的显着差异正常的甘皇荞麦在授粉后10天开始(DAP)。比较转录体分析在四种不同的发育阶段鉴定了大米和正常荞麦壳之间的9250个差异表达的基因(DEGS)。所有DEG的加权基因共抑制网络分析(WGCNA)鉴定了与水稻和正常荞麦之间壳体差异的形成相关的关键模块。在该特定模块中,许多二级细胞壁(SCW)生物合成调节和结构基因,其参与纤维素和半纤维素生物合成,被鉴定为轮毂基因并显示出共表达。这些鉴定的SCW生物合成的集线器基因在水稻荞麦壳中的表达显着低于早期船体发育阶段的正常荞麦。其中,通过定量实时聚合酶链反应(QRT-PCR)进一步验证了17种SCW生物合成相对枢纽基因的表达。
结论
本研究结果表明,水稻苦荞壳发育早期SCW生物合成调控基因和结构基因的低表达,通过降低细胞壁化学成分的含量,导致其容易脱皮,进而影响壳厚壁细胞的细胞壁厚度。船体厚度和机械强度。
背景
苦荞麦(Fagopyrum tataricumGaertn.)是蓼科的一种,是一种假谷类作物,主要生长在中国西部山区和喜马拉雅地区[1].近年来,苦荞因其丰富的营养物质,特别是富含生物活性黄酮类化合物,对人体健康有多种益处,在世界范围内引起了广泛的关注,并在食品市场上受到欢迎[2那3.那4.那5.那6.].种子是人类Tartary Buckwheat的主要利用部分[2]并已广泛用于开发葡萄酒,茶,面条,饼干等保健品。除了直接使用。然而,所有正常的荞麦品种的种子被坚韧的船体紧紧地围绕,在种子可以在食物中使用或加工之前难以去除。虽然已经开发了许多方法来解决Tartary Buckwheat的硬剥离问题,但这些方法仍然面临许多问题,例如低脱离率(≤35%),破碎的涂层和烹饪前由烹饪引起的营养损失(包括类黄酮)的问题[7.那8.那9.].这些情况严重限制了鞑靼荞麦食品加工行业的发展。幸运的是,大米荞麦,一个非常罕见和容易被脱落的鞑靼荞麦,在中国南方和喜马拉雅山的一个非常小的规模上,已被发现在很小的规模上增加了[10.].虽然大米荞麦种子种子,低产量和晚期成熟度非常小,但其优异的脱髓性能有助于改善正常的肉荞麦品种,这将有助于解决脱离问题。
一般来说,充分了解优良农艺性状的细胞、生理、遗传和分子机制是利用该性状改良作物的重要前提。到目前为止,已经进行了几项研究来调查水稻-苦荞容易脱皮的遗传机制。众所周知,水稻苦荞的易脱皮是一种隐性性状,是由单隐性基因控制的2大米荞麦和不同正常季后荞麦品种交叉的人口[11.那12.那13.].目前,通过RNA测序,膨胀的偏析和基因表达分析,已经鉴定了控制这种易于剥离的水稻荞麦的候选基因。[14.那15.那16.那17.].此外,一些表型研究发现船体沟,位于两条边之间的rice-tartary荞麦种子比正常的苦荞麦薄,这表明薄壳rice-tartary荞麦导致了容易脱壳,并进一步定义了容易脱壳特质的薄壳特征(12.那13.那18.].最近,一项生理研究发现,正常苦荞的果皮纤维素和木质素(细胞壁的主要化学成分)的含量明显高于或低于水稻苦荞和普通荞麦(另一种栽培荞麦,很容易去皮)[19.那20.那21.], 分别。然而,正常荞麦和水稻荞麦之间的木质素和纤维素总量没有明显的差异[21.],表明木质素与纤维素的比例可能是影响剥壳程度的一个因素。考虑到船体的主要化学成分除了纤维素和木质素外还含有半纤维素,因此船体的半纤维素含量是否也会影响船体的脱壳程度还有待探讨。此外,虽然水稻苦荞麦易脱皮的生理和遗传机制的研究已经取得了很大进展,但易脱皮的细胞和分子机制仍很大程度上未知,这限制了水稻苦荞麦易脱皮新品种的选育。
在这项研究中,我们进行了对比细胞,生理学,转录组和共同表达网络分析,以了解使大米荞麦易剥离的细胞,生理和分子机制。我们的研究结果揭示了大米荞麦和正常季后遇荞麦之间船体的细胞和生理差异,发现了确定水稻和正常荞麦之间的壳体差异的关键期,确定了促进脱离易燃的关键基因监管网络季后荞麦,并发现易于剥离水稻荞麦的分子机制。这些结果不仅扩大了我们对大米荞麦易剥离机制的理解,而且还提供了有价值的信息,用于进一步检查在水稻荞麦中脱落的候选基因的候选基因的功能,并通过基因操纵改善正常急性荞麦的脱落。
结果
表型和生理变化
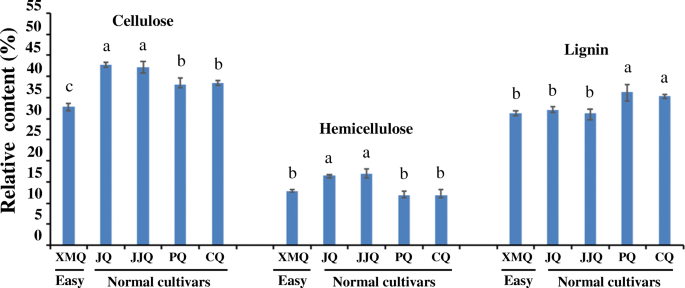
与普通苦荞品种“JQ”相比,稻苦荞“XMQ”成熟壳的机械强度明显降低,用手搓揉时易破壳脱落(图1)。1a).扫描电镜显示,“XMQ”车体出现了许多“JQ”车体不存在的缺陷(图5)。1b,c)。这些结果表明,“XMQ”壳的较低机械强度有助于其易于脱落,并且易于脱离性状被重新定义为“脆性船体”特征。为了进一步研究“XMQ”船体的较低机械强度是由船体组合物的变化引起的,我们测量了船体纤维素,半纤维素和木质素含量的“XMQ”,“JQ”和其他三种正常的季后荞麦品种(“JJQ”,“PQ”和“CQ”)。如图1所示。2与4个正常苦荞品种相比,“XMQ”的果皮纤维素含量显著低于所有供试正常苦荞品种,而“XMQ”的果皮半纤维素和木质素含量仅显著低于2个正常苦荞品种。这些结果表明,还原纤维素、半纤维素和木质素的含量可能是导致水稻苦荞脆性和易脱皮的原因,其中纤维素含量的降低可能是主要原因。
“XMQ”和“JQ”中纤维素、半纤维素含量及船体厚度的动态变化
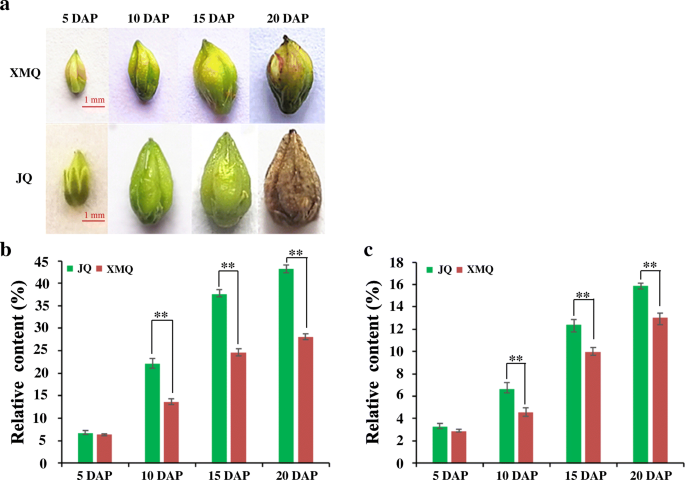
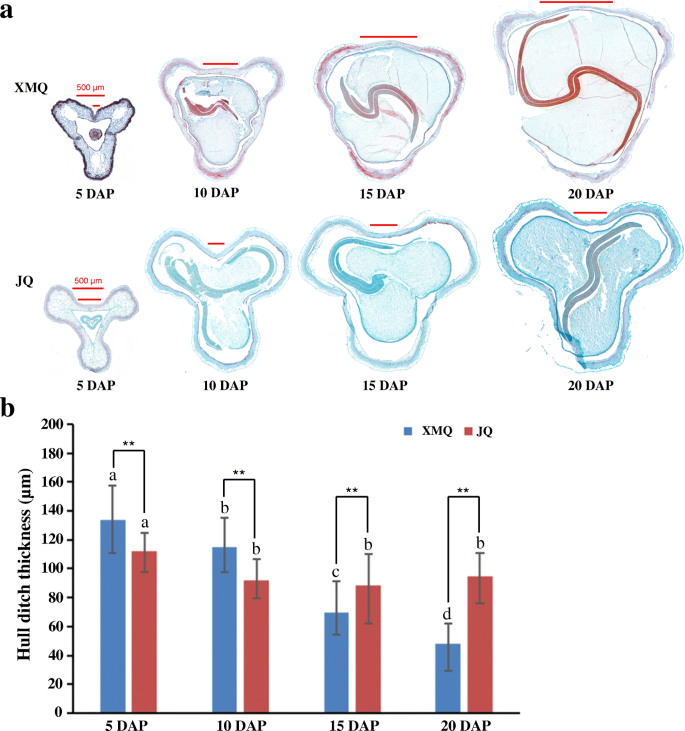
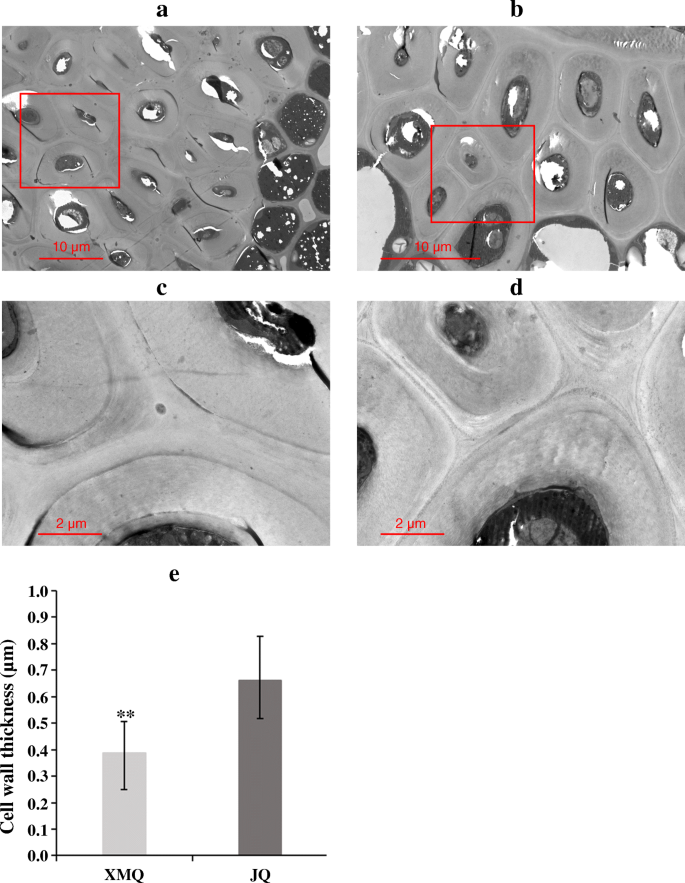
为了研究纤维素和半纤维素在壳发育过程中的积累情况,测定了“XMQ”和“JQ”4个不同阶段种子壳中纤维素和半纤维素的含量(图1)。3.一种)。如图1所示。3.B、c两个品种的纤维素和半纤维素含量变化趋势相似,在船体发育过程中持续生长。此外,纤维素和半纤维素含量在DAP 10时开始出现显著差异。为了进一步了解两个品种的壳沟厚度在种子发育过程中是否发生了变化,我们进行了石蜡切片分析,根据石蜡切片结果测量了壳沟厚度(图1)。4.).“XMQ”的壳沟厚度在种子发育过程中显著降低,而“JQ”的壳沟厚度仅在10 DAP时比5 DAP时降低,10 DAP后差异不明显(图1)。4.b)。另外,“XMQ”的船体沟槽厚度明显低于15和20dap的“JQ”,尽管其船体沟槽厚度明显高于5和10dap的“JQ”(图。4.b).透射电镜进一步显示“XMQ”船体沟厚壁组织细胞的细胞壁厚度明显小于“JQ”(图5)。5.).上述结果表明,“XMQ”和“JQ”的纤维素含量、半纤维素含量和壳沟厚度呈动态不同变化,可用于进一步的转录组分析。
卧室荞麦品种船体发育的转录组分析
在船体发育过程中洞察转录组动力学,在四种不同的发育阶段进行“XMQ”和“JQ”船体的RNA-SEQ分析(8种组织,每个组织的三个独立的生物重复,总共24个样品).共有521.39和517.72百万个清洁读数,平均为每个样本的43.43和43.09百万个清洁读取,分别为“XMQ”和“JQ”生成(附加文件1:表S1)。85.84 ~ 92.74%的clean reads被定位到每个样本的内参基因组,其中64.54 ~ 73.47%被唯一定位。通过Cufflinks和Cuffmerge分析,从24个样本的所有干净序列中获得了29,843个基因位点,包括28,465个已知基因位点和1378个新基因位点。不同组织生物复制间的PCC从0.90变化到0.99(除了“JQ”中J15和J20的一个重复和“XMQ”中X15的一个重复,这些重复被过滤后进行进一步分析),表明这些重复具有较高的可靠性和可重复性(附加文件)2:图S1)。
计算每个基因的归一化表达水平(FPKM),并且具有FPKM≥0.1的基因被认为是如表达的。在至少一个样品中,共表达了总共27,955个基因,包括26,589个已知和1366个新基因。其中,不同组织中的表达基因的数量在“XMQ”和23,282(J20)中在“JQ”中的23,575(X20)至25,014(X10)变为23,282(J20)(附加文件2:图S2a)。除X20组织外,其他组织中表达非常高(FPKM≥100)、高(50≤FPKM < 100)、中(10≤FPKM < 50)、低(2≤FPKM < 10)和非常低(0.1≤FPKM < 2)基因的比例相对相似(附文件)2:图开通)。此外,在所有组织中,极低表达基因(约42%)和中表达基因(约30%)所占比例最大(Additional file2:图开通)。综上所述,我们获得了这两个苦荞品种发育壳转录组的充分覆盖。
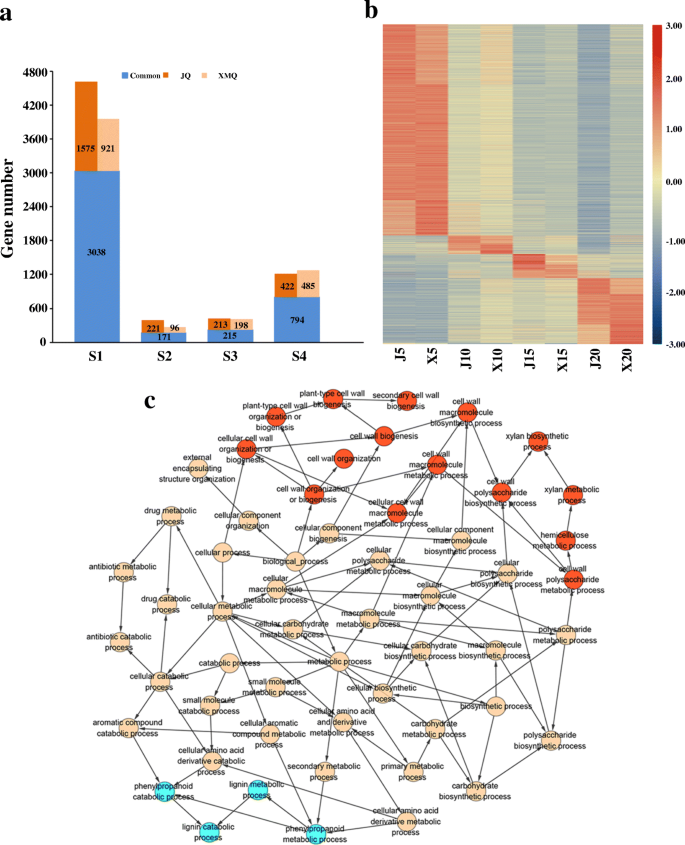
通过对苦荞麦不同品种外壳发育的转录组比较,揭示了不同品种外壳发育的关键阶段
调查船体开发转录om之间的关系来自“XMQ”和“JQ”,HCA(附加文件)2:图S3a)和PCA(附加文件2:图S3b)是基于在八个组织样本中至少一个表达的27,955个基因的平均FPKM值进行的。结果表明,除DAP 20时外,两个品种在同一生育期的相关性较高(图S3.a). PCA分析显示,X5与J5被归为一组,X10与J10、X15与J15、X20与J20之间有明显的分离(附加文件2:图S3b),表明两个品种在DAP 5时转录程序相似性较高,在DAP 10、15、20时存在明显的转录差异。此外,这些分析还表明,10 DAP可能是在分子水平上确定两个品种之间的壳差异形成的关键阶段。
鉴定在品种中壳体发育的每个阶段特别/优先表达的基因
基于SS评分≥0.5的SS算法,鉴定了在两个品种的壳体发育中的每个阶段中特别出现的基因。在“JQ”和“XMQ”的所有四个阶段中,共鉴定了总共6649和5918个特异性/优先基因。在这些基因中,348(5.2%)和302(5.1%)的特异性/优先基因被编码用于转录因子(TFS)。阶段特异性/优先基因的数量范围为“JQ”和“XMQ”的“JQ”和267至3959(图。6.a). DAP 5和DAP 10的阶段特异性/优先基因数量分别为两个品种最大和最低(图1)。6.a).此外,两种品种中均存在较高比例的时期特异性/优先性基因,且两种品种的4个时期均存在品种特异性基因(图5)。6.一种)。在图1中示出了两种温荞麦品种中所有这些阶段特异性/优选表达基因的热爱。6.b.这些结果表明,两个品种的船壳发育的每个阶段都有各自独立和共同的发育程序,也准确反映了内源mrna在船壳发育过程中的积累。
对两个品种各阶段特异/优先基因进行了基因本体(GO)富集分析。生物过程富集结果表明,细胞周期和细胞生物合成过程标志着船体发育的5dap2:图S4), 10dap显著而特异地由细胞壁和苯丙素代谢过程标记(图S4)。6.c),15个DAP主要由“硫代谢”标记(附加文件2:图S5), 20 DAP主要参与脂质代谢,响应生物和非生物胁迫和运输(附加文件2:图S6)。这些结果表明,这些阶段特异性/优先基因在胎儿荞麦和10 dap的壳体开发期间进行了阶段特异性功能,是季后赛荞麦壳的测定细胞壁生物发生中的关键阶段。
两个苦荞品种之间的差异
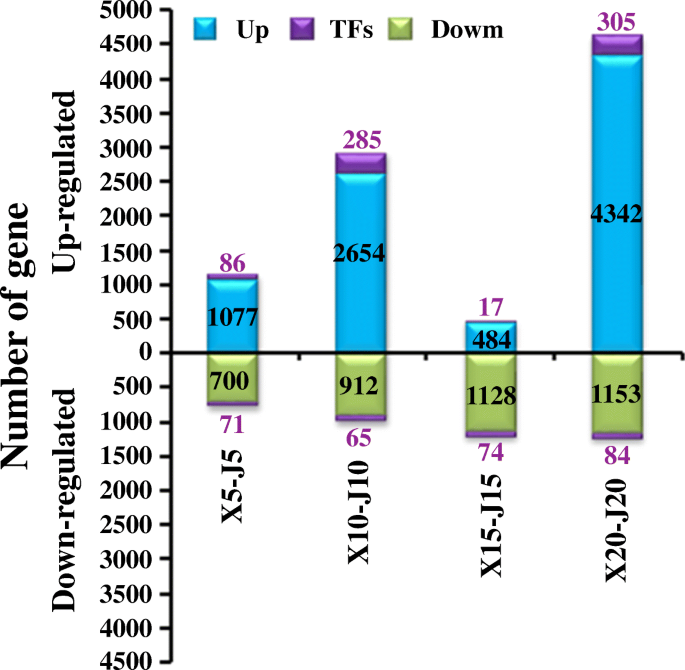
在船体发育的每个阶段确定了“XMQ”和“JQ”之间具有显着不同表达的基因。总共9250(包括693个TF编码基因)和4187(294个TF编码基因)基因分别在“XMQ”中分别在“XMQ”中的不同阶段显示出显着越来越高,表达,与“JQ”相比(图。7.).在两种品种之间,在20个DAP(5884)和10个DAP(3916)时发生两种最大的DEG(图。7.),虽然最少发生在15个dap。此外,大多数TF系列的一些成员在“XMQ”中显示出显着不同的表达,不同的TF系列的数量表现出明显的差异,这暗示它们在船体开发期间具有多样化的功能(附加文件2:图S7)。
为了进一步研究“XMQ”和“JQ”之间的deg的生物学功能,我们进行了GO富集分析。共有159、250、92和161个生物过程显著富集(P.< 0.05)分别在5dap, 10dap, 15dap,和20dap(附加文件1:表S2)。其中,一些生物过程特别/通常在船体发展的不同阶段被过度代表(附加文件1:表S2)。值得注意的是,氧化石墨烯术语,如植物型原生细胞壁生物发生(GO:0009833)、纤维素代谢过程(GO:0030243)、纤维素生物合成过程(GO:0030244)和纤维素分解代谢过程(GO:0030245)在5 DAP时独特富集,而半纤维素代谢过程(GO:0010410)和细胞壁修饰(GO:0042545)在10 DAP时特别富集(附加文件1:表S2)。此外,细胞壁生物发生(GO:0042546)和果实开裂(GO:0010047)在DAP的5个和10个时显著富集(附加文件1:表S2)。这些结果表明,5个DAP和10个DAP是确定两种季后荞麦品种之间船体差异的关键阶段。
通过基因共表达分析,对影响两种苦荞麦品种外壳差异的关键基因进行了鉴定和评价
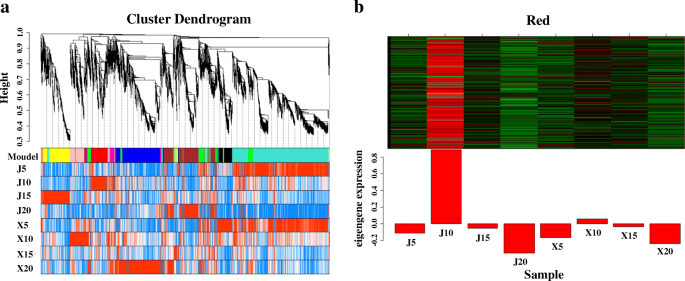
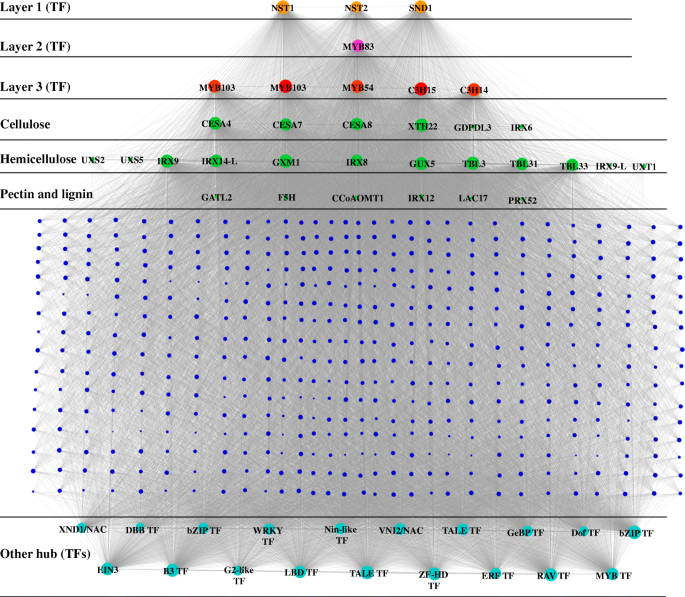
为了研究“XMQ”和“JQ”两种品种在船体发育过程中的基因调控网络(GRN),并识别影响“XMQ”和“JQ”船体差异的关键基因,利用9549个至少在一个船体发育阶段表达差异的基因进行了WGCNA研究。共鉴定了18个模块(34-3317个基因),并用不同颜色标记(图1)。8.一种)。用纤维素和半纤维素含量的这些模块的相关分析表明,Mebrown模块与纤维素含量呈现较高的相关性(R = 0.8,P.= 0.02)(附加文件2:图S8)。在该模块中,基因在20 dap的“JQ”船体中具有特异性高表达。发现该模块中没有基因参与基于同源注释的纤维素和细胞壁生物合成拟南芥这可能是由于两个品种在DAP 20时形成的外壳存在明显差异所致。考虑到(1)易剥皮是隐性性状,(2)难剥皮是显性性状,(3)10 DAP是两个品种之间的壳差异形成的关键阶段,我们推测在DAP 10点“JQ”中特异高表达的基因模块是参与两个品种不同壳形成的关键模块。结果发现,由533个基因组成的MEred模块符合这些标准(图。8.b)。基于同源诠释拟南芥在TAIR数据库中,该模块共鉴定出28个TF,代表17个TF家族。由于该模块中节点高度连接,所有28个TFs进一步被识别为hub TFs。这些枢纽tf包括同源的答:芥已知具有调控SCW生物合成功能的TFs,如第一层NAC调控因子(NST1.那第2号,NST3./SND1.),第二层调节器(MYB46/myb83)和第三层调节器(MYB54那MYB103那C3H14.,C3H15)(附加文件1:表S3)。的同源物XND1.和VNI2.,两个NAC TFs调节木质部导管形成,也被鉴定在这些枢纽TFs(图。9.额外的文件1:表S4)。此外,发现其他几个集线器TFS与答:芥TFs,参与乙烯信号转导(EIN3那ERF71.,rav.)、赤霉素生物合成(ATH1.),茉莉酸信号传导(WRKY50),以及多种激素反应(MIF2.).值得注意的是,该模块还鉴定了6个、12个、1个和5个SCW生物合成酶基因。9.额外的文件1:表S3),这是已知下游目标的同源物答:芥SCW生物合成TFs (NAC和MYB)和催化纤维素生物合成,半纤维素生物合成,果胶生物合成和木质素生物合成。在这些酶基因中,有四种纤维素生物合成基因(CESA4那CESA7那CESA8,XTH22)和八个半纤维素生物合成基因(IRX8.那IRX9.那IRX14-L那GXM1.那GUX5.那TBL3.那TBL31和TBL33)也被鉴定为该模块的枢纽基因(图。9.).通过比较,该模块中未发现果胶和木质素生物合成酶基因为hub基因(图1)。9.).
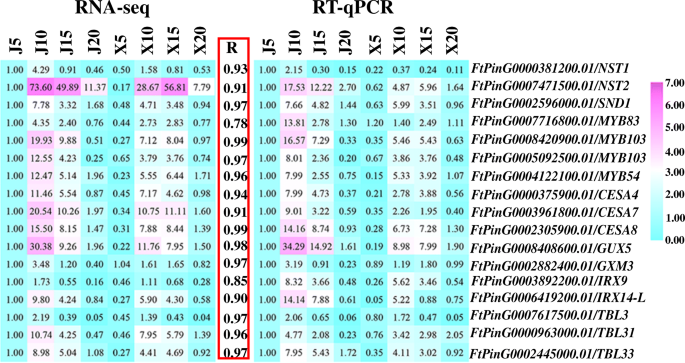
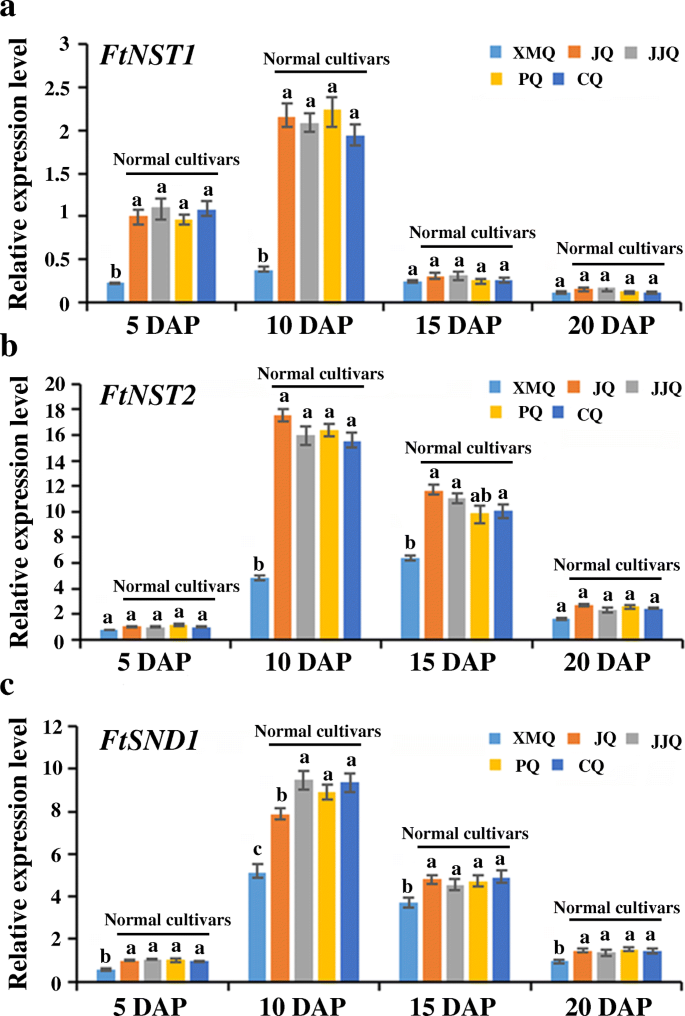
在5 dap或10 dap或5 dap和10 dap中的“xmq”中,ScW生物合成的最鉴定的集线器TF基因和酶基因的表达明显高于“XMQ”或10 dap和10 dap(附加文件)1:表S4,附加文件1:表S5),这与上述氧化石墨烯富集结果一致,再次说明了外壳早期发育阶段是决定两个苦荞品种之间外壳差异的关键。通过RT-qPCR分析,进一步证实17个scw相关基因(包括7个调控基因和10个酶基因)的表达与RNA-seq数据中观察到的表达高度相似(r≥0.78)。10.).这表明转录组数据的可靠性和所鉴定的基因导致两种温荞麦品种之间的船体差异。为了进一步验证这些鉴定的SCW生物合成基因在早期船体发育阶段的不同表达是大米荞麦和正常急性荞麦之间船体差异形成的原因,第一层调节剂的表达(NST1.那第2号,SND1./NST3.)SCW生物合成在其他三种正常的荞麦品种的船核中进行了测试。如图1所示。11.“XMQ”与正常苦荞品种间的表达量差异(倍数变化> 2)均发生在DAP的5d和10d。这说明这些SCW生物合成基因在壳发育早期的表达差异是造成水稻苦荞与正常苦荞壳差异的主要原因。
“在Silico”启动子分析Hub TFS和参与SCW生物合成中的酶基因显示,SCW相关的TFS结合位点存在
SCW相关的TF结合顺式CIS-ELEMIONS SNBE(NAC结合)[22.]和SMRE (MYB投标)[23.]在9个scw相关转录因子的启动子序列(NST1.那第2号那SND1./SNT3那MYB54那MYB46/myb83那MYB103(2),C3H14.,C3H15)、四种纤维素生物合成相关酶基因(CESA4那CESA7那CESA8,XTH22)、八种半纤维素生物合成相关酶基因(IRX8.那IRX9.那IRX14-L那GXM1.那GUX5.那TBL3.那TBL31,TBL33)和其他19个确定的枢纽TFs。结果表明,几乎所有scw相关的转录因子和酶基因的启动子序列中都存在SNBE和SMRE顺式元件(表1)1).另外,在其他19个集线器TFS的启动子序列中也发现了大量的SNBE CIS元素,而这些集线器TFS中没有或非常少的SMRE CIS元素(表1).由于乙烯反应EIN3在hub TFs中发现了TF,并且已经证明它在许多发育过程中发挥着重要的调控作用[24.,因此我们进一步研究了上述基因启动子序列中EIN3结合顺式元件。如表所示1,EIN3结合顺式与40个基因中的33中的启动子序列出现,其中在SCW生物合成的第一层NAC调节器中发现了最多的EIN3结合顺式元素(NST1.那第2号,NST3./SND1.)(15,15,9)和木质部导管形成调节剂XND1.(11),表明EIN3可能是SCW生物合成的第一层NAC调控因子的直接上游调控因子。
讨论
Tartary Buckwheat,一种高营养丰富的药用和食用作物,在全球范围内引起了全球的关注,并在食品市场中获得了普及。然而,正常荞麦品种的难以剥离偏离,严重限制了其食品加工行业的发展。幸运的是,在自然界中发现了一种非常罕见和容易脱落的甘皇荞麦,在自然界中发现了一种非常罕见和容易脱落的荞麦[10.].最近的几项研究表征了大米荞麦易剥离的遗传和部分生理机制[11.那12.那13.那18.那21.].然而,到目前为止,详细的生理,细胞,特别是分子,机制涉及容易脱皮的水稻-苦荞仍然很大程度上是未知的。在本研究中,我们通过细胞、生理和转录组的比较分析来了解水稻苦荞易脱皮的机制,并确定了导致水稻苦荞易脱皮的关键基因调控网络。
人工剥壳分析发现,稻苦荞“XMQ”比普通苦荞品种“JQ”的果皮脆性更大。在许多报道的脆性秆突变拟南芥,水稻,高粱和玉米,已经证明脆性是由还原纤维素,和/或半纤维素,和/或木质素含量[23.那25.那26.].在我们的研究中,我们发现“XMQ”的纤维素含量明显低于所有已确定的正常苦荞品种,这与之前的报道一致[21.].与部分正常苦荞品种相比,“XMQ”的半纤维素和木质素含量也明显降低。这些结果表明,“XMQ”船壳中纤维素、半纤维素和木质素含量的降低导致船体脆性,易于脱壳,而纤维素含量的降低可能是其主要原因。在以前的报道中发现,水稻苦荞和普通苦荞的纤维素含量在谷壳发育过程中维持生长[21.].在该研究中,我们获得了与“XMQ”和“JQ”中的纤维素和半纤维素含量的类似结果。此外,两种品种之间的纤维素和半纤维素含量的显着差异开始于10个DAP,并持续到20 dap。这些表明,玻璃纤维素和半纤维素含量在壳体开发期间动态地改变,早期的船体开发阶段是在形成水稻荞麦和正常的荞麦壳之间差异的关键期。最近,几项研究发现,大米荞麦的船体沟比正常的甘皇荞麦更薄,这表明大米荞麦的薄船船造成了易脱髓性的贡献[12.那13.那18.].在我们的研究中,我们还观察到“XMQ”的船体沟在船体发育的后期(15和20 DAP)的后期比“JQ”薄。此外,我们还发现,“XMQ”船体沟的硬化肌室细胞的细胞壁厚度显然比“JQ”薄。值得注意的是,在脆弱的秆突变体中拟南芥、水稻、高粱和玉米,以及还原纤维素、半纤维素和木质素的含量导致scw比野生型更薄[23.那25.那26.].因此,我们的这些发现表明,较低的壳纤维素和半纤维素含量也通过降低壳厚壁细胞的壁厚而导致了水稻苦荞的壳沟变薄。
与生理观察结果一致,我们的转录组数据也表明,早期的船体发育阶段是测定水稻荞麦和正常荞麦之间的船体差异的关键期。在答:芥还有一些其他植物,许多调节基因(主要NAC和MYB TFS)和SCW生物合成的结构基因已经鉴定,并且还建立了SCW生物合成的基因调节网络[26.那27.那28.那29.那30.那31].在我们的研究中,我们利用WGCNA对“XMQ”和“JQ”四个发育阶段的所有已鉴定的edg进行了鉴定,鉴定出一个模块,该模块的基因在DAP第10个阶段的“JQ”中表现出特异性的高表达。在这个模块中,9个确定的hub TFs被发现是同源的答:芥SCW生物合成调控基因,包括第一层的同源物(NST1.那第2号,SND1.)[32那33那34],第二层(MYB46/myb83)[35那36]和第三层监管机构(MYB54那MYB103那C3H14.,C3H15)[37那38].此外,24个同源物答:芥SCW生物合成催化纤维素,半纤维素,果胶和木质素生物合成的结构基因在本模组中鉴定出[26.那31],其中12个也被定义为枢纽基因。根据RNA-seq数据,这些已鉴定的SCW生物合成调控基因和结构基因在DAP 5、10或5、10时在“JQ”中的表达显著高于“XMQ”(倍数变化> 2),并通过qRT-PCR进一步验证。此外,第一层调节器(NST1.那第2号,SND1.)在早期船体发育阶段的其他三种正常季后荞麦品种中也明显较高。在拟南芥和其他植物,SCW生物合成调节或结构基因的突变会导致纤维素,半纤维素或木质素含量的严重减少和薄的SCW,最后导致塌陷的容器和脆性表型[26.那27.那28.那29.那30.那31那32那33那34那35那36那37那38].因此,结合上述细胞和生理数据以及这些转录组数据,我们的研究结果表明,水稻苦荞壳发育早期SCW生物合成调控基因和结构基因的低表达是导致纤维素和半纤维素含量降低的原因。这进一步导致了水稻苦荞的薄壳沟,厚壁细胞的薄壁,脆壳,最终导致其容易脱壳。
在拟南芥,SCW生物合成的第一层NAC和第二层MYB调节剂可以与其下游靶基因的启动子序列中的SNBE和SMRE序列结合,并直接激活靶基因的表达[22.那23.].在我们的研究中,我们发现在第二层调节器(MYB46/myb83)和一些其他集线器TFS,而第三层调节器和结构基因中的NO或更少数量的SNBE序列。相反,在第三层调节剂和结构基因中发现了较高数量的SMRE序列。在拟南芥, 这MYB46和myb83已被证明是第一层NAC调节器的直接目标[35那36,第三层监管机构是第二层MYB监管机构的直接目标[23.].因此,我们的研究结果表明,苦荞壳中存在一个保守的SCW生物合成基因调控网络。此外,其他已鉴定的hub TFs,在之前的研究中未显示参与SCW生物合成的功能表征,也可能通过作为第一层NAC调控因子的直接靶点,参与SCW生物合成的调控。值得注意的是EIN3在SCW生物合成模块中被确定为集线器TF等等EIN3绑定主题(15,15和9)[24.),这意味着EIN3可能是SCW生物合成中NAC第一级调控基因的直接上游调控基因。
结论
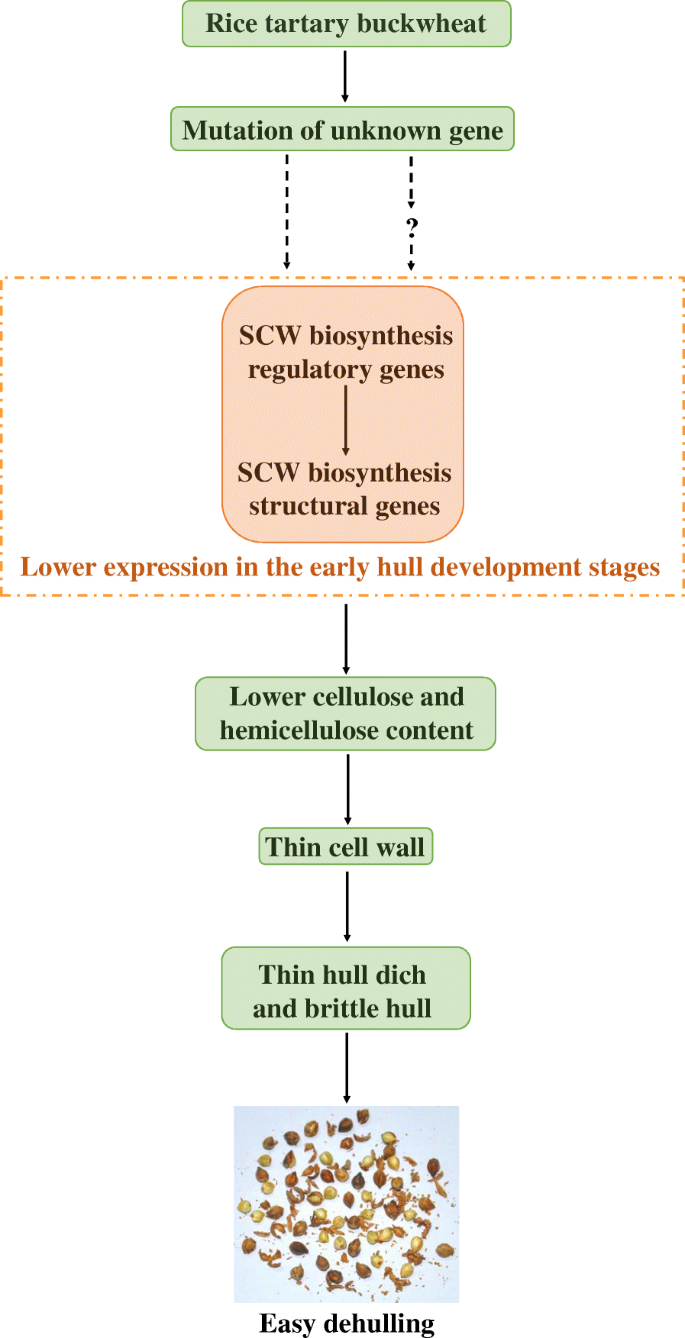
在本研究中,我们对比较细胞,生理,转录组和基因共表达网络进行了综合分析,调查水稻荞麦易于去壳的原因。我们的研究结果表明,通过降低细胞壁化学成分(纤维素和半纤维素)的含量,SCW生物合成调节和结构基因在水稻荞麦壳中的较低表达有助于其易于去剥离。在此基础上,它进一步导致了船体硬化细胞的细胞壁较薄,较薄的船体和较低船体机械强度的水稻荞麦。试图说明基于我们的结果绘制水稻荞麦易脱离机制的示意图(图。12.).这些发现有助于我们更好地了解水稻苦荞种子容易脱皮的细胞、生理和分子机制。此外,我们的数据也为未来通过基因表达干扰和基因编辑等基因操作进行正常苦荞品种的外壳改良提供了有价值的分子信息。
方法
植物材料和取样
来自我们自己的实验室的五个季后荞麦品种,包括易于剥离的米饭荞麦(“XMQ”)和四个难以脱落的正常桶荞麦(“JQ”,“JJQ”,“PQ”和“CQ的例子“),用于本研究。他们在贵州师范大学荞麦行业技术研究中心的实验领域生长(拉特。26°49'N,106°58'e,Alt。1245米),中国,2019年春季。鲜花被标记它们完全开放(完成授粉)。对于“XMQ”和“JQ”,为每种品种标记了超过15,000个鲜花。对于另外三种品种,为每种品种标记约2000个鲜花。所有五种品种的种子分别在5,10,15和20个系列中收集,分别具有三个生物重复。此外,还收获了所有五种品种的完全成熟的种子(未标记)。对于转录组分析,在渗透冰上剥离了四种差异发育阶段的“XMQ”和“JQ”的种子船体,立即在液氮中冷冻并储存在-80℃。对于石蜡截面分析,将种子样品立即浸泡在10%福尔马林中以在收集后固定组织。对于透射电子显微镜分析,在收集后立即在电子显微镜固定剂中立即浸泡种子样品。 For physiological analysis, seeds were dried at 60 °C to constant weight, and then the hulls were collected.
测量纤维素,半纤维素和木质素
以5个不同品种成熟种子的干皮为材料,测定了种子中纤维素、半纤维素和木质素的含量。此外,研究了“XMQ”和“JQ”种子在4个不同发育阶段的纤维素和半纤维素的动态积累。纤维素、半纤维素和木质素的测定基于Van Soest法[39].
扫描电镜,石蜡切片,透射电镜分析
通过扫描电子显微镜观察成熟的“XMQ”和“JQ”种子,如先前描述的[40].石蜡切片分析采用四个不同开发阶段的“XMQ”和“JQ”种子,处理方法如前所述[40].根据石蜡切片结果,利用CaseViewer软件对“XMQ”和“JQ”的船体沟槽厚度进行了测量。每个样本选取30个点测量船体沟槽厚度。使用“XMQ”和“JQ”的15颗DAP种子进行透射电镜分析,并由Servicebio有限公司(中国武汉)观察船体沟道。采用ImageJ软件测量“XMQ”和“JQ”厚壁组织细胞的细胞壁厚度。每个品种选择10个细胞,每个细胞测定10个点(均匀分布在细胞上)。
RNA测序,读图和DEGs分析
对于RNA-SEQ,每种样品的总RNA提取和图书馆结构如前所述研究中所述进行[2].采用深圳华大基因科技有限公司的BGISEQ-500系统对24个文库(8个样本,3个生物重复)进行测序,获得原始reads。然后使用Trimmomatic (v0.36)去除适配器序列和低质量reads,得到干净reads [41].干净的reads被绘制在苦荞基因组上(http://www.mbkbase.org/pinku1//)使用具有默认参数的Hisat2(v2.1.0)[1那42].映射的清洁读数进一步匹配Tarrary荞麦的参考基因序列(V2.2.5)[43[然后使用RSEM软件来计算基因表达值(FPKM,每百万次映射读数的记录长度每千碱基片段)[44].使用Pearson相关系数(PCC)确定生物复制之间的相关性。如前所述进行分层聚类分析(HCA)和主成分分析(PCA)[45].使用基于阈值的阈值(折叠变化)使用DESEQ封装来识别样品之间的显着参数≥1和fdr(假发现率)值<0.05 [2].通过如前所述的阶段特异性(SS)评分算法鉴定了两种品种中的阶段特异性/优先基因[45那46].我们将SS阈值设置为0.5,用于检测两种品种的特异性阶段/优先基因。
致富浓缩和基因共表达网络分析
根据Garg等人的描述对阶段特异性/优先性基因和DEGs进行GO富集分析[45].使用Cytoscape 2.8.2可视化氧化石墨烯富集网络。基因共表达网络分析,基于Langfelder和Horvath方法进行WGCNA [47].
识别船体差异形成的关键模块和基因
基于以下综合考虑鉴定了船体差异形成的关键模块:(1)易脱髓性状(隐性性状),(2)生理分析的特征,(2)所有表达基因的PCA分析。关键模块中的所有基因都在TAIR数据库中进行NR注释和同源性查询拟南芥鉴定与船体差异形成有关的基因。利用Cytoscape 2.8.2可视化分析了所鉴定关键模块的基因调控网络。
RT-QPCR分析和相关性验证
采用qRT-PCR方法,对17个鉴定出的导致船体差异形成的关键基因在“XMQ”和“JQ”中的表达进行了验证。此外,筛选出的17个关键基因中,3个枢纽转录因子(hub TFs)在其他3个正常苦荞品种的壳中也进行了表达检测。qRT-PCR分析方法如Li等[48].以苦荞肌动蛋白7基因为内参。本研究使用的引物列于附加文件1:表S6。
统计分析
数据采用单因素方差分析,然后采用Tukey 's检验或Student 's t检验,使用SPSS 18.0软件进行统计分析。一个P.- 将<0.05的值被鉴定为统计学上显着的差异。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。所有来自RNA-seq的原始数据都可以在NCBI的测序读取档案(SRA)中获得,生物项目编号为PRJNA666523。RNA-seq数据的短读档案可以在编号下面找到:Srr12764403、srr12764404、srr12764405、srr12764406、srr12764407、srr1276440408、srr12764409、srr12764410、srr12764411、srr12764412、srr12764413、srr12764414、srr12764415、srr12764417、srr12764418、srr12764419、srr12764420、srr12764421、srr12764422、srr12764423、srr12764424。
缩写
- DAP:
-
几天后授粉
- WGCNA:
-
加权基因共表达网络分析
- 可见:
-
差异表达基因
- FDR:
-
假发现率
- FPKM:
-
每千碱基的转录片段每百万次读取
- 标准铜线:
-
次生细胞壁
- QRT-PCR:
-
定量实时聚合酶链反应
- PCC:
-
皮尔森相关系数
- HCA:
-
层次聚类分析
- 主成分分析:
-
主成分分析
- SS:
-
阶段特异性
- 去:
-
基因本体论
- TFS:
-
转录因素
参考文献
- 1。
张l,李x,ma b,gao q,du h,han y,李y,曹y,qi m,zhu,zhhou,ma m,liu l,周j,nan c,qin y,王j那Cui L, Liu H, Liang C, Qiao Z. The tartary buckwheat genome provides insights into rutin biosynthesis and abiotic stress tolerance. Mol Plant. 2017;10:1224–37.
- 2。
代谢谱分析和转录组分析为苦荞种子发育过程中黄酮类化合物的生物合成提供了新思路。Fagopyrum tataricum).JAgric Food Chem。2019; 67:11262-76。
- 3.
苦荞黄酮通过MAPK信号通路保护肝细胞免受高糖诱导的氧化应激和胰岛素抵抗。食品功能。2016;7:1523-36。
- 4.
苦荞黄酮对高氧化三甲胺(TMAO)所致小鼠血管功能障碍和肝损伤的保护作用食品功能。2015;6:3359 - 72。
- 5.
Lee CC,Shen Sr,Lai Yj,Wu Sc。芦丁和槲皮素,从酒后荞麦的生物活性化合物,防止肝脏炎症损伤。食物功能。2013; 4:794-802。
- 6.
Giménez-Bastida JA, Zieliński H.荞麦作为功能性食品及其对健康的影响。农业化学学报。2015;63:7896-913。
- 7。
刘毅,杜Wl,吴ys。高层荞麦壳体方法优化的实验研究。JAGRIC MECH RES。2008; 12:131-3(中文)。
- 8。
李H,胡锦涛,李y,尚福,卞J。季后赛谷物谷物及发芽急荞麦籽粒加工研究。SCI Tech Food Ind。2011; 12:362(中文)。
- 9。
陈W,杜W,郑D,刘G.荞麦屋壳的实验研究与参数分析。J中国农业大学。2017; 7:107-14(中文)。
- 10。
Campbell C.荞麦作物改善。Fagopyrum。2003; 20:1-6。
- 11.
杂交水稻和普通苦荞和外壳特征的F2隔离,proc 10th int symp。荞麦;2007. p。152-4。
- 12.
陈秋芳,陈庆军,史天祥,黄坤峰,梁立波,饶清泉,唐磊,张庆东。苦荞厚壳性状的遗传及其与产量因子的关系。作物学报。2015;2:27-31。
- 13。
崔ys,王y,杨lj,吴cx,周p,ran p,chen qf。果壳率的遗传分析及Tarrary Buckwheat的相关性状。庄稼。2019; 2:51-60(中文)。
- 14.
Fukuie Y,Shimoyama H,Morishita T,Tsugama D,Fujino K.一个推定钦am同源基因(ortholog)是决定苦荞(tartar荞麦)脱皮容易程度的候选基因(Fagopyrum tataricum).足底。2020;251:85。
- 15.
张玲,马敏,刘丽。苦荞麦采后易脱皮基因座的鉴定。基因。2020;11:459。
- 16.
刘敏,傅强,马智,孙伟,黄磊,吴强,唐智,布涛,李超,陈辉苦荞MADS基因家族及去壳基因的全基因组研究(英文)Fagopyrum tataricum).Planta。2019; 249:1301-18。
- 17。
太阳W,金X,MA Z,陈H,刘M.基本螺旋环 - 螺旋(BHLH)基因家族在季后遇荞麦(Fagopyrum tataricum):全基因组鉴定、系统发育、进化扩展及表达分析。国际生物医学杂志。2020;155:1478-90。
- 18。
Li C,谢Z,王Y,Lu W,Yin G,Sun D,Ren C,Wang L.种子壳体厚度的相关性和遗传分析塔尔荞麦(Fagopyrum tataricum(l)Gaertn)。Sci繁殖。2019;69:464 - 70。
- 19。
关键词:荞麦,纤维含量,胆汁酸,消化吸收abstract:Food Res Int. 2012; 47:279-83。
- 20.
Biel W, Maciorowski R.荞麦粗麸、麸皮和麸皮的化学成分和营养品质评价(fagopyrum esculentumMöenenchL.)。ITAL J FOOD SCI。2013; 25:384-9。
- 21。
歌曲C,MA C,Xiang D.木质素和纤维素积累的变化以及种子船体的代谢变化提供了巨肉荞麦种子的剥离特征的洞察。int j mol sci。2019; 20:524。
- 22。
钟克,李c,叶zh。次墙NAC主台件直接目标的全局分析拟南芥.莫尔植物。2010; 3:1087-103。
- 23。
钟锐,叶志华。MYB46和myb83与SMRE位点结合并直接激活一系列转录因子和次生壁生物合成基因。植物生理学杂志,2012;
- 24。
Chang KN,钟,Weirauch MT,宝贝G,裴里荣拉M,李H,黄党卫军,施密茨RJ, Urich妈,郭D,打破传统小,乔H,杨,贾玛利,陈H, Ideker T,任B, bar - joseph Z,休斯TR,艾克尔JR .颞转录响应乙烯气体驱动生长激素cross-regulation拟南芥.Elife。2013;2:e00675。
- 25。
胡伟,张涛,胡忠,王立强。草类细胞壁生物合成与调控研究进展。江苏农业科学,2018;34:472-80。
- 26.
钟朗,崔德,叶zh。二次细胞壁生物合成。新植物。2019; 221:1703-23。
- 27.
Rao X, Dixon RA。草类次生细胞壁生物合成转录调控的当前模型。植物生态学报,2018;
- 28.
张家,谢米,托斯康·乔,大都会,陈杰。木质植物中二级细胞壁生物合成转录调控的最新进展。前植物SCI。2018; 9:1535。
- 29。
Meents MJ,Watanabe Y,Samuels al。二次细胞壁生物合成的细胞生物学。Ann Bot。2018; 121:1107-25。
- 30.
McCahill IW,Hazen SP。用机构混合的细胞壁增厚调节。趋势植物SCI。2019; 24:853-66。
- 31.
Zarra I,Revilla G,Sampedro J,Valdivia Er。二次细胞壁的生物合成和调节。在:Cánovasf,lüttgeu,leuschner c,risueñomc,编辑。植物学的进展,卷。81. Cham:Springer;2019年。
- 32.
Mitsuda N,Seki M,Shinozaki K,Ohme-Takagi M. NAC转录因子NST1.和第2号的拟南芥调节次壁加厚,并且需要脱裂。植物细胞。2005; 17:2993-3006。
- 33。
Mitsuda N, Iwase A, Yamamoto H, Yoshida M, Seki M, Shinozaki K, Ohme-Takagi M. NAC转录因子,NST1.和NST3.,是在木质组织中形成二级墙的关键调节因子拟南芥.植物细胞。2007;19:270 - 80。
- 34。
钟锐,叶志华。的拟南芥NAC转录因子NST2与SND1和NST1一起使用,以调节花序茎的纤维中的二次壁生物合成。植物信号表现。2015; 10:E989746。
- 35。
Zhongardson ea,ye z。的MYB46转录因子是SND1.调节次生壁的生物合成拟南芥.植物细胞。2007; 19:2776-92。
- 36。
麦卡西RL,钟锐,叶志辉。myb83直接目标是什么SND1.并冗余行为MYB46在次级细胞壁生物合成的调节中拟南芥.植物细胞生理学。2009;50:50 - 64。
- 37。
钟锐,李诚,周杰,麦卡西,叶志辉。一组转录因子参与调节次生细胞壁的生物合成拟南芥.植物细胞。2008;20:2763 - 82。
- 38.
柴G,kong y,zhu m,yu l,qi g,唐x,王z,cay,yu c,周g。Arabidopsis C3H14和C3H15在二次壁增厚和花药发育的调控中具有重叠作用。实验机器人。2015;66:2595-609。
- 39.
范多斯尔PJ,葡萄酒吧。高锰酸盐酸洗涤剂纤维木质素和纤维素的测定。J关联农业化学。1968年; 51:780-5。
- 40.
李鹏,刘啊,谭某,陈俊,朱m,lv y,liu y,yu s,张w,zhang c,cai h.flite culm 1编码高粱中次级细胞壁纤维素生物合成的眼镜蛇样蛋白。植物细胞生理。2019; 60:788-801。
- 41.
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30:2114-20。
- 42.
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12:357-60。
- 43.
Langmead B, Salzberg SL.快速缺口读对齐领结2。Nat方法。2012;9:357-9。
- 44.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。
- 45。
通过对鹰嘴豆的转录组和共表达网络的分析,揭示了鹰嘴豆种子发育和种子大小/重量决定的特异性分子特征。植物j . 2017; 91:1088 - 107。
- 46。
关键词:转录组,机器学习,差异网络分析拟南芥.植物细胞。2014;26:520-37。
- 47。
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9:559。
- 48。
李H,LV Q,邓俊,黄杰,蔡F,梁开,陈Q,王Y,朱L,张X,陈Q.转录组分析揭示了普通荞麦中的关键种子开发基因(Fagopyrum esculentum).int j mol sci。2019; 20:4303。
确认
不适用。
资金
这项工作由中国 - 贵州省政府联合计划(U1812401),中国国家自然科学基金(31860408,31760494和31660424),贵州省的科技基金(Qiankehejichu [2019]1235),贵州荞麦种质粮食养殖重点实验室建设专用基金(黔济河KY [2017] 002),贵州师范大学培训计划(Qiankehepingtairencai [2017] 5726)和初始基金贵州师范大学的医生研究(11904/0517051)。
我们感谢所有经济支持的基础。资助机构为研究项目提供资金支持,但不参与研究的设计、数据收集、数据分析或手稿的撰写。
作者信息
从属关系
贡献
HYL和QFC设计了该研究。CXW进行了实验。HYL、CXW和QYL进行数据分析。HYL写了手稿。TXS、QJC、QFC对稿件进行审核和修改。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
XMQ和JQ不同样本中RNA-SEQ数据的概述统计数据。表S2。XMQ与JQ船体之间的富集的富集列表在四个不同的发展阶段。表S3。鉴定鉴定模块中SCW生物合成的调节和结构基因。表S4。鉴定出的SCW生物合成调控和结构基因以及其他枢纽转录因子在meered模块中的表达值(FPKM)。表S5。研究了XMQ和JQ两种不同发育阶段SCW生物合成和其他中心转录因子的调控和结构基因的折叠变化。表S6。QRT-PCR分析序列引物。
附加文件2:图S1。
XMQ和JQ中每个样本的三个生物重复转录组之间的相关性热图。图S2。表达基因(A)的数量和在XMQ和JQ的不同样品中以不同水平(基于FPKM)(B)表示的基因的比例。图S3。对XMQ和JQ船体发展四个阶段的RNA-seq数据进行Pearson相关分析(A)和主成分分析(B)。图S4。XMQ和JQ壳发育5dap优先表达基因的GO富集图谱(生物过程)。图S5。XMQ和JQ壳发育15dap优先表达基因的GO富集图谱(生物过程)。图S6。在XMQ和JQ中20 dap的船体发育中优先表达基因的富集图(生物过程)。图S7。不同TF家族的基因在种皮发育过程中出现或下调的数量。图S8。模块 - 纤维素和半纤维素含量缔合(A)和与纤维素含量高相结合的模块的基因表达热图(B)。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
李海燕,吴翠霞。QY, Lv。et al。比较细胞、生理和转录组分析揭示了水稻-苦荞(Fagopyrum tararicum.).BMC植物杂志20.505(2020)。https://doi.org/10.1186/s12870-020-02715-7
收到了:
公认:
发表:
关键字
- Rice-tartary荞麦
- 易于脱落
- 赫尔开发
- 比较转录组
- WGCNA
- 细胞壁
- 纤维素
- 半纤维素
- 分子机制