抽象的
背景
转录因子叫参与植物发育过程,通过结合DNA调控区调节下游基因来应对环境胁迫。然而,关于叫基因芸苔栗鸟是可用的。参考基因组的释放B. Napus.提供了执行基因组的良好机会叫油菜的家族基因。
结果
在这项研究中,96叫确定了在19染色体上随机分布的基因B. Napus.,该基于系统发育分析及其域结构分为四个亚壳。在其GATA结构域,结构和基序组合物方面,BGGATA的氨基酸在四个亚壳中具有明显的分歧。基因复制和同步之间的基因组B. Napus.和A. Thaliana.还分析了向进化特征提供见解。而且,BnGATAs在各种组织和不同的非生物应激下显示出不同的表达模式。单核苷酸多态性(SNPS)分布BnGATAs在核心收集种质中可能与不同基因型的环境压力条件下的功能差异有关B. Napus..
结论
研究了96的基因组结构,进化特征,表达模式和SNP分布的研究bngatas。结果丰富了我们对叫油菜籽的基因。
背景
转录因子(Transcription factors, TFs)通过识别和结合调控基因表达独联体- 靶基因启动子区域的元素[1].转录因子在植物发育过程、激素信号通路和抗病反应中发挥着重要作用。有几个著名的转录因子家族,包括怀疑,MYB(V-myb禽成髓细胞增生病毒癌基因同源物),含有DREB(Dehydration-responsive元件结合蛋白),Bzip.(基本区域 - 亮氨酸拉链),疯了和叫(gata结合因子)。其中,叫基因被认为是许多生物过程的重要调控因子,如花的发育、碳和氮代谢[2].的叫基因可以识别和结合(T / A)GATA(A / G)序列以调节其下游基因的转录水平[3.,4].GATA蛋白的DNA结合域包含IV型锌指结构C-X2cx17-20cx2和一个保守的基本跟随区域,其中大部分具有C-X特征2cx18.cx2-c或c-x2cx20.cx2-C锌指域[2,3.,5,6].一般来说,这叫家族基因可以分为四个亚属,如亚家族I,II,III和IV拟南芥基于系统发育关系,DNA结合结构域和内部外显子结构[2,5,7,8,9].
许多研究已经证明了叫TFs负责植物的生长发育、开花、叶绿素合成、绿化和衰老。例如,函数的丢失和过表达叫基因如GNC(叫,硝酸盐诱导,碳代谢)和GNL(GNC- 样)可以改变开花时间和叶绿素合成A. Thaliana.[10,11,12,13].GNC调节下游基因,如光不稳定因子进行通信(光敏色素相互作用的因素)控制叶绿体生物发生和气孔指数[10,13].之间的交叉压抑相互作用GNC/GNL和疯了转录因子SOC1(Constans1过表达抑制因子)影响花期[12,13].除此之外,GNC和GNL通过由Della和Della和Charmulated调节的Gibberellin信号传导的相当大的阻遏物论坛监管机构(10,14].此外,生长素反应因子ARF2和ARF7可以压制表达GNC和GNL基因[10,11,12,14].在芸苔栗鸟, 一种叫成员BnA5。ZML1据报道是病耻感相容因子[15.].PdGNC在杨树在光合作用和植物生长中起着至关重要的作用[16.].在小麦中,过表达Tazim-A1,一名成员叫家庭,导致开花的延迟和数千核重量的减少[17.].
的叫TFS还应对植物中不同的非生物胁迫。在冷应激下,表达水平GNC和GNL显着增加,而幼苗存活率在过度表达系中升高GNC或GNL基因A. Thaliana.[18.].此外,在低温下,GATA9基因表现出显著的表达变化,激活其下游基因Vigna Subterranea[19.].在盐度压力下,osgata8.过度表达线显示出比野生型和净沥青幼苗的生物质积累和光合效率更高[20.].在大豆幼苗中,表达gata44.和GATA58在低氮沉降条件下,基因表达显著下调[21.].在b . juncea29.叫根据RNA-seq实验,基因通过转录水平对高温和干旱处理做出反应[22.].
菜籽是一种重要的油料作物。到目前为止,Darmor-BZH.(冬季生态型号),鸟覆(冬季生态型),中顺11被成功测序和组装[23.,24.,25.].最近,我们对991份油菜种质资源进行了重测序,建立了一个全球油菜核心种质[26.,27.].在这项研究中,96叫鉴定基因并表征在基因组中B. Napus..此外,分析了这些基因的表达模式和SNP分布。本研究的主要目的是(i)研究基因/蛋白序列和遗传结构的差异bngata.S;(ii)确定组织和非生物胁迫下的基因表达模式;(iii)识别SNPbngata.s在全球核心系列中。这些结果丰富了我们的知识bngata.基因,为油菜分子特性研究提供基础,促进油菜分子标记辅助育种。
方法
的识别叫在B. Napus.
研究中GATA家族成员的氨基酸序列A. Thaliana.(表S1,[2),以及gata的同源物B. Napus.对油菜品种“Darmor-BZH.”(v4.1基因组,http://www.genoscope.cns.fr/brassicanapus/data/).采用隐马尔可夫模型(HMM)和BLASTP程序对BnGATA蛋白进行鉴定。GATA锌指结构域(PF00320)的HMMER图谱来自Pfam数据库(http://pfam.janelia.org/)用于执行本地BLASTP(E-VALUE-20)搜索。在智能数据库中确认了gatas的候选序列(http://smart.embl-heidelberg.de/)[28.]、NCBI保存域数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)[29.)和pam数据库[30.].根据亚科成员在染色体上的排列顺序进行命名B. Napus.基因组(表S2).利用ExPASy (ExPASy)软件计算了GATA蛋白的氨基酸长度、分子量(MW)和等电点(pI)。http://www.expasy.ch/tools/pi_tool.html.).
系统发育分析及分类叫
使用默认参数的Clustalw进行Gata氨基酸的多次对准[31.].利用MEGA 7.0采用Neighbor-Joining (NJ)方法构建系统发育树[31.,32.],具有以下参数:Poisson模型,成对删除和1000个引导复制。来自盖塔蛋白的大型NJ树A. Thaliana.和B. Napus.也是使用MEGA 7.0构建的。的叫家庭成员的A. Thaliana.被提到分类叫家庭成员B. Napus..此外,使用Mega 7.0和Genedoc软件鉴定了蛋白质中保守的Gata锌指结构域。
基序和基因结构
基因结构显示服务器在线程序(GSDS:http://gsds.cbi.pku.edu.ch),分析了所有的外显子-内含子结构叫基因[33.].为了识别GATA蛋白中的保守基序,主题诱导的多期预期最大化(MEME)在线计划(http://meme.sdsc.edu/meme/itro.html.)执行,参数如下:重复次数=任意,最大图案数= 10;最佳基序长度= 6 ~ 100个残基[34.].
染色体定位和基因复制分析
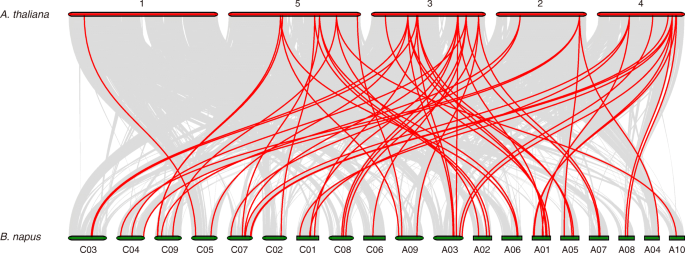
96的分布叫确定的基因B. Napus.根据他们的物理位置信息从参考基因组数据库()根据其物理位置信息映射到19个染色体(http://www.genoscope.cns.fr/brassicanapus/data/),并使用Circos软件可视化[35.].识别基因复制,叫使用BLASTP对准基因,其中E-value为1E-10和MCSCanx,以分类包括分段和串联复制的复制模式[36.].串联重复的定义是在300kb以内的一个染色体区域包含两个或两个以上的基因[37.].此外,Synteny的关系叫基因组之间的基因B. Napus.和A. Thaliana.根据朱等人建造。[38.].
的表达模式bngata.基因B. Napus.
的表达式模式bngata.基因B. Napus,来自12个组织的转录组数据B. Napus.2017年发布的品种“中双11”[25.]从NCBI (ID: PRJNA394926)中获取。我们计算并使用每个组织的三个生物重复的平均表达水平来显示它们的表达模式。此外,转录组数据与三个生物学复制B. Napus.在脱水、盐、ABA和冷胁迫条件下,参照Zhang等[7,9].基因表达量低于0.5或高于2.0的倍数变化被认为是差异表达基因(DEGs)。这些转录组数据在项目编号:CRA001775 (https://bigd.big.ac.cn/).表达的标准化叫使用DSEeq2 R包和热图和聚类分析叫使用tbtools软件构建[39.].
单核苷酸多态性的分布叫在一个核心集合B. Napus.
揭示基因组序列的自然变异叫基因B. Napus,的编码区中的snp叫基因在全球集合中确定B. Napus.鉴于我们之前研究的基因组重新排序数据,300种种质的种质[26.,27.].采用MAF大于5%、缺失率小于50%的高质量SNPs进行进一步分析。
结果
GATA蛋白的鉴定和系统发育分析B. Napus.
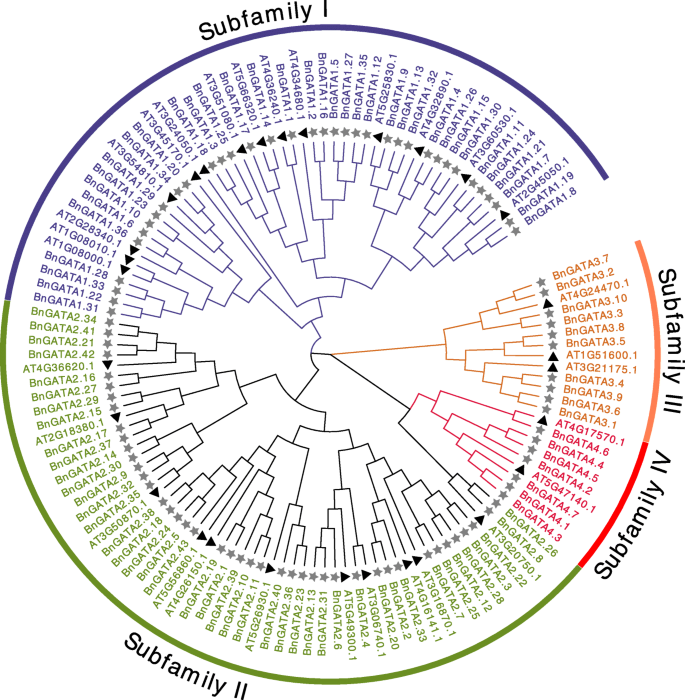
共鉴定出96个具有GATA锌指结构域的蛋白为GATA家族成员B. Napus.(表S2).保留每个蛋白的最长序列,这些蛋白的信息列于Table中S2和表S3.96个GATA蛋白的长度范围为101-576氨基酸(AA),分子量为11.17至64.59kDa。
分析GATA蛋白之间的关系B. Napus.和A. Thaliana.,利用这些GATAs的全长氨基酸构建了一个无根树。总共30种蛋白质来自A. Thaliana.和96个蛋白质来自b .napus.被确定(无花果。1).在答:芥,将gatas聚集成四个亚属[2].这里有96个gataB. Napus.对应分为4个亚科(图。1).其中,36个成员属于I亚家族,43个成员属于II亚家族,10个成员属于III亚家族,7个成员属于IV亚家族。每个bnata蛋白只有一个GATA结构域。值得注意的是,GATA结构域主要位于I亚家族的160 - 230aa位置;II亚科30-150或200-260 aa;III亚科190-330 aa, IV亚科7-40 aa(表S2).
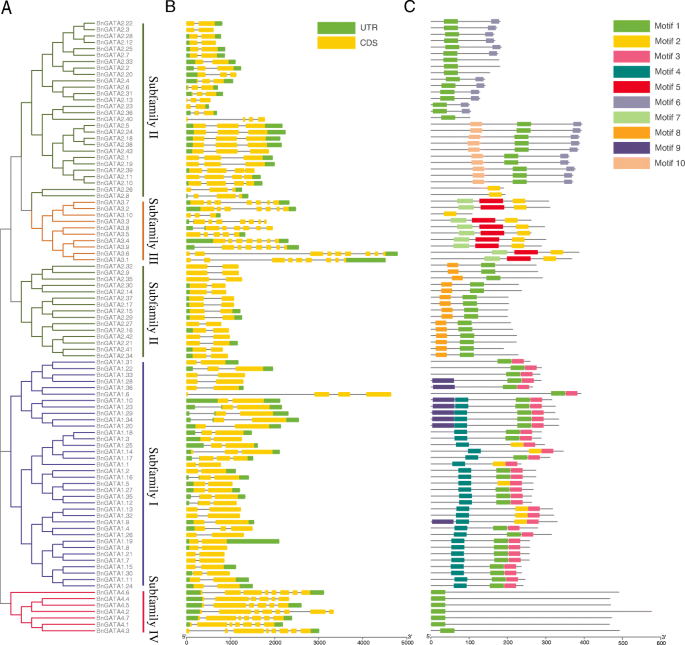
基因结构和蛋白质主题BnGATAs
如图所示。2B,确定一至九个外显子bngata.基因。类似于叫基因A. Thaliana.,bngata.亚家族I和II的基因除了2 ~ 3个外显子外bngata1.6(4个外显子),亚家族III的3至9个外显子,亚家族IV的6至8个外显子(图。2b)。
基序分析显示了GATA蛋白的结构示意图(图1)。2C)。10种保守主题的细节列于补充表中S4.在所有GATA蛋白中检测到基序1和基序2,主要在亚家族I的构件中鉴定在亚家族II的构件中的基序3,4和9中,而MOTIF 5在亚家族III的成员中鉴定了7个。除了图案1和2,亚家族IV中没有发现其他基序(图。2c).总之,一个亚科内相似的基因结构和保守的基序支持了系统发育分析的亚科分类结果。
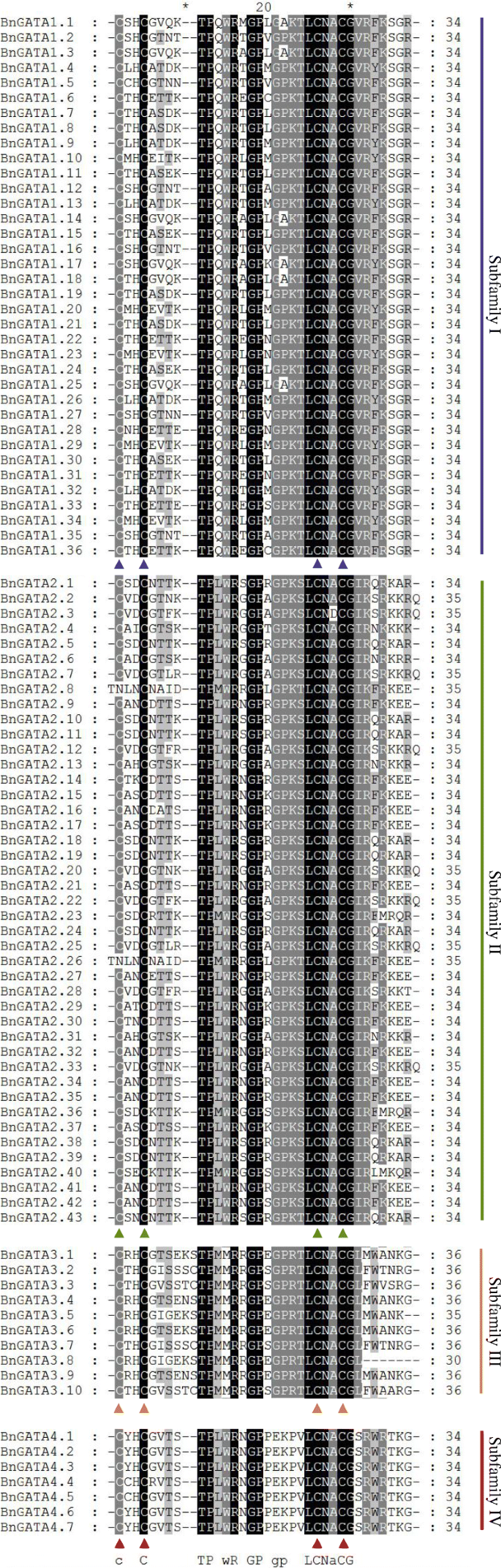
与GATA域分析结果相似A. Thaliana.[2],在Zinc手指环中含有18个残留物的亚属II,II和IV中的BGATAS(C-x2cx18.cx2-c),除bngata2.8和bngata2.26之外,其中n-x2cx18.cx2-c出现而不是c-x2cx18.cx2(图c)。3.).Subfamily III中的所有10个BGATAS在锌手指中的第二和第三Cys残留物之间含有20个残基(C-x2cx20.cx2-C)。此外,几个氨基酸位点在诸如LCNACG残基的GATA域中显示出高储蓄(图。3.).
分布,基因组同步和基因重复bngata.基因
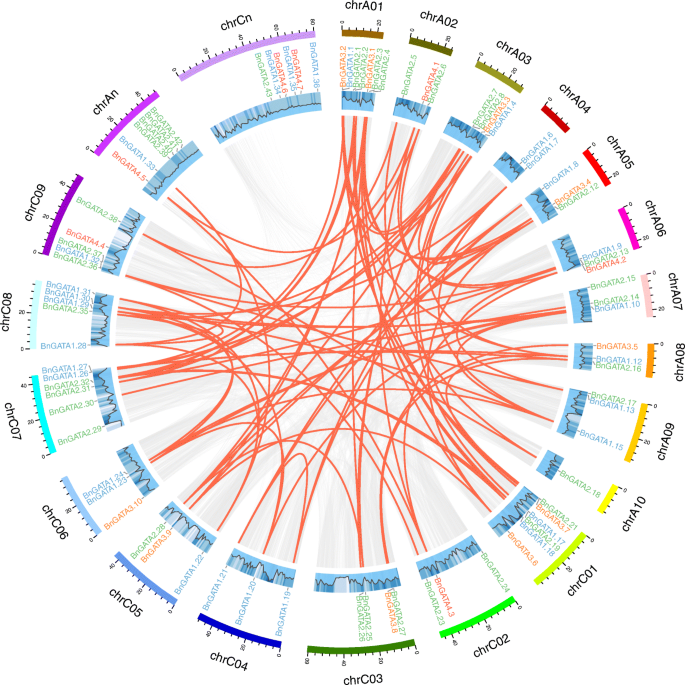
总共是96个中的84个bngata.基因分布在19条染色体上,其余12个基因被分配到随机片段中(6个在AAnn亚基因组上,6个在CCnn亚基因组上)。4和表S2).在84中BnGATAs, 46个基因位于AA亚基因组上,包括16个I亚家族基因、22个II亚家族基因、5个III亚家族基因和3个IV亚家族基因;而CC亚基因组上有50个基因,包括20个I亚家族基因、21个II亚家族基因、5个III亚家族基因和4个IV亚家族基因(图1)。4).一些bngata.基因形成为相同染色体中的簇,例如bngata1.32和BnGATA2.36(图。4).然而,大多数bngata.基因随机分布在AA或CC亚群上。此外,CHR A1显示最高密度bngata.7个基因来自亚家族II和III(图。4).
使用BLAST和MCSCANX方法,82个分段复制事件叫s被识别(图。4和表S5).在这些事件中,80个重复事件发生在染色体上,而2个重复事件发生在染色体内(bngata1.28 / bngata1.31,bngata1.19 / bngata1.21).此外,在AA亚基因组上发生14个复制事件,CC子组的14个事件,以及AA / CC子组织的50个事件。结果表明了一些bngata.在基因重复期间,基因可能是在基因重复期间,并且节段重复事件可以在扩展中发挥关键作用bngata.基因B. Napus..
更好地了解的演变bngata.基因,同时的叫基因对之间的基因对B. Napus.和A. Thaliana.建成了(图。5和表S6).在这里,55BnGATAs表现出同情的关系AtGATAs.一些AtGATAs与一个以上的同源拷贝有关吗B. Napus。例如,AT2G45050显示了同步关系BnGATA1.7、BnGATA1.8 BnGATA1.19和bngata1.21(表S6).此外,共线基因对叫高度保守的共连块上固定的基因也被检测到(图。5和表S6).
表达谱的BnGATAs在不同的组织中
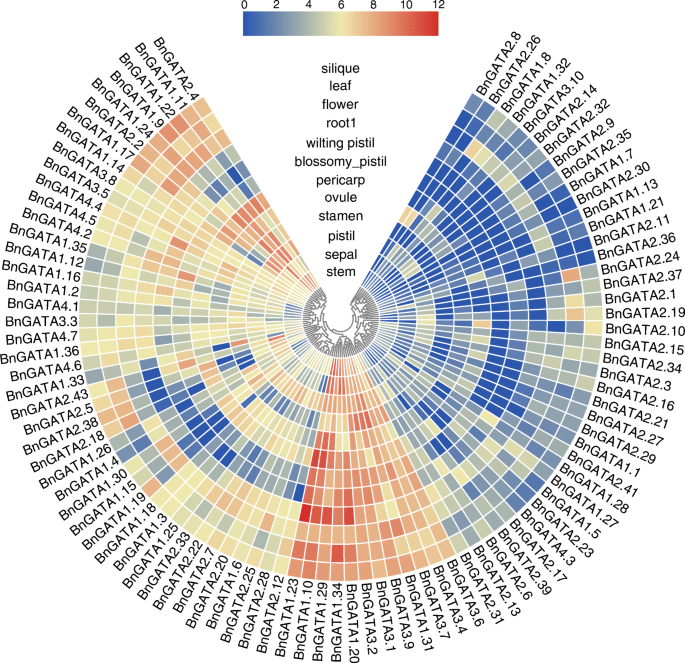
96的表达轮廓bngata.比较12种菜单ZS11组织中的基因(图。6和表S7).根据其表达模式的差异,将这些基因分为三组。具体来说,共有39个基因被归为第1组,在检测的组织中表现出低表达水平或未检测到。12BnGATAs属于这些组织中具有高表达水平的第2组。同时,43BnGATAs包括在第3组中,显示跨组织的优先表达谱。例如,BnGATA1.11在萎凋的雌蕊中不表达,在开花的雌蕊和根中表达量低,但在其他组织中表达量高(图。6和表S7).
组1包含9、28、1和1个来自4个亚家族的基因;组2分别有6个和6个基因来自I亚家族和III亚家族,组3分别有21个、13个、3个和6个来自4个亚家族(表S7).有趣的是,人们发现BnGATAs亚家族II在所有组织中均低表达,但亚家族III成员在所有组织中均高表达(图。6和表S7).表达模式叫不同组织中的基因表明不同亚属之间的功能分歧。
表达谱的BnGATAs以应对非生物胁迫
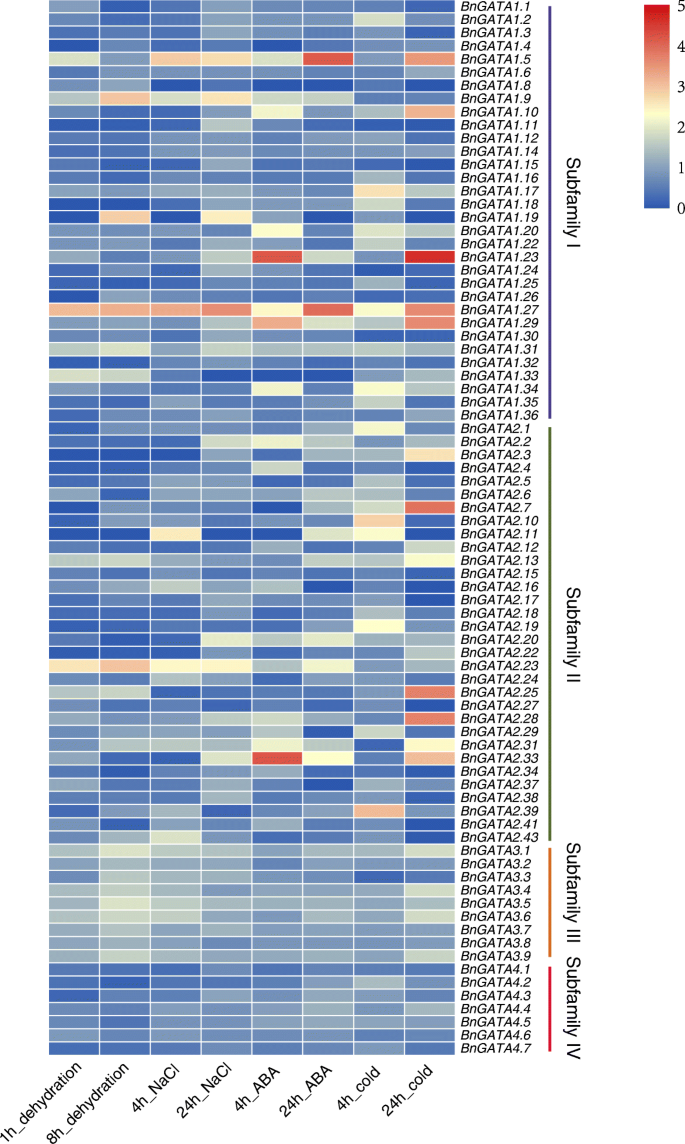
进一步,我们研究了表达模式bngata.在各种非生物胁迫下的基因,包括干旱,盐度,ABA诱导和冷应力(图。7和表S8).其中,在脱水和盐胁迫下,III亚家族成员的大部分基因显著上调,而IV亚家族成员的大部分基因下调。bngata1.27,bngata2.23和bngata3.1.是上调的,但是bngata1.8盐处理后未表达。在脱水压力下,bngata1.9,bngata1.27和BnGATA2.23表达量增幅最大,而BnGATA1.11和BnGATA2.5显着下降。bngata1.27和bngata2.33在ABA诱导下表达量较高BnGATA2.5down-expressed。冷应激下,bngata1.23和bngata1.29是显着上调的,而BnGATA1.11和bngata1.24被显著抑制。值得注意的是,bngata1.27被所有非生物应激显着诱导(图。7).除此之外,bngata1.9,bngata1.29和BnGATA2.5可能对不同的非生物处理有反应(图。7、表S8).表达轮廓的结果bngata.不同的非生物处理下的基因可能表明四个亚属植物之间的功能差异。
序列变异BnGATAs在一个核心集合B. Napus.
基于我们之前对全球991份油菜种质的重测序数据[26.,27.],利用300份MAF大于5%的核心材料的SNPs进行分析。平均检测到6个snp叫基因(表格S9).发现SNP密度bngata.AA亚基因组的s高于CC亚基因组的sS9).同时,各亚家族的SNP密度不同,4个亚家族的平均SNP密度分别为6.7、3.58、14.2和7.14个。
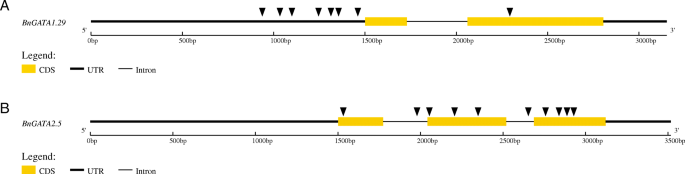
每个SNP密度bngata.一个亚家族内的基因也是不同的。例如,没有发现SNPbngata1.27,鉴定了8和10个SNPbngata1.29和BnGATA2.5.此外,详细的SNP分布bngata1.29和BnGATA2.5如图所示。8.为了BnGATA1.29,结果发现,启动子区有6个SNP位点,外显子/内含子区有2个SNP位点,3’utr区无SNP位点(图1)。8一种).为了BnGATA2.5,启动子区域中没有SNP,外显子/内部区域中的10个SNP,在3'UTR区域中没有SNP(图。8b).我们推测这些序列的变异叫S可能与它们在非生物胁迫下的表达差异有关。
讨论
在这项研究中,我们鉴定了96个基因叫家庭转录因素B. Napus.,指定bngata1.1.至bngata4.7基于他们的亚家族分类。生物信息学分析如系统发育关系,结构域,基因结构,蛋白质基序,染色体位置,同源和直晶基因叫被执行。结果表明BnGATAs聚类成四个亚家族在遗传结构和表达模式上有显著的不同,并且比这些亚家族更复杂叫TFs的A. Thaliana..此外,基因转录水平和SNP分布的信息为功能鉴定提供了资源BnGATAs.研究结果为药材的功能鉴定提供了有价值的依据bngata.TFs和分子育种B. Napus..
在以前的研究中叫系统地研究了家族基因A. Thaliana.和o.苜蓿[2,40],茄属植物lycopersicum[5],vitis Vinifera[8],Phyllostachys Edulis.[6),Gossypium膝[7,9].根据这些研究,叫双子叶植物的基因,而非单子叶植物的基因,可以严格划分为4个亚科。在我们的研究中,我们还发现了亚科I, II和III叫基因同时发生在双子叶和单焦点中,但单焦点中的亚家族IV基因不存在[2,6].的亚族IV叫基因出现在双子叶植物与单子叶植物分化之后。因此,我们推测叫亚家族IV基因可能在双子叶植物中发挥独特的功能,但还需要进一步的证据。
基因和蛋白质结构差异显著bngata.亚科可能导致功能上的分歧。例如,在亚家族III中,GATA结构域在锌指(C-X)中有20个残基2cx20.cx2-C),其余3个亚家族有18个残基。CCT和TIFY结构域特异性地存在于III亚家族中,这些结构域被报道参与了in的开花、下胚轴和根的发育A. Thaliana.[41.,42.,43.].亚家族I基因可能参与植物生长和响应非生物胁迫。在A. Thaliana,BME3(直接同源bngata1.29)被报道为种子萌发的正调控因子[44.].的BME3.敲除植物比野生型休眠更深,对低温胁迫更敏感。此外,表达量下降GA20-oxidase和GA3-氧化酶在淘汰植物中建议BME3.参与了GA Biosynthesis [44.].在这项研究中,bngata1.29(BnaC08g25560D)在各组织中均有高表达,并对ABA和冷胁迫有显著响应(表S7和表S8).最近的一项研究报道rgl2-dof6.复杂的规定gata12.(来自亚家族I)基因来强化初级休眠A. Thaliana.[45.].的子族IIBnGATAs参与植物开花和非生物胁迫响应。在A. Thaliana,GNC和GNL(直接同源BnGATA2.5)参与萌发,绿化,开花,花卉发育,衰老和花香器官脱落[10,11,12,46.,47.,48.,49.].最近,之间的联系BnGATA2.5基因表达量与株高、分枝起始高度和开花时间有关B. Napus.[50.].在这项研究中,BnGATA2.5(BnaA02g08490D)在许多组织和器官中表达B. Napus.(图。6、表S7).此外,表达BnGATA2.5在ABA诱导,干旱和冷处理下进行了下调,表明其对非生物应激的强烈反应(图。7、表S8).的亚族III叫TFs是一个新的植物特异性亚科,在开花、下胚轴和根系发育中起着重要作用[41.,42.,43.].例如,过度表达津贴(盖塔25.)可以上调表达XTH33(33 xyloglucosyl转移酶),导致拉长的下胚轴和在A. Thaliana.[42.,43.].除此之外,ZML1(gata24) 和ZML2.(gata28)被确定为两个基本组成部分cry1.(Cryptochrome1)介导的光保护反应A. Thaliana.[51.].在这项研究中,bngata3.1.(bnaa01g25320d.的同源词ATZML1.在大多数组织中表达了高度表达B. Napus.(图。6、表S7).的表达bngata3.1.对各种非生物胁迫的响应略有变化(图。7、表S8).然而,到目前为止,很少有关于亚家族的IV叫TFS在植物中。
在这项研究中,我们发现了bngata.基因在核心集合中具有丰富的SNP遗传变异B. Napus..编码区中的SNP对于产生新等位基因至关重要,等位基因差异可能导致基因功能改变,这是作物物种适应环境压力的重要促进[52.].例如,粉状霉菌抗性基因的7个功能等位基因PM3通过等位基因挖掘,从1320个面包小麦地方品种中分离到其他9个PM3显示出粉状霉菌的非功能性[53.].在我们的油菜核心种质中,III亚家族基因的SNP密度(每1kb 5.7个SNP)平均高于其他亚家族基因的SNP密度(每1kb 3.5个SNP)(见表3S9),而亚家族III基因在各种组织中高度表达并在脱水条件下表达(表S7和表S8).因此,单倍型和等位基因特异性标记bngata.在今后的工作中,可以为油菜籽分子育种提供基因鉴定的依据。油菜籽起源于自然杂交之间b·拉伯(AA)和b . oleracea(CC) [24.].在这项研究中,我们确定了46个和50个bngata.位于AA或CC亚基因组上的基因。然而,SNP密度BnGATAs在AA亚基因(4.7每1kb)上远高于CC子组(3.2)(表S9),可以通过在之间更频繁的交叉来解释B. Napus.和b·拉伯比在B. Napus.和b . oleracea[26.].
一起携带,我们进行了全面的表征叫家庭基因B. Napus..结果丰富了我们的知识bngata.基因,为操纵基因和促进油菜籽的育种标记辅助育种提供基础。但是,需要功能验证以揭示确切的功能作用bngata.基因。
结论
在目前的研究中,全基因组的鉴定和鉴定叫基因在B. Napus。共96岁叫油菜籽基因组中已鉴定出基因,可分为4个亚科。系统发育与共时性分析叫基因之间的A. Thaliana.和B. Napus.提供有价值的线索,以实现进化特征bngata.基因。此外,基因表达和SNP分布分析bngata.基因也被确定。这些结果提供了洞见的功能差异,进化关系和表达概况叫转录因子在B. Napus..
数据和材料的可用性
RNA-seq的B. Napus.在登录号PRJNA394926下,在NCBI序列读取存档(SRA)数据库中提供了不同的中子11(ZS11)。RNA-SEQ数据B. Napus.项目编号:CRA001775 (https://bigd.big.ac.cn/).支持本文结果的所有其他数据集包含在文章及其补充表中。
缩写
- ARF.:
-
一种营养响应因素
- Atgata.:
-
Arabidopsis Thaliana盖塔
- BLASTP:
-
基本的局部对齐搜索工具-蛋白质
- bngata.:
-
芸苔属植物显著叫
- Bzip.:
-
基本螺旋循环螺旋
- cry1.:
-
Cryptochrome1
- 含有DREB:
-
Dehydration-responsive元件结合蛋白
- 遗传算法:
-
吉布林素
- GNC:
-
GATA,硝酸盐诱导,涉及碳代谢
- GNL:
-
GNC-like
- 德牧:
-
基因结构显示服务器
- 嗯:
-
隐藏马可夫模式
- MEME:
-
引出主题
- MW:
-
分子量
- MYB:
-
V-myb禽成髓细胞增生病毒癌基因同源物
- pI:
-
等电点
- 进行通信:
-
植物色彩相互作用因素
- SNP:
-
单核苷酸多态性
- SOC1:
-
constans抑制因子1
- TFs:
-
转录因子
- XTH33:
-
33 Xyloglucosyl转移酶
参考文献
- 1.
Franco-Zorrilla JM, López-Vidriero I, Carrasco JL, Godoy M, Vera P, Solano R. R.植物转录因子的dna结合特异性及其定义靶基因的潜力。中国科学院研究生院学报(自然科学版)2014;
- 2。
Reyes JC, Muro-Pastor MI, Florencio FJ。GATA家族的转录因子拟南芥和米饭。植物理性。2004; 134(4):1718-32。
- 3.
Lowry Ja,Atchley WR。转录因子的Gata系列的分子演变:DNA结合结构域内的保守。J Mol Evol。1999年; 50(2):103-15。
- 4。
C.真菌叫因素。Currin微生物。2000; 3(2):126-31。
- 5。
acta botanica botanica(云南植物研究),2011,34 (5):573 - 583叫番茄转录因子家族及其表达模式分析。农业生物学报。2018;20(6):1274-82。
- 6。
王tt,杨y,娄圣,威武,赵紫猫,任yj,林ct,ma ly。基因组特征和基因表达分析叫毛竹的转录因子(Phyllostachys Edulis.).int j mol sci。2019; 21(1):14。
- 7。
关键词:油菜,转录组,非生物胁迫,转录组,转录组摩尔品种。2019;(11):158。
- 8。
张Z,任一圈,邹丽,王Y,李世,梁ZC。表征叫基因家庭vitis Vinifera:基因组 - 宽分析,表达谱,以及光线和植物激素反应的参与。基因组。2018; 61(10):713-23。
- 9。
张震,邹晓云,黄忠,范思敏,群刚,刘安,龚建伟,李建伟,龚文坤,石永忠,范立强,张志波,刘瑞霞,蒋翔,雷凯,尚焕华,徐爱民,袁玉玲.全基因组cdna序列的鉴定与表达模式分析叫三种物种转录因子Gossypium属.基因。2019 b; 680:72 - 83。
- 10.
ricter R, Behringer C, Müller IK, Schwechheimer C. gata型转录因子GNC和GNL / CGA1.抑制DELLA蛋白和光敏色素相互作用因子下游的赤霉素信号。基因Dev。2010;24(18):2093 - 104。
- 11.
Richter R,Behringer C,Zourelidou M,Schwechheimer C.植物素和胃肠杆菌素的收敛性关于Gata转录因子的调节GNC和GNL在拟南芥.国家自然科学基金资助项目(2013a);
- 12.
里希特,巴斯塔基斯,舒韦海默SOC1和GATAS GNC.和GNL / CGA1.在控制绿化,耐冷耐受和开花时间拟南芥.植物理性。2013B; 162(4):1992-2004。
- 13。
Zubo Yo,Blakley IC,Franco-Zorrilla JM,Yamburenko MV,Solano R,Kieber JJ,Loraine Ae,Schaller Ge。通过“叶绿体发展”的协调GNC和GLK转录因子家族。植物杂志。2018;178(1):130 - 47岁。
- 14。
Naito T,Kiba T,Koizumi N,Yamashino T,Mizuno T.表征独特的Gata家族基因,响应光和细胞素蛋白拟南芥.中国生物医学工程学报,2007;
- 15.
段ZQ,张YT,Tu JX,Shen JX,易B,Fu Td,Dai C,MA CZ。的芸苔栗鸟GATA转录因子BnA5。ZML1is a stigma compatibility factor. J Integr Plant Biol. 2020;62(8):1112–31.
- 16。
安毅,周云英,韩旭,沈超,王胜,刘超,尹文丽,夏晓丽。GATA转录因子GNC在杨树光合作用和生长过程中起着重要作用。机器人学报。2010;30(6):657 - 664。
- 17。
刘辉,李涛,王玉明,郑杰,李海峰,郝春英,张学勇。TaZIM-A1负面调节普通小麦的开花时间(Triticum aestivum L.).J Intent Plant Biol。2019; 61(3):359-76。
- 18。
李建平,李建平SOC1,开花途径整合子。实验机器人。2010;61(9):2247-54。
- 19。
Bonthala Vs,Mayes K,Moreton J,Blythe M,Wright V,May ST,Massawe F,Mayes S,Twycross J.通过基于网络的网络分析鉴定与Bambara Trantnut的低温响应相关的基因模块。Plos一个。2016; 11(2):E0148771。
- 20。
Nutan KK,Singla-Pareek SL,Pareek A.该SaltolQTL-localized转录因子osgata8.在抗逆性和种子发育中起着重要作用拟南芥和米饭。机器人学报。2010;30(2):431 - 434。
- 21。
张超,侯勇,郝琼,陈浩,陈玲,袁胜,单忠,张鑫,杨忠,邱丹,等。大豆全基因组调查叫低氮胁迫下转录因子基因家族及表达分析。Plos一个。2015; 10(4):E0125174。
- 22。
Bhardwaj AR,Joshi G,Kukreja B,Malik V,Arora P,Pandey R,Shukla RN,Bankar KG,Katiyar-Agarwal S,Goel S,Jagannath A,Kumar A,Agarwal M.全球洞察高温和干旱压力调节在经济上重要的油籽作物中RNA-SEQ基因芸苔属植物juncea.BMC Plant biology . 2015;15:9。
- 23。
Bayer PE, Hurgobin B, Golicz AA, Chan CK, Yuan Y, Lee H, Renton M,孟J, Li R, Long Y, Zou J, Bancroft I, Chalhoub B, King GJ, Batley J, Edwards D. Assembly and comparison of two closely related芸苔栗鸟基因组。植物Biotechnol J. 2017; 15(12):1602-10。
- 24.
Liu S, Parkin IAP, Tang H, Wang X, Chiquet J, Belcram H, Tong C, Samans B, et al. .新石器时代后的早期异源多倍体进化芸苔栗鸟油料基因组。科学。2014;345(6199):950 - 3。
- 25.
孙调频,范国刚,胡强,周永明,关明,童兵兵,李建军,等。高质量的基因组芸苔栗鸟品种ZS11揭示了半冬型的渐渗历史。植物j . 2017; 92(3): 452 - 68。
- 26.
吴迪兹,梁Z,燕t,徐y,xuan lj,唐家杰,周g,lohwasser u,hua sj,wang hy,chen xy,王q,zhu l,maodzeka a,hussain n,li zl,李xm,Shamsi IH,Jilani G,Wu Ld,郑香港,张GP,Chalhoub B,沉LS,yu H,江LX。全球范围内的油菜籽戒指的全部基因组重构揭示了生态型分歧的遗传基础。莫尔植物。2019; 12(1):30-43。
- 27.
Xuan Lj,Yan T,Lu Lz,赵Xz,吴迪兹,华SJ,江吕克。基因组 - 范围的协会研究揭示了在多倍体油菜籽中携带叶片毛细血管形成的新基因(芸苔栗鸟l .)。植物细胞学报。2010;43(3):675-91。
- 28.
Letunic I, Doerks T, Bork P. SMART 7:蛋白质结构域注释资源的最新更新。核科学与技术,2012;40(1):302-5。
- 29.
陆Marchler-Bauer,年代,安德森JB, Chitsaz F,德比郡可,DeWeese-Scott C,方JH,吉尔LY,吉尔RC,冈萨雷斯NR, Gwadz M,赫维茨DI,杰克逊JD Ke Z, Lanczycki CJ,陆F, Marchler GH, Mullokandov M, Omelchenko MV,罗伯逊CL,歌曲JS, Thanki N,山下先生RA,张D,张N,郑C,科比SH。CDD:一个用于蛋白质功能注释的保守域数据库。核酸杂志2011;39:225-9。
- 30.
Finn RD, Coggill P, Eberhardt RY, Eddy SR, Mistry J, Mitchell AL, Potter SC, Punta M, Qureshi M, Sangrador-vegas A, Salazar GA, Tate J, Bateman A. pam蛋白家族数据库:走向更可持续的未来。中国生物医学工程学报。2016;44(1):279-85。
- 31.
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33(7):1870-4。
- 32.
Saitou N,Nei M.邻居加入方法:一种重建系统发育树的新方法。mol Biol Evol。1987; 4(4):406-25。
- 33.
[11]胡斌,金军,郭爱娥,张宏,罗军,高光。GSDS 2.0:基因特征可视化升级服务器。生物信息学,2015,31(8):1296 - 7。
- 34.
作者简介:Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME SUITE:用于主题发现和搜索的工具。核酸研究2009;37:202-8。
- 35.
Krzywinski M,Schein J,Birol I,Connors J,Gascoyne R,Horsman D,Jones SJ,Marra Ma。电讯:对比较基因组学的信息审美。Genome Res。2009; 19(9):1639-45。
- 36。
王Y,Tang H,Debarry JD,Tan X,Li J,Wang X,Lee T,Jin H,Marler B,Guo H. McScanx:一种用于基因同培和共同性的检测和进化分析的工具包。核酸RES。2012; 40(7):E49。
- 37。
Holub EB。军备竞赛已成为古老的历史拟南芥野花。李文杰。2001;2(7):516-27。
- 38。
朱文忠,吴德忠,蒋立新,叶利忠。全基因组鉴定和鉴定SNRK.家庭基因芸苔栗鸟.1.中国生物医学工程学报(英文版);
- 39。
Chen CJ,Chen H,Zhang H,Thang Hr,Frank Mh,He Yh,夏R.TBTools:为大生物数据的互动分析开发了一种综合工具包。莫尔植物。2020; 13(8):1194-202。
- 40.
Manfield IW, Devlin PF, Jen CH, Westhead DR, Gilmartin PM。进化过程中光响应、昼夜调节和组织特异性表达模式的保护、收敛和发散拟南芥叫基因家族。植物杂志。2007;143(2):941 - 58。
- 41。
一种新的锌指蛋白编码基因的特性分析,津贴,在生殖阶段表达拟南芥.Biosci Biotechnol Biochem。2000; 64(7):1402-9。
- 42。
Shikata M,Matsuda Y,Ando K,Nishii A,Takemura M,Yokota A,Kohchi T.表征拟南芥结汇,一种新型植物特异性的成员叫因子基因家族。中国生物医学工程学报,2004;
- 43。
Vanholme B, Grunewald W, Bateman A, Kohchi T, Gheysen G.这个家族以前被称为津贴.植物科学,2007;12(6):239-44。
- 44。
刘普平,小izuka N, Martin RC, Nonogaki H. TheBME3(蓝色Micropylar端3)叫锌指转录因子是阳性调节因子拟南芥种子发芽。植物j . 2005; 44(6): 960 - 71。
- 45。
Ravindran p,verma v,stamm p,kumar pp。一种新的RGL2-DOF6复合物有助于原发性种子休眠拟南芥通过调节叫转录因子。莫尔植物。2017; 10(10):1307-20。
- 46。
Behringer C,Bastakis E,Ranftl Q1,Mayer Kfx,Schwechheimer C.通过亮氨酸 - 亮氨酸 - 甲硫氨酸结构域的B-Gata转录因子系列中的功能多样化。植物理性。2014; 166(1):293-305。
- 47。
毕义明,张勇,赵瑞,朱涛,罗士坦拟南芥叫转录因子基因家族揭示厌氧诱导成员对叶绿素合成和葡萄糖敏感性很重要。工厂J. 2005; 44(4):680-92。
- 48.
Chiang YH, Zubo YO, Tapken W, Kim HJ, Lavanway AM, Howard L, Pilon M, Kieber JJ, Schaller GE。GATA转录因子的功能特性GNC和CGA1.揭示他们在叶绿体开发,增长和划分中的关键作用拟南芥.植物杂志。2012;160(1):332 - 48。
- 49.
Hudson D, Guevara D, Yaish MW, Hannam C, Long N, Clarke JD, Bi YM, Rothstein SJ。GNC和CGA1.调节叶绿素生物合成和谷氨酸合酶(GLU1 / Fd-GOGAT)表达式拟南芥.Plos一个。2011; 6(11):E2675。
- 50.
沈永,向勇,徐安士,葛晓华,李志勇。外源基因渐渗衍生的株高、分枝起始高度、茎粗和开花时间的主要共定位QTL芸苔栗鸟DH群体。植物科学与技术,2018;
- 51.
该研究通过转录激活因子锌指蛋白(ZINC FINGER PROTEIN)在花序分生组织LIKE1中表达,而锌指蛋白(ZINC FINGER PROTEIN)对过度光的响应是由锌指蛋白(ZINC FINGER PROTEIN)介导的ZML2.在拟南芥.植物细胞,2012;24(7):3009 - 25所示。
- 52.
Kumar Gr,Sakthivel K,Sundaram RM,Neeraja CN,Balachandran Sm,Rani Ns,Viraktamath BC,Madhav MS。等位基因矿业在作物:前景和潜力。Biotechnol adv。2010; 28(4):451-61。
- 53.
Bhullar NK, Street K, Mackay M, Yahiaoui N, Keller B.打开小麦遗传资源的分子鉴定以前未描述的功能等位基因PM3抵抗轨迹。国家自然科学基金资助项目:国家自然科学基金资助项目。
确认
感谢张国平博士在稿件修改中提出的深刻建议和贡献。
资金
这项工作得到了中国国家自然科学基金(31961143008,31701411),中国浙江省科技计划(LGN20C130007),江苏省近代农作物生产协作创新中心,以及111个外国专家引入项目(B17039)。资金代理商在研究设计,数据收集和分析或手稿写作中没有作用。
作者信息
隶属关系
贡献
WZ和DW构思和设计了研究。WZ和YG执行了实验和数据分析。WZ,YG,YC,LJ和DW写了这篇文章;所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
有关的资料叫基因A. Thaliana..表S2。的特征叫基因B. Napus..表S3。96人名单叫确定的基因B. Napus..表S4。保守的氨基酸基序和注释叫基因B. Napus..表S5。同tenic块叫基因B. Napus..表S6。的一对一的同源关系叫基因之间的B. Napus.和A. Thaliana..表S7。表达配置文件(基于LOG2的值)叫不同组织中的基因B. Napus..表S8。表达式配置文件(比率与控制值)叫基因B. Napus.在非生物压力。表S9。的单核苷酸多态性叫在300种核心地质种质中鉴定基因。表S10。300种油菜种质核心收集遗传多样性。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
朱,W.,Guo,Y.,Chen,Y.et al。全基因组鉴定,系统发育和表达模式分析叫家庭基因芸苔栗鸟.BMC植物BIOL.20,543(2020)。https://doi.org/10.1186/s12870-020-02752-2
收到了:
接受:
发表:
关键字
- 芸苔栗鸟
- 叫
- 全基因组
- 表达式模式
- 单核苷酸多态性分布