摘要
背景
施氮可有效减轻干旱对作物生长和产量的损害。然而,旱前重施氮和旱后重施氮在调控水稻对干旱胁迫反应中的作用仍存在争议。本研究以水稻品种五峰优286为材料,通过生理、蛋白质组学和代谢组学分析两种氮肥管理模式(NBD和NAD)的产量形成及其对抗旱性的调控机制。
结果
结果表明,在幼穗分化期遭受干旱胁迫,NBD和NAD的产量显著下降,而2017年和2018年NBD的产量分别比NAD高33.85和36.33%,达到显著水平。干旱条件下,与NAD相比,NBD提高了叶片叶绿素含量和净光合速率,显著提高了超氧化物歧化酶(SOD)、过氧化物酶和过氧化氢酶等抗氧化酶活性,降低了丙二醛(MDA)含量。NBD促进了叶片氮素同化,表现为硝态氮还原酶(NR)和谷氨酰胺合成酶(GS)活性增加。此外,NBD还显著提高了可溶性糖、可溶性蛋白和游离脯氨酸等渗透调节物质的含量。对234个差异表达蛋白和518个差异代谢产物的基因本体论和KEGG富集分析表明,不同的氮素管理导致光合途径、能量代谢途径、氮素代谢和氧化还原途径发生强烈变化。
结论
不同施氮方式对水稻抗旱性有显著差异。这些结果表明,干旱前重施氮肥可能是提高水稻产量和抗逆性的重要途径,并为水稻氮素调控提供了新的生态学视角。
背景
干旱是导致作物减产的主要环境因素,干旱造成的损失大于其他环境胁迫的总和[1].不同程度的干旱压力通常导致叶子中的气孔闭合,防止转移CO2从空气到叶片的细胞间细胞和叶肉细胞[2,3.].丝纤维 - 1,5-二磷酸(镁镁)与低浓度的CO合并2在核酮糖-1,5-二磷酸羧化酶(Rubisco)作用下,经过一系列反应,经NADPH还原生成甘油醛-3-磷酸(PGAld)。由于CO的同化2消耗NADPH并减少NADP的水平+光合作用过程中电子传递的变化,限制了叶片的光合速率。氧作为叶片中重要的电子受体,导致活性氧(ROS)的快速积累,如单线态氧(O2-),过氧化物(•O2)、羟基(哦- 1)和过氧化氢(H2O2),对抗氧化代谢产生负面影响,导致细胞过氧化损伤[4,5,6].抗氧化酶如超氧化物歧化酶(SOD),过氧化物酶,过氧化氢酶,通过调节其基因表达和活性,在干旱胁迫下在植物抗氧化代谢中起着核心作用[7,8,9].干旱胁迫还影响与碳氮同化有关的酶的活性,包括蔗糖合酶(SS)、硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)和转氨酶,引起植物碳氮化合物的变化,影响植物对干旱胁迫的抵抗力[10.,11.,12.].干旱胁迫也促进了植物细胞中抗旱基因的表达。它导致功能蛋白的积累,如膜蛋白(水通道蛋白)、渗透调节分子(包括蔗糖、脯氨酸和甜菜碱)、大分子保护因子(如热休克蛋白、分子伴侣、mRNA结合蛋白)[13.,14.]和过量规范蛋白质(包括转录因子,蛋白激酶)[15.,16.].
近年来,N作为信号因子在调控植物抗逆性中的作用引起了研究者的广泛关注[17.].N调控植物抗逆性的作用与N的吸收和分配过程密切相关[18.].合理增加施氮量可显著改善干旱胁迫对水稻光合作用的负面影响[19.,20.].适当的高氮水平可以提高气孔对干旱胁迫的响应阈值,保持光合作用的完整性[21.],改善根系开发中的弹性,增强植物抗氧化能力[22.].相关的研究报告已经出现在农作物上,例如水稻[23.],玉米[24.],芸苔CameStris.[25.] 和小麦[26.]这表明适当高水平的氮肥可以有效缓解干旱胁迫并降低产量损失。农民有两种主要方式施加氮肥以改善作物的抗旱性。在干旱之前,一种是氮肥的繁重应用[27.,通常用来应对季节性干旱。另一种是干旱后大量施用氮肥[28.],多见于“雨养田”水稻上,主要用于对不规则干旱的补救措施[29.].
蛋白质组学和代谢组学是对各种环境刺激的植物反应分析的强大工具[30.].这些方法可以有效地改进对代谢网络和蛋白质调节机制的深入分析[31.].蛋白质组学和代谢组学已被广泛应用于水稻叶片干旱响应途径的研究(栽培稻l .)、玉米(玉米)和杜兰姆(小麦属植物硬质) 小麦 [32.,33.,34.].然而,两种施氮方式对水稻干旱胁迫响应的有效性仍存在争议,结合蛋白质组学、代谢组学和相关生理指标研究干旱前后重施氮肥缓解水稻产量损失的机制较少。本研究以水稻品种五峰优286为试验材料,采用干旱前重施氮和干旱后重施氮两种氮素管理模式。选择幼穗分化期作为干旱处理的时间点。为确定NBD和NAD缓解干旱对水稻产量的影响,对生理指标、蛋白质组学、代谢组学分析及产量进行了研究,为干旱条件下水稻氮素调控管理提供理论参考。
结果
产量及产量构成因素分析
2017年,干旱胁迫下单株NBD产量显著高于NAD,显著低于CK (p< 0.05)(Table1).结果表明,双熟早稻幼穗分化期是水分亏缺的敏感期。与NAD相比,NBD单株产量提高了33.85%,达到显著水平(p< 0.05)。从产量组分的角度来看,与NAD相比,NBD的种子设定率高(较高)16.09%(p< 0.05),单株有效穗数、每穗总粒数和千粒重分别提高6.03、7.65和1.07%。2018年不同处理的产量及产量构成要素与2017年基本相似(表1)1).CK的单株产量显著高于NBD和NAD (p< 0.05),单株产量比NAD高36.33% (p< 0.05)。在产量构成因素上,NBD的每穗总粒数和结实率分别比NAD高11.73和14.61% (p分别为< 0.05)。因此,在两个评价年份中,NBD和NAD组的产量和产量构成因素具有可比性。结果表明,在干旱胁迫下,NBD有利于减少水稻的产量损失,其增产的主要原因是结实率和每穗粒数的增加。
干物质、氮的吸收和分配分析
干旱胁迫下,不同氮肥管理对水稻茎、叶和穗干物质积累的影响不同2).抽穗期,NBD的茎、叶和穗干物质积累量分别比NAD高21.15、52.38和20.93%。NAD在穗部的干物质分配显著低于CK和NBD (p< 0.05)。在成熟的阶段,NAD穗中的干物质积累显着下降,分别低于NBD和CK的27.46%和41.77%。NAD的茎和叶片干物质积累均高于CK和NBD的变化。茎和鞘物质(EPMS)的出口百分比(EPMS)和转化百分比的茎和鞘物质(TPMS)的百分比在CK中为阳性,而那些在NBD和NAD中是阴性的。结果表明,NAD中的光合作用累积的部分稳定化学能量在茎中积聚,并未有效地运输到穗上。
抽穗期,CK和NBD的茎、叶和穗的氮含量显著高于NAD(表2)3.).NAD处理穗部、茎部、叶部和地上部氮素积累量分别比对照低56.34、48.96、46.21和48.81%,比对照低40.16、31.77、37.78和36.21%,差异均极显著(p< 0.05)。成熟期,NAD植株穗部、茎部和叶片氮素积累量分别比NBD高11.57、44.13和88.14%。NAD植株茎叶氮素积累率显著高于CK和NBD (p< 0.05)。CK穗部和地上部氮素积累量均显著高于NBD和NAD。
光合作用相关参数分析
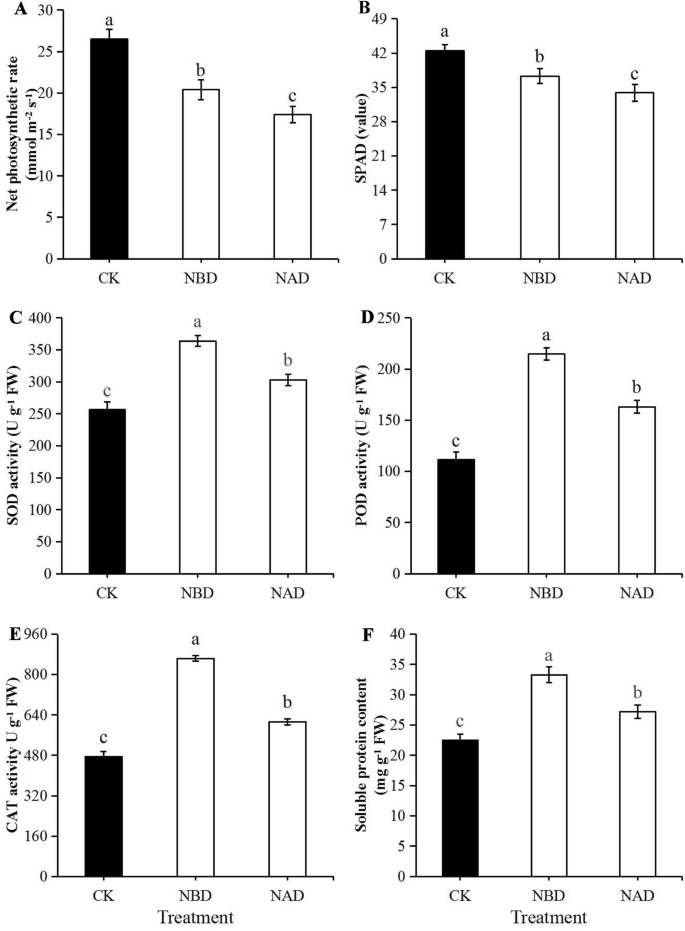
NBD的净光合速率比NAD的净光合速率高于17.9%,达到显着差异(图。1一种)。NBD和NAD的净光合速率比CK的净光合速率为22.98%和34.33%(p分别为< 0.05)。CK,NBD和NAD的气孔导度为436,359和293mmol / m2在干旱胁迫结束时,CK和NBD和NAD之间的差异显着。NBD的气孔导率比NAD高21.52%(p< 0.05)。NBD的叶绿素含量高于NAD的10.03%,差异很大(图。1b). CK的叶绿素含量比NBD和NAD分别高13.94和25.96% (p分别为< 0.05)。
抗氧化酶活性及可溶性蛋白分析
与CK和NAD相比,NBD的SOD、过氧化物酶和过氧化氢酶活性显著升高(图2)。1NBD的SOD活性比NAD和CK分别高20.09和40.92%,差异显著。过氧化物酶活性方面,NAD和CK分别比NBD低24.04和48.11%,差异极显著。NAD和CK的过氧化氢酶活性显著低于NBD的29.08和44.95% (p分别为< 0.05)。可溶性蛋白含量方面,NBD比NAD和CK分别高22.52和42.66%,差异显著(图2)。1f)。
渗透调节物质分析
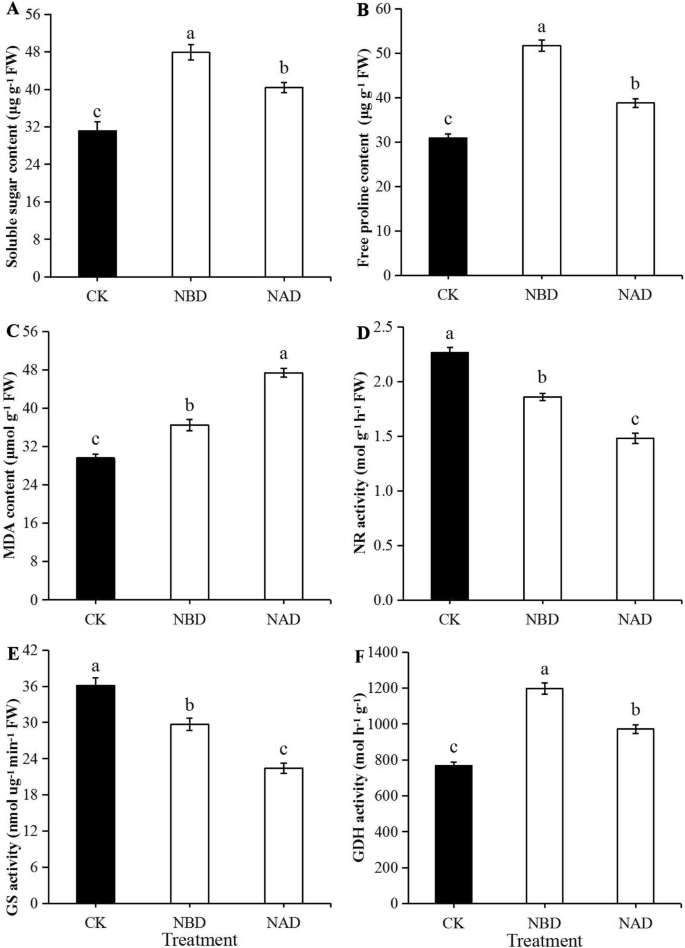
干旱结束后,NBD中可溶性糖和游离脯氨酸的含量明显高于NAD和CK中的含量(图。2a, b). NBD的可溶性糖和游离脯氨酸含量分别比NAD高18.38和33.33%,差异极显著(p< 0.05)。NBD和CK显着降低了MDA含量低于NAD(图。2c),NBD比NAD低22.87%。
与氮代谢相关的酶活性分析
NBD和CK的NR和GS活性显著高于NAD。2酶活性方面,NBD和NAD的NR活性分别比对照低17.88和34.58%,GS的活性分别比对照低17.92和38.01%。NBD的NR和GS活性分别比NAD高25.53和32.31%,差异显著(p< 0.05)。NAD和CK的GDH活性显着低于NBD(图。2f), NAD的GDH活性比NBD低18.85%。
TMT蛋白组学分析
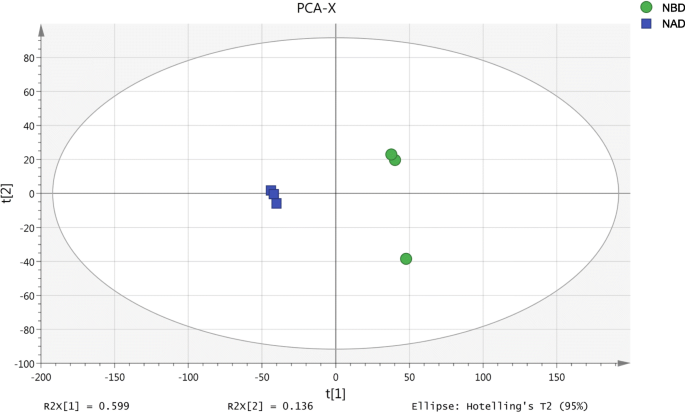
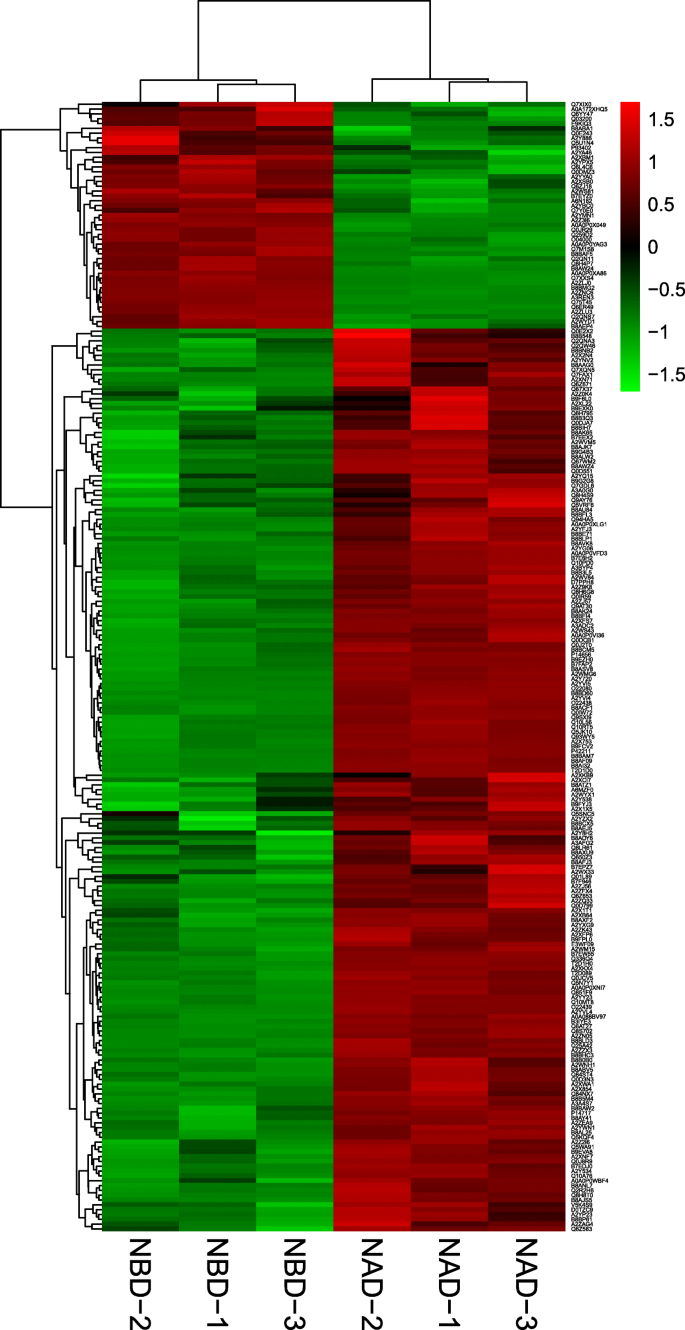
利用TMT标记NBD和NAD处理的水稻叶片进行蛋白质组学实验。每个样品经LC-MS/MS检测后,定性蛋白和定量蛋白的数量分别为4254和3892。用LC-MS对酶解标记的样品进行分析,并在数据库中检索。通过TMT实验筛选出3548个可信蛋白。通过对NBD和NAD样本的对比分析,我们发现PCA评分可以解释73.5%的NAD和NBD的分离(图。3.),因此PCA可以可靠地解释NAD和NBD样品之间的蛋白差异。此外,我们通过聚类分析可视化了NBD和NAD中不同点的差异表达蛋白(DEPs)(图)。4),结果进一步表明数据是可信的。
DEPS的功能分析
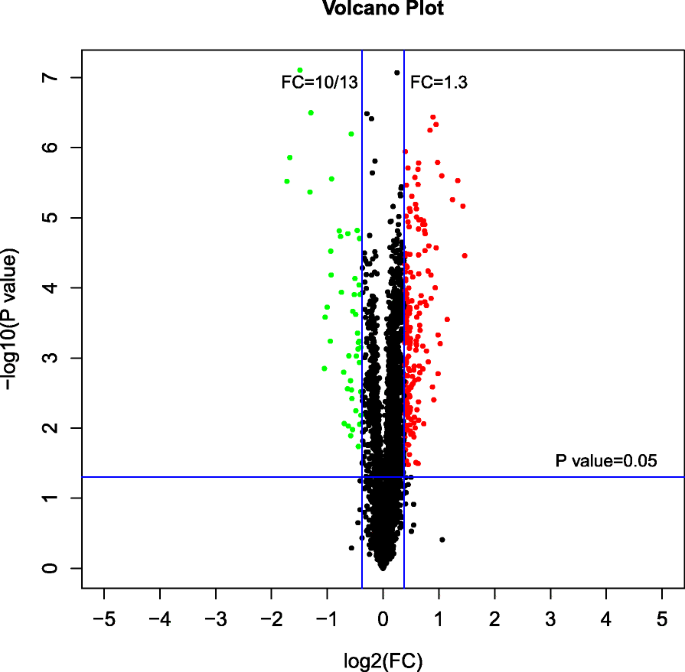
基于所选择的可信蛋白质,具有折叠变化> 1.3的蛋白质被视为上调(p< 0.05),倍数变化< 10/13者视为下调(p< 0.05)[35.].因此,这些DEPs被认为是NBD和NAD的响应蛋白,在NAD和NBD组间共衍生出234个DEPs(47个上调,187个下调)(数据集S1).在NAD和NBD之间的DEPs中,有36个上调蛋白和105个下调蛋白已被基因本体注释,其余DEPs未被注释。数字5显示了NAD-NBD的dep的火山图。
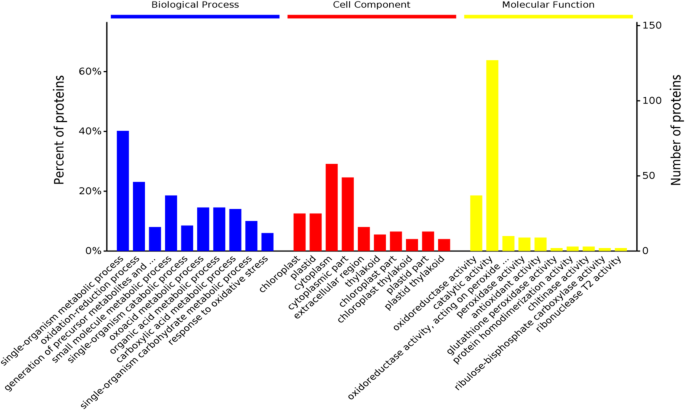
为了进一步分析NBD和NAD之间的DEPS的功能特性,首先为基因本体函数注释141AD,然后在三个水平分析:生物过程,细胞成分和分子功能。根据DEPS基因数量的重要性分析,生物过程中的前三项是单生物代谢,氧化还原和小分子代谢过程。细胞组分中的前三个项目是细胞质,细胞质部分和叶绿体。分子功能的前三个项目是催化活性,氧化还原酶活性,并在过氧化物上作用,作为受体,过氧化物酶活性(图。6).然后对DEPs进行KEGG通路分析,结果表明,参与NAD和NBD的主要KEGG通路包括:次生代谢产物的生物合成、碳代谢、氨基酸的生物合成、谷胱甘肽代谢、光合生物固碳和氮代谢(图S1).进一步分析差异蛋白与KEGG通路之间的蛋白相互作用,绘制蛋白相互作用网络图(图S1).结果表明,部分上调的微分蛋白A0A088BV97,O22438和Q0D3N3与Keeg途径相互作用,包括次级代谢物生物合成,碳代谢,代谢途径和NAD和NBD中的氨基酸生物合成。
代谢物的概要文件
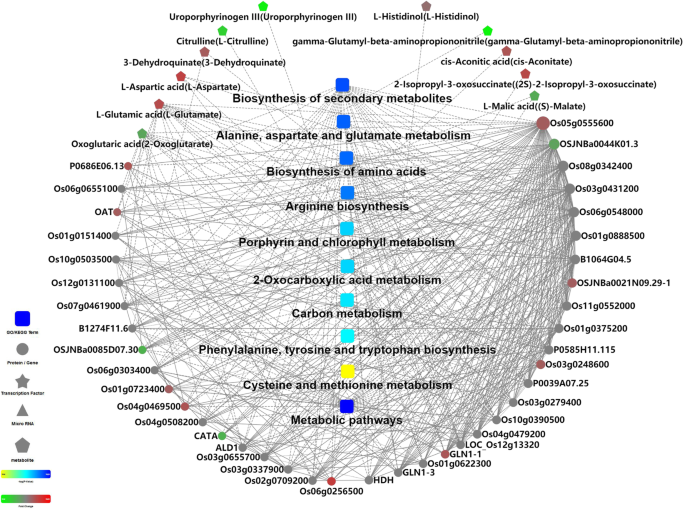
首先,在NAD和NBD样品上进行PCA,结果表明,该模型在解释两组之间的代谢差异是可信的(图。2一种);PLS-DA模型可以更好地解释NAD和NBD样品之间的差异(图S2B);NAD和NBD样品在OPLS-DA评分图上有光谱分离(图S2C),最后对OPLS-DA模型进行200次响应排序检验,结果表明该模型没有过拟合(图S)2d)。差分代谢物(DMS)和差分蛋白的筛查标准是相同的。因此,DMS被认为是NBD和NAD响应性代谢物。总共,从NAD和NBD组之间的米叶中筛选518dms(296调节和222个下调)(DataSet s2).然后,利用DMs的KEGG ID进行通路富集分析,结果表明DMs在光合生物通路中的卟啉和叶绿素代谢、柠檬酸循环、代谢通路和固碳通路中均显著富集。关于dm的更多信息包含在数据集S中2.为了更清晰地显示NAD和NBD样本中代谢物表达模式的差异,我们使用DMs表达对每组样本进行分层聚类(图S3.).说明NAD和NBD植物在代谢水平上对水分胁迫有不同的响应。表中显示了KEGG通路在DEPs和dm中显著富集4.此外,通过omicbean平台构建了差异蛋白、DMs和代谢途径的相互作用网络图(图2)。7),根据重要性对代谢途径进行排序:代谢途径;次生代谢产物的生物合成;丙氨酸、天冬氨酸、谷氨酸代谢;氨基酸的生物合成;精氨酸生物合成;卟啉、叶绿素代谢和碳代谢途径。
讨论
干旱前后重施氮肥对产量和生理生化的影响
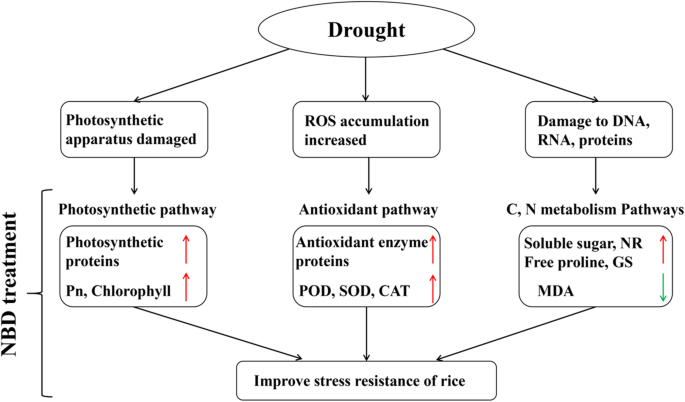
干旱胁迫通常导致谷物数减少,种子设定率和水稻产量[20.].以前的研究表明,不同的氮施用率和氮气管理可以调节干旱胁迫下的作物水和产量[19.,36.].在干旱条件下适当高水平的氮能促进水稻根系发育,减少产量损失[37.].本研究发现,2017年和2018年NBD的产量显著高于NAD。NBD的增产主要是由于结实率和每穗粒数的增加1).增加N肥料应用的水平可以有效提高植物的抗氧化能力[38.].结果表明,NBD和NAD的过氧化物酶、超氧化物歧化酶和过氧化氢酶活性显著高于CK,而NAD的过氧化物酶、过氧化物酶和过氧化氢酶活性显著低于NBD。干旱胁迫后MDA的大量积累表明水稻植株的膜结构受到了一定程度的破坏。NBD中抗氧化酶活性的提高有利于缓解叶片损伤,与NAD相比,MDA含量显著降低(图2)。2c).适当高氮水平可以协调碳氮代谢,缓解水分胁迫对光合作用的抑制[21.].本研究表明,NBD处理的叶绿素含量和净光合速率显著高于NAD处理。这也表明,NBD可以改善干旱胁迫对水稻光合作用的不利影响,这种缓解作用有利于干物质的生产和积累,这与NBD的产量和干物质结果一致(表)2).在干旱胁迫下,水稻叶片、茎、穗和根系的干物质分布存在显著差异,这也改变了根冠比之间的关系[39.].在标题阶段,NBD茎,叶片和穗茎的干物质积累明显高于NAD。在成熟的阶段,NBD的穗和TPMS中的干物质积累高于NAD,这提供了通过NBD增加产量的保证。高水平氮的应用增强了NO的同化3.-和NH4+并增加与氮代谢有关的酶的活性[22.].该研究表明,NBD治疗中NR和GS和可溶性糖和游离脯氨酸含量的活性显着高于NAD,GDH活性明显低于NAD中的GDH活性。这与NBD的每个器官中的氮积累明显高于标题阶段的NAD(表3.).结果表明,NBD有利于提高水稻氮素代谢相关酶的活性和渗透调节物质的含量,在水稻对干旱胁迫的适应中发挥重要作用。Huang等人发现氨基酸和可溶性蛋白的积累有利于提高植物抗旱性[40,我们的研究结果也与他们一致。因此,NBD有利于维持水稻的光合势,协调水稻碳氮代谢,对提高水稻的耐受性和产量形成具有重要作用。综上所述,水稻在水分胁迫下的损伤机制和抗旱性机制是一个复杂的过程。植物应对缺水主要有三种策略:避旱、避旱和耐旱[41.,这将影响植物对干旱胁迫反应的发展。NBD通过调控水稻抗旱性机制,促进渗透调节物质的积累,提高抗氧化酶的活性,为植物生理活动的维持提供保障。此外,在水稻穗分化期,严重的干旱对水稻造成了强烈的伤害,对植株造成了不可逆的伤害,两种施氮方式无法补偿正常产量。今后的研究以不同施氮量调节水稻产量和抗逆性途径为目标,将更好地阐明氮肥在水分胁迫下维持产量形成中的确切作用。
干旱前后重施氮肥对光合作用的响应
干旱对植物的影响主要是通过影响光合作用,而光合作用对干旱胁迫的反应是极其复杂的[42.].在轻度和中度干旱胁迫下,气孔导度和叶肉导度的降低直接影响光合同化能力,导致叶绿体对CO的利用减少2,或由于光合新陈代谢的变化[43.,44.].以前的研究发现,植物的光合速率随着N浓度的增加而增加,并随着土壤水分含量降低而降低[45.].水氮相互作用对光合作用的影响已经在许多作物中观察到[46.].光收获叶绿素A / B结合蛋白(LHCBS)是光系统II(PSII)复合物的载脂蛋白。这些叶绿体/囊体蛋白被核基因编码,它们的表达主要受环境和发育因素的调节[22.].本研究中,与NAD相比,NBD的叶绿素a-b结合蛋白(蛋白ID: A2WS81, A2YMN1, Q7M1S8)显著上调(p< 0.05)。在农业生态系统中,增加施氮量可以缓解作物光合能力的限制,可以将更多的N分配给光合蛋白质,进一步提高作物光合氮的利用效率[47.].本研究表明,NBD的光调节蛋白(蛋白ID: Q03200, A2Y886)含量明显高于NAD。这与抽穗期NBD叶片氮素积累显著高于NAD的结果一致。严重干旱胁迫通过氧化胁迫导致光合作用的非气孔限制,抑制了叶片中rubisco酶和电子传递复合物的功能,从而影响光合作用机制[48.].在本研究中,NBD中二磷酸核酮糖羧化酶相关蛋白(蛋白ID: A6N182)的表达显著上调(p< 0.05)。结果表明,在小穗分化期间米饭遭受严重的干旱后,叶绿素和净光合速率的参数可通过限制气孔开口,抑制PS II光反应和电子传输过程,降低细胞间二氧化碳浓度49.].干旱前大量施氮有利于光合色素和二磷酸核酮糖羧化酶等相关蛋白的合成和表达,增加气孔开度,维持较高的电子传递速率和rubisco酶活性。从而保护了光合作用的生化过程,增强了水稻对干旱胁迫的适应性。
一般代谢在干旱前后对重氮施用的反应
N对植物抗旱性的调控与施氮量和胁迫强度有关[50.].前人研究发现,适宜的高施氮肥水平促进了植株根系对硝酸盐的吸收和分配,有效提高了植株的抗逆性[51.].本研究表明,在抽穗期,NBD各器官和地上部的氮素积累量显著高于NAD。Nagy等认为GS可以作为植物抗旱性的重要代谢指标[52.].过表达NR和GS1基因可显著维持植物氮素同化能力,提高植物抗旱性[53.].本研究表明,与NAD相比,NBD处理显著提高了氨基酸合成和氮代谢相关蛋白(蛋白ID: Q2QN11, P93402)的表达,这与NBD处理提高了NR、GS等关键氮代谢酶活性是一致的。这说明NBD中的氮代谢酶促进硝态氮和铵态氮的同化,合成渗透物质脯氨酸等化合物,维持细胞水分平衡。此外,还原NO3.-叶片能更有效地消耗能量,这对于增强叶片在干旱条件下的热能耗散,缓解过剩光能对光合作用的抑制具有重要作用[54.].在水分压力下,nh4+植物组织中的积累是由蛋白质水解增加和增强的轻呼吸,而过量的NH4+累积对植物是有毒的[55.].GDH能直接催化NH的缩合反应4+与α-酮戊二酸(α-OG)结合形成NH中的Glu4+同化途径,从而降低NH的不良反应4+在水稻上[56.].本研究表明,NBD的GDH活性显著高于NAD,相关代谢酶蛋白(蛋白ID: Q7Y0E0)表达显著增加。氮作为有机渗透调节物质合成的重要元素,在改善植物农艺生理特性方面起着关键作用[50.].钟等。证明,较高的氮施用水平增强了水稻适应性对干旱胁迫,如血液疗程增加和叶片中的脯氨酸含量增加[22.].该研究表明,与NAD相比,NBD显着增加了蔗糖合酶相关蛋白(蛋白ID:A2YA46)和羧酸还原相关蛋白(蛋白质ID:A6N182)的表达,这与可溶性糖和游离脯氨酸含量的增加一致。这表明NBD促进了游离脯氨酸作为分子伴侣,以稳定细胞膜的完整性和蛋白质结构,并增加渗透调节物质,例如可溶性糖以调节细胞渗透潜力。
干旱前后重施氮肥对抗氧化反应的影响
在干旱胁迫下呼吸链中的电子转移堵塞导致反应性氧物种如h的过度积累2O2,O.2·ˉ和细胞内的氮氧化物[9],引起严重的氧化应激,导致细胞内膜结构和细胞器的氧化损伤[4].干旱胁迫在植物抗氧化酶系统中增加了过氧化氢酶,SOD和谷胱甘肽过氧化物酶的活性[38.].增加N肥料应用的水平可以进一步增强植物的抗氧化能力,抑制膜过氧化,缓解叶过氧化损伤的加重[57.].该研究表明,响应于氧化还原方法,反应性氧代谢性源和氧化应激,显着富集NBD和NAD的生物过程,如差异蛋白质基因本体富集所证明的(图。6).NBD治疗显着提高了与NAD相比过氧化物酶相关蛋白(蛋白ID:A2YPX5,A3REN3,Q5U1N4)的表达,这与抗氧化酶如过氧化物酶,SOD和过氧化氢酶的增加的增加一致。MDA是膜脂质过氧化的最终产物,其含量的变化是血浆膜损伤程度的重要指标之一[6].该研究表明,NBD显着降低了脂氧合酶相关蛋白(蛋白质ID:A2XL22)的表达,这与NBD中的MDA含量的降低一致。这表明严重的干旱诱导植物中叶细胞膜和电解质渗漏的崩解,NBD可以有助于减轻脂氧基酶在膜脂质过氧化中的累积,并减少对细胞膜系统的损伤。谷胱甘肽系统在可活性氧物种和生物保护中发挥着重要作用[58.].该研究表明,与NAD相比,NBD显着上调了谷胱甘肽过氧化物酶相关蛋白(蛋白ID:Q10L56,B8ASV8)的表达。谷胱甘肽是抗坏血酸 - 谷胱甘肽循环的基本组分,并且增加了NBD中的谷胱甘肽过氧化物酶活性促进了严重干旱下细胞内氧化还原潜力的维持,并且还催化了H的减少2O2和脂质过氧化,从而保护叶片免受环境应激产生的活性氧物质毒性。这表明,在干旱条件下植物抗氧化系统中N的调节涉及多种机制(图。8).干旱前重施氮肥提高了抗氧化酶系统中过氧化物酶和超氧化物歧化酶的活性,增加了抗氧化非酶系统中还原型谷胱甘肽的含量和抗坏血酸/脱氢抗坏血酸比值。这对于维持干旱胁迫下细胞的氧化还原状态和信号转导,在一定程度上有效缓解氧化应激,最终保护光合作用的生化效应,提高产量具有重要作用。
结论
不同施氮方式对水稻抗旱性有显著差异。结果表明,在水稻青少年穗分化阶段的干旱胁迫下,干旱前后的重氮施用对产量,生理和生化参数,蛋白质和代谢机制不同。与大氮施用后的重度氮施用相比,在水稻品种武信沟286,重氮施用前脱脂率明显增加产量,净光合速率,叶绿素和渗透叶片的血液含量,以及抗氧化酶和氮的活性在不同程度上也增加了代谢酶,这有助于缓解光合作用和叶片脂质过氧化的抑制,最终提高产率。234ACE和518DMS与光合途径,氧化还原途径,蔗糖代谢和氮代谢途径以及抗性相关蛋白质密切相关。这些结果表明,干旱前的重氮施用可能是改善水稻耐受性的重要途径,并提供了一种新的生态视角,就氮气对水稻水进行调节的影响。
方法
植物材料
吴峰友286(五峰A /中辉286,栽培稻L.)是江西大型种植区的水稻品种之一,是华南地区的主要产区。在这项研究中,由中国水稻研究所的武信楼286武功286次进行实验材料。2017年和2018年,该实验是在江西省江西省江西省农业大学进行的(28°45'N,115°49'e,平均年降雨量:1650毫米,年平均气温:17.7°C)。在塑料桶中培养米植物,高25.0cm高,30.0cm上径和23.5cm底部直径。实验土壤为0〜20厘米的表土,这是几年的未使用的荒地。2017年和2018年土壤的物理和化学特征如表所示5.土壤自然干燥后,用FT-1000A土壤崩解机(山东阿贝尔仪器有限公司)进行粉碎。然后用100毫米的筛网进行筛分。移栽前先淹土2周。在四叶期,将生长良好、一致的水稻秧苗移栽到桶中,按每桶三苗、每孔一苗的规格种植。结合植株营养需求,每桶施用钙镁磷肥5.0 g,氯化钾1.0 g作为基肥。以尿素为氮源,每桶施氮5.0 g,用量为180 kg·hm- 2.根据实验设计,在移植前将混合幼苗阶段肥料加入铲斗中,并且其余的氮肥与每个生长阶段的灌溉组合施用。在移植前,该领域均匀管理,并且在移植后,根据高产培养的方式进行植物,水,疾病和虫害。每次受精后要注意天气变化,塑料桶被移动到雨雨中的雨伞,以避免水溢出引起的肥料元素的损失,铲斗直接在雨后返回外部空间停了下来。
实验治疗
根据以往的研究结果,双季稻在幼穗分化阶段极易受到干旱胁迫[59.].因此,在青少年分化的阶段选择了武信元286种品种,为干旱胁迫。2017年,早稻稻在3月16日播种并于4月26日移植.2月25日的两种治疗方法,5月14日的Tiller肥料和胰蛋白肥料。2018年3月15日播种了早稻米并于4月25日移植。分别于4月24日,5月13日和6月13日植物肥料施用基础肥料。根据实验设计,对于NAD植物,将1g氮肥施用为基础肥料,将1克氮肥施用为耕作肥,3克氮肥施用为穗肥。对于NBD和对照处理(CK),将1g氮肥施用为碱肥料,将3克氮肥施用为耕作肥,施用1克氮肥作为穗肥(表6).CK植株在生育期保持3 ~ 5 cm水层,各处理在收获前1周进行破水处理。2017年和2018年干旱胁迫期间的平均气温分别为26.1℃和24.9℃,平均相对湿度分别为81.6和77.1%。干旱胁迫,水桶中的水的NAD和NBD植物被手动倾斜倒出,然后进入玻璃房子十天的干旱(年轻的茎长绒毛的增长点,和小穗的长度是1毫米)。土壤水分监测采用JK710土壤水分测定仪(测量范围:0-50%,北京华西泰创科技有限公司)。对不同处理组的土壤施加渐进干旱胁迫,每晚测定不同处理组的土壤含水量。随着干旱胁迫的进行,不同处理组的叶片开始枯萎卷曲,土壤表面变得块状开裂。土壤含水量< 5% (m3./ M.3.)达到NAD组和NBD组(模拟严重干旱)的严重干旱标准。干旱结束后,将NAD植株和NBD植株从玻璃房移出,分别进行复水和施用穗肥(见表2)6).根据随机块设计,NAD和NBD处理都是用3个重复进行的,每个物质含有20个桶。
产量和产量组分
在成熟的阶段,从每个治疗组中选择7种具有一致生长的水稻植物,并且它们均分离它们的圆锥,叶和茎。在阳光下风干后,研究了每株植物的产量和产量组分(每株植物的有效胰腺的数量,种子设定率,穗长,1000粒重量)。
干物质积累、分配和转运
每个处理在抽穗期和收获期选择5株生长状况相同的水稻植株,将叶片、穗部和茎部分开包装后进行碾磨。然后将它们放入80°C的烤箱中干燥至恒重。成熟期,自然晒干至恒重,重量均匀。根据文献计算茎鞘物质出口百分比(EPMSS)和茎鞘物质转化百分比(TPMSS) [59.].
氮素积累计算
氮含量按微量凯氏定氮法测定[60.].大米(全植物茎,叶和穗)的器官被高速粉碎机(浙江荣豪工业和贸易有限公司,中国)粉碎,加热了0.5g粉末样品并用硫酸消化和催化剂并用腐血氮素测定器分析(FOSE KJELTEC 8400,Danmephus Analytical仪器有限公司)。
SPAD值
用手持SPAD-502叶绿素仪(叶绿素仪SPAD-502 Plus,浙江拓普科技有限公司)测定第二叶上叶的SPAD值。干旱胁迫后,选择5株生长稳定的水稻植株,对每个处理进行标记。取叶顶、叶中、叶基的平均值作为叶片的SPAD值。
净光合速率
干旱结束后测定净光合速率。叶片的净光合速率是使用9:00至11:00的CI-340光合作用者(CID Bio-Science)测定。在晴朗的一天。在每种治疗中,选择5种植物的前第二叶,并选择具有良好且一致的生长标记和测量。
渗透调节物质和酶活性的测定
叶片标本于干旱处理结束后的同一天采集。各渗透调节物质的测定原则如下:采用蒽酮比色法测定可溶性糖[61.]可溶性蛋白质含量[62.通过BCA方法确定,丙二醛(MDA)含量[63.[硫氨基吡啶酸法测定,以及自由脯氨酸的提取[64.],按磺基水杨酸法进行(实验所用试剂盒由苏州科明生物技术有限公司提供)。
测定酶活性的步骤是每个处理组取3株水稻主茎上第二叶的0.1 g叶片样品。然后将叶片样品直接用液态N冷冻,置于−80°C冰箱中保存。硝酸还原酶(NR)活性[65.],谷氨酰胺合成酶(GS)[66.]和谷氨酰胺脱氢酶(GDH)[62.用套件(Comin,China,中国)确定。
代谢产物提取和数据分析
在干旱结束后的第一天,对不同施氮量的水稻叶片进行取样。每个处理组取8个生物重复。准确称取NAD和NBD各样品80 mg,加入内标并研磨;离心15 min后提取上清200 μl,低温保存至液相色谱-质谱(LC-MS)测定。在整个LC-MS分析过程中,每8个样品均注入qc以评估分析的重复能力。使用转换软件MS converter将原始数据转换为常用数据格式文件mzML,并使用XCMS软件(版本号:1.50.1)进行代谢数据的峰提取。然后目测所有叶片样品的基峰色谱图后,进一步去除QC样品中相对标准偏差(rsd)大于30%的变量。离子过滤后共得到正离子3882个,负离子3199个,筛选率分别为89.91和94.95%。特征产率超过75%,证明代谢组学方法是可靠的。
蛋白质提取和数据分析
NBD和NAD在3个生物重复中进行(每次重复选择同一桶植物)。提取蛋白质时,将样品用液氮研磨成粉末,然后按照蛋白质样品的提取工艺进行酶解消化[67.].通过在萃取后使用BCA试剂盒进行蛋白质浓度测量。同时,通过SDS-PAGE电泳可视化每个蛋白质样品的蛋白质带,透明和均匀,蛋白质没有降解,并且每个车道具有良好的并行性(图。4).样品经安捷伦1100高效液相色谱后反相色谱质谱分析。使用Proteome Discoverer™2.2 (Thermo, USA)对实验获得的数据进行分析,使用的数据库为Uniprot GOA大米数据库(www。http://www.ebi.ac.uk/goa/).
统计分析
SPSS 19.0 (v20.0, SPSS Inc.,芝加哥,美国)和Origin 9.0进行显著性差异分析和绘图;p< 0.05表示方差检验结果显著。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- NBD:
-
干旱前大量施氮
- nad:
-
旱后重施氮肥
- SPAD:
-
土壤和植物分析仪的开发
- epm:
-
茎鞘物质出口百分比
- 及:
-
转化百分比的茎和鞘
- MDA:
-
丙二醛
- SOD:
-
超氧化物歧化酶
- NR:
-
硝酸还原酶
- g:
-
谷氨酰胺合成酶
- GDH:
-
谷氨酸脱氢酶
- PCA:
-
主成分分析
- (O) PLS-DA:
-
(正交)部分最小二乘判别分析
- DMs:
-
微分代谢物
- DEPS:
-
差异表达的蛋白质
- KEGG:
-
京都基因和基因组百科全书
参考文献
- 1。
Cattivelli L, Rizza F, Badeck FW, Mazzucotelli E, Mastrangelo AM, Francia E, Mare C, Tondellia A, Stanca AM。作物抗旱性的改善:从育种到基因组学的综合观点。农田作物学报2008;105:1-14。
- 2。
Tomas M,Flexas J,Copolovici L,Galmes J,Hallik L,Medrano H,Ribas-Carbo M,Tosens T,Vislap v,Niinemets u.叶子解剖学在确定叶片扩散电导中的重要性2跨物种:数量限制和模型放大。J Exp Bot. 2013; 64:2269-81。
- 3.
Tosens T, Nishida K, Gago J, Coopman RE, Cabrera HM, Carriqui M, Laanisto L, Morales LV,纳达尔M, Rojas R,等。35种蕨类植物及其盟友的光合能力:叶肉CO2扩散是一个关键特征。新植醇。2016;209:1576 - 90。
- 4.
植物中的氧化剂和抗氧化信号:生理环境中氧化应激概念的重新评估。植物学报。2005;28:1056-71。
- 5。
Murata N,Takahashi S,Nishiyama Y,Allakhverdiev Si。在环境压力下照相系统的光抑制。BBA-Bioenergetics。1767; 2007:414-21。
- 6。
卞姆,江耶。肯塔基蓝草的叶片和根部的反应性氧物种,抗氧化酶活性和基因表达模式,响应干旱胁迫和恢复。SCI Hortic-Amsterdam。2009; 120:264-70。
- 7。
抗氧化应激、抗氧化剂与应激耐受性。植物科学进展。2002;7:405-10。
- 8.
Naya L,Ladrera R,Ramos J,Gonzalez Em,Arresegor C,Minchin Fr,BECAN M.碳代谢和抗氧化剂抗污染苜蓿结节对干旱胁迫的响应和随后的植物恢复。植物理性。2007; 144:1104-14。
- 9.
Anjum SA, Ashraf U, Tanveer M, Khan I, Hussain S, Shahzad B, Wang LC。干旱诱导3个玉米杂交种生长、渗透积累和抗氧化代谢的变化。植物学报2017;8 - 12。
- 10.
关键词:水分亏缺,玉米,茎叶,碳氮代谢Lupinus白色[J] .实验机器人,2001;52:1063-70 .]
- 11.
关键词:藜麦,水分亏缺胁迫,碳氮分配abstract:足底。2016;243:591 - 603。
- 12.
黄丽丽,李明杰,周凯,孙涛,胡丽丽,李春英,马富伟。干旱胁迫对土壤铵态氮和硝态氮吸收代谢的响应马吕斯prunifolia.植物生理学通讯。2018;127:185-93。
- 13。
王W,Vinocur B,Shoseyov O,Altman A.植物热冲击蛋白和分子伴侣在非生物应激反应中的作用。趋势植物SCI。2004; 9:244-52。
- 14。
卡埃罗,拉莫斯PC,特谢拉AR,费雷拉RB。泛素/蛋白酶体途径浮萍属小经受热休克。Biol platarum。2008; 52:695-702。
- 15.
唐宁,张浩,李晓华,肖建华,熊立忠。转录因子的结构性激活osbzip46.改善水稻的耐旱耐受性。植物理性。2012; 158:1755-68。
- 16。
关键词:渗透胁迫,aba依赖,aba不依赖,信号转导植物学报。2014;21:133-9。
- 17。
张国宝,易海燕,龚建敏。拟南芥乙烯/茉莉酸- nrt信号模块协调硝酸盐的再分配和生长与环境适应之间的权衡。植物细胞。2014;26:3984 - 98。
- 18.
Undurraga SF, Ibarrahenriquez C, Fredes I, Alvarez JM, Gutierrez RA。拟南芥根中硝酸盐的信号传导和早期反应。J Exp Bot. 2017; 68:2541-51。
- 19.
施氮增加了水稻根系发育可塑性的表达。土壤植物。2014;378:139-52。
- 20.
王志强,张伟,张浩,刘丽,杨军,张建军。不同灌溉方式对水稻产量和水氮利用效率的影响及其互作效应。田间作物Res. 2016; 193:54-69。
- 21.
郭建新,贾玉梅,陈海华,张丽娟,杨建军,张军,胡晓燕,叶霞,李艳,周勇。氮素水平和形态差异及钾供应对小麦生长、光合作用和养分吸收的影响。Sci众议员2019;六枝。
- 22.
钟超,曹旭,胡军,朱丽,张军,黄俊,金强。不同氮水平下水稻光合作用对水分胁迫的适应。植物学报2017;8:1079。
- 23。
Belder P, Bouman BAM, Spiertz JHJ, Pen SB, Castaneda AR, Visperas RM。淹水和好氧水稻的作物性能、氮和水利用。土壤植物。2005;273:167 - 82。
- 24。
Andrade FH,Echarte L,Rizzalli R,Maggiora Ad,Casanovas M.氮素或水胁迫下玉米内核预测。农作物科学。2002; 42:1173-9。
- 25。
Din J,Khan Su,Ali I,Gurmani AR。油菜品种对干旱胁迫的生理和农艺响应。J Anim Plant SCI。2011; 21:78-82。
- 26。
Talling Ak,Oleary GJ,Ferwerda JG,Jones SD,Fitzgerald J,Rodriguez D,Belford R.小麦氮气和水胁迫的遥感。现场裁剪。2007; 104:77-85。
- 27。
Moser Sb,Feil B,Jampatong S,邮票P.前波动干旱,氮肥率和品种对粮食产量,产量组分和热带玉米收获指数的影响。农业局管理。2006; 81:41-58。
- 28。
周W,LV TF,杨ZP,王T,傅Y,陈Y,HU BH,Ren WJ。优化氮气管理响应水稻产量增加的形态学机制。SCI REP。2017; 7:17226。
- 29。
补偿机制缓解了气候变暖和干旱对木材形成的影响。植物学报。2016;39:1338-52。
- 30。
Benevenuto RF, Agapitotenfen SZ, Vilperte V, Wikmark OG, Rensburg PJV, Nodari RO。通过蛋白质组学和代谢组学分析确定转基因玉米对非生物胁迫的分子响应。《公共科学图书馆•综合》。2017;12:e0173069。
- 31.
王志强,王志强,王志强,等。作物非生物胁迫响应机制的蛋白质组学分析。植物学报2013;4:71。
- 32.
柯玉琴,韩国强,何慧卿,李建新。干旱胁迫下水稻蛋白质和磷蛋白的差异调控。Biochem Bioph Res Co. 2009; 379:133-8。
- 33.
陆地水稻的蛋白质组学分析(栽培稻(L.)暴露于间歇性缺水。蛋白质j . 2014; 33:221-30。
- 34.
郝鹏,朱廷堂,顾爱清,吕德伟,葛鹏,陈光新,李晓华,闫玉梅。干旱胁迫下耐受性和敏感性小麦品种不同幼苗器官的综合蛋白质组分析。蛋白质组学。2015;15:1544 - 63。
- 35。
Casey TM, Khan JM, Bringans SD, Koudelka T, Takle PS, Downs RA, Livk A, Syme RA, Tan KC, Lipscombe RJ。蛋白质组覆盖的重现性分析和使用等压质量标签(iTRAQ和TMT)的定量。蛋白质组学杂志2016;16:384-92。
- 36。
摩根ja。水供应的相互作用和n在小麦中。植物理性。1984; 76:112-7。
- 37。
曹晓春,钟超,Sajid H,朱立峰,张建华,吴丽华,金强。水分条件和施氮量对水稻光合参数、生理特性和农艺性状的影响。植物学报。2017;39:135。
- 38。
干旱胁迫和氮素水平对印度番泻叶抗氧化酶、脯氨酸和产量的影响Cassia Angustifolia.L.)。J MED植物RES。2012; 6:2125-30。
- 39。
杨建军,彭士宾,张志军,王志强,维斯佩拉斯RM,朱启生。籽粒和干物质产量及同化物的分配japonica./籼稻杂交水稻。作物科学。2002;42:766 - 72。
- 40.
关键词:渗透胁迫,蛋白降解,支链氨基酸拟南芥.足底。2017;246:737-47。
- 41。
Osmolovskaya N, Shumilina J, Kim A, Didio A, Grishina T, Bilova T, Keltsieva OA, Zhukov V, Tikhonovich I, Tarakhovskaya E, Frolov A, Wessjohann LA。干旱胁迫研究方法:实验设置和生理特性。中华医学杂志。2018;17:4089。
- 42。
Flexas J, Bota J, Loreto F, Cornic G, Sharkey TD。干旱和盐胁迫下C3.植物。植物BIOL。2004; 6:269-79。
- 43.
漫画G.干旱胁迫通过降低气孔孔来抑制光合作用 - 而不是通过影响ATP合成来抑制光合作用。趋势植物SCI。2000; 5:187-8。
- 44.
陈志强,陈志强,陈志强,等。干旱胁迫对小麦叶片光合作用的影响。J Photochem Photobiol B. 2014; 137:107-15。
- 45.
刘智,Dickmann DI。水氮互作对两个杂交杨树无性系净光合作用、气孔导度和水分利用效率的影响杂志杆菌。2010;97:507-12。
- 46.
李文涛,熊宝林,王斯文,邓雪萍,尹丽娜,李海波。水氮对马铃薯块茎膨大期源库关系的调节作用《公共科学图书馆•综合》。2016;11:e0146877。
- 47。
Funk JL,Glenwinkel La,Sack L.对天然和侵入物种中的光合作用和非光合氮级分的差分分配。Plos一个。2013; 8:E64502。
- 48。
在温和干旱时期,光合碳还原和碳氧化循环是光系统II活性的主要电子汇。安机器人。2002;89:887 - 94。
- 49。
干旱胁迫和复水向日葵根系衍生的反式玉米苷和脱落酸:相互作用对叶片扩散抗性的控制?植物生态学报。2003;30:365-75。
- 50.
胁迫诱导的细胞分裂素合成通过协调调控水稻碳氮同化提高了抗旱性。植物杂志。2013;163:1609-22。
- 51.
关键词:硝态氮,氮素吸收,氮素利用效率拟南芥用限制和充足的氮气供应栽培。J Exp Bot。2010; 61:2293-302。
- 52.
谷氨酰胺合成酶同工酶和Rubisco对小麦抗旱性的影响。植物生理学报。2013;67:48-54。
- 53。
elkhatib rt,hamerlynck ep,gallardo f,kirby eg。特征的转基因杨树以松细胞溶质谷氨酰胺合成酶基因的异位表达表现出对水胁迫的增强的耐受性。树生理。2004; 24:729-36。
- 54。
Gonzalez-Dugo V,Durand JL,Gastal F.水赤字和作物的氮营养。回顾。Agron Center Dev。2010; 30:529-44。
- 55.
盐胁迫下水稻铵态氮积累的调控栽培稻L.)幼苗。植物刺激科学。2005; 8:397-404。
- 56.
Ferreira LM, De-Souza VM, Tavares OCH, Zonta E, Santacatarina C, De-Souza SR, Fernandes MS, Santos LA。OsAMT1.3表达改变水稻对铵的吸收动力学和根系形态。植物生物技术代表2015;9:221-9。
- 57.
付建明,黄斌斌。叶面施肥对匍匐草耐热性的影响。植物营养学报。2003;26:81-96。
- 58.
朱光华,庄春霞,王玉强,姜立仁,彭XX。不同氮素形态下水稻基因的差异表达及其与硫代谢的关系acta botanica botanica(云南植物研究). 2006;48:1177-84。
- 59。
熊QQ,Zhong L,Du J,Zhu Cl,Peng X,He x,Fu J,Ouyang L,Bian J,Hu L,Sun X,Xu J,周D,Ca Y,Fu H,He H,Chen x.Ribosome profiling reveals the effects of nitrogen application translational regulation of yield recovery after abrupt drought-flood alternation in rice. Plant Physiol Biochem. 2020;155:42–58.
- 60.
Saez-Plaza P, Navas MJ, Wybraniec S, Michałowski T, Asuero AG。介绍了凯氏定氮法测定氮的方法。第二部分。样品准备,工作规模,仪器整理和质量控制。Crit Rev Anal Chem. 2013; 43:224-72。
- 61.
Bodelon OG,Blanch M,Sanchezballesta MT,Escribano Mi,Merodio C.高CO的影响2花青素组合物的水平,储存在低的非冷冻温度下的草莓的抗氧化活性和可溶性糖含量。食品化学。2010; 122:673-8。
- 62.
Campion Em,Loughran St,墙壁D.蛋白质定量和纯度分析。方法Mol Biol。2011; 681:229-58。
- 63.
Castrejon Se,Yatsimirsky Ak。环糊精通过硫氨基吡乙酸法加强荧光测定马酚醛。Talanta。1997年; 44:951-7。
- 64.
Vieira Sm,Silva TM,Gloria MBA。加工对胺和脯氨酸水平的影响以及浓缩橙汁的物理化学特性。食品化学。2010; 119:7-11。
- 65。
Gibon Y, Blaesing OE, Hannemann J, Carillo P, Hohne M, Hendriks JH,等。一个基于机器人的平台,以测量多种酶活性的拟南芥使用一套循环试验:比较酶活性和转录水平的变化在白天的周期和延长的黑暗。植物细胞。2004;16:3304-25。
- 66。
Mongin AA, Hyzinskigarcia MC, Vincent MY, Keller RW。一种测定胶质细胞内谷氨酰胺合成酶和谷氨酰胺酶活性的简单方法。Am J Physiol-Cell Ph. 2011;301:4。
- 67.
关键词:蛋白质组学,蛋白质组学,样品制备,蛋白质组学Nat方法。2009;6:359 - 62。
致谢
不适用。
资金
国家自然科学基金资助项目(no . 31360309, no . 31471441)。资助方在研究设计、数据收集和分析、决定发表或手稿准备方面没有作用。
作者信息
从属关系
贡献
XC,LZ构思和设计了研究。JD,TS和QX进行了实验。XS,LH,CZ XP,XH,JF,LO和JB贡献了新的试剂或分析工具。JD,DZ和HH分析数据。JD写了稿件。所有作者都阅读并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有利益冲突。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
干旱前后重氮处理下‘五峰优286’的DEPs蛋白互作分析
附加文件2:图S2。
干旱前后重施氮肥‘五峰优286’的多元统计分析评分样地和响应排序试验样地(A)主成分分析;(B) PLS-DA;(C) OPLS-DA;(D) OPLS-DA模型的响应排序检查图。
附加文件3:图。S3。
干旱前后重氮处理下‘五峰优286’代谢产物的层次聚类分析列对应NAD和NBD组的重复序列,列对应差异代谢物。红色和绿色分别代表NBD和NAD dm的高表达和低表达。有关代谢产物的更多信息,请参阅补充数据集S2.
附加文件4:图S4。
SDS-PAGE电泳前后重氮施用在重氮施用下'武信沟286'的总蛋白质检测。NBD-1,NBD-2和NBD-3;NAD-1,NAD-2和NAD-3代表三种不同治疗的重复。
附加文件5:DataSet S1。
干旱前后重氮处理下‘五峰优286’的DEPs鉴定信息
附加文件6:DataSet S2。
干旱前后重氮处理下‘五峰优286’的dm鉴定信息
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
杜军,沈涛,熊强。et al。结合蛋白质组学、代谢组学和生理分析对干旱前后重施氮水稻生长和产量的影响。BMC植物BIOL.20.556(2020)。https://doi.org/10.1186/s12870-020-02772-y
收到了:
接受:
发表:
关键字
- 大米
- 氮
- 干旱
- 蛋白质组
- 代谢物