抽象的
背景
Haematococcus lacustris虾青素(AST)是虾青素(AST)的理想来源,虾青素储存在含有酯化AST (EAST)和三酰基甘油(TAG)的油体内。二酰基甘油酰基转移酶(DGATs)催化酰基辅酶a依赖的TAG生物合成的最后一步,也被认为是参与EAST生物合成的关键酶H. Lapustris。以前的研究已经确定了四种推定的DGAT2编码基因h . lacustris,只有HPDGAT2D允许恢复标签生物合成,但标签中HPDGAT2S的工程潜力仍然存在含糊不清。
结果
五个推定的DGAT2基因(HpDGAT2A,HpDGAT2B,HpDGAT2C,HpDGAT2D,HpDGAT2E)被确定在h . lacustris.转录分析表明HpDGAT2A,HpDGAT2D,HpDGAT2E在强光和缺氮条件下,TAG和EAST基因显著增加,且积累模式不同。功能互补研究表明,HpDGAT2A、HpDGAT2B、HpDGAT2D和HpDGAT2E能够恢复酶活性差异较大、缺乏TAG的酵母菌株(H1246)的TAG合成。脂肪酸(FA)分析表明,HpDGAT2A、HpDGAT2D和HpDGAT2E在酵母细胞中合成TAG时更倾向于单不饱和脂肪酸脂酰辅酶as (MUFAs),而不是HpDGAT2B,根据它们的饲养策略,它们更倾向于多不饱和脂肪酸脂酰辅酶as (PUFAs)。异源表达HpDGAT2D在拟南芥和衣藻reinhardtii显著提高了TAG含量,明显促进了MUFAs和PUFAs的含量。
结论
我们通过整合HpDGAT2s的表达模式、AST/TAG的积累、功能互补以及在酵母、植物和藻类中的异体表达,对HpDGAT2s的特性进行了系统的研究。这些结果(1)更新了基因模型HpDGAT2s(2)证明HpDGAT2s具有合成TAG的能力,(3)对MUFAs和PUFAs表现出强烈的偏好,(4)通过基因工程方法提供调控TAG合成的靶基因。
背景
三酰基甘油(TAG)是真核生物的主要能量储存形式,是生物柴油生产的一个有前景的来源[1].微藻能有效吸收CO2在大气中,将其变成丰富的高价值产品,包括多糖,脂质,蛋白质,颜料和生物燃料[2,3.,4,5].由于微藻光合效率高、繁殖速度快、生长周期短,被认为是解决能源危机和环境污染的最佳选择[6].进一步了解TAG积累的途径和调控机制将有助于微藻的基因工程[7,8,9].
一般而言,TAG的生物合成是在内质网中进行的,TAG的组装可分为酰基辅酶a依赖和酰基辅酶a独立途径[10].二酰基甘油酰基转移酶(DGATs)催化sn- 1,2 -二酰基甘油(DAG)最终酰化形成TAG,这是酰基辅酶a依赖的TAG形成途径的最后和限制步骤[11].这些酶是一些油料作物和藻类中TAG生物合成的瓶颈,因此被认为是控制TAG生产的关键靶点[11].在高等植物和微藻中,dgat主要分为四类:(1) DGAT1的膜结合形式,(2)DGAT2的膜结合形式与DGAT1具有低序列相似性,(3)DGAT3的可溶性形式,定位于胞质,(4)WS/DGAT的双重功能,既具有蜡酯活性,又具有TAG生物合成活性[12,13,14,15,16,17,18].DGAT1s在许多高等植物和微藻的TAG积累中起关键作用,而DGAT2s似乎在含有不寻常脂肪酸(FAs)的TAG的形成中起重要作用[14].有强有力的证据证明DGAT3和WS / DGAT在微藻中的生物合成标记中的参与[15,16].通常情况下,在许多微藻中只鉴定出1 ~ 2个DGAT1s等位基因,而DGAT2s通常存在多个等位基因,这表明DGAT2s在TAG生物合成中可能具有重要作用[12,13,14,19,20.,21,22,23,24,25,26,27].最近,大多数关于藻类DGAT的知识来自有限的藻类物种,包括衣藻reinhardtii,小球藻ellipsoidea,Nannchloropsis Oceanica,Lobosphaera切割,小球藻/Chromochloris zofingiensis,Myrmecia切割,Phaeodactylum tricornutum,其中dgat已被用于分子克隆、生化鉴定、功能表征,并评估其调节TAG生物合成的工程潜力[19,20.,21,22,23,24,25,26,27,28].有趣的是,不同的微藻是dgat的突出候选,不同的dgat的功能是独特的或种特异性的。因此,dgat在其他工业相关的虾青素(AST)生产藻类中,如Haematococcus lacustris,获得了研究兴趣[29].
h . lacustris是一种绿色微藻,以在胁迫条件下合成最高量AST(4%干重)的能力而闻名[29,30.].天然AST是一种红色的keto类动物骨,具有强烈的抗氧化能力和重要的商业价值[31].有趣的是,在环境胁迫下,TAG的积累伴随着AST的积累,AST由玉米黄质和角黄质生物合成后积累,储存在含有酯化AST (EAST)和三酰基甘油(TAG)的油体中h . lacustris[32,33,34,35].此外,之前的研究表明,东部的主要形式包括单酯AST(M-AST,70%)和二酯(D-AST,25%)[36,37,38,39,40].虽然应激诱导的标签和AST积累的确切机制h . lacustris尚不清楚,几种证据表明两种化合物的生物合成似乎通过转录水平的油生物合成酶的调节来连接[40].事实上,AST的积累似乎依赖于FAs的生物合成和TAG的积累[34,41].此外,推测某些dgat是催化谷草转氨酶酯化的候选酶h . pluvialis[34].最近,虽然有四种假定的2型dgat (HpDGAT2A,HpDGAT2B,HpDGAT2D,HpDGAT2E),从h . pluvialis(lacustris),只有HpDGAT2D具有恢复TAG缺失酵母菌株中TAG生物合成的能力[42], DGAT2s在TAG生物合成中的工程潜力尚不明确。
利用工业上相关的高产藻类h . lacustris在本研究中,我们通过整合HpDGAT2s的表达模式、AST/TAG的积累、功能互补以及在酵母、植物和藻类中的异体表达,对HpDGAT2s的特性进行了系统的研究。五个公认的HpDGAT2s被识别出来h . lacustris,其中的转录水平HPDGAT2.高光(HL)和缺氮(ND)条件下,TAG和EAST基因显著增加,且积累模式明显。HpDGAT2A、HpDGAT2D和HpDGAT2E比HpDGAT2B具有较强的TAG生物合成活性,并优先选择单不饱和脂肪酸脂酰辅酶(MUFAs)和多不饱和脂肪酸脂酰辅酶(PUFAs)。超表达实验表明了其工程潜力HpDGAT2D调节藻类和植物中TAG的积累和FAs的组成。
结果
分子克隆及生物信息学分析HPDGAT2.基因
基于h . lacustris转录组数据库(43],五个推定DGAT2.利用来自不同藻类的其他DGAT2s,用BLAST方法预测基因(附加文件)1:表S1)作为查询。通过CDNA末端(种族)方法的快速扩增和起始密码子,终止密码子,5'-未转移区域(5'-UTR),3'-未转换区域(3'-未转换区域)获得五个基因的全长mRNA序列。确定3'-UTR)和聚(a)特征尾部。五个公认的DGAT2.基因被设计出来,HpDGAT2A,HpDGAT2B,HpDGAT2C,HpDGAT2D,HpDGAT2E,通过多序列比对CrDGAT2s,其中四个,HpDGAT2A,HpDGAT2B,HpDGAT2D,HpDGAT2E,包含一个全长开放阅读框(ORF),而HpDGAT2C是部分序列(附加文件2:表S2和附加文件3.:表S3)。然后,利用引物进行PCR,克隆并测序(附加文件)4:表S4),在NCBI Genbank中重命名和存放(HpDGAT2A: MT875161;HpDGAT2B: MT875162;HpDGAT2C: MT875163;HpDGAT2D: MT875164;HpDGAT2E: MT875165)。迄今为止,这是绿藻中DGAT2s的最高剂量h . lacustris.基于与基因模型的比较HpDGAT2s由Nguyen等人报道[42],我们的结果证实有五个HpDGAT2s成员h . lacustris.一般情况下,在许多微藻中只发现了DGAT1s的一个或两个等位基因,而在微藻中发现了多个等位基因DGAT2s通常都存在[14].
为了深入了解HpDGAT2s的生化特性,我们对其分子量(分子量)、等电点(pI)、亚细胞定位、跨膜结构域(TM)、信号肽(SP)、叶绿体转移肽(CTP)和磷酸化位点(Phos)进行了分析。除HpDGAT2C中有CTP外,HpDGAT2s蛋白序列中无SP或CTP(附加文件)2:表S2)。除了HPDGAT2B中的三个TMS之外,所有PDGAT2S蛋白序列中有两个TMS(附加文件2:表S2和附加文件5图S1),这与DGAT1和DGAT2的膜结合形式一致[14].此外,在HPDGAT2蛋白序列中预测了14-30个磷酸化位点(附加文件2:表S2和附加文件6图S2),说明DGAT2酶活性中磷酸化起重要作用,因为DGAT1酶活性受小鼠DGAT1丝氨酸磷酸化位点的影响[44], TmDGAT1 [45和BnDGAT1 [46].这些磷酸化位点是否对HpDGAT2在体内的功能调控具有重要作用尚不清楚。
为了进一步分析HpDGAT2s与其他DGAT2s的保守结构域(CDs)及其进化关系,构建了HpDGAT2s与其他DGAT2s的序列比对和系统发育树。CDs分析表明,HaeDGAT2s中含有7个CDs [26,47,48],包括对DGAT2活性至关重要的YF/YFP阻断(CD1);HPHG/EPHS block (CD2),建议部分组成活性位点;PxxR (x =随机氨基酸)阻断(CD3);xGGxAE块(CD4);RxGFx(K/R)xAxxxGxx(L/V) VPxxxFG block (CD5),是动植物中最长的保守序列;PxxxVVGxPIxVP块(CD6);和RHK块(CD7)(附加文件7:图。S3)。如附加文件所示7:无花果。S3,有两个完全保守氨基酸残基(P和苯丙氨酸,脯氨酸F)在所有DGAT2s,这与先前的报道是一致的,表明这两个高度保守的残留可能位于活跃的站点的酶和酶的活动作出重大贡献49].来自真核藻类和植物的HPDGAT2和其他DGAT矫形器的系统发育分析在附加档案中示出了8:图S4,与之前大部分结果一致[20.,21,22,23,24,25,26].简单地说,所有的HpDGAT2s都与DGAT2s的同源物聚集在一起,这些同源物不同于DGAT的其他亚家族,包括DGAT1、DGAT3和DGAT/WSD。在5个HpDGAT2s中,HpDGAT2A与CrDGAT2A、CzDGAT2A、CzDGAT2B、LiDGAT2A和LiDGAT2B形成一个单系亚群(BS: 100%)。HpDGAT2B和HpDGAT2E与CrDGAT2B、CzDGAT2E和CrDGAT2C高度接近(BS: 98%)。HpDGAT2C与CzDGAT2C和LiDGAT2C进化接近(BS: 100%)。HpDGAT2D与CrDGAT2D和CzDGAT2D构建了单系亚群(BS: 73%)。
AST和TAG的积累HpDGAT2s高光和缺氮胁迫下的基因转录
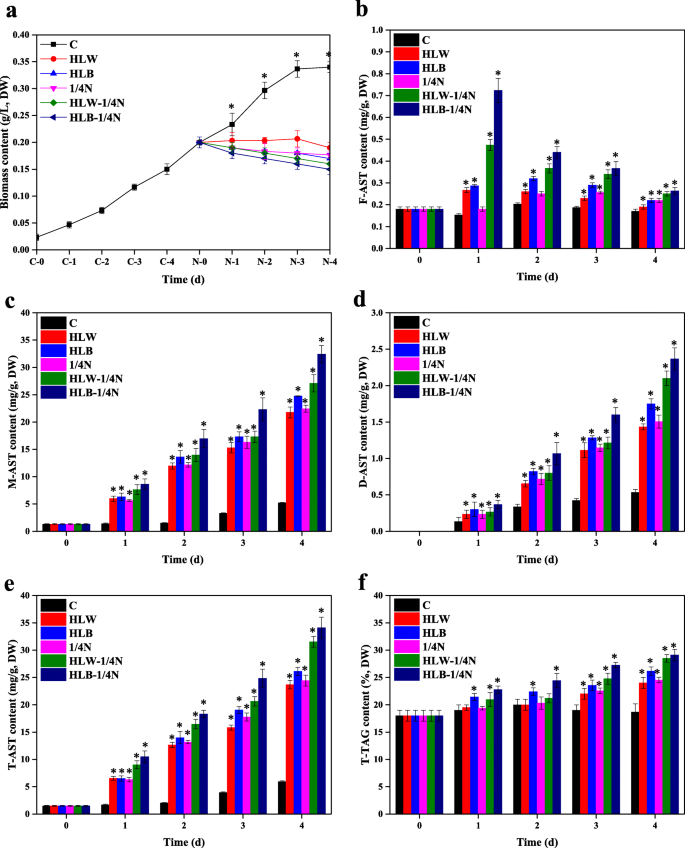
强光(HL)和缺氮(无氮,ND)胁迫能有效促进谷草转氨酶AST和TAG的积累h . lacustris[32,33,34,50,51,52,53].然而,在这种情况下,藻类的生长完全受到限制[51,52,53].最近,我们团队完成了氮缺乏(氮含量与对照BBM培养基的生长相比,如0、1/4 N、1/2 N和3/4 N)对藻类生长和AST和TAG积累的影响的研究。结果表明,在1/4 N的胁迫下,由于藻类生长的一定程度,AST产量最高。因此,在本手稿中,选择1/4 N条件作为缺氮胁迫进行进一步试验。来理解HpDGAT2s藻体生物量的时间-过程模式、表达量、总AST (T-AST)和总TAG (T-TAG)含量h . lacustris在HL,1/4 n和双HL-1 / 4N应力下进行(图。1).
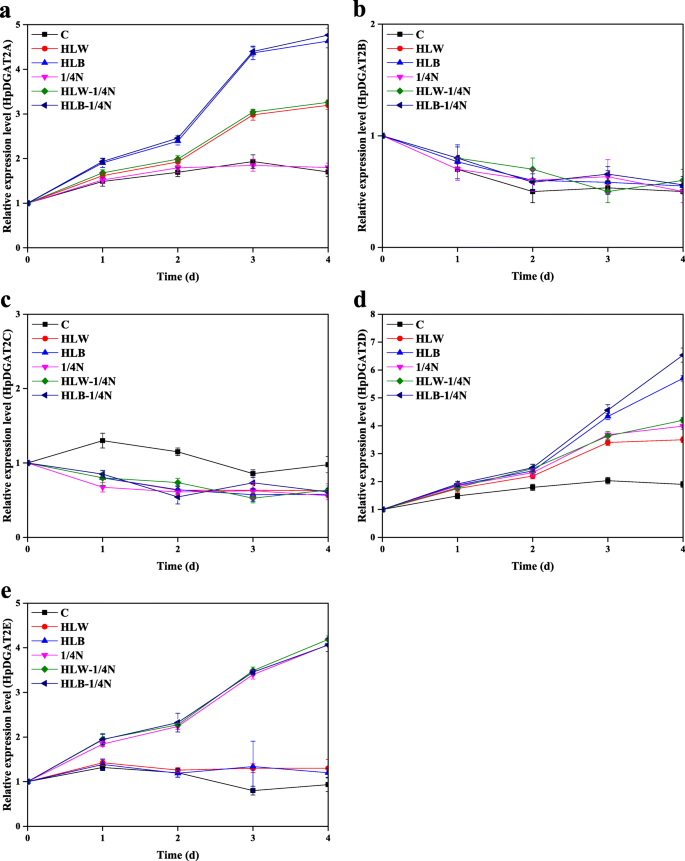
如图所示。1a,与对照相比,HL、1/4 N和双HL-1/4 N胁迫抑制藻类生长。T-AST的产生和组成如图所示。1抵扣。从这些结果可以得出以下结论:(1)M-AST为主要形式;(2)与1/4 N胁迫相比,HL诱导AST积累更有效,特别是在高蓝光(HLB)条件下;(3) HL + 1/4 N双刺激可能是改善AST积累的较好选择。在HLB-1/4 N、HLB-1/4 N、HLB-1/4 N、HLB-1/4 N和HLW条件下,T-TAG含量从第1天到第4天缓慢增加,分别达到最大值29.5、28.7、26.8、25.2和24.8%,分别比对照高159.5、155.1、144.9、136.2和134.1%(图1)。1f). HL、1/4 N和双HL-1/4 N胁迫对TAG和AST积累的影响与前人研究基本一致,即HL和ND条件下AST和脂类生物合成增强,前者与后者生物合成协调[34,41].以往的研究表明,DGAT酶可能同时负责AST的酯化和TAG的生物合成h . lacustris[33,34].qRT-PCR结果显示(图。2),HPDGAT2基因转录表达水平在HL,1/4 N和双HL-1 / 4N应力下表现出明显的图案。五HpDGAT2s,HpDGAT2B和HpDGAT2C表达水平下降,但保持不变(图。2b和c)HpDGAT2A和HpDGAT2E表达水平在暴露4 d时升高并达到最大值,且呈HL和1/4 N胁迫依赖性(图)。2A和e),而HpDGAT2D表达量增加,且呈胁迫依赖性(图。2d)。这些结果表明这些结果HpDGAT2A,HpDGAT2D,HpDGAT2E基因在施加压力下参与AST和标签生物合成。
HpDGAT2s在酵母中的功能互补
为了验证推定的HPDGAT2S酶的功能,克隆了ORF编码序列(附加文件4:表S4)进入PYES2.0质粒和异源性酵母菌株的异质表达S. Cerevisiae.H1246 (∆dga1∆lro1∆are1∆are2),缺乏标签合成活动。突变型(H1246)酵母可以在表达这四种基因中的至少一种时形成标签。此外,野生型(INVSC1)和H1246-EV(H1246遍布空载体PYES2.0)酵母菌株分别用作正和阴性对照。
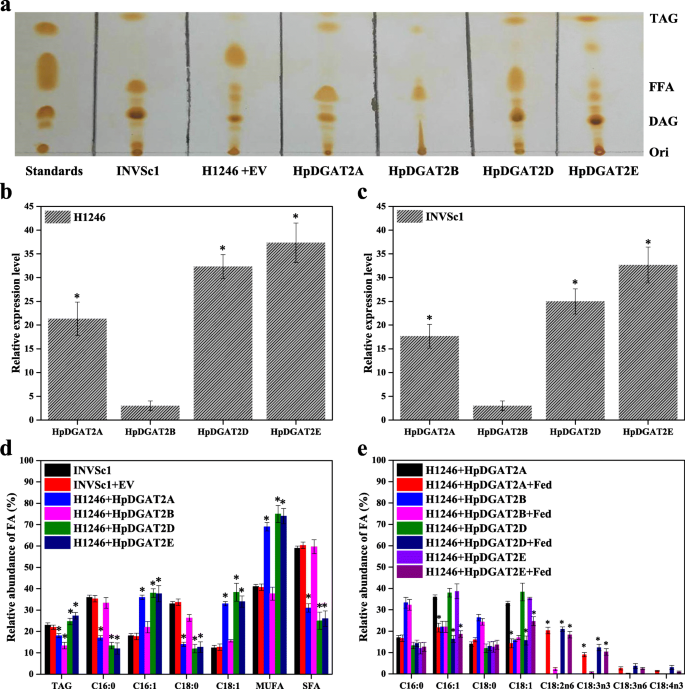
的表达HpDGAT2A,HpDGAT2B,HpDGAT2D,HpDGAT2E在H1246细胞中的不同级别恢复标记生物合成,如TLC板上的显着标签点所示(图。3.相比之下,a)。HpDGAT2B在H1246细胞中的表达产生了不明显的TAG水平,考虑到H1246细胞中低转录表达水平,表明该编码蛋白无功能(图。3.乐队h . lacustris细胞(图。2b).然而,有限的FA组成酿酒酵母可能导致HPDGAT2B的低标签内容。HPDGAT2A,HPDGAT2B,HPDGAT2D和HPDGAT2E在酵母中恢复生物合成标签的能力LED我们检查了FA底物特异性。如图1中所示。3.B和C,HpDGAT2A,HpDGAT2B,HpDGAT2D,HpDGAT2E基因在H1246和INVSc1细胞中异源表达。转化后的H1246和INVSc1细胞提取的TAG含量和FA组成变化相似。如图所示。3.d,表达的标签内容HpDGAT2A和HpDGAT2B与对照(INVSc1和INVSc1 + EV)相比,H1246细胞的表达分别降低了78.3和56.5%。表达的TAG内容HpDGAT2D和HpDGAT2E分别比对照组高108.7和122.7%。为进一步检测FA底物特异性,采用GC法分析转化H1246和INVSc1细胞的FAs。如图所示。3.D,与对照相比,MUFA棕榈酰酸(C16:1)和油酸(C18:1)大量增加HpDGAT2A -,HpDGAT2D -,HpDGAT2E- 以饱和脂肪酸(SFAs)为代价,包括棕榈酸(C16:0)和硬脂酸(C18:0)的费用。然而,几乎所有H1246转化系在不同的DGAT酶水平上都观察到这种趋势[20.,23,24,25,26,27,28].
功能描述HpDGAT2s在酿酒酵母细胞。一个对对照品提取的总脂进行薄层色谱分析S. Cerevisiae.(INVSc1) TAG-deficientS. Cerevisiae.(H1246)转化的H1246细胞HpDGAT2s空向量(EV)。b和c的转录表达水平HpDGAT2s转化H1246和INVSc1细胞HpDGAT2s.基因表达水平归一化为内源性ACT1基因。d转化后的INVSc1和H1246细胞中TAG含量及脂肪酸相对丰度HpDGAT2s.e转化H1246细胞中脂肪酸的相对丰度HpDGAT2s通过饲养C18:2n6、C18:3n3、C18:3n6和C18:4n3的游离脂肪酸,培养24 h
考虑到酵母菌株(C16:0、C18:0、C16:1和C18:1)中FA含量有限,部分PUFAs富集于h . lacustris,包括亚油酸(C18:2n6),α亚麻酸(C18:3n3),γ-亚麻酸(C18:3n6)和parinaric酸(C18:4n3)通过饲喂策略检测HpDGAT2A、HpDGAT2B、HpDGAT2D和HpDGAT2E酶的底物特异性。HpDGAT2A、HpDGAT2D和HpDGAT2E具有类似的倾向,以C16:1和C18:1为代价将这些PUFAs合并到TAG中,其模式如下:3.e).考虑到C18:2n6和C18:3n3富含h . lacustris,我们有理由推测这些HpDGAT2s可能在富含C18:2n6-和c18:3n3的TAG生产中具有潜力[32,33,34].HpDGAT2A、HpDGAT2D和HpDGAT2E酶对PUFAs的偏好强于对MUFAs的偏好,这是因为PUFAs的投喂量高于内源MUFAs的含量。Zienkiewicz等人(2018)也证实了这一现象,他们在TAG中加入了一些PUFAs,代价是16:1和18:1 inLiDGAT1 -,Lidgat2.1-,LiDGAT2.2 -,LiDGAT2.3酵母表达(23),在CzDGAT2C -表达突变H1246酵母细胞[26通过喂养试验。然而,从酵母细胞表达的TAG片段的FA谱HpDGAT2B未见明显变化,提示为无功能蛋白(图。3.e)。
HpDGAT2D外源表达促进TAG的生物合成,并促进其相对MUFAs和PUFAs的丰度c . reinhardtii
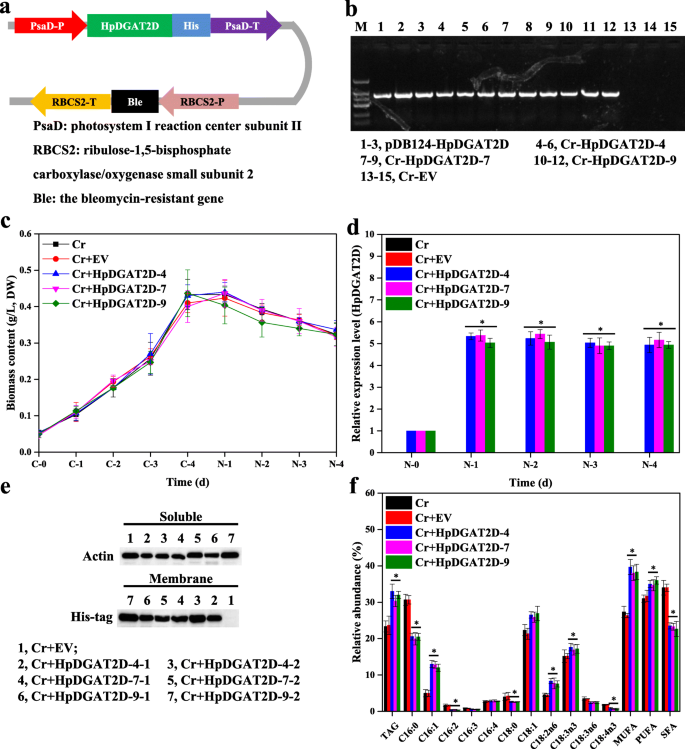
为了调查HPDGAT2S和其工程潜力调节藻类标签生物合成的工程潜力的可能生物学作用,我们产生了HpDGAT2D进化上封闭的绿藻中的异种表达谱c . reinhardtiiCC849。HpDGAT2D由于TAG在酵母细胞中具有较强的生物合成活性,因此选择进行进一步的实验。3.)和高转录表达水平h . lacustris在应力条件下(图。2d)。
核转化表达载体pDB124(附加文件9:图S5),其特征为c . reinhardtiiCC849是由深圳大学胡张立教授赠送的,由于CC849中含有过表达的磁带,所以经过修改后用于本研究HpDGAT2D-His融合与博莱霉素抗性祝福在验证内源启动子和终止子的控制下的基因PSAD.和RBCS2分别基因(图。4a).密码子偏好(HpDGAT2D)是根据藻类进行优化的c . reinhardtii(附加文件10:图S6)。在补充有博莱霉素的龙头上选择转化体(筛选超过20个推定的转化体)并通过基因组PCR证实。外源性HpDGAT2D-His融合基因被整合到藻类染色体中HPDGAT2D-CR.而在WT细胞中未检测到任何信号(图2)。4b和附加文件11:图。S7A)。三条异源表达线,HpDGAT2D-4,HpDGAT2D-7,HpDGAT2D-9在4天分批培养的ND条件下,在Nd条件下,在Nd条件下,在Nd条件下表现出转录水平的最大增加(高于控制),转基因系和对照之间的细胞生长没有显着差异(图。4c和d)。此外,通过western blot分析,使用his标记的抗体验证HpDGAT2D蛋白在体内的异体表达。三个异种表达系的膜蛋白中都有条带(HpDGAT2D-4,HpDGAT2D-7,HpDGAT2D-9),但是不存在于可溶性蛋白质中,其与HPDGAT2D是跨膜酶一致的(图。4e和附加文件11:图S7b)。HpDGAT2D在ND条件下,外源表达导致TAG含量显著增加(约1.4倍)(图2)。4f)。HpDGAT2D外源表达也影响了FA在tag中的表达谱(图。4f)。在MUFA的相对丰度(C16:1和C18:1)和PUFA(C18:2N6和C18:3N3)中观察到显着增加,伴随着SFAS(C16:0和C18:0)的显着降低,一些PUFA(C16:2,C16:3,C18:3N6和C18:4N3)。这些结果表明(1)HPDGAT2D对MUFA和PUFA的更强的偏好而不是SFA;(2)所有PUFA,HPDGAT2D选择C18:2N6和C18:3N3作为第一选项而不是C16:2,C16:3,C18:3N6和C18:4N3;(3)这些优选的基材富集c . reinhardtii.这一趋势与酵母细胞饲喂试验结果一致(图。3.D和e)和以前的研究Nodgat1a.表达c . reinhardtiiUVM4和CzDGAT1A在含油藻类中表达n .大洋洲分别由Wei et al.(2017)和Mao et al.(2019)发表[20.,22].
不同的表达HpDGAT2D在衣藻reinhardtii细胞。一个表达式向量的构造。PsaD-P,启动子的PSAD.基因;他的标签,6,他的编码基因;PsaD-T,终结者PSAD.基因;RBCS2-P,启动子的RBCS2基因;祝福,博来霉素-Resistant基因;RBCS-T,终结者红细胞表面基因。b基因组水平检测HpDGAT2D在c . reinhardtii细胞。c控制和1/4 N条件下生物量含量的时间过程。d的转录表达水平HpDGAT2D在c . reinhardtii细胞。基因表达水平归一化为内源性肌动蛋白基因。eHpDGAT2D-His标签融合蛋白与his标记抗体的Western blotting。分离可溶性蛋白和膜蛋白并进行印迹。以已知的可溶性蛋白肌动蛋白作为对照。f标签含量和脂肪酸的相对丰度c . reinhardtii细胞转化HpDGAT2D
HpDGAT2D异源表达增强种子油含量及其相对MUFA和PUFA丰富答:芥
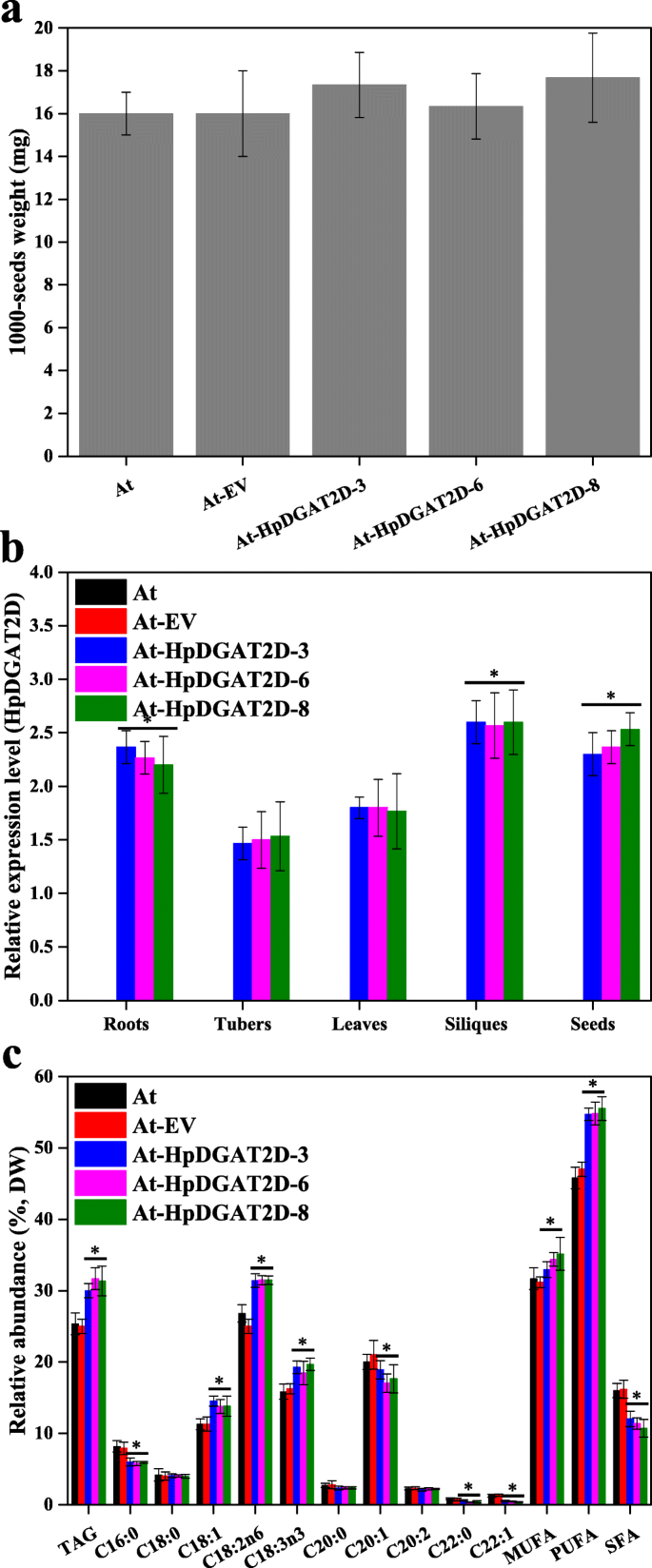
探索HPDGAT2S作为操纵acy-CoA池的工具,并在高等植物中制造生物合成的工具,HpDGAT2D异常表达拟南芥.三个答:芥独立表达式T2代系(At-HpDGAT2D-3,At-HpDGAT2D-6,At-HpDGAT2D-8选择进一步详细分析。转基因系和未转化的对照之间没有可见的形态差异(例如,1000种重量)答:芥(无花果。5a). qRT-PCR结果显示HpDGAT2D转录产物在不同组织器官(根、块茎、叶、角果和种子)中均有不同程度的表达。5b)野生型的转化答:芥和HpDGAT2D结果表明,大豆籽粒TAG含量(120.0 ~ 126.4%)高于对照(图2)。5C)。同样,来自标签的FA谱的进一步GC分析显示,PUFA和MUFA显着增加,伴随着SFA的显着降低(图。5然而,确切的变化过程比酵母和酵母中复杂得多c . reinhardtii细胞。sfa中C16:0、C22:0降低,C18:0、C20:0保持稳定。在MUFAs和PUFAs中,HpDGAT2D在TAG生物合成中优先选择C18:1、C18:2n6和C18:3n3,而不是C20:1、C20:2和C22:1。这些结果与酵母细胞的结果基本一致(图。3.D和e)和c . reinhardtii细胞(图。4c). Guo et al.(2017)指出CeDGAT1基因表达能促进FA的生物合成,提高种子质量和含油量答:芥和B. Napus.[21].
讨论
通常,在大多数压力条件下同时显着增强AST和标签的累积h . lacustris,例如HL及ND情况[29,30.,31,32,33,34,35,50,51,52,53].然而,一般而言,缺氮严重限制藻类生长[51,52,53].最近,我们的研究结果表明,在一定的生长水平下,在1/4 N的胁迫下AST产量最高。因此,在本稿件中,进一步实验选择1/4 N条件作为ND条件。我们的研究结果表明(1)HL和1/4 N条件下T-AST和T-TAG含量分别显著增加,这与前人的一些研究一致[34,41];(2) M-AST为主要形式,这也被前人的研究证实[36,37,38,39];(3)与1/4 N胁迫相比,HL诱导AST积累更有效,特别是在高蓝光条件下,本研究已证实[50];(4)耦合HL和1/4 n双刺激可能是AST和标签累积的更好选择h . lacustris(无花果。1) [53].虽然应激的具体机制诱导了TAG和AST的积累h . lacustris在很大程度上是未知的,一些证据暗示TAG和AST的生物合成似乎与转录水平上的油生物合成酶的调节有关[34,41].事实上,AST积累取决于FA生物合成和标签积累h . lacustris[34,41].最近,张等人。(2019)报道称,合成的AST主要用脂肪酸C18:1酯化,并储存在填充标签的脂液滴中c . zofingiensis[40].不同于h . lacustris,尽管AST以良好的与标签的方式累积,但AST从玉米蛋白ketolated并与FA合成无关c . zofingiensis[40].这种对比度结果可能是由于这两个生物的遗传性状的差异。在AST生产藻类中涉及东生物合成的酶h . lacustris和c . zofingiensis尚不清楚。
DGATs催化酰基辅酶a依赖性TAG生成途径的末端步骤,并代表操纵TAG生成的关键靶点[11].目前,来自不同藻类种类的DGATS已被广泛研究,这表明多样性的微藻是DGAT的突出候选者,并且不同的DGAT的功能是独特的或特定的物种[19,20.,21,22,23,24,25,26,27,28].显然,HPDGAT2.基因在HL、1/4 N和双HL-1/4 N胁迫条件下有不同的调控模式,表明这些酶共同参与AST和TAG的生物合成(图1)。2).毛等。(2019)表示CzDGAT1A,CzDGTT1,CzDGTT5和CzDGTT8表达模式不同的ND均显著上调[20.].Chen et al.(2015)指出MiDGAT2A被ND胁迫调节,导致TAG积累[28].此外,之前的研究表明,DGAT是涉及标签和东累积的可能候选酶[34],这使得在生产ast的工业藻类中识别dgat变得更加有趣h . lacustris[29].最近,虽然在中国发现了4个推测的2型DGAT基因h . pluvialis(lacustris),只有HpDGAT2D有能力恢复TAG缺失酵母菌株的生物合成[42], DGAT2s在TAG生物合成中的工程潜力尚不明确。
在这项研究中,我们证明了藻类中有五种DGAT2S基因h . lacustris,我们重命名HpDGAT2A,HpDGAT2B,HpDGAT2C,HpDGAT2D,HpDGAT2E根据序列比对和系统发育分析结果(附加文件3.:表S3和附加文件8:图S4),更新了先前关于4个假定的2型dgat的报告h . pluvialis(lacustris)转录组数据库[42].通常,在多种微藻中仅存在DGAT1的一个或两个拷贝,而通常存在多种DGAT2的副本[14].在各种藻类生物中,DGAT2s的数量是种特异性的,例如:衣藻reinhardtii(5),Nannchloropsis Oceanica(13),Lobosphaera切割(3),小球藻Zofingiensis.(8),Myrmecia切割(2)Phaeodactylum tricornutum(4)[20.,23,24,26,27,28].亚细胞定位预测揭示了HpDGAT2s的不同亚位置(附加文件)2表S2),这与绿藻dgat亚细胞定位预测结果一致c . reinhardtii[24),c . zofingiensis[20.].所有HpDGAT2s中均存在2 ~ 3个TMs(附加文件)2:表S2和附加文件5:图。S1),暗示它们是DGAT1和DGAT2的膜结合形式的成员[14].有趣的是,在所有的HpDGAT2s中预测了大量的磷酸化位点(附加文件)2:表S2和附加文件6:图。表明磷酸化在DGAT2S酶活性中起重要作用,因为DGAT1酶活性受小鼠DGAT1的磷酸化[44], BnaDGAT1 [46]和TmaDGAT1 [45].这些磷酸化位点是否对HpDGAT2在体内的功能调控具有重要作用尚不清楚。之前在高等植物和微藻DGAT2酶中发现的CDs [26,47,48]也存在于HpDGAT2s中,但保存程度不同(附加文件7图S3),包括对DGAT2活性至关重要的YF/YFP阻断(CD1);HPHG/EPHS阻断(CD4),建议部分组成活性位点;RxGFx(K/R)xAxxxGxx(L/V) VPxxxFG block (CD5),是动植物中最长的保守序列。小鼠DGAT2中一些假定的脂质结合基元(FLxLxxx和FVLF block)在HpDGAT2s和algaldgat2s中并不保守[47,48,54].此外,在所有DGAT2s中有两个完全保守的氨基酸残基(脯氨酸,P和苯丙氨酸,F),这与之前的报道一致,这两个高度保守的残基可能位于酶的活性位点[49].
表征HPDGAT2S的角色,四个HpDGAT2s基因全长编码序列(附加文件2表S2)在缺乏tag的酵母株H1246中异源表达[55].结果表明,所有的HpDGAT2s基因在酶活性上有很大的差异(图。3.a).进一步在酵母中进行功能表征,发现HpDGAT2D和HpDGAT2E比HpDGAT2A和HpDGAT2B更能增加TAG含量,使酵母的TAG含量显著增加108.7-122.7%(图2)。3.d)。这种更高的活动为DGAT2提供了一种替代候选者,以调制藻类中的标签累积。然而,先前的研究检测到,只有HPDGAT2D才能在标签缺陷酵母菌株中恢复标签生物合成[42].相反,在我们的研究中,HpDGAT2B在H1246细胞中表达产生不明显的TAG,可能是由于有限的FAs酿酒酵母.这是正确的,至少对于CzDGTT1在酵母中表达,随着添加另外两种游离FAs时TAG含量的增加[20.].也有可能HpDGAT2B可能不是真正的DGAT,而是另一种类型的转移酶,不能仅根据蛋白序列进行区分[20.].这种现象通常出现在绿藻中,如CrDGTT1 ~ CrDGTT3具有功能,而CrDGTT4则不具有功能[24].NoDGAT1A和CzDGTT1,而不是NoDGAT1B,是功能性的[20.,22].
在DGAT酶的催化下,dag和fatty酰基coas是TAG生物合成的必要底物[20.,22,24].通过FA谱分析确定脂酰辅酶a底物特异性。HpDGAT2s在酵母细胞中表现出对MUFAs (C16:1和C18:1)的强烈偏好。然而,几乎所有H1246转化系在不同的DGAT酶水平上都观察到这种趋势[20.,23,24,26,27,28].考虑到存在的酵母细胞中的有限FAS,一些存在的PUFA(例如,C18:2N6,C18:3N3,C18:3N6和C18:4N3)h . lacustris但不选择在酵母细胞中,通过使用进料策略来测试酰基-CoA底物特异性。有趣的是,除了HPDGAT2B外,除了HPDGAT2B之外的所有HPDGAT2S对酵母细胞中具有不同模式的PUFA的广泛偏好,特别是C18:2N6和C18:3N3,其也丰富h . lacustris,表明这些HPDGAT2S可能具有富含富普斯的标签生产工程的潜力。Zienkiewicz等人也证实了这种现象。(2018),他以C16:1和C18:1的费用纳入标签的一些PUFALiDGAT1 -,Lidgat2.1-,LiDGAT2.2 -,LiDGAT2.3酵母表达(23),CzDGAT2C-表达酵母突变体H1246细胞[26通过喂养试验。与低转录一致HpDGAT2B在藻类和酵母细胞中,进料试验表明了Pufas的低偏好,再次表明非官能编码蛋白质。尽管酰基-CoA底物偏好的特征在于,但需要在将来阐明DAG(原核和真核和真核)底物特异性。
为了评估HPDGAT2S的可能生物功能和工程潜力,在本研究中,在进化近绿藻中产生异源表达线的异源表达线c . reinhardtiiCC849和模型厂答:芥.这并不奇怪HpDGAT2D外源表达增强了两者的TAG含量c . reinhardtiiCC849(约1.4倍)答:芥(~ 1.2倍)。Guo et al.(2017)指出CeDGAT1基因表达能促进FA的生物合成,提高种子质量和含油量答:芥和B. Napus.[21].与对照相比,在1/4 N的胁迫条件下,4天分批培养,TAG含量显著增加HpDGAT2D异种表达系在相同胁迫条件下的表达(图。4b),可能是由于高转录水平(图。4d). Wei et al.(2017)检测到,在充氮条件下, NoDGAT1A表达c . reinhardtiiUVM4对标签累积没有影响,而在氮气耗尽条件下观察到标签增强[22].然而,Mao等人(2019年)宣布了这一点CzDGAT1A在含油藻类中表达n .大洋洲标签水平导致相当大的增加(〜2.8倍)[20.].与酵母细胞对MUFAs和PUFAs的强烈偏好一致,HpDGAT2D也表现出类似的趋势c . reinhardtii.具体地,HPDGAT2D首先选择C16:1,C18:1,C18:2N6和C18:3N3而不是C16:2,C16:3,C16:4,C18:3N6和C18:4N3。有趣的是,这些优选的基质富集c . reinhardtii,表明了它们在工程方面的潜力c . reinhardtii用于MUFA-和PUFAS的标签生产。这种趋势也与喂养试验中酵母细胞的结果一致(图。3.d和e)并与以前的研究一致Nodgat1a.表达c . reinhardtiiUVM4和CzDGAT1A在含油藻类中表达n .大洋洲分别由Wei et al.(2017)和Mao et al.(2019)发表[20.,22].在高等植物中,表示dgats.通常提高显影种子中的油沉积[56].例如,强烈的表达DGAT1.在大豆种子发育过程中比在其他组织中检测到的57].然而,DGAT1.转录物也存在于其他植物组织中,尽管它们在开发胚胎和花瓣中最强58].在目前的研究中HpDGAT2D转录物在不同组织器官的转基因系中在不同组织器官的转基因中致表达,包括根,块茎,叶片,单体和种子,不同于不同的范围(图。5b).然而,FA变化的确切过程比酵母和酵母复杂得多c . reinhardtii细胞(图。5c). HpDGAT2D在TAG生物合成中表现出对C18:1、C18:2n6、C18:3n3的强烈偏好,而非C20:1、C20:2、C22:1的偏好,这与酵母细胞的偏好基本一致(图2)。3.D和e)和c . reinhardtii细胞(图。4c).已有研究表明,种子特异性的过表达EgDGAT2在答:芥与野生型相比,增强了种子标签中的PUFA C18:2N6和C18:3N3的含量拟南芥.C18:0和C20:0 SFAs在种子TAG中的比例EgDGAT2转基因系相相同减少[59].在Thraustochytrium aureum,DGAT2.在野生型的强大种子特异性启动子下的表达答:芥增加C18:2N6内容[60].此外,转基因植株无其他表型差异。因此,HpDGAT2D在提高其他油料作物的比油产量方面有很大潜力。
虽然之前建议DGAT可以参与AST的酯化h . lacustris[34],没有直接的生物化学证据来支持这一假设。最近,所有10CzDGATs在重组的ast生产酵母株中表达[61]检查这些酶是否负责东生物合成。但是,没有检测到东部,表明在AST Esterification中的CZDGATS的空功能[20.].考虑到两种AST产藻菌株在遗传性状和AST生物合成途径上的差异,c . zofingiensis和h . lacustris,未来我们将进一步研究HpDGAT2s在AST酯化反应中的可能作用。
结论
在这里,我们通过整合HpDGAT2s在酵母、植物和藻类中的表达模式、AST/TAG积累、功能互补和异种表达来深入研究HpDGAT2s。五个公认的DGAT2s基因(HpDGAT2A,HpDGAT2B,HpDGAT2C,HpDGAT2D,HpDGAT2E)被确定在h . lacustrisBLAST和CD分析。这些DGAT2s基因显示出在应力条件下显着增加的转录水平,导致了重大标签和东部积累。功能互补证明HPDGAT2A,HPDGAT2B,HPDGAT2D和HPDGAT2E能够恢复标签缺陷酵母菌株(H1246)中的标签合成,其酶活性很大。FA型材测定揭示了HPDGAT2A,HPDGAT2D和HPDGAT2E,但不是HPDGAT2B,用于酵母细胞中标签合成的优选MUFA,并通过喂养策略显示PUFAS偏好。异源表达HpDGAT2D在野生型答:芥和c . reinhardtii显著增加了TAG含量,对MUFAs和PUFAs表现出强烈的偏好,表明在植物和藻类中增加特定TAG产量的工程潜力。
方法
藻种及生长条件
的单细胞藻类Haematococcus Lazustris / Pluvialis(FACHB-712)菌株从山西农业大学水生生物研究所淡水藻类培养收集物中获得,由山西农业大学分子农业与生物能源研究所(IMAB)维持。h . lacustris在250ml Erlenmeyer烧瓶中在100-ml BBM培养基中培养。将这些Erlenmeyer烧瓶置于25μmol/ m的培养条件下2/s光照强度,在23±1°C下,日循环为光照12 h /黑暗12 h。每天两次摇匀培养液固定时间。在HL处理中,在光照强度为500 μmol/m的连续白光(390 ~ 770 nm)或蓝光(420 ~ 500 nm)条件下,适应黑暗48 h后,再将后期呈指数增长的培养物(生物量含量约为200 mg/L)转移到新鲜培养基中2/ s没有光/暗循环。对于1/4 n氮缺乏处理,收集预培养和深色的细胞并用无氮BBM培养基洗涤,然后用1/4氮含量进一步转移到新鲜的BBM培养基中(与其中相同BBM培养基)在没有光/暗循环的情况下在控制培养条件下。对于HL和1/4 n双重应激(HL-1/4 N)处理,将预先培养和暗诱导的细胞转移到具有1/4氮含量的新鲜培养基中,在相同的连续白光或蓝光下。控制条件下的培养物用作对照样品。将这些预培养和黑暗诱导的细胞在离心和用灭菌水中洗涤后被取样为起点(N-0天)。培养物被取样N-1,N-2,N-3和治疗后N-4天。通过离心(在4℃下5分钟的4℃下的13,100g)收获细胞,并在液氮中储存之前用PBS洗涤。对于细胞干生物质测定,收集20ml细胞培养物并洗涤三次,然后将含有细胞的EP管在DW3冷冻干燥器(Heto Wind Winner,Denmark)中干燥。
HpDGAT2s的克隆及生物信息学分析
对推测的HpDGAT2s基因进行了预测和克隆:(1)利用本地BLAST程序进行预测DGAT2s基于的基因h . lacustris带有注释的CzDGAT2s和CrDGAT2s的转录组数据库(附加文件1(2)利用cDNA末端快速扩增(rapid amplification of cDNA ends, RACEs)法获得mRNA全长序列,并确定其转录起始位点、终止位点和编码序列;(3)各序列的开放阅读框(open reading frame, ORF)HpDGAT2s再次PCR获得基因,构建不同表达质粒。本研究使用的引物均列于附加文件中4:表S4。利用Compute pI/ Mw、TargetP、ChloroP、SignalP、TMHMM和NetPhos工具分别预测HpDGAT2s的分子量(Mw)、等电子点(pI)、亚细胞定位、信号肽(SP)、叶绿体转移肽(CTP)、跨膜区(TM)和磷酸化位点(Phos) [62].来自植物和藻类的HPDGAT2和其他DGATS使用CLUSTALX对齐[63].使用PhyML构建HpDGAT2s和其他DGAT蛋白的最大似然树,并从400个重复中推断bootstrap (BS)值[64,65].用MEGA5进行系统发育树的图形表示和编辑[66和TreeDyn (v198.3) [67].
RNA分离和定量实时PCR
用EasySpin RNA提取试剂盒(Aidlab Biotech,北京,中国)提取总RNA,用NanoDrop 2000c (Thermo Scientific, USA)定量。按照PrimeScript®RT Enzyme Mix I (TaKaRa DRR047A, China)试剂盒的指令合成第一链cdna。qRT-PCR是按照我们之前的研究所描述的,使用7500 Fast Real-Time PCR系统(Applied Biosystems, Waltham, MA, USA)和SYBR Green PCR Master Mix (Invitrogen) [50].使用方法标准化mRNA表达水平肌动蛋白基因作为内部控制。所有分析均基于PCR产物的CT值。采用对比CT方法检测表达水平HpDGAT2s基因[68].
htgat2s在tag缺失酵母H1246中的功能互补
的子HpDGAT2A,HpDGAT2B,HpDGAT2D,HpDGAT2E以cDNA为模板进行pcr扩增,克隆到酵母表达载体pYES2.0 (Invitrogen)中。经酶切和测序确认,重组蛋白pYES2.0-HpDGAT2s质粒转化为S. Cerevisiae.利用s.c. EasyComp转化试剂盒(Invitrogen公司)检测产生标签的菌株INVSc1或缺乏标签的四重突变株H1246 [20.].的表达HPDGAT2.通过qRT-PCR在转录水平验证酵母菌株的基因。在饲养试验中,酵母培养物按上述方法诱导,但培养基中存在1% (w/v) Tergitol NP-40 (Sigma Aldrich, St. Louis, MO, USA)。在诱导开始时,将相应的FAs (C18:2n6, C18:3n3, C18:3n6, C18:4n3)添加到培养液中,最终浓度为100 μM。采集OD600为2.5的样品进行脂质提取、薄层色谱分离和气相色谱分析。
不同的表达HpDGAT2D在c . reinhardtii
核转化表达载体pDB124(附加文件9:图S5),其特征为c . reinhardtiiCC849,深圳大学胡张丽教授赠予[69],在修改后在本研究中使用。密码子偏好(HpDGAT2D)是根据藻类进行优化的c . reinhardtii(附加文件10:图S6)。密码子偏好优化的编码序列HpDGAT2D被放大并克隆到Pml我和BmtI位点的pDB-124,然后测序验证。得到的质粒用Xba我和转化成c . reinhardtii通过玻璃珠法的CC849应变[70].在具有10μg/ ml玻璃霉素(Sigma-Aldrich)的Tris-乙酸盐 - 磷酸盐(Tap)板上选择转化体。对于ND压力,后来的指数增长c . reinhardtii通过上述部分中描述的方法使用CC849细胞(生物质含量约420mg / L)。整合HpDGAT2D进入衣原体基因组PCR验证,qRT-PCR和western blotting分别检测其转录水平和蛋白表达水平。考虑到HpDGAT2D是一种跨膜蛋白,可溶于膜蛋白HpDGAT2D-Hisfusion-heterologous表达c . reinhardtii如前所述,细胞用于免疫检测[19].
不同的表达HpDGAT2D在答:芥
的编码序列HpDGAT2D被放大并克隆成生态RI /XbapCAMBIA1303的I位点,得到pCAMBIA1303-HpDGAT2D.经酶切和测序验证,pCAMBIA1303-HpDGAT2D向量首先被转化为根癌土壤杆菌应变GV3101 [71.,最后转入答:芥真空渗透植物[72.].在潮霉素(50mg / L)和T2转基因上选择T1代种子答:芥这些线被用于进一步的分析。pCAMBIA1301-的稳定集成HpDGAT2D进入基因组并分别通过基因组PCR和QRT-PCR测定转录表达。
虾青素总量分析
采用高效液相色谱法,使用已知浓度下AST(购自Sigma-Aldrich)的标准曲线定量不同AST形式的含量[50,73.].
脂质提取和脂肪酸分析
总脂提取、标签分离和FAs分析按照前面描述的步骤进行[21,74.,75.,76.].简单地说,50 mg酵母细胞,10 mg冷冻干燥的藻类细胞或10 mg干燥的种子,按照以前报道的方法提取总脂[75.].然后采用薄层色谱(TLC)方法对标签进行分离[21].最后用5% H反酯化2所以4甲醇在85°C的1 h和脂肪酸甲基酯(饥饿)分析一个安捷伦GC配有火焰离子化检测器(FID)和毛细管柱(hp - 88100 m×0.25毫米×0.2毫米)和一个适当的添加量C17:0名声(σ)作为内部标准(75.].
统计分析
为保证重现性,所有实验均重复3次。数据以平均值±SD计算。使用SPSS统计软件包(SPSS Inc., Chicago, IL, USA)进行统计分析。处理间显著差异采用配对样本t检验进行统计分析。时具有统计学意义P < 0.01.
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。五种dgat蛋白(HpDGAT2A: MT875161;HpDGAT2B: MT875162;HpDGAT2C: MT875163;HpDGAT2D: MT875164;HpDGAT2E: MT875165)Haematococcus lacustris已存入NCBI数据库。本研究使用的所有其他蛋白质序列原始数据均从NCBI数据库(https://www.ncbi.nlm.nih.gov/protein/?term=dgat), GenBank登录号列于附加文件1S1:表。
缩写
- AST:
-
虾青素
- E-AST:
-
酯化虾青素
- 快速地:
-
免费AST.
- M-AST:
-
蒙塞斯特阿特
- D-AST:
-
二酯AST
- 标签:
-
三酰甘油
- DGAT:
-
二酰基甘油酰基转移酶
- 子:
-
开放阅读框架
- 比赛:
-
互补DNA的快速扩增结束
- UTR:
-
翻译区
- HL:
-
高亮度
- ND:
-
氮不足
- MUFAs:
-
单一饱和脂肪酰基-CAA
- pufas:
-
多不饱和脂肪酸acyl-CoAs
参考
- 1.
陈志强,陈志强,陈志强。生物柴油生产中三酰基甘油的分离纯化Nannochloropsis微藻通过膜技术。贪婪的技术。2013; 140:172-8。
- 2.
Bilal M, Rasheed T, Ahmed I, Iqbal HMN。具有工业开发价值的微藻高价值化合物综述。Biosci前面。2017;9:319-42。
- 3.
韩佩尔。微藻作为太阳能蛋白质工厂。Adv Eep Med Biol. 2016; 896:241-62。
- 4.
Ma H,Xiong H,Zhu X,Ji C,Xue J,Li R等。多糖从螺旋藻platensis.改善苯妥英酸引起的小鼠便秘症状。Int J Biol Macromol. 2019; 133:1090-101。
- 5.
Ma H,Chen S,Xiong H,Wang M,Hang W,Zhu X等人。虾青素来自Haematococcus pluvialis通过Keap1/Nrf2/HO-1通路改善化疗药物(阿霉素)致小鼠肝损伤。食品功能。2020;11:4659 - 71。
- 6.
陈勇,徐超。微藻:能源与环境之间的“绿色生物桥梁”。生物技术。2018;38:351-68。
- 7。
李玉玲,李玉玲,李玉玲。微藻三酰基甘油生物合成的分子、生物化学和计算模型研究进展。Biotechnol放置2016;34:1046 - 63。
- 8。
3 .甘油三酯在绿藻中积累的代谢调节:对提高产量的潜在工程靶点的鉴定。植物生态学报2016;14:1649-60。
- 9。
薛军,牛玉峰,黄涛,杨万东,刘俊生,李海云。微藻的遗传改良Phaeodactylum tricornutum促进中性脂质积累。金属底座Eng。2015;27:1-9。
- 10.
贝茨PD,浏览J.不同丁糖合成途径对植物油组成和生物工程的重要性。前植物SCI。2012; 3:147。
- 11.
王志强,王志强,王志强,等。DGAT酶在甘油三脂代谢中的作用[j]。Arch Biochem biophysics . 2018; 655:1-11。
- 12.
陈捷,史密斯公司。海藻中甘油酰基转移酶(dgat)的研究。生物科技J》。2012;162:28-39。
- 13.
刘Q,Siloto Rm,Lehner R,Stone SJ,Weselake RJ。酰基CoA:二酰基甘油酰基转移酶:分子生物学,生物化学和生物技术。Prog Lipid Res。2012; 51:350-77。
- 14.
Xu Y,Caldo Kmp,Pal-Nath D,Ozga J,Lemieux MJ,WeSelake RJ等。酰基 - COA的性质和生物技术应用:二酰基甘油酰基转移酶和磷脂:陆地植物和微藻二酰基甘油酰基转移酶。脂质。2018; 53:663-88。
- 15.
Bagnato C, Prados MB, Franchini GR, Scaglia N, Miranda SE, Beligni MV。对甘油三酯合成的分析揭示了一种绿藻可溶性二酰基甘油酰基转移酶,并为叶绿体途径的潜在酶的成分提供了线索。BMC基因组学。2017;18:223。
- 16.
崔Y,赵家,王Y,秦S,Lu Y.在芦苇海洋硅藻中双函数二酰基甘油酰基转移酶的表征和工程Phaeodactylum tricornutum.Biotechnol生物燃料。2018; 11:32。
- 17.
李F,吴X,林P,鸟D,郑H,Samuels L等。蜡酯合酶/酰基辅酶A:茎蜡酯生物合成所需的二酰基甘油酰基转移酶WSD1拟南芥.植物理性。2008; 148:97-107。
- 18。
Hernández ML, Whitehead L, He Z, Gazda V, Gilday A, Kozhevnikova E, et al.;胞质酰基转移酶有助于蔗糖获救的三酰基甘油的合成拟南芥籽油分解代谢突变体。植物杂志。2012;160:215-25。
- 19。
La Russa M, Bogen C, Uhmeyer A, Doebbe A, Filippone E, Kruse O, et al.;绿色微藻中生成三酰基甘油的3个2型DGAT同源基因功能分析衣藻reinhardtii.j biotechnol。2012; 162:13-20。
- 20。
毛晓霞,吴涛,寇元,石勇,张颖,刘建军。新型模型藻中I型和II型二酰基甘油酰基转移酶的鉴定小球藻Zofingiensis.揭示了它们的功能互补性和工程潜力。Biotechnol生物燃料。2019;28。啊
- 21.
guo x,风扇c,chen y,wang j,yin w,wang rr等。高效酰基 - CoA的鉴定和表征:微藻二酰基甘油酰基转移酶1(DGAT1)基因小球藻ellipsoidea.BMC Plant Biol. 2017;17:48。
- 22.
魏华,石勇,马晓东,潘艳,胡辉,李勇,等。一类二酰基甘油酰基转移酶调节产油微藻中三酰基甘油的生物合成和脂肪酸组成,Nannchloropsis Oceanica.Biotechnol生物燃料。2017;10:174。
- 23.
Zienkiewicz k,宾宁U,Siegler H,Feussner I. T型酰基-CoA:二酰基甘油酰基转移酶植物的氨纶微藻Lobosphaera incisa.BMC Plant Biol. 2018;18:298。
- 24.
刘军,韩东,尹科,胡强,李勇。2型甘油酰基转移酶的鉴定衣藻reinhardtii揭示了它们在三酰基甘油生物合成中的不同底物特异性和功能。工厂J. 2016; 86:3-19。
- 25.
链接本文:Guihéneuf F, Leu S, Zarka A, Khozin-Goldberg I, Khalilov I, Boussiba S.一种新的硅藻酰基辅酶A:二酰基甘油酰基转移酶1-like基因(PtDGAT1)的克隆和分子特性研究Phaeodactylum tricornutum.2月j . 2011; 278:3651 - 66。
- 26.
徐勇,陈国华,陈国华。绿色微藻中2型甘油酰基转移酶的研究Chromochloris zofingiensis.食品化学。2019;67:291-8。
- 27.
龚y,张j,guo x,wan x,梁z,hu cj等。PTDGAT2B的鉴定和表征,DGAT2酰基辅酶A的酰基转移酶A:二氨基甘油酰基转移酶系列Phaeodactylum tricornutum.2月。2013;587:481-7。
- 28.
陈彩霞,孙卓,曹海生,方福林,欧阳丽,周志刚。微藻酰基辅酶a:二酰基甘油酰基转移酶(DGAT) 3个基因的鉴定与鉴定MyRMecia Incisa Reisigl..藻类。2015; 12:280-8。
- 29.
邱克勤,李淑英,黄春华,傅旭,苗旭,凌涛涛,等。虾青素生物炼制的最新进展Haematococcus pluvialis.Bioresour抛光工艺。2019;288:121606。
- 30.
Solovchenko AE。微藻细胞积累虾青素生物学的最新突破。Photosynth杂志2015;125:437-49。
- 31.
梁勇,陈建军,梁勇。产虾青素的绿色微藻Haematococcus pluvialis:从单细胞到高价值的商业产品。植物学报2016;7:531。
- 32.
雷A,陈H,沉G,Hu Z,Chen L,王J.脂肪酸合成基因和脂肪酸积累的表达Haematococcus pluvialis在不同的压力。Biotechnol生物燃料。2012;5:18要。
- 33.
马荣华,张志强,张志强,等。虾青素和脂肪酸通路的基因表达谱分析Haematococcus pluvialis响应于不同的LED照明条件。贪婪的技术。2018; 250:591-602。
- 34.
陈光,王斌,韩德华,陆勇,陈飞,等。虾青素与脂肪酸生物合成协调的分子机制Haematococcus pluvialis(绿藻类)。植物j . 2015; 81:95 - 107。
- 35.
关塔,关SE, Peccia J, Zimmerman JB。超临界二氧化碳萃取微藻中虾青素和三酰甘油副产物的选择性生物精制。Bioresour抛光工艺。2018;269:81-8。
- 36.
苗芳,陆东,李勇,曾敏。虾青素酯的表征Haematococcus pluvialis液相色谱-大气压化学电离质谱联用。学生物化学肛门。2006;352:176 - 81。
- 37.
黄志强,王志强,王志强,等。微藻中虾青素和虾青素酯的含量测定Haematococcus pluvialisLC-(APCI) MS和核磁共振谱对主要类胡萝卜素异构体进行了表征。acta Bioanal Chem. 2009; 395:1613-22。
- 38.
Fábryová T, Tůmová L, Dcd S, Pereira DM, Andrade PB, Valentão P。微藻中虾青素单酯的分离Haematococcus pluvialis采用高效逆流色谱(HPCCC)和高效液相色谱(HPLC)相结合的方法。藻类研究》2020;49:1247。
- 39.
关于类胡萝卜素脂滴在绿藻中的起源的假说杜氏盐藻和Haematococcus.足底。2019;249:31-47。
- 40。
张颖,叶玉英,丁伟,毛鑫,李玉英。玉米黄质非脂肪酸合成酮化虾青素Chromochloris zofingiensis.植物杂志。2020;183:883 - 97。
- 41。
在高光照条件下抑制虾青素的合成并不能消除甘油三酯在绿藻中的积累Haematococcus pluvialis(绿藻类)。J Phycol。2005;41:819-26。
- 42。
陈国栋,徐勇,陈国栋,陈国栋。一种2型甘油酰酰基转移酶的鉴定Haematococcus pluvialis揭示了重组酶的可能构型。脂质。2019; 55:425-33。
- 43。
高志,李勇,吴刚,孙辉,邓胜,等。转录组分析Haematococcus pluvialis:水杨酸(SA)和茉莉酸(JA)诱导虾青素。《公共科学图书馆•综合》。2015;10:e0140609。
- 44。
余军,李勇,邹飞,徐树华,刘鹏。骨骼肌细胞DGAT1的磷酸化及其功能。Biophys众议员2015;1:41-50。
- 45.
Xu J,Francis T,Mietkiewska E,Giblin Em,Barton DL,Zhang Y等。酰基-CoA依赖性二酰基甘油酰基转移酶1(DGAT1)基因的克隆和表征Tropaeolum Majus.以及使用点定向诱变的DGAT蛋白的功能基序的研究,以改变酶活性和油含量。植物Biotechnol J. 2008; 6:799-818。
- 46.
Caldo Kmp,Shen W,Xu Y,Hanley-Bowdoin L,Chen G,WeSelake RJ,等。二酰基甘油酰基转移酶1通过磷酸盐活化并被SNRK1催化磷酸化抑制。植物J. 2018; 96:287-99。
- 47.
刘Q,Siloto RM,Snyder Cl,WeSelake RJ。酵母酰基 - COA的功能和拓扑分析:二酰基甘油酰基转移酶2,一种用于三酰基甘油生物合成必需的内质网。J Biol Chem。2011; 286:13115-26。
- 48.
小鼠酰基辅酶a:二酰基甘油酰基转移酶2的膜结构和关键功能氨基酸残基的鉴定生物化学学报2006;281:40273-82。
- 49.
关键词:甘油酰酰基转移酶,结构与功能分析,生物多样性BMC Res Notes. 2011;4:249。
- 50.
崔H,yu x,王y,崔y,li x,liu z等。真核光合藻类中的进化起源,分子克隆和类胡萝卜素羟基酶的表达。BMC基因组学。2013; 14:457。
- 51.
丁伟,赵颖,徐建伟。褪黑素:一种多功能分子,能触发对强光和氮饥饿应激的防御反应Haematococcus pluvialis.j农业食品化学。2018; 66:7701-11。
- 52.
Recht l,töpfern,batushansky a,sikron n,gibon y,fait a等。代谢物分析和整合模型揭示了绿藻中氮饥饿下的碳分配的代谢约束Haematococcus pluvialis.J Biol Chem. 2014; 289:30387-403。
- 53.
张WW,周XF,张YL,Cheng PF,Ma R,Cheng Wl等。增强虾青素积累Haematococcus pluvialis利用柱式光生物反应器耦合光强和缺氮。微生物学报。2018;28:2019-28。
- 54.
郑湖,鞋跟J,Bian F,Chen G,Shan L,Li X等。变体氨基酸残基改变了花生型2二酰基甘油酰基转移酶的酶活性。前植物SCI。2017; 8:1751。
- 55.
沙拉师L,Gustavsson MH,Ståhlu,dahlqvist a,wiberg e,banas a等。储存脂质合成在酵母中是非必需的。J Biol Chem。2002; 277:6478-82。
- 56.
何x, Turner C,陈国强,林廷堂,McKeon TA。蓖麻二酰基甘油酰基转移酶cDNA的克隆与鉴定。脂质。2004;39:311-8。
- 57.
Li R,Yu K,Hatanaka T,Hildebrand DF。vernonia dgats增加了石油中环氧脂肪酸的积累。植物Biotechnol J.2010; 8:184-95。
- 58.
Hobbs Dh,Lu C,山丘MJ。克隆了编码二酰基甘油酰基转移酶的cDNA拟南芥及其功能表达式。2月。1999;452:145-9。
- 59.
金烨,元y,gao l,sun r,chen l,li d,等。来自油棕型二酰基甘油酰基转移酶(DGAT2)基因的表征及功能分析(Elaeis guineensisjacq。)mesocarp in酿酒酵母和转基因拟南芥.前面。植物科学。2017;8:1791。
- 60.
张志强,张志强,张志强,等。具有广泛底物特异性的穿囊藻酸二酰基甘油酰基转移酶2在工程中强烈增加油酸含量拟南芥种子。J Exp Bot。2013; 64:3189-200。
- 61。
周P,YE L,谢W,LV X,Yu H.高效的虾青素生物合成酿酒酵母通过集成和调整藻类CRTZ和BKT。苹果microbiol biot。2015; 99:8419-28。
- 62。
ExPASy:用于深入蛋白质知识和分析的蛋白质组学服务器。核酸Res. 2003; 31:3784-8。
- 63。
陈志强,陈志强,陈志强,等。clusteral W和clusteral X 2.0版本。生物信息学。2007;23:2947-8。
- 64。
Le Sq,Lartillot N,Gascuel O.蛋白质发育混合物模型。philos trans r soc b sci。2008; 363:3965-76。
- 65。
最大似然系统发育估计的新算法和方法:评估PhyML 3.0的性能。系统医学杂志。2010;59:307-21。
- 66。
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物化学学报2011;28:2731-9。
- 67。
Chevenet F, Brun C, Bañuls AL, Jacq B, Christen R. TreeDyn:面向树分析的动态图形和注释。BMC Bioinform。2006;7:439。
- 68。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据−δδC (T))方法。方法(圣地亚哥,加利福尼亚州)。2001; 25:402-8。
- 69。
Wangyt JXQ,Hu CX,Sun T,Zeng Zy,Cai XQ,等。人造microRNA的致光学调节改善了H.2绿藻生产衣藻reinhardtii.Biotechnol生物燃料。2017;10:257。
- 70.
高频核变换衣藻reinhardtii.美国国立科学院。1990; 87:1228-32。
- 71.
李志刚,李志刚,李志刚,等。转染与转化的研究进展根癌土壤杆菌.Mol Gen Genet, 1978; 163:181-7。
- 72.
花的倾斜:一种简化的方法农杆菌介导的变换拟南芥.植物j . 1998; 16:735-43。
- 73.
崔海涛,马海涛,崔勇,朱晓霞,秦胜,李锐。硅藻中两种细胞色素P450类胡萝卜素羟化酶的克隆、鉴定和功能鉴定Phaeodactylum tricornutum.中国生物科学(英文版)。
- 74.
崔华,马辉,陈胜,于军,徐伟,朱旭,等。采用混合策略去除养鸡场冲洗废水中的营养物质和绿藻中的脂质积累,降低废水中氨氮含量小球藻sorokiniana.Bioresour抛光工艺。2020;303:122940。
- 75.
刘波,孙勇,薛军,毛昕,贾旭,李锐。硬脂酰acpΔ9去饱和酶6和去饱和酶8 (ga - sad6和GhD-SAD8)负责棕榈烯酸的生物合成,特别是在陆地棉种子胚乳发育过程中。植物学报。2019;10:703。
- 76.
Bligh Eg,例如染料WJ。一种快速的总脂质提取和纯化方法。可以j生物摄像石pymiol。1959; 37:911-7。
确认
我们承认研究团队的所有成员在该领域的援助和实验室工作。从肯塔基大学感谢宏南朱教授帮助波兰语Zhangli Hu从深圳大学加入PDB124质粒。
资金
国家自然科学基金(no . 31902394);山西省重点研发计划项目(no . 201803D31063);山西省应用基础研究规划项目(no . 201801D221250);晋中市重点研发计划项目(no . Y192012)山西农业大学科技创新计划项目(2018YJ16)、山西省煤基科技重点项目(FT-2014-01)、山西省留学基金委重点项目(2015-064)、山西省重点研发计划重点项目(201603D312005)。资助机构没有参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
HC和CZ进行了实验,分析了数据并起草了稿件。WX和Hz执行了过表达HpDGAT2s在酵母、藻类和植物中。WH和XZ参与了HpDGAT2s基因的克隆和序列分析。CJ和JX参与转录表达HpDGAT2s在h . lacustris在压力条件下。CZ参与了增长和标签和AST积累h . lacustris在压力条件下。RL构思了这项研究,参与了其设计并修订了手稿。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1表S1。
本研究中使用的DGAT和Actin蛋白序列的Genbank登录号(来自国家生物技术信息中心)。注意:CZ,Chromochloris zofingiensis;不,Nannchloropsis Oceanica;铬、衣藻reinhardtii;Pt,Phaeodactylum tricornutum;李,Lobosphaera切割;在,拟南芥;通用,大豆;Zm评选,玉米;SC,酿酒酵母.
附加文件2表S2。
基因序列信息和生化特征HpDGAT2s在Haematococcus lacustris.注意:一个有关的信息HpDGAT2C是根据从转录组数据库中获得的部分编码序列进行预测的。
附加文件3表S3。
氨基酸序列一致性(%;蓝色)和相似性(%;红色)在HpDGAT2s和CrDGAT2s之间。
附加文件4表S4。
本研究使用的引物。
附加文件5
HpDGAT2A, HpDGAT2B, HpDGAT2C, HpDGAT2D,和HpDGAT2E的预测跨膜结构域http://www.cbs.dtu.dk/services/TMHMM-2.0/).
附加文件6图S2。
通过NetPhos 3.1 Server预测HpDGAT2A, HpDGAT2B, HpDGAT2C, HpDGAT2D和HpDGAT2E的磷酸化位点http://www.cbs.dtu.dk/services/NetPhos/).
附加文件7图S3。
蛋白质序列序列引用的HPDGAT2和其他来自植物和微藻的注释的DGAT2S。本研究中使用的登录号蛋白质序列列入了附加文件1S1:表。蓝色表示关键保守结构域,黑色星号表示关键氨基酸残基。
附加文件9图S5。
pDB124-的示意图HpDGAT2D向量。里面有一盒表达HpDGAT2D基因在内源性的控制下PSAD.启动子和PSAD.终结者,一个表达式盒祝福基因由内源性和特征控制RBCS2启动子和RBCS2终结者,和一盒表达的磁带amp.抗性基因,赋予了对氨苄西林的抗性。
附加文件10图S6。
原始序列HpDGAT2D在Haematococcus lacustris和新的序列HPDGAT2D-CR.密码子优化后衣藻reinhardtii.红色代表修改后的核苷酸序列。
图S7附加文件11
.基因组水平的HpDGAT2D在c . reinhardtii细胞(a)和HpDGAT2D-6-His标签融合蛋白与his标签抗体的western blotting (b)。注:分离可溶性蛋白和膜蛋白并进行blotting。以已知的可溶性蛋白肌动蛋白作为对照。M, DNA标记物或蛋白质标记物(非蛋白印迹型)。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
崔华,赵超,徐伟。et al。2型甘油酰酰基转移酶的特性Haematococcus lacustris揭示了它们在三酰基甘油生物合成中的功能和工程潜力。BMC植物杂志21,20(2021)。https://doi.org/10.1186/s12870-020-02794-6
收到了:
接受:
发表:
关键字
- Haematococcus lacustris
- 二酰基甘油酰基转移酶
- 功能表征
- 三酰甘油
- 基因工程