摘要
背景
类胡萝卜素和黄酮类化合物是植物中重要的次生代谢产物,其对人体健康产生多种生物活跃和益处。虽然编码雌激素生成和黄酮类生物合成酶的基因具有很好的表征,但仍有待研究与途径基因相关的转录调节机制。在本研究中,在四个开发阶段的'Cara Cara'脐橙(CNO)果实用于鉴定类胡萝卜素和黄酮类积累的关键基因和TFS。
结果
在本研究中,我们利用CNO结合代谢组学和转录组学分析来研究类胡萝卜素和类黄酮的谱。花期后120天(DAF)是番茄红素积累的重要阶段。5个胡萝卜素生成基因的转录本与番茄红素含量高度相关,预计16、40、48、24和18个转录因子(TFs)可能与1-脱氧-d -木酮糖-5-磷酸合酶(1-脱氧-d -木酮糖-5-磷酸合酶)(DXS1型),脱氧氧杂环糖苷糖苷糖苷氧化硅烷酶(DXR.),天竺葵二磷酸二磷酸合成酶(GGPPS2.),植物合酶(PSY1)和番茄红素β-环化酶(LCYB)启动子,分别。柚皮素是早期肉中黄酮类物质最丰富的阶段,60 DAF是黄酮类物质积累的最重要阶段,17、22、14、25、24和16个TFs可能结合苯丙氨酸解氨酶(PAL-1和PAL-4),4-香豆素-CoA连接酶(4CL-2和4CL-5),Chalcone合成酶(CHS-1)和Chalcone异构酶(ch)分别是发起人。此外,这两套15个候选TFs可能调控至少三个关键基因,并促进类胡萝卜素/类黄酮在CNO果实中的积累。最后,提出了通路基因与TFs调控网络的层次模型。
结论
总的来说,我们的结果表明DXS1型那DXR.那GGPPS2.那PSY1和LCYB基因是类胡萝卜素积累的最重要基因,而PAL-1那PAL-4那4CL-2那4CL-5那CHS-1和ch类黄酮生物合成。共有24种TFs被认为是这两条途径的共同调节因子,可能在CNO果实中类胡萝卜素和类黄酮的积累中起重要作用。
背景
柑橘是世界上最重要的水果之一,富含氨基酸、有机酸、可溶性糖、黄酮类、挥发性萜类、柠檬苦素、香豆素和类胡萝卜素等多种初级和次级代谢产物[1那2那3.那4.那5.]. 一些代谢物,包括类黄酮、柠檬苦素、有机酸和可溶性糖,据报道有助于水果的味道[3.那4.[虽然萜类化合物和类胡萝卜素与果香和颜色有关[2那6.].
类胡萝卜素不仅有助于吸引眼球的果肉颜色,而且在人体内表现出多种生物活性,如预防癌症和其他疾病[7.]作为维生素A的前体[8.]. 柑橘果肉的颜色主要取决于类胡萝卜素的含量[6.],具有黄酮类和花青素分别施加黄色背景和血橙[9.那10.].主要类胡萝卜素的含量在不同的柑橘类别中变化,β-加密毒素是松弛皮肤普通话中的主要类胡萝卜素(柑橘类reticulata.),violaxanthin是甜橙中最丰富的甜橙(C. Sinensis.),而在柚子大部分地区发现较低水平的类胡萝卜素(C. Grandis.)和香橼(C. Medica.)[11.].此外,一些柑橘种质在其特定组织中富含特殊类胡萝卜素。例如,“红色橘子果皮是红色的,具有丰富的β-citraulin [12.];'hong anliu'甜橙(C. Sinensis.)和'卡拉卡拉'肚脐橙(C. Sinensis.由于其高浓度的番茄红素,CNO)是粉红色或红色[6.].番茄红素是一种优秀的抗氧化剂,可在皮肤保护,心血管疾病预防和抗衰老和抗癌活动中起重要作用[13.].柑橘类水果中高浓度的番茄红素不仅提高了果实品质,而且对人体健康有益。
在高等植物中,通过2- c -甲基- d -赤藓糖醇-4-磷酸(MEP)途径合成C5异戊烯基焦磷酸异构物(IPP),并被GGPP合成酶基因GGPPS用作香叶酰香叶酰二磷酸(GGPP)的前体。GGPP是由植物烯合成酶(PSY)、植物烯去饱和酶(PDS)、ζ-胡萝卜素去饱和酶(ZDS)、番茄红素β环化酶(LCYB)、胡萝卜素异构酶(CRTISO)、胡萝卜素羟化酶(HYD)、紫黄质去环氧化酶(VDE)和玉米黄质环氧化酶(ZEP)等催化的各种类胡萝卜素的直接前体。8.].以前的研究表明,1-脱氧-D-木糖糖-5-磷酸合酶(DXS)是番茄,拟南芥和猕猴桃的MEP途径中是一个重要的速率限制性酶[14.那15.].此外,将脱氧氧基糖苷糖苷氧化酯酶(DXR)显示为拟南芥的速率限制酶,过度表达DXR.增加了类胡萝卜素的含量[16.]. PSY是番茄和柑橘类胡萝卜素生物合成途径中的关键限速酶[17.那18.].当时,类胡萝卜素的含量显着增加精神分裂症在番茄和柑橘类水果中都有过表达[17.那18.].在番茄果实中,DXS.那精神分裂症那PDS.那ZDS公司和CRTISO公司在成熟阶段上调,导致番茄红素过度积累[19.].表达DXS.与柑橘中的类胡萝卜素的含量正相关[20.].‘红安柳’甜橙是‘安柳’甜橙的红瓤突变体,果实积累番茄红素在180daf左右[20.].发现一些生物合成途径基因和转录因子(TFS)通过组合转录组,蛋白质组学和代谢物分析而导致番茄红素的积累有助于[17.那20.那21.].然而,为了我们的知识,番茄红素过度积聚的分子基础仍未清楚。
虽然编码雌激素发生酶的基因表征得很好,但仍有待研究与途径基因相关的转录调节机制。TFS直接调节其靶基因的表达水平,并参与各种生物过程在植物中。已经发现一些TFS与类胡萝卜素的积累相关联,例如TAGL1那FUL1/2和ERF6.[22.那23.那24.]. 番茄红素水平随着番茄红素的过度表达而升高TAGL1或Ppplena.在番茄果中[22.那23.那24.],而在TAGL1或FUL1/2功能丧失突变体[24.].一些TFS可以直接与生物合成途径基因的启动子结合,然后影响类胡萝卜素的积累。例如,PIF1.和SLMADS1.特别绑定精神分裂症启动子并降低其转录,从而改变了类胡萝卜素剖面[25.那26.],鉴于HY5.和凛表达上调精神分裂症在番茄中[27.].除此之外CRMYB68表达水平降低CRBCH2.和CRNCED5.柑橘[28.],清晰CSMADS6.增加了那些LCYB1.那精神分裂症和PDS.在'hong anliu'[17.].
卡拉卡拉脐橙(Cara Cara肚脐橙,CNO)是由华盛顿脐橙(Washington脐橙)中番茄红素过度积累和β-胡萝卜素含量高而形成的一种芽型红肉突变体。在一些红色果肉的葡萄和甜橙中也发现了类似的结果,但番茄红素与β-胡萝卜素的比例不同[6.]表明不同基因型中类胡萝卜素的分布模式不同。结果发现,在大肠杆菌中DXS.那HDS和HDR在成熟期,CNO含量高于华盛顿脐橙[29.].然而,这些基因的上调的原因仍然未知。
黄酮类化合物是柑橘类果实中最重要的二级代谢产物之一,具有多种功能,如抗癌,抗病毒,抗炎症和抗细菌活动[30.那31.].黄酮类化合物主要包括黄烷酮,黄酮,黄酮醇,二氢酚和花青素,黄氰基糖苷是柑橘类果实中的主要黄酮类化合物。我们以前的研究发现,在90-210 DAF期间,四种甜橙中的黄酮类化合物的含量趋于稳定或略微降低,并且番茄红素积累可能对黄酮类化合物的生物合成具有直接或间接影响[9.]. 黄酮类化合物是通过苯丙烷途径合成的,主要包括朋友那C4H.那4CL.那CHS.和ch基因[32.].在4个柚子中,这些基因在60 DFA时表达量高,但在90-210 df时表达量极低,关键通路基因可能受到某些TFs的调控[32.].据报道,据报道了许多TFS调节木质素和苯丙烷型途径中的花青素生物合成[33.].例如,csmybf1被发现绑定到CHS-1启动子,然后影响柑橘中的黄酮积累[34.];红宝石被发现绑定到CHS.那DFR.和答案启动子,然后调节花青素在血橙和紫皮柚积累[10.那35.].此外,据报道许多MYB TFS直接绑定和调节朋友和C4H.促进剂影响木质素积累拟南芥和甜橙[36.那37.].然而,据我们所知,黄酮类化合物和类胡萝卜素的生物合成中TFS的调节机制仍不清楚柑橘类水果。
本研究利用高效液相色谱-类胡萝卜素和类黄酮图谱结合RNA-seq基因表达数据,挖掘了CNO果实发育过程中汁囊中类胡萝卜素和类黄酮的重要途径基因和TFs。这一结果为柑橘果实中类胡萝卜素和类黄酮积累机制的研究提供了新的思路。
结果
果实发育过程中CNO汁囊中类胡萝卜素和类黄酮的变化
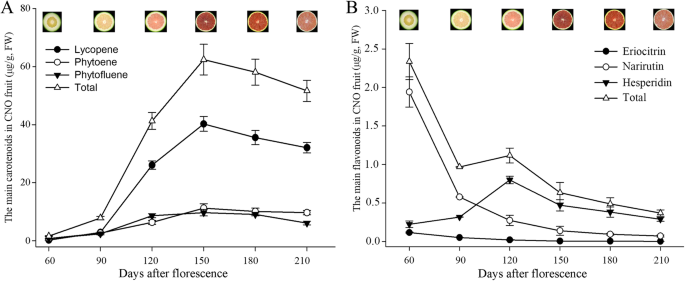
使用HPLC确定在CNO的六种不同发育阶段的CNO不同发育阶段的果汁囊与类胡萝卜素和黄酮类化合物的变化。类胡萝卜素和黄酮类化合物的含量在不同的发育阶段大大变化。
鉴定了七种主要类胡萝卜素,包括番茄红素,植物,植物,植物氟,叶黄素,viraxanthin,β-加线素和β-胡萝卜素,番茄红素水平是最高的(附加档案1:表S1;如图。1一种)。番茄红素的含量低至60dAF,从90℃达到120-10dAF,达到最大值为150个DAF,在成熟阶段显着降低(图。1一种)。番茄红素水平的增加分别为2.65μg/ g,23.23μg/ g,23.23μg/ g,分别为60至90,90至120至120-120-120-120-120dAf,表明阶段为90〜120个DAF可能是最重要的对于番茄红素生物合成(附加文件1:表S1;如图。1一种)。对于鉴定的其他类胡萝卜素,植物和植物氟苯也显着增加到90至120天,然后在成熟阶段保持或略微降低(图。1a) 是的。在180daf时发现叶黄素,210daf时叶黄素水平升高;β-隐黄质和β-胡萝卜素在150daf时检测到,并在150daf到210daf时有增加的趋势;紫黄质在120 DAF时检测到,然后从150 DAF显著增加到180 DAF(附加文件)1:表S1)。
在四个发育阶段中,共有11种黄酮类化合物在CNO果实中鉴定出Narirutin,作为60和90个DAF的主要阶段(附加文件1:表S2)。总黄酮的含量分别在60个DAF和210个DAF下最高,最低。结果表明,60个DAF阶段可能是黄酮类积累的重要阶段(图。1b)。
Pearson相关系数为-0.797,在六个发展阶段的CNO果实总类胡萝卜素和总黄酮水平之间,而 - 0.719在60至150个DAF中,表明类胡萝卜素和黄酮类化合物的总含量之间的负相关性。此外,在150个DAF之前,类胡萝卜素的水平不断增加,而黄酮类化合物的含量在90 DAF下急剧下降,由于橙皮素含量的增加,120 DAF略有增加。在150个DAF后,番茄红素的水平显着下降,而其他主要类胡萝卜素的水平和所有黄酮类化合物的水平降低或保持在稳定水平(图。1)。这些结果表明,类胡萝卜素和黄酮类化合物生物合成的协同变化,150个DAF作为转动阶段。
果实开发期间CNO中的差异表达基因
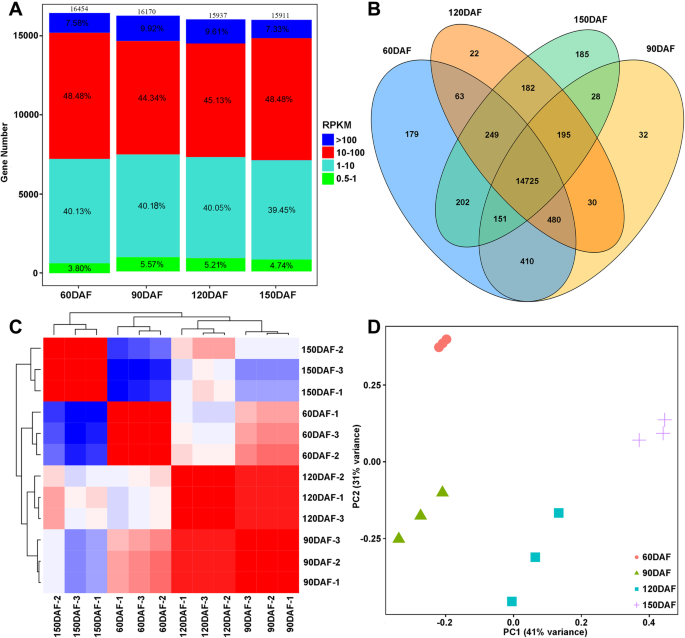
为了进一步确定番茄红素在CNO中过量积累相关基因的表达水平,对番茄汁囊在60、90、120和150daf四个发育阶段进行了转录组学分析。总计282.14 获得M个高质量碱基对,平均23.51个 M每个样本的数据。约94.68–97.57%的阅读被定位到巴伦西亚甜橙基因组,其中87.22–93.13%被唯一地对齐,4.44–7.46%被对齐到多个位点(附加文件1:表S3)。根据它们的表达水平,选择高于0.5的每千碱基转录物每百万片段的平均片段进行进一步分析(附加文件)1:表S4)。在CNO的四个开发阶段,果汁囊中表达了17,190个基因,分别为6,454,16,170,15,937和15,911分别在60,90,120和150个DAF中表达(图。2a),而178,32,20和187个基因分别在60,90,120和150个DAF中特别表达(图。2b)。此外,88.61,84.62,85.18和87.93%的表达基因分别为1至100fpkm,分别为1至100fpkm(图90,120和150个DAF(图。2a) 是的。主成分分析(PCA)和相关分析表明生物复制品之间具有良好的重复性(图。2c、 (d)。
在60 DAF与90 DAF、60 DAF与120 DAF、60 DAF与150 DAF、90 DAF与120 DAF、90 DAF与150 DAF、90 DAF与150 DAF、120 DAF与150 DAF和120 DAF与150 DAF中,共有2482、4059、5565、3738、5671和3555个差异表达基因(deg)随折叠变化(| log2FC |≥ 1) 和罗斯福≤ 分别为0.05。例如,与90daf时的果实相比,120daf时的果实中2063/1675个基因显著上调/下调(另见文件)3.:图S1 A)。
番茄红素积累的重要途径基因
从90〜120 DAF的阶段是基于代谢数据的番茄红素累积最重要的阶段。因此,对DEGS进行了KEGG富集分析,发现该次数主要富集在代谢途径,二次代谢物生物合成和植物激素信号转导(附加档案3.:图。S1 B)。在次数中,将一些基因聚集成类胡萝卜素生物合成和萜烯骨骨干生物合成,包括DXS1型(CS1G20530),DXS2型(CS9G05150),HDS(CS8G16700),HDR(Cs8g07020)和ZDS4型(CS3G11060),其果实中120 DAF的表达水平明显高于Thoseat90 DAF。此外,90-120 DAF的DEGS上的KEGG浓缩分析发现将一些基因聚集成植物激素信号转导,例如CS9G08850(乙烯信号转导),CS1G17210(Jasmonate信号转导)和CS9G18020(脱钙信号转导)等。:这也可能在番茄红素过度积累中发挥重要作用(附加文件3.:图。S1 B)。
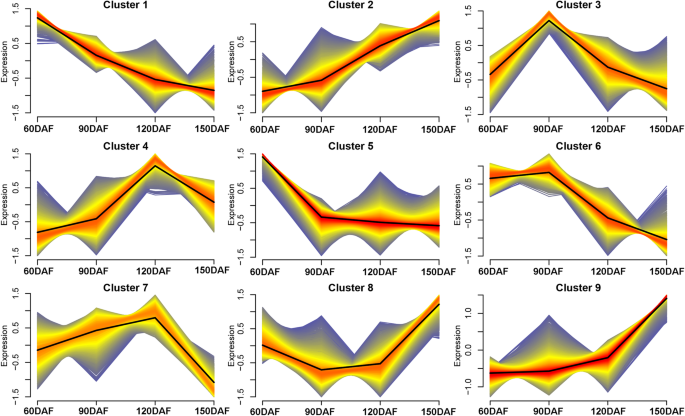
为了挖掘番茄红素在果实发育过程中过度积累的最重要基因,利用Mfuzz分析法对所有表达的基因进行了分类,得到了9个聚类(图。3.;附加文件1:表S5)。值得注意的是,簇2,4和7显示与番茄红素的含量良好的正相关,分别在簇2,4和7中分别对1804,1604和1546个基因进行分别(图。3.)。进一步的基因函数注释发现DXS1型那PSY1和ZDS2型(CS3G11060)在Cluster4中,DXR.和GGPPS2.都在Cluster2里,然后呢MDS(CS5G03050)在Cluster7中,暗示了它们作为候选基因核算番茄红素过度积累的重要性。此外,LCYB(Orange1.1 T00772)在簇6中具有始终如一的低表达水平(图。3.)。
接下来,类胡萝卜素生物合成途径中基因与番茄红素含量之间的相关分析表明DXS1型那DXR.那GGPPS2.和PSY1与番茄红素水平呈高度正相关,相关系数分别为0.997、0.893、0.834和0.964,其他番茄红素生物合成相关基因的值均低于0.800(表1)1;如图。4.)。在此处,DXS1型那DXR.那GGPPS2.和PSY1可能是CNO果实汁囊中番茄红素含量高的关键生物合成途径基因。
与关键类胡萝卜素生物合成基因有关的TFS
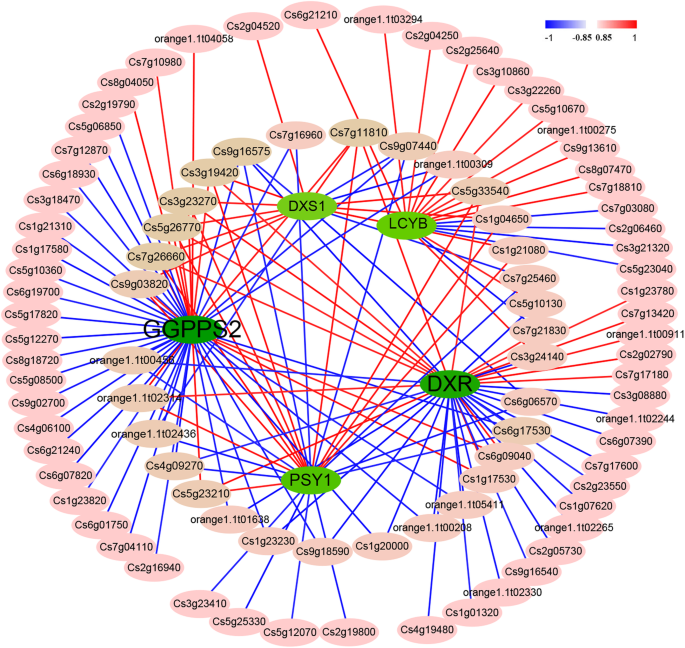
更好地了解TFS在监管中的潜在作用DXS1型那DXR.那GGPPS2.那LCYB和PSY1并且因此有助于番茄红素积累,它们的启动子用于预测使用PlantRegMap(植物TF数据库)可能的结合位点。潜在的83,147,183,104和228 TF结合位点DXS1型那DXR.那GGPPS2.那LCYB和PSY1分别预测了启动子(附加文件)2:表S6)。然而,16,40,48,18和24 TFS具有高Pearson相关系数(1μl10.85),分别具有63和83,分别为潜在的阳性和负调节剂(图。5.;附加文件2:表S7)。在146个潜在调节因子中,有93个TF(17个来自AP2家族,12个来自MADS,11个来自GRAS,8个来自MYB,5个来自TCP,WRKY和bZIP,4个来自SBP,3个来自ERF,HD-ZIP和NAC)(补充文件2:表S7)。
一些TFS高度肯定或呈负相关DXS1型那DXR.那GGPPS2.那LCYB和PSY1有助于类胡萝卜素积累的基因。这些TFS可能调节五个重要基因的表达水平,这些基因有助于CNO水果中的番茄红素积累。例如,DXS1型与10个TFs正相关,与6个TFs负相关,7个TFs的相关系数大于0.900,4个TFs的相关系数小于0.900− 0.900(图。5.;附加文件2:表S7)。
一些潜在的TFS与多个基因结合,具有高Pearson相关系数。例如,CS3G19420,CS3G23270,CS5G26720,CS7G11810和CS7G2660可能会积极调节四种重要的途径基因,而CS9G16575可能是负调节器。一些TFS可以调节五种途径基因中的三种,例如CS5G23210,CS5G33540,CS9G03820和Orange1.1 T02314,其可能是潜在的阳性调节因子,而CS4G09270,CS6G17530,Orange1.1 T00456,Organe1.1 T02436和CS9G07440可能是负数(如图。5.;附加文件2:表S7)。
黄酮类化合物生物合成的重要途径基因和TFS
黄酮类化合物的含量趋于降低在水果发育过程中(图。1B) 是的。大多数黄酮类化合物生物合成基因的表达水平在60 DAF时高,而在120和150 DAF时下降,包括PAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch(附加文件4.:图。S2)。Cluster1的MFuzz分析结果表明,它们的表达趋于降低(图。3.)KEGG注释发现,该簇中的基因主要参与代谢途径、次级代谢产物的生物合成和苯丙酸的生物合成(附加文件)5.:图S3)。巧合的是,PAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch通过基因注释鉴定成簇1。
利用PlantRegMap对TFs进行了预测,以进一步确定TFs可能调控上述6个途径基因和黄酮类化合物的积累。结果表明,该基因可能存在213、229、95、262、227和102个TF结合位点PAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch分别推动者(附加文件2:表S8)。发现具有其电位17,22,14,25,24和16 TF的途径基因具有高Pearson相关系数(1 0.85),分别具有111和7作为电位正和阴性调节剂(图。6.;附加文件2:表S9)。在118个潜在的监管者中,有64个TFs,主要包括9个来自WRKY家族,8个来自MYB, 6个来自bHLH, 4个来自ERF(额外文件2:表S9)。
一些TFS高度肯定或呈负相关PAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch有助于黄酮类化的基因积累。这些TFS可能调节六种重要途径基因的表达水平,这些途径基因有助于CNO果实中的黄酮类积累。例如,PAL-1与16 TFS高度且呈正相关,同时与一个TF负相关,其中12TF的Pearson相关系数高于0.900(图。6.;附加文件2:表S9)。
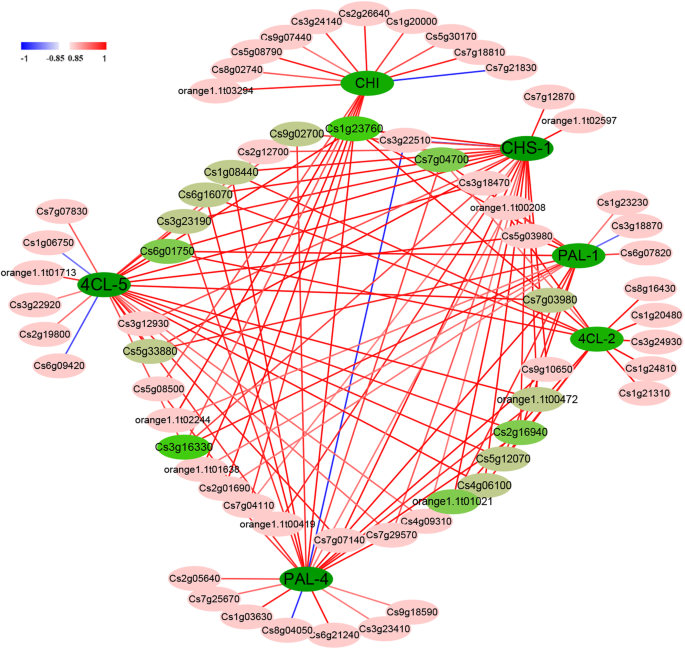
在与关键通路基因皮尔逊相关系数较高的潜在TFs中,Cs1g23760和Cs3g16330可能正调控6个关键通路基因中的5个,而Cs2g16940、Cs7g04700、Cs6g01750和orange1.1可能正调控6个关键通路基因 t01021可能正调控6个通路基因中的4个和9个TFs(Cs1g08440、Cs3g23190、Cs4g06100、Cs5g12070、Cs5g33880、Cs6g16070、Cs7g03980、Cs9g02700和orange1.1) t00472)能结合6个通路基因中的3个作为阳性调节因子(图。6.;附加文件2:表S9)。这些TFS可能在黄酮类生物合成中发挥重要作用。
在CNO调节类胡萝卜素和黄酮类化合物的假设分层网络
两组15种候选TFS可以分别结合至少三种类胡萝卜素和黄酮类生物合成基因。进一步的分析确定了24种TF,可以调节参与类胡萝卜素和黄酮类生物合成途径的重要基因。这些TFS中的二十个可能积极地和负面调节黄酮类生物合成和雌激素生成基因,而其中两种具有相反的效果,另外两个与生物合成途径中的重要基因呈正相关(附加文件6.:图S4)。因此,这些TFs可能直接调控类胡萝卜素和类黄酮生物合成途径的相关基因。
讨论
番茄红素和类胡萝卜素累积的关键阶段
类胡萝卜素是植物中的重要原发性和次生代谢物[38.].使用HPLC在CNO果汁囊中检测到七种主要类胡萝卜素(附加文件1:表S1),也许是因为中间番茄红素被过度累积,这可能影响下游类胡萝卜素和其他分支产物的生物合成。类似于以前的结果,发现番茄红素是CNO中最丰富的类胡萝卜素[6.]. 在这项研究中,90–120 DAF被确定为番茄红素和类胡萝卜素生物合成的关键阶段(图。1一种)。然而,发现180个DAF是甜橙色番茄红素积累的关键阶段,'洪anliu'[20.].因此,本研究首次揭示了治疗番茄红素过度积累的早期调节机制。
类胡萝卜素积累的重要途径基因
在MEP途径中,GGPP是PSY催化产生第一类胡萝卜素(无色植物烯)的直接前体[8.那18.].然而,DXS.和DXR.MEP途径在类胡萝卜素、脱落酸、GAs和单萜的生物合成中起重要作用[39.].迄今为止,大多数类胡萝卜素生物合成基因被柑橘和其他植物克隆,例如GGPPS.那精神分裂症那PDS.那ZDS公司那CRTISO公司那LCYB那LCYE那d那泽德和CCD.[8.那12.], 他们之中,精神分裂症那PDS.那ZDS公司和CRTISO公司升上番茄红素生物合成,而且LCYB那LCYE那d那泽德和CCD.我们在下游。据报道,该基因的表达水平精神分裂症与番茄和柑橘的类胡萝卜素积累有关,和精神分裂症在番茄红素生物合成中发挥了重要作用[17.那18.].LCYB和LCYE使用番茄红素作为前体的含苯丙乙烯分别为β-胡萝卜素和α-胡萝卜素的生产有助于[40]. 表达水平精神分裂症CNO显著高于华盛顿脐橙[41]和更高的表达水平DXR.和GGPPS.在CNO Fruit发现比在成熟阶段的华盛顿脐橙果实中[29.].然而,精神分裂症和LCYB在“红安柳”甜橙[17.].以前的研究表明过表达ZDS公司导致上游类胡萝卜素在番茄中积累较多[42],在我们的研究中,ZDS3在90和120个DAF阶段表达,番茄红素和类胡萝卜素生物合成的关键阶段,所以我们推测了ZDS3可能有助于CNO中的番茄红素积累。
在这项研究中,四个基因,DXS1型那DXR.那GGPPS2.和PSY1根据代谢组学数据,KEGG和Mfuzz聚类结果显示,在果实发育过程中,两个基因型都发生了显著的变化,并且表现出很高的Pearson相关值(> 0.80)(附加文件3.:图。S1;如图。2;桌子1),表明这些基因在CNO果实中对类胡萝卜素积累的重要贡献。这四种基因的表达水平在120dAf中最高,番茄红素水平的最高速率与90-120dAf相一致(图。3.)。尽管与前期相比,番茄红素含量的另一个显着增加,番茄红素含量为120至150个DAF,但是在150个DAF下的四个基因的表达水平低于90和120 DAF的表达水平。
众所周知,类胡萝卜素的积累是若干生物过程的净效应,包括合成,运输和降解。这LCYE和LCYB是番茄红素降解的关键基因[17.那43].在我们的研究中,LCYB在整个果实发育过程中表达保持相对较低水平(图。3.)。此外,另一种番茄红素累积相关基因LCYE发现与番茄红素含量有很高的皮尔逊相关系数(表1)1). 然而,其直接产物α-胡萝卜素和叶黄素的含量保持在较低水平。因此,在本研究中,我们的数据表明,相对较低的酶活性LCYE与较低的人一起LCYB150例DAF之前的表达水平是番茄红素累积较高的最重要原因之一。
一起服用,我们推测了高表达水平DXS1型那DXR.那GGPPS2.那PSY1和相对低表达水平LCYB可能对番茄红素在果实中的积累起重要作用。
潜在的TFs可能在番茄红素积累中起重要作用
TFS在植物生物监管网络中发挥重要作用。据报道,一些TFS调节类胡萝卜素的生物合成。例如,CSMADS6可以绑定精神分裂症和LCYB启动子直接调控其表达水平,从而影响甜橙果实红安柳中类胡萝卜素的积累[17.],而PIF,HY5,RAP2.2,RIN和SLMADS1可以直接绑定PSY启动子以改变类胡萝卜素曲线[25.那26.那44].在该研究中,16,40,48,24和18 TFS显示出高Pearson相关系数(|≥0.85)DXS1型那DXR.那GGPPS2.那PSY1和LCYB(附加文件2:表S7)。TFs参与AP2、GRAS、MADS、MYB和WRKY型转录因子的表达,并有可能结合DXS1型那DXR.那GGPPS2.和PSY1发起人(附加文件2:表S7)。八至七个TFS可以分别积极地且消极调节至少三种类胡萝卜素生物合成途径基因,因此可能在CNO中的番茄红素过度积累中起重要作用。据报道,过度表达cublh1番茄中的番茄红素含量降低Ppplena.有相反的调节效果[22.那24.]. 一些TFs可以影响植物的光合作用,导致类胡萝卜素的积累,而不是直接与番茄中的Gloden2等类胡萝卜素生物合成基因结合[24.]. 因此,本研究中发现的TFs可能通过调节激素信号转导和光合作用等其他生物过程来影响CNO果实中的特殊类胡萝卜素。然而,据《红安流》报道,皮尔逊相关系数仅为− CsMADS6(Cs7g16970)和PSY1而其他MADS-TFs、Cs7g11810和Cs1g21080的Pearson相关系数较高且呈正相关(> 0.900),但仍需通过酵母单杂交(Y1H)和电泳迁移率转移试验(EMSA)研究进一步证实[17.]. 这将是有趣的,以找出他们是否比CsMADS6更重要的番茄红素积累。
途径基因和TFS可能在黄酮类体内发挥重要作用
黄酮类化合物是柑橘果实中重要的次生代谢产物,通过苯丙素生物合成途径合成,具有重要的生理功能朋友那C4H.那4CL.那CHS.和ch参与该途径的基因[32.].在果实发育过程中,各种黄酮类化合物的含量稳定或下降朋友那C4H.那4CL.那CHS-1和ch特别是在60天的DAF中表达,在“凤凰”柚子“柚子”柚子“柚子”柚子和“HB'POMELO”和“HB'POMELO”中在90,120和210个DAF中显着下降,并在'凤凰派'柚子中显着下降[32.].同样在本研究中,表达水平PAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch在果实发育过程中,基因被发现减少4.:图S2),表明了这些基因在早期黄酮积累过程中的重要作用。
据报道许多TFS调节苯丙烷化生物合成途径基因,然后影响花青素,木质素和黄酮类化合物的含量。例如,发现mybf1绑定CHS.启动子,然后调节柑橘和葡萄牙黄酮的合成[34.那37.],虽然报告了许多其他MYB TFS绑定朋友那4CL.和CHS.启动子,然后调节花青素和木质素生物合成[44].在该研究中,基于以下预测64个具有高Pearson相关系数的潜在TFSPAL-1那PAL-3那4CL-2那4CL-5那CHS-1和ch推动者分析(图。6.). 其中一些可能与多个基因的启动子结合,因此可能是调控CNO果实中黄酮类化合物积累的最重要的TFs。
可共调节类胡萝卜素和黄酮类积累的潜在TFS
在研究中,在CNO果实中,类胡萝卜素合成的关键基因的类胡萝卜素和表达水平的含量趋于增加,而黄酮类化合物的水平和关键基因的表达水平趋于降低(图。1;如图。3.). 进一步的分析表明,这两种途径的关键基因可能是由24个潜在的TFs直接共同调控的(另一个文件)6.:图S4)。例如,Cs1g21310可能正、负调节类黄酮和类胡萝卜素的积累。考虑到TFs在类胡萝卜素和类黄酮生物合成中的直接作用,24 TFs可能作为CNO果实中类胡萝卜素和类黄酮积累的重要TFs,形成一个调控网络(补充文件6.:图。S4)。这些TFS可以在果实中具有各种代谢途径的综合果实质量调节网络。
结论
类胡萝卜素和黄酮类化合物是柑橘类水果中的重要代谢产物,发现番茄红素是CNO中为红肉的主要化合物,而Narirutin作为早期的优势黄酮。在六个发育阶段的CNO汁囊的类胡萝卜素和黄酮类化合物谱分析鉴定为番茄红素过度积累的关键阶段90-120 DAF。转录组分析表明DXS1型那DXR.那GGPPS2.那PSY1和LCYB基因是类胡萝卜素积累的最重要基因,而PAL-1那PAL-4那4CL-2那4CL-5那CHS-1和ch用于黄酮类生物合成。发现两组15种候选TFS潜在地将至少三种类胡萝卜素/类黄酮型关键途径基因的启动子粘合以调节其表达水平,因此有助于在CNO水果中产生特殊的类胡萝卜素和黄酮类化合物谱。此外,总共24种TFS直接在两种途径中作为共调节剂发布。
方法
材料
CNO的果实(柑橘sinensis.奥贝克)由国家柑橘育种中心(湖北省武汉武汉)收集,中央组织中的Zongzhou谢的种质苗圃经理鉴定了CNO品种。在正常管理下,在60,90,120,150,180和210个DAF的六个果实开发阶段,从成人和健康树上收获水果。分析了每个阶段的三种生物学重复,每次复制由来自三种不同植物的六个健康和类似的果实组成。将果汁囊立即用手术刀分离,然后置于液氮中并储存在-80℃直至分析。
类胡萝卜素的提取与鉴定
胡萝卜素从2g果汁囊中提取,然后根据Liu等人测量。[20.].简而言之,将2克果汁囊接地为液氮的功率,用于提取。通过高效液相色谱(HPLC,水,带有2996光电二极管阵列探测器的HPLC,WATERS 1525反相HPLC)进行类胡萝卜素分析,其中C30类胡萝卜素柱(250mm×4.6mm,YMC,Wilmington,NC,USA)。根据我们以前的研究,鉴定了基于保留时间和具有真实标准的保留时间和吸收光谱来鉴定出鉴定的类胡萝卜素。20.].
黄酮类化合物的测定
使用根据Chen等人的方法,每种样品从1g果汁囊中萃取黄酮类化合物。[9.]微小修改。将样品接地为液氮中的功率,然后在超声波浴模型FS60(Fisher Scientific,Pittsburgh,PA)中,在40℃下,在40℃下,在2℃下,在2mL 80%甲醇水溶液中萃取,在40℃下,在20℃下,在40℃下,在40℃下进行,在40℃下进行。将萃取以10,000×g离心10分钟,然后将上清液通过0.22μm微孔过滤并使用HPLC进行分析。使用具有C18 Hypersil Gold柱(250mm×4.6mm×5μm,Thermo Scientific)的HPLC系统进行分析黄酮类化合物。陈等人称,黄酮类化合物的HPLC参数均为。[9.].
RNA提取,转录组测序和分析
如Liu等人所述,使用60,90,120和150个DAF阶段的CNO果汁囊用于总RNA提取。[45[每个样品的2μg总RNA用于根据方案(Truseq RNA样品制备V2指南,Illumina,美国)进行cDNA文库构建。使用Illumina Truseq RNA样品制备试剂盒纯化mRNA,然后使用Agilent Technologies 2100 Bioanalyzer(安捷伦,美国)评估。合成第一和第二链互补DNA,纯化双链cDNA,加入适配器,然后将mRNA切割成约270bp的短片段。由千年公司(韩国首尔)的成对端(2×100bp)模式的Illumina Hiseq 4000平台上测序构建的文库。RNA-SEQ原始数据在加入号PRJNA636131下上传到NCBI(SRA)。
瓦伦西亚橙的基因组和注释文件(C. Sinensis.)从橙色基因组注释项目下载(http://citrus.hzau.edu.cn/Orange/Download/index.php)。建立了星星(版本2.7)的参考索引。在默认参数下使用TrimMomatic(0.36)过滤原始数据,然后使用STAR将清洁数据映射到参考基因组,并且基于映射结果使用HTSEQ计数计算的计数。编辑器用于确定差异表达的基因,然后基于Mercats序列注释软件(https://www.plabipd.de/portal/web/guest/home1)。使用Kobas 3.0进行Degs进行Kegg浓缩分析并注释(http://kobas.cbi.pku.edu.cn/)和tbtools [46], 分别。使用R.中的MFuzz包将表达基因聚集成九个基团。
预测潜在结合TF
启动子序列DXS1型(CS1G20530),DXR.(CS5G05440),GGPPS2.(CS8G02140),PSY1(CS6G15910),LCYB(橙色1.1) t00772),PAL-1(CS6G11940),PAL-4(Cs8g16290),4CL-2(CS5G24900),4CL-5(Orange1.1 T04489),CHS-1(CS2G14720)和ch利用PlantRegMap中的调控预测函数(Cs7g28130)预测结合TFs(http://plantregmap.cbi.pku.edu.cn/index.php)。这C. Sinensis.数据库被用作图书馆P.-Value低于1E- 5. 利用BLAST功能将TFs转化为巴伦西亚甜橙基因组中的相似基因。选择MADS、AP2和GRAS中的所有TFs(基于Mercator v.3.6注释结果)进行进一步分析。根据转录组数据,用皮尔逊法计算上述通路基因与潜在结合TFs的Pearson相关系数。Pearson相关系数采用大于0.850或小于0.01的方法进行筛选− 0.850,结果用Cytoscapev3.7.2显示。
数据分析
用标准曲线计算类胡萝卜素和类黄酮的含量。使用R软件包(nortest、stats和pgirmes)进行方差分析(P.<0.05)。条形图和点图是基于使用R包,GGPLOT2的DEGS和KEGG分析结果进行的。基于使用TBTOOLS的转录组数据构建类胡萝卜素生物合成相关基因的热爱系数[46].
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章和附加文件中。RNA-SEQ数据可从登录号PRJNA636131下的NCBI获得。
缩写
- DXS公司:
-
1-脱氧-D-木糖糖-5-磷酸合酶
- DXR:
-
脱氧果糖5-磷酸还原异构酶
- GGPPS:
-
Geranylgeranyl二磷酸合酶
- Psy:
-
植物合成酶
- LCYB:
-
番茄红素β-环酶
- LCYE:
-
番茄红素ε-环缩
- 朋友:
-
苯丙氨酸解氨酶
- 4CL:
-
4-香豆酸-CoA连接酶
- CHS:
-
Chalcone合成酶
- Chi:
-
查耳酮异构酶
- 总经理:
-
脐橙
- TFS:
-
转录因素
- DAF公司:
-
花期后天数
参考
- 1。
张H,文H,陈J,彭Z,史M,陈M,袁Z,刘Y,张H,徐J。果皮中挥发性化合物作为四种柑橘新生物标志物的研究。分子。2019;24:4550.
- 2。
张H,谢Y,刘C,陈S,胡S,谢Z,邓X,徐J。不同种类柑橘果实挥发性成分的综合比较分析。食品化学。2017;230:316–26.
- 3.
李伟,刘聪,何明,李杰,蔡毅,马毅,徐杰。牛肉红肉橘及其野生型中萜类成分含量差异较大。BMC植物生物学。2017;17:36.
- 4.
王我,何F,黄义,何J,杨某,曾j,邓,江x,方y,wen s。野生普通话的基因组和普通话的驯化史。莫尔植物。2018; 11:1024-37。
- 5.
徐杰,马尔,江德,朱思,闫硕,谢y,谢z,郭伟,邓小平4例柑橘种质中4例呋喃加仑单体的含量评价。食品化学。2015; 187:75-81。
- 6.
徐继,邓X.红色肉脐橙主要颜料的鉴定(柑橘sinensis.L.)在水果开发和储存过程中评估它们的浓度变化。Acta Horti Sin。2002; 29:203-8。
- 7.
Fiedor J,Burda K.类胡萝卜素作为人类健康和疾病中抗氧化剂的潜在作用。营养素。2014; 6:466-88。
- 8.
Hirschberg J. Carotenoid生物合成在开花植物中。CurrOp植物BIOL。2001; 4:210-8。
- 9.
陈俊,张H,庞y,程y,邓x,徐J.番茄红素累积和金发肉甜橙黄素生产的比较研究(柑橘sinensis.)在果实发育过程中。食品化学。2015;184:238–46.
- 10
黄D,王X,唐Z,袁Y,许Y,何J,江X,彭S,李力,布泰利E。柑橘驯化过程中Ruby2-Ruby1基因簇的亚功能化。天然植物。2018;4:930–41.
- 11.
KATO M,Ikoma Y,Matsumoto H,Sugiura M,Hyodo H,Yano M.在柑橘类果实中成熟过程中胡萝卜素的积累和类胡萝卜素生物合成基因的表达。植物理性。2004; 134:824-37。
- 12.
郑X,朱克,孙q,张w,王x,曹h,谭m,xie z,zeng y,ye J. ccd4启动子的自然变化在柑橘皮中的红色染色的特异性演变。莫尔植物。2019; 12:1294-307。
- 13。
Kim MJ,Kim H.番茄红素在胃癌中的抗癌作用。j癌症prev。2015; 20:92。
- 14
Lois Lm,Rodríguez-concepciónm,Gallego F,Campos N,Boronat A.类胡萝卜素生物合成在番茄果实开发期间:1-脱氧-d-木糖5-磷酸合酶的调节作用。工厂J. 2000; 22:503-13。
- 15
Nieuwenhuizen NJ,陈X,王M,Matich A,Perez RL,Allan AC,Green SA,Atkinson RG。Kiwifruit中单萜合成的自然变化:NAC和乙烯 - 不敏感3样转录因子的萜烯合成酶的转录调节。植物理性。2015; 167:1243-58。
- 16
Mahmoud Ss,Croteau RB。通过改变脱氧糖苷磷酸盐还原酶和术晶呋喃合酶掺氧纤维糖苷的基本油产量和组合物的代谢工程。p natl一个sci。2001; 98:8915-20。
- 17.
吕某,张y,朱克,杨,叶茹,柴l,徐q,邓x。柑橘转录因子Csmads6通过直接调节致癌基因来调节类胡萝卜素代谢。植物理性。2018; 176:2657-76。
- 18.
Giuliano G,Bartley Ge,Scolnik Pa。番茄开发期间类胡萝卜素生物合成的调节。植物细胞。1993; 5:379-87。
- 19.
罗Z,张继,李杰,杨c,王t,欧阳b,李h,giovannoni j,ye z.一种温度绿色蛋白质slsgr1通过直接与slpsy1在番茄中的熟化过程中与slpsy1相互作用来调节番茄红素和β-胡萝卜素积累。新植物。2013; 198:442-52。
- 20。
刘Q,徐杰,刘Y,赵X,邓X,郭L,顾J。导致甜橙果实番茄红素异常积累的一种新的芽变(柑橘sinensis.L. osbeck)。J Exp Bot。2007; 58:4161-71。
- 21
Zeng Y,Pan Z,Ding Y,Zhu,Cao,Xu Q,Deng X.甜橙色果实中分离的蛋白质组学分析[柑橘sinensis.(l)等)。实验机器人。2011;62:5297-309。
- 22
它,Seybold H,Breitel D,Rogachev I,Meir S,Aharoni A.番茄静物样1是果实成熟调节网络的组成部分。植物J. 2009; 60:1081-95。
- 23。
Lee JM,Joung JG,McQuinn R,Chung My,Fei Z,Tieman D,Klee H,Giovannoni J.组合转录组,遗传多样性和代谢物分析在番茄果上表明,乙烯反应因子Slerf6在成熟和类胡萝卜素中起重要作用积累。工厂J. 2012; 70:191-204。
- 24。
VREBALOV J,Pan IL,Arroyo AJM,McQuinn R,Chung M,Poole M,Rose J,Seymour G,Grandillo S,Giovannoni J.肉质果实膨胀和成熟是由番茄防碎基因Tagl1调节。植物细胞。2009; 21:3041-62。
- 25。
董T,Hu Z,Deng L,Wang Y,Zhu M,Zhang J,Chen G.一个番茄疯箱转录因子,SLMADS1,充当果实成熟的负调节器。植物理性。2013; 163:1026-36。
- 26
托莱多奥蒂斯G,Huq E,Rodríguez-concepciónm。通过植物相互作用因子直接调节植物合酶基因表达和类胡萝卜素生物合成。p natl一个sci。2010; 107:11626-31。
- 27
Toledo-Ortiz G, Johansson H, Lee KP, Bou-Torrent J, Stewart K, Steel G, Rodríguez-Concepción M, Halliday KJ。HY5-PIF调控模块协调光和温度调控光合基因的转录。公共科学图书馆麝猫。2014;10:e1004416。
- 28
朱福,罗t,刘c,王,杨h,杨w,zheng l,xiao x,张m,xu r。一种r2R3-myb转录因子通过负面调节抑制α-and crant carotenoids的转化CRBCH2和CRNCE5在Flavedo的表达柑橘网?。新植物。2017; 216:178-92。
- 29.
平底锅Z,Zeng Y,AN J,YE J,Xu Q,Deng X.转录组和蛋白质组的一致性分析为类胡萝卜素生物合成和调节提供了新的洞察力。J蛋白质组。2012; 75:2670-84。
- 30.
Tripoli E,Guardia ML,Giammanco S,Majo DD,Giammanco M.柑橘类黄酮类药物:分子结构,生物活性和营养特性:综述。食品化学。2007; 104:466-79。
- 31。
一种柑橘类黄酮,对阿尔茨海默病和帕金森氏病的潜在益处。Int J Mol Sci. 2019;
- 32。
陈俊,元Z,张H,李海,施米,彭诗,李米,田j,邓x,程y。cit1,2rhat.和两本小说CitdGlcTs在柑橘类果实开发期间参与风味相关的黄酮代谢。J Exp Bot。2019; 70:2759-71。
- 33
贾恩,刘j,tan p,sun y,lv y,liu J,Sun J,Huang Y,Lu J,Jin N.柑橘sinensis.MYB转录因子CSMYB85通过与其他CSMYB转录因子的相互作用诱导果汁囊瘫痪。前植物SCI。2019; 10:213。
- 34
刘丙,龙杰,朱克,刘丽,杨威,张赫,李丽,徐Q,邓X。调节黄酮醇和羟基肉桂酸生物合成的柑橘R2R3-MYB转录因子的特性。Sci代表2016;6:25352.
- 35。
关键词:血橙,花青素,反转录转座子,冷依赖积累植物细胞。2012;24:1242-55。
- 36。
贾恩,刘j,sun y,tan p,cao,谢y,wen b,gu t,liu J,Li M.柑橘sinensis.MYB转录因子CSMYB330和CSMYB308通过微调表达调节果汁囊瘫痪CS4CL1基因。植物SCI。2018; 277:334-43。
- 37。
Syskice DJ,Montefiori M,Edwards PJ,Mcghie TK。红猕猴桃红细胞组分的分离与结构鉴定。Jagri食品化学。2009; 57:2035-9。
- 38
Bartley GE,Scolnik PA.植物类胡萝卜素:用于光保护、视觉吸引和人类健康的色素。植物细胞。1995;7:1027–38.
- 39
关键词:大肠杆菌,类胡萝卜素,类异戊二烯前体,代谢工程,脱氧木酮糖磷酸酶《微生物学》2000;53:396-400。
- 40。
Harjes CE、Rocheford TR、Bai L、Brutnell TP、Kandianis CB、Sowinski SG、Stapleton AE、Vallabhaneni R、Williams M、Wurtzel等。用于玉米生物强化的番茄红素ε环化酶的自然遗传变异。科学。2008;319:330–3.
- 41。
陶恩、胡兹、刘Q、徐杰、程Y、郭L、郭W、邓X。植物烯合成酶基因的表达(精神分裂症)在Cara Cara Navel橙的果实成熟期间增强了(柑橘sinensis.奥斯贝克)。植物细胞代表2007; 26:837-43。
- 42。
Mcquinn RP, Gapper NE, Gray AG, Zhong S, Tphge T, Fei ZJ, Fernie AR, Giovannoni JJ。操纵ZDS公司在番茄中,类胡萝卜素和脱落酸对果实发育和成熟具有特异性作用。植物生物技术杂志。2020;18:2210–24.
- 43。
Ronen G、Cohen M、Zamir D、Hirschberg J。番茄果实发育过程中类胡萝卜素生物合成的调控:番茄红素ε环化酶基因在成熟过程中表达下调,在突变体δ中表达升高。植物J。1999;17:341–51.
- 44。
MA D,Constabel CP。MYB阻遏物作为植物中苯丙醇代谢的调节剂。趋势植物SCI。2019; 24:275-89。
- 45
刘yz。高效分离RNA从水果果皮和成熟的脐橙浆(柑橘sinensis.奥斯贝克)。j华中农业大学。2006; 25:300-4。
- 46
关键词:生物大数据,交互分析,TBtools摩尔。2020;13:1194 - 202。
致谢
我们将欣赏Zongzhou谢先生从华中农业大学获得样品收集的帮助。
基金
本研究由国家重点研究和发展计划(2018YFD1000200)资助中国国家自然科学基金(NSFC 31672102)和中央大学的基本研究基金(266201832)。资助者在研究设计中没有作用;在收集,分析或编写数据中;在写作稿件,或在决定发布结果。
作者信息
隶属关系
贡献
Hz(海鹏张),JX和Hyz(鸿阳张)设计了实验;赫兹表演了大部分实验;JC,ZP和XL执行了部分实验;MS和HW分析了类胡萝卜素数据;Hz和YJ提取了RNA;Hz和Hyz写了稿件。JX,YC和Hyz审核并编辑了稿件。所有作者都同意稿件内容并提交。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
作者在本研究中遵守了国家法律和伦理道德。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
在CNO中以六个发育阶段(μg/ g,fw)中的CNO鉴定出的类胡萝卜素。U:无法察觉。表S2。在六个发育阶段(ng/g,FW)从CNO中鉴定出黄酮类化合物。U:无法检测。表S3。RNA序列清洁数据的基本统计数据映射到参考基因组。表S4。CNO果实(FPKM)中基因的表达水平。表S5。通过MFuzz将表达的基因聚集成九个基团。
附加文件2:表S6。
在DXS1,DXR,GGPPS2,PSY1和LCYB中预测TFS。表S7。显示具有类胡萝卜素合成相关基因的高Pearson相关系数的TFS。PCC.一种:Pearson相关系数。表S8。TFS预测PAL-1,PAL-4,4CL-2,4CL-5,CHS-1和ch基因。表S9。显示具有类黄酮合成相关基因的高Pearson相关系数的TFS。PCC.一种:Pearson相关系数。表S10。TFS预测在30个最重要的TFS中,调节至少三种类胡萝卜素或类黄酮基因。
附加文件3:图S1。
不同发展阶段的CNO果汁果汁中的差异表达基因。A,不同发育阶段的差异表达基因的数量。b,果汁囊在90dAf和120dAf之间的果汁囊中的差异表达基因的Kegg分析结果。
附加文件4:图S2。
基于转录组数据显示CNO果实类生物合成相关基因的黄酮类生物合成相关基因的热图。
附加文件5:图S3。
Kegg分析果汁囊中的差异表达基因在60dAF和90个DAF之间的果汁中的结果。
附加文件6:图S4。
TFS调节类胡萝卜素和黄酮类生物合成基因。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张,H.,陈,J.,Peng,Z.等等。综合转录组学和代谢组学分析揭示了脐橙类胡萝卜素和类黄酮生物合成的转录调控网络。BMC植物生物学21,29 (2021). https://doi.org/10.1186/s12870-020-02808-3
已收到:
公认:
发表:
关键词
- 柑橘
- 胡萝卜素
- 黄酮类动物
- 转录因子
- 转录组
- 代谢组学