抽象的
背景
类胡萝卜素在光合作用、激素信号传导和次生代谢中起着重要作用。植物烯合成酶(PSY)催化类胡萝卜素生物合成途径的第一步。在本研究中,我们旨在描述精神分裂症烟草基因及其功能分析。
结果
在这项研究中,我们确定了三组精神分裂症基因,即PSY1、PSY2,psy3,四烟草物种;系统发育分析表明,这些基因与番茄的同源性较高,但与水稻、玉米等单子叶植物的同源性不高。的表达水平PSY1型和PSY2型与其他组织相比,观察到叶片中最高,并且它们可以通过用某些植物激素治疗和暴露于强光而升高。不心理战3在这些条件下检测到表达。我们构建了病毒引起的PSY1型和PSY2型研究发现,这些植物的新出叶具有严重的漂白现象,类胡萝卜素和叶绿素含量显著降低。基因沉默植株的类囊体膜蛋白复合物水平也低于对照植株。基因沉默植株的Fv/Fm、ΦPSII、qP和NPQ等反映光合系统活性的叶绿素荧光参数也显著降低。我们进一步对基因沉默烟草和对照植物进行了RNA-Seq和代谢组学分析。RNA-Seq结果显示,非生物胁迫、类异戊二烯化合物和氨基酸分解代谢过程上调,而细胞壁成分的生物合成下调。代谢分析结果与RNA序列一致。我们还发现类胡萝卜素生物合成途径中的下游基因被上调,并确定了可能调控类胡萝卜素生物合成的转录因子。
结论
本研究结果表明,PSY不仅可以通过控制生物合成的第一步来调控类胡萝卜素的含量,还可以通过影响下游基因的表达来影响光合活性。同时,PSY可能影响氨基酸分解代谢和细胞壁组织等其他过程。我们在此报道的信息可能有助于进一步的研究精神分裂症基因和类胡萝卜素生物合成。
背景
类胡萝卜素在光合生物中被广泛存在,包括植物,藻类和蓝藻。化学上,类胡萝卜素属于异戊二烯化合物;典型的类胡萝卜素含有40个碳原子(C40),其由八个C5异戊二烯单元的冷凝形成。其化学结构中的共轭双界的数量赋予它们的可见光吸收性能,产生它们的黄色至红色的特征颜色[1.,2.].类胡萝卜素含有大量不同的组件;目前,来自所有生命领域的700个生物中已发现近1200个天然类胡萝卜素。不含氧气的类胡萝卜素被归类为Carotenes,并且含有氧的那些被归类为Xhortophylls。除了典型的C40类胡萝卜素外,还发现了一些短(C30)或更长(C45或C50)的类胡萝卜素[3.].
虽然人类不能代谢合成类胡萝卜素,但类胡萝卜素可以通过食用食物或补充剂获得。类胡萝卜素作为一种天然色素,对人体健康有着广泛的作用。类胡萝卜素是重要的抗氧化剂,因为它们吸收特定波长的光,是维生素A的前体。此外,它们在保护眼睛和维持正常视力方面发挥着重要作用。此外,它们可以通过增强细胞通讯、抑制异常细胞生长或提供紫外线保护来预防某些类型的癌症。类胡萝卜素可以通过减少氧化低密度脂蛋白来预防心脏病[1.,4.].
类胡萝卜素在植物中也是不可缺少的。它们对光氧化损伤提供保护;光保护是它们最重要的功能之一。在强光条件下,类胡萝卜素能将多余的能量作为热量散发出去,清除自由基,防止膜脂过氧化,从而增强植物对不同光照条件的适应能力[5.].类胡萝卜素的另一个重要功能是它在照相型反应中心II中具有作用。类胡萝卜素促进颜料 - 蛋白质复合物的形成,并有助于能量吸收和电子流量运输[6.]. 在植物中,类胡萝卜素可以作为植物激素如脱落酸(ABA)的前体[7.]和曲格列酮[8.]在植物发育和逆境反应中都起着重要作用。此外,类胡萝卜素在植物繁殖中起着重要作用:它们所呈现的不同颜色可以吸引动物,帮助授粉和种子传播[9].
植物类胡萝卜素的生物合成是类异戊二烯前体代谢的一部分。从异戊烯基二磷酸(IPP)和二甲基烯丙基二磷酸(DMAPP)开始,类胡萝卜素的生物合成由一系列酶催化[3.];第一步是将三个IPP分子加到一个DMAPP上生成香叶酰香叶酰二磷酸(GGPP),其转化由GGPP合成酶(GGPPS)催化。GGPP是其它几组类异戊二烯的前体[10.].类胡萝卜素生物合成的下一步是通过两个GGPP分子的缩合生产40碳的植物烯;这种缩合反应是由植物烯合成酶(PSY)催化的,被认为是类胡萝卜素生物合成途径的主要“瓶颈”[11.].然后,然后通过一系列去饱和和异构化反应转化为番茄红素。两种类型的植物去饱和酶,即植物去饱和酶(PDS)[12.]和ζ-胡萝卜素去饱和酶(ZDS) [13.[据报道,据报道,负责去饱和反应,而15-CIS-β-胡萝卜素异构酶(Z-ISO)催化异构化反应[14.].下一步是番茄红素的环化,其中形成两个分支,即α-和β-分支,两者都被转化为不同的组分。α-分支相对简单;番茄红素在番茄红素ε-环状酶(LCYE)的帮助下将番茄红素环化成δ-胡萝卜素[15.]通过番茄红素β-环化酶(LCYB)进一步将其环化成α-胡萝卜素[16.].α-胡萝卜素可被两种类胡萝卜素羟化酶羟基化。类胡萝卜素β-羟化酶(CHYB,主要是细胞色素P450酶,CYP97型)产生玉米黄素,玉米黄素被类胡萝卜素ε-羟化酶(CHYE,主要是CYP97C1)进一步羟化成叶黄素。与α-分支相比,β分支包含较多的步骤,可以生成较多的中间产物。首先,番茄红素经过LCYB催化的两轮环化反应,产生γ-胡萝卜素和β-胡萝卜素。β-胡萝卜素在β-胡萝卜素羟化酶(BCH)的催化下,经过两个步骤的羟化反应,生成β-隐黄质和玉米黄质[17.].然后,在玉米黄质环氧化酶(ZEP)的催化下,对玉米黄质进行两步环化反应,形成蒽黄质和紫黄质。类胡萝卜素生物合成途径的β分支的最后一步是将紫黄素转化为新黄素;这种转化是由新黄素合成酶(NXS)催化的[11.].
PSY催化GGPP生物合成植物烯,GGPP是许多其他类异戊二烯的共同前体[10.].植物烯的形成是类胡萝卜素生物合成的第一步,也是主要的瓶颈步骤[18.].Psys由小基因家族编码;编码PSY的基因已被鉴定并孤立在许多物种中拟南芥[19.],大米[20.)、玉米(21.],还有西红柿[22.,23.,24.]其功能和表达模式已有报道[25.].在拟南芥,精神分裂症基因不仅在光合组织中有微量表达,而且在包括根系在内的非光合组织中也有微量表达,并与其他类胡萝卜素途径基因有共表达模式[26.],表明精神分裂症基因主要涉及光合途径。表达精神分裂症基因由各种因素调节,包括发展和环境信号[27.].植物激素,尤其是乙烯,在调节中发挥重要作用精神分裂症基因表达;增加的乙烯水平显著上调精神分裂症基因[28.].脱落酸也可以调节表达精神分裂症基因[25.].环境信号,如强光、盐、干旱、温度和光周期也可以改变表达水平精神分裂症基因[29.].发现一些重要的转录因子来感知上述信号,然后控制转录精神分裂症基因;例如,Phytochrome相互作用因子1(PIF1)[30]和长下胚轴5 (HY5) [31,分别属于bHLH和bZIP家族,被证实参与了光诱导的调控精神分裂症基因的表达。在蛋白质水平上,PSYs也受到调控;PSY的调控包括PSY在叶绿体中的定位;这种定位影响了它们的生物利用度[32].此外,已发现类胡萝卜素代谢产物对Psy蛋白质水平负面调节[33].
类似于其他植物,类胡萝卜素在烟草中的光合作用,生理过程和应力反应中也发挥着重要作用[34]. 此外,由于烟草具有生物量大、易于转基因等特点,烟草被认为是获得有价值类胡萝卜素成分的理想品种[35].Psys控制类胡萝卜素的代谢通量,使得烟草Psys的功能显着的学习。在先前的研究中,克隆了两种转录物烟草品种Petit Havana SR1在核苷酸和氨基酸序列上均表现出86%的同源性[36].这两个基因的过表达导致了严重的矮化表型、色素组成的变化和高水平的植物烯;这证实了PSYs在控制烟草类胡萝卜素生物合成中的重要作用。然而,这两个序列是通过同源性克隆得到的。一些的参考基因组序列烟草物种,如N. Tabacum.[37,38],N. Benthamiana.[39],N西尔维斯特里斯,n tomentosiformis[40]已被释放。因此,本研究的目的是在基因组水平进行调查Psy编码基因,并广泛研究它们在类胡萝卜素生物合成和光合作用中的功能,从而获得了关于该基因家族的更多信息。
结果
的识别精神分裂症基因在烟草
BLAST分析通过查询拟南芥来自不同烟草基因组的Psy蛋白序列,6,5,3和3个候选者精神分裂症基因在N. Tabacum,N. Benthamiana,N.Sylvestris,n . tomentosiformis分别。它们的临时名称和分子特性如表所示1..烟草的编码序列长度精神分裂症在924 ~ 1326 bp之间,蛋白质分子量在34.86 ~ 50.29 kD之间。PSYs的等电点在6.74 ~ 9.16 pH范围内,表明这些蛋白呈碱性。的外显子数精神分裂症范围从6到8(表1.).
烟草的系统发育分析精神分裂症基因家族
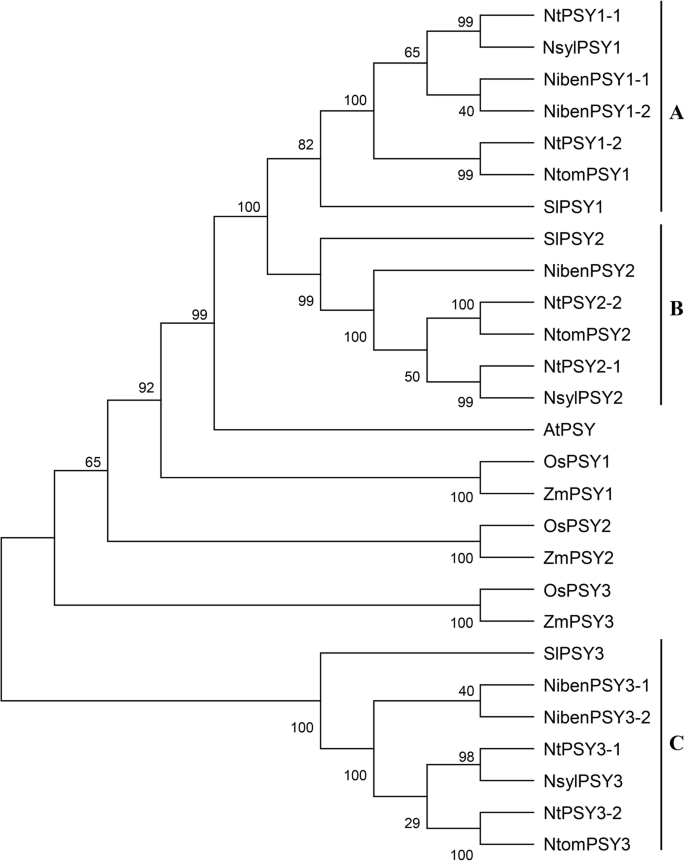
烟草的系统发育关系精神分裂症基因及其同源物拟南芥用MEGA-5软件对水稻、玉米和番茄进行了分析。精神分裂症来自不同烟草物种的基因可以基于它们的系统发育关系分为三组(A,B和C)(图。1.).其中,NtPSY1-1、NtPSY1-2、NibenPSY1-1、NibenPSY1-2、NsylPSY1,ntompsy1.属于A组,NtPSY2–1、NtPSY2–2、NibenPSY2、NsylPSY2,ntompsy2.B组,NTPSY3-1,NTPSY3-2,Nibenpsy3-1,Nibenpsy3-2,Nsylpsy3,ntompsy3.在C组下,在每组中,基因之间的强烈相关性N. Tabacum,N.Sylvestris,n tomentosiformis,与……相比N. Benthamiana.,进行了观察。在A组和B组中,共鉴定出7个外显子和6个内含子精神分裂症基因N. Tabacum,N.Sylvestris,n tomentosiformis基因中有8个外显子和7个内含子N. Benthamiana.;对于C组,在所有基因中鉴定出6个外显子和5个内含子,除外nibenpsy3-2包含7个外显子和6个内含子(表1)1.). 这些结果表明它们之间的系统发育关系相对较低N. Benthamiana.以及其他烟草物种。
烟草PSY蛋白序列的系统发育分析。psy蛋白质序列拟南芥,水稻,玉米和番茄,使用序列加入号从以前的研究[24.]从GeneBank数据库下载
三个精神分裂症番茄中的基因也与烟草聚集在一起精神分裂症基因分为三组(图。1.),这表明精神分裂症茄科植物的基因序列比较保守。然而,精神分裂症在里面拟南芥,米饭和玉米没有与烟草和番茄中的玉米聚集,表明序列精神分裂症在这些物种中,茄科症是多种多样的。
Cis-element分析ntpsy.发起人
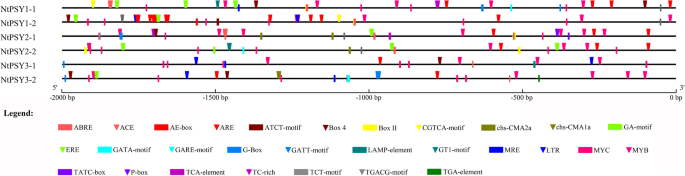
我们曾经N. Tabacum.作为烟草中cis元素测定的模型精神分裂症基因启动子。6 .起始密码子上游2000 bp片段ntpsy.从烟草基因组序列中提取基因并查询PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).如图所示。2.发现的大多数顺式元件都与光反应有关(ACE、AE盒、ATCT基序、盒4、盒II、chs-CMA1a、chs-CMA2a、GA基序、GATA基序、GATT基序、G盒、LAMP基序、GT1基序、MRE和TCT基序)。其他顺式元件被鉴定参与对温度(LTR)、干旱胁迫(MYB、富含TC)或植物激素的反应,包括MeJA(CGTCA基序、TGACG基序)、脱落酸(ABRE)、生长素(TGA元件)、赤霉素(GARE基序、TATC盒、P盒)和水杨酸(TCA元件),表明精神分裂症受多种发育和环境因素的调节。
在所有三组中都存在于这些顺式元素,Box 4,Gata-Motif,G字框,TCT-MOTIF,MYC,ABRE,IER和MYB中ntpsy.(附加文件)1.:表S1)。AE-box、ATCT基序、TGACT基序、CGTCA基序和GCN4基序仅在正常人中存在NTPSY1.chs-CMA2a、GA-motif、TATC-box、P-box、TCA-element和W box均为特异性表达NtPSY2. chs-CMA1a、GATT基序、LAMP元件和TGA元件仅存在于细胞中NtPSY3. 不同地区cis元素的多样性ntpsy.启动子表明它们的表达可能受到不同机制的调控。
表达模式ntpsy.组织中的基因
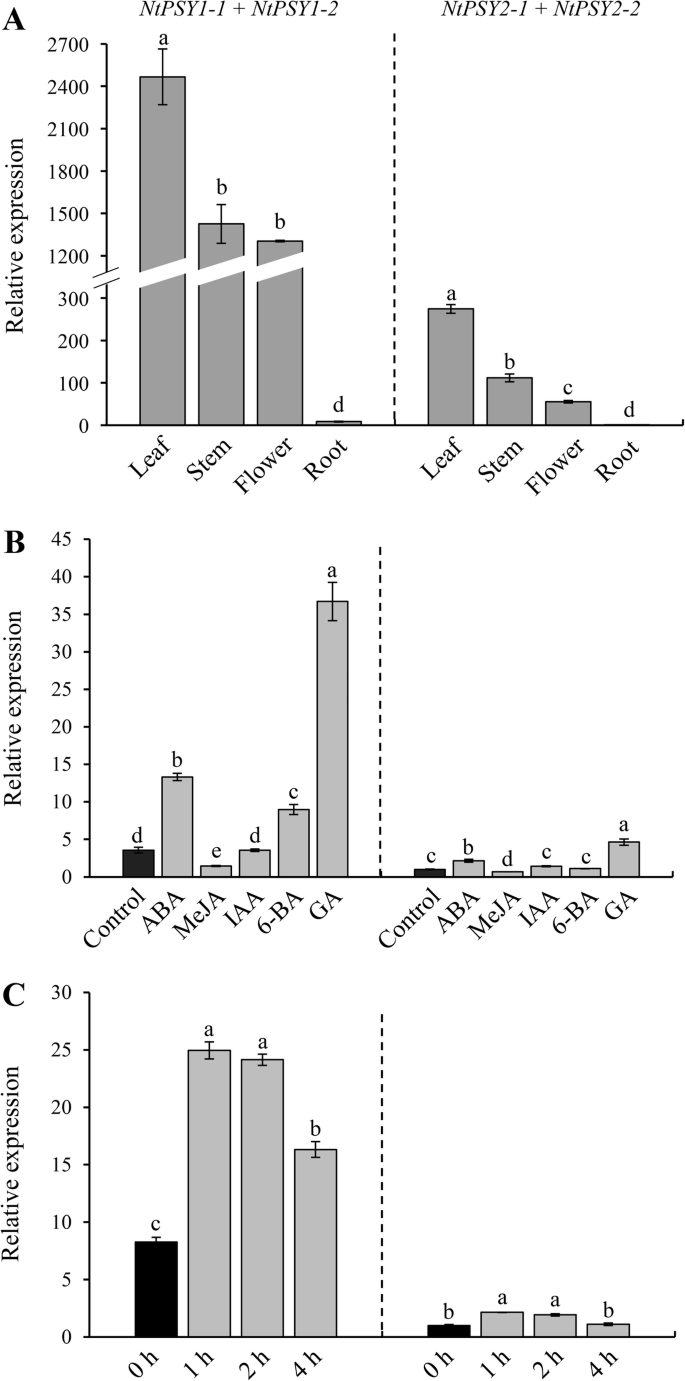
基因表达水平ntpsy.在全绽放阶段的四个组织(叶,茎,花和根)中进行了比较。由于高度相似ntpsy.3对保守的qPCR引物(见附加文件2.:表S2),可用于估计的和表达式NtPSY1-1和NtPSY1-2,NtPSY2–1个和NtPSY2–2个,NtPSY3–1个和NtPSY3–2个分别设计。结果表明表达了NtPSY3–1个和NtPSY3–2个在四种组织中均未检测到(数据未显示),表明它们可能未在这些组织中表达。其他四个基因表达模式相似;在叶片中的表达水平最高,在茎和花中的表达水平中等,在根中的表达水平相对较低。3.),表明ntpsy.基因主要在叶、茎和花中发挥作用。此外,表达水平NtPSY1-1和NtPSY1-2比其他人高得多NtPSY2–1个和NtPSY2–2个,建议NtPSY1-1和NtPSY1-2功能更重要NtPSY2–1个和NtPSY2–2个.
表达模式ntpsy.基因。一个表达水平ntpsy.叶子,茎,花朵和根中的基因;通过设定表达值来计算每个组织中的相对表达水平NtPSY2–1个+NtPSY2–2个在根部为1。B表达的变化ntpsy.不同植物激素处理的基因;通过设置表达量,计算不同条件下的相对表达量NtPSY2–1个+NtPSY2–2个在控件中为1。C表达的变化ntpsy.强光条件下的基因;通过设置基因表达值计算不同时间段的相对表达水平NtPSY2–1个+NtPSY2–2个在0小时,可用于估计总和表达的三对保守的QPCR引物NtPSY1-1和NtPSY1-2,NtPSY2–1个和NtPSY2–2个,NtPSY3–1个和NtPSY3–2个分别设计。列和栏代表手段和标准错误(N= 3),分别。用不同字母标记的列表示统计显著性(P< 0.05). 表达式的数据NtPSY3–1个和NtPSY3–2个未显示在所有条件下没有检测到表达
表达ntpsy.基因受不同植物激素和强光条件的影响
获得烟草的表达谱精神分裂症植物激素处理和强光条件下的基因,N. Tabacum.以脱落酸(ABA)、茉莉酸甲酯(MeJA)、吲哚-3-乙酸(IAA)、6-苄基腺嘌呤(6-BA)、赤霉素(GA)为模型,强光照射。qPCR检测细胞的相对表达水平ntpsy.不同处理下的基因。没有表达式NtPSY3–1个和NtPSY3–2个在任何治疗后被检测到(数据未显示)。处理后N. Tabacum.随着ABA,6-BA和GA,其他四种基因的表达水平显着上调,但显着下降N. Tabacum.接受惩罚;IAA处理后,表达水平无明显变化(图。3.b) 是的。在强光条件下,表达NtPSY1-1,NtPSY1-2,NtPSY2–1个,NtPSY2–2个在治疗1小时后均上调并达到峰值并此后下降(图。3.C)。的表达水平NtPSY1-1和NtPSY1-2明显高于那些NtPSY2–1个和NtPSY2–2个在所有治疗中。这些结果表明,植物激素和光线在调节方面发挥重要作用ntpsy.基因表达.
占据NbibenPSY基因沉默
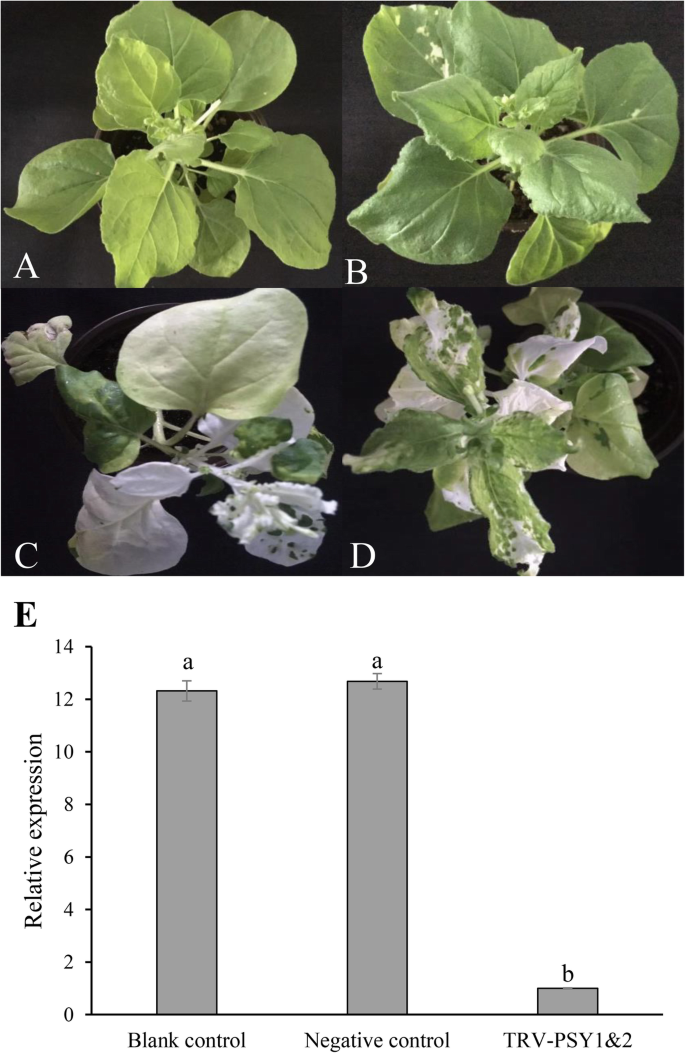
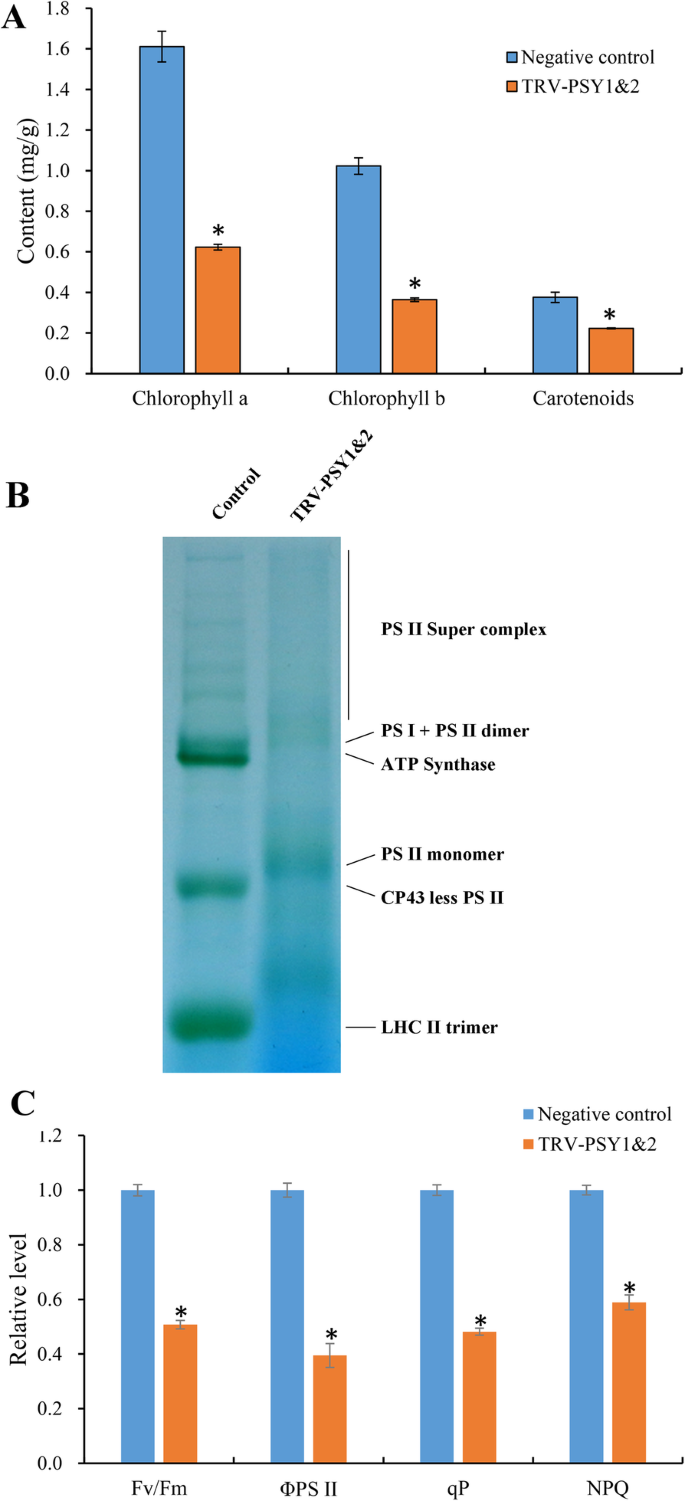
进一步研究烟草的功能精神分裂症研究结果表明,TRV-PSY1和TRV-PSY2是病毒诱导的基因沉默结构物。前者包含由nibenpsy1-1和nibenpsy1-2而且可以让两者都保持沉默,而后者可以保持沉默NibenPSY2.这两种结构被共同引入N. Benthamiana.通过农杆菌介导的转化使这三个基因同时沉默;蒸馏水、空载体和TRV-PDS构建物(如前所述)可以沉默植物烯去饱和酶基因[41)分别定义为空白、阴性和阳性对照。如图所示。4.一个-d, the newly emerged leaves of the positive control and TRV-PSY1/TRV-PSY2 co-transformed plants (named TRV-PSY1&2 hereafter) were severely bleached and characterized by abnormally wrinkled shapes, whereas no marked changes were identified in the blank and negative controls. Conserved qPCR primers were designed to estimate the expression levels of all threenibenpsy.基因。表达水平nibenpsy.与空白对照和阴性对照相比,trv - psy1和2的基因明显受到抑制(图5)。4.e)。这些结果表明了nibenpsy.基因沉默了。
光系统的变化NbibenPSY- 植物
胡萝卜素在植物光合作用中发挥重要作用6.]和漂白表型NbibenPSY-我们观察到的沉默植物启发我们分析光系统的潜在变化。首先,我们测量了类胡萝卜素和叶绿素含量(图。5.一种)。与阴性对照相比,TRV-PSY1和2植物中的类胡萝卜素含量显着降低,检测到仅60%的类胡萝卜素。TRV-PSY1和2植物中叶绿素A和叶绿素B的含量也降低,分别递减为67.26和64.65%。
接下来,我们探讨了NbibenPSY类囊体结构沉默;利用蓝色天然聚丙烯酰胺凝胶电泳(BN-PAGE)分析类囊体膜蛋白复合物(图。5.b) 是的。与阴性对照相比,TRV-PSY1&2植株的所有蛋白带密度均降低,表明TRV-PSY1&2植株类囊体膜蛋白复合体的积累较少。
我们测定了trv - psy1和2与阴性对照植株的叶绿素荧光差异,以评价其光合性能。测量了四个参数,Fv/Fm (PSII光化学的最大量子效率),ΦPSII (PSII光化学的量子产率总和),qP(光化学猝灭)和NPQ(非光化学猝灭)。5.c);与负对照相比,trv - psy1和2植株的光系统活性显著降低NbibenPSY-沉默植物显著减少。
与控制相比,TRV-PSY1和2叶片的代谢物分析
沉默引起的叶片的代谢变化精神分裂症采用GC-MS对基因进行分析。测定85种已知代谢物的水平(附加文件3.:表S3)。大多数化合物,包括氨基酸和有机酸,在TRV-PSY1和2中下调。在TRV-PSY1和2中仅需16个组分;这些组分包括细胞壁组分和主要是糖及其衍生物,包括阿拉伯呋喃,左葡聚糖和阿拉伯醇。有趣的是,Sedoheptullose也是上调的组分中。在植物中,SedoHepleplose主要存在于单磷酸盐中,在光合作用期间起着重要的作用,并且仅在细胞死亡时释放[42],表明TRV-PSY1和2中严重发生细胞死亡。
TRV-PSY1&2与对照植物RNA序列数据的全局分析
为了广泛地分析烟草Psys的功能,我们在TRV-PSY1和2和阴性对照的基因之间进行了RNA-SEQ分析。每组使用三种生物重复。为每个样品产生约4600万个配对的原始读数。通过丢弃低质量读数获得清洁读数;共生成270万清洁读取,并处理使用Trinity软件组装De Novo转录组[43].获得了总共418,816种转录物,并且每个Unigene被定义为同源基团中的最长转录物。最后,获得了总共169,954个unigenes,平均折叠长度为598bp和最小和最大长度的201和12,283bp,分别为201和12,283 bp,表格2.).
获得的unigenes用以下数据库进行查询和注释:NT (NCBI nucleotide sequences)、NR (NCBI non-redundant protein sequences)、COG (Clusters of Orthologous Groups of proteins)、KOG (euKaryotic Ortholog Groups)、Swiss-Prot (A manually annotated and review protein sequence database)、TrEMBL、PFAM (protein family)、CDD (conservative Domain database)、GO (Gene Ontology)、KEGG(京都基因和基因组百科全书)。所有169,954个unigenes被注释;64.14%的unigenes在至少一个数据库中被注释,0.82%在所有数据库中被注释(附加文件4.:表S4)。
将上述获得的一组单基因用作参考序列,然后使用Bowtie2软件将每个样本的干净读数映射到它[44]. 对于每个样本,超过93%的干净读取被成功映射(表1)3.),表明我们的结果质量足以进行下游分析。
为了促进不同样品之间基因表达水平的差异的比较,基于读取映射结果计算每个样品的基因表达水平,并且显示为每百万(TPM)值的转录物[45].
trv - psy1和2与对照植株差异表达基因的功能分析
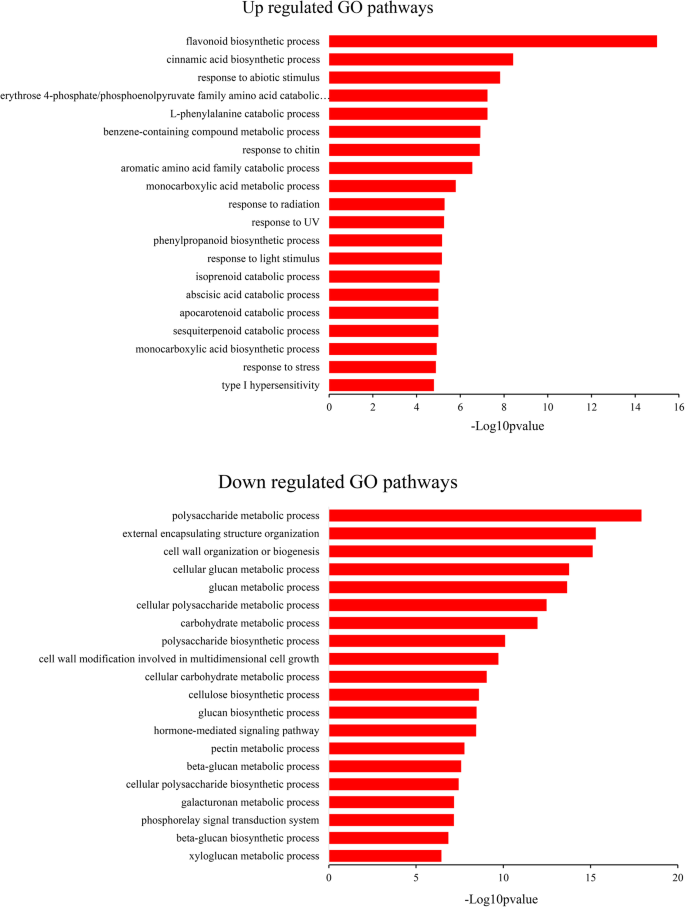
使用DESEQ软件识别差异表达基因(DEGS)[46],与p值和q值< 0.05和对数2.折叠> 1或< - 1作为显着差异表达的阈值。在本研究中,共有748和854只分别在TRV-PSY1和2植物中进行了上调和下调(附加文件5.:表S5)。为了评估这些DEG的功能类别,使用topGO软件进行GO富集分析[47].一种P<0.05且Q< 将0.05设为显著阈值,分别对这些上调和下调的DEG富集58个和96个GO项(另附文件)6.:表S6)。前20个生物过程GO项如图所示。6..在TRV-PSY1和2植物中上调了非生物应激,异戊二烯化合物和氨基酸分解法的途径,而下调的途径主要涉及细胞壁组分的生物合成,例如多糖,葡聚糖,纤维素,果胶和半乳糖醛,表明Psy可能在这些过程中发挥重要作用。
类胡萝卜素生物合成途径基因表达的变化
表达水平的变化NbibenPSY使用RNA-SEQ数据检查基因沉默和对照植物中的基因,该数据与QPCR分析一致(图。4.). 这个ir expression was significantly repressed in TRV-PSY1&2 plants compared to that of the control plants (Table4.);这进一步证实了RNA-Seq结果的高质量。在trv - psy1和2中,运行于PSY上游的GGPP合成酶也被下调;与此相反,除NXS外,PSY的所有下游基因在trv - psy1和2中均表达上调(表2)4.).
类胡萝卜素生物合成基因的qPCR验证
为了确认RNA-SEQ结果,随机选择在类胡萝卜素生物合成途径中六步的基因进行QPCR分析;选择的基因是编码GGPPS,Pds,ZDS,CrTiso,β-Lcy和Nxs的基因。为了确定每个所选步骤中基因的总表达水平,设计了保守的引物;使用的引物在附加文件中列出2.S2:表。结果表明,尽管在表达水平上存在一些数量上的差异,但qRT-PCR结果表明,所有基因均具有与RNA-seq数据显示的相似的表达模式(附加文件7.:图S1),从而进一步验证RNA-Seq数据。
鉴定调节类胡萝卜素生物合成的推定转录因子
由于trv - psy1和2中类胡萝卜素生物合成途径基因含量升高(表2)4.),其中涉及的转录因子可能参与类胡萝卜素合成的调控;在上调和下调的deg中,分别鉴定出40个和55个转录因子8.:表S7)。WRKY、MYB和NAC是上调的前3位转录因子家族,而乙烯反应转录因子、bHLH和WRKY是下调的前3位转录因子家族。这表明它们可能诱导类胡萝卜素生物合成基因的上调。
讨论
类胡萝卜素在光合作用、激素信号传导和次生代谢中起着重要作用。众所周知,植物烯合成酶在类胡萝卜素生物合成途径中起着重要作用,因为它参与了第一个承诺步骤和速率限制步骤,这可能控制下游的流量[18.].即使只有一个精神分裂症基因发现于拟南芥[19.],已知许多植物物种具有多个精神分裂症具有高序列多态性的基因,包括水稻[20.)、玉米(21.],还有西红柿[22.,23.,24.],表明在功能上存在着广泛的分歧精神分裂症植物界基因家族;因此,还需要进一步的资料。
精神分裂症基因序列高度保守烟草品种与番茄
先前的一项研究确定了两个精神分裂症基因N. Tabacum.使用基于同源的克隆[36];但是,在番茄中,这也是茄科物种,三个精神分裂症发现基因[24.,表明可能存在其他一些物种精神分裂症烟草中的基因。在这项研究中,我们进行了全基因组筛选来探索精神分裂症四分之一的基因烟草物种,即N. Tabacum,N. Benthamiana,N.Sylvestris,n tomentosiformis; 6、5、3和3精神分裂症基因(表1.)分别进行了鉴定。系统发育分析表明,它们可分为3个类群。1.).其中,NtPSY1-1,NtPSY2–1个,NtPSY3–1个高度相关NsylPSY1,NsylPSY2,NsylPSY3,分别。另一方面,NtPSY1-2,NtPSY2–2个,NtPSY3–2个更紧密地聚集在一起ntompsy1.,ntompsy2.,ntompsy3.,分别。考虑到这一点N. Tabacum.异源四倍体是起源于杂交N西尔维斯特里斯和n tomentosiformis[37],我们推测NtPSY1-1,NtPSY2–1个,NtPSY3–1个来自N西尔维斯特里斯,鉴于NtPSY1-2,NtPSY2–2个,NtPSY3–2个起源于n tomentosiformis.N. Benthamiana Psy.各组基因与其他三个基因的相似度较低烟草物种之间的系统发育关系相对较低N. Benthamiana.以及其他烟草物种。特别是,只有一个PSY2型基因发现于N. Benthamiana.它也是一种异源四倍体[39].缺乏另一种PSY2型成员可能是多倍化过程中基因损失的结果。
三个精神分裂症番茄的基因也聚类为3组(图1)。1.),表明烟草精神分裂症基因是番茄中那些人的同源物精神分裂症基因序列是溶于溶的含量;然而,精神分裂症基因拟南芥,水稻和玉米与烟草和番茄中的没有聚集,这一发现在以前的研究中也有报道[24.],表明序列精神分裂症基因在不同的物种中是不同的。
NTPSY1有一个占主导地位的表达模式相对其他精神分裂症基因
在我们的结果中,烟草PSY1型和PSY2型显示出类似的表达模式,叶子中的最高水平,茎和花中的中间体,并且根中低(图。3.a),表明它们主要在空中组织中起作用。烟草之间的组织特异性表达缺乏差异PSY1型和PSY2型减少它们之间子功能化的可能性。另一方面,烟草之间可能存在功能冗余PSY1型和PSY2型.PSY1型可能在类胡萝卜素生物合成中起主导作用,因为其表达水平远远高于PSY2型.这和番茄有很大的不同精神分裂症基因在不同的组织中发挥作用PSY1型主要表达水果[22.],PSY2型在成熟的叶子上工作[23.],和心理战3根函数[24.].许多研究发现,PSY的活动可以在转录后水平上进行调节[33,48,49,50],这表明烟草之间的子官能化PSY1型和PSY2型可能发生在蛋白质水平;因此,蛋白质定位、催化活性和相对蛋白含量的检测将为了解不同烟草的功能提供更多的信息精神分裂症基因。
另一方面,表达心理战3在这些组织中未检测到(未示出的数据),表明它在这些组织中不起作用。烟草心理战3属于一个新发现的精神分裂症分支,广泛分布但仅限于双子叶植物[24.]. 与我们的结果相似,在曼尼霍特埃斯库伦塔,心理战3在测试的所有组织和病症中也不存在转录物[51];但是,在番茄中,心理战3强烈地专注于根,主要是响应磷酸盐饥饿,而Medicago truncatula PSY3也在根中起作用,主要参与甾体内酯生物合成和磷饥饿[24.]. 因此,烟草缺乏表达的一个可能原因心理战3它只在特殊条件下表达,现在还不知道;然而,其他可能的解释也存在,例如,它可能是一个伪基因。综上所述心理战3在Dicots中,远非众所周知,仍然需要进一步的研究。
不同烟草品种间表达模式的差异精神分裂症基因可能与其启动子活性密切相关,这取决于不同基因间顺式元件组成的不同。如图所示。2.和附加文件1.:表S1,一些元素,如AE-BOX,ATCT-MOTIF,TGACT-MOTIF,CGTCA-MOTIF,而GCN4-motif仅存在于NTPSY1,这可能是高转录水平的原因NTPSY1.此外,一些顺式元件如ACE、Box II、GT1-motif和CAT-box被共享NTPSY1和NtPSY2,但不在NtPSY3,这可以解释非表达NtPSY3. 唯一存在于NtPSY3启动子可能支持调控的提示NtPSY3. 共鉴定出4个顺式元件,即chs-CMA1a、GATT基序、LAMP元件和TGA元件,它们与光和生长素反应有关。但是,没有表达NtPSY3在我们的研究中,在光照和IAA治疗下发现的,提示它们是无功能的。
尽管不同基因的表达水平存在着显著差异ntpsys.三组细胞中均含有G-box、ABRE等顺式成分ntpsy.(附加文件)1.:表S1)。其中一些元素,如G-box,在细胞的光响应表达中起着至关重要的作用精神分裂症基因拟南芥[52].由此可见,烟草表达模式不同精神分裂症基因只受启动子中识别的部分元件的调控,每个顺式元件的选择性缺失可以证明其详细的转录调控机制。
烟草精神分裂症基因通过控制类胡萝卜素的合成在光合作用和光保护中起着至关重要的作用
早期研究发现类胡萝卜素是光合系统的重要组成部分,降低类胡萝卜素含量会显著降低光合效率,导致白化表型[1.].trv - psy1和2的新出叶也发生了严重的变形。4.).根据我们的研究结果,我们推测这种表型改变主要发生在代谢水平,但是ntpsy.仍然是致病基因。直接后果ntpsy.沉默是类胡萝卜素含量的显著降低(图。5.a) ,这导致了采光复合体的不稳定性(图。5.b)和降低光合效率(图。5.c).此外,NPQ的下降表明多余的光能不能被有效耗散,使细胞暴露于严重的氧化应激[5.],最终导致细胞死亡和漂白叶子。
RNA-SEQ的一致结果和代谢分析进一步加强了重要作用精神分裂症光合作用和光保护的基因。由于光合效率降低,细胞能量不足;因此,许多分解代谢过程,包括氨基酸、异戊二烯和倍半萜在TRV-PSY1&2中上调(图。6.),符合此,代谢族分析表明,TRV-PSY1和2中大多数代谢物减少(附加文件3.:表S3)。GO富集还发现,辐射、UV、光刺激等非生物刺激反应途径上调,类黄酮生物合成过程也上调,表明TRV-PSY1&2正遭受过量光能引起的严重胁迫。
下调的GO途径主要涉及细胞壁组分的生物合成,如多糖,葡聚糖,纤维素,果胶和半乳糖醛(图。6.).代谢组学分析也显示,trv - psy1和2中部分细胞壁成分增加。更有趣的是,游离的sedoheptulose也升高了,sedoheptulose只在死亡的植物中释放[42],表明TRV-PSY1和2中发生了更多的细胞死亡,导致细胞壁的拆卸和分离组分的增加。类似于我们的结果,它也被发现在番茄中被击倒Psy-1造成大量减少的家务和结构蛋白[53].
烟草精神分裂症基因对不同的激素和光信号有反应
以前的研究发现,表达精神分裂症基因受到多种因素的调控,如植物激素如乙烯和脱落酸在调控中起着重要作用精神分裂症基因的表达。强光,盐,干旱,温度和光周期等环境信号还可以修饰PSY基因的表达水平[27.].PIF1、HY5等转录因子感知上述信号,进而控制转录精神分裂症基因[31].在本研究中,我们还发现了许多顺式元素精神分裂症基因启动子,其中大多数被发现响应光信号,而植物激素响应元件也被发现(图。2.).与此相一致的是,我们测试了植物激素和强光胁迫对其的影响精神分裂症结果表明,ABA、6-BA和GA处理均能提高表达量PSY1型和PSY2型(图。3.b) 是的。强光应力也会升高PSY1型和PSY2型表达水平(图。3.C),表明类似于其他植物物种,烟草PSY1型和PSY2型受这些因素的调控。令我们惊讶的是,大多数cis元素PSY1型和PSY2型发起人也出席了会议心理战3子,但心理战3没有对我们测试的这些治疗进行回应,表明这一点心理战3可能在其他未知的过程中起作用。
烟草精神分裂症与其他基因协同工作以控制类胡萝卜素的生物合成
作为类胡萝卜素生物合成途径的第一个酶,精神分裂症已与许多光合作用相关基因共表达,如类胡萝卜素和叶绿素的生物合成[26.]这可以解释TRV-PSY1&2植物叶绿素含量的下降(图。5.).此外,在我们的RNA-Seq分析中,我们也发现类胡萝卜素生物合成基因在烟草中协调表达,如表所示4..在trv - psy1和2中,类胡萝卜素生物合成途径的大部分下游基因均上调精神分裂症可以影响这些基因的表达。与我们的结果一致,在番茄转基因株系过表达Psy-1大多数下游基因在转录水平受到抑制[49]. 与下游基因的变化相反,GGPPS,哪个有效的流精神分裂症负责类胡萝卜素生物合成的前体,在trv - psy1和2中被下调(表4.).类似于我们的结果,番茄的过度表达Psy-1提高了文字记录的水平GGPPS[49].另一项研究发现,增强的PSY活动可以上调DXS水平[18.].DXS是一种MEP途径酶,也适用于对等异单元生物合成的PSY流和反应,表明变化精神分裂症水平也可能影响上游基因的表达。在番茄中,PSY可以与其他酶如GGPPS与大蛋白质复合物相关联[48],表明该协会可能影响这些基因的共调节。
以往的研究发现,在一些类胡萝卜素生物合成基因的启动子中存在一个共同的atcta基序,包括精神分裂症和PDS.,以及它们的上游基因DXS.和HDR公司在MEP途径。该基序是ERF转录因子的结合位点[52,54].在这项研究中,我们确定了DEG之间的95个转录因子(附加档案8.:表S7)。其中有15个属于ERF家族,可能参与了类胡萝卜素生物合成基因之间的协同表达调控,有待进一步验证。
结论
我们确定了三组精神分裂症四分之一的基因烟草与番茄的相似度较高,但与单子叶的相似度不高。PSY1型和PSY2型在叶片中的表达量最高,激素和强光处理都能提高表达量,但在叶片中没有表达心理战3已检测到。光合系统活性显著降低PSY1型和PSY2型沉默的植物。RNA-Seq分析表明烟草精神分裂症与其他基因协同控制类胡萝卜素的生物合成。这里获得的信息可能有助于进一步研究精神分裂症基因和类胡萝卜素生物合成。
方法
植物材料和生长条件
烟草benthamiana普通烟草(烟草品种K326。种子在湿润的土壤上萌发,在16℃下生长 h灯,8 h暗,25 °C条件。
的识别精神分裂症烟草基因组中的基因
K326的基因组序列和注释信息,本塔米亚烟草,sylvestris烟草,烟草tomentosiformis从Sol基因组学网络(SGN)数据库中获得(https://solgenomics.net/). 这个拟南芥psy蛋白序列(AT5G17230)获得拟南芥信息资源数据库(https://www.arabidopsis.org/)作为查询序列,利用BlastP程序和e-value < 1e对不同烟草品种的PSY序列进行筛选−10作为查询阈值。从Pfam数据库中提取PSY结构域(登录号PF00494)(http://pfam.xfam.org/)使用HMMER Web服务器确定PSY序列(https://www.ebi.ac.uk/Tools/hmmer/)[55].
系统发育分析
为了阐明烟草Psy蛋白和其他物种之间的系统发育关系,使用Mega 5软件进行系统发育分析[56].其中PSY蛋白的序列及相应的序列加入数拟南芥,如前所述使用米饭,玉米和番茄[24.],并从GeneBank数据库(https://www.ncbi.nlm.nih.gov/).
氨基酸序列采用默认参数CLUSTALW算法进行多序列比对,所得比对区域采用Neighbor-Joining法进行系统发育分析[57[和系统发育树用1000个引导重复构建。
烟草顺式元素分析ntpsy.基因启动子
2000年 起始密码子上游的bp序列ntpsy.基因从SGN数据库中获取,顺式元件分析采用PlantCARE web工具(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/). 利用GSDS2.0web服务器将结果可视化(http://gsds.cbi.pku.edu.cn/).
植物激素处理和强光照射
五叶期,K326植株分别喷施50 μmol/L赤霉素(GA)、100 μmol/L茉莉酸甲酯(MeJA)、10 μmol/L脱落酸(ABA)、2 μmol/L 6-苄基腺嘧啶(6-BA)和5 μmol/L 3-吲哚乙酸(IAA),对照植株喷施双蒸馏水;处理8 h后收获叶片。强光照条件定义为1200 μmol∙m− 2.∙年代− 1.控制条件为400 μmol∙m− 2.∙年代− 1.,在0 h和1、2和4 治疗后2h。每个处理使用三个生物复制品。收获的材料立即浸入液氮中,并储存在低温下− 80 °C直到使用。
占据NbibenPSY沉默
为了阐明烟草PSY的生物学功能,NbibenPSY用病毒诱导的基因沉默方法使基因沉默。序列相似性为96.2%NbibenPSY1–1号和NbibenPSY1–2号,同时进行基因沉默。另取726 bp的cDNA片段nbibenpsy2.沉默。以叶片cDNA为模板,通过PCR扩增获得两个片段。使用的底漆在附加文件中列出2.:表S2,带有kpn.我和XHO.I分别作为正向和反向引物的克隆位点。
两个片段和空PTRV2(Pyl156)载体(在Liu等,[58])单独消化使用kpn.我和XHO.我限制酶。然后,将片段连接到消化的Pyl156载体中,并通过测序证实。因此获得了两种构建体,即TRV-PSY1和TRV-PSY2。然后将两个构建体转移到农杆菌肿瘤术菌株GV3101采用冻融法。
渗透N. Benthamiana.叶子主要基于前面描述的方法进行[59]. 简要地,农采用含TRV-PSY1或TRV-PSY2的菌株在含适当抗生素的LB (Luria Bertani)培养基中28℃培养。收集细胞并在浸润缓冲液(10 mm MES, pH = 5.5, 200 μm乙酰丁香酮和10 mm MgCl)中重悬2.)至最终吸光度(600nm的光密度(OD))1.0,并在25±2℃下孵育2小时。叶片渗透,每个叶片渗透农将含有TRV-PSY1或TRV-PSY2的菌株在渗透缓冲液中的1:1的比例中混合,并使用1mL无需注射器渗透到下叶中。空幽门156载体及其衍生物,TRV-PDS构建体(可能沉默植物烯去饱和酶如前所述的基因[41)分别作为阴性和阳性对照,方法相同。渗透的植物保持在25°C,有效的病毒感染和传播。
光合活性测定
类胡萝卜素和叶绿素的分离如前所述[60]. 简要地,50 mg (fresh weight) samples were mixed and shook with 1 ml 80% (v/v) ice-cold acetone in the dark at 4 °C for 30 min. After centrifugation (10,000×g, 2 min, 4 °C), absorbances at 663 nm, 647 nm, and 470 nm were recorded using a spectrophotometer, and pigment levels were calculated using the following equation: chlorophyll a = 12.25*A663–2.79*A647; chlorophyll b = 21.50*A647–5.10*A663; chlorophyll total = 7.15*A663 + 18.71*A647; carotenoids = (1000*A470–1.82* chlorophyll a – 85.02* chlorophyll b)/198.
采用Dual-PAM 100 (WALZ,德国)测量叶绿素荧光;测量了PSII光化学的最大量子效率Fv/Fm、ΦPSII、qP和NPQ四个参数。
对于囊体隔离,将1g样品置于5ml提取缓冲液(500mM山梨糖醇,50mM Tris-HCl,2mM EDTA,1mM MgCl中2., 1mm MnCl2.,pH = 6.8,4°C)接地,并通过电池过滤器过滤。然后,将混合物在4℃下离心,8000g 5分钟。然后使用25bth20g缓冲液(pH = 7.0,20%甘油和25mM BIS-TRIS)洗涤上清液中的囊体,并以4℃,15,000×g离心5分钟。如前所述进行蓝色天然聚丙烯酰胺凝胶电泳(BN-PAGE)[61]有一些修改;将12μg叶绿素与1%β-DM一起温育,然后将溶解的级分装载在天然梯度凝胶上(5-12%(w / v),丙烯酰胺/双丙烯酰胺比32:1),均以4%(w/ v)堆叠凝胶(比率1:4)。电泳后,用Laemmli缓冲液(138mM Tris-HCl [pH 6.8],6M尿素,22.2%[V / V]甘油,4.3%[W / V] SDS,和200mmDTT),并且使用涡轮转移系统(Bio-rad)将分离的蛋白质复合物转移到聚偏二氟乙烯膜上。
叶片代谢组学分析
根据先前描述的方法研究了使用气相色谱 - 质谱(GC-MS)对来自对照和TRV-PSY1和2的烟草叶的代谢曲线[62]有一些修改。将冷冻干燥的组织研磨成均匀的粉末并使用40目筛过滤。将叶粉(10mg)加入到2ml Eppendorf管中并浸泡在含有异丙醇/乙腈/水(3/3/2,v / v)的1.5ml萃取溶剂中,用25μl(0.1mg / ml)三偶联酸作为内标。将所有提取物放入1小时并离心10分钟(14,000rpm,4°C)。将上清液将上清液转移到新管中,并在N-Evap氮蒸发器上在氮气流下干燥。为了增加代谢物的挥发性,通过将100μl甲基三甲基甲硅烷基 - 三氟甲酰胺(MSTFA)加入样品中并在60℃下孵育60分钟来进行甲硅烷基化反应。
代谢组学分析的GC-MS分析采用安捷伦7683B系列进样器(安捷伦,圣克拉拉,CA),与安捷伦6890 N系列气相色谱系统和5975质量选择性检测器(MSD)(安捷伦,圣克拉拉,CA)进行。色谱柱为Agilent DB-5MS (0.25 μm, 0.25 mm × 30 m, Agilent Technologies, Inc., Santa Clara, CA)。柱温设置为70°C,起始4分钟,然后以5°C/min增加到310°C,起始15分钟。氦气(99.9995%)为载气。柱流量为1.2 ml/min,采用线性速度控制模型。界面温度和离子源温度分别调整到280℃和230℃。建立电子冲击(EI)模型,在70 eV时实现代谢物的电离。
学生的T采用-检验(SPSS软件,17.0版)测定对照与TRV-PSY1&2代谢物之间的显著性差异。
RNA制备
收获不同的植物组织并立即使用液氮冷冻。使用旋转柱植物总RNA净化试剂盒(中国桑逊Biotech)分离出总RNA。使用Nanodrop 2000(Thermo Fisher,US)和琼脂糖凝胶电泳进一步测定这些RNA样品的质量和数量。
逆转录和定量实时PCR(QPCR)分析
使用Primescript逆转录酶(Takara)合成第一链cDNA。用于QPCR的引物在附加文件中列出2.S2:表。使用Roche光环480系统进行QPCR。反应混合物含有2μL引物(2.5μm),10μlSYBR绿色I主混合物(Roche),2μLcDNA模板和6μl水。实时PCR条件设定如下:95℃5分钟,其次是45℃的95℃,10s,60℃,30℃,72℃为20 s。通过在20分钟内缓慢加热60℃至95℃的熔化曲线。使用2计算相对基因表达水平-ΔCT每个样本重复3次。数据以均数±标准差(SD)表示(N= 3)。
rna测序和数据处理
6个样本用于RNA-seq分析:3个来自TRV-PSY1和TRV-PSY2共渗透植物(TRV-PSY1和2),3个来自对照植物。总RNA被送到生工生物技术(上海)有限公司,文库就是在那里生产的。然后使用Illumina HiSeq™2000对cDNA文库进行测序。然后,使用Trimmomatic软件剔除适配器和低质量reads,得到150 bp的配对端干净数据[63]. 使用Trinity软件处理生成的干净读取[43]来组装一个从头转录组,并作为下游分析的参考序列。
从新转录组中获得的Unigenes采用以下数据库进行查询和注释:NT (NCBI nucleotide sequences)、NR (NCBI non-redundant protein sequences)、COG (Clusters of Orthologous Groups of proteins)、KOG (euKaryotic Ortholog Groups)、Swiss-Prot (A manually annotated and review protein sequence database)、TrEMBL、PFAM (protein family)、CDD (conservative Domain database)、GO (Gene Ontology)、KEGG(京都基因和基因组百科全书)。
将上述获得的unigenes集合作为参考序列,用Bowtie2软件将每个样本的clean reads图谱绘制到序列上[44].基于读取映射结果计算基因表达水平,并显示为每百万(TPM)值的转录物[45].
我们使用了DESEQ软件[46]鉴定样本间差异表达基因。调整过的P以DESeq检测到的-value < 0.05为标准来表征基因表达水平的显著性。确定受精神分裂症,利用topGO软件进行DEGs的GO富集途径分析[47].
可用性数据和材料
本文使用的RNA-seq数据集可在NCBI序列读取档案(SRA) (https://www.ncbi.nlm.nih.gov/sra/),生物工程注册号:PRJNA631583。支持结果的数据包含在本文及其附加文件中。
缩写
- 阿坝:
-
脱落酸
- BN-页码:
-
Blue-native聚丙烯酰胺凝胶电泳
- 度数:
-
差异表达基因
- GA:
-
赤霉素
- GC-MS:
-
气相色谱分析-质谱法
- GGPP公司:
-
天竺葵二磷酸二磷酸酯
- 国际宇航科学院:
-
吲哚乙酸
- 梅贾:
-
茉莉酸甲酯
- 精神分裂症:
-
八氢番茄红素合酶
- 6-BA:
-
6-benzyladenine
参考文献
- 1。
Rodriguez-Concepcion M, Avalos J, Bonet ML, Boronat A, Gomez-Gomez L, Hornero-Mendez D, Limon MC, Melendez-Martinez AJ, Olmedilla-Alonso B, Palou A, et al.;类胡萝卜素的全球视角:代谢、生物技术和营养与健康的益处。脂质研究进展。2018;70:62-93。
- 2。
Sun T,Li L.朝着“金黄”时代:揭示植物类胡萝卜素积累监管控制的地位。植物SCI。2020; 290:110331。
- 3.
类胡萝卜素数据库:结构、化学指纹和生物间的分布。数据库。2017:bax004。
- 4.
Eggersdorfer M,Wyss A.在人类营养和健康中的类胡萝卜素。拱生物学生生物糖。2018; 652:18-26。
- 5.
Peñuelas J, Munné-Bosch S.异戊二烯类:光保护的进化池。植物科学学报,2005;10(4):166 - 169。
- 6.
桥本H, Uragami C, Cogdell RJ。类胡萝卜素和光合作用。正确的做法:strange C, editor。自然界中的类胡萝卜素:生物合成、调节和功能。Cham:施普林格国际出版公司;2016.111 - 39页。
- 7.
脱落酸的合成与响应。Arabidop书。2013;11:e116。
- 8。
贾·吉卜,Baz L,Al-Babili S.从类胡萝卜素到杂草酮。J Exp Bot。2018; 69(9):2189-204。
- 9。
Britton G.完整类胡萝卜素的功能。在:Britton G,Liaaen-Jensen S,Pfander H,编辑。类胡萝卜素:第4卷:自然功能。巴塞尔:Birkhäuser巴塞尔;2008. p。189-212。
- 10。
Vranova E, Coman D, Gruissem W.网络分析MVA和MEP途径合成类异戊二烯。植物生物学杂志。2013;64:665-700。
- 11.
罗德里格斯-康塞普西ion M.类胡萝卜素生物合成拟南芥:一条多彩的小路。拟南芥书。2012;10:e0158。
- 12.
秦g,顾h,ma l,peng y,deng xw,chen z,qu l-j。植物去除酶基因的破坏导致白化病毒和矮化表型拟南芥通过损害叶绿素,类胡萝卜素和胃肠杆菌蛋白生物合成。细胞res。2007; 17(5):471-82。
- 13
董浩、邓Y、穆J、陆Q、王Y、徐Y、朱C、崇K、陆C、左J。这个拟南芥自发细胞死亡1基因,编码类胡萝卜素生物合成必需的ζ - 胡萝卜素去饱和酶,参与叶绿体发育,光保护和逆行信号传导。细胞res。2007; 17(5):458-70。
- 14
陈y,李福,沃特茨尔等。隔离和表征的Z-ISO编码植物中类胡萝卜素生物合成缺失成分的基因。植物杂志。2010;153(1):66。
- 15
坎宁安FX,甘特e,一个还是两个?番茄红素ɛ-环化酶对类胡萝卜素环数的测定。P美国自然科学协会。2001年,98(5):2905。
- 16
Pecker I, Gabbay R, Cunningham FX, Hirschberg J.克隆了番茄红素β-环化酶cDNA,并分析了其在果实成熟过程中的表达。植物生物学杂志。1996;30(4):807-19。
- 17
Kim J,Smith Jj,Tian L,Dellapenna D.类胡萝卜素羟基酶的进化和功能拟南芥.植物细胞生理。2009; 50(3):463-79。
- 18。
Rodríguez-VillalónA,Gas e,Rodríguez-concepciónm.植物植物合酶活性控制类胡萝卜素的生物合成,并在深色种植中供应它们的代谢前体拟南芥幼苗。植物j . 2009; 60(3): 424 - 35。
- 19。
Scolnik PA, Bartley GE。核苷酸序列拟南芥植物合酶的cDNA。植物理性。1994年; 104(4):1471-2。
- 20.
Welsch R, Wüst F, Bär C, Al-Babili S, Beyer P.第三个植物烯合酶致力于水稻非生物胁迫诱导脱落酸的形成,并定义了植物烯合酶基因的功能多样化。植物杂志。2008;147(1):367。
- 21.
李F,Vallabhaneni R,Yu J,Rocheford T,Wurtzel等。玉米植物植物合成酶基因家族:对胚乳,光学发生和热应力耐受性的雌激素的重叠作用。植物理性。2008; 147(3):1334。
- 22.
Bartley Ge,Viitanen PV,Bacot Ko,Scolnik Pa。在果实成熟过程中表达的番茄基因编码了类胡萝卜素生物合成途径的酶。J Biol Chem。1992年; 267(8):5036-9。
- 23。
Bartley Ge,Scolnik Pa。cDNA克隆,发展过程中的表达,以及基因组映射PSY2型,第二个番茄基因编码植物烯合酶。生物化学杂志。1993;268(34):25718-21。
- 24。
双子叶植物根中独脚金内酯的含量是由植物烯合成酶基因家族的一个古老共生调节分支决定的。植物科学与技术,2018;
- 25。
Li F, Vallabhaneni R, Wurtzel ET。心理战3是禾本科植物中一个新的植物烯合酶基因家族成员,也是非生物胁迫诱导根胡萝卜素发生的调控因子。植物生理学。2008;146(3):1333.
- 26。
Meier S,Tzfadia O,Vallabhaneni R,Gehring C,Wurtzel等。发育过程中类胡萝卜素、叶绿素和质体类异戊二烯生物合成基因的转录分析和渗透胁迫反应拟南芥.BMC system Biol. 2011;5(1):77。
- 27。
Nisar N,Li L,Lu S,Khin Nay C,Pogson BJ。植物中的类胡萝卜素代谢。莫尔植物。2015; 8(1):68-82。
- 28。
乙烯对色差杏类胡萝卜素积累及基因表达的调控山杏). J实验机器人。2005;56(417):1877–86.
- 29。
卡佐内利,波格森,北京。源到库:植物类胡萝卜素生物合成的调节。植物科学趋势。2010;15(5):266–74.
- 30.
托莱多·奥尔蒂斯G、胡克·E、罗德里格斯·康塞普西翁M。光敏色素相互作用因子对光敏素合成酶基因表达和类胡萝卜素合成的直接调控。美国自然科学院,2010;107(25):11626.
- 31.
Toledo-Ortiz G, Johansson H, Lee KP, Bou-Torrent J, Stewart K, Steel G, Rodríguez-Concepción M, Halliday KJ。HY5-PIF调控模块协调光和温度调控光合基因的转录。公共科学图书馆麝猫。2014;10 (6):e1004416。
- 32.
Shumskaya M,Bradbury LMT,Monaco RR,Wurtzel等。关键类胡萝卜素酶-植物烯合酶的质体定位受同工酶、等位基因变异和活性的影响。植物细胞。2012;24(9):3725.
- 33.
周晓,Welsch R,杨勇,Álvarez D, Riediger M,袁浩,Fish T,刘杰,Thannhauser TW,李磊。拟南芥或蛋白质是控制类胡萝卜素生物合成中的植物植物合酶的主要前症调节因子。P美国自然科学协会。2015; 112(11):3558。
- 34。
赵Q,王G,季J,金C,吴W,赵J。过度表达拟南芥β-胡萝卜素羟化酶(CHYB.)转基因烟草的抗旱性研究。植物生物化学杂志。2014;23(2):190–8.
- 35。
陈建平,李建平,李建平,等。烟草花中虾青素的代谢工程研究。植物营养与肥料学报。生物科技Nat》。2000;18(8):888 - 92。
- 36。
BUSCH M,SEURER A,Hain R.烟草类胡萝卜素生物合成早期的功能分析。植物理性。2002; 128(2):439。
- 37
关键词:烟草,基因组序列,番茄,马铃薯abstract:Nat Commun 2014:5。
- 38
Edwards Kd,Fernandez-Pozo N,Drake-Stowe K,Humphry M,Evans Ad,Bombarely A,Allen F,Hurst R,White B,Kernodle Sp,等。参考基因组烟草支持基于地图的克隆与氮利用效率有关的同源基因座。BMC基因组学。2017:18.
- 39
Bombarely A、Rosli HG、Vrebalov J、Moffett P、Mueller LA、Martin GB。基因序列草图烟草benthamiana增强分子植物微生物生物学研究。Mol植物微生物。2012; 25(12):1523-30。
- 40.
关键词:参比基因组,转录组,转录组引用本文烟草的抗旱性和烟草tomentosiformis. 基因组生物学。2013;14(6):R60。
- 41.
刘娥,页JE。烟草鼓状病毒诱导基因沉默(VIGS)的优化cDNA文库。工厂方法。2008;4(1):5。
- 42.
Benson AA, Bassham JA, Calvin M. Sedoheptulose在植物光合作用中的作用。J Am Chem Soc. 2001,21(6): 531 - 531。
- 43.
Grabherr MG,Haas BJ,Yassour M,Levin JZ,Thompson DA,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q,等。无参考基因组RNA序列数据的全长转录组组装。纳特生物技术公司。2011;29(7):644–52.
- 44.
Langmead B,Salzberg SL。与Bowtie 2. NAT Meth。2012; 9(4):357-9。
- 45.
Wagner GP,Kin K,Lynch VJ。使用RNA-SEQ数据测量mRNA丰度:RPKM测量在样品之间不一致。Biosci。2012; 131(4):281-5。
- 46.
RNA-Seq数据在基因水平上的差异表达- DESeq包。欧洲分子生物学实验室:海德堡;2012.可以在www.bioconductor.org/packages/devel/bioc/vignettes/DESeq/inst/doc/DESeq.pdf.
- 47。
Alexa A,Rahnenfuhrer J。topGO:基因本体的丰富分析。R包版本。2010.可在http://www.biocidodder.org/packages/2.11/bioc/html/topgo.html..
- 48。
Fraser Pd,Schuch W,Bramley PM。来自番茄的植物合酶(番茄)叶绿体部分纯化和生化特性。足底。2000;211(3):361 - 9。
- 49。
Fraser PD, Enfissi EMA, Halket JM, Truesdale MR, Yu D, Gerrish C, Bramley PM。番茄果实中植物烯水平的调控:对类异戊二烯、质体和中介代谢的影响。植物细胞。2007;19(10):3194 - 211。
- 50
阿尔瓦雷斯D、沃什B、马斯D、威斯特F、肖布P、贝尔P、韦尔施R。胡萝卜素的生成受植物烯合成酶剪接变异体5′UTR介导的翻译调控。植物生理学。2016;172(4):2314–26.
- 51
关键词:木薯,植物烯合成酶,非生物胁迫足底。2010;232(5):1251 - 62。
- 52
关键词:植物烯合酶,启动子,结构,功能拟南芥. 足底。2003;216(3):523–34.
- 53
罗伯逊FP, Koistinen PK, Gerrish C, Halket JM, Patel RKP, Fraser PD, Bramley PM。植物烯合成酶-1转化番茄株系的蛋白质组学意义和反义方向的变化。实验机器人。2012;63(16):6035-43。
- 54.
波特拉·帕维亚P、贝松贝斯Ó、菲利普斯·马、卡雷特罗·保莱特L、博罗纳特a、罗德里格斯·康塞普西翁M。植物类胡萝卜素生物合成的调控:羟甲基丁烯基二磷酸还原酶在控制质体类异戊二烯前体供应中关键作用的证据。植物J。2004;40(2):188–99.
- 55.
Finn RD,Clements J,Eddy SR.HMMER web服务器:交互式序列相似性搜索。核酸研究,2011年;39(补充2):第29–37页。
- 56.
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 28(10):2731-9。
- 57.
Saitou N,Nei M.邻居加入方法:一种重建系统发育树的新方法。mol Biol Evol。1987; 4(4):406-25。
- 58。
Liu Y,Schiff M,Marar,Dinesh Kumar SP.烟草公司Rar1型,EDS1和NPR1/NIM1标准像基因是必需的N-介导的对烟草花叶病毒的抗性。植物j . 2002; 30(4): 415 - 29。
- 59。
Senthil-Kumar M, Hema R, Anand A, Kang L, Udayakumar M, Mysore KS。一项确定基因沉默程度的系统研究烟草benthamiana以及其他茄科物种使用外源基因序列进行病毒诱导的基因沉默时。新植醇。2007;176(4):782 - 91。
- 60
Zagari N、Sandoval Ibañez O、Sandal N、Su J、Rodriguez Concepcion M、Stougaard J、Pribil M、Leister D、Pulido P。斯诺伊仙女鼬2促进叶绿体的发育,并在两种植物的叶斑中发挥作用莲藕和拟南芥.莫尔植物。2017; 10(5):721-34。
- 61
D'Amici GM,Huber Cg,Zolla L.通过蔗糖梯度超速离心或蓝色天然SDS-PAGE二维电泳分离囊体膜蛋白。在:peirce mj,等待r,编辑。膜蛋白质组学:方法和方案。TOTOWA:Humana媒体;2009.60-70。
- 62
赵y,赵c,lu x,周h,li y,周j,chang y,zhang j,金l,林f等。基于气相色谱/质谱法,使用假靶向法的不同种植区内烟叶的代谢谱与气候因子关系的研究。J蛋白质组。2013; 12(11):5072-83。
- 63
Bolger AM, Lohse M, Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。
致谢
不适用。
资金
本研究由河南省自然科学基金项目(182300410053/902018AS0010 ~ RW)、烟草基因组计划项目(902018AA0120.2/902019AA0140)、河南省重点科技攻关项目(202102110023)、111项目#D16014资助。资助机构在研究的设计、收集、分析和解释数据以及撰写手稿中没有扮演任何角色。
作者信息
从属关系
贡献
ZJ.W.,L.Z.完成了大部分实验和数据分析。C.D.,JG.G.创造了植物株系并进行了光合作用实验。LF.J.,P.W.,F.L.进行了植物栽培和色素含量分析。XQ.Z.,R.W.,设计项目。ZJ.W.,XQ.Z.,R.W.写了手稿。所有作者都已阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充资料
附加文件1:表S1
.Docx CIS-SCOUNTION元素在启动子区发现ntpsy.基因。
附加文件2:表S2
.docx引物序列用于qPCR分析。下划线字母表示手动添加的克隆站点适配器:Kpn一和XHO.I分别为正向和反向引物。
附加文件3:表S3
.xlsx在阴性对照和TRV-PSY1&2叶片中的相对代谢物水平。
附加文件4:表S4
.Docx概要Unigene注释。
附加文件5:表S5
.XLSX在TRV-PSY1和2和对照植物之间的差异表达基因
附加文件6:表S6
.xlsx trv - psy1和2与对照植株差异表达基因的基因本体富集
附加文件7:图S1
.tif qRT-PCR证实了trv - psy1和2和对照植物的类胡萝卜素生物合成基因。GGPPS,香叶二磷酸合酶。PDS,茄红素desaturase。ZDS,ζ-胡萝卜素desaturase。CRTISO,类胡萝卜素异构酶。B-LCY,番茄红素β环化酶。nx neoxanthin合成酶。列和栏代表手段和标准错误(N= 3),分别。*表示P< 0.05。
附加文件8:表S7
.xlsx trv - psy1和2与对照植株之间差异表达的转录因子
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
王,Z.,张,L.,Dong,C。等。烟草植物烯合成酶基因家族的特征及功能分析。BMC植物生物学21,32 (2021). https://doi.org/10.1186/s12870-020-02816-3
收到了:
认可的:
发表:
关键词
- 类胡萝卜素
- 八氢番茄红素合酶
- 烟草