抽象的
背景
Simmondsia对(Jojoba)是唯一已知储存蜡酯而不是在其种子中储存蜡酯的植物。蜡酯由非常长链的单不饱和脂肪酸和脂肪醇组成,占JOJOBA种子重量的60%。在Jojoba发芽期间,蜡酯动员的第一步是脂肪酶催化。迄今为止,已经克隆并表征了jojoba脂肪酶编码基因。在这项研究中,我们在Jojoba种子的发芽期间监测储量储备的动员,并使用从发芽种子中分离的微粒体级分来进行Jojoba脂肪酶的详细表征。
结果
在26天的萌发期间,我们观察到种子中的蜡酯含量的减少60-70%,伴随着减少油蛋白量和葡萄糖含量的增加。在萌发的前50天中,种子微粒体级分中的Jojoba脂肪酶的活性增加。酶向三酰基甘油表达较高的活性,而不是朝向蜡酯。在60℃和60℃下观察到最大脂肪酶活性,对于蜡酯的三酰基甘油的pH约7.5-8。酶有效地水解含有饱和和不饱和酰基和醇部分的各种蜡酯。我们还证明Jojoba脂肪酶当游离脂肪醇和不同的酰基供体,包括三酰基甘油和游离脂肪酸的不同酰基供体,用作蜡酯合成活性。对于酯化反应,酶使用饱和和不饱和脂肪醇,偏好朝向长链和非常长的链化合物。
结论
在体外测定中,Jojoba脂肪酶在广泛的温度范围内催化三酰基甘油和不同蜡酯的水解。此外,酶的能力能够在后向反应中合成蜡酯。我们的数据表明Jojoba脂肪酶可能与其他植物脂肪酶更相似,而不是先前假设。
背景
jojoba(Simmondsia对链接,Buxaceae)是一种常年灌木,在北美西南沙漠中自然生长。它是唯一已知的植物物种,将种子中的蜡酯作为储量储存而不是三酰基甘油。蜡酯的占种子重量的60%,由非常长链的单一饱和脂肪酸和醇组成,例如己二酸(20:1),二羟酸(22:1),eicosenol(20:1-OH))和Docosenol(22:1-OH)[1那2].除了脂质外,荷荷巴籽还包括蛋白质(占鲜重的15%)、碳水化合物和淀粉(10%)、水(5-10%)和种皮(5-10%)[3.那4.].蜡酯储存在脂质液滴(经常称为蜡体)中,直径为1至1.5μm的球形储存细胞器,其在子叶中定位[5.那6.那7.那8.].蜡体的主要表面蛋白包括油溶胶,亚圆糖苷,杀毒素和脂质液滴相关蛋白(LDAPS)[8.].Jojoba Wax酯是在化妆品和制药行业中具有许多重要商业应用的有价值的化合物,并且难以化学合成。S. Chinensis.目前在许多国家的石油培养,包括美国,墨西哥,智利,阿根廷,印度,澳大利亚和埃及[9.].由于霍霍巴栽培难度较大且产量较低,近年来,在细菌中建立了类似霍霍巴蜡酯的合成方法[10.],酵母[11.那12.]和油籽植物,如Camelina Sativa和Crambe Abyssinica[13.那14.那15.那16.].然而,其种子中具有大量蜡酯的转基因植物具有降低的种子萌发频率和干扰早期幼苗生长[14.那16.那17.].有人认为,蜡酯降解受损可能是高蜡酯积累植物种子生存能力的瓶颈[18.].
在油籽植物中,储存脂质的动员很好地理解。在种子脂质液滴中积聚的三酰基甘油(标签)通过标签脂肪酶(EC 3.1.1.3)在萌发期间水解,其切割脂肪酸和甘油骨架之间的酯键[19.].甘油转化为二羟基丙酮磷酸(DHAP),进入糖异生作用。游离脂肪酸被运送到过氧化物酶体,通过β氧化分解为乙酰辅酶a。乙酰辅酶a被乙醛酸循环进一步代谢为四碳有机酸,在糖异生过程中可用于生产糖[20.那21].TAG脂肪酶已经在许多植物物种中被鉴定出来,包括油料作物,如芸苔栗鸟或麻风树图.迄今为止表征的酶表现出不同的性质,这取决于植物物种。例如,最佳pH从4-11和25℃的温度范围为4至11至80℃。此外,脂肪酶能够催化水解和合成反应[22]. 植物脂肪酶具有生物化学性质,来源广泛,生产成本低,被认为是工业应用的潜在候选酶,特别是在食品、医药和生物燃料工业中[22那23].
与TAG水解相比,萌发荷荷巴种子中的蜡酯动员需要三种独特的酶的活性,这些酶与蜡体的膜有关。首先,蜡酯被荷荷巴脂肪酶(蜡酯水解酶,WEH, EC 3.1.1.50)水解成脂肪酸和脂肪醇。然后,脂肪醇通过氧化途径转化为脂肪酸,氧化途径包括两种酶:脂肪醇氧化酶(FAO)和脂肪醛脱氢酶(FADH) [24].新生脂肪酸进入β-氧化,并通过类似于三酰基甘油储存植物物种的代谢途径进一步代谢至蔗糖[4.那6.].
迄今为止,只有荷荷巴、粮农组织和FADH被分离和鉴定。这两种酶的生化特性,包括对极长链脂肪醇和脂肪醛的活性,以及它们的基因在荷荷巴种子萌发中的高表达证实了FAO和FADH参与了荷荷巴脂肪醇氧化途径[24].关于荷荷巴脂肪酶的可能分子标识的知识仍然稀缺。在最近发表的Jojoba基因组中,报告了推定脂肪酶的100多种基因[8.].需要进一步的研究来阐明新鉴定的酶的功能。
有关荷荷巴脂肪酶生化特性的有效数据是由Huang和Moreau于20世纪70年代末获得的。在20日龄的霍霍巴幼苗中检测到该酶的活性,该酶与蜡体膜有关[4.].结果表明,蜡酯水解酶活性在萌发前15天显著升高。该酶在pH为8.5 ~ 9.0时活性最佳,能有效水解单酰甘油和蜡酯,而对二酰甘油和三酰甘油的活性较低[25].
本研究的目的是深入了解发芽Jojoba种子中Jojoba脂肪酶活性的特征,并对其底物特异性进行更详细的分析。在这里,我们还报告了Jojoba脂肪酶的蜡酯合成活性。
结果
在发芽期间动员Jojoba种子储备
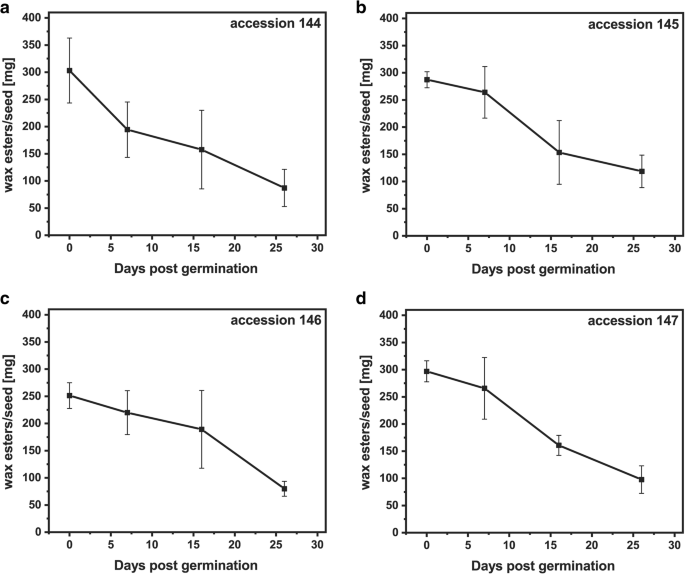
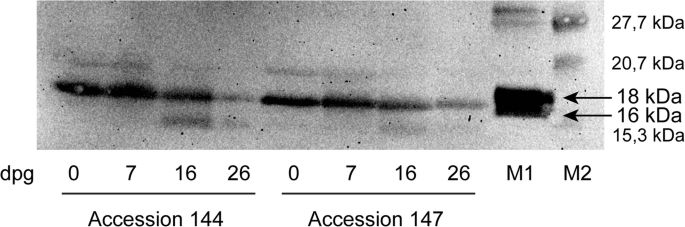
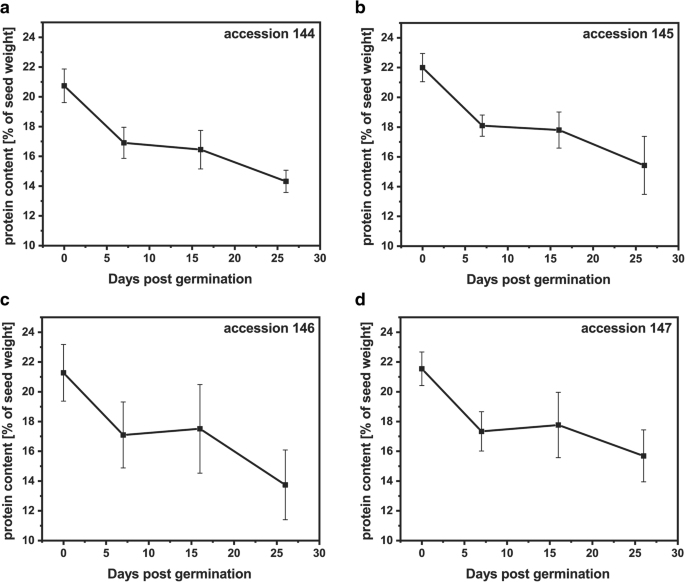
来自四种不同材料的荷荷巴种子发芽26天(附加文件1:图S1),采用气相色谱- fid分析监测蜡酯含量的变化。在4份材料中,蜡酯含量在发芽期的前26天下降了60-70%。1).种子萌发后第1周,种子萌发率显著下降144 (36%;无花果。1a),以及7-16天的发芽后萌发(DPG),用于换档145和147(约40%;图。1对于添加146,蜡酯含量的最大降幅(58%)发生在16 ~ 26 dpg之间(图1)。1C)。蜡酯的动员伴随着发芽期间葡萄糖和淀粉含量的增加(附加档案1:图。S2)和蛋白质提取物中的油蛋白酶量减少来自发芽jojoba种子,如图144和147中的代表性免疫印迹所示。2.最初的蛋白质含量约为种子重量的21%,并且在所有摘录中发芽的前26天降至约15%。降解主要发生在发芽的第一周内(图。3.).
荷荷巴种子萌发过程中总蛋白提取物中油苷含量的免疫印迹分析。M1:玉米油苷,M2:蛋白质标记物。右边的数字表示分子质量标记的位置。箭头表示玉米油苷的两种异构体。对品种145和146也观察到类似的变化。完整长度的印迹显示在附加文件中1:图。S6
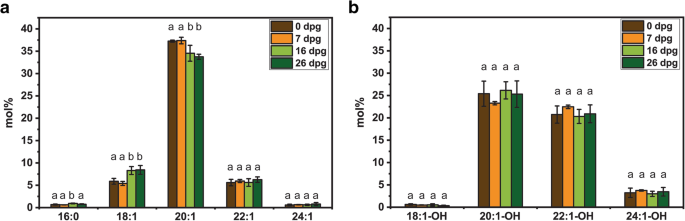
对4种荷荷巴种子的脂类分析表明,蜡酯类为主要脂类(95 ~ 98%)。极性脂类、标签、游离脂肪酸和游离醇分别约占1-2%、0.4-1%、0.3-1%和0.2-1%。在所有供试材料的成熟种子中,主要的脂肪酸为:20:1(约占总脂肪酸和脂肪酸醇的36%)、18:1(约7%)、22:1(约6%)、16:0(约0.8%)、24:1(约0.5%),而最丰富的脂肪酸为:20:1-OH(约占总脂肪酸和脂肪醇量的25%),22:1-OH(约21%),24:1-OH(约3%),18:1-OH(0.7%)(附加文件2:表S1)。脂肪酸和脂肪醇相对含量在26天的发芽期间的变化模式类似于所有摘要。加入145的代表性一组结果如图1所示。4..在所有辅助过程中,在发芽期间观察到20:1的显着降低和增加18:1的含量。
发芽jojoba种子微粒体级分的脂肪酶活性
由于尚未成功地克隆编码Jojoba脂肪酶的基因,因此我们在萌发的不同阶段使用从jojoba种子中分离的微粒体膜馏分来测试膜相关脂肪酶的活性。在我们的初步分析中,我们在使用[14.C]蜡酯([14.C] 韦斯)和[14.C]([的甘油三酯14.C]标签为基板。在发芽的早期阶段,脂肪酶活性朝向两者14.c] 18:1标签和[14.C] 20:1–18:1我们非常低,在发芽期间显著增加(附加文件)2:表S2)。我们还观察到在7-26DPG(附加文件)期间微粒体膜馏分中的油蛋白含量增加(附加文件1:图。S3)。为了进一步研究,使用具有高脂肪酶活性的微粒体级分。
霍霍巴脂肪酶的生化特性
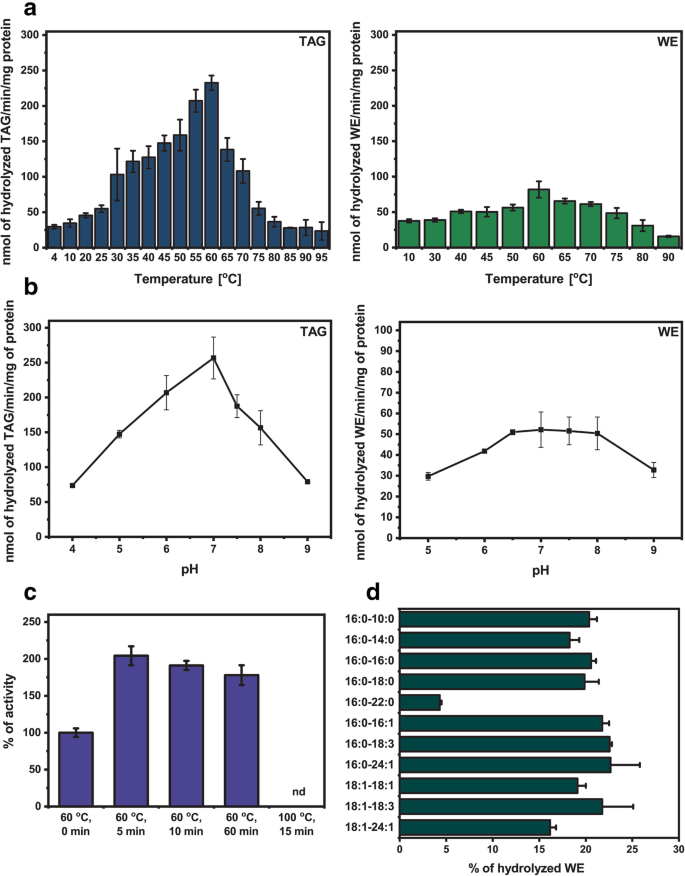
由于Jojoba脂肪酶显示朝向标签和WES的活性,因此我们使用了酶的生物化学表征的底物。朝向18:1标签的活性大约高于朝向18:1-18:1的三倍(图。5.a).微粒体组分中存在的霍霍巴脂肪酶被证明对物理和化学条件具有抗性。当温度从4°C升高到60°C时,脂肪酶活性逐渐增加到18:1-TAG。进一步升高至95°C,酶活性降低了70%。5.一种)。在18:1-18:1的情况下,10℃的脂肪酶活性已经几乎为其最大水平的50%,在60℃下观察到的(图。5.a).此外,微粒体在60°C预孵育至1小时后再进行酶学分析,可提高脂肪酶活性(图)。5.C)。
Jojoba种子脂肪酶活性的生物化学特征
.一种.温度对霍霍巴种子脂肪酶活性的影响分别为:18:1-TAG(左图)和18:1-18:1 WE(右图)。数据表示平均值,错误条表示重复的范围。测定条件:从每一种荷荷巴种子中分离到的微粒体组分混合物的等分(2.5 nmol的内源PC) (35 dpg);20 nmol [14.C] 18:1标签或[14.C] 18:1-18:1 WE加入19 μl苯的冻干微粒体中;苯蒸发,并加入100 μl 0.1 HEPES缓冲液(pH 7.0);孵育2.5分钟(TAG)或1.5分钟(WE)。B..pH对jojoba种子脂肪酶活性的影响朝向18:1标签(左面板)和18:1-18:1我们(右图)。数据表示平均值,错误条表示重复的范围。测定条件:如上用0.1M柠檬酸盐缓冲液(pH4.0-5.0),磷酸盐缓冲液(pH6.0-8.0),或Tris-HCl缓冲液(9.0),在35℃下孵育5分钟。c.预孵育条件对Jojoba种子脂肪酶活性朝向18:1标签的影响。数据代表平均值,错误栏显示重复的范围;nd - 未检测到。测定条件:如上所述,在60℃下孵育5分钟。d.Jojoba种子脂肪酶对饱和和不饱和WES的底物特异性。数据表示平均值,错误条表示重复的范围。测定条件:如上所述,[4.5 nmol [14.C] WE, 60°C孵育10分钟。
对18:1-TAG的最适脂肪酶活性在pH值为6到7时观察到,当pH值低于6或高于7时,其活性降低了2到3倍(图。5.b)。对于WES,在6.5和8之间观察到最高活性(图。5.b).根据得到的结果,我们使用pH 7.0和60°C进行进一步研究,因为在这些条件下脂肪酶最活跃。此外,还测试了两种不同的反应缓冲液。由于在HEPES缓冲液中脂肪酶的活性较高,它被用来研究底物的特异性(附加文件1:图。S4)。添加阳离子,如mg2+和加利福尼亚州2+,刺激脂肪酶活性(增加大约2倍)(附加文件1:图。S5)。
为了研究Jojoba脂肪酶的底物特异性,我们使用含有饱和和不饱和酰基和醇部分的不同蜡酯。我们观察到含有饱和(16:0-Fa)或单不饱和(18:1-Fa)脂肪酸的蜡酯的底物特异性没有显着差异。除了长链饱和蜡酯(16:0-22:0)外,所有其他蜡酯化合物都有效地水解,无明显差异(图。5.d)。
Jojoba脂肪酶的蜡酯合成活性
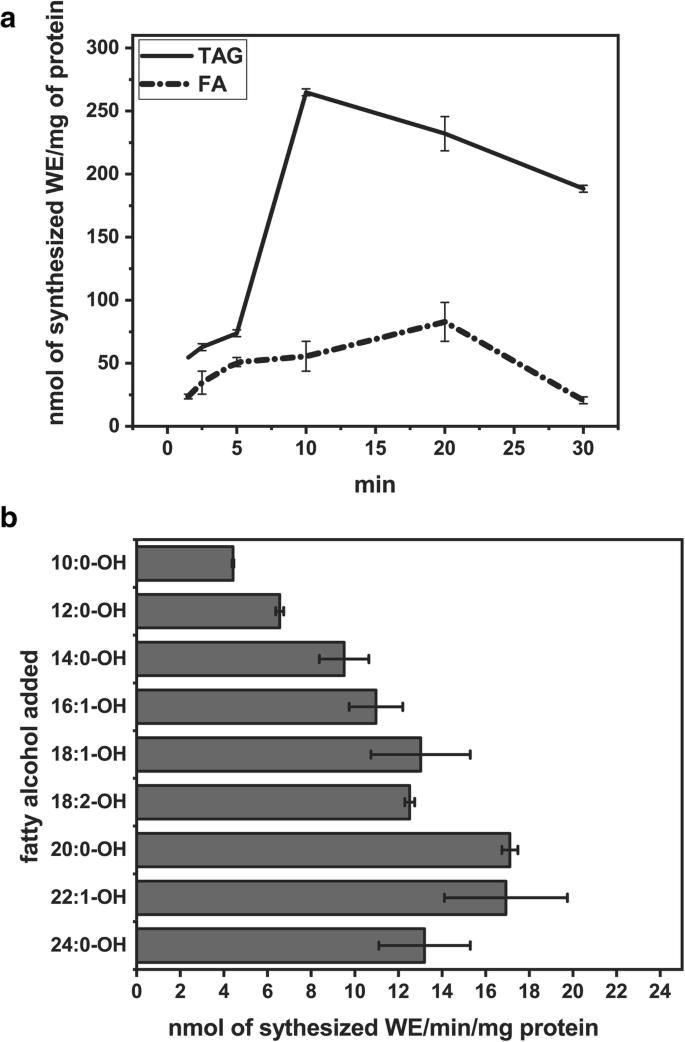
除了能够水解WEs和TAGs外,所利用的微粒体组分中的脂肪酶还显示了来自不同酰基供体和游离脂肪醇的蜡酯合成活性。由tag、二酰基甘油(DAGs)和游离脂肪酸高效地合成了WEs,而由脂肪酸酰基辅酶as和磷脂合成的WE没有检测到(表)1, 图。6.一种)。当仅将游离醇加入到反应混合物中时,也观察到我们合成,表明酶使用内源性酰基供体(表1).当用丙酮从微粒体组分中去除中性脂质时,需要添加TAG来获得WEs合成。与18:1-FA与18:1-OH组合合成的蜡酯量相比,18:1-TAG与18:1-OH组合合成的蜡酯量大约高出3倍(图4)。6.一种)。WES的合成对于长脂肪醇最有效,没有歧视饱和或不饱和脂肪醇与[14.C] 18:1-FA。长链和极长链脂肪醇的活性最高。6.b).当脂肪酶抑制剂(四氢lipstatin)存在时,我们没有观察到蜡酯合成从添加[14.C] 18:1-FA和脂肪醇。四氢锡汀还有效地抑制脂肪酶活性测定中蜡酯的水解和标签。当将DTNB(将COA和ACPS结合)加入到测定中时,蜡酯合成的DE NOVO的量不低于对照,表明添加了[14.C]18:1-FA在用于WE合成前未被激活为酰基辅酶a或酰基acp(表2).
霍霍巴籽脂肪酶we合成活性的研究。一种.我们从18:1标签合成的时间过程和18:1-FA与18:1-OH结合。数据表示平均值,错误条表示重复的范围。测定条件:微粒体馏分混合物的等分试样(2.5nmol内源性PC)(从每次加入的两个单独的Jojoba种子中分离,35 dpg);基材(20nmol [14.C] 18:1-FA或[14.C]18:1-TAG和20 nmol脂肪醇)在19 μl苯中加入冻干微粒体;苯蒸发后,加入100 μl 0.1 M HEPES缓冲液(pH 7.0);在60°C孵育。B..我们合成18:1-FA和不同的脂肪醇。数据表示平均值,错误条表示重复的范围。测定条件:如上所述,在60°C下孵育20分钟
讨论
荷荷巴是一种独特的植物,它积累蜡酯作为贮藏脂类,在萌发过程中代谢为碳水化合物[6.].在所有四个测试的Jojoba释放中,我们观察到蜡酯含量的60-70%下降,在所有四个测试的jojoba加入中,符合上一个报告[4.那26].蜡酯水解的轮廓在不同的jojoba accepcations中变化,但通常在7dpg后发生蜡酯含量的最高降低。萌发期间的二亚辛酸(20:1)的相对含量表明,与含有18:1或22:1的蜡酯相比,含有该脂肪酸的蜡酯可以以较高的速率传播为酰基部分。含有20:1的蜡酯种是jojoba种子中的主要存在[1].因此,Jojoba种子脂肪酶似乎对最丰富的蜡酯具有最高的特异性。萌发过程中葡萄糖的含量增加表明,水解的蜡酯用作葡糖生成的底物,因为它由莫鲁和黄[4.].过量的葡萄糖可以暂时以淀粉的形式储存。我们的数据证实了先前的观察结果,即霍霍巴种子中的储存脂类动员模式与报道的积累tag的油籽作物相似[4.那6.].对于种子蛋白,在发芽的第一周观察到最高的动员率,这与其他植物类似。在不同植物物种中吸收后的最初几天,观察到不同蛋白酶的高活性[27那28].
在我们的实验中,发芽期间的蜡酯量减少伴随着种子中的油蛋白含量的降低,其主要发生在7dpg之后。在几种植物物种中观察到疏油蛋白的这种逐渐降解,包括油菜籽[29],向日葵[30.]和芝麻[31].这个过程中可能涉及向日葵硫醇蛋白酶[32].在拟南芥,油溶质的蛋白水解在脂质降解之前,在进入降解途径之前,尿素中的四种含量尿液中染下了四种疏油蛋白酶[33].需要进一步的研究来阐明Jojoba中脂液滴蛋白质降解的机制。我们的研究结果还表明,Jojoba种子中存在至少两种具有分子量为17和19.5kDa的油糖苷。因此,如在其他高血管植物种类中,jojoba油糖苷属于油蛋白素类,高(h)和低(l)分子量油脂[34].发育霍霍瓦种子的转录组分析表明,在六个jojoba油蛋白基因中,在发育过程中在子叶中高度表达。这些基因编码的蛋白质在脂质液滴馏分中具有高相对丰度[8.],这表明它们可能参与jojoba蜡体的形成。
蜡酯动员的第一步是通过脂肪酶催化,其将蜡酯与脂肪酸和脂肪醇水解。Jojoba脂肪酶的活性首先以荷荷巴氏蛋白分离的蜡体为特征在于蜡体[4.那25].然而,在我们的实验中,从萌发的不同阶段的Jojoba种子中分离的酶分离的酶表现出非常低的活性。相反,我们观察到在发芽的前50天期间观察到微粒体级分中的脂肪酶活性。这与莫鲁和黄[4.[谁报道,在蜡体中检测到20天历史的Jojoba幼苗中40%的脂肪酶活性,在膜馏分中40%,可溶性级分中20%。膜级分中的脂肪酶的活性归因于蜡体的膜鬼,由这些细胞器的残余物引起,在蜡酯动员或其在亚细胞分级期间的破坏[4.].我们从荷荷巴种子萌发不同阶段的微粒体制剂中发现的油红蛋白含量的增加证实了该组分中蜡体膜的存在。
在本研究中,微粒体部分荷荷巴脂肪酶的生化特性与Huang等报道的不同[25].酶在宽范围的温度下显示出大量的水解酶活性,而在先前的研究中,脂肪酶在60℃下孵育5分钟孵育。相反,我们的实验表明,这种孵育导致更高的酶活性,这可能是酶微环境的变化的结果。我们还证明,在微粒体馏分中存在的Jojoba脂肪酶不是碱性酶,因为它们在pH 6和7中检测到它们的最高活性,用于标签,pH值为6.5至8的WES。这些差异可能来自两种研究中使用的不同反应缓冲液和基材。黄等人。[25]利用人造基质,N-甲基吲哚氧基酯,用于JOJOBA脂肪酶的生化表征,而在我们的实验中,使用18:1-标签和18:1-18:1。此外,在这里,我们向标记的jojoba脂肪酶报告高活性,其在Huang等人进行的实验中以低效率水解。[25].这种活动可能是由于在荷荷巴祖先的种子中可能存在标签,但现在,标签大多定位于荷荷巴种子的胚胎轴[8.那35].在我们的研究中,我们还扩展了Huang等人使用的底物的光谱。25].Jojoba脂肪酶有效地水解几乎所有测试的WE,含有16:0或18:1和不同链长的饱和和不饱和脂肪醇。
与目前已鉴定的植物标记脂肪酶相比,荷荷巴脂肪酶具有相似的特性。大部分来自不同植物种子的脂肪酶在pH值7-8时活性最高[36),对霍霍巴脂肪酶的TAG-和we -水解活性也进行了观察。霍霍巴脂肪酶的最适温度(60°C)高于油籽植物的脂肪酶芸苔栗鸟和麻风树图,显示在37°C的最高活动[37那38].然而,在几种植物物种中发现了具有高于50℃的最佳温度的脂肪酶,包括扁桃[39),向日葵[40].此外,加利福尼亚州2+和米格2+提高Jojoba酶的活性,因为据报道了大量其他脂肪酶[36]. 当这些离子加入到反应混合物中时,脂肪酶的活性增加了两倍。其他油料脂肪酶也观察到类似的效果,如显著脂肪酶(加入64%2+)[38),麻风树图脂肪酶(增加130%的CA2+镁的30%2+)[37].
尽管对脂肪酶的研究很多,但关于这些酶的蜡酯水解活性的资料很少。本文报道了大鼠、猪和猪的脂肪酶在体外水解蜡酯的能力荧光假单胞菌[41].蜡酯水解酶的活性也被检测在白色芥末(Sinapis Alba.l .) [42].然而,尚未鉴定具有此类活性的酶或酶或本物种中的分离。来自标签累积植物的脂肪酶通常没有测试蜡酯 - 水解活性[36].检查用于蜡酯生产的植物种子脂肪酶是否是有价值的,例如C阿比西尼亚或c .漂白亚麻纤维卷,有能力水解蜡酯。
在从发芽的Jojoba种子中分离的微粒体馏分中,我们还检测到蜡酯合成活性,当四氢辛肽,脂肪酶抑制剂加入混合物中时被抑制。这表明观察到的DE Novo合成由jojoba种子脂肪酶在向后反应中进行(酶在正向和反应中通过四氢锡丁蛋白封闭)。在我们的酶促测定中,Jojoba脂肪酶优选在游离脂肪酸上作为酰基供体的三酰基甘油。该酶有效地合成来自游离油酸(18:1)和不同脂肪醇的蜡酯,这表明相当宽的特异性。结果表明,脂肪酶可以在低浓度的醇的基材乳液表面上催化蜡酯形成。根据Tsujita等人提出的机制,用三酰基甘油或脂肪酸孵育脂肪酶,导致酰基酶中间体的形成。由于脂肪酰胺比水更有效的酰基受体,因此中间体的脱酰酯合成代替水解[41].我们的体外分析可能由于微粒体分数的存在而模拟了这些条件。然而,没有实验证据表明,脂肪酶催化的蜡酯合成存在于霍霍巴。
据报道蜡酯合成活性来自不同生物的脂肪酶,包括大鼠,猪,荧光假单胞菌[41),而念珠菌sp。99-125 [43].市售脂肪酶,例如Novozym 435(固定化脂肪酶B.念珠菌南极洲)和脂肪脂酶IM(固定化脂肪酶根瘤菌宫河),也能有效催化长链脂肪酸与脂肪醇的酯化反应[44那45].经分离和进一步鉴定,荷荷巴脂肪酶具有高稳定性和利用长链和极长链醇的能力,可用于蜡酯的工业合成。
在jojoba基因组中鉴定的脂肪酶的超过100个基因中,与其他组合的jojoba种子中的表达水平具有更高的表达水平(附加文件2:表S3)[8.].研究拟南芥蒂利亚纳表明,编码SDP1的基因,主要标签脂肪酶,主要在种子成熟期间表达[46].因此,这10个基因是参与霍霍巴储存脂质降解的脂肪酶的有希望的候选基因。此外,由于蜡酯主要局限于荷荷巴子叶[8.[该组织中表达更高的基因可以编码催化蜡酯水解的酶。
结论
我们的生化数据表明,霍霍巴脂肪酶可能不像以前怀疑的那样独特。该酶具有TAG-和we -水解活性,并具有合成蜡酯的能力。因此,荷荷巴脂肪酶与其他油料植物脂肪酶具有共同的特性。为了验证这一假说,有必要对霍霍巴脂肪酶进行鉴定、克隆和鉴定。霍霍巴脂肪酶能够高效地水解标签,这也意味着其他种子植物脂肪酶具有水解蜡酯的活性。油料作物中这种活性的筛选可用于选择种子中蜡酯生产的品种。
方法
试剂
除非另有说明,尚未说,本研究中使用的化学物质购自Sigma-Aldrich(Sigms-Aldrich(圣路易斯,Mo,USA),默克(Darmstadt,德国)或Larodan精细化学品(Malmö,瑞典)。从Avanti极性脂质(Alabaster,Al,USA)获得未标记的酰基-COA。三[14.C] 18:1-TAG购自PerkinElmer(Waltham,MA,USA)。这 [14.C]根据Sánchez等人的修饰方法合成酰基-COA。[47使用[]14.C .从Biotrend(科隆,德国)购买的脂肪酸。用于底物特异性研究的放射性标记蜡酯是用从酿酒酵母用pvt-ura矢量携带转换Marinobacter碳氢化合物Coclasticus蜡合酶(MHWS2)基因[48].简而言之,将合适的脂肪醇(100 nmol/assay)溶于苯中,然后加入冻干酵母微粒体馏分(从上述酵母菌转化子中分离出来)。干燥后,0.1 ml磷酸盐缓冲液(pH 6.7)含有20 nmol的适当[14.C]加入酰基辅酶和0.2mg牛血清白蛋白(BSA)。在50℃下进行反应1小时。用硅胶60平板(Merck,New York,USA)的薄层色谱(TLC)分离提取的脂质,使用己烷/二乙醚/乙酸(70/30/1,v / v)作为溶剂系统.刮掉含蜡酯的硅胶,并根据Bligh和Dyer提取蜡酯[49].[浓度]14.C] 使用液体闪烁计数器(Beckman Coulter,Fullerton,CA,USA)测定氯仿部分中的WEs。
种子材料及生长条件
来自亚利桑那州的四个jojoba的种子(Parl 144,Parl 145,Parl 147)是从janet caolo-tanski和John M. deer博士和美国农业部(USDA)获得的。从由国家干旱地区植物遗传资源单位(NALPGRU; PARLIER,USA)管理的网站上生长的植物中收集种子。称重600-700mg(加入145,146和147)或900-1100mg(加入144)的种子用于研究蜡酯动员和微粒体级分的分离。在每次加入中测定种子的平均重量后建立试验重量。这种选择允许获得足够量的种子油进行分析。将种子分成单独的烧杯并储存在干燥和黑暗的地方。Jojoba种子在生长室中的蛭石中萌发,在28℃下,具有16-H光周期,并在发芽后的0,7,16和26天收集,用于储存材料分析(附加文件1:图。S1),在0,13,35和50dPG,用于微粒体分离隔离。这些时间点是根据jojoba发芽的观察和可用文献数据的观察选择[4.那26].对于0 dpg,使用成熟的干种子。下一个阶段(7 dpg)的特征是种皮裂开,1 ~ 2cm的胚根出现。在16 dpg时,第一对叶片开始在上胚轴(下胚轴萌发)上发育,胚根达到数厘米长。最后一个阶段(26 dpg)包括多叶植物和发育中的根系。26 dpg后,植株仍继续生长,但种子残体仅用于微粒体制备。在所有的分析中,都使用没有种盖的残留种子材料。
脂质隔离和分析
使用修饰的枯萎和染料方法进行从萌发的每个阶段(每次加入的至少4种种子)的单个种子中的脂质提取[49].用手术刀将种子切成小块,加入11.25 ml氯仿:甲醇(1/2;v/v)使用T 25数字ULTRA-TURRAX (IKA-Werke GmbH & Co. KG, Staufen im Breisgau, Germany)。加入0.15 M醋酸3.75 ml,氯仿3.75 ml,蒸馏H 3.75 ml2O,脂质被提取为氯仿。提取的脂质经甲基化和衍生化后直接用气相色谱法分析,或在正己烷/乙醚/乙酸(70/30/1,v/v/v)中先在薄层色谱板上分离。各等份总脂提取液蒸发至干燥,加入2 ml 0.1 M NaOH于干甲醇中,在90°C下孵育1 h。然后用正己烷萃取脂肪酸甲酯和游离脂肪酸醇。将正己烷馏分蒸发至干燥,在每个样品中加入衍生化剂BSTFA (N, o -双(三甲基硅基)三氟乙酰胺0.15 ml。在70°C孵化期15 min后,用正己烷提取脂肪酸甲酯和衍生脂肪醇,并在岛渚GC-2010上进行分析,该GC-2010配有火焰离子化检测器(FID)和60 m × 0.25 mm CP-WAX 58 CB熔融硅胶柱(Agilent Technologies, Santa Clara, CA, USA)。采用十七酸甲酯作为内标。薄层色谱分离的脂质通过短暂暴露于碘蒸汽可见。含有分析脂类的硅胶部分从盘子上刮下来,用少量甲醇湿润,用氮气流干燥。WEs和游离醇进行了如上所述的甲基化和衍生化。 The other lipid classes (not containing long chain alcohols) were methylated at 90 °C for 1 h in 2% (v/v) sulphuric acid in dry methanol, extracted with hexane and analyzed using GC-FID, as described above.
蛋白质分离,SDS-PAGE和免疫印迹
通过在每个萌发的每个阶段(每次加入的四种种子)均质化在冷室中制备蛋白质提取物。使用T 25数字Ultra-Turrax(IKA-WERKE GmbH(IKA-WERKE GmbH),用手术刀切碎,均匀三次均化1分钟1分钟,以在20mL萃取缓冲液(0.1M Tris-HCl,1%SDS,1mM DTT,pH 6.8)中(IKA-WERKE GmbH&Co.KG)。在每次均匀化之后,将样品在4℃下以3000g以3000g离心10分钟,以消除泡沫。在以3000g以3000g离心10分钟后,将1.5ml上清液等分试样转移到新的微量离心管中并保持在-21℃直至使用。根据制造商的说明,使用Pierce TM BCA蛋白质测定套件(Thermo Fisher Scientific,Waltham,Ma,Ma,Ma)测量蛋白质浓度。使用Nupage Mops SDS运行缓冲液(Thermo Fisher Scientific),通过电泳通过电泳分离蛋白质提取物(60-80μg)通过电泳分离4-12%(w / v)挤压凝胶。接下来,将蛋白质转移到Nupage转移缓冲液(Thermo Fisher Scientific)中的硝酸纤维素膜中,并使用BM化学发光Western印迹试剂盒(鼠标/兔)(罗氏诊断GmbH,Mannheim,Germany)和Chemidoc XRS +系统(Biorad,Hercules,CA,USA), according to the manufacturer’s instructions. The primary rabbit antibody recognizing oat oleosins [50[稀释]用1:10,000使用。
碳水化合物的分离和分析
将来自萌发的不同阶段的四个均种子147中浸渍在液氮中,在80℃下干燥24小时,用砂浆和杵形成细粉末。在每种种子的50mg粉末中测定葡萄糖和淀粉的含量。首先通过在85℃下孵育10分钟,将粉末用5ml 80%乙醇用5ml 80%乙醇提取三次。在每次提取后,将样品以3000g离心10分钟,并使用Megazyme葡萄糖测定试剂(葡萄糖氧化酶/过氧化物酶; Gopod)使用组合上清液,如D-葡萄糖测定试剂盒(Gopod格式)手册所述(Megazyme,Bray,County Wicklow,爱尔兰)。根据制造商的使用总淀粉试剂盒(MEGazyme),根据McTcleary等人的方法,在残留颗粒中测量淀粉的含量。[51].
微粒体膜制剂和酶测定
用于脂肪酶活性的初步评估的微粒体级分由来自每个级分的四个个体种子制备。对于脂肪酶的生化表征,微粒体级分由发芽的jojoba种子(35dpg)混合在一起(来自每次加入的两种种子)。所有步骤都在冷藏室进行。将种子或子叶切成小块,在冰冷的0.1M磷酸钾缓冲液,pH7.2中,含有0.33μm蔗糖,1000u / ml过氧化氢酶和1mg / ml BSA的玻璃均化器中的小块和研磨。如stymne和stobart中所述进行后续步骤[52].
脂肪酶活性在与三 - [14.C]18 - 1- tag或放射性标记的WEs (20 nmol of [14.c]标签或[14.如果在表格或数字下没有不同地指定,则使用我们使用。标签或WES溶解在19μl苯中并加入到冷冻干燥的微粒体(对应于11μg微粒体蛋白)中。立即蒸发溶剂后,加入缓冲液(0.1M磷酸盐缓冲液或0.1M HEPES)。将测定(最终体积100μl)在给定温度下振动(1250rpm)温育适当的时间。孵育结束时,根据Bligh和染料将脂质从反应混合物中萃取到氯仿中[49]并在己烷/二乙醚/乙酸的TLC板上分离(70/30/1; v / v / v)。使用电子放射造影(即时成像器,Packard仪器)直接在TLC板上可视化和量化脂肪酶活性的分离产品。
测定霍霍巴脂肪酶蜡酯合成活性的方法如上所述,使用不同的酰基供体和脂肪醇作为底物。在反应混合物中加入20 μmol奥利司他四氢lipstatin(奥利司他)和0.7 nmol DTNB(5,5-二硫代双-(2-硝基苯甲酸)),考察其对脂肪酶活性的影响。
统计分析
对于统计分析,使用来自Statsoft的统计数据13软件。使用单向差异分析比较萌发过程中Jojoba加入过程中脂肪酸和脂肪醇的含量,其次是HOC Tukey的测试。学生的T检验用于比较来自不同底物的发芽Jojoba种子的微粒体组分的蜡酯合成的疗效。对于两种分析,p小于0.01或0.05的值被认为是显著的。
可用性数据和材料
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- F A:
-
脂肪酸
- FA-OH:
-
脂肪醇
- DPG:
-
发芽后的日子
- 标签:
-
甘油三酯
- 我们:
-
蜡酯
工具书类
- 1。
I,2,2,Herrfurth C,Hornung E,Heilmann M,Hofvander P,Stymne S等人。纳米电喷雾电离串联质谱法通过蜡酯分析。植物方法。2013; 9:24。
- 2.
miwa tk。Jojoba油蜡酯和衍生的脂肪酸和醇:气相色谱分析。J AM Oil Chem SoC。1971; 48:259-64。
- 3.
Benzioni A,Van Boven M,Ramamoorthy S,Mills D.果实生长的动态,蜡酯,猿猴,蛋白质,蛋白质和碳水化合物中的荷叶菌。indacrops prod。2007; 26:337-44。
- 4.
莫罗RA,黄AHC。荷荷巴幼苗子叶贮藏蜡的糖异生作用。植物杂志。1977;60:329-33。
- 5.
黄艾克。植物脂液滴及其相关蛋白质:快速进展的潜力。植物理性。2018; 176:1894-918。
- 6.
莫罗RA,黄AHC。Jojoba蜡酯分解代谢酶的酶。IEN:酶学中的方法。elewsvier;1981. p。804-13。
- 7。
Rost TL, Paterson KE。霍霍巴(hojoba)子叶贮藏器的结构和组织化学特征(Simmondsia对).原生质。1978; 95:1-10。
- 8。
Sturtevant D,Lu S,Zhou Z-W,Shen Y,Wang S,Song J-M等。Jojoba的基因组(Simmondsia对):一种分类学上的孤立种,指导其种子中蜡酯的积累。Sci放置2020;6:eaay3240。
- 9。
Al-eBaidi JR,Halabi MF,Alkhalifah NS,Asanar S,Al-Soqeer AA,Attia MF。Jojoba植物的植物重要性,生物技术方面和培养挑战述评。Biol Res。2017; 50。
- 10.
关键词:脂质生物合成,生物工程,中性脂质,生物工程大肠杆菌:Jojoba油状蜡酯和脂肪酸丁酯。申请环境微生物。2006; 72:1373-9。
- 11.
Wenning L,EJSing CS,David F,Sprenger RR,Nielsen J,Siewers V.增加Jojoba样蜡酯生产酿酒酵母通过增强非常长的链条,单不饱和脂肪酸合成。Microb细胞事实。2019; 18。
- 12.
Wenning L,Yu T,David F,Nielsen J,Siewers V.建立非常长链脂肪醇和蜡酯生物合成酿酒酵母:转身S. Cerevisiae.进入jojoba植物。Biotechnol Bioeng。2017; 114:1025-35。
- 13.
IVIVE T,Hornung E,Heilmann M,Feussner I.合成油脂蜡酯拟南芥蒂利亚纳和Camelina Sativa籽油。植物Biotechnol J. 2016; 14:252-9。
- 14.
Ruiz-Lopez N,Broughton R,esher S,Salas JJ,Haslam Rp,Napier Ja,等。在转基因种子中定制新型蜡酯的组成Camelina Sativa通过系统代谢工程。植物Biotechnol J. 2017; 15:837-49。
- 15.
Yu D,Hornung E,Oive T,Feussner I.通过大量供应油酸基材提供给植物种子油中的油糖糖的高级积累,从而提供给高效的蜡酯合成酶。Biotechnol生物燃料。2018; 11:53。
- 16.
Zhu L-H,Krens F,Smith MA,Li X,Qi W,van Loo EN,et al.致力于工业油料作物作为可持续工业原料生产的代谢工程平台。Sci代表2016;6:22181.
- 17.
李X,guan r,风扇j,zhu l-h。产业油作物的发展Crambe Abyssinica通过代谢工程和交叉育种来生产蜡酯。植物细胞生理。2019; 60:1274-83。
- 18。
齐W,Lu H,张Y,Cheng J,Huang B,Lu X等。油产作物遗传改性,用于生产附加值脂质。Critl Rev Biotechnol。2020; 40:777-86。
- 19。
凯利AA,Feussner I. Oil正在议程:高等植物的脂质营业额。BBA-Mol Cell Biol L. 1861; 2016:1253-68。
- 20。
Quettier A-L,Eastmond PJ。早期幼苗生长期间的储存油水解。植物理性生物化学。2009; 47:485-90。
- 21.
Theodoulou fl,Eastmond PJ。种子贮藏油分解代谢:给予和服用的故事。CurrOp植物BIOL。2012; 15:322-8。
- 22.
Seth S,Chakravorty D,Dubey VK,Patra S.深入了解植物脂肪酶研究 - 遇到的挑战。蛋白质Expr purif。2014; 95:13-21。
- 23。
Villeneuve P.植物脂肪酶及其在油和脂肪修饰中的应用。EUR J Lipid SCI Technol。2003; 105:308-17。
- 24。
Rajangam AS, Gidda SK, Craddock C, Mullen RT, Dyer JM, Eastmond PJ。发芽荷荷巴种子中蜡酯动员脂肪醇氧化途径的分子表征。植物杂志。2013;161:72 - 80。
- 25.
黄·赫科,莫鲁·雷,刘克德夫。Jojoba幼苗子叶中蜡酯水解酶的开发与性质。植物理性。1978; 61:339-41。
- 26.
Rost TL,Simper Ad,Schell P,Allen S. Jojoba的解剖学(Simmondsia对)种子和萌发过程中液体蜡的利用。经济学机器人。1977;31:140-7。
- 27.
穆兹K。双子叶植物种子发育和萌发过程中贮藏蛋白的蛋白酶和蛋白水解裂解。J实验机器人。1996;47:605–22.
- 28.
Tan-Wilson al,Wilson Ka。动员种子蛋白质储备。physiol植物。2012; 145:140-53。
- 29.
墨菲DJ,康明斯我,康。免疫细胞化学和生物化学研究在油菜发芽子叶中储存油体和蛋白质的生化研究,芸苔栗鸟. 食品农业科学杂志。1989;48:209–23.
- 30.
向日葵幼苗油体动员过程中油脂蛋白对蛋白质水解的敏感性差异。植物生理学。2002;43:1117-26。
- 31。
TZEN JTC,PENG C-C,Cheng D-J,Chen ECF,Chiu JMH。萌发后种子油体净化和油体完整性的新方法。j生物学习。1997年; 121:762-8。
- 32。
南巴纳S,Bhatla Sc。硫醇 - 蛋白酶可能的油体缔合的证据,导致向日葵幼苗子叶中的油溶胶降解。植物理性生物化学。2006; 44:714-23。
- 33.
Deruyffelaere C,Bouchez I,Morin H,Guillot A,Miquel M,Froissard M等人。泛素介导的油糖苷的蛋白酶体降解在拟南芥后发芽后的幼苗生长期间涉及油体动员。植物细胞生理。2015; 56:1374-87。
- 34.
Tzen JTC、Lai Y-K、Chan K-L、Huang AHC。高、低分子量的油氨酸异构体存在于各种种子的油体中。植物生理学。1990;94:1282–9.
- 35。
Van Boven M、Holser RA、Cokelaere M、Decuypere E、Govaerts C、Lemey J。荷荷巴油中甘油三酯的性质研究。美国石油化学学会。2000;77:1325–9.
- 36。
Barros M, Fleuri LF, Macedo GA。种子脂肪酶:来源、应用和性质综述。Braz J Chem Eng. 2010; 27:15-29。
- 37.
Abigor Rd,Uadia Po,Foglia Ta,Haas MJ,Scott K,萨维亚BJ。脂肪酶从萌发种子的局部纯化与性质麻风树图L. JAM Oil Chem SoC。2002; 79:1123-6。
- 38.
Sana NK,Hossin I,Haque Em,Shaha RK。从发芽油籽中浸润酶的鉴定,纯化和表征(芸苔栗鸟L.)。Pak J Biol Sci。2004; 7:246-52。
- 39.
Yeşiloğlu Y, Başkurt L.杏仁籽粒脂肪酶的部分纯化及特性研究。Prep Biochem Biotech. 2008; 38:397-410。
- 40。
Sagiroglu A,Arabaci N.向日葵种子脂肪酶:提取,纯化和表征。准备Biochem Biotech。2005; 35:37-51。
- 41。
Tsujita T,Sumiyoshi M,Okuda H. Wax酯合成脂肪酶活性。脂质。1999; 34:1159-66。
- 42。
Kalinowska M,Wojciechowski Za。芥末渣蜡酯水解酶的特征(Sinapis Alba.L.)幼苗。Acta Biochim Pol。1985; 32:259-69。
- 43。
邓磊,王鑫,聂坤,王峰,刘杰,王平,等。固定化脂肪酶催化脂肪酶酯化合成蜡酯念珠菌sp。99 - 125。化学工程学报2011;19:978-82。
- 44。
kuo c-h,陈h-h,陈j-h,刘y-c,shieh c-j。通过脂肪酶RMIM和Novozym 435从十六烷醇和辛酸合成的蜡酯的高产率。INT J MOL SCI。2012; 13:11694-704。
- 45.
Steinke G,Weitkamp P,Klein E,Mukherjee Kd。使用脂肪酸和来自Crambe和Camelina油的醇和醇通过脂肪酶催化的酯化通过脂肪酶催化的酯化制备。JAgric Food Chem。2001; 49:647-51。
- 46.
Eastmond PJ。糖依赖性1编码一种Patatin结构域三酰基甘油脂肪酶,在发芽时启动存储油分解拟南芥种子。植物细胞。2006;18:665 - 75。
- 47。
Sánchezm,Nicholls DG,Brindley DN。大鼠肝线粒体中Sn-甘油3-磷酸盐酶活性与酯化的棕榈酰桶 - 辅酶3-磷酸酯的关系。Biochem J. 1973; 132:697-706。
- 48。
Miklaszewska M,Dittrich-Domergue F,BanaśA,Domergue F. Wax Synthase MHWS2来自Marinobacter碳氢化合物Coclasticus:生产蜡酯的底物特异性和生物技术潜力。应用微生物生物技术。2018;102:4063-74。
- 49.
Bligh Eg,例如染料WJ。一种快速的总脂质提取和纯化方法。可以j生物摄像石pymiol。1959; 37:911-7。
- 50。
Heneen WK,Karlsson G,Brismar K,Gummeson P-O,Marttila S,Leonova S等人。燕麦籽粒胚胎油体的融合。Planta。2008; 228:589-99。
- 51。
McTery BV,Gibson Ts,Mugford DC,合作者:,Lukow O,Jackson DS等。氨基葡糖苷酶-α-淀粉酶方法测量谷物产品中的总淀粉:协作研究。J AOAC INT 1997; 80:571-579。
- 52。
Stymne s,Stobart Ak。酰基-CoA的可逆性的证据:发育红花的微粒体制剂中的溶血磷脂酰胆碱酰基转移酶(Carthamus Tinctorius.l)子叶和大鼠肝。j . 1984; 223:305-14。
致谢
我们感谢瑞典农业科学大学的Sten Stymne教授在整个研究过程中提供的全面帮助。此外,我们要感谢美国农业部(USDA)的Janet Caolo-Tanski和John M. Dyer博士提供荷荷巴种子。
资金
这项工作得到了EC FP7项目“用于新型化学品的经济作物生产附加值油”(ICON)的支持。AK项目由博美经济特区和格但斯克科技园联合资助的奖学金和欧盟在欧洲社会基金框架下联合资助的系统项目“InnoDoktorant -博士研究生奖学金,第六届”资助。
作者信息
隶属关系
贡献
AK和MM同样贡献;AK设计并进行了大部分实验,分析了数据,并修改了稿件;MM合成的蜡酯用于研究,进行整体数据分析,准备了这些数字,写道并修改了稿件;SS在蛋白质动员和分析数据上进行了实验,并修改了稿件;BG有助于分析脂肪酶活性;AB设计,LED和协调研究,并修改了手稿。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
Jojoba发芽和发芽后生长的不同阶段。图。S2。发芽Jojoba种子中淀粉和葡萄糖含量的变化。图S3。荷荷巴种子(登录号147)不同萌发阶段微粒体油氨酸含量的免疫印迹分析。图S4。磷酸缓冲液和HEPES缓冲液中TAG水解的时间过程。图。S5。CA的效果2+和米格2+在Jojoba种子脂肪酶活性朝向18:1标签。图。S6。图4的原始未折叠版本。2.
附加文件2:表S1。
主要脂肪酸(FA)和脂肪醇(FA- oh)的相对含量(占总脂肪酸和脂肪酸- oh的百分比)。表S2。在不同萌发的不同阶段的Jojoba种子中分离的微粒体部分中的脂肪酶活性。表S3。10个基因的列表,编码在种子发育过程中具有最高基因表达水平的假定荷荷巴脂肪酶。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
Kawiński,A.,Miklaszewska,M.,Stelter,S。等等。发芽期荷荷巴种子脂肪酶能有效水解三酰基甘油和蜡酯,并显示出蜡酯合成活性。BMC植物杂志21,50(2021)。https://doi.org/10.1186/s12870-020-02823-4
已收到:
公认:
发表:
关键词
- 蜡类
- 脂肪酶
- 蜡酯水解酶
- Simmondsia对
- 荷荷巴
- 蜡酯合成
- 三酰基甘油