抽象的
背景
关于二坐子胚胎种子中种子大小形成的分子基础知之甚少。蓖麻的种子(萝藦L.)被认为是种子生物学研究中的模型系统,因为它在整个种子发育过程中持续存在。
结果
我们比较了ZB107和ZB306的胚乳和胚乳细胞的大小,发现ZB107的种子尺寸较大是因为胚乳细胞数量较多,占种子总体积的比例较大。此外,ZB107的种子鲜重、干重和蛋白质含量均显著高于ZB306。采用相对和绝对定量等压标签(iTRAQ)和RNA-seq技术,对大种子ZB107和小种子ZB306进行蛋白质组学和转录组学比较分析。共鉴定到蛋白质种1416种,其中173种被鉴定为差异丰富蛋白种(DAPs)。此外,ZB306和ZB107之间有9545个差异表达基因(DEGs)。功能分析表明,这些DAPs和DEGs主要参与细胞分裂和碳水化合物和蛋白质的代谢。
结论
这些发现表明,细胞数量和储存成分的积累对种子大小的形成都至关重要,这为胚乳种子大小形成的潜在机制提供了新的见解。
背景
种子对于大多数农产品的经济和营养价值至关重要。因此,改良与种子表型相关的性状在现代农业研究中的意义越来越受到重视。种子大小是作物产量的主要决定因素,也是油料作物育种的主要性状之一,油料作物被强烈地选择用于作物驯化[1].种子大小主要受种子填充过程中的遗传因素治理,尽管种子大小的形成过程也受到生物和非生物胁迫的强烈影响[2].种子灌浆是胚胎发生和胚乳发生的时期,这一时期包含了复杂的细胞过程和种子储藏量的快速积累。虽然一些qtl或基因(特别是转录因子)已经被鉴定和/或从许多物种中克隆,如拟南芥[3.], 白饭 [4和玉米[5],单个基因的作用似乎是轻微的,并且关于监管网络的情况很少,这些网络提供全球对种子尺寸形成过程的全局控制。生理学上,负责种子储量储量的积累的生物合成途径在很大程度上定义了[6,但在种子灌浆过程中决定种子大小的机制尚不清楚。
蓖麻的种子(萝藦大戟科,L。2N = 20) is an desirable model system for studying seed biology because of the large and persistent endosperm. It is therefore ideal to study the mechanisms behind seed size formation, as the endosperm contains 60% fatty acids and 34% protein [6,7].在所有植物油中,蓖麻油是该行业的高度重视资源,由于其高蓖麻油酸(超过85%)含量,是由18个碳组成的不寻常的脂肪酸,C9和C10之间的双键,以及一个羟基附着于C12。由于其在乙醇或甲醇中优异的溶解性,蓖麻油被提出为高价值生物柴油的来源[8,9,10].由于其高经济价值和强大的环境适应能力,蓖麻豆在热带,亚热带和温暖的国家广泛种植,特别是在印度,中国和巴西[11].随着蓖麻油在许多国家的需求日益增加,种子和油产量的繁殖和蓖麻豆品种的遗传改善正在吸引育种者的许多关注[12].种子大小是与蓖麻籽中的作物产量相关的关键性状,并阐明基于种子大小的形成的分子机制将极大地促进蓖麻豆品种的基因工程的改善。
目前,蛋白质组学和转录组测序已经提供了有用的方法来研究种子大小形成的调控网络以及碳水化合物、蛋白质和脂肪酸积累的综合机制[13].最近,Itraq技术还提供了一种有用的定量蛋白质组学方法,以研究许多植物种类,如小麦,大豆,油菜籽和Medicago Truncatula.[14,15,16,17].对蓖麻种子发育的差异蛋白质组学分析有两个目的。一是确定蓖麻胚乳中参与脂肪酸生物合成的蛋白质[6].二是研究珠心母体种子组织中与蛋白质合成和降解相关的蛋白质丰度的时空变化趋势[18].迄今为止,对蓖麻种子发育过程中胚胎发生、胚乳发生和初级代谢的研究还很少。在本研究中,我们利用iTRAQ和RNA-seq技术对种子大小不同的两个自交系ZB107和ZB306的种子进行了蛋白质组学和转录组学比较分析。本研究旨在从转录(mRNA)和翻译(蛋白)两个水平鉴定参与蓖麻种子大小形成的候选基因,并为进一步了解蓖麻种子大小形成的潜在分子基础提供新的思路。
结果
种子发育过程中形态和重量的变化
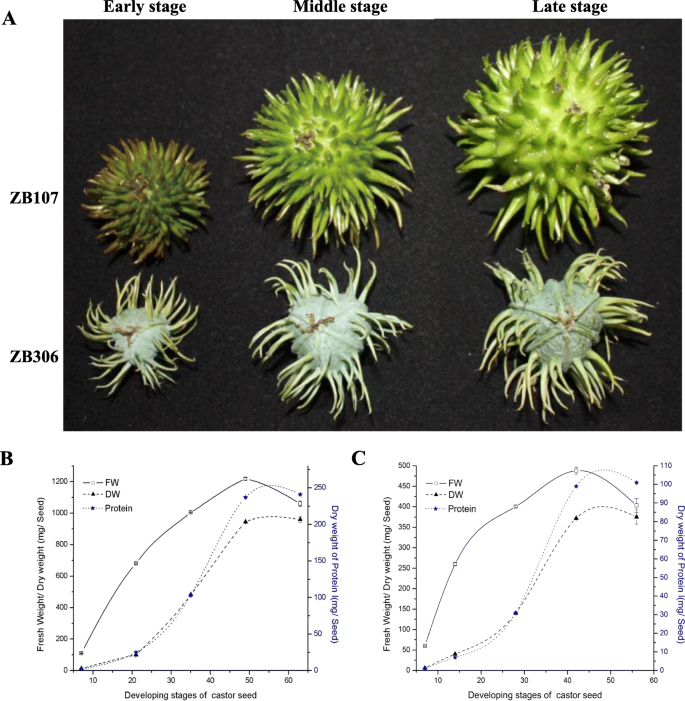
种子发展的时间长度,从授粉成熟,可能对蓖麻子的形态产生重大影响,按照胚乳的形态变化和我们先前的种子涂层发展研究[19,20].种子发育过程可分为早、中、晚三个阶段。ZB107和ZB306分别在受精后1 ~ 15、16 ~ 30和31 ~ 60 d发育。1a).早期的特征是细胞分裂活跃,与幼嫩种子中细胞数量的增加有关。在中期,细胞膨大使种子的重量和体积迅速增加(图。1a) 单粒鲜重(FW)在后期达到峰值,然后逐渐下降,从前期到后期,ZB107单粒鲜重增加了8.5倍(从142.87倍增加) ± 2.27 毫克至1207.03 ± 0.2 mg),而ZB306的FW增加了6.93倍(从70.53 ± 0.87 毫克至484.87毫克 ± 0.71 mg)(图。1b和c)。相应地,干重(DW)的单个种子增加38.5倍从早期到晚期ZB107(从24.9±0.56毫克,924.87±0.47毫克),并增加了35.45倍(从10.97±0.35毫克,390.23±0.97毫克)在ZB306(无花果。1干单粒种子的蛋白质含量在种子发育过程中呈现出相似的变化趋势,ZB107的蛋白质含量从6.2±0.36 mg增加到285.1±0.4 mg, ZB306的蛋白质含量从3.1±0.26 mg增加到97.5±0.75 mg。同样,蓖麻种子的大小从早期到后期也迅速增大(图。1a). ZB107的种子长从18.85 mm增加到37.7 mm, ZB306的种子长从16.9 mm增加到26 mm。ZB107的种子宽度从13 mm增加到26 mm, ZB306的种子宽度从11.7 mm增加到16.5 mm。
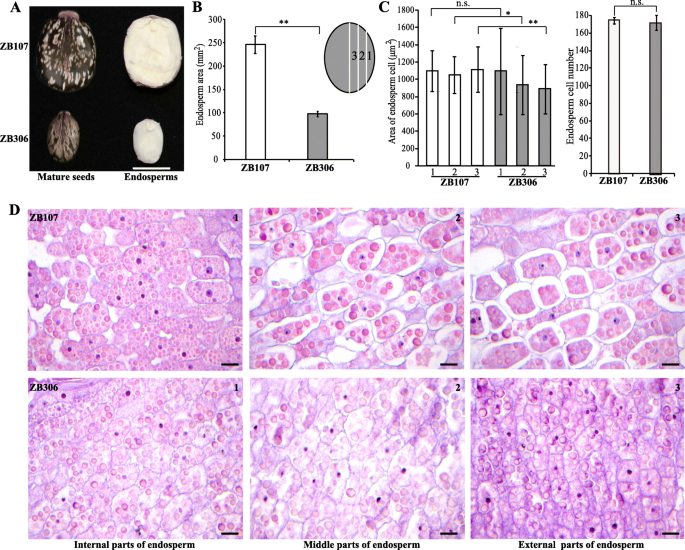
作为典型的双子叶胚乳种子,胚乳约占蓖麻种子体积的90%,因此ZB107和ZB306种子大小和重量的差异主要取决于胚乳的大小。ZB107的胚乳面积几乎是ZB306的2.51倍。2A和B)。为了进一步研究是否通过细胞尺寸或细胞数确定胚乳尺寸变化,我们对ZB107和ZB306的胚乳组织进行了微观分析。ZB107和ZB306之间的细胞尺寸和细胞数的变化在统计学上微不足道;然而,细胞密度在两个品种的内部,中间和外部部分之间变化(图。2a、c、d和e)。这些结果表明,胚乳大小差异很大的种子ZB107和小种子ZB306是由细胞数量,而不是细胞大小,这是符合我们以前观察蓖麻的种子外衣,我们注意到大的种皮区域造成更多的细胞数量19].
大种子ZB107和小种子ZB306的比较蛋白质组学分析
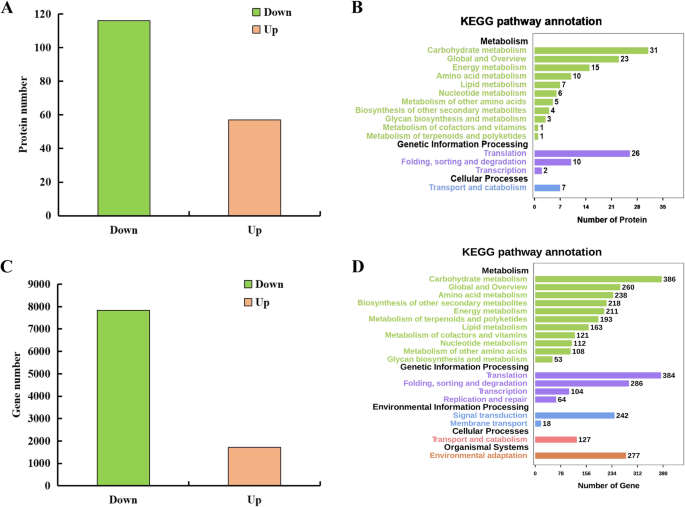
为了研究蓖麻种子大小形成过程中的蛋白质种类,我们对大粒种子ZB107和小粒种子ZB306进行了iTRAQ分析。将ZB107早期、中期和后期的种子样品进行蛋白质提取,将不同发育阶段等量的蛋白质样品混合作为大种子样品,将上述发育阶段对应的ZB306种子混合作为小种子样品。共生成156,386个图谱,其中12,674个图谱与肽谱匹配(PSM)相匹配,10,506个图谱在剔除低分图谱后是唯一的(附加文件)1:表S1)。通过吉祥物2.2程序对参考基因组数据库进行搜索,这些满足严格保密标准的独特光谱与3963个已知肽段进行了匹配,其中3681个肽段是唯一的(Additional file)1:表S1)。最后,从ZB107和ZB306的显影种子中鉴定了含有至少一种独特肽的1416种蛋白质物种(附加文件2:表S2)。在1416种蛋白质中,根据其功能注释(附加文件)分为23个Cog集群(附加文件)3.:图S1)。其中,“后期改性/蛋白质周转/伴侣”是具有最高代表性的功能类别(17.41%,179/1028),其次是“仅限通用函数预测”(14.40%,148/1028),“翻译/核糖体结构/生物发生“(11.67%,120/1028)和”能量产生和转化“(10.41%,107/1028)。此外,将8种蛋白质物种分为“细胞周期控制,细胞分裂或染色体分配”,其中六个被鉴定为钙调蛋白或钙依赖性蛋白激酶(附加文件4:表S3)。此外,基于GO类富集分析:生物过程,细胞组分和分子功能,将1157种鉴定的蛋白质物种分为三组。结果表明,在生物过程类别中,代谢过程(60.41%,699/1157)是最代表的,其次是细胞过程(55.92%,647/1157)和对刺激的反应(35.70%,413/1157)(额外的文件5:图S2)。最大类别与细胞组分中的细胞和细胞部分(82.80%,958/1157)有关。具体地,鉴定了与细胞分裂有关的三种蛋白质物种,包括毒素抑制的12.5kDa蛋白(ARP,30190.T000561),丝氨酸羧酸酯酶(SC,29489.T000001,29,745.T000011)和真核翻译开始因子5a(ef-5a,29,687.t000001)(表1).
使用折叠变化≥1.5或≤0.67和aP.-Value小于0.05,共173种蛋白质物种被鉴定为ZB107和ZB306之间的差异丰富的蛋白质(隔板)。与大种子ZB107相比,在小种子Zb306中检测到这些隔膜,57种增加的丰度和116个降低的蛋白质物种(图。3.a和附加文件6:表S4)。此外,Kegg途径富集分析显示,“碳水化合物代谢”(29.52%,31/105),“能量代谢”(14.29%,15/105),“氨基酸代谢”(氨基酸代谢),共有105个滴定剂分别为9.52%,10/105)和翻译(24.76%,26/105)(图。3.b)。这些结果表明,蛋白质和碳水化合物代谢对于测定两个蓖麻子的种子尺寸/重量是必不可少的。在本研究中,鉴定了总共19次涉及碳水化合物代谢的分布,例如三羧酸(TCA)循环,糖溶解,果糖和甘露糖代谢(表1).碳水化合物代谢是种子体积快速膨胀的主要过程,特别是在发育早期,ZB306中参与这一过程的几乎所有DAPs的丰度均呈下降趋势(表1)1和无花果。3.).在TCA循环中,ZB306中乌头酸酶(29,600.t000017)、苹果酸酶(29,794.t000105)和柠檬酸合酶(CS, 30226.t000050)的丰度较ZB107有所下降7:图S3)。同样,与Zb107相比,Zb306中综合糖酵解中参与糖酵解的酶的蛋白质在ZB306中也降低,例如Triosephosphate异构酶(TPI,27383.T000001),果糖 - 双磷酸醛糖酶(FBA,29660.T0032),磷酰型酶(PGM,29692。T000012)和甘油醛3-磷酸脱氢酶(GAPDH,30169.T000047)(表1和附加文件7:图S3)。此外,7大核糖体亚单位蛋白(28,180。t000008, 29070年。t000002, 29703年。t000077, 29743年。t000009, 30071年。t000004, 30147年。T.000153, and 30,152.t000032) that are associated with the ribosomal process exhibited decreases in ZB306, while only three of 40S ribosomal proteins (30,128.t000077, 30,147.t000458, and 30,147.t000462) were decreased-abundance protein species in ZB306 (Table1和无花果。4C)。核糖体生物发生在通过激活蛋白质合成来发挥细胞生长的基本作用[21].此外,在ZB306中还减少了与蛋白质代谢过程相关的26S蛋白酶调节亚基(29,739.T000101)和木质丝氨酸蛋白酶(29,172.T0012和29,986.T000074)的蛋白质物种。1和无花果。4d).综合来看,小种子ZB306中参与碳水化合物和蛋白质代谢的酶的蛋白质物种丰度低于大种子ZB107。结果表明,ZB107在胚发生和胚乳发生过程中需要更大的能量和贮藏储备,从而使其种子质量更高,种子大小也更大。
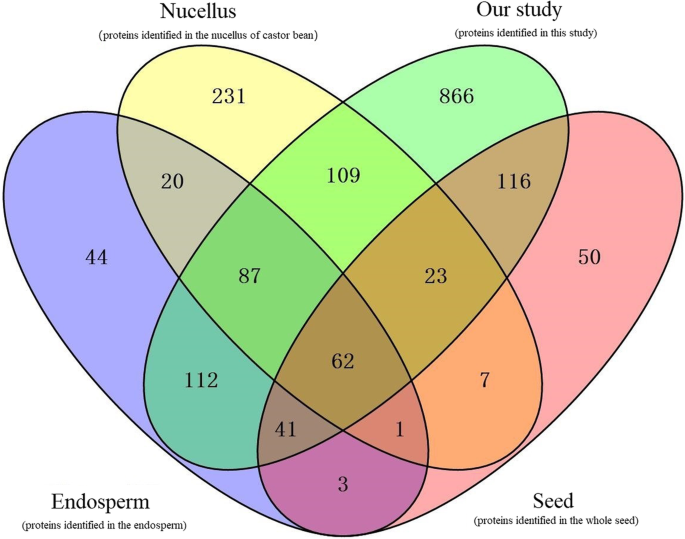
此外,我们将本研究中鉴定的蛋白质与先前由Houston等人报告的蛋白质物种进行了比较。[6和Nogueira等(分别从珠心和胚乳的不同发育阶段鉴定了766种和416种蛋白质)[18,22].在Houston的研究(使用全种子,记作“Seed”)和我们的研究中,共呈现了242种蛋白质,如图所示。5.的R.E.was an overlap of 302 protein species between our data and Nogueira’s study (only using the endosperm of castor seed, denoted as “Endosperm”), and there was an overlap of 281 protein species between our study and the Nogueira’s research of nucellus (denoted as “Nucellus”). Of note is that a total of 866 new protein species were detected in our study. These protein species were associated with embryogenesis (late embryogenesis abundant protein, 30,128.t000107/29889.t000167), seed coat development (cellulose synthase A catalytic subunit 6, 29,848.t000205), seed storage proteins synthesis (2S albumin precursor, 28,166.t000037/28166.t000041/28166.t000042), and fatty acid synthesis (Long-chain-fatty-acid CoA ligase, 29,732.t000015/29908.t000237) (Additional file8:表S5)。此外,植物激素信号转导途径中涉及的蛋白质物种在胚胎发生/胚乳的成因过程中也发挥着突出的作用,例如吲哚-3-乙酸(IAA)-AMIDO合成酶GH3.5(28,355.T000001),ARP(30,190。T000561),等等。这些结果表明,蛋白质组学分析不仅能够为蓖麻籽中的种子发育提供全面了解,并鉴定在胚胎发生调节和胚乳创世纪中起重要作用的最大蛋白质物种,但也能够引导我们进一步的重要见解储存产品的积累。最先前的研究仅使用部分种子,而我们的研究包括ZB107和ZB306的整个种子,在三种不同的发育阶段。我们的比较蛋白质组学分析表明,参与种子尺寸变异的蛋白质物种在种子胚胎发生过程中富含种子尺寸变化和蛋白质合成富集。这提供了对蓖麻籽中的种子尺寸控制的分子基础的更全面的理解。
大种子ZB107和小种子ZB306的转录组比较分析
为了研究种子大小形成过程中全局基因表达的差异,使用大种子ZB107和小种子ZB306进行了RNA seq分析。从ZB107和ZB306中总共产生了4918万和5065万个高质量读取,79.16%和84.78%的干净读取被映射到蓖麻的参考基因组n、 分别。将所有唯一映射的读段转化为RPKM以确定每个转录本的表达水平,并鉴定出ZB107和ZB306之间总共9545个DEG,与ZB107相比,ZB306中包括1713个上调基因和7832个下调基因(图。3.C)。富含碳水化合物代谢,氨基酸代谢,脂质代谢,翻译和信号转导的Kegg途径中富集386,238,163,384和242次Degs(图。3.d)。碳水化合物和氨基酸代谢是种子发展过程中最重要的过程[14].与大种子ZB107相比,小种子ZB306中参与这两个过程的大多数DEGs均下调(图1)。4和附加文件7:图S3)。例如,四个编码蔗糖合成的基因(SUS, 29726。t000198, 29739年。t000129, 29951年。T.000003, and 29,660.t000014) and are involved in the carbohydrate metabolism process were identified, and three of them showed up-regulation in large-seed ZB107. The higher expression levels of SUS suggested that the content of hexoses is higher in large-seed ZB107 than in small-seed ZB306. It is likely that sugar metabolism in the developing castor bean seeds has many vital functions, such as supplying carbon to the developing endosperm, controlling cell division, or regulating cell differentiation. In addition, the DEGs involved in translation and protein metabolic process were also up-regulated in large-seed ZB107 (see in Fig.4c和d),如SRPL32 (29,070.t000002)、SRPL8 (29,743.t000009)、eIF-5A (29,687.t000001)和s -腺苷蛋氨酸合成酶(SAMS, 30076.)。t000140, 30078年。T.000071, 30,128.t000431). The eIF-5A protein is originally identified as a translation initiation factor, functionally involved in the regulation of cell proliferation, cell growth and cell death [23,24].SAM在功能上涉及蛋氨酸代谢和碳代谢的调节[25,26].此外,GO富集分析表明,在细胞发育(GO:0048468)、细胞分裂(GO:0051301)、细胞生长(GO:0016049)和细胞周期过程(GO: 002402)中,有59、17、23和21个DEGs富集,这些富集与细胞大小和细胞数量有关(图)。6).在细胞分裂项下,ZB306的kinesin(29,171.t000006)的基因表达水平低于Zb107,而几丁质 - 诱导性胃肠杆菌蛋白响应蛋白(CIGR,29661.T000025)和EIF-5A(29,687)下降5.85倍。T000001)在ZB306中显示出2.19倍和1.30倍下调(图。6b). CIGR (GRAS家族成员)在功能上参与调节种子发育过程中的细胞分裂、伸长和扩张[27].此外,透明Testa 1蛋白(TT1,30,169.T000194)以及蛋白质COBRA前体(29,889.T0012)的转录性丰度为4.49倍,ZB306在细胞发育过程中比ZB107降低3.45倍(图.6COBRA编码假定的糖基磷脂酰肌醇锚定蛋白,在功能上参与调节纤维素合成,参与植物细胞壁的形成[28].此外,细胞周期的保守调节剂,如Cyclin A(29,648.T000086,29,794.T000196,29,841.T000018,20,170.T000189,28,152.T000004),Cyclin B(29,830.T0050,30,180.T000011,30,170.t000774,Cyclin D(30,027.t000037,29,908.t000283,20,170.t000158,29,801.t000066,30,099.t000113,29,9,970.t000009)在ZB306中也被下调(图。6d).可见,小种子ZB306中大部分参与细胞分裂的基因表达下调,这强烈表明细胞数量是蓖麻种子大小/重量的关键因素。
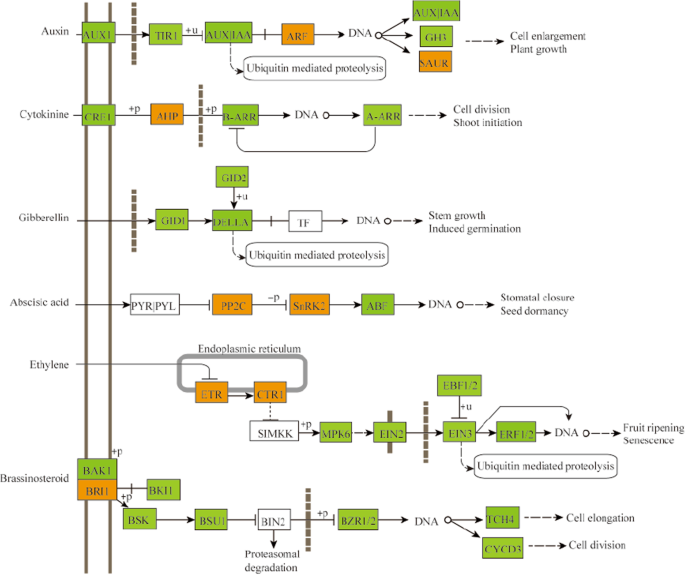
植物激素通常在控制植物生长发育的不同过程中起着关键作用[29].在生长素信号通路中,编码生长素受体转运抑制剂响应1蛋白的基因(TIR1, 29,908.t000274)在ZB107中表达量增加了2.42倍。与ZB306相比,ZB107中编码生长素/吲哚-3-乙酸的基因(AUX|IAA, 28179.t000006)和GH3 (28152 .t000001)分别增加了2.03倍和1.80倍(见表)2和无花果。7)然而,发现在ZB306中ARF2(生长素反应因子2,29647.t000040)的表达水平显著较高。一致地,在小种子ZB306中,细胞分裂素信号通路中AHP4(含拟南芥组氨酸的磷酸转移蛋白4,29912.t000167)的基因表达上调(图。7).然而,Bri1相互作用蛋白在芸苔类固醇(BRS)的信号通路中的基因表达,例如Bri 1相关受体激酶1(Bak1,30,190257),Bri1激酶抑制剂1(BKI1,30,170.T000310)和BR-信号传导激酶(BSK,30190.T000453),与ZB107相比,Zb306中的所有表现出降低的转录性丰度(在图1中。7).总的来说,这些观察结果表明植物激素,即生长素、细胞分裂素和BR,对种子发育过程产生强烈影响,这可能是ZB107和ZB306之间种子大小差异的重要原因。为了探索植物激素对种子发育的理据,我们进行了全面的研究独联体-Element分析涉及激素信号转导途径的所有41个基因的启动子。我们观察到了很多独联体在这些基因的启动子区域中发现了参与生长素、ABA、GA、MeJA和SA信号响应的-元件。其中10个基因包含独联体- 在功能上涉及调节种子发育(例如胚乳特异性表达,种子特异性调节和细胞周期调节)(附加文件9:图S4)。这些独联体-元素在控制种子大小形成过程中可能与调控基因表达有关。总的来说,转录组比较结果表明,细胞分裂负责ZB107更高的细胞数量和体积较大的种子,虽然碳代谢和蛋白质物质的过程,以及激素信号转导胚/胚乳《创世纪》期间,与ZB107的更高的种子重量有关。
参与植物激素信号转导途径的DEG。根据引用从KEGG MAP(KO04075)修改此图[29].黄色盒子代表着显着的上调基因;绿色盒子代表显着的下调基因
蛋白质组和转录组数据之间的相关性
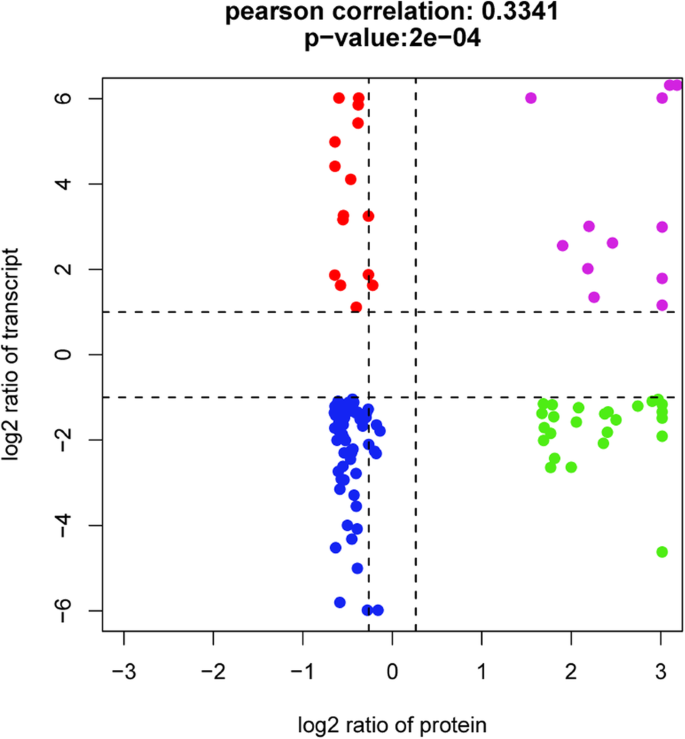
进行了点的全局相关性分析及其相应的转录物,导致Pearson相关系数低(R.= 0.334,P= 2E-04)(图。8).散点图分析表明,在转录物和蛋白质水平的情况下,12个基因(由紫点表示)上调,而在小种子ZB306中,68个基因(由蓝点表示)下调(附加文件10:表S6)。这些观察结果表明,蛋白质种类的丰度是由相应的mRNA表达水平决定的,反映了转录本和蛋白质种类之间的强相关性。在这些mRNA和蛋白水平均下调的基因中,有15个基因与碳水化合物代谢有关11:图S5),如CS(30,226.T000050),SUS(29,739.T000129)和丙酮酸激酶(30,131.T000450);12个基因与蛋白质代谢有关,例如SRPL32(29,070.T000002),SRPL8(29,743.T000009)和SAMS(30,078.T000071)。我们的结果清楚地表明,参与碳水化合物和蛋白质代谢的这些基因在转录物和蛋白质水平中协调,种子填充物影响种子尺寸/重量。此外,40个基因显示出蛋白质组学和转录组水平的相反趋势(附加文件10:表S6),暗示转录后和/或翻译后修饰可能在确定蛋白质物种丰富方面发挥重要作用。总共15个基因在mRNA水平上调节,蛋白质物种丰富(由红点表示)下降,而25个基因在mRNA水平中显着下调,蛋白质物种丰富的增加(由绿点表示无花果。8),例如,SRPL12(29,588.T000012),SRP119(30,167.T000025)和SRPL23(29,805.T000016)。众所周知,核糖体蛋白在植物中许多基本细胞活动中起重要作用,例如通过翻译规则或翻译后修改来控制许多发展方案拟南芥[30.].因此,基因表达的变化可能并不总是充分反映蛋白质水平,并且不应忽略转录后或翻译后修饰。我们的数据表明,在蛋白质和转录水平的碳水化合物和蛋白质代谢中发现了大种子Zb107和小种子Zb306之间的主要差异,而转录后或翻译后修饰的差异也可能产生影响在种子填充过程中。
采用qRT-PCR方法对选定的DAPs/DEGs进行验证
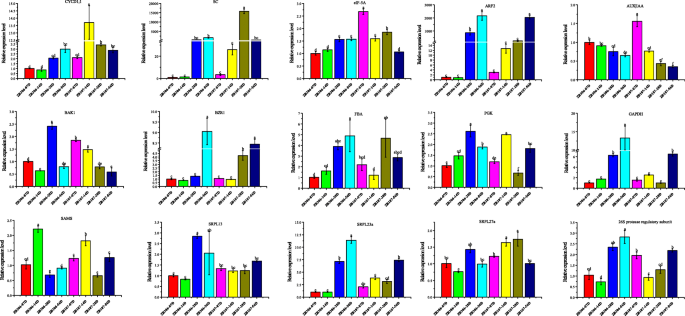
为了确认比较蛋白质组学和转录组分析的可靠性,基于QRT-PCR,在ZB107和ZB306的不同发育阶段检测到15个候选侧链/℃的表达模式(图。9).对于细胞分裂,大种子Zb107的CyCD1的表达水平显着高于小种子ZB306,特别是在14间DAF中,这表明CyCD1; 1主要在种子发育早期调节细胞数。类似地,ZB107的EIF-5a的相对基因表达比7-28dAF的Zb306显着高,与转录组和蛋白质组学分析的图案一致。此外,ARF2和BZR1的基因表达逐渐增加,而AUX | IAA和BAK1的表达在ZB107和ZB306中下调,从7-56个DAF下调。特别是在早期阶段,与ZB306(7个DAF)相比,ZB107的Aux | IAA和BAK1的表达显着高,但在中期(28 DAF),ARF2,AUX的表达,AUX | IAA和BAK1在ZB107中显着低于ZB306。对于碳水化合物新陈代谢,ZB107的14个DAF在14个DAF的表达水平比ZB306中的表达水平更高,表明种子填充的差异主要发生在早期发育阶段。对于蛋白质代谢和合成,SRPL23A,SRPL27A和26S蛋白酶调节亚基的表达水平在ZB107中比14dAF的ZB306中的表达水平较高,而编码SAMS,SRPL13,SRPL23A和26S蛋白酶调节亚基的基因进行了下调在28 DAF的ZB107中,在某种程度上,这些基因的表达并不总是与蛋白质物种丰富相关的程度。所有这些结果不仅确认了种子尺寸形成所涉及的侧链/°的准确性和可靠性,而且还进一步说明细胞分裂,碳水化合物代谢和蛋白质合成在种子大小的形成中制定了重要作用。
基于qRT-PCR的ZB107和ZB306种子发育过程中与种子大小形成相关基因的表达模式1, D1-type cyclin (29,168.t000023);SC,丝氨酸羧肽酶(29,745.t000011);eIF-5A真核翻译起始因子5a (29,687.t000001);ARF2 .t000040 (29647);AUX|IAA,生长素/吲哚-3-乙酸(28,179.t000006);BAK1, bri1相关受体激酶1 (30,190.t000257);BZR1, br激活转录因子brassinazole - resistance 1 (29,646.t000010);FBA,果糖二磷酸醛缩酶(29,660.t000032);PGK,磷酸甘油酸激酶(30,169.t000073); GAPDH, glyceraldehyde 3-phosphate dehydrogenase (30,169.t000047); SAM, S-adenosylmethionine synthetase (30,128.t000431); SRPL13, 60S ribosomal protein L13 (30,071.t000004); SRPL23a, 60S ribosomal protein L23a (28,180.t000008); RPL27a, 60S ribosomal protein L27a (30,147.t000153); and 26S protease regulatory subunit, 29,739.t000101. Expression levels were calculated by the 2−∆∆CT反对对照基因表达的方法。包括每个基因的三种生物学重复,并且基因表达的值显示为平均值±SD。不同的小写字母表示显着差异。通过单向ANOVA和TUKEY的多个比较测试分析数据,P.< 0.05
讨论
蛋白质组学技术用于蛋白质物种鉴定的比较分析
近年来,人们对蓖麻种子的代谢过程进行了大量的蛋白质组学研究,例如,我们对蓖麻种子发育过程中种子灌浆阶段的碳同化过程有了更多的了解,对脂肪酸的生物合成有了新的认识。并发现了在种子发育和萌发过程中负责储存蛋白生物合成的进一步机制[6,18,22,31].然而,我们目前的研究侧重于通过在种子发育过程中的大种子Zb107和小种子Zb306的蛋白质和转录物谱比较来解决种子大小背后的潜在机制。使用ITRAQ方法将总共1416种蛋白质物种与LC-MS / MS分析结合使用,其中866年在本研究中新发现。众所周知,施用蛋白质物种鉴定的不同蛋白质组学方法经常导致可变结果[32].本研究采用的iTRAQ标记方法比2-DGE或SDS-PAGE的蛋白分馏方法更灵敏、更有效。此外,iTRAQ方法已被广泛应用于研究种子发育的潜在分子机制和种子发育过程中贮藏储备的积累拟南芥[33],素类[34,和大米[35].但是,与之前的研究相比,本研究中观察到的蛋白质种类最多,因为本研究使用的是三个不同阶段的全种子。总之,我们的蛋白质组学分析将为蓖麻种子发育提供重要信息。
细胞分裂和种子灌浆相关蛋白的蛋白质组学鉴定
蓖麻豆通常具有胚胎种子,其尺寸主要由胚乳体积决定。在这项研究中,我们发现蓖麻豆的胚乳尺寸依赖于细胞数而不是细胞尺寸,这类似于水稻和玉米粒度的测定36,37].我们的蛋白质组学分析表明,细胞分裂和多样化的代谢过程在控制ZB107和ZB306的不同种子大小中起着至关重要的作用。特别地,我们发现ARP(30,190.t000561)在大种子ZB107和小种子ZB306之间表现出不同的蛋白质物种丰度,并且据报道,大白菜中的ARP调节了不同组织的细胞分裂[38].此外,SC (29,745.t000011)和eIF-5A (29,687.t000001)在大种子ZB107中的蛋白种类和转录本丰度均高于小种子ZB306,研究表明SC和eIF-5A在水稻细胞分裂和细胞周期调控中均发挥重要作用[39].因此,这些蛋白质可能是蓖麻细胞分裂和决定种子大小/重量形成的推定控制器。
已知初级代谢主要发生在种子发育的早期,本研究发现了许多参与碳水化合物和蛋白质代谢的蛋白质物种。中心碳代谢(包括糖酵解和TCA循环)是种子灌浆过程中的主要生理过程[40].总共18种参与碳水化合物代谢的蛋白质物种在大种子Zb107中显示出高于小种子Zb306的蛋白质丰富。例如,你等。发现,在晶粒期间,糖酵解的FBA(29,660.T000032),PGK(30,169.T000032),PGK(30,169.T000073),PGK(30,169.T000073)和葡萄糖-6-磷酸酯异构酶(GPI,30170.T000437)的含量高于粒度的较大颗粒 -填充期[13].因此,上述蛋白质种类在蓖麻种子发育过程中碳水化合物代谢的丰度不同,可能通过影响种子的填充来调节种子大小的形成。此外,蓖麻籽含油量近46-55%,油中近90%为羟基脂肪酸,而三羧酸循环中的几种酶,如乌头酸酶、苹果酸酶、CS等也通过乙醛酸循环参与脂肪酸代谢[41].我们确定了GAPDH蛋白(30,169.T000047),一种用于在糖酵解中激活脂肪酸生物合成的关键酶[42,大种子ZB107的蛋白质物种丰度高于小种子ZB306。以往的研究表明,GAPDH的活性和稳定性在控制蓖麻种子发育过程中脂质生物合成方面至关重要[43].此外,蛋白质代谢在调控胚胎/胚乳发生和贮藏蛋白生物合成中起着关键作用[44].结果表明,在大粒种子ZB107中,SRPL13 (30,071.t000004)、SRPL20 (30,147.t000462)、SRPL8 (29,743.t000009)、SRPL23a (28,180.t000008)和SRPL27a (30,147.t000153)的蛋白物种丰度显著增加。特别是,SRPL27a通过调节细胞分裂和细胞周期进程来控制种子发育拟南芥[45,46,另一种核糖体L18蛋白,心脏停止蛋白(HES),已被证明在种子的早期发育中是必不可少的拟南芥通过影响细胞分裂和细胞分化[47].ZB107的26S蛋白酶调节亚基(29,739.t000101)的蛋白质物种丰度显著增加,在胚胎发育过程中调控细胞周期和分化中起关键作用拟南芥[48].木质部丝氨酸蛋白酶(29,986.t000074)是调控木质部生物合成的关键酶[49],在大粒种子ZB107中增加。木质部丝氨酸蛋白酶也参与了种皮的形成拟南芥和甘氨酸最大[50].综上所述,这些参与碳水化合物、蛋白质、脂类和木质部代谢或生物合成的DAPs可能是直接或间接影响蓖麻种子大小/重量形成的控制器。进一步研究这些蛋白质在种子大小变化中的分子机制。
种子大小形成关键基因的转录组学鉴定
通过比较转录组分析发现,共有120个DEGs参与了细胞发育、细胞分裂、细胞生长和细胞周期控制,提示这些基因可能通过调节细胞分裂或细胞周期来参与控制种子大小。此外,大种子ZB107中一个参与细胞分裂的驱动蛋白基因(29171 .t000006)表达上调,该基因可能通过调节大种子ZB107的细胞数量来决定种子的大小烟草[51].类似地,在大种子ZB107中,细胞发育中的TT1(30,169.T000194)在大种子ZB107中也上调,并且已经证明了BNTT1不仅调节了类黄酮生物合成,而且影响了种子尺寸和脂肪酸组成。芸苔栗鸟[52,53].在碳水化合物代谢中,SUS基因表达量为29,739。t000129, 29951年。T.000003, and 29,660.t000014) were higher, suggesting that the content of hexoses is higher in large-seed ZB107 than in small-seed ZB306. The high levels of hexoses could maintain cell division and cell expansion during the embryogenesis of蚕豆根尖而且玉米种子中的马铃薯SU基因的过度表达可以增加淀粉含量[54,55].此外,已经证明,SUS的活性与鹰嘴豆种子大小正相关[56].此外,一些植物激素,如生长素、细胞分裂素和BR都可能通过细胞发育来调节种子的大小。7).例如,在大种子ZB107中ARF2 (29647 .t000040)表达较低,并通过抑制珠被区细胞分裂负向调节种子大小拟南芥种子[57].ARF2可能是通过控制种皮的扩展来决定蓖麻种子大小的。同样,细胞分裂素也有报道通过母体组织或合子组织影响种子大小[58].大种子ZB107中细胞分裂素信号负调控因子AHP4 (29,912.t000167)下调[59].此外,有报道称AHP4影响小麦种子大小、维管发育和植物发育的其他方面[60].brassinazole - resistance 1转录因子(BZR1, 29,646.t000010)可能通过影响种子的表皮、胚乳和胚发育的特定过程来调控种子的大小和形状拟南芥[61].在ZB107和Zb306的种子发育过程中,通过QRT-PCR确认了涉及细胞分裂,植物激素,碳水化合物代谢和蛋白质代谢的信号转导的这些基因的表达模式。因此,我们建议上述过程负责蓖麻籽中的种子尺寸/重量变化。
发展种子蛋白质组与转录组之间的全局关系
近年来,随着蛋白质组学和转录组分析技术的发展,在分析蓖麻种子大小形成的分子机制时,将蛋白质丰度与基因表达结合起来提供了新的机会。碳水化合物和蛋白质代谢中蛋白质物种丰度与mRNA表达的一致性表明,基因的表达决定了相应的蛋白质物种丰度。在蛋白质代谢过程中,高表达基因SAMS (30078 .t000071/30128.t000431)始终具有丰富的蛋白质物种丰度,其转录水平和蛋白质物种丰度在大种子ZB107中均高于小种子ZB306(图3)。4d)。先前的研究表明,转基因烟草中SAM的过度表达增加了种子的数量和重量[62].偶尔,蛋白质物种丰富和mRNA水平之间存在较差的相关性,这在先前的开发棉纤维的研究中已经证明,并突出了转录后和/或翻译后调节的重要性[63].转录后和翻译后修饰可能影响转录和蛋白质稳定性[64并影响翻译和代谢过程。核糖体蛋白在翻译中起着至关重要的作用,一些核糖体蛋白是翻译后修饰的靶标,这导致了mRNA水平和蛋白质物种丰度的不一致[65].例如,SRPS12/19/23蛋白的物种丰度在小种子ZB306中高于大种子ZB107,而其基因表达呈现相反的模式(图2)。4C)。到目前为止,几乎没有研究专注于转录后修改和/或翻译后修改如何影响种子大小。在未来的研究中,应在参考种子发育后的分子基础的蛋白质组学时考虑许多转录后和翻译后的监管程序。
结论
蓖麻种子是典型的双子叶植物的胚乳,因为它们的胚乳在成熟。在本研究中,组织学观察发现蓖麻胚乳中种子的大小是由细胞数量决定的,而不是由细胞大小决定的。通过对两个自交系大种子ZB107和小种子ZB306种子发育过程的转录组和蛋白质组学分析,我们发现大部分DAPs/DEGs参与了细胞分裂和储存库的积累,与种子体积和重量大小的形成相一致。这些已鉴定的DAPs/DEGs可能在蓖麻种子大小的形成中起关键作用。蛋白质组学和转录组学数据的相关分析显示,许多参与细胞分裂、碳水化合物代谢和蛋白质代谢的基因在转录和蛋白质水平上均受到相关调节,尽管皮尔逊相关系数较低(R. = 0.334)这些数据为进一步了解蓖麻种子胚乳种子大小和分子量的分子机理提供了一个重要的研究基础,希望能通过增加种子大小来阐明提高作物产量的遗传基础。
方法
植物材料及取样
蓖麻籽近交系Zb107(大种子)和Zb306(小种子)的种子是本研究中的主要材料。ZB107和ZB306都在中国科学院西双版纳热带植物园(Menglun镇,云南省Menglun镇Menglun镇; 21°56'N,101°15,600米海拔)。该区域的特征在于平均温度为21°C〜22°C。收集ZB107的种子7,21,35,49和63个DAF,对应于7,14,28,42和56个DAF的Zb306。每次,来自五种独立植物的至少20种种子用于实验,并且在三种生物学复制中进行相同的测试。ITRAQ和RNA-SEQ分析的样品立即在液氮中冷冻并储存在-80℃,而剩余的样品用于测量新鲜和干重。
种子重量和蛋白质含量测定
立即使用分析天平(TP-214;丹佛仪器,美国)称量所有收获材料的单个种子的平均鲜重,同时在65℃干燥样品后测量单个种子的平均干重 摄氏48度 如前所述,使用Kjelmaster K-375自动蒸汽蒸馏系统根据干质量测定蛋白质含量[66].将来自三种独立植物的三个种子作为一个生物重复,依次用于检测FW、DW和蛋白质含量,并计算三个生物重复的平均值。
形态学和细胞分析
为了确定种子的大小,我们拍摄了成熟的干种子和胚乳的投影面积。从5株独立的ZB107和ZB306分别从63 DAF位点和56 DAF位点新鲜分离出10粒种子。为了测定胚乳细胞的大小,从种子中分离出种皮和胚。胚乳修剪成适当大小的样品,在室温下固定在甲醛-乙酸溶液中不少于48小时,在一系列浓度上升的乙醇中脱水,在二甲苯中清除,并包埋在石蜡中,如Nogueira等人所述[18经过一些修改。将每个胚乳分为内、中、外三部分,测量细胞大小,用CM3050S旋转切片机(德国徕卡)将各部分切片,厚度为5~10 μm。这些切片用0.05%甲苯胺蓝染色,在徕卡显微镜(DM5500B, Bensheim, Germany)上显示细胞大小。使用Leica Microsystems (DFC450C)从胚乳的三个部分拍摄了至少20张照片。利用Image J软件对胚乳面积和胚乳细胞面积进行分析。
蛋白质制剂和ITRAQ标签
我们在14,28和56个DAF下使用了21,35和63个DAF的ZB107和63个DAF的整体种子,以进一步蛋白质组学分析(附加文件12:图S6)。从每个样品中提取蛋白质,有三个独立的重复。采用2D Quant试剂盒(GE Healthcare)测定蛋白浓度,SDS-PAGE验证。将ZB107中等量的3个蛋白样品混合为“大种子”,将ZB306中等量的3个蛋白样品混合为“小种子”。将大粒ZB107和小粒ZB306蛋白样品(100 μg)经胰蛋白酶消化后,用8-plex iTRAQ试剂分别对肽段进行117和121标记。所有样品以等分混合,在真空离心机中干燥。
SCX分馏
采用Agilent 1200高效液相色谱和强阳离子交换(SCX)色谱对itraq标记的多肽进行了分离。将干燥后的itraq标记多肽用缓冲液A (10 mM KH)稀释2阿宝4, 25% ACN, pH 3.0)。流速为1.0 mL/min,梯度为50 min, 100%缓冲液a作用5 min, 0~20%缓冲液B (10 mM KH)作用5 min2阿宝4(25% ACN, 500 mM KCL, pH 3.0)缓冲15分钟,20%~ 40%缓冲B 10分钟,40%~ 100%缓冲B 10分钟,100%缓冲A 10分钟。收集洗脱后的多肽并将其组合成12个组分。每个馏分在真空干燥器中干燥,并在0.1%甲酸(FA)中重新悬浮,进行LC-MS/MS分析。
LC-MS / MS分析
使用配备有纳米络反相液相色谱(RPLC)系统(AB SCIEX)的三重TOF 5600质谱仪系统进行分析LC级分。将肽级分以0.20μL/ min的流速将纳入C18塔上。使用120分钟梯度的5%〜40%ACN(0.1%Fa)的洗脱梯度。使用2.5 kV,30psi,雾化器气体为5psi的离子喷射电压来获取质谱数据,接口加热器温度为150°C。我们使用了信息相关的采集(IDA)模式来获取MS / MS数据。调查扫描以250毫秒的间隔获取,并且收集了20次排除窗口的多达35个产品离子扫描,总循环时间为2.5秒。将轧制碰撞能量设置应用于CID的所有前体离子。数据采集率为4秒。
蛋白质组学数据分析
使用Proteome Discoverer软件(Thermo Scientific, USA)将原始数据转换为MGF文件。利用Mascot软件(Matrix Science)进行蛋白质种类的鉴定萝藦数据库(ftp://ftp.tigr.org/pub/data/castorbean/release_0.1/).采用以下标准:选择iTRAQ 8-plex进行特异肽定量,肽质量耐受值设置为20 ppm, MS/MS耐受值设置为0.6 Da。定量的蛋白质种类比计算和标准化的中位数的唯一肽。对于蛋白质种类的定量,根据m/z 121报告离子的峰面积,以质量电荷比(m/z)为117作为对照样品。筛选标准为真实蛋白的HT >为0,独特肽的HT >≥1。缺失值由空值维护。倍变化率≥1.5或≤0.67的蛋白质种类P.-Value <0.05在所有三种重复中被确定为差异丰富的蛋白质物种(隔板)。
利用NCBI nr和SwissProt/Uniprot数据库对所有蛋白种的功能进行了注释,并利用COG、GO和KEGG数据库对所有蛋白种的功能进行了分析。对鉴定的DAPs进行GO和KEGG富集分析。利用MeV 4.9.0软件对两个样品的蛋白质种类进行层次聚类分析。
转录组测序和数据分析
使用RNAprep纯植物试剂盒(中国北京天根)从用于蛋白质组学分析的相同样品中提取总RNA。使用安捷伦2100生物分析仪(安捷伦科技,美国)测量RNA浓度和完整性。在Illumina HiSeq 2000平台上构建并测序了两个RNA序列库(ZB107和ZB306)。在删除低质量读取后,使用SOAP2和默认参数将测序数据映射到蓖麻豆参考基因组[67.].利用外显子模型每千碱基每百万测序Reads (RPKM)估计基因的表达水平。ZB306和ZB107的差异表达基因(deg) FDR≤0.01,|log2 (fold change) |≥1。通过Omicshare工具(http://www.omicshare.com/tools/Home/Soft/getsoft).识别独联体在激素信号转导途径相关基因启动子的-元素中,从参考基因组中提取1500 bp的基因上游序列,并对其进行分析独联体-Elements通过查询PlantCare数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
转录组与蛋白质组的相关分析
为了研究ZB107和ZB306种子发育过程中转录组和蛋白质组之间的一致性,基于DAPs及其相应的转录本进行了相关分析,计算了这些数据的Pearson相关系数,并用转录本的log2转化率绘制散点图s和相应的蛋白质物种丰度。
中存在的验证
当使用QRT-PCR时,我们选择了十五个基因以验证ZB306和ZB107种子中的表达模式。从八个样品独立地提取总RNA,包括ZB306的种子在7,14,28和56个DAF中以及7,21,35和63个DAF的相应种子。在这个阶段,为了促进种子发展期的描述,我们使用ZB306的时期代表ZB107的相应发展期。使用TransScript一体化的第一链CDNA合成超混合物用1μg总RNA合成CDNA(Transgen Biotech,北京,中国),并根据我们之前的研究进行QRT-PCR [21].我们对每个基因和每个实验进行了三个生物重复的测试。每个RNA样本中每个基因的相对表达值为平均值±SD。qRT-PCR所用引物采用引物3设计,附引物文件13:表S7。
统计分析
对于所有统计显着性分析,至少三种生物重复用于ZB107和ZB306。学生们T.-检验、单因素方差分析(ANOVA),然后进行Tukey多重比较检验(P< 0.05)was performed using SPSS18.0. The following asterisks indicate the results of significance testing: *P.< 0.05和**P. < 0.01. Different lowercase letters in the graphs indicate significant differences. Data represent mean values and error bars are SD.
数据和材料的可用性
数据集包含在文章及其附加文件中。本研究所用的测序数据已存入NCBI序列读取档案(SRA,http://www.ncbi.nlm.nih.gov/Traces/sra)数据库登录号为SRR1313230和SRR1313233。
缩写
- AHP4:
-
拟南芥组氨酸的磷酸替代蛋白4
- ARF2:
-
助线响应因子2
- ARP:
-
植物素抑制12.5 kda蛋白
- 辅助| IAA:
-
蟾蜍/吲哚-3-乙酸
- BAK1:
-
bri1相关受体激酶1
- br:
-
Brassinosteroids
- BSK:
-
BR-信号调激酶
- BZR1:
-
BRASSINAZOLE-RESISTANT1
- CIGR:
-
甲壳素诱导胃肠杆菌素响应蛋白
- 齿轮:
-
直际蛋白质群体
- CS:
-
柠檬酸合成酶
- DAF:
-
施肥后的日子
- 点击:
-
差异丰富的蛋白质种类
- 可见:
-
差异表达基因
- DW:
-
净重
- eIF-5A:
-
真核翻译启动因子5a
- F A:
-
甲酸
- 功能性:
-
Fructose-bisphosphate醛缩酶
- 弗兰克-威廉姆斯:
-
鲜重
- GAPDH:
-
甘油醛3磷酸脱氢酶
- 走:
-
基因本体论
- GPI:
-
葡萄糖-6-磷酸异构酶
- 艾达:
-
Information-dependent收购
- iTRAQ:
-
用于相对和绝对量化的等离标签
- Kegg:
-
京都基因和基因组百科全书
- PGK:
-
磷酸甘油酸酯激酶
- PGM:
-
磷素酶
- RPKM:
-
读取每百万次映射读取的外显子模型
- RPLC:
-
反相液相色谱
- 萨姆斯:
-
S-adenosylmethionine合成酶
- SC:
-
丝氨酸羧肽酶
- SUS:
-
蔗糖合成酶
- TCA:
-
Ttricarboxylic酸
- TIR1:
-
转运抑制剂反应1蛋白
- TPI:
-
Triosephosphate异构酶
- TT1:
-
透明TESTA 1蛋白
参考文献
- 1.
风扇C,xing Y,Mao H,Lu T,Han B,XU C,Li X,张Q.GS3,用于粒度的粒度和重量和小QTL的主要QTL和米米厚度,粒度,编码推定的跨膜蛋白.Al Appl Genet。2006; 112(6):1164-71。
- 2.
Sakamoto T,Matsuoka M.鉴定和利用水稻谷物产量基因。CurrOp植物BIOL。2008; 11(2):209-14。
- 3.
Garcia D,Fitz Gerald JN,Berger F. Endosperm Grower对Endosperm Grower的母体控制的母体控制是协调的,以确定拟南芥的种子大小。植物细胞。2005; 17(1):52-60。
- 4.
Kato T, Segami S, Toriyama M, Kono I, Ando T, Yano M, Kitano H, Miura K, Iwasaki Y.大粒水稻粒长qtl的检测。Sci繁殖。2011;61(3):269 - 74。
- 5.
刘俊,黄杰,郭哼,兰升,王鹤,徐y,杨x,李文,童h,xiao y等。玉米和稻米籽粒尺寸和体重的保守和独特的遗传建筑。植物理性。2017; 175(2):774-85。
- 6.
休斯顿NL, Hajduch M, Thelen JJ。蓖麻种子灌浆的定量蛋白质组学研究:通过与大豆和菜籽的比较,揭示了种子光合和非光合代谢的差异。植物杂志。2009;151(2):857 - 68。
- 7。
陈志强,陈志强,陈志强,等。小麦籽粒油脂生产的生理和发育调控。中国生物医学工程学报2010;49(3):235-49。
- 8。
Specza v,Da Silva JN。使用蓖麻油作为燃料的前景和风险。生物量生物能源。2008; 32(2):95-100。
- 9。
Dyer JM, Stymne S, Green AG, Carlsson AS。高价值的植物油。植物j . 2008; 54(4): 640 - 55。
- 10。
Ogunniyi DS。蓖麻油:一种重要的工业原料。Bioresour抛光工艺。2006;97(9):1086 - 91。
- 11.
Atsmon D. In: Robbelen G, Downey RK, Ashri A, editors。Castor。在世界油料作物中,其育种和利用。纽约:麦格劳-希尔;1989.438 - 47页。
- 12
邱L,杨C,田B,杨杰,刘A.利用EST-SSR标记在蓖麻豆类的开发和表征的利用数据库(萝藦l .)。BMC Plant Biol. 2010;10:278。
- 13.
尤聪,陈林,何海波,吴立强,王胜,丁艳峰,马春霞。基于itraq的粳稻灌浆早期优势和劣势小穗蛋白质组分析植物学报。2017;17(1):100。
- 14.
杨明敏,董军,赵卫伟,高翔。小麦籽粒发育早期相关蛋白的iTRAQ分析。J蛋白质组。2016;136:157 - 66。
- 15.
Clarke VC,Loughlin PC,Gavrin A,Chen C,Brese Em,Day Da,Smith PMC。大豆蛋白酶体的蛋白质组学分析鉴定了新的共生蛋白。Mol细胞蛋白质组学。2015; 14(5):1301-22。
- 16.
Urban MO,Vasek J,Klima M,Krtkova J,Kosova K,Prasil IT,Vitamvas P.蛋白质组学和生理学方法揭示油菜干旱诱导的变化:节水和耗水策略.蛋白质组学杂志.2017;152:188–205。
- 17。
Le Signor C, Aime D, Bordat A, Belghazi M, Labas V, Gouzy J, Young ND, Prosperi JM, Leprince O, Thompson RD, et al.;利用蛋白质组学数据进行的全基因组关联研究揭示了豆科植物种子中球蛋白合成、运输和包装的重要基因。新植醇。2017;214(4):1597 - 613。
- 18。
Nogueira FCS,Palmisano G,Soares El,Shah M,Soares AA,Roepstorff P,Campos Fap,Domont GB。在开发期间蓖麻籽(Ricinus Communis L.)种子的蛋白质形象。J蛋白质组。2012; 75(6):1933-9。
- 19。
于安明,王志强,张艳,李飞,刘雅娜。蓖麻种皮组织基因表达调控种子大小形成的潜在机制。中华医学杂志。2019;20(6):1282。
- 20.
Greenwood JS, Bewley JD。种子发展萝藦(蓖麻).1。描述性形态。可以j bot。1982; 60(9):1751-60。
- 21.
从核糖体的一个位点开始蛋白质合成。细胞。2000;102(4):511 - 20。
- 22。
Nogueira FCS,Palmisano G,Schwammle V,Campos Fap,Larsen Mr,Domont GB,Roepstorff P.定量植物蛋白质组学中的表现和同位素标记的性能。J蛋白质组。2012; 11(5):3046-52。
- 23.
关键词:拟南芥,真核翻译起始因子5A-2,细胞分裂,生长,死亡植物杂志。2007;144(3):1531 - 45。
- 24
Thompson Je,Hopkins Mt,Taylor C,王TW。真核翻译引发因子5A调节衰老:植物生长发育的影响。趋势植物SCI。2004; 9(4):174-9。
- 25.
何文伟,王勇,吴建强,舒爽,孙军,郭世荣。黄瓜S-腺苷蛋氨酸合成酶基因的分离、鉴定及其对非生物胁迫的响应。植物生理生化学报。2019;41:431 - 45。
- 26.
关键词:拟南芥,s -腺苷- l-甲硫氨酸合成酶3,木质素,游离甲硫氨酸植物j . 2002; 29(3): 371 - 80。
- 27.
Roxrud I,Lid SE,Fletcher JC,Schmidt ED,Opsahl Sorterberg HG.GASA4,拟南芥GASA小多肽家族的14个成员之一,调节开花和种子发育。植物细胞生理学。2007;48(3):471-83。
- 28.
Schindelman G, Morikami A, Jung J, Baskin TI, Carpita NC, Derbyshire P, McCann MC, Benfey PN。COBRA编码一种假定的gpi锚定蛋白,该蛋白是极性定位的,在拟南芥中是定向细胞扩张所必需的。基因Dev。2001;15(3):1115 - 27所示。
- 29。
Berens ML,Berry HM,矿山A,Argueso CT,Tsuda K.植物防御中激素信号网络的演变。Annu Rev phytopathol。2017; 55:401-25。
- 30.
李瑞霞,李瑞霞。拟南芥核糖体蛋白通过生长素反应因子的翻译调控。美国国立科学院。2012; 109(48): 19537 - 44。
- 31.
蓖麻种子发育和萌发过程中内质网的差异蛋白质组学分析(萝藦)鉴定出种子蛋白前体是内质网的重要组成部分。蛋白质组学。2007;7(9):1513 - 28。
- 32.
吴WW,王GH,BAEK SJ,沉雷。三种蛋白质组学定量方法,Dige,Cicat和Itraq,使用2D凝胶或LC-MALDI TOF / TOF的比较研究。J蛋白质组。2006; 5(3):651-8。
- 33.
梁超,程顺福,张玉军,孙永忠,Fernie AR, Kang K, Panagiotou G, Lo C, Lim BL.光照开始后拟南芥叶片转录组、蛋白质组学和代谢的变化。BMC Plant Biol. 2016;16:43。
- 34。
王耶,刘俊,陈姬,李鹤,何J,关河,果实果实果实栽培品种的比较转录组和蛋白质组分析。BMC基因组学。2017; 18(1):984。
- 35.
彭学勇,秦志林,张桂平,郭玉明,黄建林。蛋白质组和转录组的整合揭示了水稻dl2突变体的多水平基因调控。植物科学学报2015;6:351。
- 36
杨杰,张俊,黄泽,王紫q,朱琦,刘lj。水稻胚乳发育中胚乳和细胞分裂活性细胞分裂与细胞分裂活性的相关性与细胞分裂活性的相关性。Ann Bot。2002; 90(3):369-77。
- 37.
Jones RJ,Roessler J,Ouatter S.热环境在玉米细胞分裂过程中 - 胚乳细胞数量和淀粉颗粒的作用。农作物科学。1985; 25(5):830-4。
- 38.
李志强,李志强,李志强,等。油菜生长素抑制基因BrARP1和BrDRM1的分子生物学特性。中国人民大学学报(自然科学版)2013;40(1):197-209。
- 39.
李烨,粉丝CC,邢yz,江耶,罗lj,太阳l,邵d,徐cj,李xh,xiao jh等。GS5的自然变化在调节水稻中的晶粒尺寸和产量方面发挥着重要作用。NAT Genet。2011; 43(12):1266-70。
- 40。
Fernie Ar,Carrari F,SweetLove LJ。呼吸新陈代谢:糖酵解,TCA循环和线粒体电子传输。CurrOp植物BIOL。2004; 7(3):254-61。
- 41。
nes- nesi, Araujo WL, Obata T, Fernie AR.线粒体三羧酸循环的调控。植物学报。2013;16(3):335-43。
- 42.
郭L,MA FF,Wei F,Fanella B,Allen DK,王XM。胞岩磷酸化甘油型甘油醛-3-磷酸脱氢酶影响拟南芥细胞代谢,促进种子油积累。植物细胞。2014; 26(7):3023-35。
- 43.
Piattoni CV, Ferrero DML, Dellaferrera I, Vegetti A, Iglesias AA。种子发育过程中胞质甘油醛-3-磷酸脱氢酶发生磷酸化。植物学报,2017;
- 44.
Tzafrir I,Pena-Muralla R,Dickerman A,Berg M,Rogers R,Hutchens S,Sweeney TC,McElver J,Aux G,Patton d等。鉴定拟南芥胚胎发育所需的基因。植物理性。2004; 135(3):1206-20。
- 45.
Zsogon A,Szakonii D,Shi XL,Byrne ME.核糖体蛋白RPL27a以剂量依赖的方式促进雌配子体发育。植物生理学。2014;165(3):1133-43。
- 46。
Szakonyi D,Byrne Me。在拟南芥中,核糖体蛋白L27a是生长和图案化所必需的。植物J 2011; 65(2):269-81。
- 47.
张海英,罗敏,戴RC, Talbot MJ, Ivanova A, Ashton AR, Chaudhury AM, Macknight RC, Hrmova M, Koltunow AM。在拟南芥中,发育调节的HEART STOPPER是一个以线粒体为靶点的L18核糖体蛋白基因,是细胞分裂、分化和种子发育所必需的。中国生物医学工程学报。2015;66(19):5867-80。
- 48
拟南芥26S蛋白酶体的RPN1亚基在胚胎发生中起重要作用。植物细胞。2005;17(10):2723 - 37。
- 49.
赵cs,约翰逊bj,kositsup b,啤酒ep。利用拟南芥的二次生长。三个木质肽酶的Xylem和Bark cDNA文库的构建和克隆。植物理性。2000; 123(3):1185-96。
- 50.
Kour A,Boone Am,Vodkin Lo。甘氨酸Max中有缺陷种子涂层突变的RNA-SEQ剖析显示富含脯氨酸和其他细胞壁蛋白转录物的差异表达。Plos一个。2014; 9(5):E96342。
- 51。
天SJ,吴吉,刘义,黄克,李福,王泽,太阳MX。核糖体蛋白NTRP117与Kinesin-12家族蛋白NTKRP相互作用,并在调节胚胎/种子尺寸和胚根生长中的作用。J Exp Bot。2017; 68(20):5553-64。
- 52。
Sagasser M,Lu GH,Hahlbrock K,Weisshaar B. A.Thaliana透明Testa 1涉及种子涂层发育,并定义植物锌指蛋白的WIP亚家族。基因开发。2002年; 16(1):138-49。
- 53。
连建平,卢晓春,尹nw,马立军,卢军,刘旭,李军,卢军,雷波,王锐,等。沉默BnTT1家族基因影响甘蓝型油菜种子类黄酮生物合成,改变种子脂肪酸组成。植物科学。2017;254:32-47。
- 54.
Weber H,Buchner P,Borisjuk L,Wobus U. vicia Faba L期间的蔗糖新陈代谢由蔗糖 - 磷酸合酶和蔗糖合成酶的齐节作用控制:表达模式,代谢调节和种子发育的影响。工厂J. 1996; 9(6):841-50。
- 55.
李家,巴洛哈·费尔南德斯·埃尔·李省A,Munoz FJ,Ovecka M,Montero M,Sesma Mt,Alonso-Casajus N,Almagro G,Sanchez-Lopez Am,等。增强蔗糖合成酶活性导致玉米中淀粉和ADP-葡萄糖的水平增加(玉米L.)种子胚乳。植物细胞生理。2013; 54(2):282-94。
- 56.
Turner NC, Furbank RT, Berger JD, Gremigni P, Abbo S, Leport L.鹰嘴豆子叶发育中种子大小与蔗糖合酶活性相关。作物科学。2009;49(2):621 - 7。
- 57.
Schruff MC, Spielman M, Tiwari S, Adams S, Fenby N, Scott RJ。拟南芥的生长素反应因子2基因与生长素信号传递、细胞分裂、种子和其他器官的大小有关。发展。2006;133(2):251 - 61。
- 58。
Riefler M,Novak O,Strnad M,Schmulling T.拟南芥Cytokinin受体突变体揭示了芽生长,叶片衰老,种子大小,萌发,根部发育和细胞天然素代谢的功能。植物细胞。2006; 18(1):40-54。
- 59.
Hutchison Ce,Li J,Argueso C,Gonzalez M,Lee E,Lewis MW,Maxwell BB,Perdue Td,Schaller Ge,Alonso JM等。拟南芥组氨酸磷酸替代蛋白是细胞蛋白信号传导的冗余阳性调节剂。植物细胞。2006; 18(11):3073-87。
- 60.
宋建军,姜丽娟,Jameson PE。细胞分裂素基因家族成员在小麦旗叶和生殖发育中的协调调控。BMC Plant Biol. 2012;12:78。
- 61.
姜文斌,黄海英,胡永文,朱斯文,王志勇,林文辉。油菜素内酯调节拟南芥种子的大小和形状。植物杂志。2013;162(4):1965 - 77。
- 62.
齐YC,王FF,张H,刘维克。Suadea Salsa S-腺苷甲硫氨酸合成酶基因的过表达促进转基因烟草中的耐盐性。acta physiol植物。2010; 32(2):263-9。
- 63。
Friso G, van Wijk KJ。植物代谢中的翻译后蛋白修饰。植物杂志。2015;169(3):1469 - 87。
- 64。
围墙L,德鲁斯GN,Goldberg RB。大豆种子蛋白mRNA水平的转录和转录后调节。Proc Natl Acad Sci U S A. 1986; 83(7):2123-7。
- 65。
Carroll AJ,Heazlewood JL,ITO J,Millar啊。拟南芥细胞骨核糖体蛋白质组的分析为其组分及其翻译后修饰提供了详细的见解。Mol细胞蛋白质组学。2008; 7(2):347-69。
- 66.
谷物和油料中蛋白质含量的快速测定方法:验证、测量不确定度及与凯氏定氮法的比较。acta photonica sinica, 2010;15(10): 555-61。
- 67.
Li R,Yu C,Li Y,Lam Tw,Yiu Sm,Kristiansen K,Wang J. Soap2:短读对准的改进超快工具。生物信息学。2009; 25(15):1966-7。
确认
我们感谢奥斯汀史密斯博士来自世界农林,东部和中亚,批评这份手稿和有用的讨论。我们感谢经济植物和生物技术重点实验室的实验生物技术服务中心的支持,昆明植物园植物园,植物园昆明研究所。
资金
国家自然科学基金项目(no . 31571709, no . 31661143002, no . 31771839, no . 31701123);云南省应用基础研究计划项目(no . 2016FA011)。
作者信息
从属关系
贡献
AL设计了研究,FL和AY进行了实验,AY,FL,AL和AL进行了数据分析并写了稿件。所有作者审查并批准了本手稿的最终版本。
作者信息
从属关系。
中国西南山区森林资源保护与利用重点实验室,教育部,西南林业大学,云南昆明,中华人民共和国昆明650224。
余安民,刘爱忠。
中国科学院昆明植物研究所经济植物与生物技术重点实验室,云南省野生植物资源重点实验室,云南昆明650201
余安民,李飞。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
在iTRAQ分析中鉴定的光谱、多肽和蛋白质种类的数量
附加文件2:表S2。
所鉴定蛋白种的多肽序列(XLS 904 kb)
附加文件3:图S1。
所有蛋白质的COG功能分类分析。
附加文件4:表S3。
参与细胞周期控制、细胞分裂、染色体分裂的八种蛋白质
附加文件5:图S2。
用于所有蛋白质物种的GO类别识别ZB107和ZB306。
附加文件6:表S4。
差异丰富的蛋白质物种的总目录(XLS 128 KB)
附加文件7:图S3。
蓖麻种子碳水化合物代谢相关的DAPs和DEGs的示意图。
附加文件8:表S5。
蛋白质物种的基因功能分类仅在我们的比较蛋白质组学中检测到
附加文件9:图S4。
独联体激素信号转导通路基因启动子序列的元素分析。
附加文件10:表S6。
DAPs与相关基因的相关性分析
附加文件11:图S5。
在蛋白质和转录物水平之间相关的基因的Kegg注释。
附加文件12:图S6。
大种子ZB107与小种子ZB306之间的DAPs/ deg识别流程
附加文件13:表S7。
本研究中使用的引物概述。
权利和权限
开放存取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Yu,A.,Li,F.&Liu,A.比较蛋白质组学和转录组分析为蓖麻籽中的种子大小形成了新的洞察。BMC植物杂志20.48 (2020). https://doi.org/10.1186/s12870-020-2249-1
收到了:
接受:
发表: