摘要
背景
正在发育的果实是研究发育过程中代谢产物快速变化的复杂网络的一个很好的模型。
结果
代谢组学研究表明,发育中的亚麻籽果实富含初级代谢物(ω-3和ω-6脂肪酸和氨基酸)、次级代谢物和天然抗氧化剂。果实生物学和解剖学研究证实,车前草果实发育经历五个阶段。分别合成总脂和脂肪酸;随着发育阶段的增加,饱和脂肪酸(FAs)增加,总多不饱和脂肪酸(FAs)减少。非饱和指数和非饱和程度呈悬链线曲线。主成分分析证实了FA从萌芽到成熟阶段的显著变化。同样,在不同的发育阶段,随着时间的生物合成途径,总氨基酸的水平也相似。总酚和类黄酮含量随果实发育而降低。鉴定出22种不同的代谢物,并观察到果实发育过程中的代谢变化。6个代谢物仅在花期检测到,2个代谢物分别在发育的早期和成熟期检测到。 The metabolites apigenin and kaempferol were detected ubiquitously in all developmental stages. Time-dependent metabolomics revealed a shift in metabolite biosynthesis.
结论
在果实发育过程中,代谢产物FAs、氨基酸、总酚、总黄酮、抗氧化剂和清除活性均呈渐进变化并相互协调连接。未来,进一步的研究将集中在验证已鉴定的代谢产物,并结合转录组学数据,揭示车前草发育过程中的代谢调控网络。
背景
Plantago ovataForssk。是车前草科的一种古老的一年生草本植物,在世界热带地区广泛种植[8].车前草自古以来就被用于治疗许多健康状况和疾病,如炎症、伤口愈合和癌症[29.].“伊莎贝尔皮”代表种子的表皮层,它是植物的重要组成部分。谷壳是一种天然泻药,含有有药用价值的粘液化合物,在制药工业中用作增稠剂。它传统上被用作治疗肠梗阻、便秘、腹泻和痢疾的预防剂[8].
车前草,车前草的俗称Plantago ovata,含酚类、黄酮类、萜类及环烯醚萜苷[54].洋水碱的果实体具有强大的抗氧化剂化合物,被认为是丰富的天然抗氧化源[4,54].黄酮类化合物黄芩苷7-葡萄糖苷、黄芩苷7-葡萄糖醛酸、黄芩苷(5,6,7,4 ' -四羟基黄酮)、芹菜素、木犀草素、hispidulin(5,7,4 ' -三羟基甲氧基黄酮)和5,7,4 ',5 ' -四羟基黄酮-3 ' - o -葡萄糖苷已被广泛报道从亚麻籽([14.,17.,21.,28.,35])。黄酮类化合物参与心血管疾病的防御机制和其他体外抗氧化活性。6000多种类黄酮已被分类,其中大多数报告来自植物的花朵、果实和叶子[20.].黄酮类化合物可与不同类型的酶抑制剂相互作用,如环氧合酶和脂肪加氧酶,这些酶参与多种生物活性,包括抗菌、抗肝毒性、抗骨质疏松、抗溃疡、抗增殖和凋亡活性[1,18.].例如槲皮素-3- o -α- l鼠李皮苷Toona sinensis,显示抗氧化及抗肿瘤活性[65],Kaempferol和8-C-(1,1-二甲基-2-丙烯-1-基)-5,7-二羟基硫酰酚酚法国梧桐胶和梧桐树显示成骨细胞和er α介导的雌激素活性[59,山奈酚和金丝桃苷是种子中的活性化合物五角对,具有成骨作用[62].作为膳食或药用补品,多酚和类黄酮由于具有抗氧化作用而具有促进健康的特性[10.].多酚等非均相化合物具有清除ABTS(2,2′-氮杂二-(3-乙基苯并噻唑啉-6-磺酸)、清除DPPH(2,2 -二苯基-1-苦基肼)和清除羟自由基等抗氧化活性[2].
应激时产生活性氧(ROS),对细胞造成氧化损伤;因此,植物对ros诱导的氧化应激具有强大的防御机制[7,25.,44,60].一些机制涉及自由基清除活动,如通过抑制参与自由基生成的酶来破坏ROS的形成,清除ROS和通过抗氧化防御来保护ROS [7,40].植物代谢组学方法已被用于鉴定和量化药用植物的初级和次生代谢物[33,39,45].植物的初级代谢物,如脂肪酸、氨基酸和碳水化合物,是生命所必需的,而次级代谢物的生产则与植物的发育有关[42,43].植物次生代谢产物含量受基因型、物候期和生态生理条件的影响[31].从饮食、营养和药学的角度来看,物候阶段被认为是影响代谢物质量和数量的最重要的决定因素,具有重要的意义[31].之前,我们报道了车前草不同植物部分(如叶子、种子和外壳)的比较代谢谱[45].在之前的报告中,人们揭示了这种植物的营养价值,并建议车前草的叶子可以用于蔬菜沙拉,作为日常食物的膳食补充剂[45].从车前草的叶子、种子和外壳中提取的多糖具有作为天然抗氧化剂和抗增殖活性的潜力[42,43].种子发育是车前草的一个重要过程。花和种子发育的特征是结构变化,如花的起始、花器官的形成、花的分化和生长,从而导致种子成熟[5].车前草的子实体是初级和次级代谢物的有效储藏库。水果的感官品质和营养品质取决于总代谢物的组成,它在整个发育阶段都有所不同[34].研究与特定代谢和自由基清除活性相关的发育阶段的化学成分将是非常重要的。然而,据我们所知,迄今为止还没有关于车前草发育子实体的代谢谱、清除分析和形态学研究。因此,本研究通过对正在发育的果实进行代谢谱分析,以确定潜在的亚麻籽子实体的候选或适宜的采收时间。本研究利用现代分析工具和技术,对发育果实的代谢组学和清除活性进行了分析[46包括气相色谱-质谱联用(GC-MS)、高效液相色谱(HPLC)和液相色谱-质谱联用(LC-MS)。本研究为深入了解车前草子实体发育过程中的形态、生化和代谢反应提供了依据。此外,本研究还将为亚麻籽果实采收时间的优化和健康效益的最大化提供指导。
结果
周裂蒴果发育的鉴别与解剖
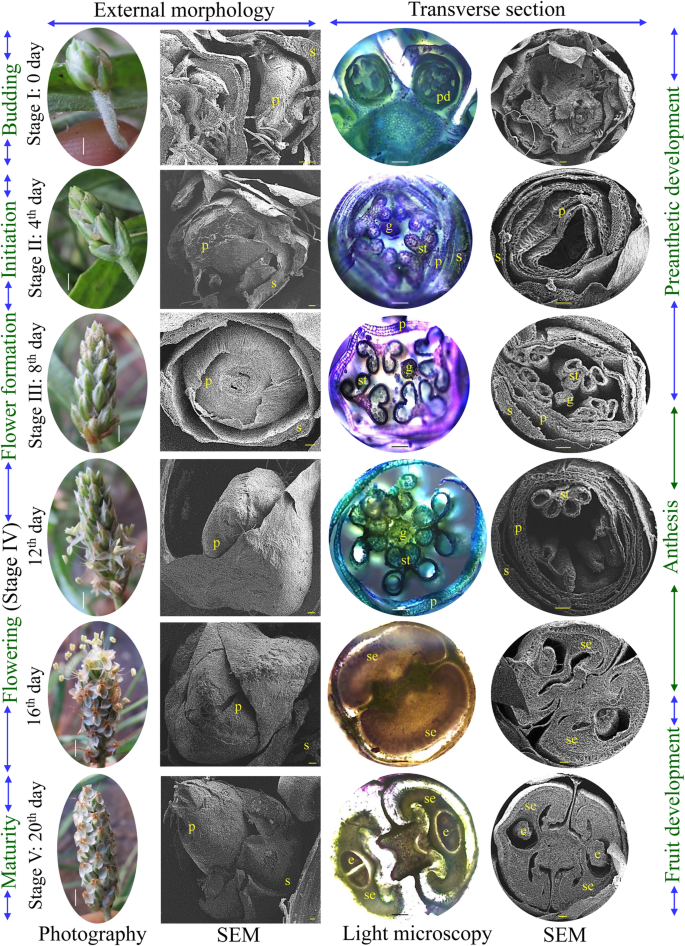
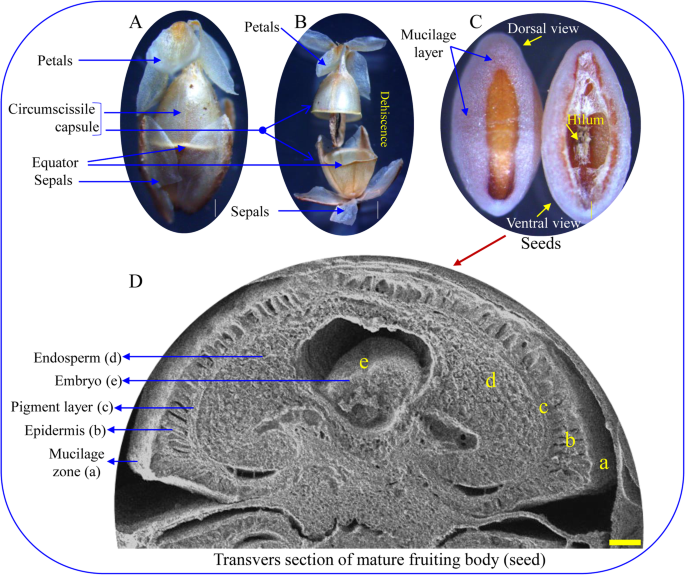
子实体的颜色在发育的不同阶段由绿色逐渐变为红色。一般来说,车前草果实在20天内成熟,并经历不同的发育阶段。1).共观察到5个阶段:花出芽期(ⅰ期;0天),花器官分化(ii期;第4天),花器官形成(iii期;第8天),花期(4期;第12 ~ 16天)和果实成熟期(v期;20天)。结果表明,花序原基起源于叶轴,后期发育为穗原基。在车前草中,一些花序从植株的基部上升(图。1).花很多,又小又白;在卵形或圆柱形穗状花序上排成四排螺旋状,由四个萼片、四个花瓣、四个雄蕊和一个雌蕊组成。萼片离生,凹,无毛和椭圆形,而花瓣无毛,反折和白色。前房子房离体,双房(每室单胚珠),轴胎座。在车前草中观察到花序的顶瓣型,即老花向基部生长,小花在生长端。花序发育早期(第1期,0天),穗长5 mm,横切面呈5花分化初期。其中3朵花萼片、花瓣和雄蕊发育,2朵花包含萼片和花瓣原基。花药在第II期(第4天)有4个雄蕊和雌蕊的起始,在发育后期(第III期,第8天以后)可以清楚地看到。种子开发了四期(12到16天)和水果达到成熟的20天(V)阶段发展。车前草的成熟的果实被称为周裂的胶囊,它是将水平分成两部分在裂开从赤道释放种子(图。2).腹股阶种子是半透明的,硬,黄棕色,光滑,船状和覆盖着粘液层。在种子的凹形(腹侧)侧被注意到Hilum的存在,用薄的白色膜覆盖(图。2).种子不发出任何气味,也没有任何味道,但多汁的部分是苦和涩的。成熟种子的横切面显示分化的胚乳、胚、色素层和表皮。2).
在发育子实体中差异合成的脂肪酸
对不同发育阶段(0、4、8、12、16和20 d)的车前草果实总脂和脂肪酸组成进行了测定1).饱和脂肪酸(SFA)含量在第I期(0 d;至成熟期(第8天),其含量最低(25.7%),随后逐渐增加,至成熟期(第20天),其含量达到33.7%。总多不饱和脂肪酸(PUFA)随着发育阶段的增加而增加,在第8天达到最大值(III期;72.5%),其后随发育阶段的增加而降低。在PUFAs中,C18 PUFAs占主导地位(48-71%),C20 PUFAs占主导地位,在发育子实体中痕量(约0.5-2%)。非饱和指数(UI)和非饱和程度(DU)呈悬链线曲线,在第III阶段(第8天)分别达到最大值188.3和146.9。
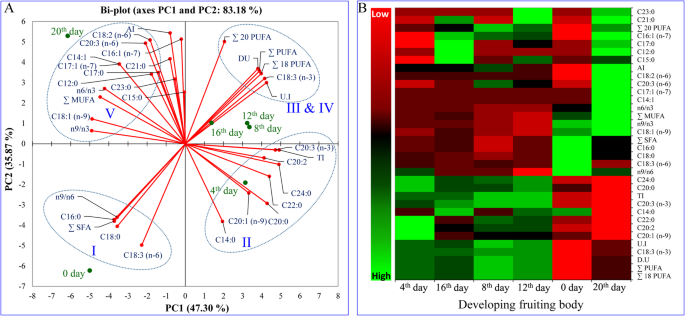
检测到一系列FAs (C12-C24),以亚油酸(C18:2, n-6;26-38%)、亚麻酸(C18:3, n-3或n-6;20-35%)和软脂酸(C16:0;20-32%)1).五种脂肪酸、棕榈酸(C16:0)、-亚麻酸(C18:3, n-6)、-亚麻酸(C18:3, n-3)、硬脂酸(C18:0)和独联体-11-二十烯酸(C20:1, n-9)随果实发育而降低。亚油酸(C18:2, n-6)随发育阶段增加,在果实成熟时达到最大值(38.8%)。四种脂肪酸,月桂酸(C12:0),肉豆蔻酸(C14:1),独联体-10-十七烷酸(C17:1, n-7)和三烷酸(C23:0)在发育后期(IV和V阶段;12 - 16日和20日)。值得注意的是,两种FAs肉豆蔻酸(C14:0)和独联体-11,14,17-二十碳二烯酸(C20:3, n-3)存在于果实发育的各个阶段,但在成熟阶段(V期,第20天)消失。在果实发育过程中,其余微量FAs未见明显变化1).主成分分析(PCA)表明,果实总脂和脂肪酸含量与果实的不同发育阶段存在显著的相关性,并在热图上显示了脂肪酸组成的差异(图2)。3.).
车前草果实总脂和脂肪酸的主成分分析和热图。一个根据表对数据矩阵的主成分分析得到双图1有两个主要组成部分。b差异合成总脂和脂肪酸的热图。所有实验共进行3次,每组3个生物重复,每个重复包含3个重复。热图中贴图的颜色(绿色、红色、黑色)代表数值从高到低的变化
基于PC1和PC2的双图显示了FA组成可能与不同发育阶段的联系,并解释了83.2%的变异(图2)。3.一种)。双图表明,总脂质和Fas被分成四簇。从发芽开始(第I阶段:0日)到成熟(第V阶段第20天),对FA组分进行显着转化。总体而言,PCA在发育阶段之间表现出脂质和FA组成的统计学意义。从阶段I(0天)到III阶段(通过第8天,第4天)有重大变化,但从第三阶段(第8天)到第四阶段没有显着相关(第12至第16天);此后,从第IV阶段(第12次至第16天)再次注意到显着的变化(第20天)。热图也支持这些观察结果,其显示出对FA和脂质组合物的显着差异(图。3.b)。
氨基酸成分揭示了颞代代谢途径
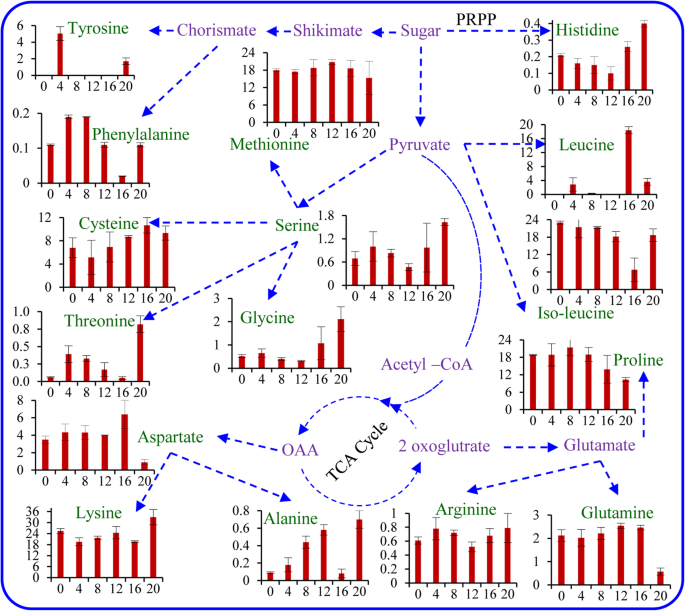
在总共6种氨基酸中,在蛋白质果实的不同显影阶段定量,并分为非必要,必需,富含富含芳族氨基酸(补充表S1).不同发育阶段的总氨基酸水平相似,并给出了可能的时间氨基酸途径(图。4).主要氨基酸为赖氨酸(20-33%)和异亮氨酸(7-23%),非必需氨基酸脯氨酸(10-21%)、富硫蛋氨酸(15-21%)和半胱氨酸(5-19%)。非必需氨基酸天门冬氨酸、谷氨酰胺和甘氨酸随着果实发育至花期(第4期,第12 ~ 16天)而增加;此后,在成熟期(V期,第20天)突然下降。丙氨酸、精氨酸和丝氨酸含量在不同发育阶段均出现突变,但在成熟期达到最大值。必需氨基酸组氨酸和苏氨酸也有类似的规律。而亮氨酸含量在果实发育第16天达到最大值。芳香氨基酸苯丙氨酸含量较低,而酪氨酸只在第4天和成熟期(即第20天)检出。成熟时丰富氨基酸脯氨酸、异亮氨酸和蛋氨酸的含量降低,赖氨酸含量升高。
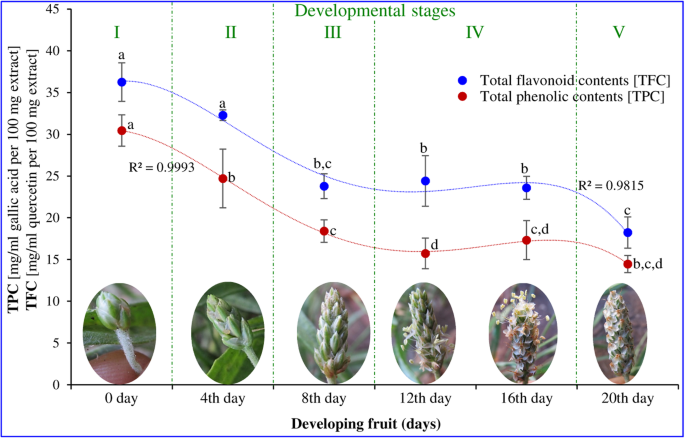
总酚和类黄酮含量随果实发育而降低
在芽引发阶段检测到最高总酚类和黄酮含量,之后它们随着发育阶段的增加而持续下降并在成熟度下达到最低限度(图。5).在统计上,四阶多项式趋势线(回归值约为0.99)清晰地划分了果实发育的不同阶段,并遵循逐渐减少的轨迹。
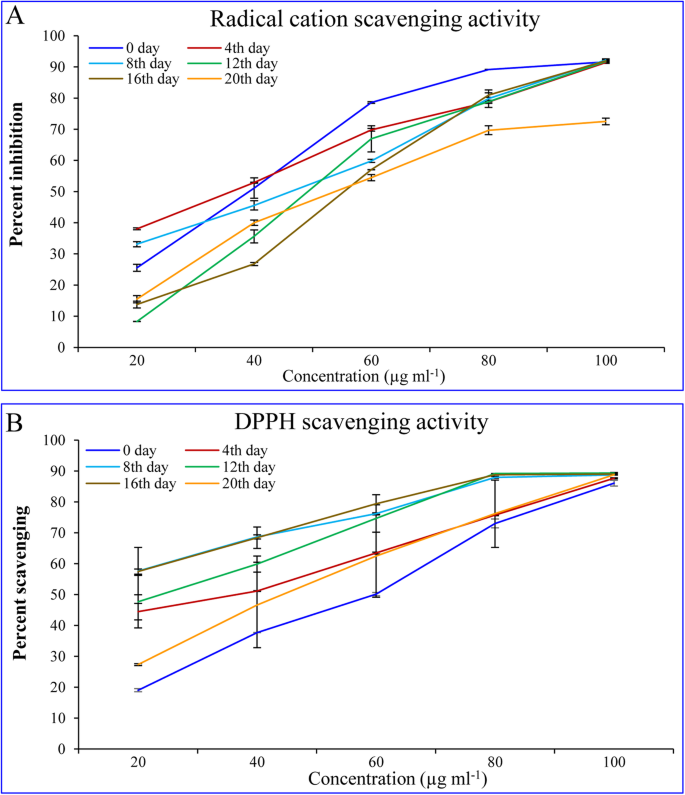
果实总抗氧化活性及清除活性
显影水果提取物的抗氧化和清除活性用提取物浓度(图伴随增加。6).总抗氧化活性(以%自由基阳离子ABTS·表示+在较低浓度范围(20 ~ 40 μg)中,清除活性在第4天(第4天)最高;在较高浓度范围(60 ~ 100 μg)中,清除活性在第1天(第0天)最高。在第4阶段(第12 - 16天),发育中的果实表现出相似的活性(94%),在此之后,以成熟果实提取物在最大浓度(100 μg)下观察到较低的活性(72%)。6a).果实提取物对DPPH的清除活性在发育第4阶段(第16天)最高,其次是第8天和第12天。100 μg提取物对所有发育子实体的清除活性约为88%。6b)。
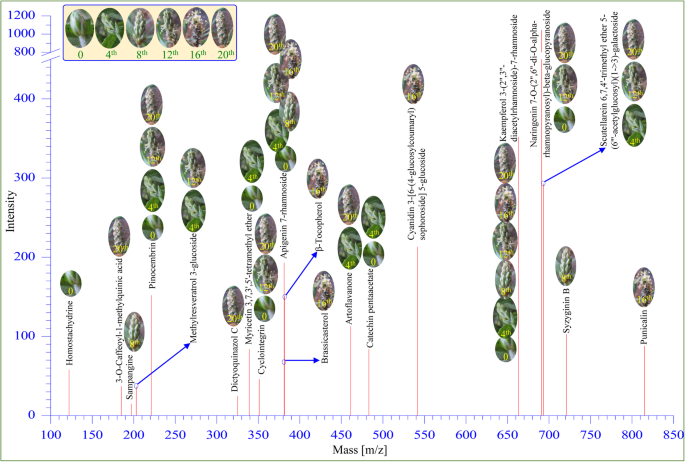
发育中的周裂胶囊的代谢物图谱
19种不同的代谢物(补充表S2在车前草果实的各个发育阶段(图。7).检测到10种具有抗氧化性能的黄酮类化合物和2种生物碱(补充表)S3.).芹菜素7-鼠李糖苷(m/z 381.10)和山酚3-(2″,3″-diacetylrhamnoside)-7-鼠李糖苷(m/z 663.19)存在于各个发育阶段。两种代谢物,五乙酸儿茶素(m/z 483.13)和杨梅素3,7,3 ',5 ' -四甲基醚(m/z 339.09)仅在发育早期(期0天和期4天)检测到。同样,两种代谢物sampangine (m/z 197.05)和syzyginin B (m/z 721.07)仅在III期(第8天)检测到。果实发育第4期(第16天)只检测到甘蓝甾醇(m/z 381.35)、花青素3-[6-(4-糖基香豆素)槐果苷]5-葡萄糖苷(m/z 541.66)、紫皮苷(m/z 815.1)和β-生育酚(m/z 381.35) 4种代谢产物。同样,两种抗氧化代谢产物——双喹啉C (m/z 325.1)和3-O-Caffeoyl-1-methylquinic acid (m/z 185.061)仅在成熟果实(V期,第20天)中被鉴定出来。其余代谢产物的含量随果实发育阶段的不同而不同。
讨论
开花植物具有丰富的花组织和广泛多变的形态特征。花的发育是一个高度协调的现象,是模式植物的代谢组学拟南芥揭示了不同的代谢途径在花发育的不同阶段受到刺激[37].器官发育和花或果实发育特征的结构变化归因于花芽起始、花器官起始、花分化和生长导致种子成熟[5].
Plantago花是辐射对称的,花的系统发育位置Plantago使其成为研究与背侧特异cyc样基因功能缺失相关的分子发育机制的模型系统[50].Protogynous是最显著的特征Plantago生长状况开花,花药成熟前柱头渗出并接受。在本研究中,观察到花序的顶花型[52花药在第II期(第4天)发育,雌蕊在第III期(第8天)发育。1).成熟后(V期,第20天),典型的车前草果实发育为周裂蒴果,蒴果小,卵形,沿赤道水平开裂(图2)。2).通常,萼片和花瓣附着在蒴果上,成熟的种子被含有脐的黏液层覆盖。蒴果(果)是一个小的壳,被宿存的花冠所覆盖[52].
车前草植物的不同部分,包括叶子、种子和外壳,被认为是必需FAs(即营养不饱和脂肪酸)的丰富来源[45,这些物质不能在人类体内从头合成,因此需要从食物中提取[16.].研究发现,发育中的果实富含ω-3 α -亚麻酸(ALA)、ω-6亚油酸(LA)和γ -亚麻酸(GLA)。类似于的发展Camelina Sativa在水果中,大多数早期阶段的脂肪酸谱与成熟阶段的不同[51].双图数据矩阵揭示了FAs与不同发育阶段之间的相关性(图。3.).从一个发育阶段到另一个发育阶段,脂质和脂肪酸组成发生了显著的变化Camelina Sativa[51].先前的双向作图分析证实不同植物部分之间在脂质和FA组成统计学差异显著[45].
在发育的早期阶段,检测到高水平的SFA,在后期(成熟时)下降。相比之下,在发育中期的中间阶段(表格)在中间阶段(表1).在PUFAs中,ALA具有广泛的生物活性,如促智和预防作用,包括抗高脂血症、抗炎、抗血栓和抗高血压作用[16.,23.].高的致动脉粥样硬化指数(AI)有利于脂质与细胞的粘附;相反,较低的AI值会抑制酯化脂肪酸的聚集和水平。同样,血栓形成指数(TI)也表明了SFA和UFA在血管中形成血栓方面的关系。高值促进凝血,而低值导致抗血栓形成(抗凝)特性。
有许多自然发生的生物活性肽具有用于药物开发的潜力[19.].在车前草果实不同发育阶段共鉴定和定量了16种初级代谢产物(氨基酸)(补充表)S1).氨基酸水平与果实发育一致,揭示了可能的颞氨基酸途径(图。4).从不同的植物中发现了氨基酸的空间分布,包括孜然,蓬子和Plantagospp。33,39,45].与前车之马果实发育过程中观察到的结果相似,在番茄发育早期,部分氨基酸增加,部分氨基酸减少;另一方面,在草莓和桃子的发育过程中发现某些氨基酸的含量增加[6,15.,30.].必需氨基酸赖氨酸(20-33%)和异亮氨酸(7-23%)在所有发育阶段均占主导地位。与其他氨基酸相比,富硫蛋氨酸(15-21%)和半胱氨酸(5-19%)含量较高。同样,在番茄和草莓的果实发育和成熟过程中,蛋氨酸水平也没有显著变化[38,64].非必需氨基酸天门冬氨酸、谷氨酰胺和甘氨酸随着果实发育而增加,但在成熟期下降,而丙氨酸、精氨酸、丝氨酸、组氨酸和苏氨酸在成熟期含量最高。主要氨基酸丝氨酸、甘氨酸、谷氨酸、谷氨酰胺和亮氨酸在种子发育过程中均有检测答:芥[3.].氨基酸丙氨酸、甘氨酸、丝氨酸、亮氨酸、赖氨酸、苏氨酸和半胱氨酸在发育后期(第四和第五阶段;第12 ~ 16天和第20天),推测这些物质参与蛋白质的生物合成。此外,它们还可以作为许多重要代谢途径的前体。
在天然抗氧化剂中,广泛分布的植物类黄酮和酚类成分值得重视,因为它们参与植物细胞防御系统,因此被认为是有效的抗氧化剂[13.,33,57].腹股沟植物部件含有较高的总黄酮和总酚的含量,并具有高抗氧化和清除活性[45].在本研究中,总酚和类黄酮的含量随果实的发育阶段而降低。5).同样,总抗氧化活性和清除活性随果实发育的不同阶段而变化。6).不同发育阶段的愈伤组织离体培养P. Ovata.,总抗氧化活性和清除活性随酚类和黄酮类含量的增加而增加[56].这些结果符合清除和抗氧化活动Plantago与酚类和类黄酮含量直接相关的多糖[42,43,45].The loading plot of primary metabolites, total flavonoids and phenolic contents confirmed the shift in metabolites from stage I (bud initiation, 0 day) to stage V (maturity, 20th day) through different intermediates (Supplementary FigureS1).
在车前草果实的发育过程中,观察到几种代谢变化。7和补充表S3.).19种鉴定出的代谢物(补充表S2)、花青素甾醇、花青素3-[6-(4-糖香豆素基)槐果苷]5-葡萄糖苷、紫皮苷和β-生育酚等4种仅在花期(第4期,第16天)检测到。植物甾醇主要存在于植物油中。甘蓝甾醇是一种游离甾醇,它在食物中具有天然的抗氧化活性[9,36],而2种抗氧化代谢物-双喹啉C和3- o -咖啡酰-1-甲基奎尼酸(MCGA3)仅在成熟期(V期,第20天)检测到。同样,3-O-Caffeoyl-1-methylquinic acid具有较强的自由基清除能力和抑制脂质过氧化作用[27.),第一次以竹子(植被类型).有趣的是,两种代谢物,五乙酸儿茶素和杨梅素3,7,3 ',5 ' -四甲基醚,尤其在早期(期I, 0天和期II, 4天)发现。黄酮类化合物芹菜素7-鼠李糖苷和山酚3-(2″,3″-diacetylrhamnoside)-7-鼠李糖苷在各个发育阶段均存在。大多数次生代谢产物,包括山奈酚、儿茶素和杨梅素,都是类黄酮,并具有有效的抗氧化活性[18.,45].其他代谢物差异检测;然而,匹诺曹胚素在发育的早期和晚期都能检测到。多项研究证明了木豆素在体内外的应用,表明木豆素是一种具有潜在抗氧化、抗炎、抗肿瘤和抗菌特性的良好药理药物[48].此前,在车前草的不同植物部位观察到代谢物的空间发生[45].类似地,空间和发育组合代谢组学在甜瓜果实中被报道,揭示了广泛的代谢交叉[34].他们证明了水果不同发育阶段的代谢物的空间组成,这些代谢物被归因于水果的感官和营养品质[34].
结论
此前,为发育过程建立了代谢产物和蛋白质复杂网络的显著变化[5,30.].在本研究中,通过代谢组学的时间依赖性比较研究,包括初级代谢产物(FAs和氨基酸)、次级代谢产物、总黄酮和总酚含量的分析,揭示了果实发育遵循不同的代谢程序。不同的生化过程和活性(抗氧化和清除)随着发育阶段的发展而发生变化,并与相关代谢物呈现同步的联系。重要的长链PUFAs,如LA, ALA, GLA和AA,具有各种生物医学和营养的应用。据我们所知,这是对亚麻籽子实体发育过程中代谢谱和清除活性的首次研究。综上所述,亚麻子实体的发育是进一步探索其营养应用的潜在候选植物。进一步的研究将集中在验证已鉴定的代谢产物,并将其与转录组学数据进行整合,从而揭示车前草果实发育的代谢调控网络。
方法
采集植物材料和样品
的种子Plantago ovata品种IS-3,购自印度古吉拉特邦马哈萨纳Jagudan种子香料研究站,在一块空地上播种(两块包含花园土壤,每块面积为63 × 36英寸),在自然农业气候条件下种植[45].每个地块由八行组成,每行大约有八株植物。车前草作物按标准商业惯例进行保养[24.].在不同的发育期(0-20 d)采集车前草子实体,在液氮中进行代谢组学和ROS清除研究,而在形态研究中,样品在FAA(甲醛(40%):乙酸:乙醇(70%);5:5:90, v / v / v)。
Eidonomy和解剖学研究
花发育用简单摄影(DSLR,EOS760D,佳能,日本)和低温扫描电子显微镜(低温SEM,JSM-7600F,JEOL,日本)形态学研究。The FAA preserved flower buds were dehydrated in ethanol (50 to 100%), cut into 5 μm thickness using microtome (MT-3, Nippon, Japan) and transverse sections were stained with 0.25% safranin. Sections were examined under light microscope (Axio imager M1, Carl Zeiss, Germany). For cry-SEM, FAA preserved samples were dehydrated in ethanol (50 to 100%), frozen and cryosectioned by using attachments of cryo-SEM and analysed. All images were captured under different magnifications. The morphology of mature seed and dehiscence were studied under compound microscope (Olympus SZX2-ILLD, Tokyo, Japan), whereas the transverse section of mature fruiting body was observed with cryo-SEM.
初级代谢产物分析
脂质提取和脂肪酸分析
用氯仿-甲醇(1:2 v/v)提取法从保存的样品(1 g生物量)中提取总脂[41].总脂质通过转甲基化转化为相应的脂肪酸甲酯[33].样品用氢氧化钠(1% v/v甲醇;1毫升),然后在55°C水浴中孵育15分钟。之后,甲醇HCl (5% v/v;加入2ml),并在55°C进一步加热15分钟。去离子水-己烷混合物(1:2;加入3 ml),得到相分离。在正己烷(2ml)中提取,N2溶解于己烷(200 μl)中。FAME样品通过配备自动进样器(AOC-5000)和火焰离子化检测(FID)/毛细管柱的气相色谱-质谱联用仪(GCMS-QP2010,岛津,日本)进行鉴定和定量,使用以前优化的方法[33,39].
总饱和脂肪酸(SFA)和不饱和脂肪酸(单不饱和脂肪酸,MUFA和多不饱和脂肪酸,PUFA)通过相应脂肪酸的百分数之和进行量化[41].未饱和指数(方程1)[47,非饱和度(方程2)[63),患(方程3.)和血栓形成(方程4)指数11.]用下列公式计算-。
氨基酸分析
基于苯异硫氰酸酯(PITC)衍生化方法的高效液相色谱系统(Waters Alliance模型,带有自动进样器的2996分离模块,美国)对氨基酸进行鉴定和定量[26.].采用三氯乙酸(TCA)沉淀法从保存的子实体(1 g)中提取总蛋白。每个样品的总蛋白在密封的玻璃容器中用HCl (6N, 500μl)水解,在烘箱中110℃加热24h。水解后,容器被打破,蛋白质样品在干燥器中真空干燥。添加乙醇-水-茶(三乙胺)(2:2:1 v/v/v;500μl)。样品通过加入乙醇-水-茶- pitc (7:1:1:1 v/v/v/v;500μl)。将反应混合物适当旋转,室温保存20min,真空干燥。干燥的样品在钠中溶解2HPO4缓冲(400μl;5mM, pH 7.4)含乙腈(5% v/v)。每个样品用0.2 μm膜过滤,用高效液相色谱分析氨基酸组成[32].
植物提取物制备
植物样品(10 g)在液体氮中研磨2,转移至甲醇水溶液(70%,v/v),保存过夜提取。8000 rpm离心10 min,收集上清。植物提取物在旋转蒸发器(150-100 mbar, 37°C)中浓缩,冻干,在−20°C保存,以供进一步研究。
为测定总酚含量、类黄酮含量、抗氧化活性和清除活性,将样品(植物提取物)的吸光度值与已知量的相应标准品用相同方法绘制的标准曲线进行比较。所有试验均为3个重复,每个重复包含3个生物重复,值以平均值±SE表示。
总酚和总黄酮含量的测定
采用Folin-Ciocalteu (FC)试剂(Sigma-Aldrich, USA)以没食子酸为标准测定提取物总酚含量[22.,33].福林-恰卡图试剂(2.5 ml 0.2 N)与提取液混合,孵育5min,反应后加入2ml碳酸钠(Na2有限公司3;75 g l−1).反应混合物在室温下进一步孵育90分钟,在760 nm处吸光度。总酚含量计算为mg ml−1没食子酸每100毫克提取的标准曲线。
确定总黄酮含量,0.3毫升纳米2(5%, v/v)加入提取液,室温孵育5 min,加入0.3 ml AlCl3.(10%, v/v)和2ml NaOH (1 M)。用水稀释反应混合物,在510 nm处记录吸光度。总黄酮含量计算为mg ml−1从标准曲线中提取的每100毫克槲皮素[57,66].
总抗氧化和清除活性
通过比较ABTS测定植物提取物的总抗氧化活性.+(2,2′-偶氮双-(3-乙基苯并噻唑啉-6-磺酸)自由基阳离子清除能力[22.,49,58].ABTS自由基阳离子由ABTS二铵盐(7 mM)溶液与过硫酸钾(2.45 mM)混合生成,然后在室温黑暗中培养12-16小时。ABTS的初始吸光度.+溶液(在735 nm处)用水稀释至0.70±0.02。稀释abt.+溶液(1 ml)与不同浓度的植物提取物或标准品(1 ~ 5 μg ml)混合−1拖车)。孵育后735nm记录吸光度;计算抑制率,并通过与用作标准的Trolox进行比较来测量自由基阳离子清除活性。
DPPH(2,2 -二苯基-1-苦基肼基)是一种自由基,由于抗氧化剂具有清除自由基的活性,DPPH由深紫色变为淡黄色的非自由基形式。清除试验是通过测量DPPH溶液的颜色变化来进行的[53].DPPH原液(0.024% w/v,甲醇)的初始吸光度在517 nm处用甲醇稀释,约为0.98±0.02。DPPH工作液(3ml)与不同浓度的提取物混合,室温黑暗孵育过夜。记录在517 nm处的吸光度,并用公式计算DPPH自由基清除活性5.
次级代谢物的提取与鉴定
将结果体(100mg)的每个阶段以液体n均化2代谢产物在冰冷的甲醇水溶液中提取(70%,v/v),然后漩涡提取[45].样品在超声水浴(MRC, Holon, Israel)中保存一小时(频率为40 kHz;25°C)。2万rpm, 25℃,离心10 min,收集上清,0.2 μm膜过滤。过滤后的溶液在正离子模式下使用LC与TOF MS/MS系统(Micromass, Waters, USA)进行代谢物分析[12.].扫描范围为0 ~ 1000 m/z,采集速率为0.25 s,扫描间隔延迟为0.1 s。使用Mass Lynx 4.1版软件(Micromass, Waters, USA),减去每个光谱的背景,对数据进行平滑、中心化和峰值集成。利用在线数据库比较LC-TOF-MS/MS峰来鉴定代谢物[67].
统计分析
所有实验共进行3次,每一次有3个生物重复组,每个重复组包含3个重复(共27个样本,采用3 × 3 × 3模式进行研究)。对每个实验的数据进行方差分析(ANOVA),以确定差异,并用均数±SE(均数的标准误差)表示。统计学意义在p ≤ 0.05使用Tukey的多重比较方法,处理中显著不同的平均值用不同的字母表示。采用主成分分析(PCA)对总脂质组成进行统计分析,并生成热图。利用脂类数据集生成Pearson相关矩阵,推断PCA和各自的热图[55,61使用不同的软件,包括西格玛图。12), SYSTAT(版本。13)和起源15)。
数据和材料的可用性
数据集使用和/或可从上合理请求对应的作者目前的研究中进行分析。
缩写
- abt:
-
(2, 2’-azinobis) - 3-ethylbenzothiazoline-6-sulfonic酸
- 人工智能:
-
Atherogenicity指数
- 阿拉巴马州:
-
α-亚麻酸
- 方差分析:
-
方差分析
- DPPH:
-
2, 2-diphenyl-1-picrylhydrazyl
- 杜:
-
不饱和度
- 费尔南多-阿隆索:
-
脂肪酸
- GC-MS:
-
气相色谱分析-质谱法
- 杯子:
-
Gamma-linolenic酸
- 高效液相色谱法:
-
高效液相色谱法
- 拉:
-
亚油酸
- 质:
-
液相色谱-光谱法
- MUFA:
-
单不饱和脂肪酸
- 主成分分析:
-
主要成分分析
- PUFA:
-
多不饱和脂肪酸
- ROS:
-
活性氧
- 扫描电镜:
-
扫描电子显微镜
- 国家林业局:
-
饱和脂肪酸
- TI:
-
Thrombogenicity指数
- 界面:
-
未饱和指数
参考
- 1。
Al-Fayez M, Cai H, Tunstall R, Steward WP, Gescher AJ。推测的癌症化学预防黄酮类化合物三聚氰胺、芹菜素和槲皮素对环氧化酶介导的前列腺素生产的差异调节。Cancer Chemother Pharmacol. 2006; 58:816-25。
- 2。
植物和农工业副产物中的酚类化合物:抗氧化活性、发生和潜在用途。食品化学。2006;99:191 - 203。
- 3.
陈志强,陈志强,陈志强,等。植物种子发育的综合研究进展拟南芥生态型WS。植物生理生化。2002;40:151-60。
- 4.
Beara IN, Lesjak MM, Jovin ED, Balog KJ, Anačkov GT, Orvcicì DZ, Mimica-Dukic NM。车前草(Plantago黄酮类抗氧化剂的新来源。中国农业科学(英文版)2009;57:9268-73
- 5.
Bellaire A, Ischebeck T, Staedler Y, Weinhaeuser I, Mair A, Parameswaran S, Ito T, Schönenberger J, Weckwerth W.代谢和发育-整合微计算机断层扫描数据和代谢谱揭示了从花开始到角子发育的代谢重编程。新植醇。2014;202:322-35。
- 6.
番茄果实发育的代谢调控。J Exp Bot. 2006; 57:1883-97。
- 7.
Chaturvedi Ak,Patel Mk,Mishra A,Tiwari V,JHA B.的SbMT-2一个盐生植物基因在转基因烟草中具有非生物胁迫耐受性并调节活性氧清除。《公共科学图书馆•综合》。2014;9:e111379。
- 8.
《药用植物百科全书》。伦敦:英国多林金德斯利有限公司制造书籍;1996.p。336。
- 9.
崔e, Min DB。抗氧化剂在食物氧化中的作用机制。食品科学与食品安全。2009;8(4):345-58。
- 10。
Cook NC, Samman S.类黄酮-化学、代谢、心脏保护作用和饮食来源。生物化学学报1996;7:66-76。
- 11.
De Lorenzo A, Petroni ML, De Luca PP, Andreoli A, Morini P, Iacopino L, Innocente I, Perriello G.质量控制指标在中度低热量地中海饮食治疗肥胖中的应用。糖尿病营养杂志2001;14:181-8。
- 12.
De Vos RC, Moco S, Lommen A, Keurentjes JJ, Bino RJ, Hall RD.使用液相色谱-质谱联用的非靶向大规模植物代谢组学。Nat Protoc。2007;2:778 - 91。
- 13.
Embuscado我。香料和草药:抗氧化剂的自然来源 - 迷你评论。J Funct Foods。2015; 18:811-9。
- 14.
黄芪皂苷的研究Plantago主要.《化学制药公牛》1981;20:1000-4。
- 15.
陈志强,王志强,王志强,王志强。草莓果实发育过程中瘦果和花托代谢网络的重构。植物杂志。2008;148:730-50。
- 16.
粮农组织:粮食及农业组织。人体营养中的脂肪和脂肪酸。见:粮农组织专家磋商会报告。罗马:联合国粮食及农业组织;2010.
- 17.
黄酮类化合物与双子叶植物的进化。In: Harborne JB,编辑。黄酮类化合物:1980年以来的研究进展。Bostan:施普林格;1988.p . 479 - 504。
- 18.
黄酮功能植物。在Andersen M, Markham KR编辑。黄酮类化合物:化学、生物化学及应用。博卡拉顿:CRC出版社;2006.p . 397 - 441。
- 19.
作为药物的多肽:发现和发展。Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA;2009.
- 20.
活性氧对组织的损伤及黄酮类化合物的保护作用。方丹临床药理学杂志1998;12:249-55。
- 21。
黄酮类化合物。Bostan:施普林格;1975.
- 22。
哈兹拉B,Biswas的S,曼德尔N.抗氧化和自由基清除活性Spondias pinnata.BMC补充另外MED。2008; 8:63。
- 23。
英尼斯SM。膳食(n-3)脂肪酸与脑发育J减轻。2007;137:855-9。
- 24。
Jat RS, Reddy RN, Bansal R, Manivel P.伊莎贝尔的良好农业规范。药用芳香植物研究理事会;2015.
- 25.
Joshi M, Jha A, Mishra A, Jha bSBNHX1.一种在盐碱地栽培的极端盐生植物的基因。《公共科学图书馆•综合》。2013;8:e71136。
- 26.
关源P,波顿JW。用吡c衍生化法对大豆进行氨基酸分析,可准确测定半胱氨酸和半胱氨酸。石油化学学报2010;87:127-32。
- 27.
kwon MH, Hwang HJ, Sung HC。新型竹绿原酸衍生物的鉴定及其抗氧化活性(植被类型).农业食品化学。2001;49(10):4646-55。
- 28.
黄酮和环烯醚萜类化合物Plantago主要和p . asiatica.Rast Resur。1980; 16:403-6。
- 29.
李春庆,李春青,李春青,李春青,黄酮类、单萜类、三萜类、环烯醚萜苷类和酚类化合物的免疫调节活性Plantago物种。Planta Med。2003; 69:600-4。
- 30.
Lombardo VA, Osorio S, Borsani J, Lauxmann MA, Bustamante CA, Budde CO, Andreo CS, Lara MV, Fernie AR, Drincovich MF。桃果实发育和成熟过程中的代谢谱揭示了支撑每个发育阶段的代谢网络。植物杂志。2011;157:1696 - 710。
- 31.
马瑞丽,门尼替尼,Stattia GA, Bonesia M, Duezc P, Menichinia F, Conforti F.酚类和亲脂成分的变化,酶抑制和抗增殖活性Ficuscarica L.品种多塔朵成熟期间的果实。食品化学毒物。2012;50:726-33。
- 32.
Mishra A,JHA B.来自微藻细胞外聚合物物质的分离和表征杜氏盐胁迫下。Bioresour抛光工艺。2009;100:3382-6。
- 33。
非靶向代谢组学和活性氧清除活性揭示了其潜在的抗氧化能力蓬子有腕门作为功能性食品。功能性食品。2015;13:21-31。
- 34。
Moing A, Aharoni A, Biais B, Rogachev I, Meir S, Brodsky L, Allwood JW, Erban A, Dunn WB, Kay L, de Koning S. spatial and developmental组合代谢组学揭示甜瓜果实的广泛代谢交叉。新植醇。2011;190:683 - 96。
- 35。
Moore DM,Williams CA,Yates B. Bipolar Disjunt物种II的研究。Plantago maritima.机器人Notiser。1973;125:261 - 72。
- 36。
橄榄油氧化。在:Aparicio R, Harwood JL,编辑。橄榄油手册:分析和性能,第二版,纽约:施普林格;2013.p . 479 - 522。
- 37.
中村Y,张志贤NZ,拐G,蔡氏CH,畅WF,Parameswaran S,小泉R,太田H,温克MR,伊藤T.转录组和期间甘油脂的脂质组简档拟南芥花的发育。新植醇。2014;203:310-22。
- 38.
Osorio S, Alba R, Nikoloski Z, Kochevenko A, Fernie AR, Giovannoni JJ。综合比较分析了辣椒和番茄成熟和发育阶段的转录和代谢谱,揭示了物种特定的网络调控行为模式。植物杂志。2012;159(4):1713 - 29。
- 39.
小茴香的生理生化组成和非靶向代谢组学研究(Cuminum Cyminum L.)使其成为有前途的功能性食品,并有助于减轻盐胁迫。《公共科学图书馆•综合》。2015;10:e0144469。
- 40.
Pandey S,Patel Mk,Mishra A,JHA B.在足底改变了孜然(Cuminum Cyminum L.),过表达SbNHX1基因表现出更高的耐盐性。《公共科学图书馆•综合》。2016;11 (7):e0159349。
- 41.
Patel MK, Pandey S, Brahmbhatt HR, Mishra A, Jha B.所选盐生植物的脂质含量和脂肪酸谱揭示了一种有前景的可再生能源。生物质生物能源。2019 b; 124:25-32。
- 42.
从车前草中提取的多糖的物理化学、清除和抗增殖分析(Plantago ovata(Forssk)壳和种子。Int J Biol Macromol. 2019a;
- 43.
陈志强,陈志强,陈志强,等。车前草(P. ovata)叶片多糖的理化性质、抗氧化和抗增殖活性研究。国际生物学杂志。2018;118:976-87。
- 44.
SbNHX1基因在转基因蓖麻中的异位表达(里纳斯Communis L.。)通过调节生理过程来增强盐胁迫。acta botanica yunnanica(云南植物研究);2015;
- 45。
Patel MK, Mishra A, Jha B.非靶向代谢谱和清除活性揭示了车前草的营养价值(Plantago ovataFORSK)。前植物SCI。2016a; 7:431。
- 46。
陈志强,王志强,王志强,等。盐生植物非靶向代谢组学研究进展。In: Kim S,编辑。海洋组学:原理与应用。博卡拉顿:CRC出版社;2016 b。309 - 25页。
- 47。
研究表明,脂肪酸的分布具有一定的规律性衣藻作为在极酸性条件下营养状况和温度的标志。活细胞生态。2004;48:78 - 89。
- 48。
一种具有多种药理活性和生物活性的天然化合物——皮诺曹苷。BioMed Res Int. 2013;379850。
- 49.
杨敏,杨国华,杨国华。基于ABTS自由基脱色法的抗氧化活性研究。自由基生物医学1999;26:31 31 - 7。
- 50.
Reardon W, Fitzpatrick DA, Fares MA, Nugent JM。花的形状在进化Plantago生长状况.植物学报。2009;41:241 - 50。
- 51.
Rodríguez-Rodríguez MF, Sánchez-García A, Salas JJ, Garcés R, Martínez-Force eCamelina Sativa种子。作物学报。2013;50:673cc9。
- 52.
罗斯,我,卵形车前草。在:世界药用植物:化学成分,传统和现代药用用途。卷3。风险:胡玛纳出版社;2005.419 - 36页。
- 53.
Saeed N,Khan Mr,Shabbir M.抗氧化活性,全植物提取物的总酚类和总黄酮含量Torilis leptophyllaL. BMC Complement Altern Med. 2012;12:221。
- 54.
传统用途,化学成分和生物活性大车大号.复习一下。J Ethnopharmacol。2000;71:1-21。
- 55.
一种新的转录因子样基因SbSDR1作为一个分子开关,赋予转基因烟草耐盐和渗透能力。Sci众议员2016;6:31686。
- 56.
陈志强,王志强,王志强,等。黄芪离体愈伤组织培养过程中酚类化合物的抗氧化活性及高效液相色谱分析Plantago ovata外源添加剂对酚类化合物积累的影响。中国农业科学(英文版)。
- 57。
Tanna B, Brahmbhatt HR, Mishra A.酚类、类黄酮和氨基酸组成表明,选定的热带海藻有潜力成为功能性食品成分。食品加工保鲜。2019;43(12):e14266。
- 58。
陈志强,陈志强,陈志强,等。海藻的抗氧化、清除和抗增殖活性研究进展。中国海洋大学学报(自然科学版)2018;
- 59。
泰国QD, Tchoumtchoua J, Makropoulou M, Boulaka A, Meligova AK, Mitsiou DJ, Mitakou S, Michel S, Halabalaki M, Alexis MN, Skaltsounis LA。植物化学研究及化学成分的生物学评价法国梧桐胶和法国梧桐×acerifolia味蕾。植物化学,2016;130:170 - 81。
- 60.
Tiwari v,Chaturvedi Ak,Mishra A,JHA B.迟钝SbASR-1从盐生植物克隆的基因蓬子有腕门增强转基因地生中的盐度和干旱耐久性(落花生hypogaea),并作为转录因子。《公共科学图书馆•综合》。2015;10:e0131567。
- 61.
细胞内非生物应激反应通用应激蛋白的过表达(某人USP)减轻盐和渗透胁迫转基因烟草植株。植物学报2016;7:518。
- 62.
杨玲,陈强,王芳,张刚五角对.J Ethnopharmacol。2011;135:553-60。
- 63.
于旭,赵鹏,何超,李军,唐旭,周军,黄志军。一种新型菌株的分离Monoraphidium并对其作为生物柴油原料的潜在应用进行了表征。Bioresour抛光工艺。2012;121:256 - 62。
- 64.
张建军,王旭,于欧,唐建军,顾旭,万旭,方超。草莓果实发育和成熟过程中代谢特征的研究。中国农业科学(英文版)。2010;62(3):1103-18。
- 65.
张伟,李超,尤丽娟,付旭,陈永山,罗玉强。化合物的结构鉴定Toona sinensis具有抗氧化和抗癌活性的叶子。功能性食品。2014;10:427-35。
- 66.
王志深,田孟成,魏建明。桑树中黄酮类化合物含量的测定及其对超氧自由基的清除作用。食品化学。1999;64:555-9。
- 67.
朱ZJ,舒尔茨王,王家,约翰逊Ch,yannone sm,帕蒂gj,苏齐达克,液相色谱quadrupole飞行时间的梅尔林数据库引导的代谢物的特征。NAT PROTOC。2013; 8:451-60。
致谢
CSIR-CSMCRI没有沟通。取了72/2016。分析和环境科学部和中央仪器设施,特别是Harshad Brahmbhatt博士在帮助运行样品进行分析分析方面得到了充分的认可。
资金
印度政府科学和工业研究理事会(CSIR),新德里。资助机构没有参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
构思并设计了实验:AM和BJ。进行实验:MKP和SJ。分析数据:MKP和AM。写了论文:AM和MKP。所有作者均已阅读并批准本稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
车前草发育子实体氨基酸组成。
附加文件2:表S2。
椎间盘碱发展果实中鉴定的代谢产物的基本化学结构。
附加文件3:表S3。
用LC-MS (+ve模式)鉴定了车前草果实发育过程中可能的代谢产物。
附加文件4:图S1。
基于(A)脂肪酸组成、(B)氨基酸、(C)总黄酮和酚含量的PC分析(PCA)负荷图。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
帕特尔,M.K.,米什拉,A.,杰斯瓦尔,S。et al。车前草周裂果实发育代谢谱及清除活性研究(Plantago ovata揭示了初级和次级代谢物的变异。BMC植物杂志20.116(2020)。https://doi.org/10.1186/s12870-020-2318-5
收到了:
接受:
发表:
关键字
- Isabgul
- 代谢产物分析
- Plantago
- 亚麻籽
- 清除活动