抽象的
背景
Glycoalkaloids是生物活性化合物,有助于植物对食草动物攻击和发病机制的防御反应。溶于植物,包括栽培和野马铃薯物种,是甾体甘油酸碱的来源。Solanum.植物在器官中甘油碱的含量和组成不同。在野生和栽培的马铃薯物种中,识别出超过50个甾体甘油碱。甾体甘油碱被认为是可能改变靶植物的生长的潜在化合物/植物毒素化合物。关于组合物对植物毒性潜力的影响有限的数据。
结果
马铃薯叶片提取物中α-茄碱和α-茄精的存在表明提取物具有较高的植物毒性。在高毒势和低毒势马铃薯叶块差异表达基因中,高毒势样品中上调最多的转录本是花青素5-芳香酰基转移酶样和枯草杆菌素样蛋白酶sbt1.7 -转录变种X2。下调最多的基因是碳酸酐酶、叶绿体样基因和奇迹素样基因。差异表达蛋白分析显示,与应激和防御相关的蛋白群最为丰富,包括葡聚糖内切-1,3- β -葡萄糖苷酶酸性亚型,其在低毒马铃薯叶片提取物中的表达量高47.96倍。
结论
糖生物碱含量低的马铃薯叶片提取物的植物毒性是由这些化合物在叶片提取物中的特定组成决定的,其中α-茄碱和α-茄精可能发挥重要作用。差异表达的基因和蛋白谱与糖生物碱合成途径在植物毒性潜能的表达不一致。我们不能排除这种植物毒性可能受到其他拮抗作用或可能减少糖生物碱作用的化合物的影响。
背景
一致性地理解的现象是指有机体(植物,细菌,病毒和真菌)之间的多向相互作用,其涉及释放称为来自化学物质的化合物进入环境[1].供体和受体植物之间的植物化感化物质主要是阴性的,危害植物生长,发育和/或发芽。合成和释放化感化合物的能力,特别是在植物植物和植物 - 病原体相互作用中,是重要的重要方面,因为它决定了生物应激期间的植物存活和适当的发育[2]. 为了区分生态系统中的化感作用和实验室中的化感作用相互作用,我们使用了“植物毒性”一词,描述了供体和受体之间的负相互作用[1].很多实验室研究专注于识别植物毒性潜在利用水提取物作为植物毒性因子。水提取物最近的植物器官的化合物浸出,在自然条件下发生(雨水浸出)[3.那4.].
异教育相互作用的整体组分是来自衍生自三种生物合成途径的次生代谢物:Shikimate,异戊二烯/甲戊酯和聚酮化合物途径[5.].基于其来源,次级代谢物可分为三组:苯丙醇,萜类化合物和聚酮化合物。这些化合物通过其特征结构(独特的碳骨架)与初级代谢物区分开,这使得它们专门用于对环境条件和生物应激的反应。次生代谢产物参与化源化相互作用,但主要用于对病原体进行植物防御[6.].
茄科物种作为食物来源和药物已成为人类文明的组成部分数千年。所有的大约180颗都有结节Solanum.这些物种原产于拉丁美洲。从北部的墨西哥到南部的智利,它们出现在各种各样的环境条件下,占据着各种各样的栖息地[7.].野生马铃薯适应和适应环境条件的能力使它们成为生物和非生物逆境抗性变异的丰富来源[8.]. 甾体糖生物碱是一种含氮的甾体糖苷,是植物体内大多数器官的次生代谢产物Solanum.物种(9.].它们是由甲羟醛酸/异戊二烯途径的甾醇分支生物合成[10].马铃薯种质中有许多类型的Glycoalkaloids(气体)。在野生物种和栽培马铃薯的块茎中揭示了五十六种气体,包括α-溶均α-solasonine,α-溶亚氨基甲酰胺,α-己酮,α-氯氰酸二烷基酮[11].块茎中GA含量明显低于马铃薯叶片[12].
α-Solanine和α-chaconine具有抗菌、杀菌和杀虫的特性[13],可归类为植物抗毒素,是为了应对病原体感染而合成的[14].它们的生物活性主要依赖于它们的化学结构,α-查康碱对真菌等的生长比α-茄碱更有活性十字花格孢,疫霉。医学,和辣椒[15].在我们之前的论文中,我们证实了对测试植物芥末的马铃薯植物毒性潜力(PP)(白芥一种常用作后处理剂的物质[16].结果表明,总糖生物碱(TGA)含量在野生马铃薯品种和马铃薯杂交种的PP表达中起着重要作用,一些TGA含量低的无性系可能具有PP。
为了更好地理解可能在低TGA含量下直接或间接地与马铃薯PP直接或间接地意义的过程/现象,我们使用转录组和蛋白质组学方法。众所周知,异常/植物毒性相互作用直接通过化感化合物直接测定,然而,它们的植物器官的含量或型材不仅在遗传水平处被调节,而且经历了代谢途径的协调。转录组和蛋白质组学研究可以为整合性代谢物分析提供互补知识,并更好地理解植物系统水平的增法/植物毒性现象[17].在本研究中,我们表明,低TGA含量下的马铃薯PP与气体组合物直接相关。
将PP和气体与间隙交叉不同的F1个体对比Solanum.混血儿S. Chacoense.用于综合分析转录组和蛋白质组学谱。
结果
评价总甘链醇,甘油碱,总酚类和总类黄酮含量
总糖生物碱(TGA)含量相近,分别为2.7 μg ml和2.6 μg ml- 1)使用各种PP(表1). 两个样品的α-茄碱浓度相似(分别为0.23和0.26) 微克 毫升- 1)和α-卡乌碱(0.14和0.18 μg ml- 1)(表1). α-茄碱仅在1.69浓度的C中检测到 微克 毫升- 1D组中以瘦素Ⅱ含量最高(66.7%),浓度为1.22% 微克 毫升- 1).D中总黄酮(TF)显著升高,而总酚(TP)在两个样品中的水平相似(表1)1).样本中发现的平均保留时间和气体质量在附加文件中呈现1,和质谱在附加文件中给出2.
差异表达基因和蛋白质的谱
气体已被认为是具有保护活性的化合物,对病原体,害虫和草食动物。最近,我们证实了马铃薯叶提取物(PLE)中气体的存在表现出PP. PLE抑制芥菜生长,TGA含量与芥菜根和幼苗长呈负相关[16].基于这一发现,我们解决了哪些因素/现象可能在低TGA下PP的表达中发挥重要作用(2.7μgml- 1)PLE中的内容?分析了马铃薯PP与马铃薯叶片中基因、蛋白质表达及叶片中GA含量的关系。
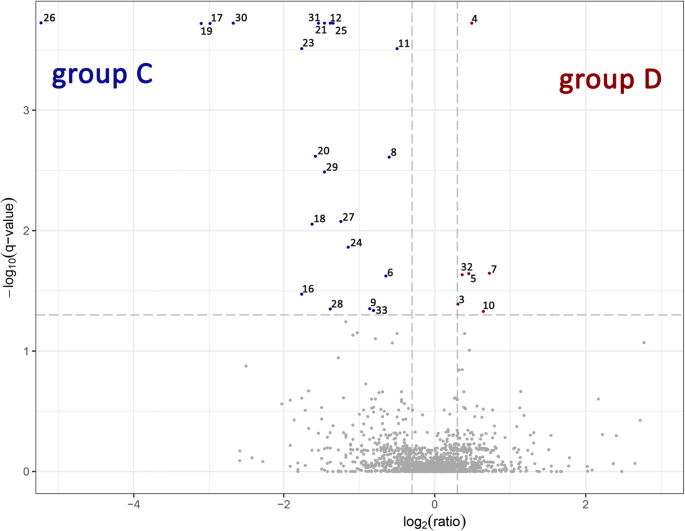
大样本C和D的叶片RNA使用BGISEQ-500(中国)平台进行分析。原始读取的总数从28,723,117到28,804,382。C和d文库共鉴定出23,836个差异表达的转录本。我们分析了具有错误发现率(fdr调整)的差异调控最多的转录本p-价值< 0.05)作为阈值,发现3125个上调转录物和3479个下调转录物。所有差异表达基因(DEG)的结果在D和C数据比较后在附加文件中给出3.. 表中列出了前10个上调和下调最多的转录本2.C中最上调的转录物是花青素5-芳族酰基转移酶样和枯草杆菌蛋白酶样蛋白酶SBT1.7,转录变体X2,分别为0.45和9.19的LOG2折叠变化(FCS)。最下调的基因是碳酸酐酶氯塑状物和米科素样,分别为-9.94和-9.28分别为-994和-9.28。
样品CAMD D的液相色谱 - 质谱分析,导致48,836个光谱与匹配的肽,2125℃连接,并注释为3054蛋白。所有定量丰富的蛋白质都在图2上呈现。1.使用既定的标准(Q值<0.05)发现了三十三种差异表达蛋白质(DEPS)(表3.). 按照行政审批制度,行政审批分为五类[18[基于UniProt数据库分配:主要代谢,氨基酸代谢,细胞结构,蛋白质转化和压力和防御。最丰富的蛋白质组是与葡聚糖肠胃 - 1,3-β-β-β-β-β-β-β-β-蛋白酶酸性同种型有关的那些,其表达在d中的表达为47.96倍,在DEP中,3是C的C. c的特征:在初级新陈代谢类别中,有甲酰胺酶和非共生血红蛋白2,并且在细胞结构类别中,存在四肽重复超家族蛋白质。对于D,3型DEP是特征:2在类别细胞结构(蛋白质滴毛组双折射,赖氨酸组氨酸转运蛋白转运蛋白转运蛋白1)和1中的应力和防御(基本的吲哚嗪酶)。
马铃薯叶片蛋白质的变化后比较散装D与C。火山图显示了蛋白质的数量丰富。只有蓝点和红点具有q值< 0.05. 火山图显示蛋白质的数量丰富。与单个肽相关的对数转换q值(t检验)与体积C和D之间丰度的对数转换倍数变化作图。不同性质的蛋白质(1号、2号、13号、14号、15号、22号)在火山图上没有标记。呈现的各种蛋白质的数量与表中描述的蛋白质数量相对应2
功能富集分析
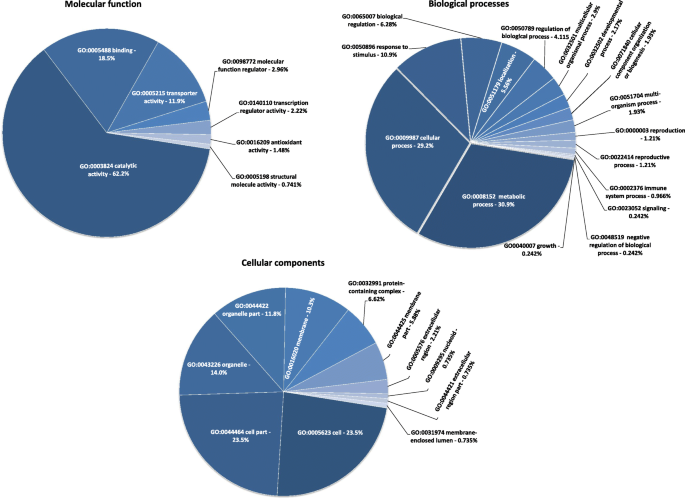
在GO分析的基础上,将其分为三个功能组:分子功能(MF)、生物过程(BP)和细胞成分(CC)。我们在三个水平上确定了34个主要的GO类别(生物学过程中的16个GO术语,分子功能中的7个GO术语和细胞成分中的11个GO术语)(图。2).在MF组中,最具显着富集的GO术语是催化活性,结合随后转运蛋白活性。对于BP组,代谢过程,蜂窝过程和对刺激的反应是最显着富集的GO术语。关于CC,最富集的GO术语是细胞,细胞部分和细胞器。从D VS. C比较中标识的所有未加工的GO术语都显示在附加文件中4..
讨论
我们之前已经证明了GAs在马铃薯植物毒性相互作用中的重要作用。然而,我们观察到低气体含量的马铃薯无性系也具有植物毒性。我们怀疑低含气量克隆的PP是由不同的气体组成决定的。为此,我们获得了一个二倍体马铃薯群体S. Chacoense.作为PP的父本供体,为了减少遗传背景的影响,选择了对照PP的无性系。S. Chacoense.野生野生相对,称为各种甾体糖类甘油碱的来源,包括含瘦糖甘油碱[19].取决于S. Chacoense.加入许多甘氨酸甘油酸碱可以被发现,包括含杆菌I和II,乳突线I和II,α-溶碱,α-和β-氯氰胺,公告和污染;其他生物碱作为花萼和clavemictine,或甾体皂苷,作为皂苷,结核,torvoside或graeculin [20.那21那22那23].在本研究中,C和D中较低的TGA含量伴随着样品间不同的GA模式。最常见的是,GAs α-茄碱和α-茄精共同可能在C. PP的表达中发挥重要作用。这两种化合物以前在灰苦苹果成熟果实(Solanum incanum.L.)作为莴苣的抑制剂(Lactuca sativaL.)浓度为100%时,根系生长强度相当 毫克 dm公司- 3.[24]. 此外,当它们以1:1的比例联合施用时,它们可能起到协同作用,如在黄瓜上所证明的(Cucumis sativusL.)分别施用这两种化合物时的胚根生长[25].
研究发现,GAs的生物活性受糖的结构和赋存状态的严格影响[26].因此,气体的组成可以塑造PP的表达和强度。气体的植物毒性和衍生物对黄瓜根生长的效果随着浓度的增加而增加,并且依赖于它们的类型[25]. α-木瓜碱的作用最强,其次是α-龙葵碱、α-龙葵碱、α-龙葵碱、6-O-硫酸木瓜碱和6-O-硫酸龙葵碱。据我们所知,没有关于瘦素II化感能力的数据。叶面瘦素糖类生物碱的发生与马铃薯甲虫的摄食抑制程度直接相关[20.那27].瘦素II具有单乙酰化(C23)的瘦素苷元。这种化学修饰增加了对CPB和人类肿瘤细胞系的瘦素毒性;然而,它的植物毒性尚未得到评估[20.那28].
糖生物碱的生物合成可以描述为糖基生物碱代谢(GAME)基因促进甾体生物碱(苷酮)产量的一系列作用[29].然后,苷元通过不同的udp -糖基转移酶进行糖基化,以合成各种GAs [30.].我们找到了各种UDP-糖基因转移酶的不同表达模式(请参阅附加文件5.),特别是udp -糖基转移酶90A1 (log2 FC = -3.01),证实了样品之间的GA景观不同,可能影响PLE的PP。最近的研究表明,在后代中,GAs的分布模式来源于与S. Chacoense.偏析,并且可以由38个基因调节,该基因位于VIII染色体上并与游戏基因共同制定[31.]. 对DEGs、GO富集进行综合分析,指出代谢过程的显著参与(BP-30.9%)和催化活性(MF-62.2%)是最有区别的组成部分。这可能表明代谢途径在植物毒性的调节中起着重要的作用。
我们不能排除PP受其他拮抗或可能减少GAs效应的化合物影响的可能性。如[15[α-溶链氨酸与无碱酸和槲皮素一起施加在一起,仅在芥末根生长上仅施用α-溶链氨酸的抑制作用。在本研究中,D具有比C显着更高的TF含量,这可能影响植物毒性效应的强度;然而,这种浓度差异轻微。
我们建议PP表达可以直接与在低TGA含量下在PLE中识别的每个GA的定性和/或定量含量相关。由于气体涉及植物抗性事件和PLE的植物毒性,因此我们认为C的PP将伴随着植物抗生物应激的基因和蛋白质的表达增加。然而,基因和蛋白表达谱的比较Vs. C的比较没有提供明确的证据来支持这一概念。发现防御反应的曲线图案,例如,内肽酶,但它们在样品之间共享。值得注意的是,在C中表达增加的基因编码反式白藜芦醇二甲基转移酶样(波特替换合酶,EC 2.1.1.240),该酶负责合成斯蒂芬,一组植物脂蛋素。该酶的大多数酶位于不同基因座上,在C中上调(参见附加文件3.).转基因烟草(烟草L.)过表达芪合成酶的线表现出增加的植物脂素的合成,伴随着耐受性葡萄孢菌感染(32.].
D和C的蛋白谱与基因表达数据不一致。最多的DEPs组涉及d的应激和防御反应,其中葡聚糖内切-1,3-β-葡萄糖苷酶酸性异构体(47.96)发生了极高的倍数变化。植物葡聚糖内切-1,3-β-葡萄糖苷酶是一种在植物发育过程中参与抵御病原菌和降解细胞壁成分(β-葡聚糖)的酶[33.那34.].然而,它们在发病机制中的重要性被讨论,因为反义的转化体N西尔维斯特里斯具有β-1,3-葡聚糖酶缺乏的烟草可以通过在烟草镶嵌病毒感染期间产生功能等同的替代来补偿该酶的活性[35.].
通过编码基因本身的变化和通过对基因组的其他区域的变化来控制蛋白质丰度[36.]. 蛋白质合成受到多个水平的调控,从剪接和mRNA降解到蛋白质修饰,再到蛋白酶体中的泛素化和蛋白质水解[37.]. 因此,转录组数据与蛋白质组图谱不一致也就不足为奇了2和表3.).我们发现一张Deg,苏氨酸脱水酶生物合成(Fc = 1.37),其蛋白质表达在D.苏氨酸脱水酶中显着增加,也称为苏氨酸脱氨酶,是异氨氨酸生物合成的酶[38.]并用食草肠道中的蛋白酶抑制剂在一起,降低膳食蛋白和苏氨酸可用性。在Solanum.物种,苏氨酸脱水酶基因具有复制的副醛酮,其与从事食草性抗性的基因共同压抑。在羽扇豆(Lupinussp。L.),高含量的苏氨酸伴随着增加水平的生物碱[39.].另一方面,较高水平的苏氨酸诱导了生物碱-匹罗卡品的合成毛果[40],是中吡咯里西啶类生物碱的良好前体Senecio Douglasii.并参与谵粒的直接生物合成[41.].仅为C的特征的蛋白质之一是甲酰胺酶(EC 3.5.1.49),其从事氮代谢[42.]. 编码这种酶的基因也被认为是干旱敏感的,并受脱落酸(ABA)调控[43.]. 这两种酶可能间接参与GA的合成,因为它们参与氮的代谢,氮被插入到苷元骨架中。
结论
气体复杂分析,与Tranfriptomic和蛋白质组学结果一起提供了新的洞察,以了解马铃薯的植物毒性能力的表达。我们证明,低TGA含量下的PP表达可以与PLE中的气体组合物连接。We pointed potential involvement of metabolic pathways (GO enrichment) in direct regulation of GAs biosynthesis and accumulation (genes of GAs main biosynthesis pathway) or indirect regulation by other factors/phenomena, e.g., nitrogen metabolism, and is a result of plant reactions to biotic and abiotic stresses. Comparison of transcriptomic with proteomic revealed gene and protein of threonine dehydratase bisynthetic as common element bonding these two omics and important in expression of potato phytotoxic abilities.
方法
植物材料
植物材料由马铃薯二倍体种群15-1(F1后代,N. = 166) from a cross ofSolanum.DG 88-89(亲本)与野生种杂交S. Chacoense.(花粉父母)。在波兰植物育种和适应院校 - 国家研究所,米罗德,米罗德,母亲克隆在波兰·米罗·瓦斯·国家研究所。父亲特定是从波兰的国家植物遗传资源中心获得的(加入POL003:333133)。DG 88-89是源自二倍体薯块克隆的十字架的多粒杂交。就基因组而言,百分比S. Tuberosum.在DG 88-89中为78.3%,而且S. Chacoense.是15.7%。DG 88-89表现出较低的TGA浓度(5.2 μg ml- 1)不可检测的PPS. Chacoense.具有高TGA浓度(55.6μgml- 1)和高pp(70%)[15]. 2016年5月至10月,每个子代的三个复制品在温室中生长。在花期,收集小叶,混合,分成0.5和1 g份,冷冻于液氮中,储存至室温下使用− 80 摄氏度。
土豆叶提取物的制备
如前所述由[16].简而言之,在液氮中研磨0.5g冷冻叶片,补充有50ml蒸馏水(1%w / v)并在实验室振荡器上摇动24小时。新鲜制备和过滤的提取物用于生物化学和质谱(MS)分析。
马铃薯叶提取物中总生物碱、总酚和总黄酮含量的测定
2016年,采用比色法测定了所有166名个体的TGA浓度[44.,并根据[16]. 简单地说,1%的PLE在真空旋转蒸发器中浓缩四倍(SpeedVac Appligene冷冻吸引器,德国)。TGA用10%乙酸提取,5%乙醇沉淀 氢氧化铵。样品悬浮在100%甲醇中。用98%硫酸和1%多聚甲醛进行显色反应。
在Hitachi U-1900(日本)分光光度计上测量吸光度,在562nm的波长上抵抗空白样品。TGA的浓度在α-溶氯(Sigma-Aldrich,S3757)的等同物中表达。
TP含量测定方法为[16]修改[45.].使用新鲜制备的十倍稀释的Folin-Ciocalteu试剂(Sigma,F9252)和7.5%碳酸钠(W / V)对双重浓缩的PLE进行分析,并在760nm处测量吸收率。TP的浓度表示为无碱酸(Phytolab,89,198)的等同物。
TF被确定为[16] [46.].使用10%氯化铝(W / V)和乙酸钾的双重浓缩的PLE对分析进行分析,并在415nm处测量吸光度抵抗坯料样品。TF的浓度表示为槲皮素(Phytolab,No.89262)的等同物。
2016-2018年测定了所选基因型的TGA、TP和TF浓度。所有测量均进行三次生物重复,每次重复有两次技术重复。
马铃薯叶提取物的植物毒性评价
以供试植物芥菜为对照,测定了PP值。Rota(Vera Agra育种公司,Cieszków,波兰)在2016年对所有166个个体进行了三次生物重复试验,并在2017-2018年对选定的植物进行了三次生物重复试验[16].简而言之,胚胎突起(APPX.3mm长)后的15种芥菜籽被转移到填充有滤纸和蒸馏水的培养皿(方形,12厘米)或用蒸馏水或1%PLE(PLE处理的植物)。孵育5天后,测量对照和对照处理的芥菜幼苗的长度。PP以%的幼苗长度抑制/刺激与根据式(在水中生长)的培养的程度表示为%
散装样品的构建
基于TGA浓度和PP(附加文件6.),构建C和D大样本,每个大样本有3个生物重复。大量样本分析可以更有效地识别一个性状背后的基因。在这种方法中,将来自隔离人群的个体进行对比,然后通常进行筛选,以识别特定的标记[47.].样品C表现出低TGA含量(2.7μgmL- 1在ple)和高pp(40%);D表现出低TGA浓度(2.6μgml- 1在PLE)中,无效的PP(PLE处理的植物与对照相同)。在每个样品中,将来自三个F1个体的液氮中的等量的冷冻叶片研磨,混合在一起并储存在-80℃。
RNA分离和RNA序列分析
根据文献[48.]使用Trizol试剂。简而言之,液氮中0.1g组织研磨物补充有1ml Trizol试剂。在氯仿中进行萃取两次。将RNA沉淀在0.3ml盐溶液(0.8M柠檬酸钠和1.2M氯化钠)和0.3ml异丙醇中并重悬于无菌水中。使用260nm和280nm和2%琼脂糖凝胶的纳米玻璃分光光度计(Thermo Sciencific)测定RNA的质量和量。接下来,用DNase I(Thermo Scientific,EN0521)处理RNA,以降解RNA样品中的双链和单链DNA污染物。
使用Dynabeads®mRNA纯化试剂盒(Ambion,61006)分离mRNA,并使用MGIEasy RNA定向文库准备集(MGI,100006386)制备文库,两者均符合制造商的协议。
建立的cDNA文库在BGISEQ-500测序平台(中国BGI基因组学)上测序,产生100bp配对末端阅读。RNA序列读取由Genomed®(波兰华沙)产生。在对适配器序列和低质量读取进行过滤之后,获得用于后续分析的数据。然后,参考基因组的索引(https://www.ncbi.nlm.nih.gov/assembly/GCF_000226075.1),使用Bowtie v2.1.0构建,并使用TopHat v2.0.9 (Broad Institute, Boston, MA)对样本C和D获得的clean reads与参考基因组进行对齐。接下来,使用HTSeq v0.5.3计算每个基因的reads数。DEGs通过DESeq包进行识别。
基因本体术语丰富性分析
为了研究DEGs的生物学功能,我们使用topGO软件包对GO基因进行了富集。为了提取有意义的GO分类,Fisher的精确检验用elim.算法。为了准备所有重要GO术语的圆图,我们在GOslim分类的基础上,使用查询来查找各个功能分类中的本体,如下所示:
马铃薯叶提取物中糖类生物碱的含量分析
采用固相萃取法(QuEChERS)从1%的膨体样品C和D中分离GA组分。首先,对于每个PLE样品,添加溶于甲醇中的α-茄碱(ChemFaces,CFN93102)作为内标物,最终浓度为10 ng公司 微升- 1计算Ga的恢复百分比。在对照样品中,将α-甲酰甲磺酸盐加入到相同的最终浓度中。两种类型的样品(控制和PLE)通过灭菌过滤器(0.2μm,Nalgene TM)。向750μl样品中,加入等量的乙腈(ACN),其中1%甲酸,并将样品施加到QueChers(UTC,Ecquch112ct)的固相上,并在涡旋混合器上摇动30秒。然后,将Ga分离后得到的上清液用甲醇稀释10倍。HPLC-MS分析是在配备DGP-3600泵的DIONEX 3000 RS-HPLC上进行的,WPS-3000 TLS TRS自动进样器,TCC-3000 RS柱舱(Dionex Corporation,USA)和Bruker MicroOf-QII质谱仪(Bruker Daltonics,德国)。色谱柱为50×3.1(即)-Millimetre Thermo Scientific Hyperil Gold,具有1,9-μm粒子(第25002-052130部分,序列号0110796A6,批号10922)。
色谱条件:对于流动相,溶剂A是水,溶剂B是ACN。流程计划如下:0分钟 - 5%溶剂B;1.4分钟 - 5%溶剂B;22.9分钟 - 95%溶剂B;24.4分钟 - 95%溶剂B;24.5分钟 - 5%溶剂B;29分钟 - 5%溶剂B.注射样品体积为1.5μL。流速为0.2毫升分钟- 1,用质谱法监测洗脱液,ESI阴性模式分析。扫描范围:50-1500 m/z,端板偏置:−500v,毛细管:4500v,雾化器气体(N2): 1,2 bar,干气(N2): 10 L/min,干温:220℃。
使用样品中TGA中每种化合物的频率对GA含量进行定性分析。使用以下公式计算定性GA曲线:
在哪里
F–化合物的频率
一种n- 分析面积化合物
一种全部-样品中所有气体的面积。
定量分析采用GA标准α-茄碱(ChemFaces, CFN90560)、α-查康宁(ChemFaces, CFN00450)、α-茄精(ChemFaces, CFN90159)和α-茄碱(PhytoLab 83,271)。为了定量化合物,在0.1 μg ml浓度范围内生成每个GA标准品的校正曲线- 1到10μgml- 1.对于Leptine II,由于缺乏标准,使用了α-溶含曲线的曲线。结果以μgmL表示- 1并考虑每种化合物的回收率与对照样品浓度的关系。
蛋白质的提取
蛋白质从C和D中分离,如[49.]稍加修改。那么,0.1 g粉末状组织悬浮在350中 μl提取缓冲液,在冰上培养30分钟 然后,以1:1(v/v)的比例添加苯酚溶液(Roti®-苯酚水),并在室温下培养10分钟 在4℃离心两次回收苯酚相 °C,转移到具有1:1(v/v)萃取缓冲液的新管中,并在含有0.1%甲醇的冷甲醇中沉淀 M乙酸铵1:4(v/v)。混合物在室温下培养过夜− 20 °C并在室温下离心。除去液相,用100%甲醇将颗粒洗涤一次,并预冷至− 20 °C,用80%丙酮离心,以最高速度离心。最后的蛋白质颗粒风干并在200℃下溶解 25μl 碳酸氢铵。样品蛋白质含量的测定方法如下:[50.以双胆碱酸测定和牛血清白蛋白为标准。本研究分析了五个独立的生物重复。每个探针中总共120 μg蛋白质被送到波兰科学院生物化学和生物物理研究所的质谱实验室进行纳米lc -MS-MS/MS(纳米液相色谱-串联质谱)分析。
差异表达蛋白的比较分析
使用nano Acquity(Waters)LC系统和Q-Exactive质谱仪(Thermo-Electron Corp.,San Jose,CA),使用相同的设备、缓冲液和参数,通过nano LC-MS/MS分析肽混合物,如[51.].原始数据由吉祥物蒸馏器处理,然后由吉祥物搜索(矩阵科学,伦敦,英国,现场许可)对比uniprot茄属植物tuberosum数据库(2018年2月发布)。前体和产物离子质量耐受的搜索参数分别为30ppm和0.1 Da,酶特异性分别为胰蛋白酶和缺失的切割位点。吉祥物得分超过吉祥物程序计算的期望值< 5%的阈值的多肽被认为是积极识别的。定量分析如[52.].很快,上述质量校准和数据滤波如[51.].最后,导出所鉴定出的相应丰度的多肽列表,用公司自行开发的Diffprot软件(version 1.5.19;3.01.2013) [53.]. 在分析之前,丰度用LOWESS标准化。对含有90%以上共同肽的蛋白质进行聚类,仅对该聚类所特有的肽进行统计分析。只有具有q值的蛋白质≤0.05被认为是差异表达。
数据和材料的可用性
本研究中分析的所有数据都包含在此已发布的文章及其补充文件中。所有原始和加工的RNA-SEQ数据都已沉积在链接下的基因表达式Omnibus [Geo]存储库中[https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse155583.]和序列读取档案[SRA]储存库的链接[https://www.ncbi.nlm.nih.gov/bioproject/PRJNA650400].
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- 体外循环:
-
马铃薯甲虫
- 度:
-
差异表达基因
- 部门:
-
差异表达蛋白
- 游戏:
-
糖生物碱代谢基因
- 去:
-
基因本体论
- PLE:
-
马铃薯叶提取物
- 页:
-
植物性毒素的潜在
- 气体:
-
Glycoalkaloids(由质谱测量)
- TF:
-
总黄酮
- TGA:
-
总糖生物碱(比色法测定)
- 总磷:
-
总酚
参考
- 1.
Macias FA, Marin D, Oliveros-Bastidas A, Varela RM, Simonet AM, Carrera C等。化感作用是生态系统可持续发展的新战略。生物科学与空间。2003;17:18-23。
- 2.
Trezzi mm,Vidal Ra,Balbinot AA,Bittencourt H Von H,Souza Filho APS。作者:陈曦,体育学院学报JOURNALJ Plant Int 2016; 11:53-60。
- 3.
Gniazdowska A,Bogatek R.植物之间的异教徒相互作用。多个站点的等级化学的行动。acta physiol植物。2005; 27:395-407。
- 4.
关键词:生物医学工程,生物力学,生物力学,生物力学评价化感植物水浸提液作为种子敷料的潜在制剂对菜花种子萌发的调节作用。农业。2020;10:122。
- 5。
BöttgerA,Vothknecht U,Bolle C,Wolf A.植物次生代谢物及其在植物中的一般功能。在:Caffeine,Cannabis&Co的课程。学习材料Biosci。(EDS)。Cham:Springer;2018. p。3-17。http://doiorg-443.webvpn.fjmu.edu.cn/10.1007/978-3-319-99546-5_1.
- 6。
Zaynab M,Fatimab M,Abbasc S,Sharifd Y,Umairc M,Zafare Mh,等。次生代谢产物在植物防御病原体中的作用。Microb Pathog。2018; 124:198-202。
- 7。
Gebhardt C.物种从Solanaceae植物家庭在遗传研究中的历史作用。Al Appl Genet。2016; 129:2281-94。
- 8。
Castañeda-Álvarez NP, de Haan S, Juárez H, Khoury CK, Achicanoy HA, Sosa CC,等。马铃薯野生亲缘物种迁地保育优先次序(Solanum.L第5节(第5节)。公共科学图书馆一号。2015;10:e0122599。
- 9
Friedman M,McDonald GM.马铃薯糖生物碱:化学、分析、安全性和植物生理学。工厂科学评论。1997;16:55–132.
- 10.
Morillo M,Rojas J,Lequart V,Lamarti A,Martin D. Solanum属和生物活性的甾虫糖类甘油碱的天然和合成衍生物。Nat Prod Chem Res。2020; 8:371。
- 11.
Shakya R,Navarre DA。4种野生马铃薯和3个栽培马铃薯块茎中茄烷糖碱多样性的LC-MS分析(茄属植物tuberosum). 农业食品化学杂志。2008;56:6949–58.
- 12.
史密斯DB,罗迪克JG,琼斯JL。马铃薯糖生物碱:一些未回答的问题。食品科技发展趋势。1996;7:126–31.
- 13。
食品糖生物碱:分布,结构,细胞毒性,提取和生物活性。In:生物碱-它们在自然界和人类生活中的重要性;2019.p。之比是13比5。
- 14。
Jeandet P,ClémentC,Courot E,Cordelier S.调制植物植物植物植物的植物抗性。J Mol Sci。2013; 14:14136-70。
- 15.
嗯,罗迪克JG。糖生物碱α-茄碱和α-木瓜碱的交互抗真菌活性。植物化学。1993;33:323–8.
- 16。
苏蒂斯·卡琳娜·D、穆劳斯卡·Z、斯特泽尔奇克·伊塔·D、瓦西里维茨·弗利斯·I、马尔泽夫斯基·W。栽培和野生马铃薯的植物毒性(Solanum.(Sp .):糖生物碱、酚类和黄酮类化合物在芥菜植物毒性中的作用(白芥L.)。acta physiol植物。2019; 41:55。
- 17。
Fukushima A,Kusano M,Redestig H,Arita M,Saito K.植物系统生物学中的集成OMIC方法。Curr Op Chem Biol。2009; 13:532-8。
- 18。
Alexander MM,Cilia MA。分子拔河:病毒感染期间全球植物蛋白质组的变化。当前植物生物学。2016;5:13–24.
- 19
Veilleux R,Miller Ar。F1之间的混合分解茄和美国phureja瘦素生物合成的基因转移。美国社会科学杂志。1998;123:854–8.
- 20.
Sinden SL,LIND LS,DEAHL KL。含瘦糖甘油碱的分离茄苦的。JAgric Food Chem。1986; 34:372-7。
- 21.
DEAHL KL,SINDEN SL,Young RJ。野生凝聚煤的评价Solanum.供试材料叶中糖碱的含量和组成。我是波特J。1993;70:61–9.
- 22.
Mweetwa AM、Hunter D、Poe R、Harich KC、Ginzberg I、Veilleux RE、Tokuhisa JG。糖皮质生物碱茄. 植物化学。2012;75:32–40.
- 23.
Joshi JR, Yao L, Charkowski AO, Heuberger AL.从野生马铃薯中提取代谢物抑制软腐病和黑腿病原菌的毒力因子。MPMI。2020;https://doi.org/10.1094/mpmi-08-20-0224-r..
- 24.
福原爱,久保一世。植物甾体糖生物碱的分离Solanum incanum.采用两种逆流色谱法。Phytochem。1991;30:485 - 687。
- 25.
Sun F,Li S,He D,Cao G,Ni X,Tai G,等。甘蔗植物从胶原蛋白对黄瓜根生长的影响。Phytochem。2010; 71:1534-8。
- 26。
Chowański S, Adamski Z, Marciniak P, Rosiński G, Büyükgüzelet E, Büyükgüzel K,等。茄科生物碱的杀虫活性研究进展。毒素(巴塞尔)。2016; 8:60。
- 27。
Yencho GC、Kowalski SP、Kennedy GG、Sanford LL。瘦素糖生物碱的分离及其对马铃薯甲虫的抗性(Leptinotarsa Decemlineata.在F2(说))茄属植物tuberosum(4倍)S. Chacoense.(4 x)土豆后代。中国科学技术出版社2000年版;77:167。
- 28。
施赖伯K。甾体生物碱,茄属。在:生物碱。第十卷,Manske RHF,Holmes HL(电子数据系统)。纽约:学术出版社;1968年。1–192.
- 29。
ITKin M,Heinig U,Tzfadia O,Bhide AJ,Shinde B,Cardenas PD等。溶于作物中的抗抑制生物碱的生物合成由聚簇基因介导。科学。2013; 341:175-9。
- 30
中安M, Umemoto N, Ohyama K, Fujimoto Y, Lee HJ, Watanabe B, et al. .一种双加氧酶催化甾体糖生物碱生物合成中的甾体16α-羟基化。植物杂志。2017;175:120-33。
- 31
彭Z,王P,唐D,尚y,李c-h,huang s-w等。马铃薯块茎肉体甾体甘油酸碱的遗传。j infrogric。2019; 18:2255-63。
- 32.
Hain R,Reif Hj,Krause E,Langebartels R,Kindl H,Vornam B等人。一种新型植物中的异物植物素表达的抗病抗性。自然。1993年; 361:153-6。
- 33.
贝尔AA。抗病生化机制。《植物生理学研究》1981;32:21-81。
- 34.
Morohashi Y,Matsushima H.发芽番茄种子中β-1,3-葡聚糖酶活性的发展。J Exp Bot。2000; 51:1381-7。
- 35.
关键词:葡聚糖-1,3- fb -葡萄糖苷酶,反义转化,特异性诱导美国国家科学院科学研究所1993;19:8792-6。
- 36.
Foss EJ,Radulovic D,Shaffer SA,Ruderfer DM,Bedalov A,Goodlett Dr等。酵母蛋白质组变异的遗传基础。NAT Genet。2007; 39:1369-75。
- 37.
Vogel C,Marcotte Em。从蛋白质组学和转录组分析中欣赏蛋白质丰富的洞察。NAT Rev Genet。2012; 13:227-32。
- 38。
Gonzales-Vigila E,Bianchetti Cm,Phillips Gn Jr,Howea Ga。苏氨酸脱氨酶在植物防治中对昆虫食草的自适应演变。pnas。2011; 108:5897-902。
- 39。
Wasilewko J, Buraczewska L.在波兰栽培的三种羽衣甘蓝种子的化学成分,包括氨基酸,矿物质和生物碱的含量。动物饲料科学,1999;8:1-12。
- 40
Sawaya ACHF、Abreu IN、Andreazza NL、Eberlin MN、Mazzafera P。毛果芸香碱及其相关生物碱的研究(芸香粉).生物碱:性质、应用和药理作用;2010.p . 63 - 80。
- 41
罗宾逊T.一些杂项生物碱。在:生物化生物化学;1981. p。145-7。
- 42
弗雷泽贾,戴维斯马,海恩斯MJ。甲酰胺酶基因Aspergillus nidulans.:通过氮代谢物抑制和重叠上游基因的转录干扰进行调节。遗传学。2000;157:119–31.
- 43
黄东,魏伟仁,黄志明,黄志明。拟南芥干旱相关基因表达与激素和环境因子的关系[J] .实验机器人,2008;59:2991-3007。
- 44.
安德烈A,奥利瓦C,迪斯特尔S,达里奥G。不同田间抗性马铃薯品种叶片和块茎中植保素、糖生物碱和酚类物质的产生Phytophthora Infestans..Am J Potato Res。2001; 44:1-9。
- 45.
Maurya S,Singh D。Kr.,白花蛇舌草提取物中总酚含量的定量分析。国际医药技术研究杂志,2010年;2:2403–6.
- 46.
Chang Cc,杨MH,Wen HM,Chern JC。用两种互补比例估算蜂胶中总黄酮含量的估计。J食物药物肛门。2002; 10:178-82。
- 47.
邹丙、王平、徐勇。遗传学、基因组学和作物改良的大样本分析。植物生物技术杂志。2016;14:1941–55.
- 48.
Chomczyński P, Sacchi N.单步法分离RNA硫氰酸盐-酚-氯仿萃取。学生物化学肛门。1987;162:156-9。
- 49.
Szajko K、Strzelczyk-Żyta D、Marczewski W。马铃薯叶片蛋白质组比较研究(茄属植物tuberosumL.)基因型,具有ER-和HR介导的PVY感染抗性。EUR J植物途径。2018; 150:375-85。
- 50
史密斯PK,Krohn Ri,Hermanson GT,Mallia AK,Gartner FH,Provenzano MD,等。使用二金鸡宁酸测量蛋白质。肛门生物化学。1985年; 150:76-8。
- 51
关键词:马铃薯,不同抗性,块茎,蛋白质组学,定量分析Dickekea solani.. 种植土壤。2019;441:317–29.
- 52
Bakun M,Niemczyk M,Domanski D,Jazwiec R,Perzanowska A,Niemczyk S等人。尿液蛋白质组常染色体显性多囊肾疾病患者。临床蛋白质组学。2012; 9:13。
- 53
Malinowska A,Kistowski M,Bakun M,Rubel T,Tkaczyk M,Mierzejewska J,et al.Diffprot–用于差异蛋白质组学数据非参数统计分析的软件。蛋白质组学杂志。2012;75:4062–73.
致谢
作者感谢Masdiag实验室(波兰华沙)的Konrad Kowalski在GA识别和测定方面提供的有用指导和技术支持。
资金
该研究得到了波兰国家科学中心的资助(UMO-2016/23/D/NZ9/02672)。资助机构为研究项目提供资金支持,但不参与研究的设计、数据收集、数据分析或手稿的撰写。
作者信息
从属关系
贡献
大部分实验由KS完成,JC对GA进行定量分析,IW-S提供并收集植物材料,WM提供有用的建议并撰写部分稿件,DSK设计并进行实验,撰写稿件。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:补充表S1。
样品D和C中发现的化合物的平均保留时间(RT)和质量。
附加文件2:补充图S1。
样品C和D中发现的气体质谱。
附加文件3:补充表S2。
在比较D与C块之后识别的所有参数,由Log2 FC排序。
附加文件4:补充表S3。
GO在分子功能、生物过程和细胞隔间中的富集
补充文件5:补充表S4。
udp -糖基转移酶和其他参与GAs生物合成的基因在D块和C块之间的表达模式,按log2fc排序。
附加文件6:补充表S5。
15-1群体个体TGA含量和PP。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
Szajko,K.,Ciekot,J.,Wasilewicz-Flis,I。et al。低糖生物碱含量马铃薯种间杂种植物毒性的转录和蛋白质组学研究。BMC植物BIOL.21,60(2021)。https://doi.org/10.1186/s12870-021-02825-021-02825-021-02825
收到了:
公认:
发表:
内政部:https://doi.org/10.1186/s12870-021-02825-021-02825-021-02825
关键字
- 一生
- 二倍体杂种
- 葡聚糖内-1,3-β-葡萄糖苷酶
- Leptine二世
- 龙葵碱
- 茄
- 茄属植物tuberosum
- Solasonine.
- 苏氨酸脱氨酶