抽象的
背景
毛状体在植物的发展中发挥着关键作用,并存在于各种各样的物种中。
结果
本文综述了植物毛状体的结构和形态特征,以及毛状体发育的生物学功能和经典调控机制。环境因素、激素、转录因子、非编码RNA等在毛状体的初始化、分支、生长和发育等方面发挥着重要的调控作用。此外,对非模式植物的非典型调控机制进行了进一步的研究,发现对茶(山茶花Sinensis.)毛状体主要受激素和新型调节因子的影响。
结论
本综述进一步展示了培养的培养型启动和发展中的复杂和差分调节网络,为植物中的胎儿进行了基础和应用研究的参考。
背景
毛状体被定义为单细胞或多细胞阑尾,其是植物中上述表皮细胞的延伸[1].这些附属物在Plussand的发展中发挥着关键作用,在各种各样的物种中发生[2].毛状体是抵御自然灾害的保护性屏障,如草食动物、紫外线照射、病原体攻击、过度蒸腾、种子传播和种子保护。单细胞的非腺毛拟南芥作为研究植物培养型发育的分子机制的优秀模型[3.那4.那5.那6.那7.].尽管毛状体的体积很小,但它们对植物和人类健康有显著影响。棉籽毛状体是纺织工业的重要原料[8.那9.那10]而茶叶剧本对茶叶养殖和茶品质至关重要,因为它们具有丰富的营养素[11].水稻的轻叶轻壳型缺毛,有利于作物收获和后续加工;然而,叶状毛在杨树和法国梧桐对人类有害,容易引起呼吸道感染,肺部感染,发热,流感,潜在引起癌症[12].
胎儿的结构和形态特征
毛状体广泛分布在不同植物的不同器官/组织的表面上,表现出各种形态。基于不同的特征和功能,毛状体通常分为单细胞或多细胞,支链或非腺体和腺或非腺体。毛状物也具有不同的形状,例如头部,星形,钩和鳞片。Theobald和Barthlott进一步将毛状物分为三类基于叶子的分布:大,小和腺体毛状体[13那14].大颗粒主要分布在轴向表面和边缘和血管束上;气孔para细胞中的小毛状体;腺体毛状体通常定期分布在叶面上的所有或部分皮骨组织中[2].粒状物的形态与植物器官的空间分布有关。番茄的底部(Lycopersicon esculentum)茎覆盖着长毛粒,而茎的上部具有短且稀疏的毛状体[15].此外,粒状物的密度在不同的器官中变化。叶片上的毛粒的密度显着高于刀片背面的密度[16].酿酒商发现,不同类型的叶子具有不同的毛状体密度。在大豆中,叶子的相对于毛细血管小体密度大于轴向表面[17].
植物胎儿的生物学功能
植物已经进化了许多防御机制,以防止不同的非生物和生物应激。胎儿的形态和密度通过介导植物与环境之间的相互作用来影响植物生理学和生态学的几个方面[18].毛状体,与表皮上的气孔,cutin和蜡一起,通过合成,储存和分泌许多重要物质进行各种保护功能[19那20.那21].棉花花瓣毛状体体保持芽的形状,确保种子的生产[22].此外,毛状体通过分泌疏口剂,生物碱和有毒物质来保护来自食草动物,昆虫和病原体的植物[21那23那24那25].Kim等人。(2011)检查了辣椒毛细胞和辣椒斑点病毒(Pepmov)抗性之间的关系,并表明Pepmov-snu1菌株的抗性由辣椒品种Cm334,Chilsungcho和EcW123R中的交叉组合继承[15].在水稻中,两种毛状体双折射(TBR)样蛋白在抗叶斑病中起着重要作用[26].
胎儿在对非生物胁迫的反应中也很重要[22].毛状体的存在增加了表皮的厚度,长链脂肪酸的含量显着高于其他表皮细胞中的含量,这有助于降低蒸发和调节温度[20.那27].在巴西的高空岩石区,植物克罗顿·蒂格利和Vriesea通过毛状体有效地从大气中吸收水分和养分,提高水和肥料的利用率[28那29].高密度的多分支Acanthophyllum squarrosum毛状体不仅具有很高的抗沙埋藏能力,还能减少风沙对机械的破坏[30.].此外,水生植物的毛状体Salvinia molesta,在保持正常呼吸中发挥疏水作用[14].毛状物也在信号传输中起作用。细胞壁拟南芥毛状体从上到下逐渐变薄,这一变化使得毛状体的底部对外界刺激极其敏感。这种刺激通过Ca的改变传递到毛状体基部周围的细胞2+含量和pH,从而调节防御物质的合成[31那32].
植物培养体发育的调节机制
植物毛粒的发展是协调和调节的各种因素,例如环境,激素,调节基因和非编码RNA。其中,监管基因包括转录因子和功能基因,在调节初始化,生长和发育中起重要作用。
培养基因编码基因的调节机制
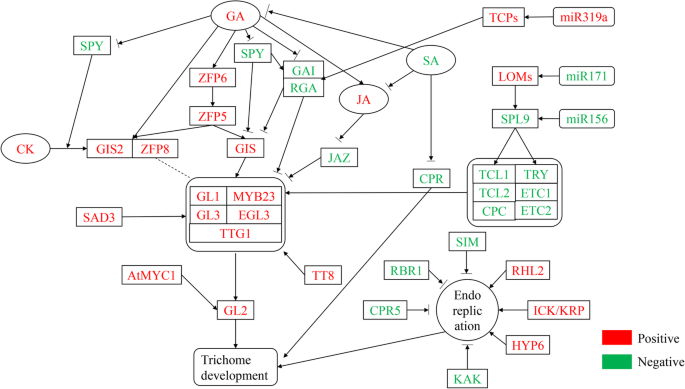
植物毛状体的发育受复杂的分子网络、植物激素和环境因素的调控。1).以前的研究表明,许多转录因子参与调节植物毛粒的起始,生长和发育(表1).阳性调节因子包括WD40家族蛋白TTG1(透明Testa Glabra1),四种类似的转录因子GL3(GLABRA3),EGL3(Glabra3的增强剂),TT8(透明Testa),MyC-1和三个R2R3相关转录因素(GL1,MYB23和MYB5)[33那41那46那47那65那66那67那68那69].这些基因在功能上是冗余的,并形成MYB-bHLH-TTG复合物与启动子结合glabra2.(GL2.)[70].TTG1在毛状体的发育中起着重要的调控作用。Bloomer等(2012)发现MYB23、GL1、GL2和GL3在毛状体发育中的调控作用需要TTG1的参与[71].GL1和TTG1中的完全突变导致培养滴注体的损失。这GL3 / EGL3.双突变体也显示无毛表型[72].SAD2(对ABA和DROUGHT 2敏感)是一种重要的β样蛋白,通过介导GL3功能调控毛状体的启动。在SAD2突变体,MyB23,GL1,GL2和TTG1的转录物水平随GL3和EGL3表达的降低而增加[73].
负调节器包括Caprice(CPC),Triptychon(尝试),尝试增强器和CPC1(ETC1),ETC2,其显示功能冗余。与GL3,EGL3和TTG1相互作用的阴性调节剂负面调节毛状体的发育[73].此外,ETC1和ETC2充当尝试和CPC的增强剂,以促进细胞之间的运动,并通过与GL3和TTG1相互作用来抑制毛状体发育的开始。CPC并尝试具有类似的功能[42].
目前,关于毛状体发育的分子调控机制有两种模型,它们共同调控植物毛状体的生长发育。第一种是激活剂耗尽模型:TTG1在毛状体发育中具有双重作用,在细胞间自由移动,并结合GL3/EGL3和GL1/MYB23形成GL1/MYB23-GL3/EGL3-TTG1复合物,正向调节毛状体发育[74].第二种是活化剂抑制剂模型:MYB-BHLH-TTG复合物激活试验/ CPC并促进尝试和CPC蛋白进入相邻的细胞。该复合物形成无活性的试验/ CPC-GL3 / EGL3-TTG1复合物,并通过替换积极调节的转录因子GL1 / MYB23来负调节毛状体形成[75].SAD2通过调节植物中许多培养基相关基因的MRNA的积累来维持GL1-GL3-TTG1复合物的稳定性,这反过来影响蛋白质活性[53].
此外,一些调节因子通过调节培养细胞的核复制来影响毛状体分支。在培养型核DNA的初期综合术后,发生滴毛组分支的形成。其中,影响DNA复制和分支过程的阳性调节剂是CDK / KIP相关蛋白(ICK / KRP),根部无毛2(RHL2),Hypoco-Tyl 6(Hyp6),Zwichel(ZWI),无毛花序的交互剂茎(GIS),GL3和TTG1。
在单细胞中ICK1/KRP1的错误表达拟南芥毛状体减少核内再复制、细胞大小并诱导细胞死亡[50].这zwi, rhl2和hyp6突变减少毛状体分支[76];AtFIP37和GIS通过核内复制周期正调控植物毛状体分支[77那78].毛状体分支的负调控因子包括SIAMESE (SIM)、KAKTUS (KAK)、SPINDLY (SPY)、CONSTITUTIVE PATHOGEN RESPONSE 5 (CPR5)、RETINOBLASTOMA RELATED 1 (RBR)、TRY和HOMEODOMAIN GLABROUS 11 (HDG11)。SIM, CPR5和RBR都通过控制核复制来影响毛状体分支[42那56那66];KAK主要调控GL3和EGL3的表达模式,导致毛状体分支减少[55];SPY是由赤霉素控制的负调控因子[79],而HDG11可以恢复表型GL2.突变体的拟南芥毛状体(58].
滴毛体和植物有机组织的发育同步发生。玻璃状头发(glh),tbr,noeck(nok),它们的蛋白质复合物一起诱导毛粒的形成。三种基因的突变表型均为玻璃状胎儿[59那60那61].在毛状体发育后期,GLH可诱导毛状体形成乳头状毛格拉夫突变体减少拟南芥[59].此外,复合物GL1-GL3-TTG1通过激活毛状体发育的负调控基因CPC、TRY、ETC1等,影响细胞间的信号传递,从而抑制GL1-GL3-TTG1复合物的活性,促进细胞向非毛状细胞的发育[50].
然而,在各种植物中培养的滴毛瘤的调节机制是不同的。过度表达拟南芥GL1在烟草(烟草L)不影响毛状体的发育。金鱼草MIXTA和棉花MIXTA同源基因CotMYB基因的过表达增加了棉花的密度n .烟草滴毛症,而转基因拟南芥MIXTA显示没有变化[68].此外,棉花TRY基因的过表达阻碍了烟草毛状体的发育,而转基因烟草则相反拟南芥没有变化[64].拟南芥毛状体抑制器CPC没有影响l . esculentum毛状体特征[80].控制滴毛组发酵G11和滴毛体分化OCL4B(外部电池层4)抑制玉米[81]仅限于毛皮体的生长和发展拟南芥不是烟草属L..,l Esculentum.[82].因此,所有的研究表明多细胞和单细胞毛状体发育过程中存在不同的调节机制。然而,它们之间有特定的关系。例如,棉花毛状体转录因子GaMYB2可以恢复毛状体的表型GL1.突变体拟南芥[63], AnnGh3蛋白从棉花中分离后,促进毛状体伸长拟南芥[64].
还研究了与多细胞毛细胞相关的其他转录因子。WO(狼)影响了初步发展l . esculentum毛状体(83].黄瓜CsGL1控制毛枝发育[84].此外,可转换元件参与棉纤维细胞发育[85].M6a(内腺苷的位置N6的甲基化)残留物直接由其yth读者容纳。含有Yth结构域的Ect2蛋白在显影过程中解码M6A信号,并通过控制其倍增水平来调节毛状体分支[86那87].SlCycB2过度表达导致导致l . esculentum没有非腺状和腺毛状体的植物[88].
非编码基因的调节
microrna (mirna)是一种内源性非编码小rna,长度约为21个核苷酸,与靶mrna序列高度互补。这些mirna通过在转录后水平上调节其靶基因的表达水平来控制细胞功能的许多方面[89那90.].miRNA通过调节Squamosa启动子结合蛋白的表达等(SPL)来调节毛状体的发育[91.].miR156是一种潜在的移植型传染性miRNA,可调节叶片形态,产生长叶毛状体[92.].在拟南芥,SPLS是花序茎和花器官中培养的滴毛瘤的负稳压因子。这拟南芥SPL基因家族包含17个成员,其中10个被miR156靶向[93.].miR156和SPLs (SPL3/SPL)的表达9.)时间上调[94.那95.].MiR156的表达水平是幼苗中最高的,并且随着植物年龄的下降,而其靶标的表达水平,幼苗在幼苗中低,并且在生殖生长期间逐渐积累。表达模式与茎和花器官上的胎儿的逐渐丧失一致。MiR156的模仿靶的过度表达显着降低了茎粒细胞的密度。在过表达MIR156抗性形式的SPL3,SPL9和SPL10的转基因植物中发现了类似的表型。SPL9,与TCL1的启动子结合并尝试,激活它们的表达并抑制形成毛状体的形成[91.].另外,转基因拟南芥组成型过表达乳头156在茎和花器官上产生异位毛细胞。转基因苜蓿(紫花苜蓿)过表达miR156由于三个靶点表达水平降低,导致毛状体密度增加,开花时间推迟,生物量产量增加:(SPL6,SPL12和SPL13)。我们发现MiR171靶向丢失的商品1(LOM1),LOM2和LOM3也参与了调节SPL活性。通过过表达的MiR171减少LOM丰度导致茎和花器官上的毛状体密度降低。相反,MiR171抗性LOM(RLOM)的组成型表达促进了培养体的培养[96.].最近的研究表明,在MiR319A-OX转基因蛋白中,TCP作为miR319a的靶标的表达水平降低,并显着增加了叶毛细胞的密度。相反,使用短串联靶模具模拟(STTM)抑制miR319a,TCP的转录水平上调并降低培养物密度(表2)[97.].
激素在毛状体生长和发育中的作用
毛状体的分化与其生长位置、生长发育阶段和激素水平密切相关3.).研究表明,吉布林素(GA)[101],cytokinin(ck)[102]水杨酸(SA)[98.]茉莉酸(JA)[103芸苔(Br)和其他激素调节植物毛状体的开始,生长和发育。GA治疗增加了毛泽东体数量拟南芥叶子。GA提高MYB23、GL1、GL3、EGL3的表达水平,抑制TRY、ETC1、ETC2的表达水平[74].分析拟南芥ga1-3,间谍突变体和野生型表明,内源性GA水平和/或信号转导途径的活性正调控毛状体的数量和分支[4.那97.].GA和CK控制毛细血管形成,主要通过C2H2转录因子,例如GIS1,GIS2,锌指蛋白(ZFP)5,ZFP6和ZFP8,其在GL3 / EGL3-GL1-TTG1转录活化剂复合物上游。
CKS促进毛状体形成[45].GA反应抑制剂间谍活动激活CK信号通路拟南芥[104].GA和CK信号传导途径通过整合来控制毛皮组电池命运拟南芥转录因子GIS,ZFP8,GIS2调节GL1表达。该研究表明,ZFP8和GIS2参与CK对培养的调节机制。CKS诱导的GIS2在间谍下游,但在GL1上游。
SA可减少毛状体的形成[97.].这拟南芥心肺复苏突变体溢出Sa显示出低毛状体密度。SA降低了JA对培养体诱导的积极作用,表明JA-和SA依赖性途径之间的负串扰。还有证据表明GA,JA和SA路径之间的互动,以及拟南芥用SA处理表明毛状体密度的1/4降低。在培养体形成的诱导中,GA和JA协同作用,但SA作用于Ga关于毛细胞的密度和数量的影响。外源性JA应用显着增加了毛粒的密度A. Annua.和l . esculentum[105].JA水平的减少(通过OPR3的沉默,在JA的前体的生物合成中的一个关键酶)损害腺体培养l . esculentum[106].jasmonate Zim-域(Jaz)蛋白质与BHLH转录因子(GL3,EGL3和TT8)和MYB转录因子(MYB75和GL1)相互作用,这些因子通过JA降解来调节毛滴度的启动和发育,通过释放WD重复/ bhlh / myb复合体和激活下游因素[99.].
乙烯增加黄瓜中的毛滴毛瘤[107].增加乙烯合成增强了棉花中培养的枝条的长度[108那109].乙烯受体ETR2通过调节微管的组装来控制毛状体的分支[110].最近的一项研究表明l . esculentumSlIAA15作为生长素依赖性转录的强抑制因子,参与调节毛状体的起始[One hundred.].此外,Br在棉花中的应用增加了棉胚轴中纤维相关基因的表达水平,而BRZ(BR抑制剂)抑制纤维相关的基因表达[111].
环境因素对培养的影响
蒂氏有助于植物处理不同的环境挑战。为了更好地适应环境,胎儿已经发展,以适应复杂和变化的环境,例如盐,温度,光和其他非生物因素[112那113那114].在盐胁迫试验中,薄荷和马郁兰的毛状体大小和密度显著增加[115那116].毛的密度Solanum Habrochaites.受到光周期和温度的影响。在漫长的天然阳光下,毛状体密度增加;密度在20-25℃的温度下增加,低温下降[117].Ning et al.(2016)沿着黄土高原纬度梯度选择两个试验点(由湿向干),观察毛状体形态的变化Caragana Korshinskii.[114].使用扫描电子显微镜观察在减少沉淀下滴注的微现象,并且在减少降水下观察到。证据表明毛状体对低温的结构调整,并从桦树的研究中获得了对冻融的耐受性,霜冻迅速增加腺体滴毛的密度[118].Yan et al.(2012)发现拟南芥uv-b可以刺激毛状体形成[119].来自更高纬度的植物往往更短,较少,较少的分支,较早,花较大,开发较少的毛状体,并在较低纬度的植物产生更高度裂片的叶子[120].表面密度M. Sativa.机械损伤、干旱胁迫或缺水条件下生长的增加[121].
茶叶中毛状体研究(c . sinensis)
在其他模型植物中还研究了滴毛组形成的分子机制,例如C. Sativus.[122],l . esculentum[123],B. Campestris.[124),B. Napus.[125].最近的一项研究表明,另一种调节机制可能参与调节植物中的培养体发育。滴乳(在茶中也称为“Háo”)通常被认为是由于分泌各种次级代谢物,例如类黄酮,茶多酚和氨基酸的茶的质量标准之一。茶叶的数量取决于茶叶的压痛程度。在新芽的叶子上粒子的分布特别厚,随着叶子的发展逐渐减少[126].以前的研究表明,在FDDB(Fudingdabaicha,Trichoma-Rich)和RCZ(荣春ZAO,较少的)中鉴定出超过20,000种差异表达的基因(DEGS)[127].但是,同源序列拟南芥两品种间毛状体相关基因无显著差异,甚至未检测到[127].
提出了两种假说来解释上述现象。首先,茶叶中毛状体的比例较低,导致毛状体相关基因的转录相对较低。第二,茶树毛状体形成的新途径可能尚未发现。此前的研究发现,‘RCZ’茶树的trichome相关基因,包括4个HB调控基因(REVOLUTA、WOX1/WOX8和ATHB-51)、RAV1、SPLs和TCPs均上调。的表达水平ZFP4基因在'rcz'下降。这些结果与先前的研究一致,即这些基因在调节培养的培养物发育中发挥了关键作用拟南芥[102那128那129那130那131那132那133].植物激素在茶叶毛状体发育中也起着重要作用。虽然参与各类型植物激素信号的基因表达存在差异,但与ck相关的基因以及编码GA受体GID1b的基因在RCZ中均受到抑制;然而,编码主要GA信号抑制因子的della表达上调。这些结果表明,遗传算法和CK信号在RCZ中都得到了抑制。此外,GA和CK的功能可能受到SPINDLY的O-linked的影响N- 抑制Ga信号传导和促进CK响应的乙酰甘氨酸胺转移酶[48那109那132那134].DEG DataSet表明,Spindly的表达也被下调。总的来说,这些结果表明RCZ的无毛可能导致抑制GA和CK信号。毛状体含有用于建立厚细胞壁的纤维素,其受培养体发育阶段的调节[135].在本研究中,我们发现RCZ中大多数对纤维素合成重要的TBR-like家族(TBR和TBL)和纤维素合成酶基因都受到了抑制,并且这种抑制与RCZ品种的无毛表型显著相关。
虽然茶叶薄膜对叶片夹杂物的含量没有显着影响,但在叶子中的少量比例下占叶片夹杂物的含量。但毛状体真的存在一些毛状体合成的调味材料,包括儿茶素,黄酮醇,氨基酸,嘌呤生物碱和挥发物,这些茶叶口味是重要的成分。更重要的是,一些防御性代谢物和许多抗昆虫,抗微生物基因分别在胎儿中积累并表达,强烈表明毛粒也可能在保护茶叶植物免受生物和非生物胁迫的情况下起作用[11那136].
外表
近年来,虽然在培养的毛皮组织发育的分子机制中取得了巨大进展拟南芥,对非模型植物培养体发育调控机制的研究尚不清楚。迫切需要进一步研究,探索非模型植物中培养的毛肌瘤发育的分子机制。随着下一代测序技术的发展,基因组学和古典遗传学的组合提供了一种非常强大的工具,可识别调节培养的培养基的候选基因。CRISPR / CAS9介导的敲除和siRNA介导的敲除技术通过比较突变体和对照植物之间的差异来鉴定候选基因的功能。此外,作为抗植物抵抗不同应力的障碍,滴毛体在应对生物和非生物胁迫方面发挥了重要作用。通过转录组织,使用与代谢组合结合的蛋白质组学来进一步阐明复杂的信号转换机制。植物的分子机制将环境刺激转化为内源信号,反过来调节滴毛体的生长和发育,并影响结构,密度和功能,尚不清楚。另一方面,腺体滴毛体的一个重要特征是它特异性地合成各种次级代谢物。这些次级代谢产物不仅在对生物和非生物胁迫的反应中发挥着重要作用,而且有助于人类生产和生活,具有非常重要的经济价值。例如,唾液蛋白是倍半萜内酯,从蒿属植物的腺体滴毛组中分离出来并广泛用于其高抗疟原药作用[137].腺毛的腺毛c .漂白亚麻纤维卷可以合成和积累大麻漏骨,该蛋白质是具有重要药理作用的戊酰化的聚酮化合物,在临床研究中具有重要药理作用[138].现代遗传工程技术用于将植物腺滴毛转化为“化学工厂”,合成人类的宝贵化合物也具有很大的发展前景。
结论
毛状体对植物和人类健康有着显著的影响,其生长发育受到环境因素、激素、转录因子、非编码RNA等的影响。以往的研究虽然对影响植物毛状体形成和发育的因素进行了综述,但综述缺乏综合性,主要集中在模式植物的转录因子、激素和环境等方面。本文综述了模式植物中环境因子、激素、转录因子、非编码RNA和功能基因等因素对植物毛状体形成和发育的调控,并探讨了茶等非模式植物毛状体发育的调控机制。以期为今后植物毛状体的基础和应用研究提供参考。
可用性数据和材料
不适用。
参考
- 1.
约翰逊HB。植物短柔毛:生态学的观点。机器人启41 1975;(3):233 - 58。
- 2.
萧k,毛Xh,林yl,xu hb,zhu ys,cai qh等。滴毛体,植物中的功能分集表型。mol Biol。2016; 2017(1):1-6。
- 3.
陈志强,陈志强,陈志强,等。表皮细胞命运的测定拟南芥:由类固醇诱导稳压器定义的图案。科学。1994年; 266(5184):436-9。
- 4.
Chien JC,Sussex Im。胃纤维素和光周期胞间叶片形成滴毛瘤的差异调节拟南芥(L.)Heynh。植物理性。1996年; 111(4):1321-8。
- 5.
Larkin JC,Young N,Prigge M,Marks MD。控制毛状体间距和数量拟南芥.发展。1996;122(3):997 - 1005。
- 6.
陈志强,陈志强,陈志强,等。植物体表毛状体的相位变化及其分布规律拟南芥.发展。1997年; 124(3):645-54。
- 7.
Perazza D, Vachon G, Herzog M. Gibberellins通过上调GLABROUS1促进毛状体的形成拟南芥.植物杂志。1998;117(2):375 - 83。
- 8.
王刚,冯慧娟,孙建林,杜晓明。通过棉花BTL、棉花SIM和棉花胚珠培养纤维的共表达诱导胚珠培养纤维分枝拟南芥STI基因。J Exp Bot. 2013;64(14): 4157-68。
- 9。
Guan XY, Pang MX, Nah G, Shi X, Ye W, Stelly DM, et al. miR828和miR858调控同源性MYB2基因功能拟南芥毛状体和棉纤维的开发。Nat Commun》2014。https://doi.org/10.1038/ncomms4050.
- 10.
李文强,吴建刚,翁少林,张东,张勇,史聪(GL1.)在米饭中(奥雅萨苜蓿L.)。植物细胞代表2010; 29(6):617-27。
- 11.
李金玲,曾丽玲,廖媛媛,唐娟,杨智。毛状体对茶叶代谢产物组成的贡献评价山茶花Sinensis.)叶子及其产品。LWT Food SCI Technol。2020。
- 12.
唐小林,尤涛,吴伟,孙丽,李哲。南京市两种常见街道树木的致敏性及防治。吉首大学学报(自然科学版)。35 2014;(3): 69 - 73。
- 13.
Theobald Wl,Krahulik JL,Rollins RC。毛滴注目和分类。双子膜子的解剖学I.牛津:Clarendon Mound;1980. p。40-53。
- 14.
Barthlott W,Wiersch S,Colic ZC,Koch K.在水蕨萨尔凡尼种类中的滴毛瘤的分类,以及蛋搅拌粒细胞的Ontogeny。植物学。2009; 87(9):830-6。
- 15.
Kim HJ, Han JH, Kim S, Lee HR, Shin J, Kim J,等。辣椒主茎毛状体密度与PepMoV抗性密切相关(甜椒L。).你。苹果。遗传。2011; 122(6):1051-8。
- 16.
ascensão,marques n,pais ms。Leonotis Leonurus植物和生殖器官的腺毛状体(Lamiaceæ).安机器人。1995;75(6):619 - 26所示。
- 17.
Brewer Ca,史密斯WK。模拟脱水对大豆素光合作用和产量的影响(大豆(L。)稳定。cv Williams)的毛状体密度。acta botanica sinica(云南植物学报),1994;
- 18.
王恩,谢泼德。植物毛状突起研究与开发的新途径。安机器人。2004;93(1):3-11。
- 19.
McDowell et,Kapteyn J,Schmidt A,Li C,Kang J,Descour A等。溶兰腺毛滴毛瘤的比较功能基因组分析。植物理性。2010; 155(1):524-39。
- 20。
Hegebarth D,Buschhaus C,Wu M,Bird Da,Jetter R.在胎儿的表面蜡的组成拟南芥与其他表皮细胞的蜡不同。工厂J. 2016; 88(5):762-74。
- 21.
Rakha M ., Bouba N ., Ramasamy S ., Regnard J ., Hanson P., an . Evaluation of wild tomato (Solanum spp.)测定了KOCH)基于滴毛组型和酰基熊含量。遗传。副资源。农作物ev。2017; 64(5):1011-22。
- 22.
赵强,陈小燕。植物毛状体的一种新功能。Nat植物。2016;2(7):16096。
- 23.
康建华,刘刚,石峰,Jones AD, Beaudry RM, Howe GA。番茄无嗅-2突变体在以毛为基础的各种专门代谢物的生产和对昆虫食草动物的广谱抗性方面存在缺陷。植物杂志。2010;154(1):262 - 72。
- 24.
康J,Shi F,Jones Ad,Marks MD,Howe Ga。番茄无毛突变的滴毛形态的变形会影响叶面化学。J Exp Bot。2009; 61(4):1053-64。
- 25.
张永强,张永强,李志强,等。植物激素对黄花蒿毛状体形成和抗疟化合物青蒿素生物合成的调控。新植醇。2010;189(1):176 - 89。
- 26.
高艳,何超,张东,刘旭,徐志强,田勇,等。两个毛状体双折射样蛋白介导木聚糖乙酰化,这对水稻抗叶枯病至关重要。植物杂志。2017;173(1):470 - 81。
- 27.
Busta L,Hegebarth D,Kroc E,Jetter R.切割蜡覆盖和开发的组成的变化拟南芥叶片受蜡质生物合成基因表达水平和毛状体密度的影响。足底。2017;245(2):297 - 311。
- 28.
Vitarelli NC, Riina R, Cassino MF, Meira RM。巴西高原岩石露头的巴豆中出现毛状突起:大气吸水的证据。植物生态学报。2016;1:23-35。
- 29.
Vanhoutte B, Schenkels L, Ceusters J, De Proft MP。葡萄品种对水和养分的吸收:毛状体和根。Environ Exp Bot. 2017; 1:21-30。
- 30.
陈光,赵建军,赵鹏,段瑞,Nevo E,等。一种沙生植物Agriophyllum squarrosum(L.)Moq .:潜在的食物作物。遗传。副资源。农作物ev。2014; 61(3):669-76。
- 31.
刘立,周LH,焦吉,刘某,张祖,卢TJ等。梯度机械性能有助于拟南芥滴塞组成机械传感器。申请母体接口。2016; 8(15):9755-61。
- 32.
周丽华,刘树平,王鹏,卢天军,徐飞,Genin GM,等。这拟南芥毛滴体是一个有源机械损伤开关。植物细胞环境。2017; 40(5):611-21。
- 33.
Oppenheimer DG, Herman PL, Sivakumaran S, Esch JJ, Marks MD拟南芥用尺寸表达。细胞。1991年; 67(3):483-93。
- 34.
戴旭,王刚,杨东升,唐勇,Broun P, Marks MD,等。植物毛状体的比较组学数据库。植物杂志。2009;152(1):44-54。
- 35.
Alahakoon Ui,Taheri A,Nayidu NK,EPP DJ,Yu M,Parkin Ia,等。毛茸茸的油菜(Brasssica显著在atgl3增强的毛状叶背景下,下调TTG1可促进毛状叶生长、毛状体覆盖率和代谢物基因表达多样性。植物学报。2016;16(1):e12。
- 36.
Ioannidi E, Rigas S, Tsitsekian D, Daras G, Alatzas A, Makris A,等。毛状体模式控制涉及TTG1与SPL转录因子的相互作用。植物学报。2016;92(6):675-87。
- 37.
李义,山X,高克,杨某,王某,高X等。来自Freesia Hybrida的两种IIIF CLADE-BHLHS在异化生物合成中发挥着发散的作用和不同的表达拟南芥.Sci众议员2016;6 (1):e30514。
- 38.
高C,Li D,Jin C,Duan S,QI S,Liu K,等。对血清素生物合成和培养的胞间组形成的Glabra3下游基因的基因组鉴定拟南芥.Biochem Bioph Res Co. 2017; 485(2):360-5。
- 39.
透明的TESTA GLABRA2,一种毛状体和种皮发育基因拟南芥,编码WRKY转录因子。植物细胞。2002;14(6):1359 - 75。
- 40。
戴X,周L,张W,Cai L,Guo H,Tian H,等。Glabra1的R3结构域中的单个氨基酸取代导致培养滴体形成的抑制拟南芥不影响其与GLABRA3的互动。植物细胞环境。2016; 39(4):897-907。
- 41。
Tominagawada R,Nukumizu Y,Sato S,Kato T,Tabata S,Wada T. MYB相关基因的功能分歧,狼人和ATMYB23拟南芥.Biosci Biotechnol Biochem。2012; 76(5):883-7。
- 42。
ESCH JJ,Chen M,Sanders M.一种矛盾的Glabra3等位基因有助于定义控制培养的基因相互作用拟南芥.发展。2003; 130(24):5885-94。
- 43。
Schellmann S,Schnitter A,Kirik V,Wada T,冈田K,Beermann A等。Triptychon和Caprice在滴毛组和根发图案中介导侧向抑制拟南芥.Embo J. 2002; 21(19):5036-46。
- 44。
TRY和CPC 2 (ETC2)的ENHANCER揭示了区域特异性控制毛状体发育的冗余性拟南芥.植物mol biol。2004; 55(3):389-98。
- 45。
透明TESTA GLABRA1网络的功能专一性允许不同的激素控制层和边缘毛状体启动拟南芥莲座丛叶。植物杂志。2008;148(3):1453 - 64。
- 46.
赵辉,王旭,朱东,崔胜,李旭,曹勇,等。在基础螺旋-环-螺旋转录因子AtMYC1的IIIf亚家族中,一个单一的氨基酸替换通过废除其与中伙伴蛋白的相互作用而导致毛状体和根毛模式缺陷拟南芥.J Biol Chem。2012; 287(17):14109-21。
- 47.
李顺峰,李春华,李春华,等。这拟南芥MYB5转录因子调节粘液合成,种子涂层发育和培养体形态发生。植物细胞。2009; 21(1):72-89。
- 48.
刘春梅,刘春梅,刘春梅。细胞分裂素与赤霉素信号通路的整合拟南芥表皮细胞命运调节中的转录因子GIS,ZFP8和GIS2。发展。2007; 134(11):2073-81。
- 49.
王志强,王志强,王志强,等。拓扑异构酶6B参与染色质重塑,与控制碳分配到次级代谢物和细胞壁和表皮形态发生有关拟南芥.J Exp Bot. 2014;65(15): 4217-39。
- 50。
Schnittger A,Weinl C,Bouyer D,Schobinger U,Hulskamp M.细胞周期蛋白依赖性激酶抑制剂ICLEN的Misexpression ICLIES拟南芥毛状体可减少exodoreduplication和细胞尺寸并诱导细胞死亡。植物细胞。2003; 15(2):303-15。
- 51。
Sugimotoshirasu K, Stacey N, Corsar J, Roberts K, Mccann MC. DNA拓扑异构酶VI是必需的核内复制拟南芥.咕咕叫医学杂志。2002;12(20):1782 - 6。
- 52。
蔡恩华。微管稳定导致生长再定向拟南芥毛状体。植物细胞。2000;12(4):465 - 77。
- 53。
高艳,龚晓明,曹文辉,赵建峰,傅立强,王小春,等。SAD2在拟南芥通过介导GL3的功能和调控GL1、ttg1和GL2的表达,调控毛状体的起始。acta botanica yunnanica(云南植物研究). 2008;50(7):906-17。
- 54。
教堂ML,棕色ML,KATO N,Kirik V,HULSKAMP M,INZE D等人。暹罗,一种植物特异性细胞周期调节器,控制incoreplication发作拟南芥.植物细胞。2006; 18(11):3145-57。
- 55.
Perazza D,Herzog M,Hulskamp M,Brown SW,Dorne A,Bonneville J. Trichome细胞生长拟南芥可以在至少五个基因中的突变进行解毒。遗传学。1999年; 152(1):461-76。
- 56.
张志强,张志强,张志强,等。CPR5参与细胞增殖和细胞死亡控制,并编码一种新的跨膜蛋白。咕咕叫医学杂志。2001;134(4):1891 - 5。
- 57.
Morohashi K,Grotewold E.系统方法揭示了监管电路拟南芥GL3和GL1选择器的毛状体启动。Plos Genet。2009; 5:2。
- 58.
HD-zip蛋白GL2和HDG11具有冗余功能拟南芥颗粒,GL2通过MyB23激活正反馈回路。植物细胞。2014; 26(5):2184-200。
- 59.
Suo BX,Seifert S,Kirik V.拟南芥玻璃毛基因促进毛状体乳头的发育。J Exp Bot. 2013;64(16): 4981-91。
- 60.
Bischoff V,Nita S,Neumetzler L,Schindelasch D,Urbain A,Eshed R等人。毛状体双折射及其同源物AT5G01360编码纤维素生物合成所需的植物特异性DUF231蛋白拟南芥.植物理性。2010; 153(2):590-602。
- 61.
Jakoby M,Falkenhan D,Mader Mt,Brininstool G,Wischnitzki E,Platz N等人。成熟的转录分析拟南芥毛状体显示Noeck编码混合物样转录调节器MyB106。植物理性。2008; 148(3):1583-602。
- 62.
Payne T,Clement J,Arnold D,Lloyd Am。不同从GL1的异源MYB基因提高尼古拉塔纳氏菌菌在烟囱过表达时的产量。发展。1999; 126(4):671-82。
- 63。
徐斌,王磊,陈晓霞。棉花MYB基因启动子在毛状体中的功能拟南芥和烟草的腺毛。中国生物医学工程学报。2008;59(13):3533-42。
- 64。
李b,李德德,张俊,夏h,王xl,li y等。编码膜蛋白的棉花3优先于纤维中表达并促进转基因中的叶子毛状物的开始和伸长率拟南芥.acta botanica yunnanica(云南植物研究). 2013;55(10):902-16。
- 65。
TTG基因在特定的表皮细胞命运和细胞模式中是必需的拟南芥根。Dev杂志。1994;166(2):740 - 54。
- 66。
Walker Ar,Davison Pa,Bolognesi-Winfield Ac,James Cm,Srinivasan N,Blundell TL等人。透明的Testa glabra1基因座,其调节毛细血体分化和花青素生物合成拟南芥,编码WD40重复蛋白。植物细胞。1999;11(7):1337 - 50。
- 67。
李明国,郑志刚,李明国,等。MYB23和GL1基因在毛状体形态发生和起始中的功能分化发展。2005;132(7):1477 - 85。
- 68。
Payne CT,张F,Lloyd Am。GL3编码一个调节毛毛皮组的BHLH蛋白质拟南芥通过与GL1和TTG1的交互。遗传学。2000; 156(3):1349-62。
- 69。
张F,Gonzalez A,Zhao M,Payne Ct,Lloyd Am。冗余BHLH蛋白质网络在所有TTG1依赖性途径中函数拟南芥.发展。2003;130(20):4859 - 69。
- 70。
王sc,陈杰克。拟南芥瞬时表达分析表明,GLABRA2的激活可能需要GLABRA1和GLABRA3与GLABRA2的启动子同时结合。植物生理学报。2008;49(12):1792-804。
- 71。
Bloomer Rh,Juenger Te,Symonds VV。GL1的自然变化,其对培养物密度的影响拟南芥.Mol Ecol。2012; 1:3501-15。
- 72。
齐涛,黄洪,吴东,严军,齐勇,宋胜,等。拟南芥DELLA和JAZ蛋白结合WD-repeat/bHLH/MYB复合物调控赤霉素和茉莉酸信号协同作用。植物细胞。2014;21(14):1118 - 33所示。
- 73。
黄志强,王志强,王志强,等。毛状体起始和形态发生的分子遗传分析进展拟南芥.植物科学进展,2000;5(5):214-9。
- 74。
Meinhardt H,Gierer A.基于侧向抑制的生物学模式形成理论的应用。J Cell SCI。1974; 15(2):321-46。
- 75。
杨cx,ye zb。毛状体作为研究植物细胞分化的模型。细胞mol寿命。2012; 70(11):1937-48。
- 76。
在其他真核生物中不存在的古细菌拓扑异构酶同源物对植物细胞增殖是必不可少的。咕咕叫医学杂志。2002;12(20):1787 - 91。
- 77。
一个L,周Z,SU S,Yan A,GaN Y.通过凝胶酸信号传导需要牵铬体支化所需的无毛花序茎(GIS)拟南芥.植物生理学杂志。2011;53(2):457-69。
- 78。
Vespa L,Vachon G,Berger F,Perazza D,Faure J,等。免疫蛋白 - 相互作用的蛋白质ATFIP37拟南芥是植物发育所必需的,并参与毛体核内再复制。植物杂志。2004;134(4):1283 - 92。
- 79.
Jacobsen Se,Binkowski Ka,Olszewski Ne。Smindly,涉及胃肠杆菌素信号转导的四肽重复蛋白拟南芥.美国Natl Acid Sci。1996; 93(17): 9292 - 6。
- 80。
Tominagawada R,Nukumizu Y,Sato S,Wada T.番茄的植物培养和根发发育的控制(茄属植物lycopersicum) R3 MYB转录因子。《公共科学图书馆•综合》。2013;8:1。
- 81。
Vernoud V, Laigle G, Rozier F, Meeley RB, Perez P, Rogowsky总理。HD-ZIP IV转录因子OCL4是玉米毛状体形成和花药发育所必需的。植物j . 2009; 59(6): 883 - 94。
- 82。
Lloyd Am,Walbot V,Davis RW。拟南芥玉米调节剂R和C1激活尼古利亚纳花青素生产。科学。1992年; 258(5089):1773-5。
- 83.
Spyropoulou Ea,Haring Ma,Schuurink RC。RNA测序茄属植物lycopersicum粒状鉴定激活萜烯合酶启动子的转录因子。BMC基因组学。2014; 15(1):402。
- 84.
李Q,Cao C,张C,郑S,王Z,王L等。形成胎儿所需的Cucumis Sativus无毛1(CSG1)揭示了同源域 - 亮氨酸拉链I基因的新功能。J Exp Bot。2015; 66(9):2515-26。
- 85.
王克,黄克,朱y。转移元素在棉花基因组进化和纤维细胞发育过程中发挥着重要作用。科学生中国生活SCI。2015; 59(2):112-21。
- 86.
Scutenaire J,Deragon J,Jean V,Benhamed M,Raynaud C,Favory J等人。yth结构域蛋白Ect2是正常培养的分支所需的M6a阅读器拟南芥.植物细胞。2018; 30(5):986-1005。
- 87。
Wei L,Song P,Wang Y,Lu Z,Tang Q,Yu Q等。M6A阅读器Ect2通过影响mRNA稳定性来控制培养体形态拟南芥.植物细胞。2018;30(5):968 - 85。
- 88。
高S,高Y,Xiong C,Yu G,Chang J,Yang Q等。番茄B型细胞周期蛋白基因,Slcycb2,在生殖器官发育中,培养的培养运动,三萜类生物合成和饲养症Litura防御中的关键作用。植物SCI。2017; 2017年:103-14。
- 89。
voinnet O.植物microRNA的起源,生物生物和活性。细胞。2009; 136(4):669-87。
- 90。
微rna对mRNA翻译和稳定性的调控。生物化学学报。2010;79(1):351-79。
- 91。
Yu N,Cai W,Wang S,Shan C,Wang L,Chen X. MicroRNA156靶向SPL基因的滴毛体分布的时间控制拟南芥.植物细胞。2010;22(7):2322 - 35。
- 92。
Bhogale S,Mahajan A,Natarajan B,Rajabhoj M,Thulasiram HV,Banerjee A. MicroRNA156:一种潜在的移植式传播微小RNA,可在Solanum Tuberosum SSP中调制植物建筑和核算。安迪纳。植物理性。2014; 164(2):1011-27。
- 93。
Rhoades MW, Reinhart BJ, Lim LP, Burge CB, Bartel B, Bartel DP。植物microRNA靶标的预测。细胞。2002;110(4):513 - 20。
- 94。
吴G.拍摄发展的时间调节拟南芥通过mir156及其目标spl3。发展。2006; 133(18):3539-47。
- 95。
MicroRNA156是一种很有前途的苜蓿改良工具。植物学报;2015;13(6):779-90。
- 96。
薛X,赵b,陈l,陈d,崔w,毛y等。两个时序微稻草之间的相互作用控制毛滴毛分布拟南芥.公共科学图书馆麝猫。2014;10:4。
- 97。
风扇D,RAN LY,HU J,YE X,XU D,LI J等。MiR319A / TCP模块和Della蛋白调节培训型起始协同作用,改善Populus tomentosa的昆虫防御。新植物。2020; 227(3):867-83。
- 98。
Traw MB,Bergelson J.茉莉酸,水杨酸和吉布林蛋白在胎儿诱导中的互动作用拟南芥.植物杂志。2003;133 (3):1367 - 75。
- 99。
齐T,歌曲,任q,吴d,黄鹤,陈y等。jasmonate-zim结构域蛋白与WD-Repeed / BHLH / MYB复合物相互作用,以调节茉莉酸介导的花青素积累和培养型起始拟南芥.植物细胞。2011;23(5):1795 - 814。
- 100。
邓炜,杨y,仁z,audrandelande c,米拉I,王x等。番茄SLIAA15参与毛状体形成和腋下射击发育。新植物。2012; 194(2):379-90。
- 101。
Inthima P,Nakano M,Otani M,Niki T,Nishijima T,Koshioka M等。嗜来自嗜血蛋白的嗜来自嗜来自特罗尼亚的胃肠杆菌20-氧化酶基因的过度表达,其改性培养的滴毛组形成和葡萄球菌植物细胞组织组织植物组织组织术。2017; 129(2):223-36。
- 102。
周志强,孙丽,赵玉兰,安玲,严安,等。锌指蛋白6 (Zinc finger protein 6, ZFP6)通过整合赤霉素和细胞分裂素信号来调控毛状体的起始拟南芥.植物杂志。2013;198(3):699 - 708。
- 103.
夏旭,胡强,李伟,陈勇,韩磊,陶明,等。棉(gossypium hirsutum)Jaz3和SLR1在茉莉酸盐和胃蛋白酶介导的表皮细胞分化和伸长率。植物细胞组织org。2018; 133(2):249-62。
- 104.
Greenboim-Wainberg Y,Maymon I,Borochov R等。吉布林素和细胞蛋白之间的交叉谈话:拟南芥GA反应抑制剂在细胞蛋白信号传导中起着积极作用。植物细胞。2005; 17(1):92-102。
- 105.
严T,陈米,沉Q,Li L,Fu X,Pan Q等。在Arte-Misia Annua的jasMonate介导的腺培养型滴毛组中需要同源域蛋白1。新植物。2017; 213(3):1145-55。
- 106。
Bosch M,Wright LP,Gershenzon J,Wasternack C,Hause B,Schaller A等人。茉莉酸及其前体12-氧代苯甲酸控制组成型的不同方面,并在番茄中诱导的食草动物防御。植物理性。2014; 166(1):396-410。
- 107。
Kazama H, Dan H, Imaseki H, wasteney GO。短暂暴露于乙烯刺激细胞分裂,改变下胚轴表皮细胞的命运和极性。植物杂志。2004;134(4):1614 - 23所示。
- 108。
石y,朱思,毛x,冯j,qin y,张l等。转录组分析,分子生物学和生理学研究揭示了乙烯在棉纤维细胞伸长中的主要作用。植物细胞。2006; 18(3):651-64。
- 109。
Qin Y,Hu C,Pang Y,Kastaniotis Aj,Hirtunen JK,朱Y.饱和的非常长链脂肪酸促进棉纤维和拟南芥通过激活乙烯生物合成的细胞伸长。植物细胞。2007; 19(11):3692-704。
- 110。
乙烯受体ETR2通过调节微管组装来控制毛状体的分支拟南芥.中国农业科学。2009;60(13):3923-33。
- 111。
Lu R,Zhang J,Liu D,Wei Y,Wang Y,Li X.涉及铜纤维开发中的BHLH / HLH基因的BHLH / HLH基因的表征(gossypium hirsutum).BMC植物BIOL。2018; 18(1):1-13。
- 112。
Hendrick MF,Finseth FR,Mathiasson Me,Palmer Ka,Broder Em,Breigenzer P等人。极端微观摄影适应的遗传学:综合方法鉴定了黄石模拟牙图株叶片毛细血管分歧的主要基因。Mol Ecol。2016; 25(22):5647-62。
- 113。
Mazie Ar,Baum da。在发育基因上的思思思态阳性选择:植物毛皮组织和植物在Physaria中的星状粒细胞的演变(十字花科).Mol phygenew Evol. 2016; 1:31-40。
- 114。
宁P,王家,周y,高L,王继,龚C.植物克尔赫林斯西氏菌对黄土高原天然干旱胁迫的适应演化。NAT ECOL EVOL。2016; 6(11):3786-95。
- 115。
Karraybouraoun,Rabhi M,Neffati M,Baldan B,Ranieri A,Marzouk B等人。盐对丸叶叶片产量及幼虫形态和密度的产量及组成。ind crop prod。2009; 30(3):338-43。
- 116。
4 .叶龄和盐度对大叶牛尾草(Origanum majorana L. afetados pela idade da folhagem e pela salinidade)幼苗精油和毛状体密度的影响= Óleo大叶牛尾草(Origanum majorana L. afetados pela salinidade da folhagem e pela salinidade)。Biosci j . 2016; 32:1。
- 117。
田D,Peiffer M,De Moraes Cm,Felton GW。乙烯和茉莉酸在番茄中系统诱导防御中的作用(茄属植物lycopersicum)针对Helicoverpa Zea。Planta。2014; 239(3):577-89。
- 118。
Prozherina N,Freiwald v,Rousi M,Oksanen E.春天时间霜冻和臭氧对早期生长,叶面损伤和叶片结构的影响,桦木(Betula pendula Roth)基因型的影响。新植物。2003; 159(3):623-36。
- 119。
燕A,潘j,le,gan y,feng h.滴毛组突变体对增强紫外-b辐射的反应拟南芥.J Photochem Photobiol B. 2012:29-35。
- 120。
Kooyers NJ,Greenlee Ab,Colicchio Jm,哦,黑人BK。复制普拉迪特·克莱丁揭示了进化柔韧性在年幼的模拟古塔努塔斯中适应干旱胁迫。新植物。2015; 206(1):152-65。
- 121。
Scoville AG, Barnett LL, Bodbylroels SA, Kelly J, Hileman LC。MYB转录因子的差异调控与菌毛密度的跨代表观遗传相关。新植醇。2011;191(1):251 - 63。
- 122。
崔军,苗华,丁磊,刘鹏,王永强,等。黄瓜毛状体发育中发现一个新的无毛基因csgl3 (L Cucumis巨大成功)。《公共科学图书馆•综合》。2016;11:3。
- 123。
杨C,李H,张J,罗Z,龚P,张C等人。调节基因在番茄中诱导毛状体形成和胚胎致命性。p natl一个sci。2011; 108(29):11836-41。
- 124。
张俊,鲁y,元y,张x,耿j,陈y等。基于地图控制牙科基因的克隆与表征芸薹属RAPA中的毛涂色特征。植物mol biol。2009; 69(5):553-63。
- 125。
王志强,王志强,王志强,等。表达AtGL3转录因子的甘蓝型油菜(Brassica napus)品系子叶生化组成和转录组的变化。BMC Plant biology . 2018;18(1):1 - 19。
- 126。
孙波,朱震,刘锐,王磊,戴飞,曹飞,等。透明TESTA GLABRA1 (TTG1)调节茶树叶毛状体密度。北方J机器人。2020;38:1。
- 127.
悦c,曹h,陈d,林h,王z,hu j等。毛茸茸无毛茶厂的比较转录组研究(山茶花Sinensis.)拍摄。植物2018:41-52杂志。
- 128.
周志强,安立,孙立军,朱树华,席伟,Broun P .,等。锌指蛋白5通过作用于锌指蛋白8的上游来控制毛状体的起始拟南芥.植物杂志。2011;157(2):673 - 82。
- 129.
闫阿,吴米,赵啊,张A,刘B,Schiefelbein j等。C2H2锌手指蛋白在表皮细胞命运测定中的参与拟南芥.acta botanica yunnanica(云南植物研究). 2014;56(12):1112-7。
- 130。
Matías-Hernández L, Aguilar-Jaramillo, et al.;TEMPRANILLO揭示了叶肉为表皮毛状体的形成。植物杂志。2016;170(3):1624 - 39。
- 131。
王米,赵p,cheng h,han l,wu x,gao p等。棉花转录因子TCP14在疾病介导的表皮细胞分化和伸长中的作用。植物理性。2013; 162(3):1669-80。
- 132。
Steiner E,Efroni I,Gopalraj M,Saathoff K,Tseng Ts,Kieffer M等。这拟南芥O-连接的N-乙酰葡糖胺转移酶与I类TCPS立即相互作用,以促进叶子和花中的细胞蛋白反应。植物细胞。2012; 24(1):96-108。
- 133。
TCP4转录因子通过直接激活无毛花序茎部调控毛状细胞分化拟南芥.工厂J. 2018; 93(2):259-69。
- 134。
Shimada A,Ueguchi-Tanaka M,Sakamoto T,等。通过控制Della蛋白,SLR1和调节芸苔类固醇合成的抑制功能,水稻基因作为胃肠杆菌素信号传导的负调节剂。工厂J. 2006; 48(3):390-402。
- 135。
Marks MD,Betancur L,Gilding EK,Chen F,Bauer S,Wenger JP等。一种隔离大量的新方法拟南芥转录组,细胞壁和其他类型分析的毛状体。工厂J. 2008; 56(3):483-92。
- 136。
李鹏,徐y,张y,傅j,yu s,gu h等。代谢物分析和转录体分析显示茶叶毛茶叶和茶叶植物防御的化学贡献。JAgric Food Chem。2020。https://doi.org/10.1021/acs.jafc.0c04075..
- 137。
布朗GD。青蒿素的生物合成及黄花蒿的植物化学研究。分子。2010;(11):7603 - 98。
- 138。
Sirikantaramas S,Morimoto S,Shoyama Y,Ishikawa Y,Wada Y,Shoyama Y等。控制大麻心理活动的基因。J Biol Chem。2004; 279(38):39767-74。
致谢
不适用。
资金
本研究在贵州科技支持项目(Qiankehe支持[2019] 2257)的财务支持;贵州科技计划项目(Qiankehe平台人才[2018] 5768-03);贵州蔬菜品种创作与工业化(Qiankehe平台人才[2017] 5715);贵州高级创新人才培训,百级才能项目(Qiankehe Talent [2015] 4024);贵州农业科学院(贵州农业科学院种质资源[2020] 10)。
作者信息
隶属关系
贡献
XJW,CS,PHM,GFT和LTL收集了手稿数据,XJW和CS编写了稿件,GFT,PHM和LTL批准了最终手稿,所有作者都已读取并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
没有伦理批准和同意参与本手稿。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王旭东,沈C.,孟,P。et al。植物中胎儿的分析与评论。BMC植物杂志21,70(2021)。https://doi.org/10.1186/s12870-021-02840-x
收到了:
公认:
发表:
关键字
- 毛皮组织
- 转录因素
- 环境
- 荷尔蒙
- 非编码RNA