- 研究文章
- 开放访问
- 发布:
Putrescine-官能化的碳量子点(PUT-CQD)纳米颗粒有效地葡萄葡萄(葡萄简历。‘Sultana’)来对抗盐胁迫
BMC植物生物学体积21., 文章编号:120.(2021)
抽象的
背景
盐度是一种重要的全球性问题,对植物产生了破坏性影响,导致植物的不同生化和代谢变化通过诱导氧化应激,使植物的代谢,生长,性能和生产力扰动。鉴于Putrescine(Put)和碳量子点(CQDS),单独地对不同的植物过程中具有有希望的效果,它们在纳米结构“PUT-CQD”中的组合的想法导致其合成来评估协同的潜在开发效果。目前的研究旨在调查由CQD组成的新合成纳米粒子(NPS)的应用并放入葡萄(葡萄简历。‘Sultana’)在盐度胁迫条件下。为此,Put、cqd和Put- cqd NPs分别为5和10 mg L- 1浓度在“苏丹国葡萄48H的”苏丹国“葡萄48H之前的盐分应力拼版(0和100mM NaCl)中施用为化学灌注剂。
结果
盐度显着下降(P.(≤0.05)形态参数、光合色素、叶绿素荧光参数和膜稳定性指标。此外,盐度增加MDA、H2O.2,脯氨酸含量和抗氧化酶活性。结果表明,Put-CQD NPS,特别是在10毫克L.- 1通过提高叶片鲜重和干重,K+内容,光合色素,叶绿素荧光和SPAD参数,脯氨酸含量,总酚和抗氧化酶活性(CAT,APX,GP和SOD),而减少的Na+内容,EL,MDA和H2O.2的水平。
结论
综上所述,Put-CQD NPs是一种创新的启动处理,可以有效地应用于葡萄植株在盐胁迫条件下提高植株性能。
背景
非生物胁迫因素如盐度和干旱正在影响大部分农业用地,限制了栖息地的植物分布。盐胁迫,重大环境约束和关键的全球气候变化相关的问题,使性能和植物的产量[负面影响1那2].在形态,生理,营养和生化特性,离子毒性或不平衡实质障碍(钠+和Cl.-)渗透胁迫是植物中的一些主要盐度影响[3.].因此,盐胁迫导致大量的生化和代谢变化,从而导致植物的氧化应激[2那4.].
化学引物是处理盐等胁迫的几种方法之一,作为一种有利的技术,提高植物对不同胁迫的耐受性[5.那6.],其发生之前[7.].天然化合物,如氨基酸(如脯氨酸和甘氨酸甜菜碱[8.];)和激素(例如,水杨酸[9.),以及合成分子(如nosh -阿司匹林[10.];),是许多材料中,其具有抗应力的引发剂的潜力。此外,某些化学物质(例如,[11.])和纳米颗粒(NPS)(例如,[12.那13.)可以通过启动来改善盐胁迫的负面影响。
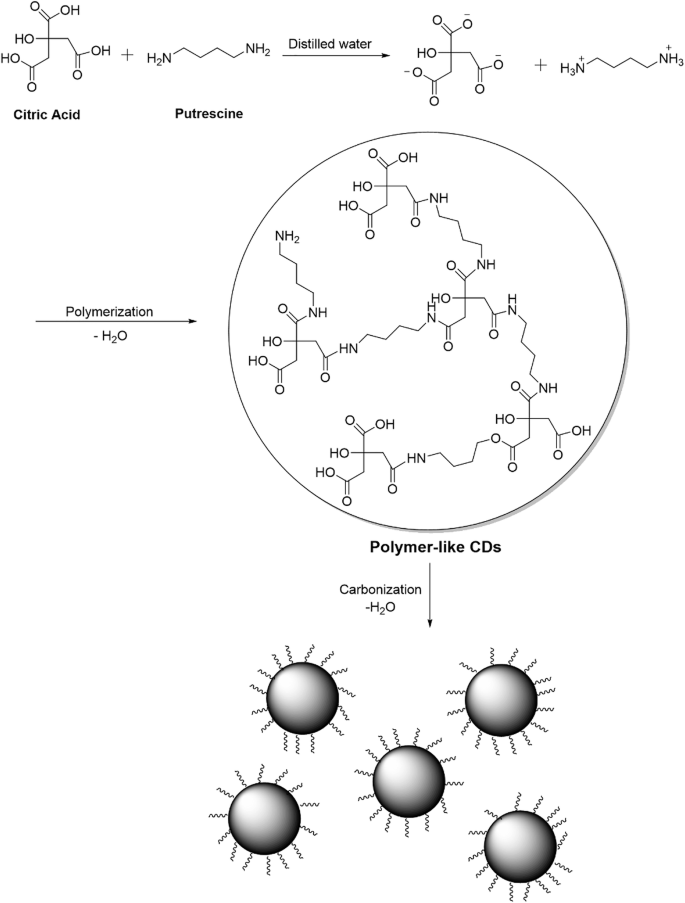
纳米技术提出了大量的好处,如通过改进纳米结构使化学品具有优越的性能,然后通过化学底漆的应用减少了它们的环境负荷[14.].因此,它们的应用代表了一种很有前景的农业产业策略[15.].NPs通过对ROS的解毒作用,对植物的生长发育以及植物对非生物胁迫的耐受性有很大的影响[16.].此外,作为对非生物应激敏感的细胞过程的光合作用可以通过降低渗透和氧化应激来保护NP应用来保护[14.].随后,NP在这方面的应用也越来越受到关注。量子点(QD) NPs的尺寸为2-10纳米,这使它们具有载流子的作用和尺寸相关的基本特性。它们是能量量子化的零维半导体NPs [17.].此外,量子点被广泛用于亚细胞标记和成像生物学研究通过其独特的荧光特征[施加18.].碳量子点(CQDs)作为含氧碳化合物的新一代量子点NPs,其性质与碳基NPs有所不同[19.].CQD NPS尺寸小于10nm(如其他QD),圆形,具有巨大的使用范围(例如,低或无毒性,生物相容性,生物相容性和生物溶解性,生物相容性和生物溶解性的高毒性和高水溶性,生物相容性和生物溶解性)的圆形(如此。20.].一些研究表明,不同的量子点对植物有有利的影响;石墨烯量子点使处理过的大蒜和香菜种子的生长参数(如叶、根、芽、花和果实)增加[21.].CQD NPS由于Rubisco酶活性增加而增强了水稻产量。此外,通过增强的Thionin基因表达,它们改善了种子萌发,根伸长,碳水化合物产生和抗病患者[22.].
腐胺(putresine, Put)是一种重要的多胺(polyamine, PAs),在植物的生长和分化中起着重要的作用,特别是在盐胁迫下[1那23.那24.那25.].Put稳定生物膜和细胞的大分子结构[26.].具有低分子量的聚阳离子和性质[27.那28.],放入众多生理和发育过程中的重要作用,如细胞分裂,流管生成,胚胎发生,衰老,花卉发育和果实设置和成熟。值得陈述,在压力条件下放入浓度增加,以增强对压力源的植物容差[26.].在把内容这种增加的趋势被报道在盐胁迫下植物[29.].放的应用提高通过稳定膜和细胞结构,清除自由基,调节离子通道,维持阳离子 - 阴离子平衡,并通过ATP合成的刺激激励细胞抗逆[24.那28.].因此,外源Put处理可被认为是提高植物在盐度下生产性能的典型尝试,主要通过提高光合效率和防止叶绿素损失[1].植物物种,应力的持续时间和强度,植物组织和应用治疗的发育阶段可能会影响压力条件下植物的含量。通过表现出对压力条件的反应证明了其作为信号分子的作用[26.].放可以逆转以Na引起的应力,减少细胞膜损伤,脂质过氧化,ROS积累,增加生长抑制+和Cl.-和叶绿素的损失,也增加渗透反应基因的表达,抗氧化酶活性,非酶化合物和相容渗透剂[29.].舒尔。[1]注意到,认沽治疗增加盐度条件下植物中Put含量。放应用程序通过改善植物生长和抗氧化酶活性,抑制的Na减少应力和盐胁迫条件下的植物的脂质过氧化损伤+和Cl.-摄取和加速k的累积+,加利福尼亚州2+和米格2+[30.].
葡萄藤 (葡萄(L.)被认为是世界范围内种植的最重要、最具附加值的农产品之一,因而具有重要的经济意义[31.].对盐胁迫的葡萄葡萄葡萄葡萄葡萄,对生长和生产率的显着损失以及盐度条件下的果实质量[32.].
考虑到CQD NPS的保护性能并在单独应用时放置,特别是在减少盐度应力的破坏性效果时,用CQD NPS(PUT-CQD NPS)的缀合可以改善放入植物细胞的入口,从而提高其效率,特别是在较低剂量。因此,在合成Put-CQD NPS后,将NPS作为葡萄葡萄葡萄中的引发剂(葡萄简历。“苏丹娜”)为了减轻盐压力条件的不良影响,代表了对我们知识的第一报告。
结果
Put-CQDS合成和表征
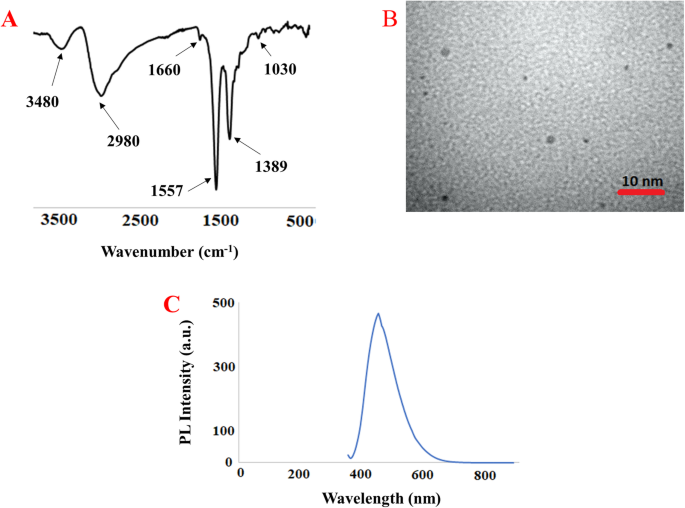
采用一锅易水热法制备了Put-CQD NPs。柠檬酸是最常用的碳源,它既可以单独使用,也可以与其他功能化胺一起用于制备CQDs。从图中可以看出。1,柠檬酸的羧酸基团首先浓缩与矿物质的胺基团,导致形成聚合物样CQDS,然后碳化以形成CD。使用FTIR和TEM分析表征合成的PUT-CQD NP的结构组成和形态。在Put-CQD NPS的FTIR光谱中(图。2一种)那Characteristic bands at 3480 cm- 1和2980厘米- 1对应于分别-O-H和C-H,的伸缩振动。The sharp bands at 1557 cm- 1和1389厘米- 1可能与分别弯曲NH和C-NH-C的振动。Moreover, C=O and C–N stretching vibration could be seen at 1660 cm- 1和1030厘米- 1.数字2b为Put-CQD NPs的TEM图像。可以看出,所合成的Put-CQD NPs分散均匀,无明显的聚集,粒径在3 - 5nm范围内。PL光谱在λ范围内呈现蓝色荧光马克斯一种t 440 nm under 360 nm UV-light (Fig.2C)。
叶FW和DW
盐度叶FW和DW负面影响。叶FW显著上升(P. ≤ 0.05) by 10 mg L- 1放5毫克和10毫克- 1PUT-CQD NPS;然而,其他治疗无效或降低了对照条件下的重量。所有治疗都在控制条件下增强了叶片DW。在盐胁迫条件下,10毫克l- 1CQD NPS和5和10 MG L.- 1PUT-CQD纳米粒子增加的叶FW,而其他涂刷处理与在盐的非底层葡萄相比未表现出效果。所有启动处理盐度条件下提高叶DW。Under both conditions, 10 mg L- 1Put-CQD NPS可以被认为是最佳启动治疗(表1).
离子稳态
盐度显着下降(P. ≤ 0.05) K+含量,增加娜+内容和NA+/ K.+比率。在非盐条件,所有的治疗降低的Na+内容与控制和k相比+内容仅在10 mg l引发的葡萄曲线中增强- 1把-CQD纳米颗粒。因此,所有启动的治疗增加了娜+/ K.+ratio, with the exception of 5 mg L- 1加入10mg L- 1与控制相比没有效果的CQD。在盐度条件下,所有治疗均降低NA+内容和NA+/ K.+Put和Put- cqd NPs处理(5和10 mg L .- 1)增加K+内容。Put-CQD NPS在10毫克l- 1浓度对K的抑制效果最好+, Na+和na+/ K.+两种情况下的比率(表1).
生理参数
CHL.一种那B.类胡萝卜素含量随盐度的增加而降低。显著增加(P.≤0.05)一种和B.Put和Put- cqd NPs启动处理后,观察其含量;对照条件下,所有启动处理的类胡萝卜素含量均高于对照。在胁迫条件下,所有处理均显著增加ChlA,B和类胡萝卜素含量。Put-CQD NPS在10毫克l- 1导致CHL的最高价值A,B和类胡萝卜素水平。盐度对SPAD值有负向影响。除了10毫克升的CQDs- 1这表明对对照没有显着差异,其他处理在非应力条件下增强了SPAD值。通过放入(5和10 mg L.- 1)、cqd (10mg L- 1)和Put-CQD NPs(5和10 mg L- 1)盐胁迫条件下的引发处理。最高的SPAD值记录在10毫克L.- 1put-cqd nps-primed葡萄(表2).
盐胁迫对叶绿素荧光参数有显著的负面影响。FV/调频所有治疗增加,唯一的例外为5 mg l- 1CQDs底漆处理与未底漆、无应力样品没有差异。所有的启动处理都有积极的影响FV/调频应激条件下。把和Put-CQD纳米颗粒吸治疗增加FV/佛控制和胁迫条件下的参数。Regarding Y (II) parameter, Put-CQD NP treatments (5 and 10 mg L- 1)导致其显着增加(P. ≤ 0.05) under control conditions. Under salinity stress, all treatments enhanced Y (II) parameter. Considering all parameters, Put-CQD NPs at 10 mg L- 1浓度代表了控制应力和应力条件下的最佳处理(表3.).
细胞损伤指标
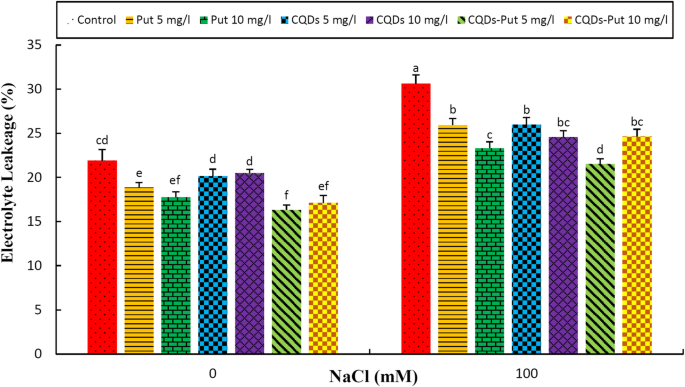
盐度显著增强(P. ≤ 0.05) in electrolyte leakage (EL). All priming treatments significantly decreased EL values under both control and stress conditions with optimal protection being achieved following 5 mg L- 1放置cqd NPs底漆处理(图。3.).
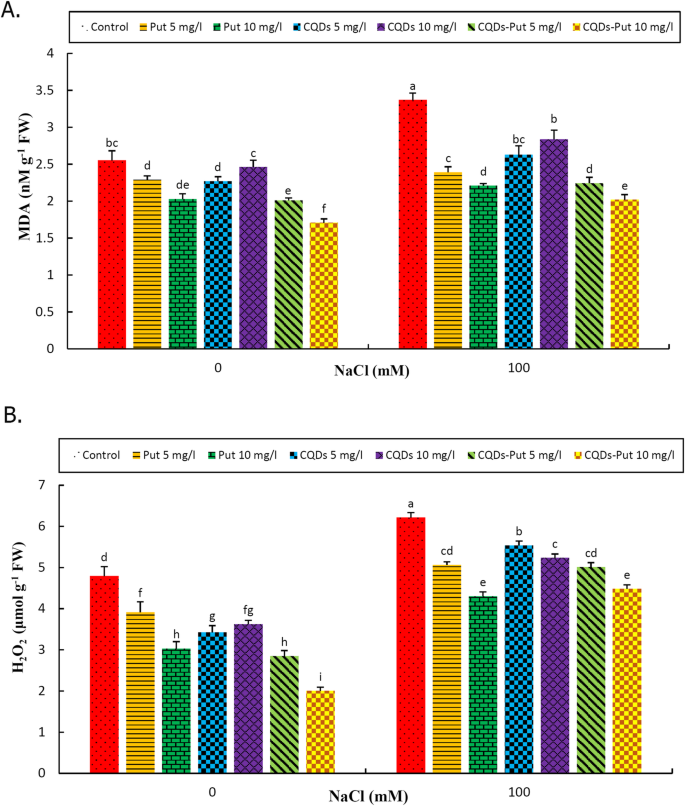
正如预期的那样,MDA和H.2O.2盐胁迫后含量增加,而启动处理显著降低(P. ≤ 0.05) MDA and H2O.2控制和压力条件下的内容。一般来说,10毫克l- 1PUT-CQD NP引发处理提供了MDA和H的改善方面的最佳结果2O.2在两个条件下增加(图。4.a,b)。
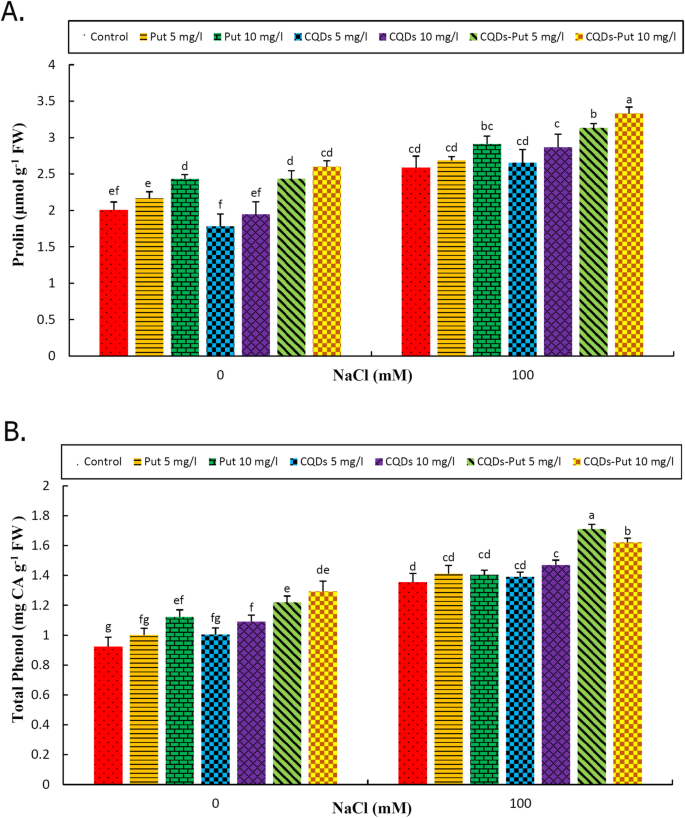
脯氨酸和总酚类化合物
盐度显着增强(p≤0.05)脯氨酸含量和葡萄总酚类化合物(图。5.).在控制和胁迫条件下,启动处理包括Put 10 mg L- 15毫克和10毫克的放置cqd NPs- 1浓度显著提高了脯氨酸含量,而其他处理对脯氨酸含量无显著影响。脯氨酸含量在10 mg L时最高- 1两种条件下的Put-CQD NP处理(图。5.一种)。在控制条件下,所有启动治疗(除了5 mg l的put和cqds之外- 1浓度)增加了总酚类物质。在盐度条件下,10mg L- 1cqd, 5毫克和10毫克- 1PUT-NP CQD吸治疗增强酚含量;与在盐的非底层葡萄相比其他治疗都没有效果。脯氨酸含量在10 mg L时最高- 1在盐胁迫条件下,Put-CQD NP启动葡萄(图。5.b)。
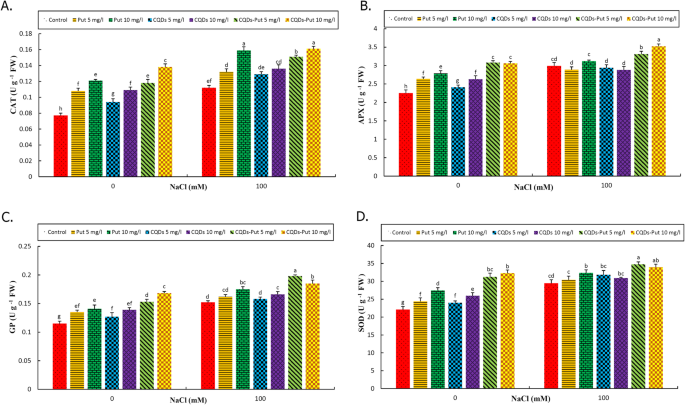
抗氧化剂酶活性
抗氧化酶活性(CAT, APX, GP和SOD)在盐胁迫下增强。6.).所有引发治疗均在控制和应力条件下增加猫酶活性,酶的最高活性记录在10毫克L以下- 1放cqd NP,然后放10mg L- 1盐度条件下的浓度(图。6A).
考虑到APX酶,所有引发处理均可在控制条件下增强其活性,最佳结果在5℃和10毫克L.- 1Put-CQD NP治疗。在盐度条件下,只有5和10 mg L- 1把-NP CQD吸显著增加APX活性,而其他涂刷处理与在盐的非底层葡萄(图相比没有显著影响。6.b)。
在控制条件下,所有治疗增加了GP酶活性,并在10毫克升之后记录了最佳活动- 1Put-CQD NP治疗。Most treatments, enhanced GP activity under salt stress, with the exception of 5 mg L- 1放5毫克l- 1CQD治疗在盐度下展示了在未提生的葡萄树中的类似GP活性。在申请5 mg l后记录了最高活动- 1PUT-CQD NPS(图。6.C)。
SOD酶活性增加显著(P.≤0.05)。在10mg L时活性最高- 1Put-CQD NP治疗。在盐度条件下,所有处理(除5mg L- 1施用)增强的SOD活动,最佳结果记录在5和10 mg l以下- 1PUT-CQD NP引发处理(图。6.d)。
讨论
盐度通过诱导的渗透胁迫对植物生长及其生理、代谢和生物学途径产生负面影响[2].因此,盐度降低叶FW和DW(例如,[23.),并根据目前的研究结果。一些NPs对盐胁迫下农艺性状的积极影响已被报道(例如,[12.那13.]),与Put-CQD NPs效果一致。施用Put对提高葡萄耐盐性的叶片FW和DW也有正效应。先前也有类似的研究结果,支持Put或其他PAs在盐胁迫下对植物的保护作用([23.那26.那28.])。Put在改善生长参数中的作用可以通过它的多阳离子性质和离子代谢的调节来描述,从而增强对盐度的耐受性[28.].所以,把-CQD NP的积极影响可能是由于上述的原因。
总的来说,盐度提高了钠的含量+并减少K.+由于过量的Na离子在植物中+在不平衡植物对离子吸收的土壤或营养液中[27.那28.那31.].放入或其他PA对减少NA的有益效果+并增加K.+盐下植物的含量以前曾有报导[23.那26.].通过PAS(例如,PUT)的根细胞中的离子通道活性来描述这种影响来描述抑制NA+涌入根,增强k+潮向地上。此外,减少在等离子体的活性膜 - 粘合的H+通过施加的盐度-ATPase可通过PA应用,其然后减小的Na来减轻+并增加ķ+在植物中含量盐度条件[下生长26.].另一个可能的原因在这方面放积极的作用可能是通过其在稳定细胞膜和维持阴阳离子平衡[作用28.].认沽作为负责钾内向整流的信号调节器+渠道[28.].Mozafari等。[31.]报告了减小钠的铁纳米粒积极作用+并增加K.+盐度条件下植物的含量。据我们所知,没有现有技术表明碳基NPs对钠的影响+和K.+在植物中含量盐胁迫条件下。因此,这是第一份报告,证明对降低娜PUT-CQD NP的积极作用+并加强ķ+在植物中含量盐胁迫条件下。
盐度导致光合色素含量,包括叶绿素a降一种那B.和类胡萝卜素。Chl含量的下降是由于Chl生物合成的减少和降解/周转的增加。光合色素的分解可能是通过叶绿体中有毒离子的积累和在施加盐胁迫后增强植物的氧化应激而发生的[33.].此外,盐胁迫抑制光化学反应和叶绿体编码基因的下调导致chl含量降低[26.].减少的背影一种和B.Hatami等人注意到盐度胁迫条件下的植物含量。[33.和Gohari等[11.那12.那13.],根据目前的研究。功率放大器可以通过稳定寡聚光合蛋白质和特别是叶绿素反向盐度的这些负面影响一种/B.结合蛋白应力期间显示蛋白酶作用[26.].虽然CQDs治疗增强了chl一种那B.和总叶绿素,CQDS浓度的进一步增加随后降低了它们的值[34.].此外,Gohari等人[12.]报道了修饰的mwcnts在chl中的积极作用一种和B.内容。本研究报道了CQDs对chl的积极作用一种和B.盐度条件下的内容。盐度胁迫已知以改变生物合成以及类似的类胡萝卜素的次级代谢产物的积累[35.].盐胁迫下葡萄类胡萝卜素的减少可能是由于为了调节植物生长而诱导脱落酸产生的途径[32.].由于ROS的淬火,通过其非酶促抗氧化功能在应力条件下从光氧化下,提高类胡萝卜素引起的植物耐受性对应力条件的耐受性。36.].一些NPs的积极影响,如TiO2和多壁碳纳米管的NP在类胡萝卜素含量也已先前在胁迫条件[下生长的植物注意到12.那13.,从而支持Put-CQD NPs对盐度条件下葡萄类胡萝卜素含量的积极影响。
叶绿素荧光参数是用于评估植物生理特性的固体标志物和应力效应的检测。叶绿素荧光参数的显着降低可能是由于盐胁迫下的热量的主要比例的光能耗散引起[37.],先前由Netondo等报道。[38.和Gohari等[12.那13.].有研究表明,NP应用后叶绿素荧光调节[12.那13.].增加的背影一种和B.可以通过增强叶绿体膜吸收的光能转移到PSII,促进光能向电子能转化和电子传递,以及加速水的光解和氧的进化[39.].另一个可能的原因可能是二氧化碳在植物中的吸收增加,在光合作用和叶绿素荧光参数重要作用[的RuBisCO酶活性40].
电解质渗漏是一种可靠的细胞损伤的指标,可以识别任何损坏细胞膜的完整性[41.].盐度通过破坏细胞膜的完整性提高EL值。PA应用程序通过其聚阳离子性质下盐度降低植物的EL值造成直接绑定到保持膜的功能带负电荷的膜磷脂头基和胁迫条件下稳定它[26.那28.].此外,在较低剂量下的SWCNT和MWCNT应用降低了盐度条件下的EL值和增加的细胞膜稳定性[12.那33.],同时在SIO后还报告了EL2NP申请[42.].
高浓度ROS的产生具有破坏性影响,如脂质过氧化,扰乱膜完整性,提高MDA含量[43.].在盐度下的植物中报告了MDA含量的增加。PAS的外源性应用降低盐度下的MDA水平[24.那26.那27.那44.].此外,低剂量下的石墨烯QD申请减少了MDA含量[45.].Mozafari等。[31.]观察到对下盐度降低葡萄MDA含量的铁纳米粒类似减轻作用。它是可能的稳定通过PUT和CQDs和它们的共轭形式(PUT-CQD NPS)膜的完整性可以(至少部分地)证明盐度条件下在MDA含量的降低。
H2O.2,具有与生长,开发和应力保护相关的多个过程的关键调节器[46.],具有取决于它的浓度二进制影响。在低浓度下,它作为所需的抗性机制对生物和非生物胁迫引发的信号传导分子,而其导致氧化应激47.高浓度时,细胞会程序性死亡。H2O.2通过羟基自由基形成导致脂质过氧化[48.].增加H.2O.2在盐度下葡萄藤的含量以前曾有报导[31.].观察到的下降2O.2在盐度下放置植物的灌注后的内容与以前的报告一致[24.那26.].这种改善作用可以通过pa对自由基的清除和对蛋白质的保护来描述[28.].实际上,功率放大器可逆转盐度效果,如ROS产生(例如,H2O.2)、脂质过氧化及相应的丙二醛生成[26.].治疗方法的脯氨酸增加可以描述H的减少2O.2H值随脯氨酸的增加而降低2O.2或通过激活抗氧化酶活性(如SOD、APX、GP和CAT) [49.].Mozafari等。[31.]报道铁纳米粒减少ħ2O.2通过提高抗氧化酶活性的葡萄植株内容在盐。
脯氨酸是一种渗透、金属螯合、抗氧化剂和信号分子[50.].脯氨酸在非生物胁迫下积累,因为它作为渗透调节剂和ROS解毒剂,保持膜的完整性、亚细胞结构、抗氧化酶活性和蛋白质结构[31.那50.].盐胁迫下葡萄脯氨酸含量的增加以前有过记录[31.],可能是由于脯氨酸氧化减少和生物合成增加[51.].外源PA(包括Put)处理增加了盐胁迫下植物脯氨酸积累[26.那44.].由于脯氨酸是一种渗透物质,是氮素在胁迫下的储存物质,是ROS的清除剂和NADP的调节剂,因此这种增强可以被认为是一种保护植物免受盐胁迫的机制+/ NADPH氧化还原状态。增加脯氨酸含量以下PA应用导致细胞间的大分子,渗透adoptability的保护,导致耐盐性羟基自由基的清除[26.].还显示铁NPS以增强控制和盐度条件下的葡萄树的脯氨酸含量[31.].这种增强报道如下QD应用,以及[45.],根据目前的研究。
酚类物质通过潜在的非酶性和水溶性抗氧化剂作用来保护植物细胞。这种特性是通过猝灭活性氧和自由基来实现的[52.].酚类物质可阻止ROS的生成和积累,从而抑制氧化应激,减少其不良作用[16.].在生物和非生物应激下刺激大多数酚类症状[49.],例如在盐度条件下[52.].冯等人。[45.]报道低浓度量子点应用后酚类物质增加。此外,MWCNTs-COOH处理增强了盐度条件下植物酚类物质的含量[12.].Current results demonstrated positive effect of CQDs at 10 mg L- 1并且在两种浓度下都可以通过增强的生物合成,作为抗氧化应激施加的氧化应激的抗氧化防御。他。[53.表明PA(亚精胺)在盐胁迫下诱导了植物酶促和非酶促抗氧化剂(如酚类化合物)相关基因的表达,这与目前的研究结果部分一致。
SOD酶活性消除了dissimulating至H超氧自由基2O.2,然后通过几种抗氧化酶(例如CAT,POD,APX,GP)排毒[46.].CAT,对于H中的主要酶2O.2淬火,去除超氧化物自由基作为对ROS的第一步,以减少氧化应激损伤。APX删除H.2O.2,与猫,通过谷胱甘肽 - 抗坏血酸循环[54.].GP酶利用谷胱甘肽解毒ħ2O.2,还原脂类及有机氢过氧化物[46.].盐度通过ROS的产生和积累引起植物细胞的氧化应激,抗氧化酶(如CAT、SOD、GP和APX)可能作为ROS解毒的防御机制。因此,通过抗氧化酶活性猝灭ROS可以减少应激影响,这是增强对应激条件耐受性的重要策略[26.].植物在增加盐分后主要抗氧化酶活性的增加已被充分记录[26.那54.那55.],同意当前调查结果。PAS增强抗氧化酶和非酶促抗氧化剂的活性(例如花青素,黄酮类化合物[23.那26.];)。此外,PAs通过清除细胞自由基和提高细胞存活率来提高植物对盐胁迫的耐受性[24.[以及诱导编码抗氧化酶的基因的表达。有趣的是,PAS也充当直接自由基清除剂,因为PAS与抗氧化酶分子结合[28.].Put通过两种机制防止盐胁迫下生物分子的膜过氧化和变性:首先,PAs在生理pH下的广泛质子化使其能够直接或结合到细胞膜上清除自由基;第二,PAs通过增加抗氧化酶的活性,从而增强ROS的解毒和减少氧化损伤。总的来说,这些机制导致植物对盐胁迫的保护[23.].据报道这种结果以下PA的外源性应用上增加的抗氧化剂酶的活性(SOD和CAT)包括投资,从而导致降低的ROS的影响和膜损伤[28.].就盐度条件下葡萄鱼的纳米材料,铁NPS增强的APX,SOD和POD酶活性的影响而言,[31.].冯等人。[45.]报告称,在较低的石墨烯QD浓度下,CAT活性增强,这可能是由于氧化应激增强,减少了CAT等抗氧化酶的生物合成。Gohari等人[12.那13.]报道的MWCNT-COOH和TiO的积极作用2对照和盐胁迫条件下对SOD,CAT,APX和GP酶活性的NP,在与当前的发现一致。因此,在所有抗氧化酶活性显著上调下面放-CQD NP治疗能改善盐度的负面影响,这表明CQDs增强影响和奚落CQD纳米粒子放入。
结论
考虑到作为植物中的应激缓解剂的既定效果,另外引入纳米粒子应用作为改善生物活性化合物的递送和效率的创新方法,使用CQDS制定先进的纳米结构。因此,将CQD NPS成功地应用于改进葡萄CV的引发处理。苏丹国在盐压力条件下的性能。Put-CQD NPS与PACE和CQD的个体治疗相比,效果改善,特别是以10mg L的浓度- 1通过增加一些农艺、生理和生化参数。,强调Put和cqd在Put- cqd NPs中的潜在协同效应。总之,Put-CQD NPs代表了一种创新方法,可以成功地应用于葡萄植株,提高其在盐度条件下的性能,同时还在进一步验证其对其他作物的有效性。
方法
试验地、植物材料及应用处理
试验采用完全随机设计(CRD),在伊朗马拉格大学农学院研究温室(经度46°16′E,纬度37°23′N,海拔1485 m)进行因子试验。两龄葡萄藤插枝。Sultana被种植在7公斤的花盆里,花盆里以3:1的比例混合了可可泥炭和中粒珍珠岩(每个花盆里有一个切口)。然后,用1 / 2浓度的霍格兰(Hoagland)溶液浇灌它们,直到至少长出八片真叶。这时,以12小时为间隔,对植物进行4次化学启动处理。处理包括腐胺(Put)两个浓度(5和10 mg L- 1),碳量子点(CQD) NPs的两种浓度(5和10 mg L- 1)和腐胺功能化碳量子点(Put-CQD NPs)的浓度分别为5和10 mg L- 1),每次治疗三次复制。将处理与Hoagland溶液联合完成,进入盆栽的培养基。在施加盐胁迫之前,在48小时进行引发处理的最后施用。因此,每天通过用Hoagland溶液浇水并持续到一个月,每天施用两个浓度(0和100mM NaCl)的盐度应力。使用完全膨胀的叶片施加盐胁迫后3天实施所有生化和酶测量。将取样的叶子瞬间将液氮瞬间持续2分钟,然后在-80℃的冷冻机中保存后,直至进行测量。其他参数包括NA+/ K.+在施盐1个月后,研究了含盐量、光合参数和色素的变化。色素测定采用上述相同的取样方法,而叶片鲜重、干重和光合参数则采用新鲜叶片测定。每次测量采用三次技术重复。对照植物只需用1 / 2强度的霍格兰溶液进行灌溉。
腐胺功能化碳量子点的制备
In a 25 mL Teflon-lined autoclave chamber containing 10 mL distilled water, 0.5 g putrescine and 2 g citric acid were added and heated at 200 °C for 12 h. After cooling the reaction temperature to room temperature, the pH value of resulted red-brown solution was set to 7 by NaOH before use and characterization. For comparison, the same procedure was used to synthesize bare CQDs.
叶子新鲜和干燥的重量
5个叶片样品分别称量鲜重(FW),然后在收获阶段放入烤箱(70°C, 72 h)进行干重(DW)测量。
NA.+和K.+分析
从每种处理中随机收集叶样品,洗涤并空气干燥,然后在60℃下在热空气烘箱中干燥18小时。然后,将样品在威尔利磨机中研磨,并将动力样品储存用于测定。三循环消化提取物用于估计NA+和K.+火焰光度法,如Ghosh所述[56.]并用mmol kg表示- 1.从而,钠+/ K.+比进行了测定。
光合色素的定量(叶绿素一种那B.和类胡萝卜素)
充分展开的叶片(0.2 g)用0.5 mL丙酮(3% v/v)提取,离心(10,000 rpm, 10 min),记录上清液在645 nm (ChlB.),663 nm(chl一种通过UV-Vis分光光度法(UV-1800 Shimadzu,Japan),470nm(类胡萝卜素)。CHL.一种那B.和类胡萝卜素含量通过Sharma等人所描述的公式计算。[57.].
叶绿素荧光和SPAD测定
采用dual-pam-100叶绿素荧光仪(Heinz Walz, Effeltrich, Germany)测量叶绿素荧光参数,包括FV/佛那FV/调频和y(ii)。在植物深度适应20分钟后进行测量[58.].
每个花盆随机选取5片叶片,通过SPAD仪(502 +叶绿素仪,日本)测定SPAD值(叶片叶绿素浓度)[59.].
电解质泄漏(EL)测定
对于EL测定法中,完全展开的叶子的0.5厘米直径的圆片切成;the discs were then washed thrice by deionized water and incubated in ambient temperate for 24 h. A conductivity meter (Hanna, HI98192) was used to measure the initial electrical conductivity (EC1) of the solution. At that time, the samples were incubated in a water bath (95 °C, 20 min) to release all electrolytes, cooled down to 25 °C and their final electrical conductivity (EC2) was measured. The electrolyte leakage (EL) was calculated from following equation [60.].
丙二醛(MDA)和过氧化氢(H2O.2)测定
均质化后0.1 g叶样品2.5毫升醋酸10% (w / v)和离心法(15000 rpm, 20分钟),同样体积的获得的上层清液和硫代巴比土酸0.5% (w / v)在三氯乙酸(TCA)(20%)是在96°C的环境在试管中30分钟。然后将样品置于0°C下5分钟,离心(10,000 rpm, 5分钟),在532和600 nm处用分光光度计记录吸光度。MDA含量计算公式如下:
注:ɛ=比消光系数(155 mM)- 1 cm- 1),V =破碎介质的体积,W =叶FW,600 = 600nm处的吸光度和532 = 532nm处的吸光度[61.].
测定H.2O.2,将0.2g叶片在冰浴中用5ml三氯乙酸(0.1%w / v)混合,然后离心(12,000rpm,4℃,15分钟)。加入得到的上清液(0.5mL),加入0.5mL磷酸钾缓冲液(pH6.8,10mM)和1ml碘化钾(1M),并将吸光度记录在390nm。最后,H.2O.2含量通过先前通过各种ħ制成标准校准曲线计算2O.2浓度并表示为μmolg- 1弗兰克-威廉姆斯(62.].
脯氨酸量化
为了测定脯氨酸含量,将0.5g叶样品在冰浴中在10ml硫磺酸水溶液(3%)中均化。离心(1000rpm,4℃),将2ml茚三酮酸和2ml冰醋酸(1:1:1溶液)加入到2ml上清液中,将其精细混合并在100℃下孵育1小时。将反应物在冰浴中止滴,最终加入4ml甲苯并剧烈混合(20秒)。使用分光光度计在520nm处记录混合吸收。不同浓度的L-脯氨酸用于标准曲线和脯氨酸值的最终计算[63.].
总酚类化合物的定量
简单地说,0.1 g叶子样品用5 mL 95%乙醇消化后,在黑暗中保存(24 h),然后加入1 mL上清液、1 mL 95%乙醇和3 mL蒸馏水。下一步加入0.5 mL 50%福林酚溶液和1 mL 5%碳酸氢钠,在黑暗条件下1h,用分光光度计在725 nm记录吸光度。通过不同浓度没食子酸的标准曲线将吸光度值转化为总酚,以mg没食子酸(GAE) g表示- 1弗兰克-威廉姆斯(64.].
抗氧化酶活性测定
通过以前储存在-80℃的冰箱的叶片通过叶片测定可溶性蛋白质和抗氧化酶活性。酶提取的所有步骤如下,如下进行:使用磁力搅拌器用含有1%聚乙烯吡咯烷酮(PVP)和EDTA(4mM)的磷酸钾缓冲液(pH6.8,100mm)均化叶(0.5g)均化。10分钟。离心(6000rpm,20分钟)后,收集上清液以评估总可溶性蛋白质,过缩酶(猫),抗坏血液过氧化物酶(APX),超氧化物歧化酶(SOD)和Guaiacol过氧化物酶(Guaiacol过氧化物酶(GP)酶活性,基于相同的方法由Gohari等人。(2020B)。
统计分析
所有获得的数据均采用SAS软件进行分析,每个处理的平均值在95%的概率水平(SAS Institute Inc., ver.)进行邓肯多范围检验。9.1,美国北卡罗来纳州凯里)。
数据和材料的可用性
支持本研究结果的数据可在合理的请求时从相应的作者获得。
缩写
- CQDs:
-
碳量子点
- 把:
-
腐胺
- Put-CQD NPs:
-
由Putriecine纳米颗粒官能化的碳量子点
- 埃尔:
-
电解质泄漏
- H2O.2:
-
过氧化氢
- 草皮:
-
超氧化物歧化酶
- 医生:
-
愈创木酚过氧化物酶
- APX型:
-
抗坏血酸盐过氧化物酶
- 叶绿素:
-
叶绿素
- MDA:
-
丙二醛
- 猫:
-
过氧化氢酶
- FW:
-
鲜重
- DW:
-
净重
- 热合:
-
多壁碳纳米管
- SWCNTs:
-
单壁碳纳米管
参考文献
- 1。
舒舒,袁勇,陈静,孙军,张伟,唐勇,等。盐胁迫下腐胺在类囊体膜蛋白和脂肪酸调控中的作用。Sci众议员2015;5:14390。
- 2。
等。植物耐盐工程研究进展与展望。足底。2020;251:76。
- 3。
Parihar P,Singh S,Singh R.盐度压力对植物及其公差策略的影响:综述。环境科学污染粉丝。2015; 2:4056-75。
- 4。
熊L,朱杰克。植物反应对渗透压的分子和遗传方面。植物细胞环境。2002; 25(2):131-9。
- 5。
陈建平,陈志强,陈志强,等。活性氧-氮-硫在植物抗逆性和抗逆性中的作用。植物学报2016;33:101-7。
- 6。
Savvides A,Ali S,Tester M,Fotopoulos V.化学灌注对多种非生物应激:特派团可能吗?趋势植物SCI。2016; 21:329-40。
- 7。
关键词:氮,供体硝普钠,叶片,多胺,脯氨酸代谢Medicago Truncatula.植物。Free Radic Biol Med. 2013; 56:172-83。
- 8。
伊斯兰教MM,Hoque Ma,Okuma E,Banu MNA,Shimoishi Y,Nakamura Y等。外源性脯氨酸和甘油氨基碱基增加抗氧化剂酶活性并赋予培养的烟草细胞中镉胁迫的耐受性。J植物理性。2009; 166(15):1587-97。
- 9。
李涛,胡Y,杜X,唐H,沉C,吴J.水杨酸缓解盐胁迫的不利影响香榧简历。香榧苗通过激活光合作用,增强抗氧化系统。Plos一个。2014; 9(10):1-9。
- 10。
研究表明,一氧化氮和硫化氢(NOSH)释放化合物是一种新型的抗旱启动剂Medicago Sativa.植物。生物分子。2020; 10:120。
- 11.
研究了过氧化氢与硝普钠的相互作用OCimum Basilicum.L.抗盐胁迫。physiol植物。2020; 168(2):361-73。
- 12.
Gohari G, Mohammadi A, Akbari A, Panahirad。, Dadpour MR, Fotopoulos V,等。二氧化钛纳米颗粒(TiO2NPS)促进增长和精油轮廓改善盐胁迫效应和生化属性Dracocephalum meteravica.SCI代表2020; 10(1):1-14。
- 13。
Gohari G, Safai F, Panahirad S, Akbari A, Rasouli F, Dadpour MR, et al.;修饰的多壁碳纳米管在植物体内表现出植物毒性或促进生长和保护环境的活性OCimum Basilicum.L.与浓度有关。臭氧层。2020;126171年。
- 14。
可汗MN, Mobin M, Abbas ZK, AlMutairi KA, Siddiqui ZH。纳米材料在具有挑战性环境下的植物中的作用。植物生理生化学报。2017;110:194-209。
- 15.
Ioannou的A,Gohari G,Papaphilippou P,Panahirad S,阿克巴丽A,Dadpour MR,等人。农业先进纳米材料在气候变化下:在通往未来之路还是Environ Exp Bot。2020; 104048。
- 16。
Rico CM, Peralta-Videa JR, Gardea-Torresdey JL。纳米粒子的化学、生物化学及其在植物抗氧化防御系统中的作用。纳米技术和植物科学。2015; 17。施普林格。可汗。
- 17。
白旭,杨志强。铜基三元或四元各向异性量子点、多型纳米晶体和核/壳异质结构的光学性质、合成和潜在应用。纳米材料。2019;9(1):85。
- 18。
六必居V,Mundayoor S,Omkumar RV,阿纳斯A,用于癌症研究石川M.生物共轭量子点:现状,前景和遗留问题。Biotechnol Adv。2010; 28(2):199-213。
- 19。
利姆Sy,沉W,高Z.碳量子点及其应用。2015年Chem SoC Rev.44(1):362-81。
- 20。
张M,高B,陈继,李Y。石墨烯对种子萌发和幼苗生长的影响。j纳米盖特res。2015; 17(2):78。
- 21。
Chakravarty d,Erande MB,晚DJ。石墨烯量子点作为增强植物生长调节剂:对香菜和大蒜植物的影响。J SCI食物农业。2015; 95(13):2772-8。
- 22。
李h,黄j,lu f,liu y,song y,sun y等。碳点对水稻植物的影响:提高生长和提高抗病性。ACS Appl Bio Mater。2018; 1(3):663-72。
- 23。
张G,徐S,胡Q,毛W,龚Y.腐胺起到通过降低蔬菜大豆根系氧化损伤耐盐机制的积极作用。ĴINTEGR AGRIC。2014; 13:349-57。
- 24.
李S,晋H,外源亚精胺浓度对多胺代谢和耐盐性结缕草张Q.的影响(结缕草粳稻结缕草)经受短期盐度胁迫。前植物SCI。2016; 7:1221。
- 25.
多胺:促进植物抗旱性和耐盐性的新兴中心。Curr Mol Biol rep 2017; 3:28-36。
- 26.
Saleethong P,SanitchonĴ,孔-Ngern K,Theerakulpisut P.预处理与亚精胺反转在两个水稻(盐应力的抑制效果奥雅萨苜蓿耐盐性不同的品种。植物学报,2011;10(4):245。
- 27.
QUINET男,Ndayiragije A,利费夫I,Lambillotte B,杜邦-Gillain CC,Lutts S.腐胺不同影响盐胁迫对多胺代谢和乙烯合成在水稻品种中盐抗性不同的效果。J Exp Bot。2010; 61(10):2719-33。
- 28.
叶面施用多胺对干旱胁迫下柑桔生长、气体交换特性和叶绿素荧光的影响。56 Photosynthetica。2017;(2):731 - 42。
- 29.
Roychoudhury A,八宿S,森古普塔DN。盐度胁迫的缓解外源施用的亚精胺或精胺在三个品种籼稻在他们的耐盐性的电平不同的。J植物理性。2011; 168(4):317-28。
- 30。
唐W,牛顿RJ。多胺通过增加抗氧化酶的活性和降低脂质过氧化作用来减少盐诱导的氧化损伤弗吉尼亚松树.植物生长调节。2005; 46(1):31-43。
- 31。
Mozafari AA,下在体外条件Ghaderi N.葡萄响应于盐度胁迫和铁纳米颗粒和硅酸钾的作用,以减轻盐诱导的损伤。physiolmol biol植物。2018; 24(1):25-35。
- 32。
Suarez的DL,切利什N,安德森RG,桑德D.葡萄砧木响应于盐度,水和组合盐度和干旱胁迫。农艺学。2019; 9(6):321。
- 33。
关键词:碳纳米管,碳纳米管,毒性Cucurbita浆果在充足的水分和水分胁迫条件下。Ecotox Environ Safe. 2017; 142:274-83。
- 34。
王浩,张敏,宋永华,李辉,黄辉,邵明,等。碳点促进绿豆芽的生长和光合作用。碳。2018;136:94 - 102。
- 35。
Borghesi E,冈萨雷斯米雷特ML,埃斯库德罗,Gilete ML,Malorgio楼埃雷迪亚FJ,梅伦德斯 - 马丁内斯AJ。类胡萝卜素,花青素盐度胁迫,多样番茄基因型的颜色的影响。JAgric Food Chem。2011; 59(21):11676-82。
- 36。
盐胁迫对番茄色素和可溶性总蛋白含量的影响。中国农业科学(英文版);2010;5(15):2056-65。
- 37。
Yamane K,Kawasaki M,Taniguchi M,Miyake H.叶绿体超微结构与水稻叶片叶绿素荧光特性之间的相关性(奥雅萨苜蓿L.)在盐度下成长。植物刺激科学。2008; 11:139-45。
- 38。
Netondo GW,奥尼JC。贝克E.高粱和盐度:II。盐胁迫下作物科学2004的气体交换和高粱的叶绿素荧光; 44:806。
- 39。
明宇,王洪辉,赵亮。纳米锐钛矿对tio2的影响2菠菜叶绿体膜的吸收,光和光电膜的吸收和光电膜。BIOL追踪ELEM RES。2007; 118:120-30。
- 40。
Rubisco活化酶是在任何温度下的非稳态光合作用和在高温下的稳态光合作用的关键调节因子。工厂j . 2012, 71(6): 871 - 80。
- 41。
Bajji M,Kinet JM,Lutt S.使用电解质泄漏方法以评估细胞膜稳定性作为杜兰姆小麦水分胁迫试验。植物生长调节。2002; 36(1):61-70。
- 42。
西迪基MH,铝Whaibi MH,费萨尔男,莎莉铝AA。氧化钛纳米硅减轻盐胁迫的不利影响Cucurbita浆果L. ENVIRON毒理学化学。2014; 33:2429-37。
- 43。
外源脯氨酸和甜菜碱可以缓解盐胁迫对水稻植株的不利影响。科学通报,2016;10(3):38-43。
- 44。
Tanou G,Ziogas V,Belghazi M,Christou A,Filippou P,Job D等人。多胺重新编程氧化和氮化状态以及暴露于盐度胁迫的柑橘植物的蛋白质组。植物细胞环境。2014; 37:864-85。
- 45。
冯P,耿B,程Z,廖X,潘达,黄杰。石墨烯量子点诱导绿豆和番茄幼苗的生理和生化反应。Braz J Bot。2019; 42(1):29-41。
- 46。
Hasanuzzaman M,Bhuyan MHMB,Zulfiqar F,Raza A,Mohsin Sm,Al Mahmud J,Fujita M,Fotopoulos V.非生物胁迫下植物的活性氧物种和抗氧化代谢:重新审视普遍防御调节器的关键作用。抗氧化剂。2020; 9:681。
- 47。
Molassiotis A,Fotopoulos五氧化和植物亚硝基信号:两个分支在同一棵树?植物信号表现。2011; 6:210-4。
- 48.
盐胁迫对植物抗氧化系统和活性氧代谢的影响Dunaliella Salina.和杜氏盐藻.AFRĴ生物技术。2011; 10(19):3795-808。
- 49.
郑JL,赵LY,吴CW,沉B,朱AY。外源脯氨酸通过介导的离子和渗透调节和增强抗氧化防御降低的NaCl诱导的损伤eurya emarginata..Acta physiol植物。2015; 37(9):181。
- 50.
生活报S,生活报Q,Alyemeni MN,迩AS,PichtelĴ,脯氨酸在不断变化的环境艾哈迈德A.作用:审查。植物信号表现。2012; 7(11):1456至1466年。
- 51.
盐度对亚麻子生长、酶活性、光合作用、脯氨酸积累和产量的影响。中国农业科学。2007;3(5):685-95。
- 52.
陈志强,陈志强,陈志强,等。不同遗传多样性小麦品种对盐胁迫的响应:叶片脂质过氧化和酚类物质含量。植物学报。2010;42(1):559-65。
- 53.
何丽丽,潘玉英,Inoue H ., Matsuda N ., Liu J ., Moriguchi T. effects of nacl胁迫对亚精胺合成酶基因表达的影响。植物化学。2008;69(11):2133 - 41。
- 54。
Gharsallah C,Fakhfakh H,Grubb D,Gorsane F.盐胁迫对离子浓度,脯氨酸含量,抗氧化酶活性和番茄品种基因表达的影响。AOB植物。2016; 8。
- 55。
Filippou P,Bouchagier P,Skotti E,Fotopoulos V.脯氨酸和活性氧/氮物种的生物合成中涉及的入侵植物物种的耐受性响应Ailanthus Altissima对干旱和盐度。Environ Exp Bot。2014; 97:1-10。
- 56。
土壤、植物、水和肥料的分析方法。土壤学报,1993;41(4):814-5。
- 57。
陈志强,陈志强,陈志强,等。植物活性氧种类、氧化机理及抗氧化防御机制的研究进展。J 2012:1-26机器人。
- 58。
麦克斯韦K,约翰逊GN。叶绿素荧光的实用指南。J Exp Bot。2000; 51(345):659-68。
- 59。
凌Q,黄W,Jarvis P.使用Spad-502仪表来测量叶片叶绿素浓度拟南芥蒂利亚纳.Photosynth杂志2011;107(2):209 - 14所示。
- 60。
在缺水小麦渗透剂和渗透调节的纳亚尔H.积累(小麦)和玉米(Zea Mays.)受钙及其拮抗剂的影响。Environ Exp Bot。2003; 50(3):253-64。
- 61。
Stewart RRC,Bewley JD。脂质过氧化与大豆轴加速老化相关的过氧化。植物理性。1980; 65:245-58。
- 62。
辛哈S,Saxena先生R,在植物辛格S.铬诱导的脂质过氧化pistia stratiotes抗氧化剂和抗氧化酶的作用。臭氧层。2005;58:595 - 604。
- 63。
贝茨LS,Waldren RP,Hinde ID。快速测定水应激研究的游离脯氨酸。植物土壤。1973; 39(1):205-7。
- 64。
Xu C,张Y,Cao L,Lu J.在中国种植的不同葡萄品种的酚类化合物和抗氧化特性。食品化学。2010; 119:1557-65。
确认
这些结果来自Mostafa Sadeghi的硕士论文,我们非常感谢Maragheh大学在这个项目中给予我们的支持。
资金
这项研究没有从公共、商业或非营利部门的资助机构获得任何具体的资助。
作者信息
隶属关系
贡献
所有作者都参与了这项研究。实验装置由GG、SP和VF设计。MS进行了温室实验,生化和生理参数。对AA合成的纳米材料进行了表征,对EZ和SMZ进行了统计分析。GG, SP, AA, MKB分析数据和结果,GG, SP, VF撰写手稿。所有作者阅读并批准了最终的手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Gohari, G., Panahirad, S., Sadeghi, M.。等等。Putrescine-官能化的碳量子点(PUT-CQD)纳米颗粒有效地葡萄葡萄(葡萄简历。'苏丹娜')对抗盐压力。BMC植物BIOL.21,120(2021)。https://doi.org/10.1186/s12870-021-02901-1
已收到:
公认:
发表:
关键词
- 碳量子点
- 葡萄藤
- 纳米技术
- 启动
- 非生物胁迫