摘要
Backgorund
包括非生物应激和生物应力的环境压力限制植物的限制产率。应力育种是在压力条件下提高植物产量的有效方法。CRISPR / CAS9的基因组编辑可用于分子育种,以改善作物中的农艺性状,但在大多数情况下,健身成本。植物激素ABA通过信号转导对生物应激的植物反应调节。我们以前将艾特拉作为一系列新的转录因子,在调节对ABA和非生物应激的植物反应中发挥作用。我们发现单一,双倍和三倍增加了非生物胁迫耐受性aitr突变体。然而,目前尚不清楚突变体中的非生物胁迫耐受性是否可能具有健康成本。
结果
我们在这里报告表征AITRs作为适合CRISPR/Cas9编辑的候选基因,提高植物的抗逆性。利用CRISPR/Cas9进行靶向AITR3和AITR4同时在这方面AITR256.三倍AITR1256.四重突变体分别生成了免费的Cas9AITR23456.Quintule和aitr123456六倍的突变体。我们发现这些突变体对ABA的敏感性降低,对干旱和盐的耐受性增强。最重要的是,植物的生长发育甚至没有受到影响aitr123456六十格突变体,整个人AITR家族基因被淘汰了,而且aitr1234566个突变体也表现出对病原体感染的野生型反应。
结论
我们的研究结果表明AITR拟南芥家族基因在不消耗适应度的情况下增强了非生物胁迫耐受性。考虑到刚才的几次击倒AITRsaitr在被子植物中广泛分布,具有多种编码基因,AITRs可能是分子育种的目标,以提高植物包括作物的非生物胁迫耐受性。
背景
到2050年,世界人口预计将达到90亿,因此,到那时,为了养活人口,粮食产量需要增加70% [1,2].然而,包括作物体的植物的产量主要受环境应激的影响,包括非生物胁迫,例如干旱,盐度和低和/或高温,以及病原体和昆虫等生物应力[3.,4].据估计,生物应力导致大多数主要作物的全球产量损失平均导致〜20%,而非生物应激,〜50%[5,6].在非生物胁迫下,在许多不同的地区发生干旱和盐度,预测地球上的超过50%的土地将在2050年的年度严重盐化[3.].加速的气候变化和全球变暖将使情况恶化,并导致包括农作物在内的植物进一步减产。
培育对非生物胁迫耐受性强的作物,可以提高作物在逆境条件下的产量,但传统育种需要很长时间,结果往往难以预测[7].分子育种,另一方面,能够在很大程度上克服这些短缺[8],而新开发的技术,如果使用得当,可能有助于进一步缩短育种过程。
发现后不久之后,内切核酸酶Cas9(CRISPR-CASSOCIED蛋白9)能够在真核细胞中切割靶向的双链DNA [9,10[, CRISPR (clustered regularly interspaced short palindromic repeats)/Cas9已发展成为一种新的技术,用于靶向基因组编辑,并已成功应用于植物[11,12,13].目前有两种不同类型的CRIPSR/Cas9基因组编辑系统,即DNA裂解系统和碱基编辑系统。第一种方法允许在目标位点进行小的核苷酸缺失或插入[14],而第二种则能产生精确的单核苷酸替换[15].他们两者都被用来在植物中产生突变,不仅在模型植物拟南芥中,而且在一些主要作物中,至少在小麦和米饭中,至少在某些情况下,改善农艺性状[16,17,18,19].CRISPR/Cas9基因组编辑可以产生预测的突变,并且可以从基因组编辑的转基因植物中分离出无转基因突变体,因此可以用于加速植物育种过程[17,19,20.,21,22].最近对CRISPR/Cas9系统的改进,如通过使用Cas9变体扩大目标空间或工程Cas9进一步扩大了其用于植物育种的能力[23,24].然而,在作物育种中,能够被CRISPR/Cas9编辑以提高植物非生物胁迫耐受性的候选基因大部分尚未被识别。
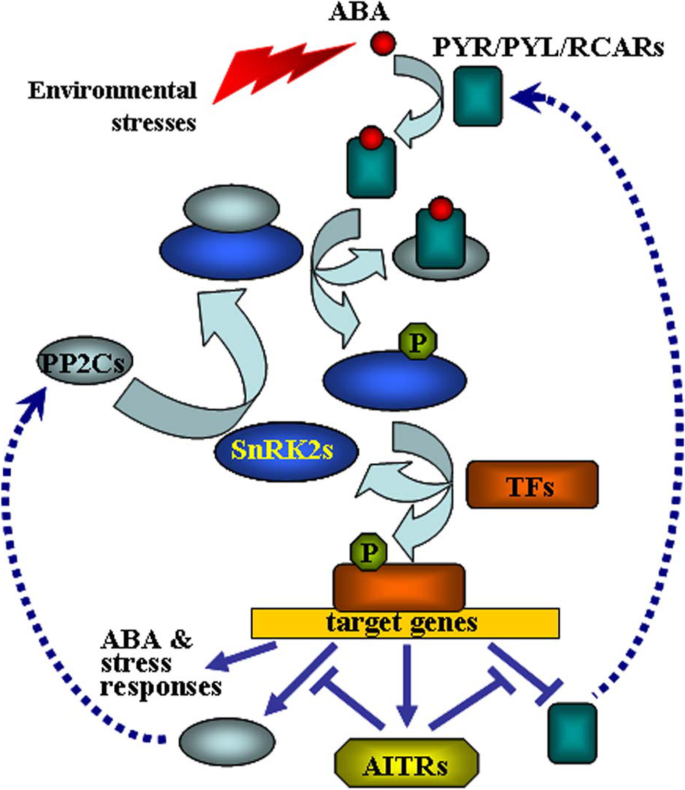
植物激素ABA(脱离酸)是一个关键的胁迫激素,它可以通过信号转导,调节对非生物胁迫的植物反应,例如干旱,盐度,冷和热量[25,26,27,28,29,30.].几种不同类型的蛋白质包括受体蛋白PYR1 (Pyrabactin resistance 1)/PYL (PYR1-like)/ RCAR (ABA受体的调节成分),蛋白激酶PP2Cs (A-group protein PHOSPHATASE 2cc)磷酸酶,SnRK2s (nonfermatin 1 (SNF1)相关蛋白激酶),bZIP(碱性区亮氨酸拉链)转录因子ABF/AREB/ABI5是ABA信号转导的关键调控因子[26,30.,31,32,33,34,35].而几种UBQ连接酶可以影响关键调控因子的蛋白质稳定性,因此参与了ABA信号的调控。例如,E2连接酶VPS23A和E3连接酶CUL4和RSL1能够靶向PYR/PYL/RCABR受体进行蛋白酶体降解[36,37,38,39], E3连接酶KEG (KEEP ON GOING)、DWA1和DWA2能够靶向ABF/AREB/ABI5转录因子进行降解[40.,41.,42.,43.]并且E3连接酶PUB12和PUB13能够靶向PP2C蛋白激酶进行降解[44.].由于ABA在调节植物非生物胁迫反应中起关键作用,在ABA信号调节基因表达水平的变化通常会影响植物抗逆。例如,在ABF / arsb / abi5转录因子基因的函数突变体中降低了干旱耐受性SnRK2s基因(45.,46.],而在转基因植物过表达的转基因植物中观察到增强的干旱耐受性所有供试基因(47.,48.].因此,通过CRISPR / CAS9对这些调节剂基因的基因编辑可能无法改善植物中的非生物耐受性。
在上一份报告中,我们鉴定了艾特拉(ABA诱发的转录阻遏物)作为缓解新的转录因子家族,我们发现艾特里斯作为负调节剂调节对比对非生物应激的植物反应中的负调节因子[30.].我们在这里报告表征AITRs作为提高植物非生物胁迫耐受性的适宜基因组编辑靶点。我们生成的拟南芥aitr这六个人都是变种人AITR基因被淘汰,发现突变体显示出增强的干旱和耐盐性,但植物生长和发育,以及对突变体不受影响的病原体感染的植物反应。
结果
生成aitr所有的突变体AITR基因淘汰了
我们之前已经鉴定出AITRs是被子植物保守的新型转录因子家族,并发现其对ABA和干旱、盐等非生物胁迫的耐受性增强aitr突变植物[30.),这表明AITRs可能是分子育种的目标,以提高植物对非生物胁迫的耐受性。
在拟南芥中,总共有6个基因编码AITRs [30.[进一步检查艾硝酸血管耐受性应力的功能,以及是否丧失函数AITRs可能有健康成本,我们决定产生高阶aitr所有的突变体AITR基因淘汰出局。T-DNA插入突变体AITR1,AITR2,AITR5和AITR6,除了aitr2 aitr5 aitr6(AITR256.)三重突变体[30.],我们由此产生Aitr1 aitr2 aitr5 aitr6(AITR1256.四倍杂交突变体。然后,我们生成的Aitr2 Aitr3 Aitr4 Aitr5 Aitr6(AITR23456.五个一组和Aitr1 Aitr2 Aitr3 Aitr4 Aitr5 Aitr6(aitr123456)通过使用CRISPR / CAS9同时靶向突变突变体AITR3和AITR4在AITR256.三倍AITR1256.四重突变体分别。
两个无cas9的纯合子AITR23456.Quintuple突变线,即aitr23456-c1和aitr23456-c2,两株无cas9纯合子aitr123456Sexuple突变线,即,aitr123456-c1和aitr123456-c2生成的。在所有4个突变系中,单核苷酸插入均发生在目标位点AITR3和AITR4(图。1a),导致核苷酸插入位点和亚硝基和亚硝的过早止挡(图。1b)。
生成AITR23456.Quintule和aitr123456六倍的突变体。一个CRISPR / CAS9目标序列的对准AITR3和AITR4在colwild类型和AITR23456.Quintule和aitr123456六倍的突变体。通过改变突变体来产生AITR256.三倍AITR1256.5倍T-DNA插入突变体植株,分别与a收Crispr / Cas9构建同时瞄准AITR3和AITR4.通过测序检测T1转基因植株的基因组编辑状态。从单个基因组编辑T1植株的T2或T3后代中分离出无cas9突变体。数字表示核苷酸相对于起始碱基的位置AITR3和AITR4,分别。下划线表示紧跟在目标站点之后的PAM站点。bAitr3和Aitr4在Col野生类型和αITR4中的氨基酸序列比对AITR23456.Quintule和aitr123456六倍的突变体。的编码序列AITR3和AITR4在AITR23456.Quintule和aitr123456Sexuple突变体用于ORF分析ORFFIDED(https://www.ncbi.nlm.nih.gov/orffinder/).普遍的氨基酸序列分别用于与野生型αITR3和αITR4对准。数字表示相对于第一次得到的残留物的氨基酸位置。下划线表示亚硝基的完全或部分保守的LXLXL主题
的aitr突变体对ABA不敏感
在种子萌发和子叶绿化测定中,对于基因的所有单个T-DNA插入突变体,观察到对ABA的敏感性降低AITR1,AITR2,AITR5和AITR6,双突变体对ABA的敏感性进一步降低aitr2 aitr5(艾特尔201.)和aitr2 aitr6(AITR26.)和三重突变体AITR256.[30.,提示aitr在调节ABA反应中可能具有冗余功能。
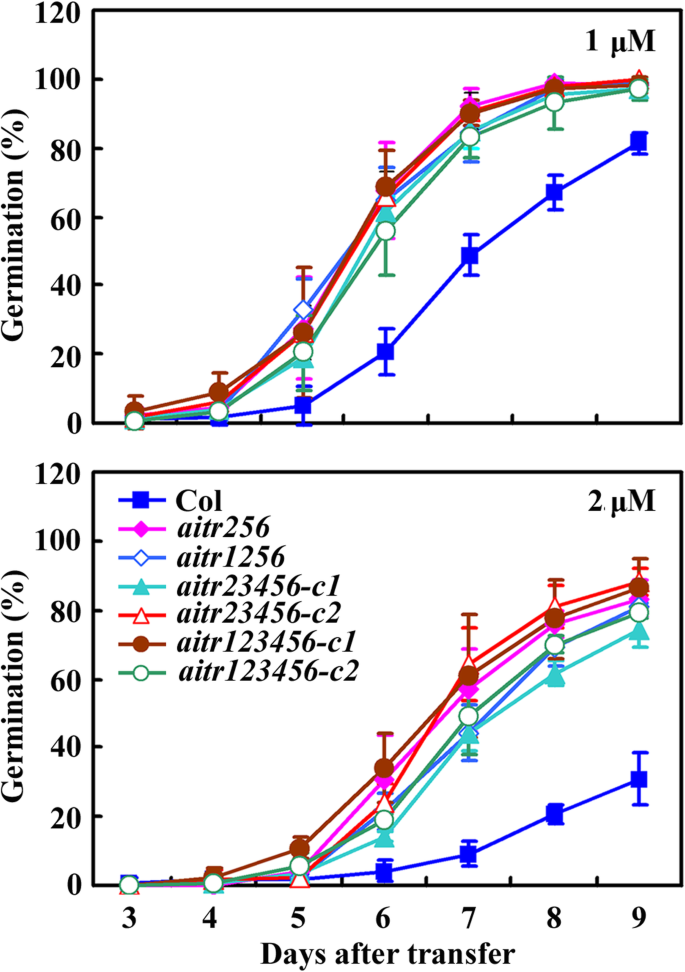
通过种子萌发试验和子叶绿化试验来检测ABA的响应aitr生成更高阶突变体。如图所示。2在种子萌发试验中,所有突变体都被检测,包括AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456Sextuple突变体表现出对测试的浓度大大降低了对ABA的敏感性。但是,很少,如果观察到萌发率的任何差异aitr123456六倍的AITR256.突变体(图三倍。2).
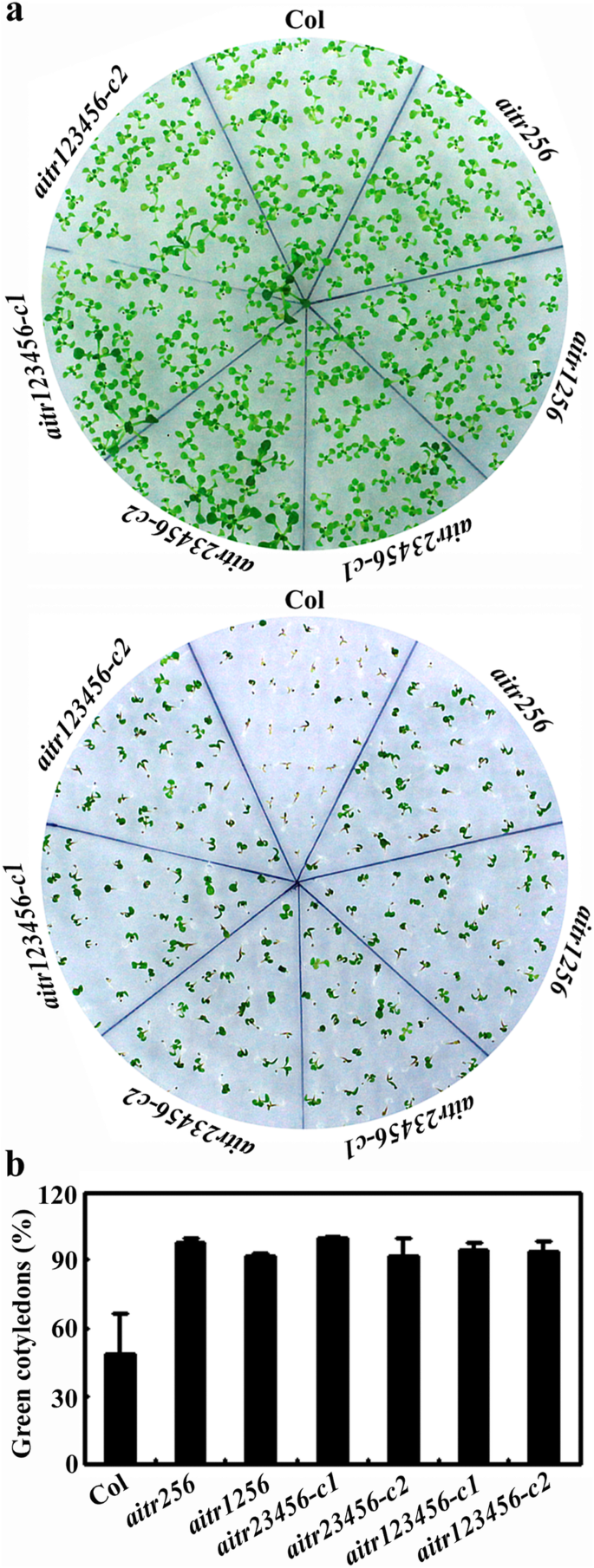
在子叶绿化试验中,所有突变体对ABA的敏感性都大大降低。3.a)。所有突变体的几乎所有幼苗都在ABA的存在下产生了绿色子叶,即所有突变幼苗的近100%的绿色子叶,与COL野生型幼苗的〜50%相比(图。3.b)。
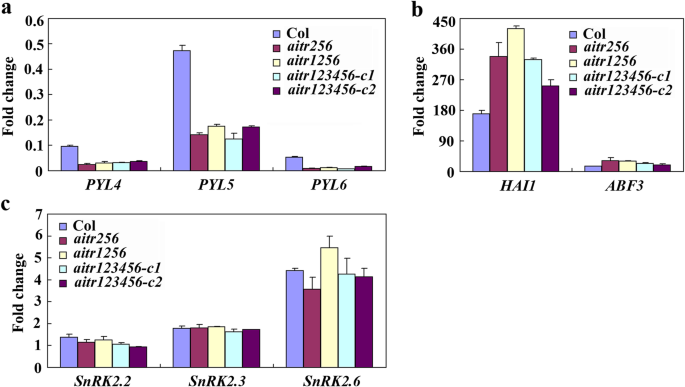
然后比较了Col野生型中核心ABA信号调节基因的ABA响应AITR256.,AITR1256.和aitr123456突变体。我们发现PYL受体基因的表达水平Pyl4.,Pyl5.和Pyl6.对ABA的响应进一步降低aitr突变体与Col野生型幼苗相比,差异无统计学意义AITR256.,AITR1256.和aitr123456突变体(无花果。4a).相比之下,PP2C磷酸酶基因的表达水平HAI1和ABF / arsb / abi5转录因子基因ABF3对ABA的响应进一步增加(图4b),而SnRK2激酶基因SnRK2.2,SnRK2.3和SnRK2.6对ABA的响应基本保持不变(图。4c)。
外源ABA信号元件基因对外源ABA的响应AITR256.,AITR1256.和aitr123456突变体。一个PYR/PYL受体基因的折叠变化Pyl4.,Pyl5.和Pyl6..bPP2C磷酸酶基因的折叠变化HAI1ABF转录因子基因ABF3.cSnRK2激酶基因折叠变化SnRK2.2,SnRK2.3和SnRK2.6.12日龄的野生型和AITR256.,AITR1256.和aitr123456突变体用50μmABA处理,分离总RNA,用定量RT-PCR检查ABA信号传导中的关键调节剂基因的表达。表达ACT2.作为内对照,通过比较ABA处理和未处理样品中相应基因的表达量来计算fold changes。实验重复了三次,得到了相似的结果。数据代表三次重复的平均值±SD
的aitr突变植物显示出对干旱和盐胁迫的增强的耐受性
ABA信号传导中调节剂基因的表达水平变化通常影响植物非生物胁迫耐受性[45.,46.,47.,48.].也是如此AITRs,aitr单、双、三重突变体检测表明耐旱性和耐盐性增强[30.].我们检测了高阶非生物的耐受性aitr产生的突变体。成熟植物生长的土壤被用来进行干旱和盐处理。如图所示。5,在重新浇水后,大多数突变植物包括AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456回收六十突变体,而所有野生型植物都没有(图。5).
所有突变体也显示出增强的盐处理耐受性。如图所示。6,盐处理严重影响Col野生型植物的生长发育,无法产生种子。另一方面,成长和发展的aitr突变体包括AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456由于大多数突变植物仍然能够生产种子(图。6).
生长发育不受影响aitr突变体
增强的抗压力能力,通常伴随着生长和发育的健康成本[49.,50.].对干旱和盐等非生物胁迫的耐受性增强aitr突变体表明AITRs可能是植物育种的目标,以提高植物对非生物胁迫的耐受性。然而,健身成本应该评估之前AITRs可针对植物育种。因此我们研究了植物的生长发育aitr正常生长条件下的突变体。
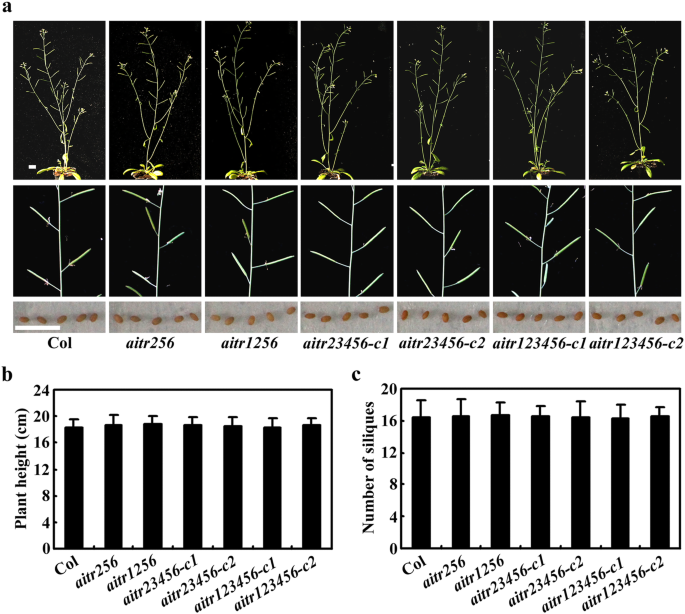
直接比较,Col野生类型和aitr突变体包括AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456直接染色突变体并在生长室中并排在土豆盆中生长。在其整个生长期期间,突变体和Col野生型植物之间发现了无明显不同,包括营养生长,开花和种子产生阶段(图。7a)。量化分析结果表明所有的aitr突变体的高度与Col野生型植株相同(图。7b),植株产生的角果数也相似(图。7c)。
的aitr突变体对病原体感染表现出野生型反应
积累的实验证据表明,ABA也可以调节生物的耐受性[51.,52.,53.]观察到生物和非生物应激应激之间的权衡[54.,55.].表明,亚硝酸能够调节ABA反应,并且在包括干旱和盐的非生物应激的增强耐受性aitr突变体,我们检查了植物对病原体感染的反应可能受到影响aitr突变体。
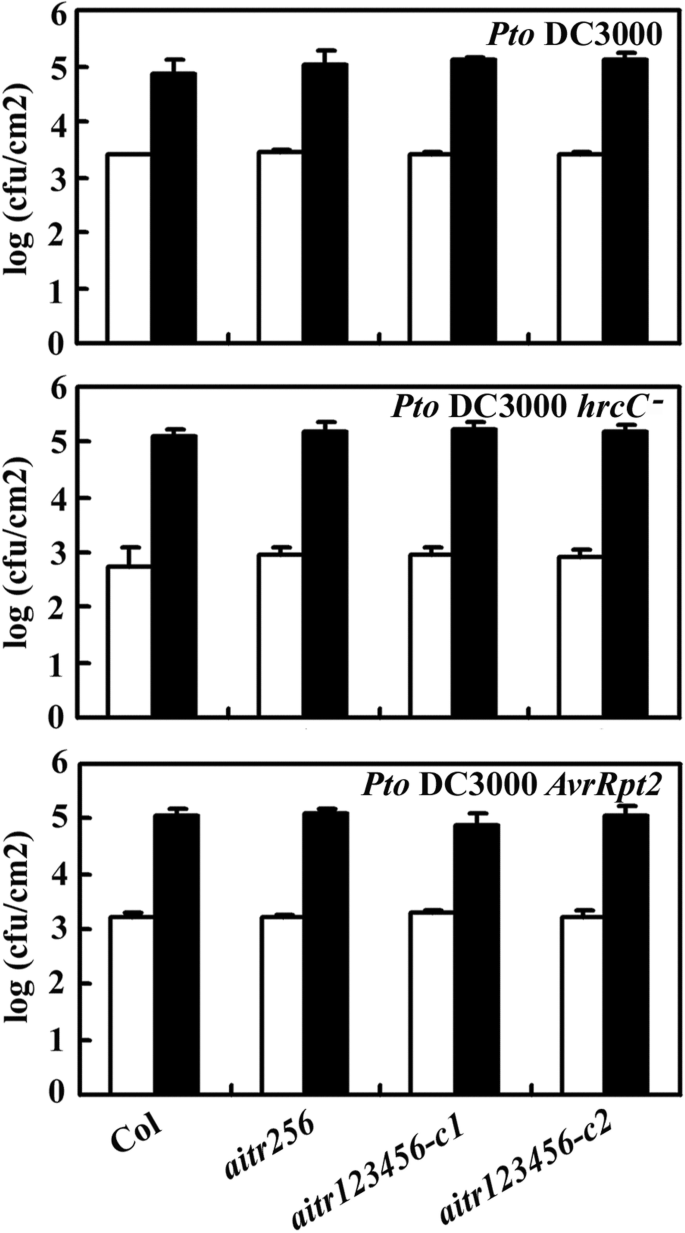
Col野生型植物和aitr突变体受到毒性细菌病原体的挑战两光伏番茄(PTO.)DC3000,PTO.DC3000HRCC.-和PTO.DC3000AVRRPT2.,并检测细菌的生长情况。如图所示。8,所有的aitr突变体表现出与Col野生型植物相似的反应。
讨论
CRISPR/Cas9的基因组编辑能够在不同植物物种中产生无转基因突变体,并已成功用于改善几种不同作物的重要农艺性状[17,20.,21,22,56.].然而,CRISPR/Cas9基因组编辑技术在植物育种中应用是一个挑战。我们在这项研究中提供的证据表明AITR基因可能被用于基因组编辑,以提高植物对非生物胁迫的耐受性,而不影响它们的农艺表现。
环境胁迫,尤其是非生物应激这种干旱和盐是一种全球性问题,导致植物中产量损失,包括最重要的作物[5,6].作为关键应激激素,ABA调节对非生物应激的植物耐受性[25,26,27,28,29,30.].结果,改变ABA信号传导中的核心调节剂基因的表达水平通常影响植物对非生物胁迫的反应。作为示例,操纵表达的表达所有供试受体基因,SnRK2蛋白激酶基因,和/或沛富/AREB转录因子基因对拟南芥抗旱性的影响[45.,46.,48.].然而,在过表达这些核心调节基因的植物中通常观察到增强的非生物耐受性,而函数突变通常导致非生物胁迫耐受性降低[45.,46.,48.].因此,这些核心调控基因不太可能被CRISPR/Cas9靶向进行基因组编辑以增强植物对非生物胁迫的耐受性。
我们之前已经发现,AITRs是一种新型转录因子,在ABA信号转导和植物对非生物胁迫的响应中起反馈调节作用。9),以及功能丧失AITRs能够增强拟南芥的非生物耐受性[30.].使用CRISPR/Cas9进行编辑AITR3和AITR4在T-DNA插入突变体中AITR256.和AITR1256.,我们生成了AITR23456.Quintule和aitr123456SEXTuple突变体(图。1).结果表明,在种子萌发试验和绿色子叶试验中aitr高阶突变体对ABA的敏感性较低。2和3.),增强对干旱和盐处理的耐受性(图。5和6).然而,与……相比AITR256.三重突变体,如果在包括该高阶突变体中观察到任何增强的ABA和非生物胁迫耐受性很少aitr123456六个突变体,其中六个AITR基因被敲除了。与上述观察结果一致的是,PYL受体基因对ABA的响应Pyl4.,Pyl5.和Pyl6.,pp2c磷酸酶基因HAI1和ABF / arsb / abi5转录因子基因ABF3,和snrk2激酶基因SnRK2.2,SnRK2.3和SnRK2.6响应阿巴仍然很大程度上相似aitr123456六个突变体和AITR256.三,AITR1256.突变体(图4倍。4).这可能是因为基础表达水平AITRs非常低[30.),功能丧失AITR2,AITR5和AITR6可能已经达到了表达级别阈值,其中冗余函数的最高程度AITRs可以实现。然而,这些结果表明AITRs可以作为CRISPR/Cas9基因组编辑的候选基因,改善植物的非生物耐胁迫特性。
为了在逆境条件下生存,植物通常会在生长发育和耐受性之间进行权衡,因此,耐受性的增强通常伴随着适应度的惩罚[49.,50.,57.].因此,在没有健康成本的情况下改善植物应力耐受性是一项挑战。到目前为止,已经使用了一些方法来克服这个问题。作为实施例,通过使用病原体诱导的启动子来驱动表达IPA1(理想的植物结构1),是一种参与水稻产量和免疫反应调节的转录因子基因[58.],在转基因水稻植株上获得了抗病性增强和产量提高[57.].通过使用UORF(上游开放阅读框) - 甲型免疫诱导型启动子来驱动关键免疫调节剂基因的表达,在拟南芥和水稻中观察到没有健身成本的改善抗病抗性[50.].然而,这些策略仍然依赖于转基因植物的产生。
最近,有报道称MYC2-TARGETED BHLH1 (MTB1)、MTB2和MTB3这三种茉莉酸诱导bHLH转录因子作为JA介导的植物生物胁迫应答的负调控因子[59.].的快艇CRISPR / CAS9基因组编辑产生的突变体显示出增强对昆虫攻击的抗性,但突变体的总体生长和发育不受影响[59.].据我们所知,mtb可能是到目前为止确定的第一个基因家族,可以由CRISPR / CAS9靶向,以改善植物中的生物应力耐受性而无需健身成本。我们的研究结果表明,AITRS作为ABA介导的植物非生物应激反应的负调节剂(图。5和6).所有6的淘汰赛AITR基因不影响植物的生长和发育(图。7),植物对病原菌侵染的反应也不受影响aitr123456SEXTuple突变体(图。8).这些结果表明AITRsCRISPR/Cas9可能是迄今为止发现的第一个可以被CRISPR/Cas9靶向的基因家族,可以在不消耗适应度的情况下提高植物的非生物耐受性。
考虑到aitr只存在于包括所有作物物种在内的被子植物中,而在大豆和番茄等其他植物中检测到的aitr与拟南芥aitr具有相似的特征[30.,很有可能AITRs可以针对基因组编辑来改善作物中的殷息应力耐受性,而不担心健身成本。考虑到ABA和JA信号传导途径在植物中被保守,如果同时击退,它可能有趣AITRs和mtb可能增加作物的生物和非生物胁迫。考虑到目前在不同地区种植的作物品种可能具有不同的高产、优质等农艺性状,但对非生物胁迫的耐受性较低,基因组编辑AITR这些作物的基因可以在不影响其他性状的情况下增强其非生物抗逆性,从而整合作物所需的农艺性状。大多数作物有多重AITR基因(30.,它可能不容易击倒所有的AITR作物中的基因。然而,我们的观察表明,两者之间没有显著差异AITR256.三重突变体和aitr123456四种对非生物胁迫反应的突变,表明敲除了一些AITR基因敲除可能足以提高作物对非生物胁迫的耐受性,从而使基因的编辑AITRs改善农作物中的非生物胁迫耐受性更加实用。
结论
总之,我们发现淘汰了几个AITR拟南芥的基因足以增强非生物的耐受性,并敲除了拟南芥的标题家族AITR基因没有适应度成本。因为AITRs家族在有多种编码基因的作物中是保守的,AITRs可以是用于分子育种的良好候选基因,以改善植物中的非生物胁迫耐受性。这种发现可能会通过基于CRISPR / CAS9基因组编辑的分子育种,迎接新的农业环境中植物非生物胁迫耐受性的新浪潮。
方法
植物材料和生长条件
储存在我们实验室中的Col生态型拟查拟南芥用作野生类型,并且突变体都在Col Ecotype背景中。的Aitr1.单和aitr2 aitr5 aitr6(AITR256.)我们实验室储存的三种突变体如前所述[30.].的Aitr1 aitr2 aitr5 aitr6(AITR1256.)四倍突变体通过杂交产生Aitr1.单突变体和aitr2 aitr5 aitr6三重突变体,以及基因分型F2后代。
用于ABA或非生物处理和RNA分离的拟南芥幼苗在1/2 MS板上萌发。用于基因组编辑,表型观察和病原体感染的拟南芥植物直接发芽并在土豆罐中生长。所有植物都在生长室中生长,前面描述的生长条件[30.,60.],除了用于病原菌侵染的拟南芥是在短日条件下的生长室内生长的。因为这些植物是我们自己种植的,所以我们有权利收集这些植物的材料。
构造
CRISPR/Cas9基因组编辑构建AITR3和AITR4编辑是使用phee401e.向量。在单外显子的基因组序列上找到合适的靶位点AITR3和AITR4通过CRISPRscan进行识别(www.crisprscan.org.),然后在Cas-OFFinder (www.rgenome.net/cas-offinder/).用于的目标序列AITR3和AITR4编辑为5'-GGGTAAACCGGGCCTACCGG(AGG)-3’ ,和5'-TGGTTAACGAGGCTTACCGG(AGG)-3’ ,分别。通过遵循先前描述的过程产生CRISPR / CAS9构建体[61.].用于将目标序列插入到的引物phee401e.向量,AITR3-DT1.-净水器5“-ATATATGGTCTCGATTGGGTAAACCGGGCCTACCGGGTT-3”,AITR3-Dti.-F05“-TGGGTAAACCGGGCCTACCGGGTTTTAGAGCTAGAAATAGC-3”,AITR4-DT2.-R0.,5-aacccggtaagcctcgttaacccaatctcttagtcgactctac-3',和AITR4-DT2.-BsR5“-ATTATTGGTCTCGAAACCCGGTAAGCCTCGTTAACCC-3”。的U626-idf.和U629-IDR.用于克隆PCR的引物及其在CRISPR / CAS9构建体中的SGRNA表达盒的测序[62.].
植物转化、转基因植物鉴定及无cas9突变体的分离
大约5周岁AITR256.三倍AITR1256.当在主要花序茎上产生几朵成熟的花时,四重突变植物用于转化。用通过使用花卉DIP方法产生的CRISPR / CAS9构建体转化植物[63.].为了筛选转基因植株,将T1种子放在1/2 MS培养皿上,培养皿中含有30µg/ml潮霉素和50µg/ml卡苄西林。目的:研究转基因植物的基因编辑状况AITR3和AITR4扩增并测序。为筛选无Cas9纯合突变体,将经基因编辑的T1植株T2代直接在土盆中萌发,检测Cas9基因编辑状态和缺失情况。使用两个已确认的独立的无cas9纯合子突变体进行实验。
DNA分离和PCR
的基因组编辑状态AITR3和AITR4,收集T1转基因植物或单个基因的T2后代的叶子,并用于DNA分离。分离的DNA用于PCR扩增的基因组序列AITR3和AITR4,分别。分离PCR产物并送去测序,并且测序结果与野生型序列对齐AITR3和AITR4,分别。为了分离Cas9-free突变体,收集T1单株基因编辑后的T2后代叶片,分离DNA并进行扩增Cas9通过聚合链反应。用于扩增的引物AITR3是,AITR3-MF.,5'-aatggagagataaaagctggtgagt-3'和Aitr3-R.,5'- tcacatgccaagccttagag-3'。对于AITR4是,AITR4-MF.,5'- tggagtccgttaacagtgg-3'和AITR4-R5“-TCAAAGCCAAAGAGT-3”。的Cas9-F和Cas9-R用于扩增的引物Cas9已在前面描述[62.].
RNA分离和定量RT-PCR (qRT-PCR)
野生型的12日龄幼苗AITR256.,AITR1256.和aitr123456如前所述用于ABA治疗的突变体[30.].通过使用easyPure植物RNA试剂盒(转基因)分离总RNA,通过使用EAzyscript First-Slard DNA合成超级混合试剂盒(Transgen Biotech)对1μgRNA进行cDNA合成。
通过qRT-PCR检测ABA信号元件基因对ABA处理的响应,并按照前面所述计算[30.].所用引物与之前报道的相同[30.,64.,65.,66.,67.].
ABA敏感性分析
对ABA敏感性的种子萌发和子叶绿化试验如前所述[68.].简单地说,科尔野生型的种子AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456在1/2 MS板上灭菌和筛选塞子突变体,或没有表明浓度的ABA。在4℃下保持暗淡2天后,将板转移到生长室。
对于种子萌发测定,在转移后每天在解剖显微镜下检查种子萌发,并计算出萌发率。对于子叶绿化测定,幼苗的图片在转移后17天进行,计算绿色幼苗,计算绿色幼苗的百分比。
干旱耐受分析
如前所述,耐旱耐受性[30.与修改)。总之,野生型和野生型的种子AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456六十突变体直接发芽,在生长室的土壤中生长30天,正常浇水。采取了图片,通过扣用浇水,将植物进行干旱治疗12天。在干旱治疗后恢复了图片并浇水。恢复浇水后2天再次服用图片。
耐盐分析
耐盐性aitr如前所述测定突变体[30.与修改)。简而言之,野生型的种子和AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456六十突变体直接发芽,并在生长室的土壤盆中生长30天,足够的浇水。采取了图片,然后将植物每隔一天用150mM NaCl浇水10次。盐处理后采取了图片。
病原体感染测定
用于病原菌感染的检测,种子的Col野生型和aitr1234566个突变体直接发芽,在短日条件下在生长室内的土壤盆栽中生长。对4周龄的植物进行渗透,细菌的生长情况如前所述[69.].用于渗透的病原菌及其浓度分别为两光伏番茄(PTO.)DC3000,PTO.DC3000HRCC.-和PTO.DC3000AVRRPT2.在一剂OD600 = 0.0002, 0.001 and 0.001, respectively.
形态分析
用于植物生长和发育测定,Col野生类型的种子和AITR256.三,AITR1256.四边形,AITR23456.Quintule和aitr123456六分层突变体直接发芽并在生长室的土豆盆中生长。检查了不同生长阶段的植物的形态。通过使用数码相机采取了指定的生长阶段的植物和花序的图片,并且在配备有数码相机的解剖显微镜下进行种子的图片。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。
缩写
- 阿坝:
-
脱落酸
- AITRs:
-
ABA-induced转录阻遏物
- bZIP:
-
基本区域亮氨酸拉链
- CRISPR / Cas9:
-
规律性聚集间隔短回文重复序列/CRISPR相关蛋白9
- IPA1:
-
理想的植物结构1
- 是:
-
贾斯莫酸盐
- 柯格:
-
继续前进
- MTB1:
-
myc2目标bhlh1
- PP2CS:
-
蛋白磷酸酶2摄氏度
- pyl:
-
Pyr1就是这样的
- PYR1:
-
Pyrabactin电阻1
- RCAR:
-
ABA受体的监管组分
- SnRKs:
-
非发酵1 (snf1)相关蛋白激酶
- UORF:
-
上游开放阅读框
参考文献
- 1.
Ray DK,Mueller Nd,West PC,Foley Ja。产量趋势不足以通过2050年双重作物生产.PLO。2013; 8:E66428。
- 2.
范利约丹,叶华,宋林,马文华,陈志强。大豆抗旱耐涝能力的遗传多样性和基因组策略。J Exp Bot. 2017; 68:1835-49。
- 3.
王伟,王文华,王文华,等。植物对干旱、盐胁迫和极端温度的响应研究进展。足底。2003;218:1-14。
- 4.
Fujita M, Fujita Y, Noutoshi Y, Takahashi F, Narusaka Y, Yamaguchi-Shinozaki K,等。非生物和生物应激反应之间的串扰:当前从应激信号网络收敛的观点。植物学报2006;9:436-42。
- 5。
Boyer JS。植物生产力与环境。科学。1982;218:443-8。
- 6。
Ghosh D,Xu J.植物根中非生物应激反应:蛋白质组学的观点。前植物SCI。2014; 5:6。
- 7。
Manavalan LP,Guttikonda SK,Tran LS,Nguyen HT。在大豆中改善抗旱性的生理和分子方法。植物细胞生理。2009; 50:1260-76。
- 8。
徐y,lu y,谢c,gao s,wan j,prasanna bm。标记辅助植物育种的全基因组策略。mol繁殖。2012; 29:833-54。
- 9。
Jinek M,Chylinski K,Fonfara I,Hauer M,Doudna Ja,Charpentier E.一种可编程的双RNA引导的DNA内切核酸酶,适应性细菌免疫。科学。2012; 337:816-21。
- 10.
丛丽,冉发,林胜,等。利用CRISPR/Cas系统进行多重基因组工程。科学。2013;339:819-23。
- 11.
李建峰,张丹丹,李建峰,等。利用导RNA和Cas9对拟南芥和本氏烟草进行多重和同源重组介导的基因组编辑。生物科技Nat》。2013;31:688 - 91。
- 12.
Nekrasov V, Staskawicz B, Weigel D, Jones JD, Kamoun S.利用Cas9 rna引导内切酶在模式植物本氏烟草中的靶向诱变。生物科技Nat》。2013;31:691-3。
- 13.
单强,王颖,李建军,张勇,陈凯,梁志强,等。利用CRISPR-Cas系统对作物进行靶向基因组修饰。生物科技Nat》。2013;31:686-8。
- 14.
Knott GJ,Doudna Ja。CRISPR-CAS指导基因工程的未来。科学。2018; 361:866-9。
- 15.
碱基编辑:活细胞基因组和转录组的精确化学。Nat Rev Genet. 2018; 19:770-88。
- 16。
Shimatani Z,Kashojiya S,Takayama M,Terada R,Arazoe T,Ishii H,等。使用CRISPR-CAS9胞嘧啶脱氨酶融合来靶向稻米和番茄。NAT BIOTECHNOL。2017; 35:441-3。
- 17。
他,朱米,王L,吴俊,王Q,王河,赵玉。编程的CRISPR / CAS9构建的自我消除极大地加速了编辑和转基因稻植物的分离。莫尔植物。2018; 11:1210-3。
- 18。
Zsögöna,čermákt,naves er,notini mm,edel kh,weinl s等人。使用基因组编辑的De Novo驯化野生番茄。NAT BIOTECHNOL。2018; 36:1211-6。
- 19。
陈侃,王y,张r,张h,高c. crispr / cas基因组编辑和精密植物育种在农业中。Annu Rev植物Biol。2019; 70:667-97。
- 20。
马旭,张强,朱强,刘伟,陈勇,邱锐,等。用于单子叶和双子叶植物中方便、高效的多重基因组编辑的稳健CRISPR/Cas9系统。摩尔。2015;1274 - 1284。
- 21。
Gao X, Chen J, Dai X, Zhang D, Zhao Y.一种可靠分离遗传和无cas9基因的有效策略拟南芥由RISPR/ cas9介导的基因组编辑产生的突变体。植物杂志。2016;171:1794 - 800。
- 22。
鲁惠普,刘姆,徐股,陈怀,周X,谭益等。CRISPR-S:一种用于快速和廉价的基因组编辑,无转基米植物选择的活性干扰元件。植物Biotechnol J. 2017; 15:1371-3。
- 23。
胡建辉,米勒SM, Geurts MH,唐伟,陈磊,孙楠,等。进化出具有广泛的PAM兼容性和高DNA特异性的Cas9变异。大自然。2018;556:57 - 63。
- 24。
石晓东,石黑一雄,高磊,平野一雄,冈崎一雄,等。扩增靶向空间的CRISPR-Cas9核酸酶。科学。2018;361:1259 - 62。
- 25。
朱家杰。缺失3个脱落酸激活蛋白激酶的拟南芥突变体揭示了生长、繁殖和应激的关键作用。美国国家科学院学报。2009; 106:8380-5。
- 26。
Umezawa T,Nakashima K,Miyakawa T,Kuromori T,Tanokura M,Shinozaki K,等。ABA响应中核心监管网络的分子基础:传感,信号和运输。植物细胞生理。2010; 51:1821-39。
- 27。
拉什敦DL,Tripathi P,Rabara Rc,Lin J,Ringler P,Boken Ak等人。WRKY转录因子:脱钙信号中的关键组分。植物Biotechnol J. 2012; 10:2-11。
- 28。
Yoshida T,Mogami J,Yamaguchi-Shinozaki K. ABA依赖性和无关的信号,响应于植物中的渗透胁迫。CurrOp植物BIOL。2014; 21:133-9。
- 29。
宋l,黄sc,wise a,castanon r,nery jr,chen h,等。转录因子层次结构定义了环境应力响应网络科学。2016; 354:AAG1550。
- 30.
天H,陈某,杨W,王T,郑k,王Y等。ABA信号传导所需,需要在被子培训中保守的新型转录因子家族。植物细胞环境。2017; 40:2958-71。
- 31.
拟南芥(Arabidopsis thaliana)中与ABI1和ABI2同源的蛋白磷酸酶2c (PP2C)的分子克隆植物学报1998;38:879-83。
- 32.
Gosti F, Beaudoin N, Serizet C, Webb AA, Vartanian N, Giraudat J. ABI1蛋白磷酸酶2 C是脱落酸信号的负调控因子。植物细胞。1999;11:1897 - 910。
- 33.
朱建军。拟南芥中脱落酸调节种子萌发、根生长和基因表达所需的两种蛋白激酶的鉴定。植物细胞。2007;19:485 - 94。
- 34.
郭健,杨旭,Weston DJ,陈建国。脱落酸受体:过去、现在和未来。acta botanica yunnanica(云南植物研究)2011;53:469-79。
- 35.
董T,Park Y,Hwang I. Asscisic acid:生物合成,灭活,同性恋和信号传导。散文生物化学。2015; 58:29-48。
- 36.
Bueso E,Rodriguez L,Lorenzo-Orts L,Gonzalez-Guzman M,Sayas E,Muñoz-Bertomeu J,等。单亚单位环型E3泛素连接酶RSL1靶向膜膜中的Pyl4和Pyr1 ABA受体,以调节脱落酸信号传导。工厂J. 2014; 80:1057-71。
- 37.
徐琪,李jh, Nezames CD,钟舒,宋娥,卞默,等。ABD1是拟南芥中基于cul4 - ddb1的E3连接酶的DCAF底物受体,作为脱落酸信号的负调控因子。植物细胞。2014;26:695 - 711。
- 38.
于飞,娄丽,田敏,李强,丁颖,曹旭,等。ESCRT-I组分VPS23A通过识别内体降解的ABA受体来影响ABA信号传导。摩尔。2016;9:1570 - 82。
- 39。
Belda-Palazon B, Rodriguez L, Fernandez MA, Castillo MC, Anderson EA, Gao C, et al.;FYVE1/FREE1与PYL4 ABA受体相互作用,并介导其传递到液泡降解途径。植物细胞。2016;28:2291 - 311。
- 40.
KEEP ON GOING是一种环E3连接酶,在拟南芥的生长发育中起重要作用,它参与了脱落酸信号的传递。植物细胞。2006;18:3415-28。
- 41.
Chen YT, Liu HX, Stone S ., Callis J. ABA和泛素E3连接酶KEEP ON GOING影响蛋白水解拟南芥转录因子ABF1和ABF3。植物j . 2013; 75:965 - 76。
- 42.
关键词:拟南芥,ABI5转录因子,KEG E3连接酶,自泛素化,蛋白酶体降解植物细胞。2010;22:2630-41。
- 43.
拟南芥转录因子脱落酸不敏感5的细胞质降解是由ring型E3连接酶KEEP ON GOING介导的。J Biol Chem. 2013; 288:20267-79。
- 44。
孔林,程军,朱勇,丁勇,陈志强,等。PUB12/13 U-box E3连接酶对ABA共受体ABI1的降解Nat Commun。2015;6:8630。
- 45。
藤田y,nakashima k,yoshida t,katagiri t,Kidokoro S,Kanamori n等人。三个SNRK2蛋白激酶是拟拟南芥水分胁迫的脱落酸信号传导的主要阳性稳压因子。植物细胞生理。2009; 50:2123-32。
- 46。
Yoshida T,Fujita Y,Maruyama K,Mogami J,Todaka D,Shinozaki K,等。四种拟南芥arb / ABF转录因子主要在SNRK2激酶下游的基因表达中响应于渗透胁迫的脱落酸信号传导。植物细胞环境。2015; 38:35-49。
- 47。
公园SY,Peterson FC,Mosquna A,Yao J,Volkman BF,Cutler SR。使用工程脱落酸受体的植物用水的农业化学控制。自然。2015; 520:545-8。
- 48。
陈赵Y, Z,高J,邢L,曹M,于C, et al。ABA受体PYL9促进抗旱性和叶片衰老。美国国家科学院学报。2016; 113:1949-54。
- 49。
Gurr SJ,Rushton PJ。抗病抵抗力增加的工程植物:我们如何表达它?趋势生物技术。2005; 23:283-90。
- 50。
徐G,元M,AI C,刘L,庄E,Karapetyan S等人。UORF介导的翻译允许工程植物疾病抵抗而无需健康成本。自然。2017; 545:91-494。
- 51。
Alzaem M,He Mh,Moffett P,Lin NS。脱落酸诱导抗性竹马赛克病毒通过阿尔戈瑙特2号和3号。植物杂志。2017;174:339-55。
- 52。
Alzaem M,Lin NS。植物中脱落酸的抗病毒作用。前植物SCI。2017; 8:1760。
- 53。
杨旭,何华,王敏,郭鹏,王艳艳,等。表达的GmKR3,TIR-NBS-LRR类型R基因,在大豆中赋予对多种病毒的抗性。植物mol biol。2019; 99:95-111。
- 54.
Berens Ml,Wolinska KW,Spaepen S,Ziegler J,Nobori T,Nair A等。通过叶龄依赖于应力激素串扰的叶龄依赖性变化平衡生物和非生物应激反应之间的权衡。美国国家科学院学报。2019; 116:2364-73。
- 55.
Bostock Rm,Pye Mf,Roubtsova电视。植物病中易感性:利用非生物和生物应激感知和反应的Nexus。Annu Rev phytopathol。2014; 52:517-49。
- 56.
李X,谢y,朱q,刘yg。基因和顺式调节区域的靶向基因组编辑可提高作物中的定性和定量性状。莫尔植物。2017; 10:1368-70。
- 57.
刘米,施Z,张X,王米,张l,郑k等。理想植物架构1的诱导过度表达提高了水稻产量和抗病性。Nat植物。2019; 5:389-400。
- 58.
王军,周立军,石华,陈明,于华,易辉,等。一个单一的转录因子可以促进水稻的产量和免疫力。科学。2018;361:1026-8。
- 59.
刘勇,杜敏,邓丽,沈军,方敏,陈强,等。MYC2通过一个自调节负反馈回路调控茉莉酸信号的终止。植物细胞。2019;31:106-27。
- 60.
戴旭,周玲,张伟,蔡林,郭华,田华,等。在拟南芥中,GLABRA1 R3区域的一个氨基酸替换可以抑制毛状体的形成,而不影响其与GLABRA3的相互作用。植物学报。2016;39:897-907。
- 61.
王Z,邢H,董立,张H,韩C,王X等。蛋细胞特异性启动子控制的CISPR / CAS9有效地为单一代拟南芥中的多个靶基因产生纯合突变体。基因组Biol。2015; 16:144。
- 62.
陈某,张n,张q,周g,天h,侯赛因S等人。基因组编辑以整合拟南芥中的种子大小和非生物胁迫耐受性状,揭示了DPA4和SOD7在花序架构的调节中的作用。int j mol sci。2019; 20:2695。
- 63.
阵伤SJ,弯曲AF。花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J. 1998; 16:735-43。
- 64.
徐泽,金苏,金德,董T,公园Y,Jin JB等。拟南芥NAC转录因子ANAC096与脱水和渗透应激反应中的Bzip型转录因子配合。植物细胞。2013; 25:4708-24。
- 65.
刘S,胡Q,罗S,李Q,杨X,王X等。野生型PTRIAA14.1的表达,杨树Aux / IAA基因导致拟南芥的形态变化。前植物SCI。2015; 6:388。
- 66.
田华,郭洪,戴晓华,程阳,郑凯,王旭东,等。bHLH129是一个ABA下调bHLH转录抑制基因,在拟南芥中过表达时,bHLH129调控根伸长和ABA反应。Sci众议员2015;5:17587。
- 67.
黄烨,冯cz,ye q,吴wh,陈yf。Arabidopsis Wrky6转录因子用作种子萌发和早期幼苗发育过程中脱落酸信号的正调节因子。Plos Genet。2016; 12:E1005833。
- 68。
郭继,王家,十三,黄师傅,梁俊,陈杰。Rack1是ABA arabidopsis的负调节器。J Exp Bot。2009; 60:3819-33。
- 69。
孔强,孙涛,曲宁,马军,李敏,程玉涛,等。两个多余的受体样胞浆激酶作用于模式识别受体的下游,以调节SA生物合成的激活。植物杂志。2016;171:1344-54。
致谢
我们感谢所有实验室成员的帮助讨论。
资金
这项工作得到了中国国家自然科学基金(32071938),中国国家重点研发计划(2016YFD01900),以及临沂大学的启动资金(Lydx2019BS039)。该资助者在研究和收集,分析和数据的设计方面没有作用,以及编写手稿。
作者信息
隶属关系
贡献
SW构思了这项研究。SC、HT和SW设计了实验。SC、NZ、GZ、SH、SA和HT进行了实验。SC, HT和SW对数据进行了分析,并起草了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
陈淑珍,张楠,周国栋。et al。淘汰整个家庭AITR拟南芥中的基因导致没有健身成本的增强的干旱和盐度耐受性。BMC植物BIOL.21,137(2021)。https://doi.org/10.1186/s12870-021-02907-9
收到了:
接受:
发表:
关键字
- 阿坝
- 非生物压力
- AITRs
- 拟南芥
- 基因编辑
- 健身成本