摘要
背景
机械损伤对植物的生长和生存是不可避免的威胁。虽然对衰老(下部)叶子的伤害会提高植物的活力,但对年轻(上部)叶子的伤害通常会导致整个植物的损坏或死亡。源汇模型常被用来解释植物对生物或非生物胁迫的反应。本研究采用源-库模型,解释了红豆杉幼叶和衰老叶机械损伤代谢机制的差异Catharanthus roseus也叫.
结果
本研究采用GC-MS和LC-QTOF-MS代谢组学技术,探讨不同器官源库分配和代谢调节的差异Catharanthus roseus也叫上/下叶片(WUL/ will)机械损伤后。与对照组相比,wl组和WLL组的能量供给增加,并通过TCA循环传递到次级代谢途径。两组治疗采用不同的次级代谢反应策略。WLL组通过增加酚类物质的积累增加了损伤后防御反应的输入。将源库模型应用于对局部(受损叶片)和系统(整株)损伤的防御反应。在WUL组中,由于幼叶的损伤,汇的数量增加了,并且强调了耐受性反应。
结论
两种机械损伤治疗之间的初级和次级代谢物的积累显着差异。Catharanthus roseus也叫在容忍(修复)和防御之间使用不同的权衡来应对机械损伤。修复损害和化学防御被认为比增长发展更耗费精力,这证实了源汇模型中所看到的资源权衡和分配。
背景
在生长和发展期间,植物在自然环境中进行各种生物和非生物胁迫[1].伤害是由于非生物和生物胁迫对植物造成的常见机械伤害,威胁植物的生长和生存[2].机械损伤会破坏植物细胞的完整性。它导致细胞膜破坏、干燥、脂质和蛋白质氧化以及蛋白质聚集[3.].受损的组织导致植物养分流失和病原体入侵,导致疾病在整个植物中传播[2].植物已发展出构成性和诱导性防御机制来对伤害作出反应并适当地防止感染[4.].以前的研究表明,环境胁迫刺激初级和次级代谢物的积累,保护植物免受虫害、疾病和胁迫[5.那6.那7.那8.].特定代谢物集中在伤口上,促进伤口愈合,防止微生物感染。这是由机械损伤引起的特定代谢途径的激活和调节引起的[9.].相关代谢物通过直接或间接的毒性作用帮助植物抵抗食草动物、病原体或竞争对手造成的伤害[10].因此,代谢物和代谢途径的变化反映了植物对机械损伤的响应。
源汇模型已经解释了植物需求变化与能量分配之间的关系,涉及复杂的代谢和信令网络[11那12那13].植物常常重新配置其营养资源和次生代谢物,以应对环境压力[10那14].代谢物的变化导致植物内部资源在生长和防御之间的重新分配[15].生长模式源自源过程之间的相互作用(供应碳水化合物,植物的建筑物块)和水槽活动(碳水化合物的需求)[16].当防御所需的资源超过生长和繁殖所需的资源时,受伤的植物就会经历生理变化。这些变化包括激活休眠的分生组织,改变植物的结构和生长,以及调节储存和繁殖之间的资源分配[17那18].碳水化合物的分配是碳从源组织(如叶)同化和分配到库组织(如茎、根和种子)的过程[19].碳水化合物调节基因影响糖代谢,调节植物对逆境和环境信号变化的反应的资源分配[20.那21].基因表达改变植物中的源和水槽活动,以根据碳资源的可用性和收购来调节其生长模式[10].贮藏器官的碳水平影响源组织的净光合活性,而糖水平改变叶片光合相关酶的表达。然而,糖调节植物源基因表达的机制仍然相对未被研究[22].
Catharanthus roseus也叫(c . roseus也叫)是Apocynaceae的成员,是植物园的观赏植物[23].这种植物在生长过程中产生各种次生代谢物[24],是用于次级代谢研究的药用植物模型[25].Terpenoid Indole生物碱(TIAS)是物种的基本二次代谢产物[26].这些代谢物有独特的化学结构,包括吲哚和萜烯部分,帮助植物抵御生物和环境压力[27那28].此外,c . roseus也叫含有长春碱、长春新碱等生物碱,能有效抑制肿瘤,是从植物中提取的应用最广泛的天然抗肿瘤成分。这种植物的硫酸盐成分已广泛用于实际医学[29].
在本研究中,我们研究了在c . roseus也叫机械损伤对年轻(上)和Sencing(下)叶子。GC-MS和LC-MS用于检测和识别代谢物,并提供对机械损伤调节的代谢途径的洞察[30.那31那32那33].我们假设代谢产物发生变化c . roseus也叫叶片机械损坏后与权衡和源水槽关系有关。为此目的,我们分析了代谢物和相关基因在不同器官中的变化。代谢组策略用于分析代谢途径的变化。我们的研究可以增加对植物防御机制的理解,从而为对机械损伤的不同代谢反应进行研究提供了基础。
结果
初级代谢物的反应
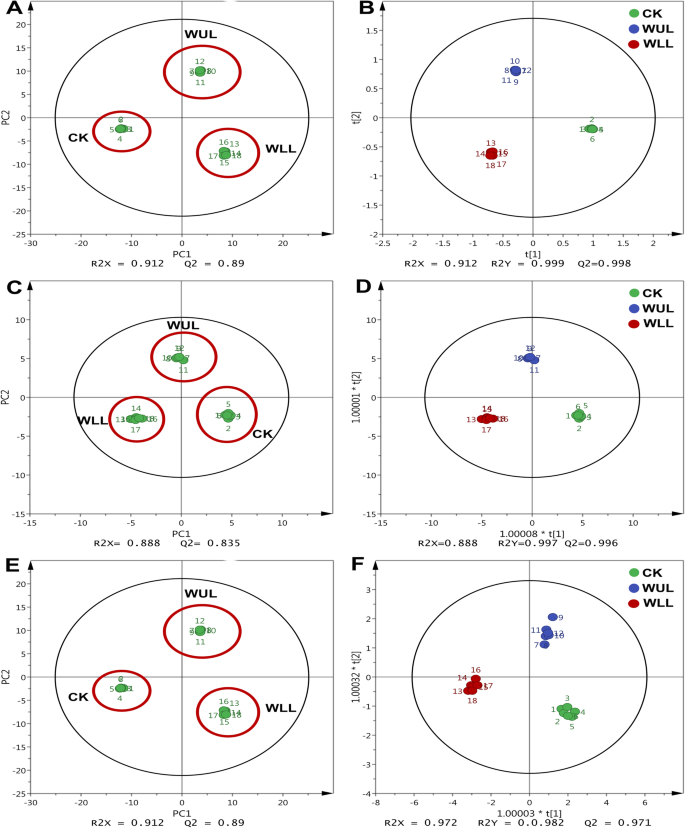
GC-MS检测到174种代谢物。采用PCA模型分析治疗组间初级代谢物差异。结果显示,三个处理组有显著的代谢差异(图。1.一种)。OPLS-DA模型用于鉴定治疗组之间的不同代谢物(图。1.b)。发现了六种不同的代谢物,这取决于其VIP值(VIP> 1)和P- 值(P< 0.05)(Table S1).每个代谢物都标记在Kegg数据库中,以找到所涉及的生物途径。重要标准是p≤0.05为差异代谢途径的筛选标准。采用显著性标准对半乳糖代谢和脂肪酸生物合成途径进行标记p≤0.05(表1),由四种糖和两种脂肪酸组成(表S2).
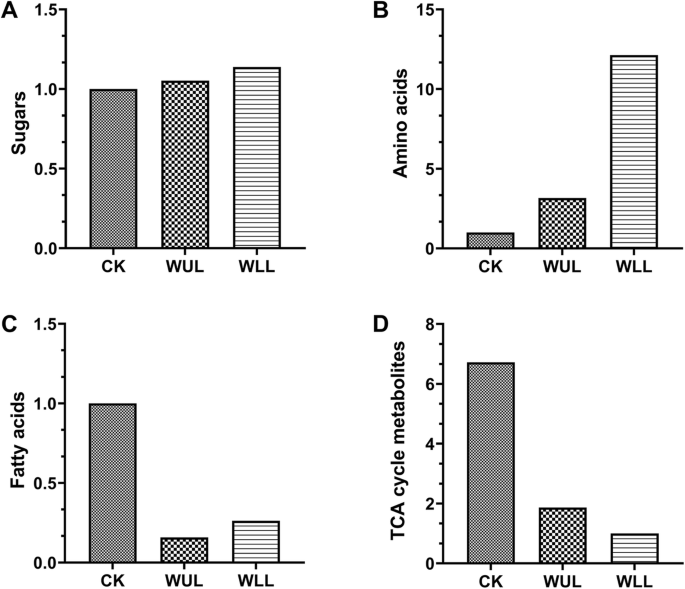
Q值表示初级代谢物的总积累量。机械损伤增加了糖和氨基酸的积累c . roseus也叫.WUL和WLL的糖含量分别比CK高5.25和13.74%(图2)。2.a). waul和WLL的氨基酸比CK分别高215.30和1213.00%(图2)。2.b).相比之下,机械损伤减少了脂肪酸,TCA循环代谢产物积累。waul和WLL的脂肪酸含量分别比CK低84.21和73.68%(图3)。2.C)。WUL和WLL中的TCA循环代谢物比CK中的572.00%和87.00%低(图。2.d)。
酚类的反应
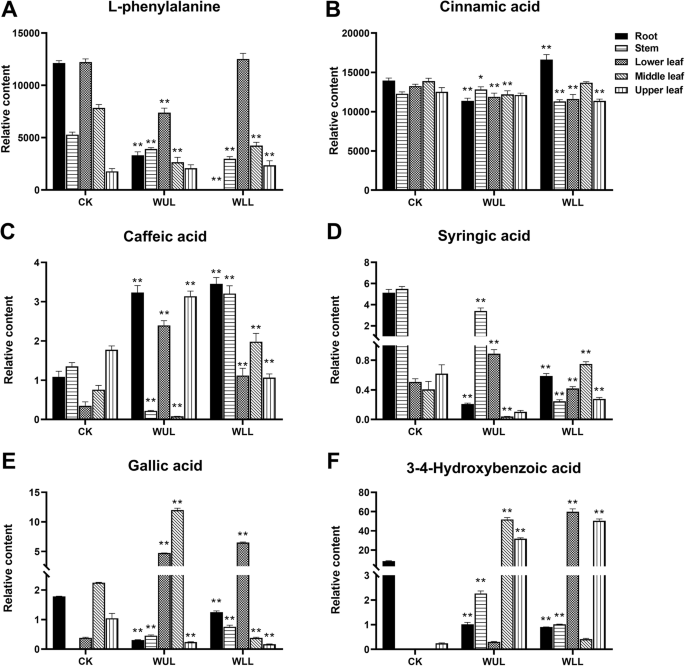
PCA模型显示,各处理组中酚类物质的积累存在差异(图2)。1.c). OPLS-DA模型获得11个差异显著的pc (VIP > 1,P< 0.05)(图2.d,无花果。3.,无花果。4.).WLL和WUL的根、茎和中位叶中苯丙氨酸含量均低于CK。叶片上部的叶绿素含量高于对照(图2)。3..a).肉桂酸显示器官变异。枸杞地上部器官含量低于对照,而根系则呈现相反趋势。在WUL中,根和叶中肉桂酸含量低于CK,茎中肉桂酸含量高于CK(图2)。3..b).除下叶外,各处理组咖啡酸含量均高于对照。叶柄和下部叶的wl高于叶柄,中部叶的WLL高于叶柄。3..c) WLL的丁香酸除下叶外均低于CK,中位叶高于CK(图3)。3..d). WUL除根和上部叶外,没食子酸含量均高于CK。枸杞根、茎、下叶中含量高于对照,中、上叶中含量低于对照(图2)。3..e).地下器官中WUL中3 - 4-羟基苯甲酸含量低于CK。除中位叶外,地上部器官均高于对照(图2)。3..F)。
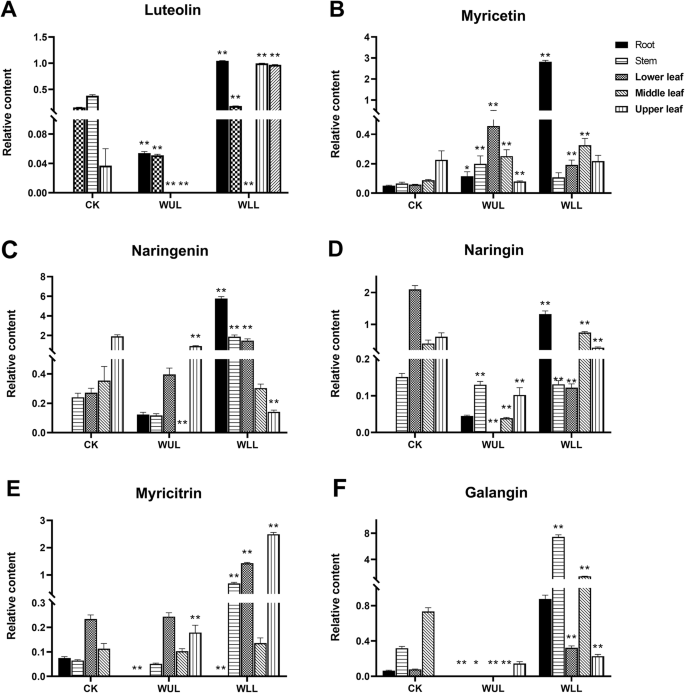
在大多数器官中,木犀草素、柚皮素、柚皮素和高良姜在WLL中的反应更强烈(图2)。4..一种。C。天。F)。除了下叶之外,Wll中的叶黄素低于CK。WUL中的含量低于上部叶片中的CK中的含量(图。4..一种)。在根中的乳腺素和中位数叶子比ck更高。除了上叶外,其含量高于WUL的CK(图。4..b)。在Wll中,鼻腔含量低于中间和上叶中的CK中的含量。在武伍中,其含量低于中间叶中的CK中的含量(图。4..C)。在WLL中,除了茎外的鼻腔内的含量高于CK中的含量。然而,在WUL中,其含量低于茎和中值叶中的CK中的含量(图。4..d).枸杞地上器官杨梅苦苷含量高于对照。在WUL中,其含量仅在上部叶中较高。在根系中,WLL和WUL的杨梅苦苷含量低于CK(图。4..e).高良姜在各器官中的含量均高于对照。除上叶(图2)外,枸橼酸含量均低于对照。4..F)。
TIAs的反应
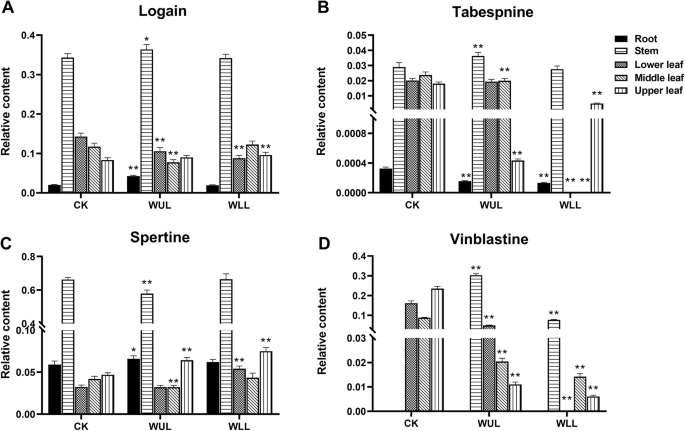
PCA模型结果显示,治疗组TIAs存在差异(图2)。1.e). OLPS-DA模型显示了治疗组之间四种不同的tia(图。1.F,VIP> 1,P< 0.05,无花果。5.).在Wll中,Loganin的相对含量低于下叶中的CK中的相对含量,高于上叶中的CK中的CK。在WUL中,其相对含量低于下叶中的CK,并且在根和茎中高于CK(图。5..a).枸杞子除茎外,其他器官中塔伯索宁的相对含量均低于对照。在WUL中,根、中位和上叶的产量均低于CK(图2)。5..b). WLL下叶和上叶精氨酸的相对含量均高于对照。在WUL中,根和上叶的叶绿素含量高于对照,茎和中叶的叶绿素含量低于对照。5..c).冬小麦茎部长春碱相对含量高于对照,叶部长春碱相对含量低于对照。WUL的地上器官比CK低(图2)。5..d)。
主要代谢生产的流入方向
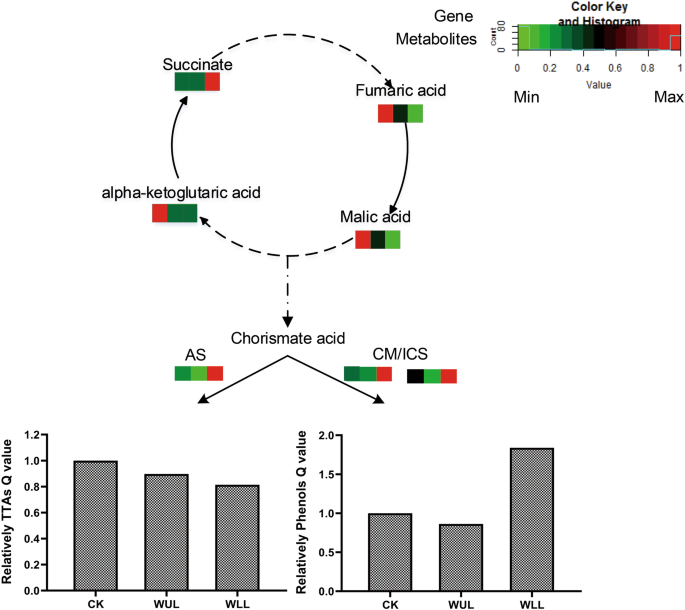
WLL在TCA循环中消耗的能量比CK多。更多的资源通过TCA循环流入次级代谢。与WUL相比,在WLL中表达更高的基因是邻氨基苯甲酸合成酶(AS)、chorismate mutase (CM)和isochorismate synthase (ICS)(图)。6.).虽然TIA合成相关基因表达增加,但机械损伤处理组TIA的Q值降低(图2)。7.).这一结果表明,TIA积累的减少可能是由于合成的抑制。我们还发现了TIA基因表达与PC积累之间的相关性。当TIA基因高水平表达时,pc在WLL中积累更多。TIA基因的低表达与WUL中PC的低积累相对应(图。6.).
代谢网络图的响应
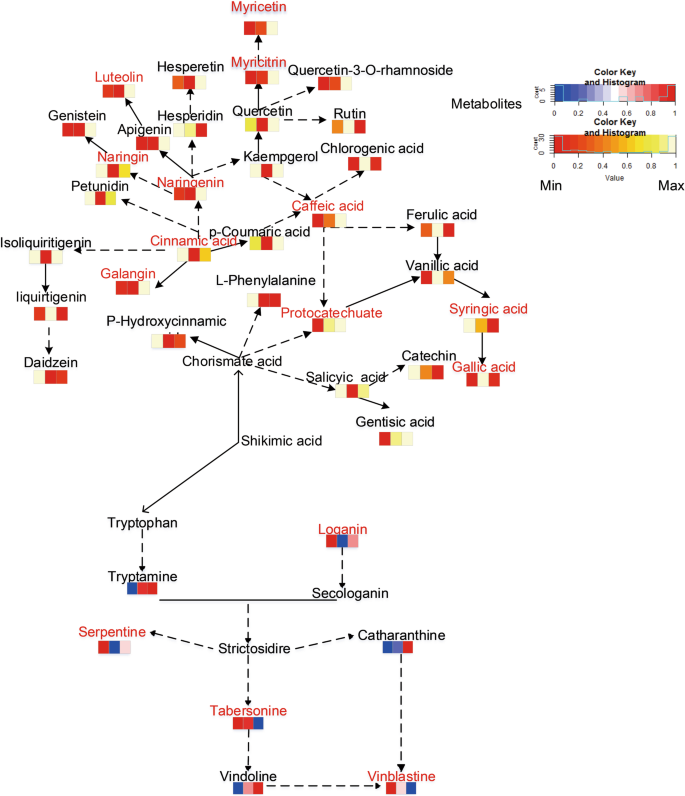
在初级代谢方面,机械损伤促进了碳水化合物和氨基酸代谢,抑制了TCA循环代谢(图S3.).WLL组的代谢变化比WLL组更明显(图S)3.).关于次生新陈代谢,机械损伤会影响PC代谢。WLL促进了纳兰纳,柚皮素,咖啡酸和半葡萄项的分支途径(图。7.).TIA合成途径也受到影响。治疗组在TIA的合成上游区域中的TryPtamine比CK组更高。然而,Loganin低于CK。在TIA合成途径中的下游代谢物的合成也受到影响。治疗组中的血管内比CK较低。在WLL中,其前体代谢物Tabersonine也被降低。然而,丘安洁净和屈曲的含量高于CK中的内容。在WUL中,长春碱的三种前体代谢物的含量高于CK中的含量。
讨论
代谢是对化合物合成的生理、生物学和功能调节各方面的总称[34].初级代谢是植物对营养和能量的调节和分配,为植物提供抵抗环境胁迫的次级代谢的基础和原料[35].对WUL和WLL组的不良分析表明,机械损伤后合成了许多初级代谢物,其中大部分是糖(图。2).在此过程中,碳水化合物主要作为能量生产的底物和增加植物抗性的二次代谢物质,反映出植物在机械损伤胁迫后对能量的需求较高。KEGG途径富集分析鉴定了碳水化合物代谢,这与植物对机械胁迫的响应密切相关。糖代谢、糖酵解和TCA循环都是与植物生命活动生长发育过程中提供可用能量和碳骨架直接相关的碳代谢途径[36].TCA循环是碳水化合物,脂肪和氨基酸的最终氧化途径,这是植物能源供应的重要代谢途径[37].本研究中,TCA循环代谢物参与了治疗组机械损伤应激后相关代谢物的中枢代谢重建。WLL组琥珀酸积累较多,WLL组苹果酸和富马酸积累较多,进入不同的碳水化合物代谢(图2)。7.).
氨基酸是植物初级代谢过程中必不可少的代谢产物,在植物生理过程中发挥着重要作用:作为渗透剂,调节气孔打开,作为合成防御相关代谢产物和信号转导代谢产物的前体[38].各种各样的次级代谢产物来自其化学结构,其中许多具有重要的防御机制[39].各处理组氨基酸的Q值表明,WLL对机械损伤的响应最强,这是由于衰老(下)叶片受到损伤后,植物不同组织的共同反应(图)。2.b)。此外,脂肪酸在植物抵抗中发挥着重要作用[40].在WLL组,它们显著减少(图。2.c),表明该工厂积极动员初级代谢,以准备损坏参培叶子。
植物生长阶段、环境胁迫、营养和植物遗传学影响次生代谢物的产生[41].PC在植物中普遍存在,以为用作物理障碍和抗菌物质[42].它们是一个相互联系的新陈代谢网络,通过调节和合作对环境压力作出反应[43].原儿茶酸是单宁的前体,在植物中具有特殊的防御作用[44].槲皮素-3-o-鼠李糖苷下游代谢物可有效促进创面愈合[45].橙皮苷能有效抵抗植物病原体的入侵[46].我们发现,在WLL组中,更多的pc对机械损伤有积极反应(图)。7.).原儿茶酸和槲皮素-3-o-鼠李糖苷仅在WUL组有反应。值得注意的是,在WLL组中,只有橙皮苷有局部反应,而参与各治疗组反应的其他pc则有系统反应。最后,通过局部或系统响应的权衡,可以更好地发挥机械损伤响应的作用。因此,不同组织中的pc对机械损伤应力有不同的响应策略。
TIAS和PC是植物中的主要次生代谢产物。通过苯丙醇丙烷途径合成PC [47].因此,它们与TIA生物合成竞争共同的前体合唱偶[48].TIAs和pc在与植物合作或竞争的权衡分配中对生物和非生物压力作出反应[49].经过初步的能源和原料准备,不同的处理首先对PCs有反应。然后,TIAs做出了回应(图。6.).它们之间存在时间序列上的差异。植物体内代谢物的迁移与组织器官的生物量无关,被认为是源库关系调节[50.].源汇模型已逐渐应用于压力下的植物资源控制[13那51.].在这项研究中,机械损坏破坏了源水槽平衡。因此,受损的工厂必须建立一个新的源汇总平衡,以减少资源分配的其他部分的消耗。
与WLL相比,WUL具有更多的合成障碍和次级代谢输入。由于杨(上)叶是植物生长和发育的关键组织部分,对幼叶的机械损伤将对植物产生更多的负面影响并消耗更多的资源和能量分配。由于植物老化的冗余组织部分,对山峰的损害通常为植物带来了更大的资源分配和有益的刺激。结果表明,果岭对c . roseus也叫,W.赫希机械损伤后,通过源汇模型重新调整资源分配,有效地改变了源汇活动(图2)。7.,图.. s3.).植物可以根据碳资源的可得性调整它们的生长模式[52.].即幼叶在受到破坏后,由强源变成强库,需要更多的资源。
导致机械损伤应力的沉淀强度增加的因素包括修复过程(耐受)和次级代谢调节(抗性)。不同的治疗导致不同的反应和应对策略。植物遭受损伤后,首先消耗基于碳的初级代谢物,然后通过权衡选择耐受性或阻力[53.].我们的研究发现,WLL组以耐药为主,而WUL组以耐药为主。机械损伤后,植物仍在资源限制的条件下选择性地进行次生代谢,诱导相关防御化合物,降低资源库中的资源利用率,显示出次生代谢在应对机械损伤中的重要性[54.那55.].因此,损坏c . roseus也叫必须有效地平衡并在有限的资源下分配。该分工的潜在利益是最大限度地减少受伤造成的代谢成本,并确保实施最有效的防御战略。
结果表明,机械损伤改变了初级和次级代谢物积累c . roseus也叫.代谢物由源向库转移。代谢产物的变化改变了源器官(未受损器官)和库器官(受损器官)之间的力量平衡。因此,WLL组具有更丰富的资源配置和防御代谢物积累。他们将在受损地区发挥关键的防御作用。受损植物利用其资源提高最大的受损适应性,并投入资源的比例。这导致了生理和代谢投资之间的权衡,最终选择耐受或抵抗应激。然而,会有一个配置效应的工厂权衡分配。一种代谢物的增加会导致其他代谢物的减少。在我们的研究中,PC反应是治疗组的主要反应。 There was a timing difference for the TIA responses. Therefore, the WLL group, with more induced resources, might have increased allocation to self-repair.
结论
总之,初级和次生代谢物的变化c . roseus也叫在机械损伤局部,由代谢途径改变引起的,这取决于受损叶片的生长阶段。结果表明,机械损伤将导致初级代谢资源和次生代谢物的再分布c . roseus也叫.提出了一个源汇模型来解释这种资源再分配机制。这些结果为研究植物对不同方式的机械损伤的响应以及探索植物对不利生态条件和胁迫的新的响应模式提供了有用的信息。虽然我们已经将机械损伤下的代谢资源串联起来,但通过代谢反应修复损伤的机制尚未得到充分解释。在未来的研究中,我们将以细胞损伤为重点,尝试将叶片损伤/耐受/修复与代谢/分子反应联系起来。从而揭示从诱导表观损伤到内部代谢调节到修复外部损伤的系统响应模式。
方法
植物材料及处理
的c . roseus也叫种子购自广东省广州市世诚农场有限公司。所购种子经东北林业大学植物生态学重点实验室唐忠华教授鉴定。种子标本保存在东北林业大学植物生态学重点实验室。种子在生长室中生长,温度为27-28℃/ 23-25℃昼夜温度循环,相对湿度为75%,光周期为12 h /12 h暗周期。种子萌发后,用1/2浓度的Hoagland溶液(pH 5.9-6.0)浇灌幼苗。在长出7-8片叶子(3个月后)后,每棵成熟植株被分成5个不同的生理区域或部分:根、茎、下叶、中叶和上叶。
在这项研究中有三个治疗组。对照组(CK)无机械损伤处理。上(幼)叶和下(衰老)叶分别用无菌剪刀、WUL和WLL进行机械损伤处理。如图S所示1,分布图显示处理位置在c . roseus也叫.每个处理组6个生物重复进行统计分析。通过研究代谢产物反应与时间的关系,确定最佳加工时间。分别于0 h、0.5 h、1 h、3 h和5 h采集样品。结果显示,治疗组中最强烈的反应出现在1 h(图S2);因此,本研究中所有采样时间均为1 h。
GC-MS分析
称取60毫克植物组织,用360 μL冷甲醇和40 μL内标液混合。然后使用组织层系统均质混合物并超声30分钟。然后加入200 μL氯仿和400 μL水。反应充分后,样品在4°C下10000 g离心10分钟。加氯仿200 μL,水400 μL。样品干燥,然后甲氧基胺化和硅基化[8.].
通过上述步骤衍生化之后,在GC-MS系统上分析样品。非极性DB-5毛细管柱用于分离。载气是高纯度氦,流速为1.0ml / min。温度方案为50-125℃,8分钟,在125-170℃下升高15分钟,在170-210℃下升高4分钟,在210-270℃下升高10分钟,升高在270-305℃5分钟,并保持在305℃下5分钟。入口温度为260℃,EI源温度为230℃,EI源电压为-70V.通过扫描50至600来收集质谱 m / z,延迟5 min后开始采集,采集速度为20谱/s。
LC-QTOF-MS分析
新鲜的植物组织首先在−180°C冰箱中冷冻干燥,然后粉碎。称取1克粉碎后的样品,溶于20 ml甲醇中,低频超声处理40 min。简单溶液8000转/分离心10分钟。TIAS检测基于Waters ACQUITY UPLC系统(Waters,日本)和Qtrap 5500离子阱质谱(ABS, SCIEX,美国),配备ACQUITY UPLC BEH C18色谱柱。柱温为30℃。流速为0.25 ml/min。UPLC流动相为水(0.1%甲酸)(A)和乙腈(B)。质谱为电喷雾离子源,具有阳性和多反应监测扫描模式。MS条件为:离子喷淋电压5500 V;雾化温度500°C;雾化空气压力,25psi; and air curtain pressure, 20 psi.
酚代谢物(PC年代)使用耦合到四极型飞行时间(QTOF)质谱仪(XEVO G2 QTOF,Waters)的Quadrupole时间(QTOF)的水域进行进行。色谱柱:Acquity UPLC-BE1 C18柱(1.7 mm,2.1 mm,×50 mm)。流动相系统由0.05%甲酸 - 水(A)和0.05%甲酸 - 乙腈(B)组成。在阳性模式下进行多重反应监测转变在120-1200m / z;内标是Leu-Enkephalin [26].
实时荧光定量PCR分析
实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)分析的条件是基于我们之前的研究[56.].所有植物样品均以六个生物学重复收集并立即在液氮中冷冻。使用Trizol试剂(Invitrogen,USA)衍生自RNA的总RNA。使用DNase I(新英格兰Biolabs)除去总RNA中的DNA污染。通过1%琼脂糖凝胶电泳检测DNA和RNA的纯度。然后使用NanoDrop分光光度计(Thermo Fisher Scientific,Inc。)检测总RNA浓度。使用Revertra Ace QPCR RT Master Mix(Toyobo,Shanghai,China)将总RNA(2g)转化为cDNA,用寡核苷酸(DT)作为底漆。使用CDNA作为模板和基因特异性引物进行QRT-PCR分析,使用Sybr Premix ExAQ进行初始变性。PCR方法包括95℃,30℃,然后在94℃下循环35℃,30s,56℃,30秒,30℃。每种样品至少连续三次重复该过程,以确保再现性。 The gene-specific primers used are listed in Table2(https://www.ncbi.nlm.nih.gov/genome/?TERM=TXID4058.那c . roseus也叫基因组)。核糖体蛋白亚单位9 (Rsp9)作为内部对照c . roseus也叫植物 [57.那58.].
统计分析
GC-MS原始数据文件被转换为CDF格式(NetCDF)NetCDF(* .cdf)格式,使用Agilent GC / MS 5975数据分析软件(版本14.1,Agilent Technologies,Santa Clara,CA,USA)并随后处理XCMS(www.biocondion.org.)[59.].将归一化数据导入SIMCA-P软件(版本13.0,http://www.umetrics.com/simca).应用无监督主成分分析(PCA)来可视化组间的整体代谢概况。其次,采用监督正交偏最小二乘判别分析(OPLS-DA)鉴别治疗组之间的差异代谢物。通过OPLS-DA分析,区分两个处理组的差异代谢物的变量重要图值大于1.0和P值小于0.05。使用kegg数据库注释差分代谢物(http://www.kegg.jp/kegg/pathway.html.)及MBRole 2.0 (http://csbg.cnb.csic.es/mbrole2/)[60.].主成分“Q”(Q)得分采用统计软件SPSS version 21.0软件(Chicago, IL, USA)计算,并用主成分“Q值”(Q)得分进行统计分析。Q是对客观现象进行分析和科学评价的综合性指标。热图、直方图和路径图使用GraphPad Prism 6.0版本(GraphPad Software Inc., La Jolla, CA, USA)或R 3.5版本(R Foundation for Statistical Computing, Vienna, Austria;https://www.r-project.org/).
数据和材料的可用性
在当前的研究中使用和/或分析的数据集可从通信作者在合理的要求。
缩写
- c . roseus也叫:
-
c . roseus也叫
- 电脑:
-
酚类
- 脑细胞死亡:
-
萜类吲哚生物碱
- PCA:
-
主要成分分析
- OPLS-DA:
-
正交偏最小二乘判别分析
- CK:
-
控制组
- WUL和WLL:
-
用机械损伤处理上叶和下叶
参考
- 1.
kare S, Singh N, Singh A, Hussain I, Niharika K, Yadav V,等。生物和非生物条件下植物次生代谢产物的合成及其调控。acta botanica sinica(云南植物学报),2019;https://doi.org/10.1007/s12374-020-09245-7.
- 2.
黄志强,王志强,王志强,等。柑橘叶片中主要代谢产物的代谢组学分析。中国生物工程学报。2017;33(3):376-81。https://doi.org/10.1016/j.jbiosc.2016.09.013.
- 3.
博斯托克RM。信号串扰和诱导电阻:跨越成本和收益之间的界线。植物病理学杂志。2005;43(1):545-80。https://doi.org/10.1146/annurev.phyto.41.052002.095505..
- 4.
植物组织创伤修复的研究。学生物化学:微+.2011年,47(3):229 - 33。
- 5。
杨玲,温克胜,阮霞,赵应祥,魏芳,王强。植物次生代谢产物对环境因子的响应。分子。2018;23(4)。
- 6。
ISAHT。植物次级代谢产物生产中的压力和防御反应。Biol Res。2019; 52(1):39。https://doi.org/10.1186/s40659-019-0246-3.
- 7。
Martim Sa。原发性代谢物的障碍响应干旱可能会增加用于药用目的的天然产品的合成:南美草药 - 以案例研究。察觉帕特生物。2014; 8(1):36-46。https://doi.org/10.2174/1872208307666131218125553.
- 8.
Tian M,Xu X,Liu F,风扇X,Pan S.未确定的代谢组学揭示了主要代谢物中的主要改变花椰菜芽对收获前硒处理的响应。食品资源国际。2018;111:205-11。https://doi.org/10.1016/j.foodres.2018.04.020.
- 9.
SavaTin DV,Gramegna G,Modesti V,Cervone F.在植物组织中伤害:防御危险的通道。前植物SCI。2014; 5:470。
- 10.
张文杰,张文杰,张文杰,等。不同处理对玉米幼苗再生能力和代谢产物的影响L Plantago生长状况.植物生理学报。2013;71:325-33。https://doi.org/10.1016/j.plaphy.2013.07.016.
- 11.
下沉强度:它是什么,我们如何衡量它?一个总结。植物细胞包围.1993; 16(9): 1045 - 6。https://doi.org/10.1111/j.1365-3040.1996.tb02061.x.
- 12.
Aslani L, Gholami M, Mobli M, Sabzalian M . effect of库源平衡的改变对温室番茄生长和产量的影响。acta physol Mol Biol Pla. 2020;26(11): 2109-23。https://doi.org/10.1007/S12298-020-00891-2..
- 13.
关键词:源库调节,干旱胁迫,时间和强度,光合作用,籽粒产量燕麦属漂白亚麻纤维卷L.)基因型。J工厂增长调节。2020:1-14。
- 14.
张晓东,张志强,张志强,等。植物源库组织中淀粉-糖相互转化的动态变化促进植物对非生物胁迫的响应。acta botanica yunnanica(云南植物研究);
- 15.
马拉克HB,比尔A,尚格云顿JM。化学防御的健康成本在Plantago生长状况营养和竞争胁迫的影响。57进化。2003;(11):2519 - 30。https://doi.org/10.1111/j.0014-3820.2003.tb01496.x.
- 16。
Schaaf W,Bens O,Fischer A,Gerke Hh,Gerwin W,GrünewaldU等。初始陆地生态系统开发的模式和过程。J植物Nutr土壤Sc。2011; 174(2):229-39。https://doi.org/10.1002/jpln.201000158.
- 17。
耐草食动物的进化:权衡假说的检验。同行j . 2015; 3: e789。https://doi.org/10.7717/peerj.789.
- 18。
Schwachtje J, Baldwin IT。为什么食草动物的攻击会改变初级代谢?植物杂志。2008;146(3):845 - 51。https://doi.org/10.1104/pp.107.112490.
- 19.
李建军,董晓东,崔坤,宋华,李华,胡玉华。大白菜叶片源库组织的鉴定。碳水化合物含量和转录组分析。基因染色体组。2020;42(1):24里面。https://doi.org/10.1007/s13258-019-00873-z.
- 20.
安德森CP。源水槽的平衡和植物下面的地面下面的碳分配。新植物。2003; 157(2):213-28。https://doi.org/10.1046/j.1469-8137.2003.00674.x.
- 21.
Kumar R,Bishop E,Bridges Wc,Tharayil N,Sekhon Rs。糖分配和源水槽相互作用是玉米叶片衰老的关键决定因素。植物细胞环境。2019; 42(9):2597-611。https://doi.org/10.1111/pce.13599.
- 22.
陈志强,王志强,王志强,等。甘蔗源库干扰对叶片光合速率和基因表达的影响。安Bot-London。2008, 101(1): 89 - 102。https://doi.org/10.1093/aob/mcm258.
- 23.
Garibaldi A, Bertetti D, Gullino ML.番茄灰霉病在长春花上的首次报道(Catharanthus roseus也叫在意大利)。工厂说。2009;93(5):554。https://doi.org/10.1094/pdis-93-5-0554B..
- 24.
Fraser Vn,Philmus B,Megraw M.代谢组科分析显示植物品种和激素治疗的选择调节vinca生物碱生产Catharanthus roseus也叫.工厂直接。2020;4 (9):e00267。https://doi.org/10.1002/pld3.267.
- 25.
Schluttenhofer C,Pattanaik S,Patra B,Yuan L.分析Catharanthus roseus也叫和拟南芥WRKY转录因子参与茉莉酸信号转导。BMC基因组学,2014;15(1):502。https://doi.org/10.1186/1471-2164-15-502.
- 26.
陈强,吕旭,郭旭,郭强,李东。夹竹桃科植物的代谢组学研究。Catharanthus roseus也叫和小长春花,采用GC-MS和LC-MS相结合的方法。分子。2017;22(6):997。https://doi.org/10.3390/molecules22060997.
- 27.
3 .茉莉酸类化合物在植物胁迫反应中的作用及发育应用。Biotechnol放置2014;32(1):31-9。https://doi.org/10.1016/j.biotechade.2013.09.009.
- 28。
关键词:ORCA3和strictosidine葡萄糖苷酶,基因工程,过表达Catharanthus roseus也叫毛状根可增加生物碱产量。原生质。2016;253(5):1255 - 64。https://doi.org/10.1007/s00709-015-0881-7.
- 29。
fereres F, Figueiredo R, Bettencourt S, Carqueijeiro I, Oliveira J, gill - izquierdo A, et al.;药用植物分离液泡中酚类化合物的鉴定Catharanthus roseus也叫和它们与液泡III类过氧化物酶的相互作用:一个H2O2事件?acta photonica sinica . 2011;62(8): 2841-54。https://doi.org/10.1093/jxb/erq458.
- 30.
Vrancheva rz,Dincheva In,Aneva Iy,Pavlov Ai。通过GC-MS的代谢物分析结合了自然群体的主要成分分析Nectaroscordum siculum.SSP。bulgaricum(詹娜)斯特兰。Z NaturforSch C J Biosci。2020; 75(11-12):451-7。https://doi.org/10.1515/znc-2020-0058..
- 31.
Lavergne FD,Brockling CD,Cockrell DM,Haley SD,Peairs FB,Jahn Ce,等。GC-MS代谢组学评估植物切蜡的组成四个Triticum aestivum.品种。int j mol sci。2018; 19(2)。
- 32.
靶向和非靶向LC-MS多酚分析和化学计量学分析蜂胶来自克罗地亚不同地区J pharma Biomed Anal. 2019; 165:162-72。https://doi.org/10.1016/j.jpba.2018.11.061.
- 33.
Shimizu T,Watanabe M,Fernie Ar,Tohge T.植物次级代谢物的靶向LC-MS分析。方法Mol Biol。1778; 2018:171-81。
- 34.
PłonkaJ,GórnyA,Kokoszka K,Barchanska H.代谢曲线在什基酸途径的过程中萝卜var longipinnatus暴露于梅斯托利翁及其降解产物。光化层.2020; 245:125616。
- 35.
Maeda公顷。初级代谢的进化多样性及其对植物化学多样性的贡献。植物学报。2019;10:881。https://doi.org/10.3389/fpls.2019.00881.
- 36.
MA Y,Reddy VR,Devi MJ,Song L,Cao B. de Novo表征Goji Berry(枸杞L.)果转录组和糖果基因的候选基因在不同二氧化碳浓度下的分析。树生理。2019; 39(6):1032-45。https://doi.org/10.1093/treephys/tpz014.
- 37.
常伟,赵华,于胜,于军,蔡科,孙伟,等。比较转录组和代谢组学分析揭示了烟草叶片发育动态的复杂机制。基因组学。2020;112(6):4009 - 22所示。https://doi.org/10.1016/j.ygeno.2020.07.005.
- 38.
宋超,黄敏,白建军,张旭,王伟,萨普强,等。转基因MoS2和TiO2纳米颗粒对黄瓜叶片代谢及生理响应的影响NanoImpact。2020; 20:100271。https://doi.org/10.1016/j.impact.2020100271.
- 39.
Rehman F,Khan F,Badruddin S.酚类在植物防御对昆虫草食的作用。在:植物势化学:健康、能源和环境的观点:施普林格;2012.309 - 13页。
- 40。
王志强,王志强,王志强,等。植物营养在害虫防治中的应用研究进展。acta botanica yunnanica(云南植物研究). 2018;7(4):2737-42。
- 41。
Akula R, Ravishankar GA。非生物胁迫信号对植物次生代谢产物的影响。植物学报。2011;6(11):1720-31。https://doi.org/10.4161/psb.6.11.17613.
- 42。
Shanmugam V, Ronen M, Shalaby S, Larkov O, Rachamim Y, Hadar R, et al.;真菌病原体异strophus Cochliobolus对玉米酚类物质的响应:植物-真菌相互作用中的新小分子信号。细胞Microbiol。2010;12(10):1421 - 34。https://doi.org/10.1111/j.1462-5822.2010.01479.x.
- 43.
Hussein RA, El-Anssary AA。植物次生代谢产物:药用植物药理作用的关键驱动因素。J Herb Med. 2019;1:13。
- 44.
Mejanelle P,Bleton J,Goursaud S,Tchapla A.鉴定埃及木乃伊的平稳和组织中的酚醛酸和肌醇。J ChromatogR A. 1997; 767(1-2):177-86。https://doi.org/10.1016/s0021 - 9673 (96) 01067 - 9.
- 45.
Özbilgin S, Acıkara ÖB, Akkol EK, Süntar I, Keleş H, İşcan GS。大戟亚种的体内创面愈合活性。乌菲尼:槲皮素苷类生物活性化合物的分离与定量。J Ethnopharmacol。2018;224:400-8。https://doi.org/10.1016/j.jep.2018.06.015.
- 46.
Kumar S,Abedin MM,Singh Ak,Das S.酚类化合物在植物防御机制中的作用。在:可持续农业中的植物酚类物质:施普林格;2020.517 - 32页。
- 47.
杜布罗维纳市基谢列夫KV。二苯乙烯合酶基因的过度表达以调节植物和植物细胞培养的特性。生物技术应用。2020。
- 48.
Verma P,Mathur Ak,Masood N,Luqman S,Shanker K.色氨酸过度产生的Catharanthus Roseus(L)G. Don及其在搅拌釜生物反应器中的上缩放:检测具有抗氧化潜力的酚类化合物。原生质。2013; 250(1):371-80。https://doi.org/10.1007/S00709-012-0423-5..
- 49.
Rodrigues AS, Pérez-Gregorio MR, García-Falcón MS, Simal-Gándara J, Almeida DP。采后措施对红、白洋葱品种类黄酮含量的影响。食品控制。2010;21(6):878 - 84。https://doi.org/10.1016/j.foodcont.2009.12.003.
- 50。
Mirajkar SJ, Suprasanna P, Vaidya ER。辐射诱导甘蔗突变体中蔗糖代谢酶的空间分布及动态。植物生理学报。2016;100:85-93。https://doi.org/10.1016/j.plaphy.2015.12.018.
- 51。
干旱对干旱胁迫的生理响应玉米关于氮气和源水槽关系。在:非生物应激植物。IntechOpen;2020.
- 52。
Walters D,Heil M.成本和权衡与诱导抗性相关。Physiolmol植物P. 2007; 71(1-3):3-17。https://doi.org/10.1016/j.pmpp.2007.09.008.
- 53。
Fernie AR,Bachem CW,Helariutta Y,Neuhaus He,Prat S,Ruan Y-L等。源水槽相互作用的发育,分子和代谢方面的同步。Nat植物。2020; 6(2):55-66。https://doi.org/10.1038/s41477-020-0590-x.
- 54。
Naikoo Mi,Dar Mi,Raghib F,Jaleel H,Ahmad B,Raina A等人。植物酚醛植物中非生物胁迫耐受性的作用和调节:概述。植物标志分子。2019:157-68。https://doi.org/10.1016/B978-0-12-816451-8.00009-5..
- 55.
Tolosa Ln,张Z。在不同压力条件下索甘菊粮作物中的主要转录因子的作用:当前和未来的观点。植物。2020; 9(1):56。https://doi.org/10.3390/plants9010056.
- 56.
陈Q,吴k,唐z,guo q,guo x,王h.外源乙烯增强了镉的抵抗力,改变了生物碱生物合成Catharanthus roseus也叫幼苗。植物学报,2017;39(12):267。https://doi.org/10.1007/s11738-017-2567-6.
- 57.
刘军,刘勇,王勇,张志辉,祖永刚,Efferth T,等。代谢组学分析揭示了乙烯和MeJA联合作用对Catharanthus roseus中酚类化合物代谢谱的影响。杂志。2016;7:217。
- 58.
魏淑芳。茉莉酸诱导的萜类吲哚生物碱途径基因的表达模式Catharanthus roseus也叫幼苗。植物生长规律。2010;61(3):243-51。https://doi.org/10.1007/s10725-010-9468-7.
- 59.
李Z,姜米在哺乳期牦牛乳腺组织中的代谢物谱。Plos一个。2019; 14(7):E0219220。https://doi.org/10.1371/journal.pone.0219220.
- 60.
Chu C,Murdock Mh,Jing D,赢了,涌,克雷克尔am等。微生物群调节神经元功能,恐惧灭绝学习。自然。2019; 574(7779):543-8。https://doi.org/10.1038/s41586-019-1644-y.
致谢
不适用。
资金
国家自然科学基金项目(No. 31400337);南通市科技基金项目(No. JC2018159);黑龙江省博士后科学基金项目(No. lbj - z20091);黑龙江省中医药研究基金重点项目(zy -18-009)。资助人没有参与实验设计、数据收集和分析、手稿准备或决定发表。
作者信息
从属关系
贡献
QC和Myx进行了实验,分析和解释了数据,准备的数字,并写了稿件。XYL表现了部分实验和数据分析。XRG和Zht批判性地修改了这篇文章。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者宣布没有竞争金融利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
的模式图Catharanthus roseus也叫。图S2。不同处理时间对初级代谢产物的影响:处理时间:0 h、0.5 h、1 h、3 h、5 h;Q值与CK、WUL、WLL处理组相结合。图S3。初级代谢网络的变化。网格从左到右分别为CK组、WUL组和WLL组;初级代谢物含量由低到高,分别表现为绿色到红色;CK:对照组,WUL:上部叶片受损组,WLL:下部叶片受损组。表S1.治疗组间差异代谢物(GC-MS)。表S2。不同处理组的代谢物(糖和脂肪酸)差异(GC-MS)。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
陈强,卢旭东,郭旭东。et al。来源-库模型解释了在机械损伤的代谢机制的差异,年轻和衰老的叶片Catharanthus roseus也叫.BMC植物BIOL.21,154(2021)。https://doi.org/10.1186/s12870-021-02934-6
收到了:
公认:
发表:
关键字
- 机械损伤
- 代谢组学
- Catharanthus roseus也叫
- 源库模型
- 资源平衡