- 研究
- 开放访问
- 发布:
小RNA测序提供候选miRNA-target对,用于揭示Apomixis的机制Zanthoxylum Bungeanum.
BMC植物生物学体积21., 文章编号:178(2021.)
抽象的
背景
apomixis是一种具有性繁殖形式的形式,可以产生后代而无需组合雄性和女性配子,并且后代具有与母亲相同的遗传构成。因此,Apomixis技术在植物育种中具有很大的应用潜力。识别Apomixis类型和关键时期,不同花卉发展阶段的胚胎发育Zanthoxylum Bungeanum.通过细胞学观察。
结果
结果表明,S3阶段是Apomixis的关键时期,在此期间,Nucellar细胞发展成无偶像原始胚胎。细胞学观察结果表明apomixis的类型z水保是孢子性的apomixis。此外,使用miRNA测序,miRNA-靶基因相互作用,双荧光素酶报告结果和RT-QPCR验证来揭示miRNA-target对的动态调节z水保apomixis。miRNA测序鉴定了96个成熟的miRNA,其中40名已知,56个是新的。另外,根据不同发育阶段的MiRNA表达水平筛选29个差异表达的miRNA。基因和基因组(Kegg)和基因本体论(GO)富集分析的京都百科全书表明,差异表达的miRNA的靶基因主要富集植物激素信号转导,RNA生物合成过程和对激素途径的反应。
结论
在审计胚胎发育的关键时期,MIR172C显着降低了表达水平托伊3.和Apetala 2(AP2.)基因,从而上调表达钦am基因。基于它们的相互作用和表达模式构建MiRNA-靶对的分子调节模型,以进一步了解MiRNA-靶对在Apomixis中的作用。我们的数据表明MIR172C可以调节钦am表达通过抑制托伊3.在Abomixis的临界时期。
背景
开花植物中最常见的繁殖形式是双重施肥。在这里,雄性和雌性杂草形状组合形成新工厂[1]。然而,另一种植物繁殖模式可以在没有性繁殖的情况下产生后代,被称为apomixis。这是一种直接产生后代的生殖模式,而无需组合雄性和女性配子。APOMictic物种中后代的遗传构成与女性父母的遗传学完全一致,因此保留了女性父母可能拥有的任何优越的特征。因此,Apomixis在作物遗传育种中具有相当大的应用潜力。
有三种类型的apomixis,具体取决于胚胎的来源:证明,血管素和孢子体apomixis。Diploshory是未收款的二倍体胚囊中的蛋细胞发展成胚胎[2]。这种类型可以在诸如Fleabanes之类的植物中找到[3.]。Aposhory是核心细胞通过有丝分裂形成未更好的胚囊囊的生殖过程,并且初始细胞发展到胚胎中。这种类型发生在植物中,例如BahiaGrass [4.]。这两种形式的繁殖都属于配子糖型apomixis。孢子体Apomixis是一种过程,其中核酸细胞的有丝分裂分裂形成了不定的聚氧化物。这种类型可以在植物中找到Cyrtogonellum caducum.[5.那6.那7.]。在这种情况下,在apomixis过程中,胚乳可能无法通过受精自主形式,并且可能需要通过伪敏感形成三倍体胚乳[8.那9.]。
近年来对无融合生殖机制的研究取得了前所未有的进展,各种调控因子参与了无融合生殖的过程。嗜酸甘油蛋白不敏感的矮种蛋白质1(BbGID1)特异性在核心中表达Brachiaria brizantha..过度表达AtGID1导致差异化拟南芥蒂利亚纳大孢子母细胞样细胞[10.]。宝宝繁荣1(BBM1.)是在水稻精子细胞中表达的AP2的转录因子系列的成员。蛋细胞中的异位表达可导致米持续繁殖,没有受精[11.]。此外,长链非编码RNA (lncRNA) PN_LNC_N13在有性繁殖和无融合生殖中表达差异较大柑橘植物Notatum.,提示lncrna可能参与无融合生殖调节[12.]。此外,小RNA(SRNA)是Apomixis中不可缺少的调节剂。Argonaute 9依赖的SRNA沉默在发展中起着关键作用拟南芥伴随细胞的表观遗传重编程需要卵巢,以及植物配子的SRNA依赖性沉默[13.]。在Apomicic柑橘的胚珠中,据报道,单次杂交品种中miRN23-5p的表达水平明显高于聚氧化铝品种,其表达与其调节靶基因的表达呈负相关[14.]。在伊格拉蒂斯曲面,miRNA-mRNA相互作用分析表明,miRNA可以通过调节疯箱转录因子基因和转座子来参与apomixis [15.]。因此,miRNA-靶基因的表达分析可能是阐明审计监管网络的有价值的工具。虽然在Abomixis的研究中取得了一些进展,但其完整的监管网络仍然模糊不清。
Zanthoxylum Bungeanum.(Zb)是属的物种Zanthoxylum.,广泛分布于陕西,甘肃,四川,山东和河北省,以及中国周围的许多其他地方[16.]。ZB水果的皮肤是着名的中国传统调味术草本。由于其独特的麻木特性,它广泛用于烹饪。它还用于中药治疗各种疾病[17.]。ZB具有APOMictic特性,因此它是一种学习apomixis的合适模型。在该研究中,使用细胞学观察,转录组,双荧光素酶报告,RT-QPCR和miRNA-靶基因相互作用验证研究ZB Apomixis的分子机制。我们的结果提供了对Apomixis发育过程和机制研究的参考。
结果
鉴定ApomixisZanthoxylum Bungeanum.
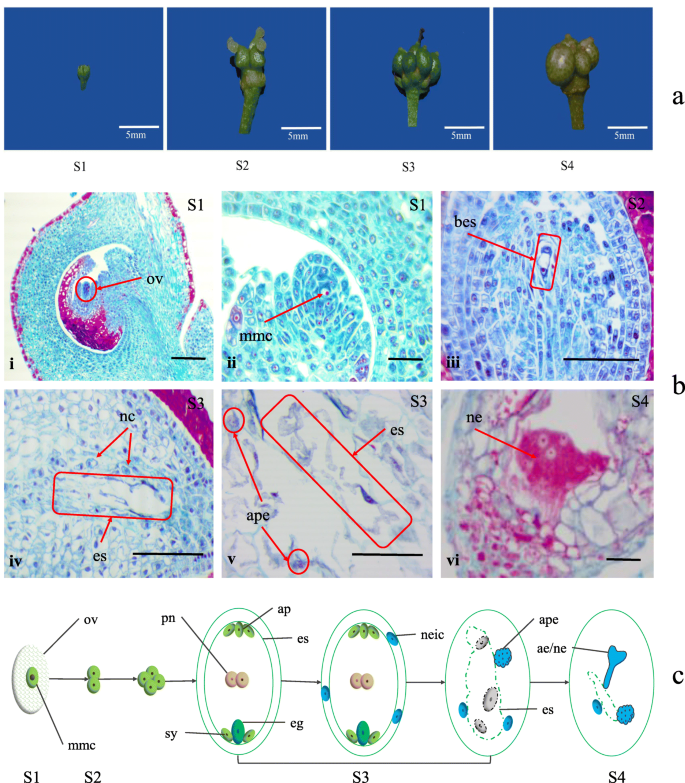
在研究Abomixis机制时,需要识别apomixis胚胎发育的关键时期。为此,我们对不同发育阶段的收集的花进行了细胞学观察(图。1a).结果表明,胚珠在开花(S1)前出现,并含有大孢子母细胞(fig .;1b i和ii)。在S2中,胚芽孔母细胞在胚珠中分开以形成嗜核胚囊(图。1B III)。在S3中,双核胚囊囊在成熟的胚囊中发育,但胚囊囊分解并不能正常工作(图。1b iv)。在胚囊附近,Nucellus细胞继续分化以形成偶然原始胚胎(图。1B v)。最后,偶然原始胚胎在S4中发育成核心胚胎(图。1B VI)。建立了不定胚发生模型图,以显示ZB中的Apomixis。基于该图,发现ZB具有孢子素嗜孢子的特征。Nucellar细胞在S3阶段的不偶诱导原始胚胎中的分化是Apomixis最关键的时期。
赤膜的细胞学观察Zanthoxylum bungeanum。一种不同的发展阶段Zanthoxylum Bungeanum.水果。B.赤霉素的细胞学观察Zanthoxylum Bungeanum..(I-II)在S1中形成Megaspore母细胞。(iii)在S2中形成了双核胚囊。(IV-V)胚胎囊分解,Nucellus细胞在S3中产生偶然原始胚胎。(vi)无偶原子化胚胎在S4中发育成核心胚胎。秤条=20μm。C不定胚胎发生模型图Zanthoxylum bungeanum。AE:Adfisting Embryo,AP:Antipodals,APE:无偶原始胚胎,BES:Binuclear Embryo Sac,例如:蛋,ES:胚胎SAC:MMC:NC:Nucellar Cell,NeiC:Nucellus Embryo,Neic:Nucellar胚胎初始细胞,OV:Ovule,Pn:极性核,SY:Synergids
小RNA测序剖面
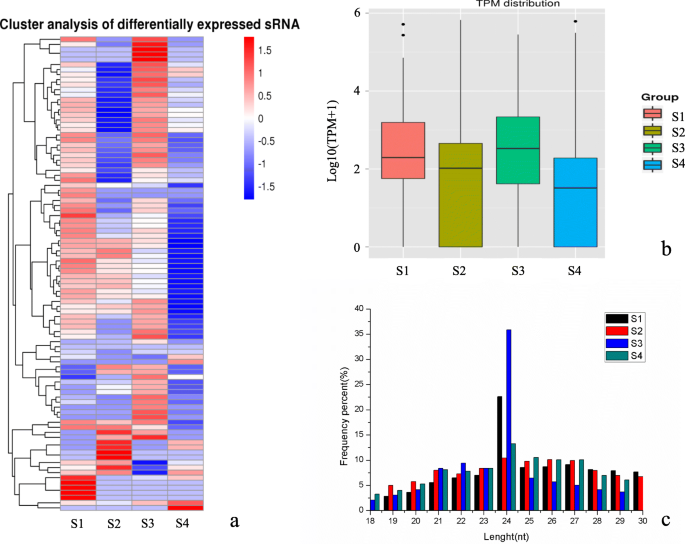
在四个Apomixis发育阶段的12个ZB样品上,Illumina Hiseq 2500测序平台(Illumina,San Diego,CA,USA)进行小RNA测序。测序获得62,810,130读数和60,347,610清洁读数,其中高质量读数占99.95%(表1).Bowtie软件用于分析参考序列上miRNA的位置和分布。分析结果表明,超过62%的小RNA可以位于参考序列(Zanthoxylum Bungeanum.非参考基因组转录组剪接转录物作为参考序列)。在参考序列中映射到相同链的读数的数量超过50%,而映射到参考序列的相对股线的读数的数量小于10%。
鉴定了总共96种成熟的miRNA,其中40名已知,56个是新的。还鉴定了总共106个miRNA发夹,49名已知和57个新颖(表S1).每百万读数(TPM)的成绩单可以代表miRNA表达水平。根据miRNA的log10(TPM + 1)值,聚类不同组中的差异表达的miRNA以确定其在四个ZB果发育阶段的表达模式(图。2一种)。miRNA表达式模式与其功能直接相关。我们主要在关键的Apomicic胚胎发生期间分析差异表达的miRNA(S3)以研究MiRNA和Apomixis之间的关系。另外,在四个ZB果发育阶段之间注意到MIRNA的TPM分布的大差异(图。2b)。动物SRNA的长度范围为18-35NT,而植物SRNA的长度范围为18〜30nt。长度分布峰可以确定SRNA的类型。例如,miRNA的长度浓缩在21-22nt范围内,同时siRNA长度大部分为24 nT。四个ZB果实发育阶段的miRNA为18-30 nt,MiRNA为24 nT的所有阶段最丰富(图。2C)。ZB miRNA的长度分布的差异提供了间接证据,即不同的apomixis阶段存在不同的监管机制。
Apomixis的差异表达miRNA分析
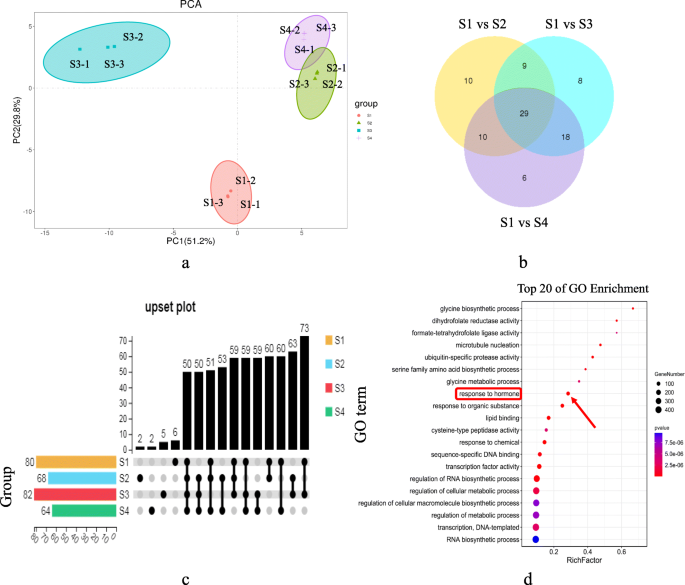
根据MiRNA表达水平或TPM,在来自四种果实发育阶段的12个ZB样品上进行主成分分析(PCA)。结果表明,PC1和PC2一起解释了81.0%的样本差异,并将样本聚类分为组,显示它们具有良好的重复性并达到数据分析要求(图。3.一种)。实验组中差异表达的miRNA的分析可以筛选在该过程中发挥关键作用的miRNA。因此,我们使用DESEQ软件来筛选并分析了四个ZB Apomixis阶段的miRNA。我们发现29个差异表达的miRNA(图。3.b)。其中,15名已知miRNA,14个是新的。根据不同发育阶段的96种成熟miRNA的数量分布来绘制镦粗图(图。3.C)。结果表明,S3中检测到的成熟miRNA的数量是最大的(82),而S4中最小(64)。此外,发育阶段S1,S2,S3和S4独特的MIRNA的数量分别为6,2,5和2。四个发展阶段共享的miRNA数量为50。
miRNA通过调节靶基因的表达或抑制它们的翻译来参与各种生命过程。因此,必须通过与靶基因的相互作用和表达水平来确定miRNA功能。我们使用基因和基因组(Kegg)的京都百科全书来分析Zb中apomixis期间差异表达基因的富集途径。结果表明,许多差异表达基因与RNA转运,植物激素信号转导(KO04075),RNA转运(KO03013)和类固醇生物合成(KO00100;图S1).还合成了许多物质,包括脂肪酸,淀粉,蔗糖和叶酸。此外,对差异表达miRNA的靶基因进行基因本体学(GO)富集分析(图。3.d)。结果表明,许多差异表达基因在几种途径中富集,包括RNA生物合成过程(GO:0032774),转录因子活动(GO:0003700),对激素的反应(GO:0009725),更重要。其中,457,167和81个差异表达基因分别在RNA生物合成过程中富集,转录因子活性和对激素途径的反应,表明合成了RNA和转录因子的分数,在ZB期间激活激素应答途径apomixis。差异表达的miRNA靶基因的Kegg和GO富集分析表明,许多基因富集在与激素合成和调节相关的途径中,表明可能参与ZB Apomixis调节的激素。
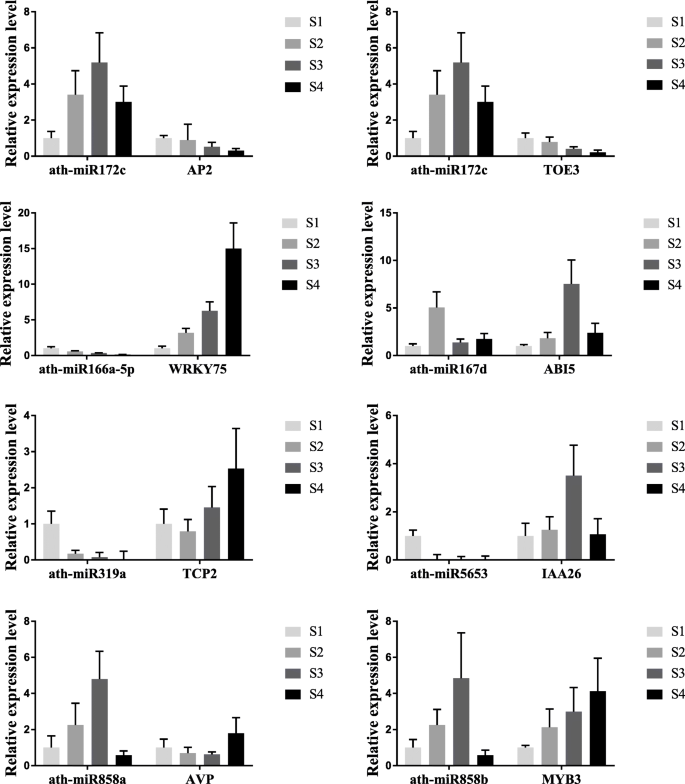
miRNA及其靶基因的相互作用分析
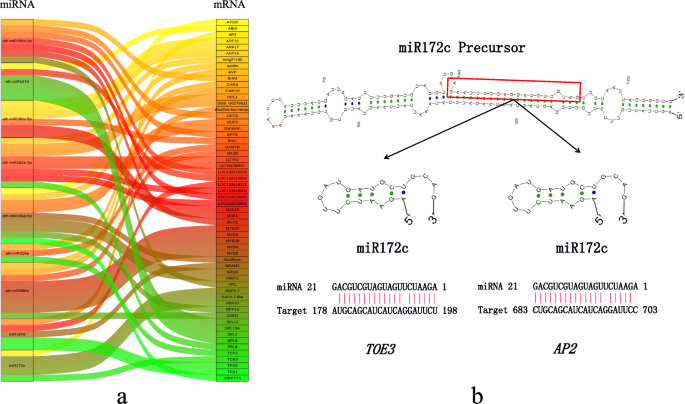
对miRNA和mRNA表达型谱的综合分析有助于鉴定缺点过程中涉及的功能性miRNA-mRNA相互作用对(图。4.和表2).8个mirna在四个发育阶段均有显著差异表达。通过定量反转录PCR (RT-qPCR)检测,验证测序结果的有效性(图2)。5.).结果表明,MiRNA测序和RT-QPCR结果基本一致,确认其可靠性。另外,我们预测了差异表达miRNA的靶基因,结果表明它们参与了多种生命过程的基因和调节因素,包括与激素有关的Abi5.那IAA26, 和托伊3.,以及几种转录因素,如WRKY75那myb3,和TCP2..其中,miR172c有两个靶基因,脚趾3和AP2..成熟的miR172c可以与两个靶基因形成互补对(图。4.b)。它在键ZB apomixis阶段中具有高表达水平(S3),暗示它及其靶基因在Apomixis中发挥着重要作用。
通过RT-QPCR分析miRNA和它们的靶基因的相对表达水平,以进一步确定它们之间的相互作用(图。5.).结果表明,在ZB果实发育过程中,八个差异表达的miRNA的表达水平和其靶基因的表达水平负相关,预先验证它们之间的相互作用模式。
验证miRNA与其靶基因之间的相互作用
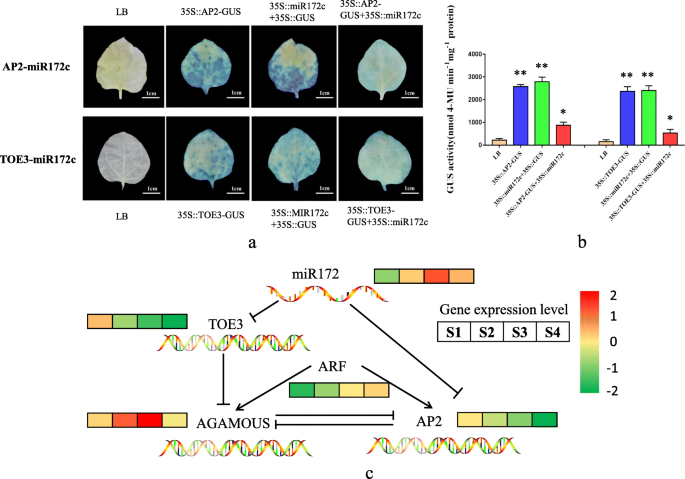
我们分别在PCA1301和PBI121载体上构建了miRNA和靶基因序列,以证明它们之间的相互作用。将它们转移到烟草叶中,评价GUS蛋白的表达以确定miRNA与其靶基因之间是否存在相互作用[18.]。35 s::AP2.-Gus,35s ::托伊3.--Gus和35s :: mir172c-gus注射到烟草叶后产生大量的GUS蛋白,而35秒::AP2.--gus + 35s :: mir172c-gus和35s ::托伊3.-GUS + 35S::miR172c-GUS显著降低了GUS蛋白活性(图)。6.A和B)。这些结果表明mir172c可以切割托伊3.和Apetala 2(AP2.)基因并因此阻断了GUS蛋白的合成,证实了这一点托伊3.和AP2.是它的目标基因。
基于MiR172C构建的分子调节模型AP2.和mir172c-脚趾3相互作用以了解Zb apomixis中的分子过程(图。6.C)。钦am属于疯狂箱转录因子类C基因,以及AP2.属于疯狂箱转录因子类别的基因。A类和C基因彼此对抗拮抗作用。钦am可以控制雄蕊和心皮的发展,并规范花卉公司的活动,在Apomixis中发挥着重要作用[19.那20.]。AGAMOU在果实发育过程中,表达水平逐渐增加,尤其是在ZB审查胚胎发生的临界期间(S3)。表达水平AP2.另一方面,在开发期间逐渐减少。miRNA-target基因相互作用实验表明miR172c可以切割脚趾3,Toe3可以抑制钦am表达(图。6.c).因此,miR172c会增加钦am通过抑制表达丰富托伊3.ZB apomixis期间的转录水平。此外,在果实开发期间,营养响应因子的表达水平(ARF.)逐渐增加,表明激素可能在Apomixis中发挥重要作用。
讨论
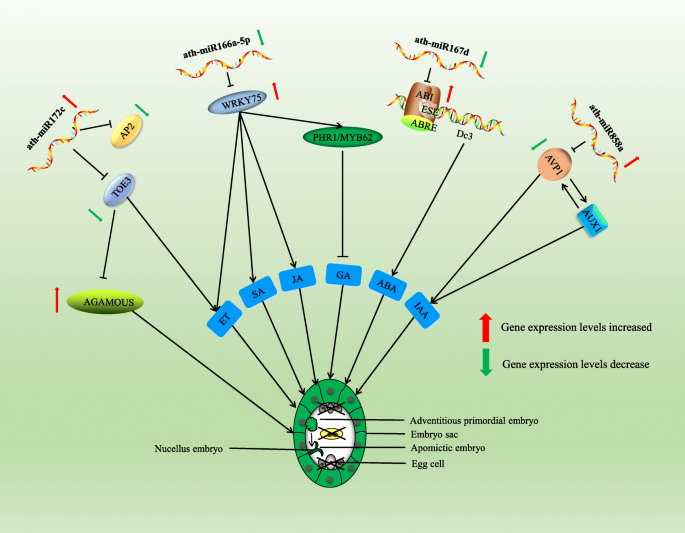
apomixis导致继承继承女性父母的完整基因型的后代,从而具有广泛的农业杂种优势固定的应用潜力。然而,apomixis的机制仍然不清楚。阐明Apomixis胚胎发生过程是研究其机制的先决条件。我们通过细胞学观察分析了Zb中的Apomixis胚胎发生过程,结论是Zb是孢子性Apomixis类型,S3是Apomixis的关键时期。在该研究中,使用miRNA测序,miRNA-靶基因相互作用,双荧光素酶报告结果和RT-QPCR验证来揭示ZB Apomixis中miRNA-靶对的动态调节。miRNA参与各种生物过程,是调节生物的最重要因素群中[21.那22.那23.]。在ZB Apomixis中检测到许多差异表达的miRNA,表明它们可能在过程中发挥重要作用。在Apomixis期间与靶基因的相互作用可以识别候选基因和新思想,以帮助阐明Apomixis机制。使用miRNA测序,miRNA-靶基因相互作用实验和RT-QPCR验证,我们表明MIR172抑制了活动托伊3.和AP2.在S3期间,从而增加表达水平钦am.因此,MiR172可能是apomixis的关键调节器(图。7.).此外,MIR172在服从中被纳入了缓解,并且广泛参与了植物花器官发展。它通过调节多个疯箱转录因子来控制花动器官的开花时间[24.那25.]。
差异表达miRNA的功能分析及其在Apomixis中的靶基因显示出许多靶基因在激素合成和调节中发挥着积极作用。为了进一步了解miRNA在apomixis中的可能作用,基于分析结果和先前的研究,建立了miRNA相互作用调节模型。此外,许多研究表明,激素可以诱导植物体细胞形成胚胎和活化植物细胞包层直通[26.那27.]。研究还检测到种子胚胎发育过程中的许多激素变化[28.那29.]。在芸苔栗鸟,茉莉酸是一种组织特异性激素,参与胚胎发育过程中的基因和蛋白质表达。已显示脱落酸(ABA)在体细胞胚胎发生期间诱导细胞分化Cunninghamia lanceolate.,从而促进胚胎质量的生长[30.]。促进响应基因,ABA相关基因和胃肠杆菌蛋白相关基因全部由MiR393调节。该miRNA在大麦激素合成和胚胎发育中发挥着重要作用[31.]。基于我们的分析,推断MiRNA通过与其靶基因相互作用来调节激素合成,从而激活参与阿帕莫西的植物细胞的全能性。
WRKY75是Ath-miR166a-5p的靶基因,其结合并降解其以阻止其转录并抑制其功能。RT-QPCR表明WRKY75ZB Apomixis期间的Ath-MiR166A-5P表达趋势是负相关的,而且WRKY75相对表达水平显着增加。WRKY75是一种与许多激素相互作用的转录因子[32.]。AtWRKY75可以激活茉莉酸和乙烯的途径[33.],促进合成Phr1.和myb62,Myb转录因子家庭的成员。它们抑制嗜酸甘油蛋白合成及其信号通路[34.那35.]。ABA不敏感的5蛋白(ABI5)与胚胎规格元素(ESE)结合DC3.基因启动子和ABA响应元素(ABRE)。通过控制种子发育过程中ABA调节基因的表达,它直接影响ABA合成[36.]。而且,ERF7.能直接抑制ABA的合成吗SNL1.(SIN3-LIFE1)和SNL2.在乙烯存在下[37.那38.]。通过分析mRNA和miRNA之间的相互作用,我们发现Ath-MiR167D与ABI结合并抑制其合成。然而,我们的相对表达水平分析证明了Apomixis期间Ath-MiR167D表达水平低,因此在此阶段无法限制ABA合成。此外,MiRNA在养肝调节途径中发挥作用。AVP1.编码质子泵,该泵调节植物液泡中的pH值。AVP1.和AUX1/IAA.参与生长素的梯度调控和转运[39.那40]。表达AVP1.受ATH-MiR858a的限制,并且两者的相对表达水平是负相关的,如RT-QPCR分析所示。ZB apomixis过程中Ath-MiR858a表达水平的增加抑制了函数AVP1..综上所述,我们认为miRNA及其靶基因通过调节激素合成参与无融合生殖。
结论
我们通过细胞学观察证明了ZB使用孢子体Apomixis类型,并且S3阶段是该过程中的关键时期。我们进行了miRNA测序和RT-QPCR,以筛选涉及apomixis的候选MiRNA。我们的研究结果表明,在Apomixis S3期间miR172具有更高的表达水平。此外,双荧光素酶报告结果验证了miR172调节托伊3.和AP2.表达水平。这些互动钦am规范Abomixis过程。本研究显示了ZB中Apomixis过程的证据,并为其机制提供了见解。有必要澄清监管因素在多个层面的角色,并通过多种方式更清楚地了解Apomixis机制,最终描述其监管互动网络。
方法
植物材料
从ZB实验站,西北农业和林业大学,中国陕西奉贤,植物材料收集。健康,五岁的ZB(Zanthoxylum Bungeanum.简历。汉腾达洪普均选中均匀生长的灌木。ZB是一个脱衣厂。未开封的ZB女性花卉袋装并在开发的四个阶段收集:S1,预开花,鲜花不打开;S2,中开着,开花开始后7天;S3,年轻水果,开花开始后15天;S4,水果膨胀,开花后30天开始。在每个阶段的三棵ZB树上收集六百个鲜花。样品立即储存在液氮中以进行遗传分析。在每个发育阶段收集三个生物学重复(三ZB树)。 The flowers or fruits used for cytological observations were stored in formalin-acetic acid-alcohol (FAA) fixative.
mirna文库构建与测序
植物样品被送到北京诺二烯基因组学研究所MiRNAS测序。Hiseq和MiSeq技术用于miRNAS测序。使用小型RNA样品制备试剂盒(Illumina,San Diego,CA,USA)来构建测序文库。在四种果实开发阶段中的每一个,建立了12个miRNA库包括三个生物学重复。直接添加SRNA末端,配合适配器并反转转录以合成cDNA。PAGE凝胶电泳用于在PCR扩增后分离靶DNA片段。通过切割凝胶并回收DNA来获得cDNA文库。从原始读取中删除适配器和低质量读取以获得清洁读取。保持长度为18-30个核苷酸的清洁读数被用于下游分析。将清洁读数与miRBase中的序列进行比较,并且获得了已知的miRNA,miRNA序列,长度,丰度和其他信息的二次结构。 miREvo [41.]和mirdeep2 [42.用来预测和分析新的miRNA。然后,我们预测了差异表达的miRNA的靶基因并进行了对这些靶基因进行的GO和Kegg浓缩分析。
差异表达miRNA分析
每百万读数的成绩单[TPM =(读数* 1,000,000)/映射读数计数]表示miRNA的表达式级别。DESEQ软件用于分析发展阶段之间的差异表达的miRNA。使用的筛选标准是假发现率(FDR)≤0.05和│Log2FC1≥1,其中Fc是折叠的变化。
总RNA提取和cDNA合成
Takara小纤维植物RNA提取套件(Takara,Takara,北京,中国)用于在不同发育阶段从花或水果中提取总RNA。根据制造商的说明,使用MiR-X miRNA第一链合成试剂盒(Takara)进行MiRNA的第一链cDNA合成。这些被用作RT-QPCR反应的模板。
定量实时PCR(RT-QPCR)
采用CFX96 Real-Time PCR检测系统(Bio-Rad, Hercules, CA, USA)验证无融合生殖过程中miRNAs的相对表达。反应体系为10 μL,其中2× SYBR Premix Ex Taq II (TaKaRa) 5 μL, cDNA 1 μL,正反引物各1 μL, ddH 2 μL2O.U6.作为内参基因。同样,RT-qPCR检测目的基因的相对表达量,为ZBUBQ.和ZBTIF.作为参考基因[43.]。使用Primer Premier 5.0(PROMIER,PALO ALTO,CA)设计了底漆。引物序列如表所示S3.RT-QPCR反应方案为:95℃,30s,30℃,54℃的40℃,54℃,30℃,72℃为45秒。为每个样品进行三种技术复制。
MiRNA靶基因的预测
psrnatarget在线工具(http://plantgrn.noble.org/psrnatarget/)使用全长转录组作为靶模板以预测已知和新的miRNA的靶基因。具体参数设定如下:预期:5,G:U配对的罚款:0.5,其他不匹配的罚款:1,种子区域额外重量:1.5,种子区域:2-13个核苷酸,种子区不匹配:2,HSP尺寸:19,开放间隙的罚款:2,延伸间隙的罚款:0.5,和翻译抑制范围:10-11核苷酸。
双荧光素酶报告系统
采用双荧光素酶报告基因检测系统验证miRNA与其靶基因之间的相互作用。miRNA前体及其靶基因分别构建在pCA1301和pBI121载体上。在pBI121载体下游插入GUS (β-葡萄糖醛酸酶)报告基因。如果miRNA切割mRNA,则下游GUS基因无法表达,从而无法检测到GUS蛋白。因此可以通过检测GUS蛋白表达来验证miRNAs与靶基因之间的相互作用[18.]。
GUS染色实验是在四周大的烟草植物叶子上进行(尼古利亚娜·宾夕法尼亚州).我们在注入LB,35S ::的叶子中检测到GUS活动AP2.--gus,35s :: mir172c + 35s :: gus,35s ::AP2.--gus + 35s :: mir172c,35s ::托伊3.- 和35s ::托伊3.-Gus + 35s :: mir172c。我们彻底接地0.5g液氮冷冻烟叶,其用作实验材料。然后我们使用了追随制造商的指示,从而使用了GUS组织化学染色工具包(茅波,上海,中国),以检测它们中的GUS蛋白表达。
可用性数据和材料
复制这些发现所需的所有数据和材料都可以通过联系相应的作者,Anzhi Wei教授共享(weianzhi@126.com).
缩写
- 阿巴:
-
脱盐酸
- Abi5.:
-
ABA-Insensitive 5蛋白
- ABRE:
-
ABA响应元素
- AP2.:
-
Apetala.2
- ARF:
-
助线响应因子
- Bbgid.1:
-
嗜酸甘油蛋白不敏感的矮种蛋白质1
- BBM1.:
-
宝宝繁荣1
- ESE:
-
胚胎规格元素
- 去:
-
基因本体论
- Kegg:
-
Kyoto基因和基因组的百科全书
- lncrana:
-
长期非编码RNA
- PCA:
-
主要成分分析
- SRNA:
-
小RNA
- TPM:
-
每百万次读取的转录本
- ZB:
-
Zanthoxylum Bungeanum.
- GUS:
-
β-葡萄糖醛酸酶
- SNL1:
-
sin3-like1.
参考
- 1。
Raghavan V.对双重施肥的一些思考,从它对现在的发现。新植物。2003; 159(3):565-83。https://doi.org/10.1046/j.1469-8137.2003.00846.x..
- 2。
Hojsgaard D. Apomixis技术:将小麦与谷壳分开。基因。2020; 11(4):411。https://doi.org/10.3390/genes11040411.
- 3.
noyes rd。Pleabanes(Erigeron,Asteraceae)中藿香(博物馆)的遗产。遗传。2005; 94(2):193-8。https://doi.org/10.1038/sj.hdy.6800597.
- 4.
Martínezej,urbani mh,Quarin Cl,Ortiz JPA。阿皮亚草,万普拉姆草原的遗产。秘密人。2010; 135(1):19-25。
- 5.
koltunow am。Apomixis:胚囊和胚胎没有减少的胚珠或胚珠。植物细胞。1993年; 5(10):1425-37。https://doi.org/10.2307/3869793.
- 6.
无融合生殖与多胚现象的研究。安植物学。1996;78(1):67 - 72。https://do.org/10.1006/anbo.1996.0097.
- 7.
刘·赫姆,戴尔·雷,郭泽,珍米,李杰,哈拉德S.蕨类植物赤霉素的进化动态:聚斯蒂氏蕨类植物的案例研究。J Botany。2012; 2012:1-11(2012-11-5)。
- 8.
姚杰,胡ZCG。Apomixis在Eulaliopsis Binata:生殖模式的表征和胚乳开发。性植物团体。2007; 20(3):151-8。https://doi.org/10.1007/S00497-007-0051-Y..
- 9.
Ogawa D,Johnson SD,Henderson St,Koltunow Am。两种自主胚乳形成(AUTE)的遗传分离; HIERACIUM中Apomixis的其他组分。植物团体。2013; 26(2):113-23。https://doi.org/10.1007/S00497-013-0214-Y..
- 10。
Ferreira Lg,De Alencar Dusi Dm,Irsigler Ast,Gomes A,Mendes Ma,Colombo L等。GID1表达与性和空调植物的胚珠开发有关。植物细胞代表2018; 37(2):293-306。https://doi.org/10.1007/s00299-017-2230-0.
- 11.
陈志强,王志强,王志强,等。水稻种子无性繁殖的诱导机制研究进展。大自然。2019;565(7737):91 - 5。https://doi.org/10.1038/s41586-018-0785-8.
- 12.
等。PN_LNC_N13是一种长链非编码RNA,在无融合生殖和有性生殖中差异表达。acta botanica yunnanica(云南植物研究). 2018;37(1):1 - 4。https://doi.org/10.1007/S11103-017-0679-4.
- 13。
Vianey OM, Noé DF, Mario AV, Edgar DA, Daphné A, Daniel G. R Keith S, Martienssen RA, Jean-Philippe VC:在拟南芥中通过小RNA途径控制雌性配子的形成。大自然。2010;464(7288):628 - 32。
- 14。
Long J-M,Liu Z,Wu X-M,Fang Y-N,Jia H-H,Xie Z-Z等人。基因组测量mRNA和小RNA转录组含有柑橘apomixis的启动。J Exp Bot。2016; 67(19):5743-56。https://doi.org/10.1093/jxb/erw338.
- 15.
Garbus I,Selva JP,粘贴MC,Bellido Am,Carballo J,Albertini E等。埃格拉蒂斯曲面的APOMicic和性基因型miRNA和miRNA靶标的表征和发现。BMC基因组学。2019; 20(1):839。https://doi.org/10.1186/s12864-019-6169-0..
- 16.
李辰Y,荣L,Jin T,Zi-Tao J. Zanthoxylum Maxim叶片的多酚组成。在河北,中国种植及其激进清除活动。JAgric Food Chem。2013; 61(8):1772-8。
- 17.
He F,Li D,王D,Dencirlin,Hycerary,Rutin和Zhantoxylum Maxim叶片的提取和纯化使用两相系统。J Food Sci。2016; 81(7):C1593-602。https://doi.org/10.1111/1750-3841.13331.
- 18.
恒C,春夏y,剑兰,豪尔兰q,ling w,li-a a x等。miRNA-target对调节杨树中的不定根:mir167a的功能作用及其目标毒素响应因子8.树状物质。2019; 39(11):1922-36。
- 19.
刘德德,东QL,Sun C,Wang QL,你CX,Yao YX等。苹果Apomixis相关MHFIE基因在繁殖发育中的功能表征。植物SCI。2012年; 185-186(无):111。
- 20。
Uemura A,Yamaguchi N,Xu Y,Wy,Ichihashi Y,Suzuki T,等。通过拟南芥中静脉,超人和Clavata3的相互作用来调节花卉分娩活动。植物团体。2018; 31(1):89-105。https://doi.org/10.1007/S00497-017-0315-0..
- 21。
Lionel N,Patrice D,Florence J,Benedict A,Nihal D,Mark E等人。植物miRNA通过抑制养肝信号传导来促进抗菌性。科学。2006; 312(5772):436。
- 22。
赵胜,王旭,闫晓霞,郭磊,米旭,徐强,等。不同生长时间山茶萜类生物合成调控基因网络的MicroRNA揭示中国农业科学。2018;66(47):12604-16。https://doi.org/10.1021/acs.jafc.8b05345..
- 23。
张X,李克,邢河,刘某,陈X,阳h等。miRNA和mRNA表达概况揭示了对壳聚糖介导的植物生长调节的洞察力。JAgric Food Chem。2018; 66(15):3810-22。https://doi.org/10.1021/acs.jafc.7b06081.
- 24。
Huijser P,Schmid M.植物中发育期转型的控制。发展。2011; 138(19):4117-29。https://doi.org/10.1242/dev.063511.
- 25。
钱浩浩,朱,克里斯,一个。,Helliwell:MiR172的开花时间和花卉图案化。J Exp Bot 2010,62(2):487-495,DOI:https://doi.org/10.1093/jxb/erq295.
- 26。
Vasil Ik,Vasil V. Totipotency和植物细胞和组织培养中的胚胎发生。体外。1972; 8(3):117-27。https://doi.org/10.1007/BF02619487.
- 27。
oinam gs,kothari sl。籼稻菌肤组织的全能性(oryza sativa l..简历。ch 1039)。植物学报1995;14(4):245。
- 28.
Miransari M,Smith DL。植物激素和种子萌发。Environ Exp Botany。2014; 99(3):110-21。https://doi.org/10.1016/j.envexpbot.2013.11.005.
- 29.
Luckwill LC。果实发育与植物激素的关系研究:I.发育中的苹果种子产生的激素与果实脱落的关系。果树学报。2015;28(1):14-24。
- 30。
周X,郑河,刘克,徐y,Zhou Y,Laux T,等。干燥治疗和内源性IAA水平是影响高频体细胞胚胎发生的关键因素Cunninghamia lanceolata.(羊肉。)钩。前植物SCI。2017; 8:2054。https://doi.org/10.3389/fpls.2017.02054.
- 31。
白桦,施,侯n,cay,meng y,bian h,等。MicroRNA在种子发育和萌发过程中参与大麦胚胎的基因表达调节和植物激素串扰。BMC植物BIOL。2017; 17(1):150。https://doi.org/10.1186/s12870-017-1095-2.
- 32。
BAEK D,春HJ,云DJ,金MC。磷酸盐饥饿与植物中其他环境应力信号通路之间的交叉谈话。mol细胞。2017; 40(10):697-705。https://doi.org/10.14348/molcells.2017.0192.
- 33。
关键词:拟南芥,AtWRKY28, AtWRKY75,抗草酸,菌核病植物学报2013;32(10):1589-99。https://doi.org/10.1007/S00299-013-1469-3..
- 34。
Doerks T,Copley Rr,Schultz J,Ponting Cp,Bork P.系统鉴定与核职能相关的新型蛋白质领域家庭。Genome Res。2002; 12(1):47-56。https://doi.org/10.1101/gr.203201.
- 35。
Devaiah Bn,Madhuvanthi R,Karthikeyan As,Raghothama Kg。磷酸盐饥饿反应和甘油酸生物合成受拟南芥中的MyB62转录因子调节。莫尔植物。2009; 2(1):43-58。https://doi.org/10.1093/mp/sn081.
- 36。
Chak RKF,Thomas TL,Quatrano Rs,Rock CD。ABI1和ABI2基因涉及脱落酸和干旱诱导的表达Daucus Carota.L.转基因保护细胞中的DC3启动子拟南芥蒂利亚纳(L.)Heynh。Planta。2000; 210(6):875。
- 37。
刘W,王Y,GaO C.来自Tamarix Hispida的乙烯反应因子(ERF)基因对盐,干旱和ABA治疗作出反应。树木。2014; 28(2):317-27。https://doi.org/10.1007/S00468-013-0950-5.
- 38。
Zhi W,Hong C,Yongzhen S,小英L,Fengying C,Annaick C,等。Arabidopsis成对的两亲螺旋蛋白SNL1和SNL2通过组蛋白脱乙酰化介导的脱落酸 - 乙烯拮抗作用来冗余调节原发性种子休眠。植物细胞。2013; 25(1):149-66。
- 39。
刘克,冯某,潘y,zhong j,chen y,元c等。糖苹果中花卉过渡和花卉发育的转录组分析及鉴定(Annona Squamosa.L.)。前植物SCI。2016; 7:1695。
- 40。
Wei L,Xiao Z,Chao F,Jiang N,Meng X,Xu X.具有不同水果成熟时期的荔枝中华鳖的黄酮合成酶基因的克隆与表征。前植物SCI。2018; 9:567。
- 41。
温米,沉Y,Shi S. Tang T:Mirevo:下一代测序实验的一体化MicroRNA进化分析平台。BMC生物素。2012; 13(1):140。https://doi.org/10.1186/1471-2105-13-140.
- 42。
Mackowiak SD。用MIDDEEP2的深序数据鉴定新颖和已知的miRNA。Curr Protoc生物素。2011; 12(12):12。
- 43。
费雪,史强,杨涛,费志,魏安。10个候选内参基因在花椒RT-qPCR中的表达稳定性。分子。2018;23(4):802。
致谢
作者感谢黄东博士提供的实验技术支持。
资金
本研究得到了国家重点研发计划项目资金(2018年FD1000605)的财务支持。该资助者在实验设计中没有作用,数据分析,决定发布或准备稿件。
作者信息
隶属关系
贡献
AW构思了这个项目;X.F.设计并进行实验;XF写了论文。所有作者(XF,YL,YQ,SW,HH,YH,YM和AW)讨论了结果并对稿件评论。作者阅读并批准了最终手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Fei,X.,Lei,Y.,Qi,Y.等等。小RNA测序提供候选miRNA-target对,用于揭示Apomixis的机制Zanthoxylum Bungeanum..BMC植物杂志21,178(2021)。https://doi.org/10.1186/s12870-021-02935-5.
已收到:
公认:
发表:
关键词
- apomixis.
- 钦am
- miRNA-target对
- MiR172.
- 托伊3.
- Zanthoxylum Bungeanum.