摘要
背景
木薯(Manihot EsculentaCrantz)是一种以其高淀粉含量而闻名的重要粮食作物。多倍体育种在其遗传改进中是有效的,并且使用2n性多倍体育种的配子是木薯育种和改善的潜在方法之一。在我们的研究中,通过杂交2成功地产生了携带许多有价值性状的木薯性四倍体(ST)n女性配子sc5(♀)和2n雄性配子sc10(♂)。然而,分子机制仍然不清楚。为了了解在ST植物的表型改变和杂种中的这些潜在的分子机制,我们通过测定块茎根部扩大期间St植物及其父母的转录组来研究多倍体和二倍体之间的基因表达的差异。我们还比较了ST植物及其亲本的性状和转录组。
结果
除叶片数较低外,ST株株高、茎粗、叶面积、叶柄长、单株质量和根重均优于亲本。5个月后(块根膨大期),ST植株根系中淀粉粒数量高于亲本植株,这可能是由于叶片净光合速率较高导致淀粉粒提前填充所致。通过转录组分析,我们分别鉴定出了2934和3171个差异表达基因(DEGs)。途径富集分析表明,黄酮生物合成和糖酵解/糖异生作用在ST植物中显著富集,这可能分别与叶柄颜色(紫红色)、根表皮颜色(深棕色)和块茎淀粉积累有关。
结论
有性多倍体化后,ST的表型与二倍体亲本相比发生了显著变化,主要表现为生物量增大、产量增加、淀粉早期充塞、叶柄颜色深、根表皮颜色深。四倍体植株由于淀粉粒灌浆较早,成熟较早。由于丰富的类黄酮生物合成和糖酵解/糖异生作用,它们可能分别抵抗逆境胁迫和提供更好的产量。
背景
木薯(Manihot EsculentaCrantz)是热带地区种植最广泛的第四大作物,是世界三大淀粉作物之一,也是非洲热带地区的主要粮食作物[1].它的茎秆含有丰富的淀粉 - 20-40%的新重量和80%的干重, - 使其成为已知的淀粉作物中的最高等级,因此Cassava通常被称为“地下食物”,“淀粉之王”“,”特别作物“和”能量作物“[2那3.那4.].对这一重要的经济和能源作物的育种研究具有十分重要的意义和广泛的报道。通过有性杂交和选择自然变异的传统育种方法是生产木薯品种的常用育种方法[5.].通过观察叶片形态,在TMS91934和TMS89/00037-17木薯无性系中鉴定出一个优良的木薯品种[6.].其他育种者还通过优异的木薯种质的内部杂交,例如KU50和Rayong系列[7.].虽然传统的改进方法有助于木薯育种过程,但它仍然足够远,以满足对木薯根产量,淀粉含量和对非生物和生物应力的抗性的需求。
多倍体育种已被报告为作物遗传改善的有效方法[8.].四倍体的产量芸苔属植物拉伯ssp。(中国卷心菜)比二倍体高出20-30%,具有增强对非生物和生物应激的抗性的二倍体[9.].红阳猕猴桃四倍体比二倍体体外抗溃疡能力明显增强[10.].在木薯的多倍体育种中,大多数品种是通过使用裂解细胞来治疗腋芽或干蕾的体细胞染色体的数量来产生自身传递,例如SC8和SC124自身四倍体[11.那12.那13.].还使用了血清氨基浸泡和混合培养物的另一种方法,以治疗芽杆段,子叶区段和木薯簇芽,得到SC8和ARG7 Actiopyploids [14.].
育种者现在使用以2为中介的性繁殖n形成染色体重组的配子[15.那16.].多倍体后代由2形成n2 .配子减数分裂n配子由没有减少的微孔或Megaspore母细胞产生的,并且父母的同源染色体以高频重新组合;因此,父等位基因可以彼此分离成形成后果[17.那18.那19.].由于缺乏减数分裂重组,不可能通过体细胞染色体倍增-有丝分裂多倍体(体细胞在有丝分裂期间进行染色体倍增)来重组基因。育种科学家已经成功地培育出几个优良的农作物品种n配子多倍体化(15.),如樱草属植物denticulata(报春花)[20.],疫苗部分Cyanococcus(蓝莓) [21.],Populus tomentosa卡尔。(杨树)[22.),而橡胶树取代巴西橡胶树(橡胶)23.].在茄属植物tuberosum(马铃薯)作物,多倍体由2n配子有助于开发精英品种(从单倍体到六倍倍细),其具有高蛋白质含量[24.那25.那26.].与他们的二倍体父母相比,性多倍体显示出所需的表型和生理生长变化:性三倍体Tulipa Gesneriana郁金香在商业上很重要,因为它的花很大,颜色鲜艳。27.]和性四倍体B. Rapa.SSP。pekinensis.具有高生物量,产量增加[28.].有性多倍体也比无性多倍体更稳定,因为它们是从受精卵发育而来的,所以没有嵌合现象[29.].因此,性多倍化育种在引入新的变异和开发后代等位基因的新组合方面更有价值。
尽管其他植物中的性多倍化有几点报告,请研究2nCassava中的配子多倍化很少报道。我们的研究小组通过杂交2成功获得了木薯的性四倍体(ST)植物n通过将木薯和微孔花序用殖民碱和二甲基亚砜(DMSO)用粉碎片兆波和微孔花序(DMSO)而获得的女性和雄性配子以形成2n有性阶段的配子[30.那31.].报告显示,多倍体的表型改变可能与染色体倍增后特定基因组表达的变化有关[32.那33.那34.].这些基因表达在许多天然和合成的多倍体植物中发现了变化[35.诸如,在全多大倍性/ -Autotetropoids中改变新基因和基因组的表达拟南芥[33.].rna介导的基因调控在多倍体化中的重要性芸苔属植物显著[36.那37.[多倍体化后的种子发育中的类黄酮生物合成和脂质有关的基因的显着变化Gossypium.[38.那39.,以及在自然或合成的异源四倍体中形成多倍体后基因的偶然丢失和沉默tragopogon miscellus.[40]是改变基因表达的一些例子。但是Cassava多倍体中基因表达和调节网络的变化需要进一步研究。
下一代高通量测序技术的发展是基因组学和转录检测领域的革命性突破。通过测量转录组范围内的基因表达,我们可以分析多倍体和二倍体之间的基因表达差异,这有助于理解多倍体表型变异背后的机制。转录组测序技术已应用于许多人工多倍体和自然多倍体植物中,并已证明多倍体和二倍体之间的基因表达存在显著差异[35.那41.那42.那43.].这些DEGs通常与植物激素合成、信号转导、转录因子、葡萄糖代谢等有关,与四倍体和二倍体生长和繁殖的表型差异有关[34.那44.那45.].木薯ST植株表型改变和杂种优势的分子机制尚不清楚,需要进一步研究。为了解决这一问题,我们通过测定ST植物及其亲本在块根膨大期间的转录组,研究了多倍体和二倍体之间的基因表达差异。我们还比较了ST植物及其亲本的性状和转录组。我们的研究将有助于从功能基因组水平揭示ST植物表型变异的分子机制。这也为进一步研究木薯性多倍体中与根系形成、产量、逆境胁迫等重要农艺性状相关的关键控制基因的结构和功能奠定了基础。
结果
杂交木薯品种的多倍体鉴定
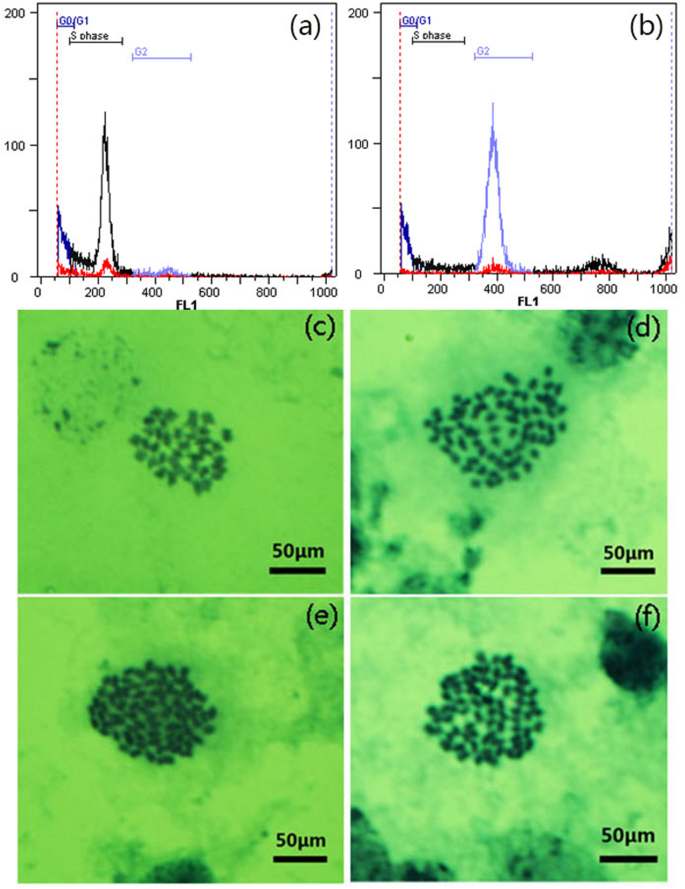
杂交木薯苗由亲本SC5(♀)× SC10(♂)有性杂交获得。通过流式细胞术和叶片细胞染色体计数证实了杂交木薯幼苗(F1)的倍性。二倍体亲本的DNA含量在200通道出现一个主峰(图)。1a),杂交木薯植物显示对照二倍体的DNA含量的两倍,在通道400处具有主峰(图。1b).他们的染色体数目是二倍体双亲的两倍(图。1C和D)。我们没有发现嵌合的二倍体细胞,证实杂化木薯品种是均匀的四倍体(图。1).通过计数叶细胞染色体来确认克隆系(F2 / F3)的倍率稳定性。结果表明,木薯性四倍体(ST)的倍增性是均匀且稳定的(图。1e,f)。
田野中木薯植物的特征
结果表明,与亲本相比,ST株系叶片较大,叶片形状较圆,叶脉较粗,叶柄较长,呈紫红色。2b)。ST植物的根目性较暗(图。2c)韧性厚度厚度厚度(图。2C)。除了叶片数量的叶片数量,植物高度,茎直径,叶面积,叶柄长度和植物重量的上述地面部分的平均值高于亲本植物的平均值1).对于地下零件,St植物的根重高于母植物的根部重量,但根部的长度或直径没有显着差异(表1).ST株的叶片净光合速率高于亲本,而根系干物质速率没有显著差异(表1)1).
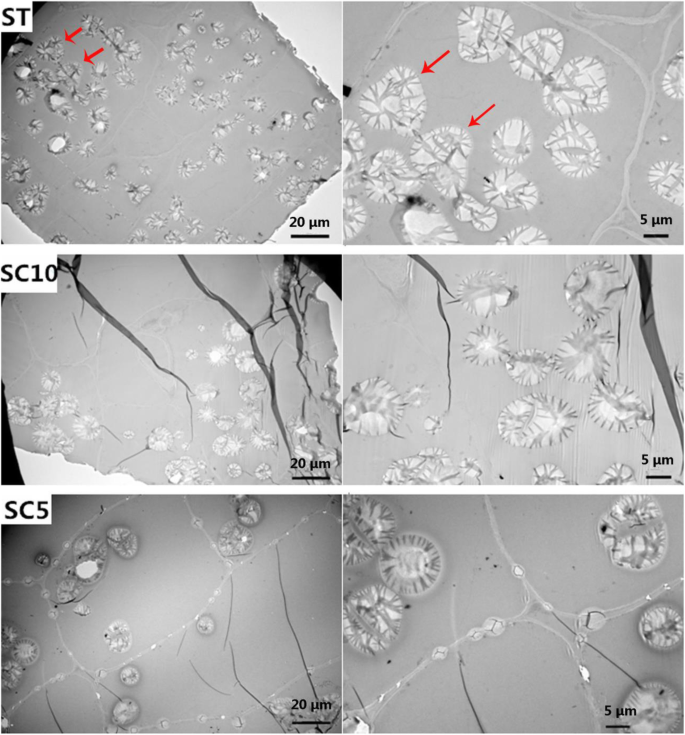
在种植5个月后,利用透射电镜观察了ST、SC5和SC10块根中淀粉颗粒的横切面。5个月后(块根膨大期),ST植株根系中的淀粉粒数高于亲本植株(图。3.),但10个月(块根成熟期)后无显著差异。附加文件(图S1)显示了这种观察的细节。我们的结果表明,ST植物中的淀粉谷物早于父母。在这两个时段中,我们没有观察到ST植物和母植物之间的细胞大小的任何显着差异(图。3.和s1).在ST植株中,2 - 3个淀粉粒粘在一起形成不规则的淀粉体,而在其亲本中,大多数淀粉体有1个淀粉粒,很少有2 - 3个淀粉粒(图中红色箭头所示)。3.).与亲本植物中的淀粉颗粒,“斑马条纹”的密度也不同。我们的研究结果表明St植物中淀粉颗粒的内部结构的变化。
转录组数据采集
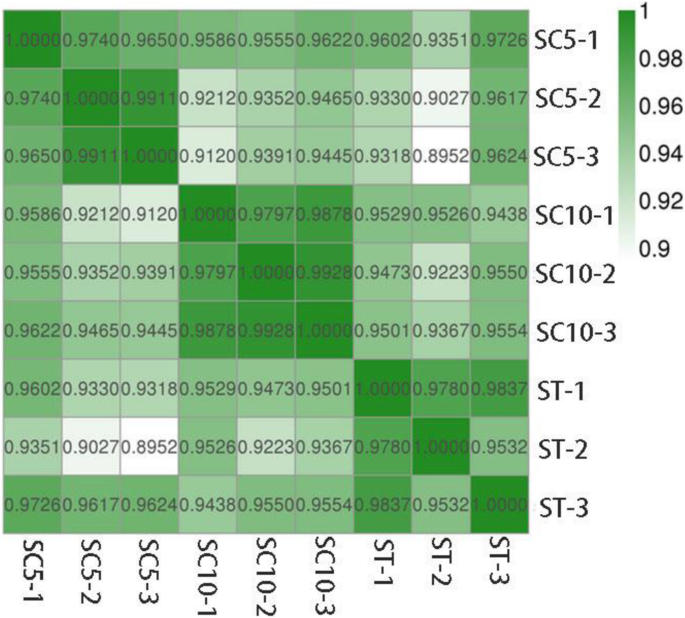
总读取,未映射读数的比例约为20%,唯一映射读数的比例约为79.5%,多个映射读数的比例约为0.5%(表2).相关系数热图分析和重现性分析结果表明,每个品种的3个重复均具有较高的相关性(Pearson相关> 0.95)和可重复性(图1)。4.).额外的电影文件(图S2)更详细地示出了该观察。结果表明,重复数据对于基因表达分析有效。
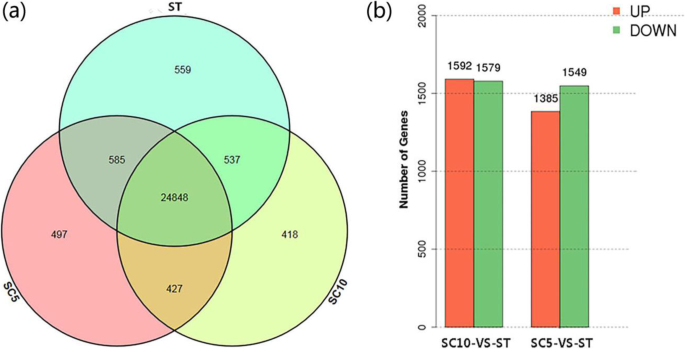
总共有27,274个已知的基因,占整个参考基因组的82.54%,我们检测到611个潜在的新基因。这些基因中的大多数在所有三种植物材料中表达,并且一些基因在特定的基因如SC5(497),SC10(418)和ST(559)中仅表达(图359)(图。5.一个)。
ST植物与母植物之间的差异表达基因分析
我们在ST植株中分别鉴定了2934和3171个DEGs,与它的母本和父本进行了比较。5.b)。我们的结果表明,只有少量基因在St植物和母体植物中的所有检测到的基因中差异表达,表明基因表达在多倍化后没有明显的基因组变化。
基因本体功能和Kegg途径浓缩分析
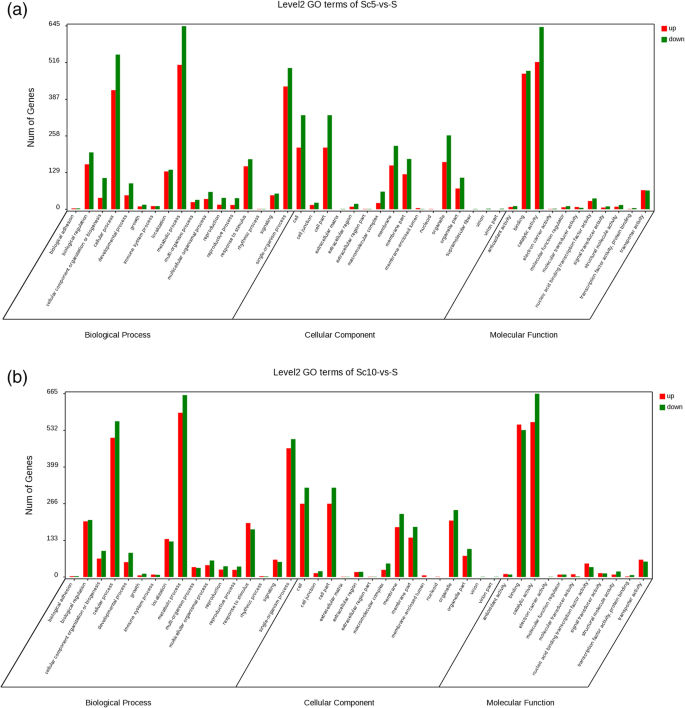
GO功能富集分析表明,ST及其亲本之间的DEGs分别分为44/43个GO项,分别包含在细胞过程、细胞组分和分子功能中(图1)。6.A和B)。与女性父母相比,该DEG主要富集在细胞过程,代谢过程,单生体过程,生物调节,刺激反应和局部化的生物过程中。与雄性父母相比,ST植物的富集分布与女性母体非常相似,不同之处在于在超分子纤维的生物学过程中富含DEG。与女性父母相比,在黄酮类生物合成和代谢的过程中富集。
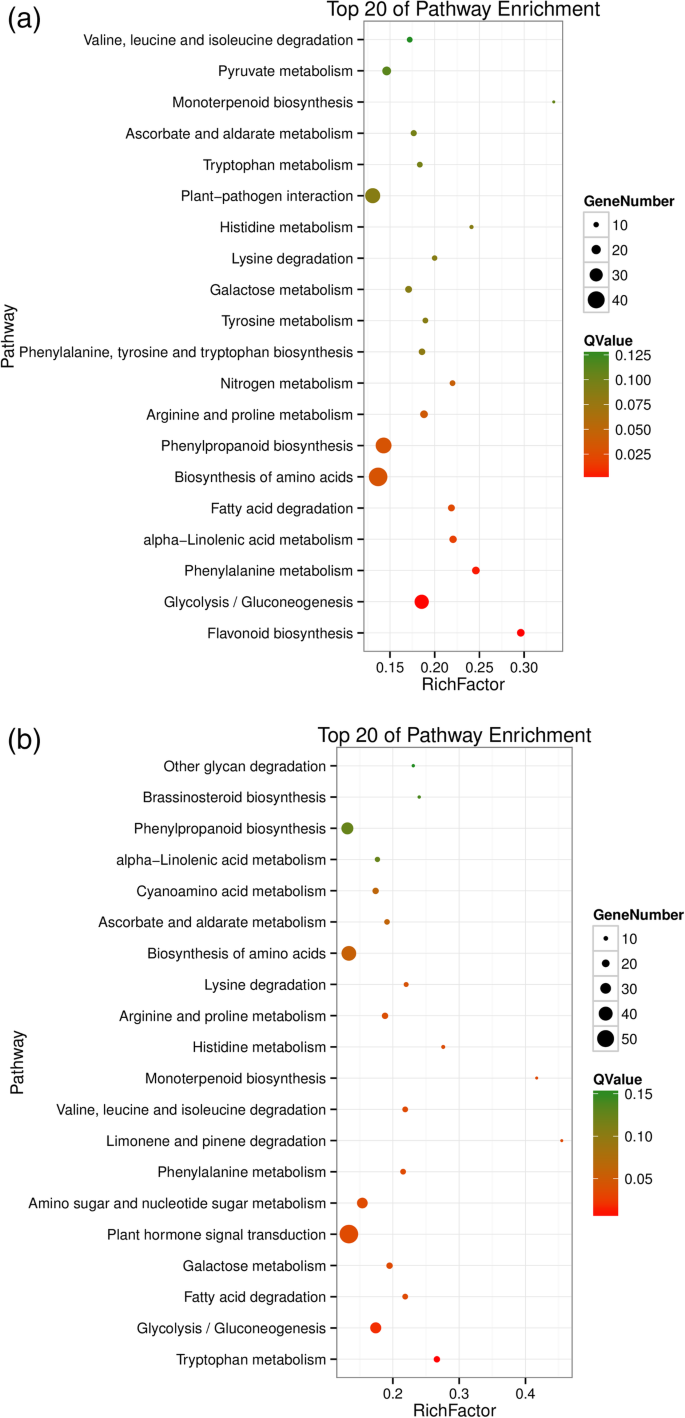
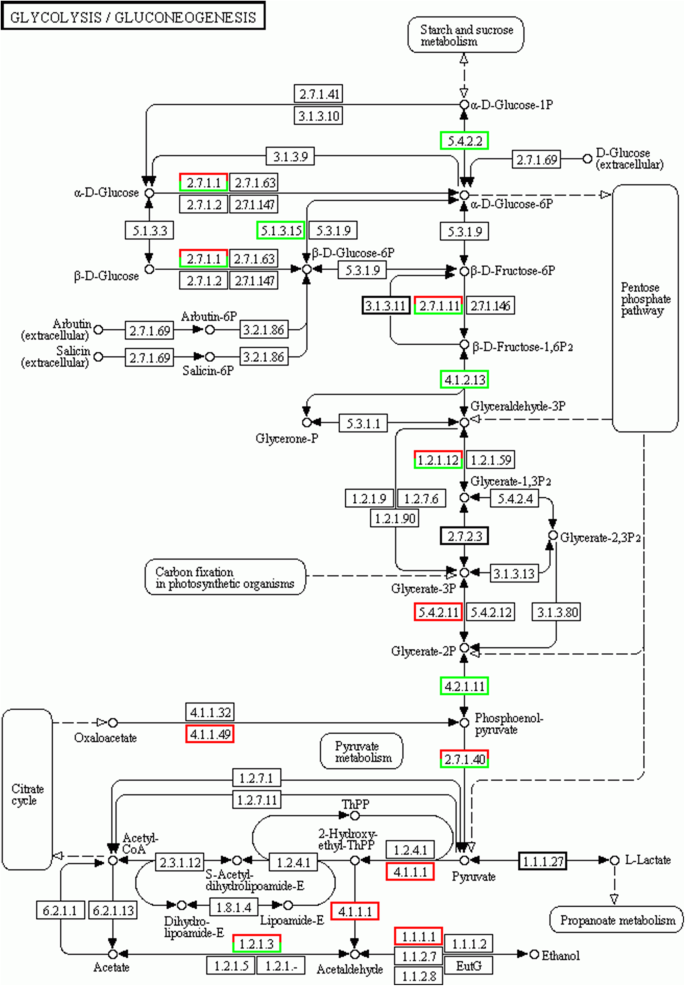
图7.A和B显示出前20个富集途径,类似于富集结果。与雌性母体SC5相比,DEG最富集在黄酮类生物合成中(图。7.a).在母本和父本的糖酵解/糖异生过程中,许多deg被二次富集(fig . 2)。7.A和B)。糖酵解/葡糖生成与木薯根中的淀粉积累密切相关(图。8.)揭示性四倍体可能影响淀粉积累。
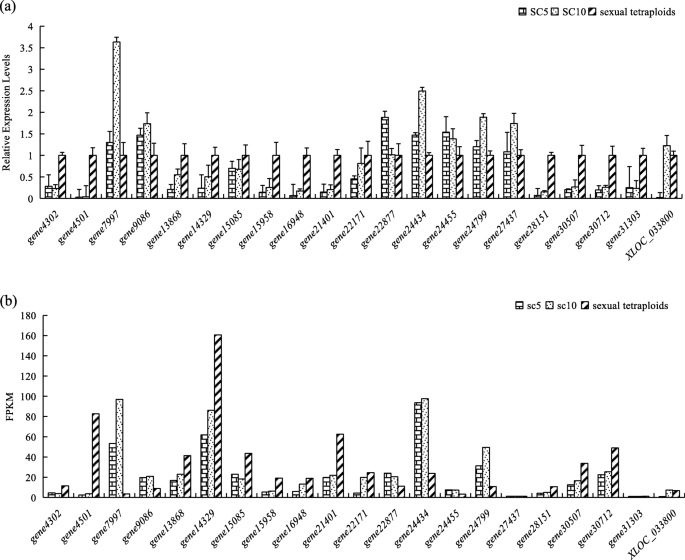
实时定量RT-PCR (qRT-PCR)验证糖代谢相关的DEGs
为了验证RNA-seq测序结果的准确性,选择21个参与糖酵解/糖异生的deg进行qRT-PCR。数字8.图示了在红色盒子中的ST和其父植物和绿色盒子中的下调的下部之间的上调的°。与转录组测序分析一样,在块茎增大期间从三种木薯植物材料的结节根提取的RNA用于QRT-PCR(其与转录组测序分析中使用的QRT-PCR)。QRT-PCR的相对表达变化趋势符合RNA-SEQ的相对表达趋势(图。9.),表明转录组比较数据是可靠的。
讨论
性多倍体2n配子是植物中最重要的多倍体,因为生殖细胞对环境更敏感而不是细胞细胞[46.].在本研究中,我们通过人工诱导2获得人造ST植物n在女性和男性父母的配子和杂交它们[47.].我们对ST植物的性状进行了研究,发现ST植物的性状较亲本有所改善。ST植株的叶片体积比亲本大,叶面积显著增大,叶柄较长,扩张期收获的器官根也显著高于二倍体亲本。我们还观察到ST植物的叶片数量减少,表明在没有分枝的植物中具有多倍体性质。这一性状使木薯在田间易于管理,更有利于木薯的密植。这些结果表明,木薯ST植株的生长性状与一般多倍体一致。与木薯无性多倍体相比,由于木薯的ST是由2n配子途径[47.然后直接通过受精卵发育,不存在嵌合现象。在繁殖过程中,它不会退化并恢复为二倍体。本研究证实了其倍性、纯合性和无性繁殖稳定性。值得一提的是,我们在木薯ST无性系的三代中都没有观察到开花结果,因此ST植株不能作为杂交亲本进一步获得有性三倍体或其他杂交种。通常,染色体复制后,细胞核内的染色体出现减数分裂配对障碍,导致后代生长速度降低,不育,这是多倍体物种中常见的现象[48.].透射电子显微照片在ST植物中显示出许多淀粉谷物在根扩大期(种植后五个月),而两个母体植物的根部几乎甚至没有开始填充(图。3.).早期填充淀粉颗粒可能与更高的叶片净光合速率相关。这是选择早期熟肉的木薯品种的重要发现。
通常,多倍体基因组行为会影响杂种优势,而异聚倍增物(天然和合成)通常表现出“基因组优势”[49.那50.].多倍体的表型和生理变化是基因复制产生改变的基因调控途径后基因表达的变化[31.那36.那51.那52.那53.].在我们的研究中,我们观察到其中一些参与参与生物调节,代谢过程,本地化,对刺激的反应以及发育过程。我们的发现与自身传递物相同步森菊属l .(桑)42.].在Paulownia Fortunei.多倍化,基因表达变异导致表观遗传相关的变化[35.那43.],还有Betula Platyphylla.(桦树),吲哚乙酸(IAA)和乙烯的生物合成和信号转导在基因组复制后发生改变,从而导致表型变化[44.].结果表明,木薯有性四倍体化后基因数量没有明显变化,但基因表达发生了变化,木薯STs的表型和生理生化变化可能受到这些DEGs的调控。
我们对途径浓缩分析的研究表明,两种代谢途径生物合成和糖酵解/葡糖生成显示出富集的显着差异。圣植物的叶柄和块茎根表皮分别是紫红色和深棕色,与父母的紫色和深棕色。“黄酮类生物合成”的显着富集的代谢途径可能导致ST植物中的叶柄和根表皮的变化,由于花青素(黄酮类化合物)的积累。黄酮类化合物还充当植物胁迫性抗氧化剂:拟南芥通过过度累积抗氧化黄酮类化合物显示氧化和干旱耐受性[54.],抗菌活性Zingiber Officinale.rosc。(姜)与黄酮含量相关[55.],木薯根采后生理恶化(PPD)与酚类、类胡萝卜素呈负相关,与花青素、类黄酮、褪黑素呈正相关[56.那57.].ST植物根中“类黄酮代谢途径”明显富集。在另一项研究中,我们观察到其块根比其亲本对PPD有更强的抗性。木薯叶片的光合速率、合成蔗糖的能力以及木薯块根对蔗糖的利用能力在木薯淀粉积累过程中起着关键作用[58.那59.那60那61].ST植物具有比母植物更高的净光合速率,并且显着富集在可能影响其产量并略微改变其根部的干物质组合物的糖酵解/葡糖生成的代谢途径。
结论
本研究对木薯有性四倍体及其二倍体亲本的性状和全基因组基因表达谱进行了研究,旨在阐明有性多倍体后性状变化的分子机制。总体而言,木薯性四倍体的表型和生理特性与二倍体亲本不同,包括生物量大、光合速率高、叶柄和根表皮呈紫色等有益性状。与亲本相比,木薯性四倍体具有较高的净光合速率和显著富集的糖酵解/糖异生代谢途径,这可能与淀粉粒早期灌浆、产量增加和根系干物质组成增加有关。类黄酮生物合成代谢途径的显著富集可能导致有性四倍体叶柄和根表皮颜色的改变。对木薯有性多倍体中经济重要农艺性状基因的进一步研究,有助于大规模生产更好的品种,导致木薯淀粉不仅用于食品,也用于造纸和制药等非食品用途的批量生产。
方法
植物材料
实验性母体植物材料,Manihot EsculentaCrantz华南5号(SC5)和10号(SC10)来源于中国热带农业科学院热带作物资源研究所。木薯有性四倍体(ST)植株由2n女性(SC5)和2n雄性(SC10)配子的方法如下:
- 1。
2n配子诱导:根据木薯大孢子/小孢子母细胞减数分裂与花序、雌蕊/雄蕊形态特征的相关性,选择减数分裂前期长2.8 ~ 3.5 mm、直径1.0 ~ 1.7 mm的雌蕊,诱导2n雄(SC10)和雌(SC5)配子采用0.3% (w/v)秋水仙碱和1% (v/v) DMSO浸渍棉花。
- 2。
杂交:在木薯开花期,2n女配子(SC5)用于2个杂交n花粉(SC10)。
- 3.
统一的四倍体的选择:收集几种杂种成熟种子,播种以生产植物(F1);然后,F1植物繁殖以产生F2克隆,其又产生F3克隆。通过测量DNA含量和从F1,F2和F3克隆的叶片计数染色体数来鉴定它们的倍率和纯合子。在以下实验中使用具有稳定表型的均匀四倍体克隆。
三种木薯植物材料(SC5,SC10和ST)在海南大学农业学院,丹州校区,中国海口,丹南大学农业学院繁殖。将所有生物复制从不同的克隆中随机选择。
杂交植物中的多倍体鉴定
通过以下方法鉴定了F1、F2和F3植株的倍性和纯合性。采用流式细胞仪测定了杂交植株F1及其亲本的叶片DNA含量。将从木薯植株顶部附近收集的0.5 g嫩叶放入装有裂解缓冲液(45 mM MgCI)的培养皿中2如:30 mM柠檬酸钠,20 mM MOPS, 0.1% v/v Triton X-100),然后用刀片切碎,处理2-3分钟,用300目过滤器过滤收集滤液,然后在室温1500 rpm下离心5分钟。沉淀溶于1ml鞘液中,室温1500rpm离心5min。最后将沉淀与5 mL DAPI染料混合,在黑暗条件下染色0.5-2 h。采用FACSC alibur流式细胞术(BD, USA)进行多倍体检测,采用CellQuest Pro软件进行数据分析。以二倍体亲本作为对照。
采用酶解吸法制备杂交植株F1、F2和F3及其二倍体亲本的叶片染色体样品[62].上午9 ~ 12时采集木薯青铜叶,室温下用对二氯苯饱和液预处理1-2 h,然后用自来水漂洗4-5次,蒸馏水漂洗3-5次。叶片在无水乙醇和冰乙酸(3:1)中固定10-24 h。将叶片用蒸馏水漂洗3-5次,每次5 min,然后在蒸馏水中保存30 min,进行预低渗。用0.75%纤维素酶和3.75%果胶酶的混合酶在37℃下酶解2-4.5 h(叶与酶的体积比约为1:4)。用蒸馏水轻洗2-3次后,在蒸馏水中低渗透保存30分钟;最后在无水乙醇和冰醋酸中固定15分钟。叶子被小心地放在一个没有气泡的玻璃片上,很快就被镊子压碎了。大块的残留物被剪掉并风干。然后用10% (w/v)吉氏染色液(pH 7.0)染色20 min。 The excess dye was washed off with water, and the leaf was air dried. The cells in metaphase division were selected for chromosome number calculation under the microscope.
表型
在5个月大的植物中研究了ST及其母体二倍体植物的表型。选择在田间栽培的ST,SC5和SC10植物,用于测量植物身高,茎直径,叶面积,叶柄长度,叶子数,叶片净光合速率,地上和地下植物重量,长度和直径根,根系干物质率。选择第四个完全膨胀的叶片用于叶测量(叶面积,叶柄长度,叶子号和叶净光合速率),并且通过使用扫描方法和imagej软件计算叶面积。通过使用GFS-3000光合作用测试仪(Walz,德国产品)检测木薯叶的净光合速率[63].来自ST,SC5和SC 10植物的三种生物样品从三个独立的植物中随机选择,用于每个实验分析。每个实验以三重次数进行。
在透射电子显微镜下观察到5个月历龄ST,SC5和SC10植物的结节根中的淀粉颗粒和淀粉片[64].来自ST,SC5和SC 10植物的三个样品从三个独立的植物中随机选择,用于每个实验分析。
RNA提取和转录组测序
在制造商的说明之后,通过使用ominiplant RNA套件(DNASE1)(DNASE1)(DNASE1)(DNASE1)(DNASE1)(DNASE1)(DNASE1)(COMWIN,北京,中国)在制造商的说明中,从5个月历史的新鲜茎秆根中提取总RNA。来自ST,SC5和SC 10植物的三个样品从三个独立的植物中随机选择,用于每个实验分析。每个实验以三重次数进行。通过使用碎片缓冲液(DT)来富含总mRNA,然后使用碎片缓冲液进行碎片,并通过使用NEB#7530套件(NEB#7530套件,新英格兰Biolabs)反转转录到cDNA中。CDNA片段被末端修复,加入聚(a),并将其连接到Illumina测序适配器,然后通过施用Ampure XP珠粒(1.0x)试剂盒纯化产物,在制造商的说明之后。使用Illumina Hi SEQ TM2500进行转录体测序(Gene Denovo Biotechnology Co.,Changzhou)进行。
与参考基因组比对并重建转录本
通过该测序获得的原始图像数据通过基本呼叫转换为原始数据。为了确保数据质量,在信息分析之前执行原始数据,并且通过数据过滤丢弃冗余数据。在严格过滤这些清洁读取后,包括含适配器的读数,超过10%N读取,低质量读取(具有质量值Q≤20的基础,占整个读数的50%以上),最后,高质量的清洁读数用于随后的信息分析。
为了进一步防止核糖体污染,短读比较工具Bowtie2 [65]用于将高质量的清洁读数与核糖体数据库对齐。除去属于核糖体的读取后,每个样品的剩余数据通过使用转录组数据对准软件TOPHAT2(v.2.0.3.12)对转录组组件和进一步分析来对准Cassava参考基因组。对准参数如下:最大读错匹配是2;Mate-pai读数之间的距离为50 bp;Mate-pair读数之间的距离的误差为±80 bp [66那67].
在与参考基因组对齐之后,将未映射的读数(或那些较差的读数)与Bowtie2重新排列。将丰富的未映射的读数分成较小的段,然后用于搜索潜在的剪接位点。这些短片的部分和位置也是预测的。通过初始的ath2读取的读取读数构建了一组接头位点,而不依赖于已知的基因注释[68].
转录物的重建用腹部与顶部hat2一起进行,以鉴定已知的新基因和新的剪接变体。基于参考注释的转录物(RABT)算法是优选的。袖扣根据弥补低覆盖量测序的影响,构建了人造读数。所有重组片段与参考基因对齐,除去类似的片段。每组的不同副本通过使用绒毛胶融入一组综合的成绩单。来自多个组的综合转录物用于进一步下游差异表达分析。
差异表达基因(DEGS)的功能和KEGG途径浓缩分析
为了比较差异表达基因(DEGs)在ST植物和亲本植物中的表达情况,采用转录本每千碱基(FPKM)法计算每个基因的表达值。这种方法可以消除基因长度和测序差异对基因表达的影响,结果可以直接用于比较不同样本之间的基因表达差异。我们使用了错误发现率(FDR)P.(FDR修正后的值)和log2 (FPKM英石/ FPKM.二倍体)在FDR <0.05和| LOG2FC下筛选差异基因 > 1.
为了进一步了解ST及其亲本植物之间的次数,基因本体(GO)和基因组(KEGG)数据库的基因本体(GO)和京都百科全书用于这些基因的功能性富集分类。将所有DEG映射到基因本体数据库中的术语(http://www.geneontology.org/)通过超大测量测试来计算每个术语的每个术语的基因的数量,并且在DEG中显着富集术语。这P.值(69]计算如下:
在那里,N是所有具有GO注释的基因的数量,ndeg的数量是多少N那m是向某些GO条款注释的所有基因的数量,以及米deg的数量是多少m。
通过基因和基因组(KEGG)数据库的京都百科全书鉴定了途径富集分析。这P.值(63]的计算方法与GO项分析相同。在这个公式,N为所有具有KEGG注释的基因数,ndeg的数量是多少N那m是向特定途径注释的所有基因的数量,以及米deg的数量是多少m。
这里使用的木薯转录组的原始数据已经保存在NCBI的SRA数据库中(登录号为SRP151951)。
实时定量RT-PCR(Q-PCR)验证
Total RNA was extracted from tuberous roots of three cassava plant materials (SC5, SC10, and ST) using RNAgen Plus plant total RNA extraction reagent (Tiangen Biochemical Technology Co., Ltd., Beijing, China) according to manufacturer’s instructions, and then reverse transcription was performed. The relative mRNA expression of the DEGs was analyzed by qRT-PCR using a set of gene-specific primers (Table3.),基于对木薯基因组数据库的BLAST分析(http://www.phytozome.net/cassava.).逆转录和QRT-PCR反应系统和特定操作步骤是指我们发表的论文[70].分析了每个样品的三种技术复制。
数据和材料的可用性
支持本文结论的数据集可在NCBI存储库的SRA数据库中提供(登录号:SRP151951)。
缩写
- SC5:
-
Manihot EsculentaCrantz South China No.5
- SC10:
-
Manihot EsculentaCrantz South中国10号
- 英石:
-
木薯性四倍体
- DMSO:
-
二甲亚砜
- 可见:
-
差异表达基因
参考
- 1。
热带根块茎作物:木薯、甘薯、山药和香草;2008.
- 2。
木薯改良:挑战与影响。中国农业科学(英文版)2007;145(145):163-71。
- 3.
冯x,m-r xu,张l,李n-h。木薯生物燃料工业化的文献综述。中国农业科公牛。2010; 26(10):375-80。
- 4.
赖H-G,庄N-S。木薯多倍体育种研究进展。J热带生物。2010; 01(4):380-5。
- 5。
你们J-Q。中国木薯育种进展。热带农业科学。2009;11:115-9。
- 6.
木薯体细胞四倍体的研究。日本育种杂志,1992;42(2):303-8。
- 7.
宋H-y。木薯野生物种肿块根系转录和研究:海南大学;2014年。
- 8。
彭·魏y-r,熊x-h。植物研究摘要的多倍体诱导。中国农业科学公关。2010; 26(11):45-9。
- 9。
太阳m-h,张s-n。多倍体育种在园艺作物中的应用。江苏农业科学。2004; 1:68-72。
- 10。
张康杂交初步研究红阳猕猴桃抗牛肝菌特征:新安大学;2011年。
- 11.
陈X-S,Wei L-J,Tian Y-N,Lu Z-S,潘H. Colchindines诱导的木薯多倍体植物的再生。中国J Trop Agric。2008; 28(1):17-20。
- 12.
王J-L。木薯多倍体育种技术研究:广西大学2008.
- 13。
安芳芳,范杰,李永华,简春平,李坤明。木薯叶片蛋白质组和叶绿素荧光的比较。SC8及其四倍体突变体。中国农业科学,2013;46(19):3978-87。
- 14。
关键词:木薯,多倍体,离体诱导2012.
- 15.
植物性多倍体在作物改良中的应用。Euphytica。2003;133(1):3 - 8。https://doi.org/10.1023/A:1025600824483。
- 16.
Younis A,Hwang Yj,Lim KB。诱导2的开发n-植物育种的配子。植物学报2014;33(2):215-23。https://doi.org/10.1007/S00299-013-1534-Y.。
- 17.
LIM KB。植物中三种杂种中的同种杂种重组。韩国J繁殖。2003; 35:8-12。
- 18。
Barbagonzalez r,lim kb,拉姆纳ms,tuyl jmv。使用2N配子诱导百合杂交物中的骨髓组重组。Acta Horticulturae。2005;(673):161-6。
- 19。
德国德威特公司,Laere KV, Huylenbroeck JV。使用2n植物育种中的配子:InTech;2012.
- 20。
Mai H,Kato J,Ohashi H,MII M.未收回的3x配子形成来自报春花牙龈(4X)×P.Rosea(2x)的丙酮型(4X)×P.Rosea(2x)作为在回载中产生五倍倍杂交物的因果因素Tetraploid P.Denticulata。Euphytica。2009; 169(1):123-31。
- 21。
Lyrene PM,Vorsa N,Ballington JR。痘苗属的多倍体和性多倍化。Euphytica。2003; 133(1):27-36。https://doi.org/10.1023/a:1025608408727。
- 22。
张震,康欣。毛白杨数量未减少花粉产量的细胞学特征。Euphytica。2010;173(2):151 - 9。https://doi.org/10.1007/S10681-009-0051-0.。
- 23。
张等号左边。橡胶树坐果规律与三倍体诱导:北京林业大学2013.
- 24。
卡普托D,巴隆A,弗洛桑特L. 2n马铃薯的配子:育种和种质转移的必要成分。理论与应用遗传学。2000; 101(5-6):805-13。https://doi.org/10.1007/s001220051547。
- 25。
邱传林,白永明,吕卫华,徐晓平,李勇,吕德强。利用单侧性多倍体技术提高马铃薯蛋白质含量。作物。2009;4:23-6。
- 26。
Carputo D,Barone A.通过性杂交地区土豆的倍性水平操纵。Ann Appl Biol。2015; 146(1):71-9。
- 27。
赵颖,刘文林,郑世新,肖永强。秋水仙碱诱导郁金香有性多倍体化的研究。北方园艺。2006;6:135-6。
- 28。
Zhong C,张S-N,Yu X-H,Li Y,Hou X-L,Li S-J。诱导2的研究n在大白菜中配子和性多倍化的四倍化的生产。Acta Horticulturae Sinica。2010; 37(11):001789-95。
- 29.
王X-F,Cai M,He D,Ren X-X,Wang X-Y,Pan H-T等。关于2的初步报告n中国观赏园艺研究进展:20102010.
- 30。
赖海根,陈旭,陈智,叶建强,李坤明,刘金平。雌性诱导2n通过木薯的性杂交配子和造成四倍体的创造(Manihot Esculenta).Euphytica。2015;201(2):265 - 73。https://doi.org/10.1007/s10681-014-1207-0。
- 31。
leitch ar,leitch ij。基因组可塑性和多倍体植物的多样性。科学。2008; 320(5875):481-3。https://doi.org/10.1126/science.1153585。
- 32。
三文鱼A,AINouche ML,Wendel JF。斯巴塔基纳(Poaceae)近期杂交和多倍体的遗传和表观遗传后果。Mol Ecol。2005; 14(4):1163-75。https://doi.org/10.1111/j.1365-294X.2005.02488.x。
- 33。
郑义,乔治H,Michaela M,Thomas R,Klaus FXM,Alfons G.自然遗传变异对自身传递拟拉乌拉诺血症拟南芥转录组的影响。Proc Natl Acad Sci U S A. 2010; 107(41):17809-14。
- 34。
李X,yu e,风扇c,zhang c,fu t,周Y.自身传递拟拟拟南芥的发育,细胞学和转录分析。Planta。2012; 236(2):579-96。https://doi.org/10.1007/S00425-012-1629-7.。
- 35。
张旭,邓敏,范国栋。泡桐及其同源多倍体转录组差异分析。中华医学杂志。2014;15(3):5079-93。https://doi.org/10.3390/ijms15035079。
- 36。
Harper AL, Trick M, Higgins J, Fraser F, Clissold L, Wells R,等。多倍体作物甘蓝型油菜性状的关联转录组学。生物科技Nat》。2012;30(8):798 - 802。https://doi.org/10.1038/nbt.2302。
- 37。
江j,邵y,du k,ran l,fang x,王y。数字基因表达的使用在早期几代结合的甘蓝型油菜及其二倍体祖细胞中的基因表达差异。BMC基因组学。2013; 14(1):1-11。
- 38。
胡国华,胡国华,胡国华,等。可纺棉纤维的进化需要长时间的发育和一种新的新陈代谢。公共科学图书馆麝猫。2008;4 (2):e25。https://doi.org/10.1371/journal.pgen.0040025。
- 39。
Ran H,Faigenboimdoron A,Kadmon N,Hu G,Zhang X,Gallagher JP等人。用于显影多倍体棉种子的转录组型材。植物基因组。2015; 8(1):1-15。
- 40.
Buggs RJA, Doust AN, Tate JA, Koh J, Soltis K, Feltus FA,等。黄龙杂集(菊科)的基因丢失和沉默:天然和合成的异源四倍体的比较。遗传。2009;103(1):73 - 81。https://doi.org/10.1038/hdy.2009.24。
- 41。
Chopra R,Burow G,Farmer A,Mudge J,Simpson Ce,Burow Md。使用花生(Arachis SPP)的二倍体和多倍体物种中De Novo转录组瓶子的比较。RNA-SEQ数据。《公共科学图书馆•综合》。2014; 9(12):E115055。
- 42。
戴飞,王志,罗刚,唐灿。桑树同源四倍体和二倍体的表型和转录组分析。中华医学杂志。2015;16(9):22938-56。https://doi.org/10.3390/ijms160922938。
- 43。
风扇G,王L,邓米,牛S,Zhao Z,Xu E等。使用高通量测序的自身传递体浮子泡桐植物和二倍体的变异转录体分析。Mol Gen Genomics。2015; 290(4):1627-38。https://doi.org/10.1007/S00438-015-1023-9.。
- 44。
穆赫赫兹,刘志军,林林,李海英,姜杰,刘发发。白桦同源四倍体表型变化的转录组分析。中华医学杂志。2012;13(10):13012-29。https://doi.org/10.3390/ijms131013012。
- 45。
mu h-z。桦木生长和生殖变化的转录组分析(Betula Platyphylla.同源四倍体:东北林业大学;2013.
- 46。
奥托SP,Whitton J.多倍体发病率和进化。Annu Rev Genet。2000; 34(1):401-37。https://doi.org/10.1146/annurev.genet.34.1.401。
- 47。
赖G-H。木薯2n配子:海南大学;2014年。
- 48。
陈建平:体细胞染色体数目的配子及其在同源多倍体植物进化中的作用。新植醇。2010;129(1):22页。
- 49。
Freeling M. Woodhouse M R,Subramaniam S:分馏诱变和机制中除去可分配或更少表达DNA的机制的类似后果。CurrOp植物BIOL。2012; 15(2):131-9。https://doi.org/10.1016/j.pbi.2012.01.015。
- 50.
弗拉格尔,文德尔。异源四倍体棉花物种形成过程中的进化速率变异、基因组优势和重复基因表达演化。新植醇。2010;186(1):184 - 93。https://doi.org/10.1111/j.1469-8137.2009.03107.x。
- 51.
亚当斯kl。多倍体和杂交植物中重复基因表达的演变。j hered。2007; 98(2):136-41。https://doi.org/10.1093/jhered/esl061。
- 52.
萨帕塔F, Sakurai T, Seki M, Salcedo A, Tohme MJ,等。木薯转录组的计算分析、基因发现和调控元件预测。中国计算机科学(英文版). 2008;92(9):1729-32。
- 53。
Hegarty MJ,Barker GL,Brennan Ac,Edwards Kj,Abbott RJ,Hiscock SJ。植物中杂交品种相关的基因表达的变化:中央研究中转录组研究的进一步见解。Philos Trans R SoC Lond Ser B Biol Sci。2008; 363(1506):3055-69。https://doi.org/10.1098/rstb.2008.0080。
- 54。
中林等。通过过量积累抗氧化类黄酮增强拟南芥的抗氧化和抗旱性。植物j . 2014; 77(3): 367 - 79。https://doi.org/10.1111/tpj.12388。
- 55。
哈特蒂,苏达达AG,Fidrianny I,Ginting TM。四种Zingiberaceae的四种类黄酮含量和抗微生物性质。int J Pharm Pharmaceutical SCI。2014; 6(7):142-4。
- 56。
Uarrota VG, Moresco R, Coelho B, Nunes EDC, Peruch LAM, Neubert EDO,等。代谢组学结合化学计量学工具(PCA, HCA, PLS-DA和SVM)筛选木薯(Manihot Esculenta采后根的生理恶化。食品化学。2014;161(6):67 - 78。https://doi.org/10.1016/j.foodchem.2014.03.110。
- 57。
胡伟,孔辉,郭艳,丁志强,铁伟,等。比较生理学和转录组分析揭示了褪黑素在延缓木薯采后生理恶化中的作用。植物学报。2016;7(e0136993):736。
- 58。
木薯叶片光合作用的生理、结构和转录组研究Manihot Esculenta):海南大学;2012.
- 59。
吕丽艳,曹胜,谢晓燕,曾伟东,闫海波。木薯叶片形状与SPAD值及光合特性的相关性南方农业学报。2014;45(4):558-64。
- 60.
朱y-m,罗x-l,yan g-b,风扇w-j。蔗糖合成,分布与木薯根块茎中淀粉积累的关系。桂花。2016; 12:1492-7。
- 61.
Siriwat W,Kalapanulak S,Suksangpanomrung M,Netrphan S,Meechai A,Saithong T.翻译组数据集成推断淀粉生物合成中碳的碳利用碳的优势。程序计算机SCI。2012; 11(12):96-106。https://doi.org/10.1016/j.procs.2012.09.011。
- 62.
王超,王建峰,庄楠生,王勇。木薯根尖细胞染色体扩散技术的优化。热带作物学报,2012;33(4):627-30。
- 63.
张Z-W,郑Y-Q,YE J-Q,Li K-M。木薯叶片光合特性研究。西南三国农业科学。2009; 22(2):000300-3。
- 64.
Min Y,Yao Y,Wang J,Hu X-W,Guo J-C。用扫描电子显微镜观察木薯贮藏根早期淀粉片结构和发展。J Chin Electron MicroSC SOC。2010; 29(4):379-84。
- 65。
Langmead B,Trapnell C,Pop M,Salzberg SL。超快和记忆高DNA序列对人类基因组的对准。基因组Biol。2009; 10(3):R25。https://doi.org/10.1186/gb-2009-10-3-r25。
- 66。
Kim D,Pertea G,Trapnell C,Pimentel H,Kelley R,Salzberg SL。TOPHAT2:在存在插入,缺失和基因融合的情况下,转录om的精确对准。基因组Biol。2013; 14(4):R36。https://doi.org/10.1186/gb-2013-14-4-r36。
- 67。
郭R,陈H-Z,杜y,周D-D,耿S-H,王H-P,Zhu Z-W,Shi C-Y,WAN J-Q,Xiong C-L,Zheny Y-Z,Chen D-F。基因组 - 长期非编码RNA的识别及其监管网络Apis melliferaLigustica对Nosema Ceranae感染的反应。Biorxiv 2019,Doi.org/https://doi.org/10.1101/643627。
- 68。
Trapnell C,Williams B-A,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,等。通过RNA-SEQ的转录程序组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。https://doi.org/10.1038/nbt.1621。
- 69。
ABDI H. Bonferroni和Sidak校正进行多种比较。百科全书的测量和统计。2007年:103-7。
- 70.
姚y,耿m-t,wu x-h,刘j,li r-m,hu x-w等人。Cell Wall反转酶从木薯旁边的基因组鉴定,3D建模,表达和酶活性分析(Manihot EsculentaCrantz)。J Mol Sci。2014; 15(5):7313-31。https://doi.org/10.3390/ijms15057313。
致谢
作者要感谢TopEdit (www.topeditsci.com.)在编写本手稿期间的语言援助。
资金
该工作得到了中国国家重点研发计划的财务支持(2019YFD1001105),资金机构在研究设计中发挥作用;中国国家自然科学基金(31760408,31671767),资金机构在研究设计和稿件中具有作用;资金机构的现代农业工业技术研究系统(No. Cars-11-Hngjc)的专用基金在研究设计中发挥作用;中国热带农业科学院中央公开兴趣科学机构基础基金(1630052020009,1630052020010),资金机构在数据收集和分析中发挥作用。
作者信息
隶属关系
贡献
通过XC,HG-L,JC-G和XW-H构思该研究。XC起草了手稿。XC,HG-L和RM-L同样贡献,并对Cassava性四倍体表征进行了大部分工作。YY和RM-L负责转录组数据的映射。XC,HG-L,YY,RM-L和JL负责分析差异表达基因。XC,HG-L和SY也参与表型测量和多倍体筛选。HG-L和SP-F提供了关于木薯性四倍体表征的建议。RM-L为转录组数据分析提供了建议。YY,XC和HG-L设计了Cassava性四倍体表征和转录组分析的实验。XC和HG-L参与手稿编辑。 All authors read and approved the final manuscript.
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
陈,X.,Lai,H.,Li,R.et al。木薯性四倍体的角色变化和转录组分析。BMC植物BIOL.21,188(2021)。https://doi.org/10.1186/s12870-021-02963-1
已收到:
公认:
发表:
关键字
- Manihot Esculenta克兰特
- 性四倍体
- 字符
- 转录组
- 差异表达基因