抽象的
背景
通过间隙杂交和基因组倍增技术,使人工合成八倍口油菜籽双倍单倍体(DH)感应系Y3380和Y3560。DH诱导生产纯线条提供了前面实现纯合子的新方法B.Napus..以前,诱导机制,以及诱导是否具有明显的母体基因型差异,到目前为止还不知道。
结果
在本研究中,不同的核基因和细胞质基因型B.Napus.用以前报道的DH诱导剂Y3380和Y3560授粉。我们的研究提出了不同细胞质基因型杂交的精细比较,以阐明DH诱导的机制。诱导型油菜的倍性鉴定、育性及SSR标记分析1结果表明,诱导的F1植物与母系类型一致,而不是父系类型。SNP芯片分析表明,当母质基因型相同时,DH诱导剂的诱导效率受核基因的影响。而当核素相同时,DH的诱导效率也受细胞质基因型的影响ogura细胞质显示出高频诱导物基因杂交或低频渗透。
结论
诱导效果受母体核苷酸和细胞质基因型之间的相互作用的影响,并且子种体染色体的部分杂交结果表明诱导过程可归因于父系染色体的选择性消除。本研究为探索DH诱导者的机制提供了基础B.Napus.,并提供了用于在分子育种中使用诱导剂的新见解。
背景
芸苔栗鸟(AACC,2N = 4×= 38)是源自的同种异体一种百倍植物芸苔酱油(AA,2n = 20)和Brassica oleracea(CC, 2n = 18)通过种间杂交和染色体自然加倍,大约发生在7500年前[1那2].繁殖B.Napus.品种已经赞赏利用主要包括不同技术方法的杂种物。托马马细胞质无菌(波尔CMS)和ogura细胞质无菌(oguCMS)。在成功应用微孔文化之前B.Napus.,纯线用于通过多代自行实现[3.那4.那5.]但是养殖周期很长。虽然分离的微孔培养可以加速育种循环,但它受到基因型和环境温度等许多因素的限制[6.那7.那8.].菜籽科学家热衷于发现,比孤立的微孔培养更简单,更高效的技术,可以快速有效地获得纯粹的线条B.Napus.?近年来,从玉米中衍生出了体内单倍体诱导系股票6.[9.[介导的单倍体感应线拟南芥Cenh3.基因已成功应用于玉米[10], 大麦 [11,和大米[12].玉米单倍体感应基因zmpla1.[13),拟南芥基因Cenh3.[14那15那16]已应用于小麦,并已实现单倍体诱导。此外,大麦球茎法和玉米花粉远距离授粉在小麦中也实现了单倍体诱导,诱导率约为20-45% [14].通过与孤立的微孔培养的单倍体交叉引起的纯线更容易。最近的一项研究报告,其中一个异种情况B.Napus.用allo-octaploid强奸(aaaacccc,2n =8x≈76)交叉[17]和两个异源八倍体油菜诱导母本产生双单倍体(DH)的功能,命名为DH诱导系B.Napus.: Y3560及Y3380 [18].SSR分子标记、植物倍性和形态鉴定结果表明,黄花蓟马的植株比例较高1代数与母本相近,诱导效率为34.09% ~ 98.66%。是什么导致了感应效率的巨大差异?不同母质基因型的诱导效果不同B.Napus..诱导效率是否与母本细胞质基因型有关?因此,在本研究中,我们以DH诱导系为父本对三种类型的水稻进行授粉波尔那ogu和午睡观察了诱导后代的细胞质、倍性、表型和基因型。采用SNP分析评价亲本细胞质效应的关系。本研究为DH系的应用奠定了基础,并有助于了解母体核型和细胞质基因型效应。
结果
倍增分析
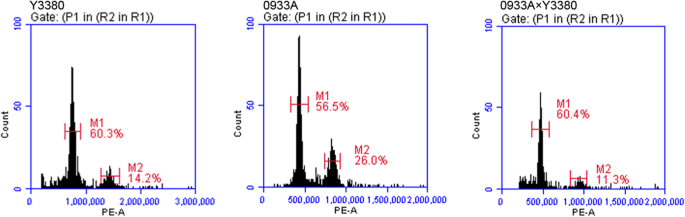
高倍倍增性和低倍倍增性之间的杂种的后代容易容易发生中倍性[19].为了了解诱导前后的倍性水平是否存在差异,我们选择了不同的B.Napus.诱导F.1和四倍体B.Napus.用作控制的ZS11。倍增性的检测结果如下给出(图。1,附加文件1,附加文件2).f的荧光强度1通过授粉Y3560和四个产妇父母获得的一代约409.5〜510.5d千行。f的荧光强度1用五个产妇父母授粉的Y3380的产生约为398.9〜521.1d千条线,检测结果与控制混合后代的423.1〜487.7d千条线几乎相同。我们还测试了授粉孕产妇父母和DH诱导者的倍性倍性。母体植物的荧光强度范围为406.9〜502.1d千条线,所有这些都是四倍体。虽然,诱导剂的荧光强度约为753.2〜852.5d千条线,其比ZS11(对照)高出两倍,因此诱导剂是八倍体。在这项研究中,我们选择了八磅油菜籽DH系作为父母父母并与四倍体交叉B.Napus..发现后代的倍增性是母体倍性(四倍体)的一致性。为了找到八大单三倍体交叉的初步说明,产生四倍体促使我们研究八倍体父母父母的父母可能发挥诱导或部分染色体杂交效应的研究如何?
植物形态与生育调查
在之前的研究中,我们发现诱导F1代植株与母本相似,但部分代植株的育性发生了变化。因此,对诱导的F1观察到生成植物以研究DH诱导的影响。生育和植物形态研究(图。2,附加文件3.F的)1表明,大多数植物都是无菌的,而只有少数是肥沃的。无菌线被DH诱导型线(父母母体)授粉,而肥沃植物的植物的含量没有明显与母体父母的明显差异,除了花形态学。父母Y3560,Y3380和诱导F的生育鉴定1遵循额外文件3..纯合和稳定波尔0068A,0933A和D717A的CMS用作母体母体并与Y3560交叉,结果分别在其后代发现六个,两种肥沃的植物。在f中只发现了一个肥沃的植物1,当Y3380用作父母父母和纯合时波尔以CMS 0933A为母本。在F中没有发现肥沃的植物1当Y3380与L0068A和L0933A交叉时作为母体父母。同时,通过用不同的母体父母交叉ZS11作为父母的父母交叉ZS11而开发了杂化后代,并且所有产生的后代产生的后代是半无菌或无菌的。生育率鉴定结果表明,来自父母父母Y3560和Y3380的诱导后代,肥沃的植物出现在后代波尔CMS,当它用作母体父母的概率为2.22至30.00%。其中,在D717A×Y3560中发现0068a×Y3560的概率最高(30.00%),而最低(2.22%)。肥沃植物的诱导波尔CMS母本可能与Y3380和Y3560的杂交亲和性有关波尔细胞质恢复基因。根据肥沃植物的概率,估计Y3380和Y3560的诱导率从70〜100%变化,表明诱导线的诱导效果可能受母体核型和细胞质类型的影响。
SSR分子标记的扩增和F的SNP芯片分析1感应线
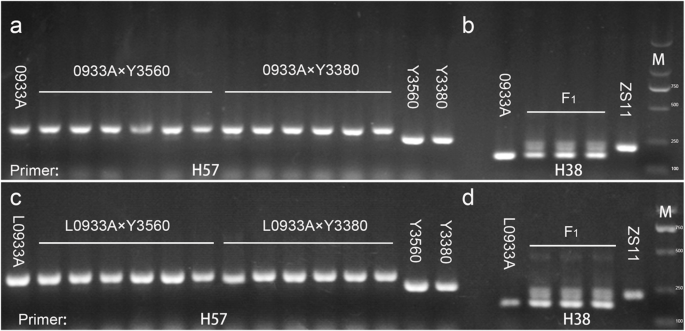
自F的形态和倍数1诱导后的代植株与母本一致,但是否存在基因型差异尚不清楚。首先,利用600对SSR引物寻找亲本和母本及其后代之间的多态性(图。3.,附加文件4.,附加文件5.).以Y3560为亲本,用0068A扩增3对特异性引物;4对特异性引物分别扩增出0933A和L0933A。这些特异性引物也被扩增到他们的后代,以揭示基因型多态性。SSR标记的扩增结果表明,诱导F1生成植物与母体带式一致,没有父母或杂合带型。同时,结合现场生育率调查,M1-1,M1-8和M1-9,0068A×Y3560的后代初步判断为诱导植物。虽然对于Y3380,用L0068A扩增三对特异性引物,用0933A和L0933A扩增了五对特异性引物,扩增结果表明,除了L0068A×Y3380后代M4-5,M4-5还揭示了杂合带型。剩下的后代虽然显示母体带式。当使用Zs11父母父母,并且在每个母体父母中扩增2-3对特异性引物。引物的扩增显示,后代含有双父母的带类型,因此都是杂交植物。由于多晶态引物不足,因此应使用覆盖全基因组中更多标记位点的SNP芯片分析来验证每个组合的后代是纯合或杂合子诱导的植物。鉴于倍增性,形态和SSR分子标记鉴定不会产生精确的结果,选择62株植物6 K SNP芯片分析(附加文件6.).SNP位点纯合率和母体遗传相似性的结果在附加文件中给出7.,亲本的纯合率为97.93% ~ 99.29%。这一较高的纯合子率接近ZS11(99.16%),说明这7个亲本几乎是纯合子。F1杂交为63.73%〜68.74%和基因分型(图。4.D,附加文件9.c,额外的文件10e)还表明这些后代是f1由zs11产生的杂交种作为父母父母。同时,一些f的纯合率1诱导后的植物从56.39%〜78.87%和基因分型范围(图。4.得了,附加的文件9.a - b,附加的文件10A-D)用于识别F.1作为杂种或部分染色体杂交后代。剩余单株植物中的纯合SNP位点的速率范围为98.48%〜99.33%。基因分型(图。4.得了,附加的文件9.a - b,附加的文件10答案:d1纯植物。因此,对不同单株间纯合子率的分析表明,以DH系为父本时,纯合子率为60%左右的后代为杂交后代,而纯合子率为> 95%的后代为诱导后代。随后,我们分析了母本与62 (F1)植物,并计算母体父母与其F之间的遗传相似率1的后代。杂交后代与母本的遗传相似率为64.64% ~ 68.74%,而诱导纯合子单株与母本的遗传相似率高达99.33%。由此证实了DH诱导剂的诱导不是普通的杂交,而F1产生的代为与母本相同的纯合子后代。
一些父母和F的SSR引物的扩增结果1个体植物。一种:扩增父亲诱导线(作为父母母体),0933A(作为母体母体)和诱导的后代,0933A×Y3560后代的SSR特异性引物H57,从左到右,是M31-1,M31-2,M31-5,M31-7,M31-8,M31-12;0933A×Y3380后代,从左到右是M30-1,M30-2,M30-3,M30-6,M30-10,M30-11。B.:特异性SSR引物H38在亲本和杂交后代(0933A × ZS11)中的扩增。CSSR特异引物H57在父系诱导系(为父本)、L0933A(为母本)及诱导后代(L0933A × Y3560)中扩增,从左到右依次为M35-1、M35-7、M35-9、M35-10、M35-12、M35-14;L0933A × Y3380的子代,从左到右依次为M34-1、M34-2、M34-3、M34-5、M34-6、M34-9。d:特异性SSR引物H38在亲本和杂交后代(L0933A × ZS11)中的扩增。从相同的实验中导出的样本和全长原始凝胶包含在附加文件中5.
基因分型在感应过程中揭示了患者染色体杂交和渗透
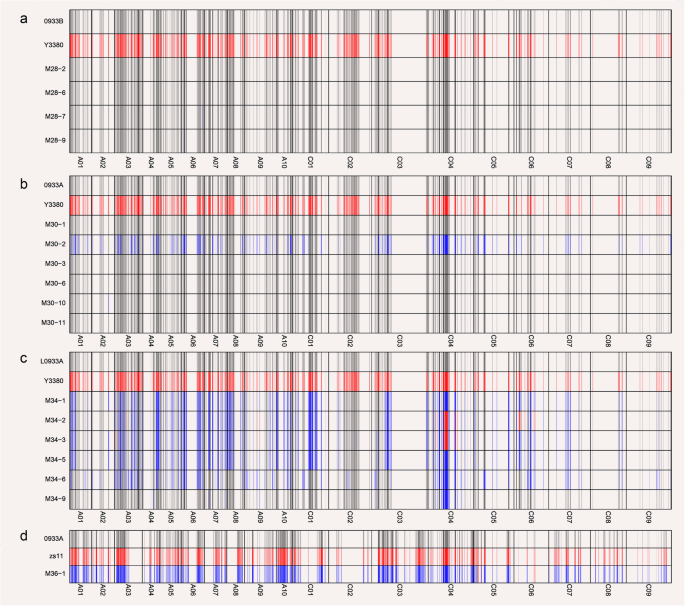
为了更好地了解诱导过程中的父系染色体杂交和浸润,我们筛选了纯合子SNP位点,并通过基因分型揭示了后代的SNP位点(图2)。4.,附加文件9.,附加文件10,附加文件11).亲本差异中纯合子SNP位点的数量为873 ~ 1227个1, 图。5.一个,附加文件11).以母体母体0933为例,与混合组合0933A×ZS11相比(图。4.d)显示出97.91%的杂合度,当0933B时(图。4.a)和0933a(图。4.B)为母本,诱导后代的基因型与母本一致。杂种后代亲本基因杂交率为33.84% ~ 44.26%,亲本渗透率为0.09 ~ 0.19%。当L0933A(无花果。4.c)为母本,杂交后代的检出率为37.87% ~ 53.03%(表2)1)父系基因杂合度为0.09% ~ 0.18%(表1)父亲的基因渗入。这些结果表明,诱导效率受细胞质基因型和杂交的影响ogu当核苷酸相同时,细胞质基因型更容易发生母体母体。当细胞质基因型是波尔(0068A, 0933A, D717A), 0068A的后代(33.82% ~ 47.10%)1)更有可能与父代杂交;当细胞质类型为午睡(0933B,D717B),D717B的后代(24.84%〜42.86%)(表1)最有可能渗透父母基因。虽然,细胞质基因型是ogu(L0933A,L0933A更容易与父母父母交换或交换L0933A,更容易在C-Genome上(图。5.b),表明当细胞质基因型相同时,诱导效果受母体母体核基因型的影响。总之,诱导效率受母体核型和细胞质基因型的影响,以及核型>细胞质基因型的影响。
诱导系与母系核基因互作效应分析
由于母系核基因和细胞质基因型共同影响诱导效率,诱导物杂交和浸润位点是否随机尚不清楚。基于SNP在基因分型中的比较(表1, 图。5.a),发现杂交后代(以ZS11为父本时)除个别位点被父本渗透外,SNP位点均为杂合子,杂合率为96.48% ~ 99.19%(表2)1, 图。5.a),父亲渗透率为0.54%〜3.34%(表1, 图。5.a).而以诱导剂为父本,虽能产生杂种后代,但杂种后代杂合率仅为29.78% ~ 64.52%(表2)1, 图。5.a),大多数网站与母体父母的网站相同。随后分析所在杂交位点的染色体发现,当ZS11是父母父母时,杂交主要发生在C基因组的CO 3和CO 4染色体上,杂合率高达99.2%〜100%(额外的文件12);当诱导剂用作父母父母时,尽管类似地,它主要发生在C基因组的CO 3和CO 4染色体上,但杂交后代CO 3和CO 4上的杂合率为28.1%〜68.14和30.71%〜86.2%(附加文件12),显著低于正常杂交水平。因此,用诱导剂作父本所产生的杂交不是普通的杂交。
同时,分析了患者渗透位点的染色体(图。5.B-C,附加文件13).0068和0933具有类似的遗传背景(来自同一个父母的一部分)并用作母体父母,作为父母父母的诱导剂,父母基因的浸润更可能在C基因组的CO 4和CO 6染色体上(图。5.b);而当ZS11为父本时,父本浸润的位点主要在c基因组的C05和C06染色体上,且诱导剂的父本更易发生浸润(图2)。5.c).然而,由于C06染色体上的位点基本相同,因而消除了C06染色体上的穿透位点(图6)。5.B-C,附加文件13),并推出DH线更有可能导致父母基因渗透到C基因组的CO 4染色体上。在正常杂交期间患者渗透期间,在CO 5染色体上更可能发生。当母体父母是D717时,诱导症的父母浸润部位更可能出现在C基因组的C07染色体上,而ZS11的染色体主要在A06染色体上和C的CO 6染色体上基因组。总之,对父亲交叉和浸润部位的分析表明,DH诱导剂与母体karyogene具有相互作用效果,并且在不同基因组上具有偏差。
讨论
油菜DH诱导系的诱导效果
玉米单倍体诱导系诱导母株产生单倍体时,母株基因型影响明显,诱导效率为2 ~ 15% [20.那21],还有约2%的父亲基因渗透现象,以及吗?Bassica显著DH诱导系有类似情况尚未见报道。在本研究中,两种DH诱导剂系B.Napus.,Y3380和Y3560用于用不同的细胞质基因型授粉母体父母,并使用多种方法进行鉴定(附加文件14).鉴定方法反映了诱导杂交、可育后代、SSR标记杂合子后代和SNP检测杂合子后代的效果一致,表明检测结果完全可靠。结合这些试验结果,发现诱导体系对不同基因型的诱导效果不同芸苔栗鸟.当核基因相同时,诱导差异主要受细胞质基因型的影响。在相同的细胞质基因型中,诱导差异主要受核基因的影响。因此,DH诱导剂系的诱导过程与母系核基因和细胞质基因型存在互作效应。同时还发现,诱导的F基因SNP位点的遗传相似率与SNP位点的纯合子率之间存在极显著的正相关关系1生成和父代(附加文件7.),如f10068A×Y3560和母体母体遗传相似性为99.79%,但其SNP位点纯合率和母体SNP位点分别为98.79,98.79,97.93%的纯合率(附加档案7.);F10933A×Y3560的遗传相似性为98.86%,母体父母,但其SNP位点纯合率为99.23%,而母体母体SNP位点纯合率为98.27%(附加档案7.).它表明,DH诱导型线可以使纯合的父母无限更接近纯合。此外,F的父母父母基因中存在一些杂合性1杂合度变化较大,为0.09 ~ 64.52%1).对于诱导的后代,一些个体植物还将具有少量的父母基因浸润(0.09-0.18%)。在诱导的后代,所有的波尔CMS和午睡细胞质中没有父系基因的浸润,而在诱导后代中oguCMS作为母本,DH诱导剂基因的渗透频率低,杂交频率高。(无花果。5.一张桌子1).这些结果表明,当母本含有DH诱导剂时,DH诱导系基因更有可能渗透到后代中ogu诱导细胞质。
DH诱导系诱导机理分析
在玉米等植物中,已经探索了诱导体内诱导植物产生单倍体或双单倍体的研究[22那23那24],芸苔栗鸟[17那18],波斯核桃[25].但DH诱导系的诱导作用机制尚不清楚,一般认为单亲本染色体消除[14那26那27Xu等人在玉米中发现诱导剂基因渗透到单倍体中[28证实了玉米单倍体诱导过程中发生了双受精,表明染色体消除是玉米单倍体诱导的基础;赵等人[24研究发现,在授粉后7天内,诱导系的大部分染色体都从细胞中排出,在单倍体后代中还发现了约44 Mb的父本染色体片段,进一步证实了染色体浸润现象。Kasha等人[29]发现在大麦中授粉后可以获得具有两组亲本基因组的杂种[30.]但是之球体染色体后不久将选择性地丢失[31].Burk等人通过远缘杂交产生烟草单倍体[32].因此,根据单倍体感应线的机制调查结果,这类似于我们的研究结果B. Napus.DH诱导物。
在该研究中,Allo-Octoploid Y3380和Y3560用于四倍体的授粉B. Napus.,并且后代是四倍体。除生育外,产后几乎与母亲父母几乎相同,但与父母的父母显着不同。从基因分型结果(表1),ZS11的SNP杂交速率为父母母体杂种率超过96.48%,产妇母体浸润率为0.19%〜0.27%。并且使用诱导剂作为父母父母,SNP杂交率最高率为64.52%,最低为0%,母体母体浸润率为35.39%〜100%,表明即使诱导剂和产妇父母之间存在杂交,它不是一般交叉,而是部分染色体或诱导剂和母体之间的基因交叉。因此,我们推测了双倍单倍体诱导的原因芸苔栗鸟也可以是选择性消除诱导剂染色体。与母体母体的染色体或大片段交叉的一小部分可能是由诱导剂的不完全或部分染色体丧失引起的。少量诱导物基因在后代的浸润可能是由基因交换引起的。需要进一步的研究来确定Y3560和Y3380的诱导机制是否与一些特定基因有关。
DH诱导剂的应用芸苔栗鸟繁殖
基于上述研究成果,由于杂交孕产妇染色体或基因渗透DH诱导物(但基因型与母体核基因是高度一致的,产妇渗透速率为90.44到99.91%),这些情况可能略有改变母体遗传特征,和整体一致性,特别是对于相同的核基因和不同的细胞质母本,杂交和基因浸润有很大的不同。我们大胆预测,DH诱导剂可以为创新提供一种新的模式B. Napus.种质资源。创新的种质资源来源于DH诱导剂特异基因的渗透,田间观察发现在诱导剂诱导过程中出现了紫叶突变ogu胞质B. Napus.(父母没有紫色特征)(图。2c).推测诱导基因片段或转座子在诱导过程中渗透,导致母本某些功能的获得。因此,诱导剂基因的渗透使植物获得一定功能的现象可以应用于油菜种质资源的开发,寻找深入的特殊位点,并在特定位点对母体基因进行修饰。油菜DH诱导剂的应用可以加速和改变油菜育种模式,为种质资源开发创造新思路,具有巨大的应用潜力和实用价值。
结论
本研究探讨了两个双单倍体诱导系的诱导特性B. Napus..结果表明,当诱导系作为父本与母本授粉时,杂交后代表现出父本基因的异质性杂交;部分诱导后代植株存在少量父系基因浸润。并且根据母本类型的不同,在诱导上也存在差异。当核基因相同时,诱导差异主要受细胞质基因影响;当细胞质基因相同时,诱导差异主要受核基因影响。诱导系的诱导过程与母系基因型和细胞质型相互作用。利用这种互动效应为创新提供新的见解B. Napus.种质资源。
方法
材料
DH诱导型线,Y3380和Y3560(AAAACCCC,2N =8X≈76)是2011年成都农业和林业科学院人为育的新草食品种[18].经细胞学和流式细胞术鉴定为异源八倍体,作为亲本。而维修线路0933B和D717B (午睡细胞质基因型)作为母本。这些母系与四倍体自交系杂交15代以上。的波尔CMS线(0068A,0933A,D717A)和ogu将具有四倍体数量的染色体数(AACC,2N = 38)的CMS(L0068a,L0933a)进行了转染到12-15代的维护系。所有类型的孕产妇父母(维护系列,波尔CMS和ogu在该实验中使用的CMS具有相同的karyogene,并且对于细胞质基因型不同(附加文件8.).收集和繁殖B. Napus.材料获得并经中国种质资源管理部门地方许可使用。的B.Napus.本研究中使用的作物一般为油料作物,被认为是中国的本地种,不属于名古屋议定书的范围。2016年10月,在中国成都温江(E103.83, N30.70)试验田相同条件下,种植ZS11(对照)、不育系、保持系和诱导系等植株材料。这些材料于2017年3月花期人工授粉,混打收获。为避免统计误差,所有试验材料及其杂交种均按三重栽培。2018年10月,所有种植材料最初在苗圃盆栽中培育,随后移栽到田间。
流式细胞术
我们每种特定植物材料的15种植物的幼叶是通过先前公布的协议随机选择并用于流式细胞术分析[33].ZS11作为父母的父母患者1代(母本)和随机选取的3个品系进行检测。
诱导后代的株型及育性鉴定
根据无菌系的特征,使用生育能力作为标记特征,用于识别该领域的人工观察。其中,肥沃的植物具有满粉和正常的花粉,而无菌线根据不同类型的植物显示不同的特性。形态学波尔CMS植株与可育植株无显著差异,但花药萎缩,无花粉或低温下花粉含量少[34].的雄蕊oguCMS与未产生正常花粉的薄粉分化。我们鉴定了植物类型,并计算了每个F的肥沃植物的数量1生成和拍照。
DNA提取及PCR扩增
采用CTAB法提取叶片总基因组DNA。新鲜叶子在液氮中快速研磨,加入900 μl CTAB提取物,水浴加热45分钟,然后放在摇床上(80 rpm)搅拌15分钟,搅拌均匀。12000 rpm离心10min,抽吸上清液,加入等体积预冷异丙醇,置冰30min。所有样品12000 rpm离心5 min, 70%无水乙醇洗涤2次,100 uL ddH2O溶解,最后0.8%琼脂糖凝胶电泳检测DNA质量。PCR反应程序为94°C for 4min, 94°C for 30s, TM30s, 72°C for 45s, 72°C for 8min, 35个循环。琼脂糖凝胶电泳检测。
SNP芯片分析
我们使用了6k Infinium SNP芯片,它均匀地分布在油菜基因组中(附加文件15),鉴定和分析后代中亲代基因位点。的基因组B.Napus._v4.1(http://brassicadb.org/brad/datasets/pub/Genomes/Brassica_napus/)作为参考。SNP位点质量控制DQC≥0.82,CR≥95。最终筛选出有用多态性SNP位点3816个,占标记位点总数的75.44%。利用相关软件对这些位点进行分析,比较各基因位点的纯合率和亲本的遗传相似率。使用Power Maker V3.25软件计算母本遗传距离。遗传相似率的计算公式为S = Nxy / Nx + Ny (Nxy为两个样本中相同的基因型,Nx和Ny分别为X和Y样本中的基因型数)。SNP基因分析是基于不同授粉组合的SNP位点进行的,这些组合对亲本来说是纯合子的。利用R studio进行基因分型,测定后代相同位点的SNP位点(附加文件)11).如果后代的SNP条带状图案与父母父母的SNP条带状图案相同,则判断它被渗透并与母体父母一致。虽然,如果在后代发现的杂交带类型比父母基因型在后代发现,则判断SNP。6 K芯片检测由中国金色标志生物有限公司完成(附加档案6.).
可用性数据和材料
支持本文结论的数据集包含在文章及其附加文件中。
参考
- 1.
王旭东,刘胜,唐华,等。新石器时代后的早期异源多倍体进化芸苔栗鸟油籽基因组。科学.2014, 345(6202): 1255。
- 2.
霍利斯特JD。多倍性:对基因组环境的适应。新植醇。2015;205(3):1034 - 9。https://doi.org/10.1111/3ph.12939..
- 3.
Charne DG,Pukacki P,Kott Ls,Beversdorf Wd。在油菜籽(Brassica Napus L.)中分离的幼儿孢子中冷冻保存后的胚胎发生。植物细胞批准。1988; 7(6):407-9。https://doi.org/10.1007/BF00269524.
- 4.
风扇Z,Armstrong KC,Keller WA。甘蓝型油菜植物中体内和体外孢子的研制。1988; 147(2-3):191-9。https://doi.org/10.1007/BF01403347.
- 5.
甘蓝型油菜花粉诱导单倍体植株的研究。Z Pflanzenphysiol。1982;105(5):427 - 34。https://doi.org/10.1016/s0044-328x(82)80040-8.
- 6.
顾赫,哈伯格P,周WJ。冷预处理增强了油菜油菜中的微孔胚胎发生(Brassica Napus L.)。植物生长调节。2004; 42(2):137-43。https://doi.org/10.1023/B:GROW.0000017488.29181.fa.
- 7.
Lionneton E,Beuret W,Delaitre C,Ochattm S. Rancillac:改善的微孔培养和棕色调味品芥末(Brassica Juncea)中的双倍单倍体植物再生。植物细胞代表2001; 20(2):126-30。https://doi.org/10.1007/S002990000292..
- 8.
MLLERS C,IQBAL MCM,RBBELEN G.高效地生产PICOROWERS的COLCHICINE治疗双倍单倍体芸苔植物。Euphytica。1994年; 75(1):95-104。https://doi.org/10.1007/BF00024536.
- 9。
Lashermes P,Beckert M.玉米母体单倍体遗传控制(Zea Mays L.)和单倍体诱导线的选择。理论苹果类型。1988; 76(3):405-10。https://doi.org/10.1007/BF00265341.
- 10。
钟春霞:玉米着丝粒反转录因子和卫星与玉米着丝粒蛋白CENH3相互作用。植物细胞。2002;14(11):2825 - 36。https://doi.org/10.1105/TPC.006106.
- 11.
Sanei M,Pickering R,Kumke K,Nasuba S,Houben A.来自Centromeres的焦化组蛋白H3(CENH3)的丧失在三种染色体中消除了三种斑杂种。PROC NATL ACAD SCI。2011; 108(33):13373-4。
- 12.
张涛,张伟,吴勇,杨震,等。封面:PNAS +: CentO卫星提供水稻着丝粒中cenH3核小体的翻译和旋转相位。中国科学(d辑:地球科学)2013;110(50):E4875-83。https://doi.org/10.1073/pnas.1319548110.
- 13.
Chenxu L,Xiang L,Dexuan M,Yu Z,Chen C,Xin D等人。在编码推定的磷脂酶A中的Zmpla1的4-BP插入产生玉米中的单倍体诱导。莫尔植物。2017; 10(3):520-2。
- 14.
Ravi C. Swl:由着丝粒介导的基因组消除产生的单倍体植物。大自然。2010;464 (7288):615 - u180。https://doi.org/10.1038/nature08842.
- 15.
Karimi-Ashtiyani R,Ishii T,Niessen M,Stein N,Andreas H. Point突变损害焦化CenH3装载和诱导单倍体植物。Proc Natl Acad Sci U S A. 2015; 112(36):11211-6。https://doi.org/10.1073/pnas.1504333112.
- 16.
Britt AB,Kuppu S. Cenh3:单倍体感应技术的新兴球员。前植物SCI。2016; 7:357。https://doi.org/10.3389/fpls.2016.00357.
- 17.
杨立勤,张振东,李轩,梁军,李宇,等。异源四倍体全基因组复制芸苔栗鸟自我授粉后代产生新颖的特征和广泛的倍性变异。G3..2020; 10:3687-99。
- 18.
付松,尹龙,徐敏,李艳,王敏,杨军,等。甘蓝型油菜和异八倍型油菜间倍体杂交的母系加倍单倍体产量。足底。2018;247(1):113 - 25所示。https://doi.org/10.1007/S00425-017-2772-Y..
- 19。
从进化到新植物发育的多倍体。Researchgate。2006;56:137-42。
- 20.
COE E. H:具有高单倍体频率的玉米线。我是nat。1959; 93(873):381-2。https://doi.org/10.1086/282098.
- 21。
Eder J,Chalyk S.在玉米体内单倍体诱导中。理论苹果类型。2002; 104(4):703-8。https://doi.org/10.1007/S00122-001-0773-4.
- 22。
李丽,徐旭,金伟,陈松。高油诱导玉米单倍体DNA渐渗的形态学和分子证据。足底。2009;230(2):367 - 76。https://doi.org/10.1007/s00425-009-0943-1.
- 23。
邱F,梁Y,Li Y,Liu Y,Wang L,Zheng Y.玉米单倍体诱导体内染色体随机消除的形态学,细胞和分子证明。目前的植物生物学。2014; 1(c):83-90。https://doi.org/10.1016/j.cpb.2014.04.001.
- 24.
Xin Z,Xu X,谢H,陈S,金W.玉米单倍体诱导患者交叉施肥和发十进染色体消除。植物理性。2013; 163:721-31。
- 25.
Sadat-Hosseini M,Vahdati K,Lotfi M,Hassani D,Pirvali Beiranvand J. Persian核桃通过丙烷辐照花粉诱导的单性发生器生产单倍体。J AM SoC园艺SCI AM SoC园艺SCI。2011; 136(3):198-204。https://doi.org/10.21273/jashs.136.3.198.
- 26.
陈志强,陈志强,陈志强,等。染色体消除的单倍体化研究进展。植物学报1981;67(1):421。
- 27.
Kim S,Armstrong K,Fedak G,Ho K,Park Ni。来自稻瘟病真菌(MagnaportheGrisea)的微卫星序列区分了杂交植物中的Hordeum Vulgare和H. Bulbosum的Centromeres。基因组。2002; 45(1):165-74。https://doi.org/10.1139/g01-129.
- 28.
徐X,Li L,Dong X,Jin W,MA E,Chen S.Cametophytic和Zygotic选择通过体内诱导玉米孕产妇单倍体的分离畸变。J Exp Bot。2013; 64(4):1083-96。https://doi.org/10.1093/jxb/ers393.
- 29.
KAHA KJ,KAO KN。大麦(Hordeum Vulgare L)的高频单倍体生产。自然。1970; 225(5235):874-6。https://doi.org/10.1038/225874A0.
- 30.
humphreys mw。Hordeum Vulgare X H. Bulbosum杂种中的染色体不稳定性。染色体瘤。1978; 65(4):301-7。https://doi.org/10.1007/BF00286410.
- 31.
利用单亲本染色体消除生产大麦双单倍体。植物学报。2011;104(3):321-7。https://doi.org/10.1007/S11240-010-9856-8.
- 32.
Burk Lg,Gerstel du,Wernsman EA。尼古利亚娜塔塔巴蟾蜍L.的母体单倍体。科学。1979; 206(4418):585。https://doi.org/10.1126/science.206.4418.585.
- 33。
高平J,堂兄A,尼尔森MN,西华。利用流式细胞术提高甘蓝型油菜双单倍体小孢子培养效率。植物细胞组织器官培养。2011;104(1):51-9。https://doi.org/10.1007/s11240-010-9803-8.
- 34。
广东Y,廷东F.甘草骨质母菌在芸苔豆腐植物品种的遗传。2010; 104(2):121-4。
确认
所有作者都感谢实验室成员寻求帮助,建议和讨论。所有作者都感谢编辑和裁判员,以便他们有价值的评论,以改善稿件。
资金
这个工作是由三个经费,包括国家重点研发项目(2016 yfd0101300),也支持诱导物的育种Y3380 Y3560,四川油菜育种计划在13日五年计划期间,已支持雄性不育系的选育,维护者。四川省创新团队计划项目,四川省重大科技计划项目(2018NZDZX0003),支持植物倍性和分子标记的鉴定。以及成都应用技术研发计划,该计划支持SNP芯片分析。
作者信息
从属关系
贡献
SHF,SXG和WZ,设计了实验。YTM,ZDZ,LJH,AA,XL,YZ,YL,PZX,JY,ZL,HRS,JSW,WZG,QZ,LRT,ZMK,RT,ZJZ和ZL进行了实验。WZ写了稿件。AA和SHF编辑了稿件。所有作者都阅读并批准了其内容。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1。
诱导线Y3560,母体母体0068a和诱导后代流式细胞术图。
额外的文件2。
流式细胞术结果统计。用荧光强度计算强奸倍率,峰值范围表示流式细胞仪的有丝分裂G1相的荧光信号值。在相同的倍率下,每种材料的荧光信号值存在一些差异,并且倍率之间的荧光信号值存在显着差异。
额外的文件3。
生育率鉴定结果。
额外的文件4。
一些父母和F的SSR引物的扩增结果1个体植物。A:扩增父亲诱导线Y3560(作为父母父母),0068A(作为母体父母)和F中的SSR特异性引物H571子代,0068A × Y3560子代,从左到右分别为M1-1、M1-2、M1-3、M1-8、M1-9、M1-10;SSR引物H172在亲本和杂交后代(0068A × ZS11)中扩增。b: SSR特异引物H57在父系诱导系Y3380(父本)、L0068A(母本)和F中扩增1左右左右的后代,L0068A×Y3380左右是M4-3,M4-4,M4-5,M4-9;父母和杂交后代特异性SSR引物H172的扩增(L0068A×ZS11)。C:在父亲诱导线(作为父母母体),D717a(作为母体父母)和f中的SSR特异性引物H57的扩增1后代D717A×Y3560后代,从左到右的是M39-2,M39-4,M39-6,M39-8,M39-13;D717A×Y3380后代,从左到右是M38-1,M38-2,M38-5,M38-9。D:在父母和杂交后代的特异性SSR引物H38的扩增(D717A×ZS11)。从相同的实验中导出的样本和全长原始凝胶包含在附加文件中5..
附加文件6。
6 K SNP芯片原始数据。
额外的文件7。
SNP纯合子率和遗传率。
附加文件8。
测试材料的信息。相同数量的材料代表相同的核基因,“A”代表不育系,“B”代表保持系,用15代保持系回交得到pol CMS,用12代保持系回交得到ogu CMS,只有细胞质基因型差异。但0068和0933有相似的来源。收集和繁殖芸苔栗鸟我们使用的材料在中国获得了当地许可,这符合国家政策。的芸苔栗鸟本研究中使用的是中国本土常见的油料作物,不属于名古屋议定书。
附加文件9。
0068诱导前后的基因分型图。a-c:分别为0068A × Y3560、L0068A × Y3380、0068A × ZS11诱导前后的亲本和后代的基因分型图,编号为M的条带为后代植株。
额外的文件10。
D717诱导前后诱导线的基因分型图。A-E:用于诱导D717A×Y3560,D717A×Y3380,D717B×Y3560,D717A×Y3380,D717A×Y3380和D717A×ZS11之前和之后的父母和后代的基因分型图。该数量中的频带是后代植物。
额外的文件11。
基因分型原始数据。
额外的文件12。
统计杂种F1的一代。
额外的文件13。
F1一代父母潜水的SNP网站。
额外的文件14。
不同识别方法鉴定结果的统计。
额外的文件15。
SNP位点分布图。这些蓝点代表了中染色体A01-A10和C01-C09上SNP位点的分布芸苔栗鸟.6 k(总5127个位点)SNP芯片在19染色体上很好地分布。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张,W.,MA,Y.,Zhu,Z.等等。母体karyogene和细胞质基因型影响双倍单倍体诱导剂的诱导效率芸苔栗鸟.BMC植物杂志21,207(2021)。https://doi.org/10.1186/s12870-021-02981-z
收到了:
公认:
发表:
关键词
- 双单倍体诱导物
- 父亲的渗透
- 染色体消除
- 多倍体
- 芸苔栗鸟