- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
抑制侧枝形成的RNA干扰和化学诱导的基因突变表达的腋窝分生组织GydF4y2Ba烟草GydF4y2BaL.GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba,商品编号:GydF4y2Ba236GydF4y2Ba(GydF4y2Ba2021GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
在烟草中,侧枝在茎的花序部分顶部后蓬勃增殖,以成熟的叶片被收获。因此,具有抑制侧枝形成的烟草品种是烟农的理想选择。GydF4y2Ba
结果GydF4y2Ba
对烟草侧枝形成的遗传抑制进行了研究。通过RNA干扰检查两组基因。第一组包括在其他植物中介导侧枝形成的基因的同源物,而第二组包括在腋芽原始阶段高度表达的基因。虽然在出现的花蕾未受影响时,植物之后越来越大的“初级”侧芽,但在敲击时显着抑制了在原发性侧枝碱的亚轴侧检测到的“二次”侧芽的生长下降线GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba. 化学诱变GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba,GydF4y2Bantrev.GydF4y2Ba同样抑制次生侧枝和“第三”侧枝的发育,但不抑制初生侧枝的发育。的突变GydF4y2BantlGydF4y2Ba和GydF4y2BaNtBl1GydF4y2Ba通过回复被纳入精英品种。在商业烟草生产区进行的现场试验中检测了回Cross系的农艺特征。该线通常适用于烟草生产,可用作新的烟草品种。GydF4y2Ba
结论GydF4y2Ba
压制的表达GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,或GydF4y2BaVE12GydF4y2Ba仅抑制烟草次生和第三次生侧枝的发育。该突变系可以使烟草种植者受益,因为农民在收获烟叶时,需要劳动密集型的过程,即尽量减少去除次生和第三次生侧枝所需的工作量。GydF4y2Ba
背景GydF4y2Ba
侧枝发育是植物的一个基本过程,在所有物种中都受到独特的调控。在作物品种中,如何控制侧枝形成直接影响收获质量和产量。参与腋生分生组织发育的基因已经在各种植物中进行了研究。突变GydF4y2Ba侧抑制器GydF4y2Ba番茄中的基因(GydF4y2BaLsGydF4y2Ba)[GydF4y2Ba1GydF4y2Ba拟南芥(GydF4y2Ba拉斯GydF4y2Ba)[GydF4y2Ba2GydF4y2Ba]在营养期抑制腋芽的形成。水稻同源基因的突变GydF4y2BaMonoculm 1.GydF4y2Ba(GydF4y2BaMOC1.GydF4y2Ba),导致抑制分蘖和rachis分支和尖峰的减少[GydF4y2Ba3.GydF4y2Ba]. 基因突变GydF4y2Ba盲目的GydF4y2Ba基因强烈抑制番茄腋生分生组织的形成[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].三个GydF4y2Ba腋生稳健机GydF4y2Ba(GydF4y2BarGydF4y2Ba)基因,GydF4y2Barax1GydF4y2Ba那GydF4y2Barax2.GydF4y2Ba,GydF4y2Barax3.GydF4y2Ba,以拟南芥鉴定为同源物GydF4y2Ba盲目的GydF4y2Ba.三重隐性突变体表现出几乎完全抑制的腋芽形成[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].GydF4y2Ba盲目的GydF4y2Ba和GydF4y2BarGydF4y2Ba这些基因编码R2R3 MYB转录因子,这些转录因子对于营养阶段腋窝分生组织的发育至关重要。以前的研究表明GydF4y2Ba盲目的GydF4y2Ba也控制生殖阶段的腋窝分生组织起始[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].在拟南芥中,初生芽的去头并不刺激腋芽的生长GydF4y2Ba拉斯维加斯GydF4y2Ba突变或GydF4y2Barax1GydF4y2Ba突变体[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].的GydF4y2BaLAX1GydF4y2Ba水稻中的基因及其应用GydF4y2Ba巴1GydF4y2Ba基因编码bHLH结构域,并参与花序和营养芽的分枝[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].的GydF4y2Ba火箭GydF4y2Ba基因是拟南芥的同源GydF4y2BaLAX1GydF4y2Ba和GydF4y2Ba巴1GydF4y2Ba.据报道,据报道,早期植物阶段的横向芽形成[GydF4y2Ba10GydF4y2Ba].GydF4y2Ba
一些调控腋生分生组织形成的基因突变影响主茎尖的发育。例如,在GydF4y2Ba罗沃拉GydF4y2Ba(GydF4y2Ba录GydF4y2Ba)拟南芥的基因显着降低了莲座叶和甲磺酸的生长,并抑制原发性芽的斩波后抑制腋窝的刺激[GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba].此外,这是GydF4y2Ba录GydF4y2Ba突变有时会导致初生芽顶端分生组织(SAM)在早期发育受阻。的GydF4y2Ba的杯状容器子叶GydF4y2Ba(GydF4y2Ba中联科利GydF4y2Ba)基因GydF4y2BaCUC1.GydF4y2Ba那GydF4y2BaCUC2GydF4y2Ba,GydF4y2BaCUC3.GydF4y2Ba[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba]和GydF4y2Ba侧向器官融合GydF4y2Ba(GydF4y2BaLOF.GydF4y2Bagene [GydF4y2Ba16GydF4y2Ba[拟南芥中调节器官分离和腋生分析。GydF4y2Ba多毛分生组织GydF4y2Ba(GydF4y2Ba火腿GydF4y2Ba)矮牵牛基因[GydF4y2Ba17GydF4y2Ba和胡椒[GydF4y2Ba18GydF4y2Ba他们在拟南芥中的同源物,GydF4y2Ba失去的分生组织GydF4y2Ba(GydF4y2Ba洛美GydF4y2Ba)[GydF4y2Ba19GydF4y2Ba]对SAM和腋生分生组织的发育有重要作用。因此,牵牛花和胡椒GydF4y2Ba火腿GydF4y2Ba突变体和拟南芥GydF4y2Balom1GydF4y2Ba-GydF4y2Balom2GydF4y2Ba-GydF4y2Balom3GydF4y2Ba三重突变体表现出枝条顶点的过早终止并阻止了腋下射击发育。一个突变GydF4y2Ba红光对于细长的下胚轴GydF4y2Ba(GydF4y2BaFHY3.GydF4y2Ba)基因抑制拟南芥腋芽的生长。此外,这是GydF4y2Ba录GydF4y2Ba-GydF4y2BaFHY3.GydF4y2Ba双突变比单隐性突变更能抑制腋芽的形成[GydF4y2Ba20.GydF4y2Ba].GydF4y2Ba
由于烟草为叶子栽培,当植物开始花时,茎(主要是花序)的顶端部分被切断(即,顶部),以增强收获前的叶片发育和成熟。虽然烟草植物一般表现出强大的顶端优势,但顶部释放出休眠的侧芽。由此产生的横向芽,其通常被称为“吸盘”在烟草中,经历剧烈的发展。烟草农民必须在开发后尽快删除这些“初级”横向芽,但“二次”侧枝立即从初级侧枝底座的轴向侧生长。因此,在培养期间(最多“的”横向芽期间,横向射击依次出现。这些横向芽必须由化学物质手动或抑制(即“,”吸吮“)来抑制,以使植物能够产生许多高质量的叶子。然而,这种对侧枝的控制是一种劳动密集型和昂贵的过程。去除次级和三级射击尤其不方便,因为当农民必须收获叶子时,它们的出现时间一致,这是另一个劳动密集型任务。因此,非常需要具有较少的侧枝,特别是次级和三级的烟草品种。不幸的是,涉及常规和生物技术方法的繁殖并未导致侧面较少较少的品种。GydF4y2Ba
参与腋生芽的调节的烟草基因及其功能仍然相对无表。然而,在其他植物中的上述基因的同源物可能存在并且在烟草中类似地存在。例如,烟草同源物(Genbank Eu935981)GydF4y2BaLsGydF4y2Ba已被克隆[GydF4y2Ba21GydF4y2Ba]但它没有调查其功能。在该研究中,通过RNA干扰(RNAi)将这些基因的同源物以及优先在腋中的许多在腋中表达的其他基因的表达表达。另外,将化学诱导的突变抑制横向芽形成。突变线的特征在于温室和田间试验。GydF4y2Ba
结果GydF4y2Ba
爆炸的搜索GydF4y2Ba
研究了两组烟草基因对侧枝形成的影响。第一组包括与其他植物侧枝形成有关的基因同源物。对GenBank数据库和内部烟草cDNA数据库进行了BLAST搜索,以鉴定烟草同源物(表1)GydF4y2Ba1GydF4y2Ba).因为烟草是一种双二倍体物种,它的基因组是从GydF4y2Ba美花烟草GydF4y2Ba(S-genome)和GydF4y2BaNicotiana tomentosiformis.GydF4y2Ba(T-基因组)[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba[每个同源物鉴定S-Genes和T-基因。的GydF4y2BaNtBlGydF4y2Ba和GydF4y2BaNtCUCGydF4y2Ba基因分别以同源性的降序为单位编号GydF4y2Ba盲目的GydF4y2Ba和GydF4y2Ba杯状GydF4y2Ba(GenBank HM210879),一个番茄同源物GydF4y2Ba中联科利GydF4y2Ba基因。GydF4y2Ba
RNA测序(RNA-SEQ)分析GydF4y2Ba
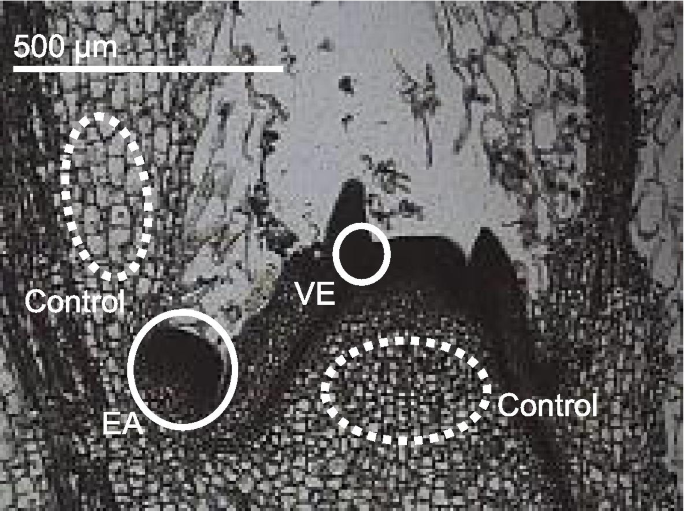
在其他植物中未研究的基因也可能参与腋生分析和芽的调节或开发。因此,作为第二组,通过RNA-SEQ鉴定在腋芽原始阶段高度表达的基因。通过激光微解析从早期(EA)和早期(EA)和非常早期阶段(VE)和来自烟草植物的控制区的组织中取样(图。GydF4y2Ba1GydF4y2Ba).从组织中提取总RNA,并使用454 GS FLX下一代测序仪(454 Life Sciences, Roche)分析。每个组织样本获得约900000个reads,平均长度约为400 bp,组装成38569个独特基因。第二组的基因选择按照下列标准:(a)基因的读计数在EA或已经至少有着高于控制,(b)基因组装超过200个基点,和(c)基因编码转录因子或未知的蛋白质根据注释。我们选择了11个在EA组织中高表达的基因(GydF4y2Baea1.GydF4y2Ba-GydF4y2BaEA11型GydF4y2Ba)和13个VE组织高表达基因(GydF4y2BaVE1.GydF4y2Ba-GydF4y2BaVE13GydF4y2Ba) (桌子GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
第一组基因(即烟草同源物)的RNA读计数列于表中GydF4y2Ba2GydF4y2Ba.与对照组织进行比较GydF4y2BantlGydF4y2Ba和GydF4y2BaNtBl1GydF4y2Ba均在EA或VE组织中高度特异性表达。在这三个样本中,GydF4y2Bantrev.GydF4y2Ba高度表达。关于其他同源物,三种组织中表达水平没有显着差异,或表达水平过低以检测。先前的调查证明了这一点GydF4y2Ba拉斯GydF4y2Ba和GydF4y2BarGydF4y2Ba基因在叶子原基的腋中高度表达[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].此外,GydF4y2Ba录GydF4y2Ba据报道,在初始横向射击中表达,以及在倒杯形细胞群中的SAM中心中[GydF4y2Ba12GydF4y2Ba].因此,至少一些同源物的表达模式(GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba,GydF4y2Bantrev.GydF4y2Ba)与其他物种的同类相似。GydF4y2Ba
值得注意的是,序列分析显示GydF4y2BaVE7.GydF4y2Ba,编码bHLH结构域,是同源的GydF4y2Ba火箭GydF4y2Ba拟南芥的基因。识别GydF4y2Ba火箭GydF4y2Ba是在我们对上述基因同源物的快速搜索之后发表的[GydF4y2Ba10GydF4y2Ba].此外,GydF4y2BaVE12GydF4y2Ba该基因编码一个NAC域,缺乏miR164的识别位点,被鉴定为aGydF4y2BaCUC3.GydF4y2Ba同族体。以前的研究证实GydF4y2Ba火箭GydF4y2Ba[GydF4y2Ba10GydF4y2Ba]它的玉米orthologGydF4y2Ba巴1GydF4y2Ba[GydF4y2Ba9.GydF4y2Ba]在叶子原金的关于曲线边界和GydF4y2BaCUC3.GydF4y2Ba在叶原基与茎分生组织的边界处表达[GydF4y2Ba25GydF4y2Ba]. 因此,GydF4y2BaVE7.GydF4y2Ba和GydF4y2BaVE12GydF4y2Ba在表达模式上与同源物相似。除了腋生分生组织的早期阶段,GydF4y2BaLsGydF4y2Ba那GydF4y2Bab11GydF4y2Ba,大部分GydF4y2Ba已经GydF4y2Ba和GydF4y2BaeaGydF4y2Ba基因在其他组织和器官中表达(附表GydF4y2BaS1GydF4y2Ba).更重要的是,rna序列分析补充了同源物的搜索。GydF4y2Ba
RNAi混战GydF4y2Ba
对于在RNA-SEQ筛选期间选择的12个同源物和24个基因的RNA干扰,总共36个触发序列,平均长度为430bp的触发序列GydF4y2BaS2GydF4y2Ba).三个GydF4y2BaNtBlGydF4y2Ba和四个GydF4y2BaNtCUCGydF4y2Ba基因。因此,较不保守的区域(即小于70%的同一性)占三个GydF4y2BaNtBlGydF4y2Ba基因和四个GydF4y2BaNtCUCGydF4y2Ba用基因设计触发序列来区分每个基因。对每个靶标进行s基因和t基因的比较。选择一个高度同源的区域作为触发器,以确保两个基因被一个单一的触发器序列有效敲除。s基因和t基因的触发区平均序列同源性为95.4%,高于Parrish等人确定的同时敲除两个基因的足够同源性[GydF4y2Ba26GydF4y2Ba].GydF4y2Ba
将RNAi基因引入GydF4y2Ba烟草GydF4y2Bal .简历。佩蒂特哈瓦那SR-1。TGydF4y2Ba1GydF4y2Ba每个结构的三个单位点转化子的子代在温室中生长,并检测了目的基因的表达。目的基因在分析的植物中被完全抑制(表1)GydF4y2Ba2GydF4y2Ba),除了GydF4y2BaVE3.GydF4y2Ba转化子,其中目的基因的表达量高于零分离子;表达增多的原因尚不清楚。数据显示,转基因植株和无分离子之间的初级侧枝产量(即数量和重量)缺乏差异(表1)GydF4y2Ba2GydF4y2Ba).因此,通过RNAi敲除靶基因的表达并没有抑制初生侧枝的形成。然而,次生侧枝的产生在数量和/或重量上受到抑制GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba是目标。例如,在野生型植物的初级侧枝的背面基部可以看到次级侧芽。GydF4y2Ba2GydF4y2Baa),但不是转基因植物GydF4y2BantlGydF4y2Ba表达被撞击(图。GydF4y2Ba2GydF4y2Bab).去除次生侧枝后,温室内生长的植物上不再形成额外的侧枝。一项较早的研究表明,至少22个连续核苷酸的序列匹配可能导致触发序列的脱靶沉默[GydF4y2Ba27GydF4y2Ba].因此,我们进行了BLAST搜索,筛选出22个与5个有效基因的触发序列相同的连续核苷酸。GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba).除了GydF4y2BaVE12GydF4y2Ba,没有发现22个核苷酸序列与触发序列相同的烟草基因。的GydF4y2BaVE12GydF4y2Ba基因被认为是NAC基因,属于烟草中最大的转录因子家族之一[GydF4y2Ba28GydF4y2Ba]. 因此,我们不能排除目标外沉默的可能性GydF4y2BaVE12GydF4y2Ba_RNAi烟草植物。关于GydF4y2BaNtBl1GydF4y2Ba,我们确认了表达GydF4y2BaNtBl2GydF4y2Ba和GydF4y2BaNtBl3GydF4y2Ba没有下调监管吗GydF4y2BaNtBl1GydF4y2Ba_rna干扰烟草植物。因此,进一步验证了RNAi的结果。GydF4y2Ba
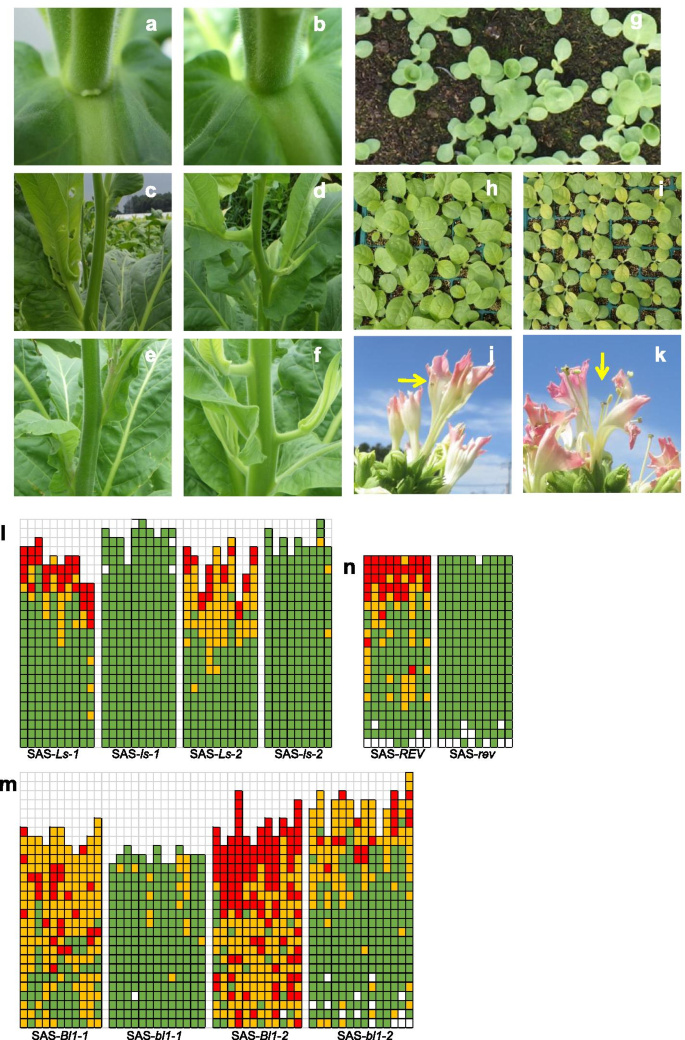
一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba野生型植物中主要侧枝碱的侧面(GydF4y2Ba一种GydF4y2Ba)和RNAiGydF4y2BantlGydF4y2Ba可拆卸的植物(GydF4y2BaB.GydF4y2Ba);GydF4y2BaCGydF4y2Ba-GydF4y2BaFGydF4y2BaSAS-的初级侧枝GydF4y2BaLs-1GydF4y2Ba(GydF4y2BaCGydF4y2Ba),sas-GydF4y2BaBL-1-1GydF4y2Ba(GydF4y2BaE.GydF4y2Ba),SAGydF4y2Ba-ls-1GydF4y2Ba(GydF4y2BaD.GydF4y2Ba)和sas-GydF4y2BaBL1-1GydF4y2Ba(GydF4y2BaFGydF4y2Ba) 植物;GydF4y2BaGGydF4y2Ba-GydF4y2Ba一世GydF4y2BaSAS的幼苗 -GydF4y2Ba录GydF4y2Ba突变体(GydF4y2BaGGydF4y2Ba)、“Coker319”(GydF4y2BaHGydF4y2Ba)和Coker319GydF4y2Ba-ls-1GydF4y2Ba(GydF4y2Ba一世GydF4y2Ba);GydF4y2BajGydF4y2Ba那GydF4y2BaK.GydF4y2BaCoker319之花GydF4y2Ba-ls-1GydF4y2Ba植物;GydF4y2BaL.GydF4y2Ba-GydF4y2BaNGydF4y2BaSAS叶腋一级、二级和三级侧枝形成的图示-GydF4y2BaLsGydF4y2Ba和GydF4y2BaLS.GydF4y2Ba行(GydF4y2BaL.GydF4y2Ba),sas-GydF4y2Bab11GydF4y2Ba和GydF4y2BaBL1.GydF4y2Ba行(GydF4y2BamGydF4y2Ba)和sas-GydF4y2Ba录GydF4y2Ba和GydF4y2Ba录GydF4y2Ba行(GydF4y2BaNGydF4y2Ba). 中的每列(GydF4y2BaL.GydF4y2Ba-GydF4y2BaNGydF4y2Ba)代表一株植物,每个正方形代表一个单独的叶腋。从下到上,这些正方形代表了在顶部之后植物的叶子位置。红色表示初级到第三级(或更多)侧枝的存在;黄色表示有初生至次生侧枝;绿色表示只存在初级侧枝;白色表示缺乏侧枝GydF4y2Ba
化学诱导突变体GydF4y2Ba
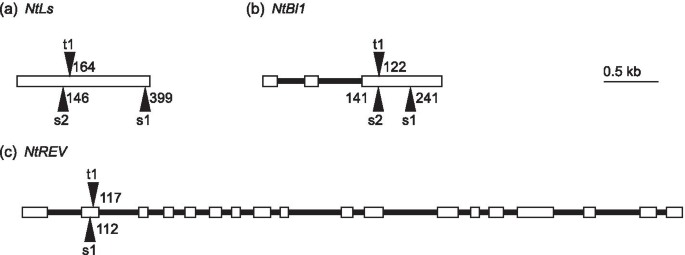
甲基磺酸乙酯(EMS)突变体文库GydF4y2Ba烟草GydF4y2Bal .简历。筑珠1筛查了废弃的突变GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba.我们鉴定并绘制了以下突变(图。GydF4y2Ba3.GydF4y2Ba):每个两个GydF4y2BaNTLS-S.GydF4y2Ba和GydF4y2BaNtBl1-SGydF4y2Ba每个人都在GydF4y2BaNTLS-T.GydF4y2Ba那GydF4y2BaNtBl1-TGydF4y2Ba那GydF4y2BaNtRev-S公司GydF4y2Ba,GydF4y2BaNtRev-T公司GydF4y2Ba.此外,将s -基因组和t -基因组的突变通过杂交组合,产生双突变系,称为SAS株系(Table .)GydF4y2Ba3.GydF4y2Ba). 因为在基因中没有发现无义突变GydF4y2BaVE7.GydF4y2Ba和GydF4y2BaVE12GydF4y2Ba,这些基因没有被进一步研究。GydF4y2Ba
据报道,一些参与腋生分生组织形成的基因突变会影响主茎尖的发育[GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].SAS的幼苗 -GydF4y2Ba录GydF4y2Ba突变线产生杯形或不对称子叶(图。GydF4y2Ba2GydF4y2BaG)。此外,叶子为4到5周哥式猫319-GydF4y2BaLS-1GydF4y2Ba植物GydF4y2Ba那GydF4y2Ba在商业生产基地进行田间试验的回交系,在苗圃箱中生长有时会变黄(图。GydF4y2Ba2GydF4y2Ba一世)。在4至5周龄Coker319中观察到相同的表型GydF4y2BaLS-1GydF4y2Ba在生长室内15°C培养的植物,尽管在28°C下植株看起来正常。这些发现表明Coker319-GydF4y2BaLS-1GydF4y2Ba叶片着色对冷胁迫很敏感。然而,发黄的植物恢复得很快,没有延迟生长。将正常生长的SAS系移栽到试验田,观察其侧枝发育情况。同样,初级侧枝在SAS中没有明显的抑制作用-GydF4y2BaLS.GydF4y2Ba,sas-GydF4y2BaBL1.GydF4y2Ba,和SAS-GydF4y2Ba录GydF4y2Ba植物(表格GydF4y2Ba4.GydF4y2Ba)而次生侧枝的数量和重量则减少。此外,第三级侧枝的形成几乎完全被抑制(图。GydF4y2Ba2GydF4y2Bal,m和n)。温室中RNAi线的表型与现场EMS突变体的表型一致。有趣的是,初级侧面射击的位置在SAS中向上移动 -GydF4y2BaLS.GydF4y2Ba和SAS -GydF4y2BaBL1.GydF4y2Ba突变系(图。GydF4y2Ba2GydF4y2BaD和f)在田间和温室(数据未示)。在温室中生长的RNAi系中没有观察到类似的变化。GydF4y2Ba2GydF4y2Bab).突变株系和RNAi株系的第二次和第三次侧枝位置不变。突变株中主要侧枝的位置GydF4y2BantlGydF4y2Ba和GydF4y2BaNtBl1GydF4y2Ba但这种转变的原因仍不清楚。GydF4y2Ba
商业生产区的现场试验GydF4y2Ba
在用于烟草商业生产的地区进行了田间试验,以研究突变株的农艺性状。的GydF4y2BaLS-1GydF4y2Ba和GydF4y2BaBL1-1GydF4y2Ba将突变引入日本广泛种植的烤烟繁殖的烟草品种“Coker319”中(GydF4y2Ba烟草GydF4y2Bal .简历。Coker319)通过回交育种(表GydF4y2Ba3.GydF4y2Ba).因为空间限制,GydF4y2Ba录GydF4y2Ba未测试突变。GydF4y2Ba
Coker319-的分析结果GydF4y2BaLS-1GydF4y2Ba在四个地点和Coker319-GydF4y2BaBL1.GydF4y2Ba-GydF4y2Ba1GydF4y2Ba在两个地点呈现在表格中GydF4y2Ba5.GydF4y2Ba.在所有位置处每根线复制包括10株植物的曲线图。总的来说,在叶片产量或其他参数方面,突变线与原始的“Coker319”植物没有多大差异,尽管虽然小,但统计学上显着,但检测到差异。具体而言,与“Coker319”植物相比,Coker319-GydF4y2BaLS-1GydF4y2Ba在一个或多个位置的植株更高,有更大(长度和宽度)和更深的叶子,开花较晚。相比之下,Coker319-GydF4y2BaBL1.GydF4y2Ba-GydF4y2Ba1GydF4y2Ba与“Coker319”植株相比,一两个部位的植株更短,产生更多的叶子,更小,颜色更浅(从顶部的1/2处)。因此,该突变系适合于后续试验。侧枝的发育受到抑制,尤其是次生和第三次生侧枝的发育。一项初步调查显示,Coker319-去除侧枝所需的劳力降低了52%GydF4y2BaLS-1GydF4y2Ba植物而不是'Coker319'植物(补充表GydF4y2BaS3GydF4y2Ba).GydF4y2Ba
花卉发展与生育GydF4y2Ba
在温室和场地,大部分鲜花的花瓣 -GydF4y2BaLS-1GydF4y2Ba,sas-GydF4y2BaLS-2GydF4y2Ba,和Coker319.GydF4y2Ba-ls-1GydF4y2Ba植物被分开(Fig。GydF4y2Ba2GydF4y2Baj)。在严重的情况下,雌蕊和雄蕊完全暴露(图。GydF4y2Ba2GydF4y2Bak)。与天然授粉的WT花相比,从Coker319的异常花的种子产量GydF4y2BaLS-1GydF4y2Ba自然授粉降低35%,人工授粉降低55%。GydF4y2BaS1GydF4y2Ba).GydF4y2Ba
Coker319-GydF4y2BaBL1-1GydF4y2Ba在田间试验中,与野生型植物相比,植株的花量减少了73%。GydF4y2BaS2GydF4y2Ba).每花的种子产量319-GydF4y2BaBL1-1GydF4y2Ba比Coker319少28%(补充Fig。GydF4y2BaS1GydF4y2Ba).GydF4y2Ba
讨论GydF4y2Ba
对烟草侧枝形成的遗传抑制进行了研究。选择两组烟草基因,研究RNAi对烟草侧枝形成的影响。一组候选基因包含了据报道参与其他植物侧枝形成的基因的同源体。这类基因在拟南芥中研究得最为广泛。共鉴定出8个基因或基因家族:GydF4y2Ba拉斯GydF4y2Ba[GydF4y2Ba2GydF4y2Ba],GydF4y2BarGydF4y2Ba家庭 [GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba],GydF4y2Ba火箭GydF4y2Ba[GydF4y2Ba10GydF4y2Ba],GydF4y2Ba录GydF4y2Ba[GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba],GydF4y2Ba中联科利GydF4y2Ba家庭 [GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba],GydF4y2BaLOF.GydF4y2Ba[GydF4y2Ba16GydF4y2Ba],GydF4y2Ba洛美GydF4y2Ba[GydF4y2Ba19GydF4y2Ba], 和GydF4y2BaFHY3.GydF4y2Ba[GydF4y2Ba20.GydF4y2Ba]. 一个BLAST搜索确定了这些基因的烟草同源物,除了GydF4y2Ba火箭GydF4y2Ba,这是在BLAST搜索执行后报告的。的GydF4y2BaVE7.GydF4y2Ba基因,同源于GydF4y2Ba火箭GydF4y2Ba,被包含在另一组基因中,通过RNA-seq分析发现这些基因在烟草腋芽的原始阶段高表达。的相同器官GydF4y2BaCUC3.GydF4y2Ba那GydF4y2BaVE12GydF4y2Ba也属于第二组基因。因此,烟草和拟南芥显然拥有相似的基因。GydF4y2Ba
转基因素线GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,或GydF4y2BaVE12GydF4y2BaRNAi和化学诱导突变的细胞株的表达均被抑制GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba,或GydF4y2Bantrev.GydF4y2Ba次生侧枝形成受到抑制。这个GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba基因分别是GydF4y2Ba拉斯GydF4y2Ba那GydF4y2Barax1GydF4y2Ba那GydF4y2Ba录GydF4y2Ba那GydF4y2Ba火箭GydF4y2Ba,GydF4y2BaCUC3.GydF4y2Ba.他们报告的表达模式与本文提供的RNA-seq数据一致。此外,突变GydF4y2Ba拉斯GydF4y2Ba那GydF4y2BaLsGydF4y2Ba(在番茄中),和GydF4y2BantlGydF4y2Ba影响花形态学。雄蕊GydF4y2Ba拉斯维加斯GydF4y2Ba突变植株异常短[GydF4y2Ba2GydF4y2Ba].其他研究证明,花瓣发育被抑制GydF4y2BaLS.GydF4y2Ba突变体和花瓣大多小于野生型花瓣[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba29GydF4y2Ba].此外,花粉产量和种子产量也普遍下降。突变GydF4y2Ba盲目的GydF4y2Ba[GydF4y2Ba5.GydF4y2Ba],这是GydF4y2Barax1GydF4y2Ba,GydF4y2BaNtBl1GydF4y2Ba导致鲜花数量减少。所以,GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba可能分别被认为是GydF4y2Ba拉斯GydF4y2Ba那GydF4y2Barax1GydF4y2Ba那GydF4y2Ba录GydF4y2Ba那GydF4y2Ba火箭GydF4y2Ba,GydF4y2BaCUC3.GydF4y2Ba.GydF4y2Ba
一些观察到的特征敲除和化学诱导烟草植株没有报道其他植物。烟草初生侧枝的形成不受抑制,次生侧枝和次生侧枝的发育受抑制。此外,在烟草突变体中,初生侧枝的位置向上移动GydF4y2BantlGydF4y2Ba和GydF4y2BaNtBl1GydF4y2Ba.植物物种之间差异的机制仍然不清楚;然而,这些差异并不令人惊讶,因为横向分支调节中的多样性是与相当多种植物形状相关的关键因素。GydF4y2Ba
其他分析的烟草同源物在击倒研究中无效。这些基因的表达要么是无法检测到的,要么不是特定于腋芽原始阶段。它们很可能是其他植物的非功能同源基因。GydF4y2Ba
第二组候选基因在腋芽原始期高表达。通过RNA-seq分析,筛选出24个基因。它们在EA或VE组织中高度特异地表达。然而,除了GydF4y2BaVE7.GydF4y2Ba和GydF4y2BaVE12GydF4y2Ba,敲击这些基因的表达并没有显着抑制横向芽形成。因此,这些基因可能与横向射击发育有关的关键调节作用。或者,烟草中的功能可能是多余的。GydF4y2Ba
在商业烟草生产现场的现场试验中检查了具有“Coker319”遗传背景的两个突变烟草线。这些系列对烟草叶生产令人满意,应重复试验。关于抑制二次和叔侧芽形成的后果,在初步调查中评估了去除外侧芽所需的劳动。虽然在幼苗阶段的寒冷敏感性和一些花卉异常的含量较低,但在此期间观察到降低的种子产量GydF4y2Bantls-GydF4y2Ba突变的植物,这些特性不太可能影响烟草叶生产实践。GydF4y2Ba
本研究中检测的Coker319衍生物是潜在有用的烟草新品种。它们可以减少烟草种植者控制次生和三次生侧枝形成所需的劳力和时间。此外,培育其他有突变的品种GydF4y2BantlGydF4y2Ba和/或GydF4y2BaNtBl1GydF4y2Ba进一步描述GydF4y2BantlGydF4y2Ba那GydF4y2BaNtBl1GydF4y2Ba那GydF4y2Bantrev.GydF4y2Ba那GydF4y2BaVE7.GydF4y2Ba,GydF4y2BaVE12GydF4y2Ba基因是未来研究的重要目标之一。GydF4y2Ba
结论GydF4y2Ba
在这项研究中,我们试图利用抑制横向芽形成开发烟草线。对烟草农民之间的这种线条有相当大的需求。五种基因的RNA干扰和化学诱导的突变到三种基因显着抑制了温室和田间条件下烟草中的横向射击发育。在商业生产基地进行的现场试验中评估了两条突变线。虽然在检查的线中不抑制原发性横向芽形成,但二次和三级射击的产生降低可能对改善的商业烟草生产产生影响。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
烟草GydF4y2Bal .简历。Petit Havana SR-1由福井府大学于1995年提供,用于RNA测序和RNA干扰。GydF4y2Ba烟草GydF4y2Bal .简历。筑波1号于1980年由日本烟草公司开发,用于基因克隆和化学诱导突变体的发育。GydF4y2Ba烟草GydF4y2Bal .简历。Coker319由Coker's Fedigreed Seear Co.于1963年提供,用于繁殖。GydF4y2Ba
爆破分析GydF4y2Ba
NCBI BLAST数据库中用于BLAST查询的基因(GydF4y2Bahttp://blast.ncbi.nlm.nih.gov/blast.cgi.GydF4y2Ba)和包含多次内部研究累积的烟草cDNA序列的数据库列在表中GydF4y2Ba1GydF4y2Ba.GydF4y2Ba
RNA序列GydF4y2Ba
在‘小哈瓦那SR-1’烟草幼苗萌发后29~37天,采集其茎尖组织,然后将其固定在3:1乙醇和乙酸的冰凉溶液中。Takahashi等人先前描述了用于制备石蜡包埋切片和激光显微切割的方案[GydF4y2Ba30.GydF4y2Ba].使用PicoPure™RNA分离试剂盒(Thermo Fisher Scientific Inc.)提取的总RNA使用安捷伦2100生物分析仪和RNA 6000 Pico试剂盒(安捷伦技术公司)进行检测。然后用T7启动子序列的oligo-dT引物合成cDNA,然后用T7 RNA聚合酶转录反义RNA。反义RNA作为模板,随机引物合成cDNA。经过一个片段化步骤,收集含有3’端的cDNA (400 - 1000 bp),并用454 GS FLX系统对片段的5’端进行测序。包含这些序列的文件已存放在DDBJ (DRA011900)。获得的读取用Newbler(2.6版)组装。GydF4y2Ba
基因克隆GydF4y2Ba
从GenBank和内部cDNA数据库中提取编码序列信息后,使用SMARTer RACE cDNA Amplification Kit (Clontech)进行5 ' -或3 ' -RACE,获得编码序列全长cDNA克隆。从休眠的腋芽、茎尖、花蕾或根中提取总RNA (magtion®;精密系统科学有限公司)。扩增片段使用BigDye®(3.1版)循环测序试剂盒(赛默飞世尔科学公司)和3730xl DNA分析仪(赛默飞世尔科学公司)进行测序。标准程序用于DNA操作[GydF4y2Ba31GydF4y2Ba].获得的序列信息见补充表GydF4y2BaS4GydF4y2Ba.GydF4y2Ba
RNA干扰GydF4y2Ba
引物见补充表GydF4y2BaS2GydF4y2Ba从‘Petit Havana SR-1’烟草植株的休眠腋芽、茎尖、花蕾或根中分离的克隆cDNA或RNA,用于扩增触发序列。扩增片段被克隆到pENTR™/D-TOPO载体(Takara Bio)中,然后引入改良的pHellsgate12二进制载体[GydF4y2Ba32GydF4y2Ba含有表达盒,其包含在CAMV 35s启动子的控制下编码绿色荧光蛋白的基因。将二进制载体插入GydF4y2Ba根癌土壤杆菌GydF4y2Ba菌株LBA4404细胞,然后用于转化小哈瓦那SR-1烟草植株。根据转基因植株中绿色荧光的分离比,确定了转基因的位点数GydF4y2Ba1GydF4y2Ba的一代。采用定量PCR检测目的基因表达水平。简而言之,从叶片、根或不含叶片的地上组织中提取的RNA作为模板,使用带gDNA橡皮擦(Takara Bio)的PrimeScript RT试剂试剂盒合成cDNA。采用TaqMan Fast Advanced Master Mix(赛默飞世尔科学公司)和StepOnePlus系统(赛默飞世尔科学公司)进行定量PCR分析。引物和探针的详细信息见补充表GydF4y2BaS5GydF4y2Ba.以编码伸长因子-1α (AF120093)的基因作为内参对照。目的基因在RNAi系中的相对表达量与不含该基因的无分离对照中的表达量进行了比较。GydF4y2Ba
化学诱导突变体GydF4y2Ba
图书馆GydF4y2Ba烟草GydF4y2Bal .简历。Tsukuba 1与Tajima等人的EMS突变[GydF4y2Ba33GydF4y2Ba]如Takakura等人所述进行筛选[GydF4y2Ba34GydF4y2Ba],使用补充表中列出的引物GydF4y2BaS6GydF4y2Ba.GydF4y2Ba
植物栽培GydF4y2Ba
在25℃下在自然的日间长度条件下或12小时光(25℃):12-H黑色(18°C) 循环。它们也在日本烟草公司叶烟草研究中心的实验领域种植,或在日本西南部用于商业烟草生产的领域。根据各自的标准实践进行管理。当出现花蕾时,植物被截止,然后在生长室或在该领域进行每周测量横向芽5周。使用叶子颜色图2019A用于烟草(藤叶岛工业;补充表GydF4y2BaS7GydF4y2Ba).GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在稿件及其补充文件中。图中描绘的所有图像都是我们自己的。番茄,拟南芥和烟草基因的序列信息可从Solanaceae基因组学网络获得(GydF4y2Bahttps://solgenomics.net/GydF4y2Ba),Genbank(GydF4y2Bahttps://www.ncbi.nlm.nih.gov/genbank/GydF4y2Ba)及日本DNA资料库(GydF4y2Bahttps://www.ddbj.nig.ac.jp/index-e.html.GydF4y2Ba).本研究获得的基于下一代测序的原始reads可从DDBJ/EMBL/NCBI获得,注册号为DRA011900 (GydF4y2Bahttps://ddbj.nig.ac.jp/DRASearch/submission?acc=DRA011900GydF4y2Ba).本研究中产生或分析的数据集可从通讯作者处获得,用于非商业目的。GydF4y2Ba
缩写GydF4y2Ba
- LsGydF4y2Ba那GydF4y2Ba拉斯GydF4y2Ba:GydF4y2Ba
-
侧抑制器GydF4y2Ba
- MOC1.GydF4y2Ba:GydF4y2Ba
-
MonoculmGydF4y2Ba1GydF4y2Ba
- rGydF4y2Ba:GydF4y2Ba
-
腋窝分生组织的调节GydF4y2Ba
- MYB:GydF4y2Ba
-
骨髓霉素GydF4y2Ba
- lGydF4y2Ba:GydF4y2Ba
-
宽松的圆锥花序GydF4y2Ba
- 巴1GydF4y2Ba:GydF4y2Ba
-
贫瘠的茎1.GydF4y2Ba
- bHLH:GydF4y2Ba
-
基本helix-loop-helixGydF4y2Ba
- 火箭GydF4y2Ba:GydF4y2Ba
-
腋生稳压器形成GydF4y2Ba
- 录GydF4y2Ba:GydF4y2Ba
-
罗沃拉GydF4y2Ba
- 中联科利GydF4y2Ba:GydF4y2Ba
-
杯形子叶GydF4y2Ba
- LOF.GydF4y2Ba:GydF4y2Ba
-
侧向器官融合GydF4y2Ba
- 火腿GydF4y2Ba:GydF4y2Ba
-
毛茸茸的公司GydF4y2Ba
- 洛美GydF4y2Ba:GydF4y2Ba
-
失去的分生组织GydF4y2Ba
- FHY3.GydF4y2Ba:GydF4y2Ba
-
红光对于细长hypocotyl3GydF4y2Ba
- RNAi:GydF4y2Ba
-
RNA干扰GydF4y2Ba
- NCBI:GydF4y2Ba
-
国家生物技术信息中心GydF4y2Ba
- 爆破:GydF4y2Ba
-
基本的局部比对搜索工具GydF4y2Ba
- blGydF4y2Ba:GydF4y2Ba
-
B.GydF4y2Ba林德GydF4y2Ba
- RNA-seq:GydF4y2Ba
-
RNA序列GydF4y2Ba
- 山姆:GydF4y2Ba
-
茎顶端分生组织GydF4y2Ba
- NAC:GydF4y2Ba
-
Petunia nam和Arabidopsis Ataf1,Ataf2和Cuc2GydF4y2Ba
- EMS:GydF4y2Ba
-
甲基磺酸乙酯GydF4y2Ba
- 种族:GydF4y2Ba
-
cDNA末端的快速扩增GydF4y2Ba
- CaMV:GydF4y2Ba
-
花椰菜马赛克病毒GydF4y2Ba
- SD:GydF4y2Ba
-
标准偏差GydF4y2Ba
工具书类GydF4y2Ba
- 1.GydF4y2Ba
番茄横向抑制(Lateral suppressor, Ls)基因编码了一个新的VHIID蛋白家族成员。美国科学研究院学报1999;96:290-5。GydF4y2Ba
- 2.GydF4y2Ba
通过对拟南芥侧位抑制基因(LATERAL SUPPRESSOR gene)的分子分析,揭示了一个保守的控制腋生分生组织形成的机制。基因Dev。2003;17:1175 - 87。GydF4y2Ba
- 3.GydF4y2Ba
李X,钱Q,傅Z,王y,xiong g,zeng d,王x,刘x,tengs,hiroshi f等。稻米分蘖的控制。自然。2003; 422:618-21。GydF4y2Ba
- 4.GydF4y2Ba
Mapelli S, Kinet JM。植物生长调节剂和嫁接对TO-2突变番茄腋芽形成和发育的控制。植物生长规律1992;11:385-90。GydF4y2Ba
- 5.GydF4y2Ba
Schmitz G, tilmann E, Carriero F, Fiore C, Cellini F, hs K.番茄盲基因编码MYB转录因子,控制侧分生组织的形成。美国国家科学研究院2002;99:1064-9。GydF4y2Ba
- 6.GydF4y2Ba
拟南芥腋生分生组织(Arabidopsis tharillary MERISTEMS1)调节因子1调控叶腋干细胞的生长发育。植物细胞。2006;18:598 - 611。GydF4y2Ba
- 7.GydF4y2Ba
Müllerd,Schmitz G,Theres K.盲人同源R2R3 MYB基因控制拟南芥中横向分生成的模式。植物细胞。2006; 18:586-97。GydF4y2Ba
- 8.GydF4y2Ba
小松K,Maekawa M,Ujiie S,Satake Y,Furutani I,Okamoto H,Shimamoto K,Kyozuka J. Lax和Spa:大米射击分支的主要监管机构。Proc Natl Acad SCI U S A. 2003; 100:11765-70。GydF4y2Ba
- 9。GydF4y2Ba
gallavotti a,赵q,kyozuka j,meeley rb,ritter mk,doobley jf,pème,schmidt rj。贫瘠的鼠李在玉米建筑中的作用。自然。2004; 432:630-5。GydF4y2Ba
- 10.GydF4y2Ba
杨芙、王琦、施密茨G、穆勒D、特雷斯K。bHLH蛋白ROX与RAX1和LAS协同调控拟南芥腋生分生组织的形成。植物J。2012;71:61–70.GydF4y2Ba
- 11.GydF4y2Ba
Talbert PB, Adler HT, Parks DW, Comai L.在根尖分生组织发育和限制叶和茎细胞分裂中,REVOLUTA基因是必需的GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.发展。1995;121:2723-35。GydF4y2Ba
- 12.GydF4y2Ba
Otsuga D, DeGuzman B, Prigge MJ, drew GN, Clark SE。REVOLUTA在侧位调节分生组织的起始。植物j . 2001; 25:223-36。GydF4y2Ba
- 13.GydF4y2Ba
AIDA M,Ishida T,Fukaki H,Fujisawa H,塔萨卡M.参与拟南芥器官分离的基因:杯形子叶突变体的分析。植物细胞。1997年; 9:841-57。GydF4y2Ba
- 14.GydF4y2Ba
AIDA M,Ishida T,Tasaka M.在拟南芥胚胎发生期间拍摄顶端分类和子叶形成:杯形子叶中的相互作用和射击无可比基因。发展。1999; 126:1563-70。GydF4y2Ba
- 15.GydF4y2Ba
高田S,Hibara K,Ishida T,Tasaka M.拟南芥的杯形子叶1基因调节芽顶部分型形成。发展。2001; 128:1127-35。GydF4y2Ba
- 16.GydF4y2Ba
Lee DK,Geisler M,Springer PS。拟南芥中横向器官分离和腋生形式形成的外侧器官融合1和外侧器官融合2功能。发展。2009; 136:2423-32。GydF4y2Ba
- 17.GydF4y2Ba
植物芽分生组织的维持是由一个格拉斯基因介导的分化细胞信号控制的。基因Dev。2002;16:2213-8。GydF4y2Ba
- 18.GydF4y2Ba
David-Schwartz R,Borovsky Y,Zemach H,Paran I. Caham是自动规管化的,并调节Castm表达,是猪肉中的顶端公司组织所必需的。植物SCI。2013; 203-204:8-16。GydF4y2Ba
- 19。GydF4y2Ba
Schulze S,SchäferBN,帕萨维托EA,Voinnet O,Theres K.丢失的分泌物基因调节拟南芥射击商品中的中央区域后代的细胞分化。工厂J.2010; 64:668-78。GydF4y2Ba
- 20.GydF4y2Ba
关键词:拟南芥,FHY3,芽分化,抗逆性植物j . 2012; 71:907-20。GydF4y2Ba
- 21.GydF4y2Ba
王伟,台S,王L,刘G-S,刘F-x,高x-m,孙Y-h。NtLS基因RNAi载体的构建及其在烟草中的转化。中国科学院。2011;32:31–5.GydF4y2Ba
- 22.GydF4y2Ba
Riechers de,Timko MP。编码PUTRESCINE N-甲基转移酶的基因家族的结构和表达GydF4y2Ba烟草GydF4y2Ba:新线索到栽培烟草的进化起源。植物mol biol。1999; 41:387-401。GydF4y2Ba
- 23.GydF4y2Ba
Murad L,Lim Ky,Christopodulou V,Matyasek R,Lichtenstein CP,Kovarik A,Leitch Ar。烟草的T基因组的起源被追溯到内部的特定谱系GydF4y2BaNicotiana tomentosiformis.GydF4y2Ba(GydF4y2BaSolanaceae.GydF4y2Ba).中国生物医学工程学报2002;89:921-8。GydF4y2Ba
- 24.GydF4y2Ba
Gavilano LB、Coleman NP、Bowen SW、Siminszky B。对尼古丁脱甲基酶基因的功能分析揭示了现代烟草的进化。生物化学杂志。2007;282:249–56.GydF4y2Ba
- 25.GydF4y2Ba
拟南芥CUP-SHAPED COTYLEDON3调控胚后芽分生组织和器官边界的形成。植物细胞。2006;18:2946-57。GydF4y2Ba
- 26.GydF4y2Ba
Parrish S,Fleenor J,Xu S,Mello C,Fire A. DSRNA触发的功能解剖:用于RNA干扰的两个触发链的差异要求。Mol细胞。2000; 6:1077-87。GydF4y2Ba
- 27.GydF4y2Ba
徐平,张Y,康L,罗斯尼克MJ,迈索尔KS。植物转录后基因沉默过程中非靶向沉默的计算估计和实验验证。植物生理学。2006;142:429–40.GydF4y2Ba
- 28.GydF4y2Ba
罗斯顿PJ,博克威克MT,韩S,张H,Brannock JF,Chen X,Laudeman TW,Timko MP。烟草转录因子:新型凝结性调控在茄科内的转录调控。植物理性。2008; 147:280-95。GydF4y2Ba
- 29.GydF4y2Ba
Groot SPC、Keizer LCP、de Ruiter W、Dons JJM。番茄侧抑制突变体的种子和座果率。科幻电影。1994;59:157–62.GydF4y2Ba
- 30.GydF4y2Ba
Takahashi H,Kamakura H,Sato Y,Shiono K,Abiko T,Tsutsumi N,Nagamura Y,Nishizawa NK,Nishazono M。通过激光微粉切割从植物组织的石蜡切片获得高质量RNA的方法。j植物res。2010; 123:807-13。GydF4y2Ba
- 31。GydF4y2Ba
Sambrook JF, Russell DW。分子克隆:实验室手册(3卷集)。冷泉港:冷泉港实验室出版社;2001.GydF4y2Ba
- 32.GydF4y2Ba
Wesley Sv等人。构建植物高效,有效和高通量基因沉默的设计。工厂J. 2001; 27:581-90。GydF4y2Ba
- 33.GydF4y2Ba
Tajima T,Sato S,Hiyoshi T.突变委员会的建设GydF4y2Ba尼古利亚娜GydF4y2Ba塔瓦姆GydF4y2BaL植物病理学学会。2011;77:258.GydF4y2Ba
- 34.GydF4y2Ba
Takakura Y,Udagawa H,Shinjo A,Koga K.突变GydF4y2Ba烟草GydF4y2BaL.真核翻译引发因子基因降低了对马铃薯病毒Y.Mol植物差异的抗性破坏菌株的易感性。2018; 19:2124-33。GydF4y2Ba
致谢GydF4y2Ba
作者感谢Mikio Nakazono博士和Hirokazu Takahashi博士在激光显微切割和RNA提取过程中提供的技术支持。我们也感谢Toshihiko Komari博士对手稿的友好、批判性和仔细阅读。我们要对大谷佐子博士、小泉雅子、竹原迈博士、佐藤南爱、小池早矢和高桥明子的出色技术援助表示感谢。GydF4y2Ba
资金GydF4y2Ba
所有作者都附属的日本烟草公司是研究的唯一资助。本研究作为烟草业务部门研发部的活动之一。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
KH、SS1、TN1、SS2设计了研究和实验。KH、SS1、MA、YN、TN1、TK、TN2、SS2进行实验。KH、SS1、SS2定期讨论研究进展,制定研究策略。KH和SS2写了手稿。SS1和SS2分别对应saiki Sato和Shoichi Suzuki。TN1和TN2分别对应Nakamura Takashi和Naragino Tsuyoshi。所有作者均已阅读并批准稿件。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
日本烟草公司资助所有研究的生产和持有关于RNAi烟草和化学诱导的烟草突变体的专利。专利WO / 2017/170796A1,日本烟草Inc.,烟草植物体和制造方法。GydF4y2Ba
提交人声明他们没有竞争利益。所有作者都与日本烟草公司隶属于这项研究的资助者。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:补充表S1。GydF4y2Ba
几种组织和器官基因的表达。GydF4y2Ba补充表S2。GydF4y2Ba用于扩增触发DNA的引物。GydF4y2Ba补充表S3。GydF4y2Ba在商业生产现场的田间试验中手动去除侧枝的工时。GydF4y2Ba补充表S4。GydF4y2Ba通过RNA-SEQ筛选的基因数量。GydF4y2Ba补充表S5。GydF4y2Ba定量PCR的引物和探针。GydF4y2Ba补充表S6。GydF4y2Ba筛选突变的引物。GydF4y2BaS7补充表。GydF4y2BaCIELAB颜色评分(国际照明委员会;GydF4y2Bahttp://cie.co.at/GydF4y2Ba)用烟叶叶色图2019A测定。GydF4y2Ba
附加文件2:补充图。S1。GydF4y2Ba
突变线的种子产量。统计学意义采用GydF4y2BaT.GydF4y2Ba-测试 (**GydF4y2BaP.GydF4y2Ba<0.01)。ns:不重要。GydF4y2Ba
附加文件3:补充图S2。GydF4y2Ba
焦炭中的花数319GydF4y2Ba-bl1-1GydF4y2Ba植物。统计学意义采用GydF4y2BaT.GydF4y2Ba-测试 (**GydF4y2BaP.GydF4y2Ba<0.01)。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.“创作共用公共领域”豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非信用额度中另有规定。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
哈曼,K。,佐藤,S.,Arai,M。GydF4y2Ba等等。GydF4y2Ba抑制侧枝形成的RNA干扰和化学诱导的基因突变表达的腋窝分生组织GydF4y2Ba烟草GydF4y2Bal ..GydF4y2BaBMC植物杂志GydF4y2Ba21日,GydF4y2Ba236(2021)。https://doi.org/10.1186/s12870-021-03008-3GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-03008-3GydF4y2Ba
关键字GydF4y2Ba
- 化学诱变技术GydF4y2Ba
- 侧枝抑制GydF4y2Ba
- RNA干扰GydF4y2Ba
- RNA-seqGydF4y2Ba
- 抽油GydF4y2Ba
- 烟草GydF4y2Ba