- 研究GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
Poplar Aquaporin.GydF4y2BaPIP1; 1GydF4y2Ba促进GydF4y2Ba拟南芥GydF4y2Ba增长和发展GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba文章编号:GydF4y2Ba253GydF4y2Ba(GydF4y2Ba2021.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
根液压电导主要由活组织的导电到径向水流来确定。根皮疹细胞中的血浆膜内在蛋白(PIPS)对于植物占用水很重要,并且被认为直接参与细胞生长。GydF4y2Ba
结果GydF4y2Ba
在本研究中,我们发现杨树根特异性基因的结构性过表达GydF4y2BaPtoPIP1; 1GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba加速螺栓和开花。在发育过程的早期阶段,GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba叶子和根部的细胞生长更快。植物的Turgor压力相应增加GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥,GydF4y2Ba水的状况也改变了。同时,开花相关基因的表达量(GydF4y2BaCRY1GydF4y2Ba那GydF4y2BaCRY2GydF4y2Ba和GydF4y2BaFCA.GydF4y2Ba)和花时调控网络中的中心基因(GydF4y2BaFT.GydF4y2Ba和GydF4y2BaSOC1GydF4y2Ba)在OE植物中显著上调,而花抑制子则显著上调GydF4y2BaFLC.GydF4y2Ba基因显著下调。GydF4y2Ba
结论GydF4y2Ba
综上所述,我们的研究结果表明,结构性的过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba在发育过程的早期,通过加快叶片和根的细胞生长来加速抽薹和开花。开花调控的自主途径可能是通过监测发育年龄来实现的。膨胀的增加和水状态的变化GydF4y2BaPtoPIP1; 1GydF4y2Ba过度表达在促进细胞生长中起着重要作用。GydF4y2Ba
背景GydF4y2Ba
植物的生长来源于分生组织,分生组织细胞在膨胀到最终体积之前要分裂几个周期[GydF4y2Ba1GydF4y2Ba].单个细胞膨胀的速率被认为是托尔压力,细胞壁性能和细胞液压导电的函数[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].细胞的持续生长需要足够的水分;因此,细胞的水分运动和体内平衡受到严格控制。细胞水运动主要由水通道蛋白(AQPs)介导,它促进水在膜上的被动交换[GydF4y2Ba4.GydF4y2Ba].质膜(PM)固有蛋白(PIP)亚家族是AQP家族的一个成员[GydF4y2Ba5.GydF4y2Ba].由于根深蒂固细胞的疏水性尸体条带严重限制了水的径向传输,因此PIPS被认为是PM上的径向吸水性的第一阈值,负责高达30%-90%的根水渗透性超过十种植物物种[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].GydF4y2Ba
考虑到水分对植物生长的不可缺少和PIP在水分渗透中的重要性,PIP应该在植物根系生长中发挥作用。侧根出现延迟GydF4y2Ba拟南芥pip2; 1GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba], 举个例子。鉴于PIP家族中的大型成员及其功能冗余,一些GydF4y2Ba皮普GydF4y2Ba突变显示出生长形态没有显着差异,例如GydF4y2Ba拟南芥pip1; 2 - 1GydF4y2Ba那GydF4y2Bapip1; 2 - 2GydF4y2Ba那GydF4y2Bapip2; 2 - 1GydF4y2Ba和GydF4y2Bapip2; 2 - 2GydF4y2Ba[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba,这使得研究它们在植物生长中的作用变得困难。根的总长度、表面积和根体积较小,根尖较少GydF4y2BaOsPIP2;1GydF4y2BaRNAI转基因植物[GydF4y2Ba11GydF4y2Ba[中,观察到明显的形态变形和发育延迟GydF4y2BaBnPIP1GydF4y2Ba反义转基因烟草[GydF4y2Ba12GydF4y2Ba],这提供了PIP参与植物生长和发展的证据。最近,已经通过遗传操作来改善植物增长的工作。虽然并非所有尝试都是成功的,但在一些皮疹过度抑制(OE)植物中观察到更好的生长性能。下面列出了一些例子:GydF4y2BaVvpip2; 4 nGydF4y2BaOE葡萄(GydF4y2Ba13GydF4y2Ba],GydF4y2BaTDPIP2; 1GydF4y2BaOE小麦(GydF4y2Ba14GydF4y2Ba],GydF4y2BaRsPIP2; 1GydF4y2BaOEGydF4y2Ba桉树GydF4y2Ba[GydF4y2Ba15GydF4y2Ba],GydF4y2BaAtPIP1bGydF4y2Ba那GydF4y2BaTdPIP1; 1GydF4y2Ba和GydF4y2BaTDPIP2; 1GydF4y2BaOE烟草[GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba],GydF4y2BaRCPIP2; 1GydF4y2Ba那GydF4y2BaRCPIP2; 2GydF4y2Ba,GydF4y2BaAcPIP2GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].GydF4y2Ba
膨压是植物细胞生长的重要动力。细胞的持续生长需要足够的水来保持稳定的膨压高于产率阈值,而膨压提供了对细胞壁的物理驱动力,从而促进细胞分裂[GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21GydF4y2Ba]和细胞扩展[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba].1965年初,稳态伸长率与托尔压力之间的关系得到了认识到[GydF4y2Ba25GydF4y2Ba].后来,据报道,由于托戈尔压力增加到1.0巴,细胞分裂大大刺激,而电池膨胀被刺激,因为橡胶压力在孤立的萝卜中高于3.0巴(GydF4y2Ba萝卜GydF4y2Ba红太子)子叶[GydF4y2Ba20.GydF4y2Ba].GydF4y2Ba
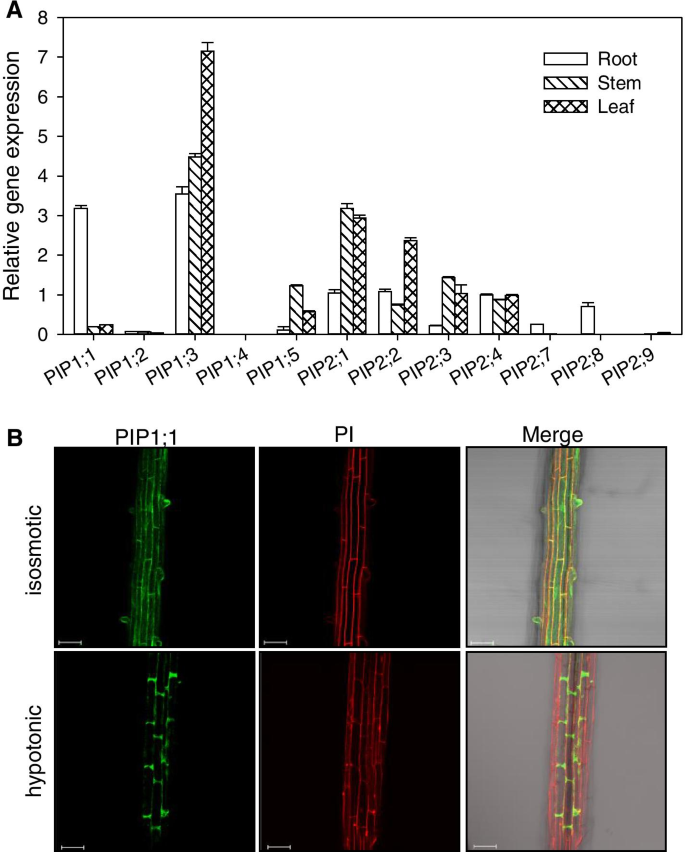
在早期的研究中,我们发现根部压力参与重新填充杨树的栓塞血管[GydF4y2Ba26GydF4y2Ba].在这项研究中,我们进行了一项实验来检测杨树皮普的表达基因在根、茎和叶中存在,结果表明PIP1; 1和PIP2; 8相对根与茎和叶相比,中高度表达的相对表达水平和PIP1; 1根是最高的(无花果。GydF4y2Ba1GydF4y2Baa).应该注意的是,在这个实验中,GydF4y2BaPTPIP2,5.GydF4y2Ba和GydF4y2BaPtPIP2; 6GydF4y2Ba未纳入,因为序列相似度很高,达到99%,且本实验未找到合适的引物。然而,后来,我们实验室的一位同事发现了成功分离两个pip的引物,并确定GydF4y2BaPtPIP2; 5GydF4y2Ba和GydF4y2BaPtPIP2; 6GydF4y2Ba是杨树根中最表达的斑点[GydF4y2Ba27GydF4y2Ba].本文的QRT-PCR使用在温室中生长的两个月大的切割杨树植物进行,而江等人则进行。使用组织培养植物[GydF4y2Ba27GydF4y2Ba].尽管植株生长条件不同,但本文的qRT-PCR结果与前一篇文章一致。最初,我们打算研究主要表达的水通道蛋白在根压中的作用。因此,我们进行了本构性过表达(OE)GydF4y2Ba杨树GydF4y2Ba皮普水通道蛋白GydF4y2BaPtoPIP1; 1GydF4y2Ba和GydF4y2Baptopip2; 8GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba出乎意料地发现GydF4y2BaPtoPIP1; 1GydF4y2BaOE导致早期开花。据我们所知,尚未报告AQP加速开花。此外GydF4y2BaPtoPIP1; 1GydF4y2Ba,我们也选择了GydF4y2BaPtoPIP1; 3GydF4y2Ba和GydF4y2Baptopip2; 3GydF4y2Ba进行比较。我们的选择取决于PtoPIP1;1, PtoPIP1;3和PtoPIP2;loopE中不同的氨基酸残基与PIP2的相互作用不同有关,导致PIP2的水渗透系数不同[GydF4y2Ba28GydF4y2Ba].据此,PtoPIP1;1, PtoPIP1;3和PtoPIP2;3的E环不同的蛋白序列(图SGydF4y2Ba6.GydF4y2Ba)可能导致与其他pip的相互作用不同,从而导致不同的水渗透系数。GydF4y2Ba
开花是植物从营养生长向生殖发育过渡过程中发生的一个典型事件,目前已经确定了5个控制开花的遗传途径:春化途径(VRN1、VRN3等)、光周期途径(CRY1、CRY2等)、赤霉素途径(GAI、RGA、SPY等)、自主途径(FCA、FPA、FVE等)、衰老途径[GydF4y2Ba29GydF4y2Ba].然而,LFY、FT、SOC1和CO是花时间调控网络中的集成商[GydF4y2Ba29GydF4y2Ba].在本研究中,过表达与野生型植物生长在相同的环境中,所以光照或温度不是导致开花时间变化的原因。自主通路可以监测发育年龄;植物在开花前必须经过幼年期并达到成年营养期[GydF4y2Ba30.GydF4y2Ba].因此,从水通道蛋白参与植物生长的角度,我们假设水通道蛋白引起的生长变化促进了植物开花。因此,我们研究了转基因植物的生长速率和渗透势,以探索AQP加速开花的机制。在之前的一项研究中,水通道蛋白对根系水力传导率、生长甚至膨压的影响通过用汞抑制水通道蛋白的活性得到了相反的证明[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba].在这项研究中,我们希望进一步探索水素在水导率,Turgor压力和过度抑制水蛋白的增长的参与,以及确定与开花时间的关系。GydF4y2Ba
结果GydF4y2Ba
PtoPIP1; 1GydF4y2Ba-Overexpressing.GydF4y2Ba拟南芥GydF4y2Ba显示加速开花GydF4y2Ba
15GydF4y2Ba皮普GydF4y2Ba基因被鉴定在GydF4y2Bap . trichocarpaGydF4y2Ba(图GydF4y2Ba1GydF4y2Ba和表S.GydF4y2Ba1GydF4y2Ba).杨树的表达GydF4y2Ba皮普GydF4y2Ba通过qRT-PCR对根、茎和叶的基因进行分析,结果表明GydF4y2BaPIP1; 1GydF4y2Ba那GydF4y2BaPIP2; 7GydF4y2Ba和GydF4y2BaPIP2; 8GydF4y2Ba在根,茎和叶子中的根部相对高度表达,而相对表达水平GydF4y2BaPIP1; 1GydF4y2Ba在根中最高(图。GydF4y2Ba1GydF4y2Ba一)。GydF4y2BaPIP1; 1GydF4y2Ba被克隆GydF4y2Bap . tomentosaGydF4y2Ba并对其亚细胞定位进行了研究。通过瞬时表达PtoPIP1;1-YFP融合蛋白GydF4y2Ban benthamianaGydF4y2Ba其中,PtoPIP1;1- yfp的荧光信号与FM4-64和内质网(ER)标记物HDEL融合良好,表明PtoPIP1;1定位于质膜(PM)和内质网(ER)(图S)GydF4y2Ba2GydF4y2Ba).与实验结果一致的是,PtoPIP1;1在转基因PtoPIP1;1- yfp中也在PM上有定位GydF4y2Ba拟南芥GydF4y2Ba(无花果。GydF4y2Ba1GydF4y2Bab).有趣的是,在低渗(水处理)条件下,大部分PtoPIP1;1-YFP荧光信号分布在根表皮和皮层细胞的两端(图2)。GydF4y2Ba1GydF4y2Bab),显示PM的类极定位模式。PtoPIP1;1的定位模式可能反映了其在促进水运输方面对不同水条件的动态响应。GydF4y2Ba
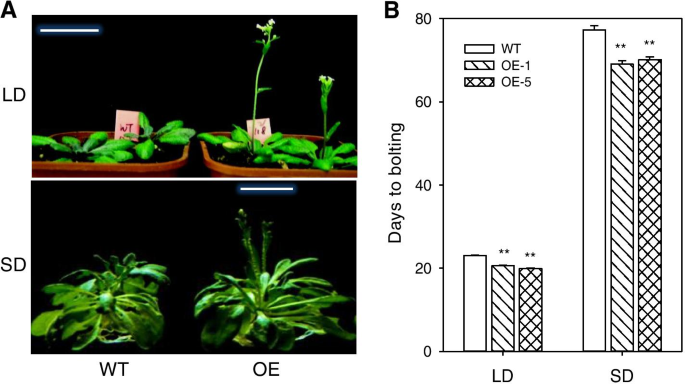
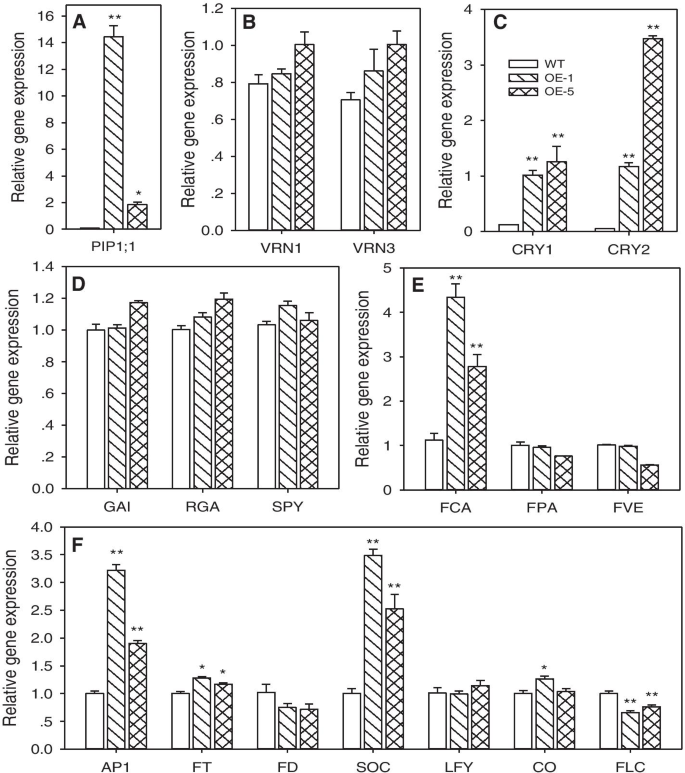
与野生型(WT)相比,GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba无论是长日照(LD)还是短日照(SD)条件下,均表现出早花表型。GydF4y2Ba2GydF4y2Ba).此外,与非转基因对照植物相比,OE Ptopip1; 1系具有相同的叶子数;然而,前者的叶片发展比后者更快(图SGydF4y2Ba3.GydF4y2Ba).在发育过程中(14das),表达水平GydF4y2BaCRY1GydF4y2Ba那GydF4y2BaCRY2GydF4y2Ba和GydF4y2BaFCA.GydF4y2Ba(光周期和自主途径的基因)以及GydF4y2BaFT.GydF4y2Ba和GydF4y2BaSOC1GydF4y2Ba(潜在的花卉时期的监管网络中的主要集线器)在OE植物中显着上调,而花卉阻遏物基因GydF4y2BaFLC.GydF4y2Ba在OE植物中显著下调(图。GydF4y2Ba3.GydF4y2Ba).因此,过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba能够加速GydF4y2Ba拟南芥GydF4y2Ba发展。GydF4y2Ba
早开的开花GydF4y2BaPtoPIP1; 1GydF4y2Ba-overexpressing(OE)GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba一种GydF4y2Ba野生型(WT)和GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba长日(LD)和短日(SD)条件下生长。GydF4y2BaB.GydF4y2BaWT和两天的螺栓GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba在LD和SD条件下(OE-1和OE-5)。平均值±标准误差(GydF4y2BaNGydF4y2Ba= 20或以上)。数据在统计上使用学生分析GydF4y2Bat -GydF4y2Ba测试。**GydF4y2BaP.GydF4y2Ba < 0.01
的表达GydF4y2BaPtoPIP1; 1GydF4y2Ba和wt和两个的开花相关基因GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba行(OE-1和OE-5)。GydF4y2Ba一种GydF4y2Ba表达GydF4y2BaPtoPIP1; 1GydF4y2Ba.GydF4y2Ba抵扣GydF4y2Ba四个开花时间途径相关基因的表达水平。GydF4y2BaFGydF4y2Ba花卉时序底层监管网络中主要集线基因的表达水平。8小时后的14株DAS植物(GydF4y2BaNGydF4y2Ba = 3) were measured, andActin2GydF4y2Ba作为内部控制。数据在统计上使用学生分析GydF4y2Bat -GydF4y2Ba测试。*GydF4y2BaP.GydF4y2Ba < 0.05. **P.GydF4y2Ba< 0.01。质膜固有蛋白;VRN(春化反应);哭(色素);时至今日(gibberellin-insensitive);RGA (GA1-3抑制因子);间谍(细长的);FCA(一种rna结合蛋白);FPA(一种rna结合蛋白);FVE (WD-40重复蛋白); AP1 (apetala1); FT (flowering locus t); FD (flowering locus d); SOC (suppressor of overexpression of constans 1); LFY (leafy); CO (constans); FLC (flowering locus c)
叶细胞生长GydF4y2Ba
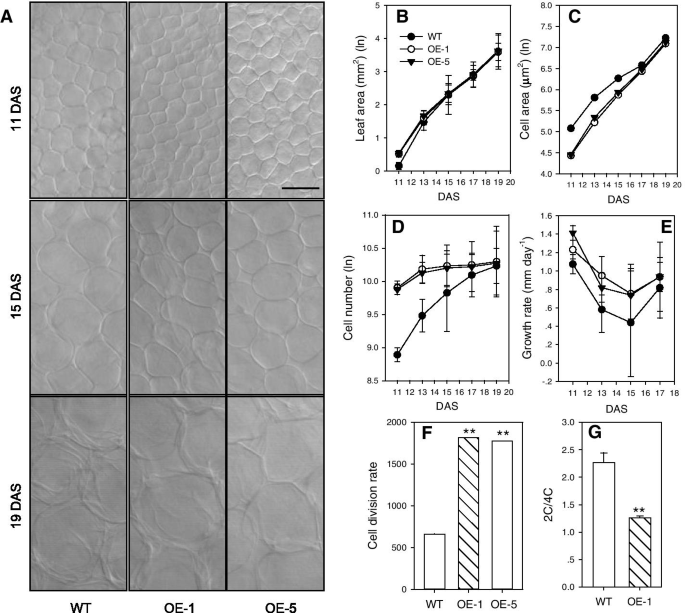
为了确定细胞加速生长的机制,对叶片发育过程中细胞的数量和大小进行了运动学分析。3GydF4y2Ba理查德·道金斯GydF4y2Ba叶片在WT发育过程中每2天收获一次GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba;更准确地说,抽样时间为分层(DAS)后11 ~ 19天。测定叶片大小和栅栏细胞面积。叶面积GydF4y2BaPtoPIP1; 1GydF4y2Ba在第11和13 DAS时,OE植株比WT分别大45.3%和17.5%,但在第19 DAS时与之相当(图2)。GydF4y2Ba4.GydF4y2Bab). OE植株的栅栏细胞大小在第11、13和15 DAS时小于WT,在第17和19 DAS时相似(图2)。GydF4y2Ba4.GydF4y2Baa, c)。在第11和13 DAS时,OE植物的计算细胞数大于WT,而在第17和19 DAS时则几乎相同(图2)。GydF4y2Ba4.GydF4y2Bad)。较高的细胞分裂率和较大的叶面积GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba比WT在早期发育阶段的作用要大(图。GydF4y2Ba4.GydF4y2Bae,f)表明GydF4y2BaPtoPIP1; 1GydF4y2Ba能通过加速细胞分裂促进叶片生长发育。进一步,对野生型和野生型细胞分裂的现状进行了分析GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba通过流式细胞术分析11 das。结果表明,4C分数GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba(55.6%)比WT拟南芥(31.5%)大得多(图。GydF4y2Ba4.GydF4y2Bag),进一步说明PtoPIP1;1能促进叶片细胞的生长。GydF4y2Ba
3的表征GydF4y2Ba理查德·道金斯GydF4y2Ba叶和二GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba行(OE-1和OE-5)。GydF4y2Ba一种GydF4y2Ba栅栏细胞3GydF4y2Ba理查德·道金斯GydF4y2Ba叶和GydF4y2BaPtoPIP1; 1GydF4y2BaOE分别在分层(DAS)后11、15和19天。Bar = 20µm。GydF4y2BaB.GydF4y2Ba叶面积,表示±标准误差(GydF4y2BaNGydF4y2Ba= 6 ~ 8)。GydF4y2BaCGydF4y2Ba栅栏细胞区域。用6 ~ 8张叶片照片中的40 ~ 60个叶片细胞测量细胞面积。GydF4y2BaD.GydF4y2Ba计算的单元格数3GydF4y2Ba理查德·道金斯GydF4y2Ba叶和二GydF4y2BaPtoPIP1; 1GydF4y2BaOE线。平均值±标准误差(GydF4y2BaNGydF4y2Ba= 6 ~ 8)。GydF4y2BaE.GydF4y2Ba基于来自A的数据计算相对细胞生长速率。相对细胞生长速率表示为细胞面积的增加(μmGydF4y2Ba2GydF4y2Ba)相对于每单位时间(日)的先前细胞面积。GydF4y2BaFGydF4y2Ba平均细胞分裂率根据a的数据计算,11-DAS幼苗的平均细胞分裂率表示为单位时间内的平均细胞数。GydF4y2BaGGydF4y2Ba来自3的2C / 4C细胞的比例GydF4y2Ba理查德·道金斯GydF4y2BaWT和GydF4y2BaPtoPIP1; 1GydF4y2Ba通过流式细胞识标分析它们的核DNA含量的11das的OE线。2C/4C比值的数据代表6个生物重复的平均值,每个重复汇集了多个叶片。数据在统计上使用学生分析GydF4y2Bat -GydF4y2Ba测试。**GydF4y2BaP.GydF4y2Ba < 0.01
根细胞生长GydF4y2Ba
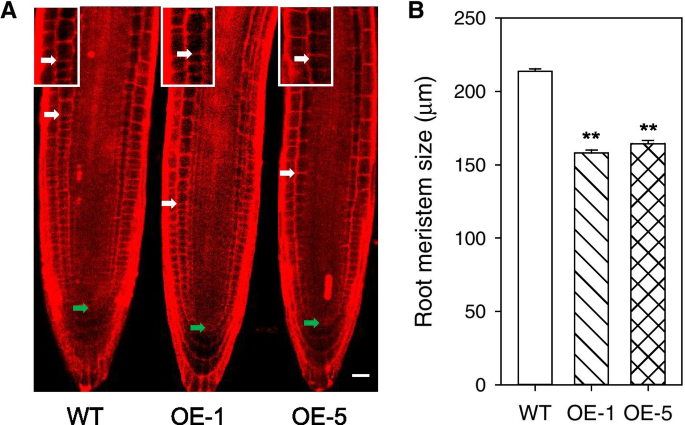
拟南芥GydF4y2Ba根也是研究细胞分裂、伸长和终末分化的良好模型[GydF4y2Ba33GydF4y2Ba];因此,根长度、根分生组织大小和根细胞大小都在WT和GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba.根长度GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba与wt的没有显着差异(图S4a,b);但是,根业证大小GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba显着降低24.5%(图。GydF4y2Ba5.GydF4y2Ba),表明根细胞的伸长分化被促进GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba.此外,6的细胞长度GydF4y2BathGydF4y2Ba细胞从伸长的根GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba的长度比WT小28.9%,而WT和GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba(图S4C),这与叶栅细胞的生长过程相一致。根的长度和根分生组织的大小另2GydF4y2Ba皮普GydF4y2Ba年代,GydF4y2BaPtoPIP1; 3GydF4y2Ba和GydF4y2Baptopip2; 3GydF4y2Ba, OEGydF4y2Ba拟南芥GydF4y2Ba没有与wt的差异(图S5),表示并非所有的GydF4y2Ba皮普GydF4y2BaS参与根细胞生长的调控。GydF4y2Ba
防水和托尔压力GydF4y2Ba
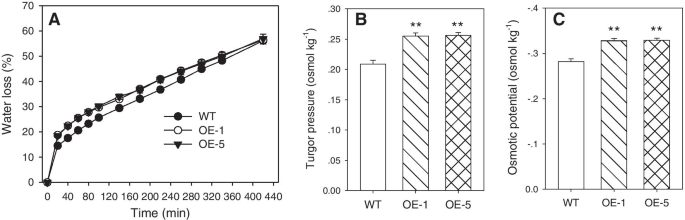
由于AQPS促进了细胞膜的水运动[GydF4y2Ba34GydF4y2Ba],WT和WT之间的水损失差异GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba是检查。水分损失GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba显著快于WT(图。GydF4y2Ba6.GydF4y2BaA),表明过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba改变了水的状态。由于膨压在细胞分裂和扩张/伸长中起着关键作用[GydF4y2Ba19GydF4y2Ba那GydF4y2Ba24GydF4y2Ba那GydF4y2Ba35GydF4y2Ba的渗透势GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba,并据此计算膨压。与野生拟南芥相比,GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba渗透势显著降低,膨压显著升高(图。GydF4y2Ba6.GydF4y2Bab,c)。值得注意的是,托槽压力增加约0.05奥姆莫克的值GydF4y2Ba-1GydF4y2Ba(无花果。GydF4y2Ba6.GydF4y2Bab),这足以根据对萝卜子叶的先前研究促进细胞分裂[GydF4y2Ba19GydF4y2Ba].GydF4y2Ba
生理参数检测WT和二GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba行(OE-1和OE-5)。GydF4y2Ba一种GydF4y2Ba在WT和WT中检测到水分损失GydF4y2BaPtoPIP1; 1GydF4y2BaOE线。条形图代表了至少4种植物的平均值的标准误差。GydF4y2Bab, cGydF4y2Ba膨压(GydF4y2Bab)GydF4y2Ba和渗透势(GydF4y2Bac)GydF4y2Bawt和GydF4y2BaPtoPIP1; 1GydF4y2Ba11 DAS的OE线。数据显示为来自六个生物复制的平均值±SE。数据在统计上使用学生分析GydF4y2Bat -GydF4y2Ba测试。**GydF4y2BaP.GydF4y2Ba < 0.01
讨论GydF4y2Ba
在这项研究中,我们报告了这一组成型过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba快速叶和根细胞生长加速植物发育。托尔戈尔压力被改变GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba到可能影响细胞增长的水平。GydF4y2Ba
调控开花的自主途径是指不依赖于光周期、温度和赤霉素途径的内源调控因子。自主通路中的所有基因都是通过抑制来起作用的GydF4y2BaFLC.GydF4y2Ba表达 [GydF4y2Ba29GydF4y2Ba],如本研究所示,其中GydF4y2BaFLC.GydF4y2Ba表达在OE植物中显着下调。FCA(其基因在本研究中上调)显示与下调相关GydF4y2BaFLC.GydF4y2Ba[GydF4y2Ba36GydF4y2Ba].另一方面,上调的GydF4y2BaFT.GydF4y2Ba和GydF4y2BaSOC1GydF4y2Ba也证实了下调GydF4y2BaFLC.GydF4y2Ba[GydF4y2Ba37GydF4y2Ba].此外,Cryptochromes(Cry)促进光学发育和从植物转变为花卉发展的转变[GydF4y2Ba38GydF4y2Ba].生长速率和生长量可能为开花调控通路输入信号。报道,GydF4y2BaAgalinis strictifoliaGydF4y2Ba开花早于生长较慢的个体[GydF4y2Ba39GydF4y2Ba],较大的植物比较小的植物开花更早,开的花更多[GydF4y2Ba40GydF4y2Ba].在本研究中,开花较早GydF4y2Ba拟南芥GydF4y2Ba在发育过程中,根和叶的生长都更快。GydF4y2Ba
通过表型和组织细胞学分析,我们发现GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba表现出与前面提到的相同的加速生长GydF4y2Ba皮普GydF4y2BaOE植物[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba41GydF4y2Ba那GydF4y2Ba42GydF4y2Ba].然而,应该注意的是,不是所有的GydF4y2Ba皮普GydF4y2BaOE植物显示出改善的生长。例如,GydF4y2BaAtPIP1; 4GydF4y2Ba和GydF4y2BaATPIP2; 5GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba和烟草[GydF4y2Ba43GydF4y2Ba],GydF4y2Bamusapip1; 2GydF4y2Ba和GydF4y2BaMusapip2; 6.GydF4y2Baoe香蕉[GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba],GydF4y2BaBnPIP1GydF4y2BaOE烟草[GydF4y2Ba12GydF4y2Ba],GydF4y2Bacspip1; 1GydF4y2Ba那GydF4y2BaCFPIP2; 1GydF4y2Ba那GydF4y2BaMFPIP2-7GydF4y2Ba那GydF4y2BaThPIP2; 5GydF4y2Ba,GydF4y2BaMsPIP2; 2GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba43GydF4y2Ba那GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba那GydF4y2Ba48GydF4y2Ba与他们的非转基因对照组没有区别。此外,还有一些增长GydF4y2Ba皮普GydF4y2Ba植物甚至被抑制,如GydF4y2Babjpip1.GydF4y2BaOE烟草[GydF4y2Ba49GydF4y2Ba],GydF4y2BaRsPIP1; 1GydF4y2BaOEGydF4y2Ba桉树GydF4y2Ba[GydF4y2Ba15GydF4y2Ba], 和GydF4y2BaATPIP2; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba].在我们的研究中,虽然GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba表现出加速植物生长,增长和发展GydF4y2BaPtoPIP1; 3GydF4y2Ba和GydF4y2Baptopip2; 3GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba因此,并不是所有PIP成员都能促进植物生长。GydF4y2Ba
细胞生长通过细胞分裂和细胞扩张/伸长-分化发生[GydF4y2Ba1GydF4y2Ba].在我们的研究中,叶栅细胞和根细胞的生长过程GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba是相似的。叶子尺寸较大,普拉迪斯细胞尺寸较小GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba比在叶片发育的早期阶段的WT,而叶子尺寸和拨塔细胞尺寸在叶片发育后期的阶段变得类似于WT,表明细胞分裂在叶发育的早期阶段促进,并且促进了细胞扩张过度表达的叶片开发的晚期GydF4y2BaPtoPIP1; 1GydF4y2Ba.对于根,虽然根分生组织的大小降低GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba,整个根长度和成熟的根细胞尺寸在wt和GydF4y2BaPtoPIP1; 1GydF4y2Ba结果表明,在OE细胞株中过表达可促进根细胞的伸长分化GydF4y2BaPtoPIP1; 1GydF4y2Ba.总之,过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba加速叶片和根细胞生长,从而在发育过程的早期阶段生长。GydF4y2Ba
膨压是植物细胞生长的重要驱动力,包括细胞分裂、细胞扩张和细胞壁伸长[GydF4y2Ba19GydF4y2Ba那GydF4y2Ba24GydF4y2Ba那GydF4y2Ba35GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].在本研究中,膨胀压力GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba大约比wt高约1.3巴。据报道,由于橡胶压力增加到1.0巴,可以大大刺激细胞分裂,而刺激细胞膨胀,因为砂萝卜子叶中的3.0巴升高3.0巴增加[GydF4y2Ba20.GydF4y2Ba].因此,膨胀压力的增加GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba足以促进细胞分裂。尽管膨胀的潜在机制是GydF4y2BaPtoPIP1; 1GydF4y2Ba表达不清楚,一些植物水通道蛋白可以运输小的中性溶质,如甘油、尿素、甲酰胺、乙酰胺、甲铵、硼酸、硅酸、乳酸和COGydF4y2Ba2GydF4y2Ba(查看Maurel等人的审查。[GydF4y2Ba5.GydF4y2Ba),这些都会影响细胞的渗透压和充盈。例如,干旱负荷、过氧化氢和缺氧处理导致玉米根系水通道蛋白介导的水力传导率降低,据报道对膨压和叶片伸长率有影响[GydF4y2Ba22GydF4y2Ba], 和GydF4y2BaCpPIP2GydF4y2Ba被认为是一种潜在的基因,用于调节膨压驱动的发育纤维伸长[GydF4y2Ba51GydF4y2Ba].事实上,渗透潜力降低,托尔压力增加GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba,虽然这里的Turgor压力是计算但没有直接确定。然而,应该注意的是,与使用细胞压力探针的直接Turgor压力测定方法相比,此处使用的Turgor压力估计方法,结果显示了这两种方法之间的良好一致性[GydF4y2Ba52GydF4y2Ba].有趣的是,同样的材料,PtPIP1;1被发现参与渗透胁迫反应[GydF4y2Ba27GydF4y2Ba].GydF4y2Ba
在这项研究中,GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba表现出植物生长加速,而GydF4y2BaPtoPIP1; 3GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba与WT相差不大。失水实验反映了GydF4y2BaPtoPIP1; 1GydF4y2Ba.因此,过度表达GydF4y2BaPtoPIP1; 1GydF4y2Ba由于所有植株都生长在相对湿度为100%的培养皿中,可以增加水分向根的被动转运率;在此条件下,根内外均存在较大的水势梯度。此外,有报道称,即使在有利的生长条件下,WT植物也可能由于水通道蛋白的次优共体水运输而始终遭受水分亏缺[GydF4y2Ba16GydF4y2Ba].在这里,观察到加速的植物生长GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba进一步证实了PtoPIP1引起的水渗透系数增大;此外,在低渗条件下,大部分PtoPIP1;1蛋白在根的两端表皮和皮层细胞中积累。PtoPIP1;1的定位模式可能反映了其对不同水条件的动态响应,以促进适当的水运输。这一发现与先前的一份报告显示,一致增长根细胞的渗透系数应该看到更多的背景下促进水流通过组织而不是促进水吸收速度足够高到单个细胞,支持细胞的扩张生长(GydF4y2Ba53GydF4y2Ba].GydF4y2Ba
结论GydF4y2Ba
杨树根特异性基因的结构性过表达GydF4y2BaPtoPIP1; 1GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba在发育过程的早期,通过加快叶子和根的细胞生长来加速开花。本研究结果表明表达GydF4y2BaPtoPIP1; 1GydF4y2Ba可以增加Turgor压力,并且Turgor压力改变促进了植物发育的某个阶段的加速植物生长。伴随加速增长,涉及自主途径开花调节的基因发生了变化。开花调节的自主途径可以通过监测发育年龄和开花相关基因的表达水平来执行(GydF4y2BaCRY1GydF4y2Ba那GydF4y2BaCRY2GydF4y2Ba和GydF4y2BaFCA.GydF4y2Ba)和花时调控网络中的中心基因(GydF4y2BaFT.GydF4y2Ba和GydF4y2BaSOC1GydF4y2Ba)在OE植物中显著上调。第一个信号可能是促进叶片生长发育,第二个信号可能是自主通路中基因的中枢调控网络。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
拟南芥GydF4y2Ba生态型号GydF4y2BaCol-0.GydF4y2Ba,通过TAIR从拟南芥生物资源中心(ABRC)获得(GydF4y2Bawww.arabidopsis.orgGydF4y2Ba),温室条件为21℃,光照16 h /暗8 h,相对湿度70%,光照强度110 μmol mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba.无菌种子被放置在添加1%蔗糖(Suc)和0.8%琼脂的1/2 MS上。7 - das(分层后的第一天)幼苗转移到土壤中,继续生长约两个月以收获种子。为了进行分生组织大小分析和水势测量,转基因幼苗与相应的WT植株在同一平板上垂直放置。GydF4y2Ba
杂交杨树的幼苗GydF4y2Ba杨树阿尔巴GydF4y2Ba和GydF4y2Bap . glandulosaGydF4y2Ba无性系84k的扦插繁殖。部分茎长8厘米的两个或三个侧芽扎根和成长的2个月塑料锅(深30厘米×直径26厘米,每个锅一个幼苗)充满了人工土壤在半控温室20°C-28°C与相对湿度和光合有效辐射波动30至55%,分别为600和1200 μmol m-2 s-1。花盆每周随机旋转两次,以减少边缘效果。GydF4y2Ba
亚细胞本地化GydF4y2Ba
为了确定PtoPIP1;1的亚细胞定位,我们在PtoPIP1;1的编码区不带终止密码子,通过pcr介导添加attB位点,并按照制造商的方案(Invitrogen公司)插入pDONR 222。然后通过LR反应(Invitrogen)将cDNA转移到目的载体pEarleyGate 101(C-YFP)中,构建35S::PtoPIP1;1-YFP。瞬时表达PtoPIP1;1-YFP和GFP-HDELGydF4y2Ba尼古利亚娜·宾夕法尼亚州GydF4y2Ba使用叶片下表皮细胞使用GydF4y2Ba农杆菌GydF4y2Ba根据以前的报告进行的改造[GydF4y2Ba54GydF4y2Ba].GydF4y2Ba
质粒构建及基因表达分析GydF4y2Ba
杨树GydF4y2Ba皮普(表GydF4y2Ba1GydF4y2Ba)序列从杨树基因组数据库(GydF4y2Bahttp://www.phytozome.net/poplar.phpGydF4y2Ba,发布3.0)和NCBI数据库(GydF4y2Bahttp://www.ncbi.nlm.nih.gov/GydF4y2Ba),而GydF4y2Ba拟南芥GydF4y2Ba从Tair获得PIP蛋白序列(GydF4y2Bahttp://www.arabidopsis.org/GydF4y2Ba).然后,使用Clustalx程序进行氨基酸序列比对(GydF4y2Bahttp://www.clustal.org/GydF4y2Ba).一个假定的与其他同源的全长表达序列(位点名Potri.010G191900)GydF4y2BaPIP1sGydF4y2Ba(图S1)。的信用违约掉期GydF4y2BaPIP1; 1GydF4y2Ba那GydF4y2BaPIP1; 3GydF4y2Ba和GydF4y2BaPIP2; 3GydF4y2Ba被克隆GydF4y2BaPopulus tomentosaGydF4y2Ba使用表S2所列引物。对于过表达,首先将纯化的PCR产物插入pMD-19载体(TaKaRa),并通过DNA测序确认。然后用XbaI和SalI消化连接序列GydF4y2BaPtoPIP1; 1GydF4y2Ba那GydF4y2BaPtoPIP1; 3GydF4y2Ba和GydF4y2Baptopip2; 3GydF4y2Ba使用T4连接酶(NEB)进入PBI121二元载体,导致GydF4y2Ba35 s:: PtoPIP1; 1GydF4y2Ba那GydF4y2Ba35 s:: PtoPIP1; 3GydF4y2Ba和GydF4y2Ba35 s:: PtoPIP2; 3GydF4y2Ba分别构造。GydF4y2Ba
采用qRT-PCR方法对2月龄杨树(GydF4y2Ba杨树阿尔巴GydF4y2Ba×GydF4y2BaPopulus GlandulosaGydF4y2Ba(克隆84k)在温室中生长。取顶端第3片叶提取总RNA,取茎中部木质部部分提取茎RNA,取细根提取根RNA。采用7500 real-time PCR系统(Applied Biosystems, CA, USA),使用SYBR Premix Ex TaqTM试剂盒(TaKaRa, Tokyo, Japan)进行实时定量PCR (qRT-PCR)分析。引物的GydF4y2Ba拟南芥GydF4y2Ba开花相关基因[GydF4y2Ba29GydF4y2Ba]发现了pip基因GydF4y2Bap . trichocarpaGydF4y2Ba[GydF4y2Ba26GydF4y2Ba]用于qRT-PCR分析,其长度为20-24个核苷酸,预测熔化温度为59-61℃(表S3)。pcr检测共20µL,内含0.2µM引物、2µL cDNA和10µL SYBR Premix Ex Taq™(2 ×)。30年代的PCR程序1周期在95°C,紧随其后的是40 95°C的周期5 s和60°C 34 s,最终分离阶段15秒95°C,紧随其后的是60°C 1分钟和95°C 15 s来验证引物的特异性。无模板pcr作为阴性对照。最终阈值循环(Ct)值是3个生物重复中12个值的平均值,每个生物重复中有4个技术重复。利用7500 Real-Time PCR软件计算相对转录本丰度GydF4y2BaEIF-5AGydF4y2Ba对于poplar [GydF4y2Ba26GydF4y2Ba),GydF4y2BaActin2GydF4y2Ba为了GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba55GydF4y2Ba作为内部控制。GydF4y2Ba
植物转化GydF4y2Ba
35s :: ptpip1; 1GydF4y2Ba那GydF4y2Ba35s :: ptpip1; 3GydF4y2Ba那GydF4y2Ba35 s:: PtPIP2; 3GydF4y2Ba和35s :: ptpip1; 1-yfp构建体被引入到GydF4y2Ba根癌土壤杆菌GydF4y2BaGV3101应变。使用花浸法进行农杆菌介导的转化[GydF4y2Ba56GydF4y2Ba在GydF4y2BaCol-0拟南芥GydF4y2Ba.在添加30 mg L的1/2 MS板上筛选可能的转基因植株GydF4y2Ba-1GydF4y2BaKanamycin然后转移到土壤中进行繁殖。对T2代的抗Kanamycin抗性植物进行表达分析。纯合T3转基因植物与WT植物一起用于进一步研究。在这项研究中,总共超过10个过表达线GydF4y2BaPtPIP1; 1GydF4y2Ba生成,与非转基因对照植物相比,所有这些都具有早期开花表型。其中,选择了两个独立的线,OE-1和OE-5,以进行进一步的功能分析,鉴于实验的重量工作。GydF4y2Ba
用于荧光信号检测,根源GydF4y2Ba35s :: ptpip1; 1GydF4y2Ba-YFPGydF4y2Ba拟南芥GydF4y2Ba使用共聚焦显微镜(Zeiss LSM 510)在1/2毫秒或水(低渗条件)中观察到。图像(图。GydF4y2Ba1GydF4y2Bab)所示的代表至少三个独立实验,每种溶液中至少具有10根。GydF4y2Ba
叶生长分析GydF4y2Ba
对第3叶不同采收时间(11、15和19 DAS)的叶片生长进行了分析。用甲醛-乙酸-酒精(FAA)固定叶片,然后用水合氯醛溶液(水合氯醛200 g,甘油20 g, H 50 ml)清除叶片GydF4y2Ba2GydF4y2Ba然后将叶片置于100%乳酸的镜检玻片上。所有的观测都是使用蔡司LSM 510 AX70和差分干涉对比物镜进行的。利用IMAGEJ软件(GydF4y2Bahttp://rsb.info.nih.gov/ij/GydF4y2Ba),相应地计算细胞数。在从尖端和叶片的底部之间的距离和叶片之间的距离之间的距离和叶片边缘之间的一半,测量细胞区域。对于运动学分析,LN转化的叶面积,细胞面积和细胞数局部地适合于二次功能,其中第一衍生物分别作为相对生长和膨胀[GydF4y2Ba57GydF4y2Ba那GydF4y2Ba58GydF4y2Ba].GydF4y2Ba
流动细胞术分析GydF4y2Ba
根据先前报告的方法进行流式细胞术分析[GydF4y2Ba59GydF4y2Ba].3GydF4y2Ba理查德·道金斯GydF4y2Ba叶片被解剖GydF4y2Ba拟南芥GydF4y2Ba在11das条件下,用剃刀将幼苗切碎,放入400µL的核提取缓冲液中。加入600µL碘化丙啶(50 μg/mL)染色缓冲液,用30µm滤膜过滤,收集上清。采用FACSCalibur流式细胞仪(BD Biosciences, CA, USA)分析细胞核DNA含量的分布。对于每个样本,我们分析了10,000个事件。采用ModFit LT 3.0软件分析细胞周期。2C/4C比值的数据代表6个生物重复的平均值,每个重复汇集了多个叶片。核2C/4C比率反映了细胞周期内细胞的状态[GydF4y2Ba60GydF4y2Ba].GydF4y2Ba
根长度和根分生组织大小分析GydF4y2Ba
将根染色在10μmPI溶液(Sigma-Aldrich)中染色2分钟。根部分生成定义为从静态中心(QC)延伸到过渡区的第一细长单元的皮质单元(TZ)[GydF4y2Ba61GydF4y2Ba].然后用lsm510共聚焦显微镜(Zeiss)测量根分生组织大小。使用IMAGE J软件测量根长(GydF4y2Bahttp://rsb.info.nih.gov/ijGydF4y2Ba).根部长度和根部分发尺寸的数据代表来自三个独立实验的手段,至少有20根的根。GydF4y2Ba
失水速度测定GydF4y2Ba
为了量化水分流失,至少4株14-DAS幼苗在测量前在黑暗中驯化3小时。在相对湿度为40 ~ 50%,温度为22℃左右的条件下,立即称量整株幼苗,每20 min称量一次。根据样品的初始鲜重计算失水比例。GydF4y2Ba
渗透势测量和托尔压力计算GydF4y2Ba
将11-DAS幼苗在液氮中冷冻,然后在1,500g中以1,500g离心20分钟的微量加电管。通过以9,600g以9,600g离心10分钟,通过离心10分钟获得细胞流体的进一步分离,并且在冻结点凹陷中使用30μl样品用Osmomat 030(Gonotec,Berlin,Germany)测量渗透势。自WT和GydF4y2BaPtoPIP1; 1GydF4y2BaOE植物所有在具有100%相对湿度的平板中成长,植物的水势被用作渗透介质的值。基于上述渗透势和水势,计算托尔压力,并且可以被认为是植物中涡轮压力的估计值[GydF4y2Ba62GydF4y2Ba].GydF4y2BaPtoPIP1; 1GydF4y2BaOEGydF4y2Ba拟南芥GydF4y2Ba植物和相应的WT在同一个培养皿中生长。用6个生物重复,每个重复集中多个叶片来测定渗透势。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在本文中,并从合理的请求中获取相应的作者。GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
Rymen B, Sugimoto K.调整增长以适应环境需求。植物生态学报。2012;15:683-90。GydF4y2Ba
- 2.GydF4y2Ba
Boyer JS。水运输。植物生理学年鉴1985;36:473-516。GydF4y2Ba
- 3.GydF4y2Ba
•DJ。生长细胞的水分吸收:壁松弛、溶质吸收和水力传导的控制作用的评估。acta botanica yunnanica(云南植物研究);GydF4y2Ba
- 4.GydF4y2Ba
水通道蛋白:植物和动物细胞的水通道蛋白。《生物化学趋势》1994;19:421-5。GydF4y2Ba
- 5.GydF4y2Ba
Maurel C,Verdoucq L,Luu Dt,Santoni V.植物水疗法:膜通道,具有多种集成功能。Annu Rev植物Biol。2008; 59:595-624。GydF4y2Ba
- 6.GydF4y2Ba
万X,Zwiazek JJ。白杨幼苗根水运输的酰胺氯化物作用。植物理性。1999年; 121:939-46。GydF4y2Ba
- 7.GydF4y2Ba
水通道蛋白在植物根系水分吸收中的作用。安机器人。2002;90:301-13。GydF4y2Ba
- 8。GydF4y2Ba
Peret B, Li G, Zhao J, Band LR, Voss U, Postaire O, Luu D-T, Da Ines O, Casimiro I, Lucas M, Wells DM, Lazzerini L, Nacry P, King JR, Jensen OE, Schäffner AR, Maurel C, Bennett MJ。生长素调节水通道蛋白的功能,促进侧根的出现。细胞生物学杂志。2012;14:991-8。GydF4y2Ba
- 9。GydF4y2Ba
Javot H,Lauvergeat v,Santoni V,Martin-Laurent F,Guclu J,Vinh J,Heyes J,Franck Ki,SchäffnerAR,Bouchez D,Maurel C.一种Aquaporin同种型在根浇水中的作用。植物细胞。2003; 15:509-22。GydF4y2Ba
- 10.GydF4y2Ba
海邮o,塔内港-roux c,grondin a,boursiac y,morillon r,schaffner ar,maurel c. pip1 apapaporin有助于静水诱导的根源诱导的水运输GydF4y2Ba拟南芥GydF4y2Ba.植物杂志。2010;152:1418-30。GydF4y2Ba
- 11.GydF4y2Ba
引用本文:丁磊,Uehlein N, Kaldenhoff R,郭树清,朱勇,Kai L.水通道蛋白PIP2;1对水稻水分运输和根系生长的影响(GydF4y2Ba栽培稻GydF4y2BaL.)。植物理性生物生物。2019; 139:152-60。GydF4y2Ba
- 12.GydF4y2Ba
于强,胡颖,李军,吴强,林志杰。质膜水通道蛋白的义和反义表达GydF4y2BaBnPIP1GydF4y2Ba从GydF4y2Ba芸苔属植物显著GydF4y2Ba及其对植物抗旱性的影响。植物科学。2005;169:647-56。GydF4y2Ba
- 13.GydF4y2Ba
errone i,gambino g,chitarra w,vitali m,pagliarani c,riccomagno n,balestrini r,kaldenhoff r,uehlein n,grabaudo i,schubert a,lovisolo c.葡萄树根特异性的水素GydF4y2BaVVPIP2; 4N.GydF4y2Ba在含水良好的条件下控制根液压传导和叶片气体交换,但不在水胁迫下。植物理性。2012; 160:965-77。GydF4y2Ba
- 14.GydF4y2Ba
Ayadi M,Brini F,Masmoudi K.过表达小麦水疗蛋白基因,GydF4y2BaTDPIP2; 1GydF4y2Ba,增强转基因硬质小麦CV中的盐和耐旱性。马利。int j mol sci。2019; 20(10):2389。GydF4y2Ba
- 15.GydF4y2Ba
田志刚,韩波,田志刚,川azu T, Maeshima M.过表达萝卜质膜水通道蛋白对水分利用效率、光合作用和生长的影响GydF4y2Ba桉树GydF4y2Ba树。树杂志。2010;30:417-30。GydF4y2Ba
- 16.GydF4y2Ba
在干旱和盐胁迫条件下,转基因烟草质膜水通道蛋白的过表达提高了植株的活力。植物细胞。2003;15:439-47。GydF4y2Ba
- 17.GydF4y2Ba
Ayadi M,Cavez D,Miled N,Chaumont F,Masmoudi K.杜兰姆小麦两种浆膜水电素的鉴定及表征(GydF4y2Ba小麦属植物turgidumGydF4y2BaL. subsp。杜伦姆)及其在非生物胁迫耐受性中的作用。植物理性生物生物。2011; 49:1029-39。GydF4y2Ba
- 18。GydF4y2Ba
彭y,arora r,li g,王x,fessehaie a。GydF4y2BaRhododendron catawbiense.GydF4y2Ba质膜固有蛋白为水通道蛋白,其过表达降低了转基因植物的抗冻性和冷适应能力GydF4y2Ba拟南芥GydF4y2Ba植物。植物细胞环境。2008; 31:1275-89。GydF4y2Ba
- 19。GydF4y2Ba
李茹,yu g,太阳x,刘y,刘j,张x,jia c,pan h.acpip2,含有含有含有血浆膜的血浆膜内在蛋白质GydF4y2Ba滨藜属canescensGydF4y2Ba,在过度表达时增强植物生长速率和非生物胁迫耐受性GydF4y2Ba拟南芥GydF4y2Ba.植物细胞批准。2015; 34:1401-15。GydF4y2Ba
- 20。GydF4y2Ba
Kirkham MB,Gardner WR,Gerloff GC。用磨削压力调节细胞分裂和细胞扩大。植物理性。1972; 49:961-2。GydF4y2Ba
- 21.GydF4y2Ba
张志强,张志强,张志强,等。酵母胞质分裂过程中充盈压力、收缩环和隔膜组装对细胞分裂力的影响。咕咕叫沸腾。2012;22:1601-8。GydF4y2Ba
- 22.GydF4y2Ba
Ehlert C,Maurel C,Tardieu F,Simonneau T. Aquaporin-介导的玉米根液态电导率的降低均匀影响细胞卷发和叶伸长率,即使不改变蒸腾。植物理性。2009; 150:1093-104。GydF4y2Ba
- 23.GydF4y2Ba
Ortega JK,Munoz CM,Blakley Se,Truong JT,Ortega El。PHYComyces的僵硬突变基因会影响Turgor压力和壁式机械性能以调节伸长率的生长速率。前植物SCI。2012; 3:99。GydF4y2Ba
- 24.GydF4y2Ba
Kutschera U, Niklas KJ。幼体植物的细胞分裂和膨胀驱动的茎伸长:一种合成。植物科学。2013;207:45-56。GydF4y2Ba
- 25.GydF4y2Ba
洛克哈特农协。植物细胞不可逆伸长的分析。J Theor Boil, 1965; 8:264-75。GydF4y2Ba
- 26.GydF4y2Ba
Leng H,Lu M,WAN X.在杨树克隆的干旱胁迫和重新浇水幼苗中栓塞发生和修复栓塞和修复。physiol platararum。2013; 147:329-39。GydF4y2Ba
- 27.GydF4y2Ba
江C,宋X,他,楚l,周H,赵y,徐y,zeng w,林x,lu m。覆盖血浆膜水上素基因家族的基因组覆盖GydF4y2Ba杨树GydF4y2Ba和功能鉴定GydF4y2BaPIP1; 1GydF4y2Ba涉及渗透压力。环境Exp Bot. 2020;179:104200。GydF4y2Ba
- 28.GydF4y2Ba
王志强,王志强,王志强,等。质膜水通道蛋白的相互作用对水通道活性的影响。植物细胞。2004;16:215-28。GydF4y2Ba
- 29.GydF4y2Ba
srikanth a,施密米的开花时间的调节:所有道路都通往罗马。细胞mol寿命。2011; 68:2013-37。GydF4y2Ba
- 30.GydF4y2Ba
SIMPSON GG,Dean C. Arabidopsis,花瓶开花时间的石头?科学。2002; 296:285-9。GydF4y2Ba
- 31.GydF4y2Ba
玉米根中质膜水通道蛋白基因的共浆分离和表达与细胞水通道蛋白对汞的敏感性一致。足底。2002;215:1047-56。GydF4y2Ba
- 32.GydF4y2Ba
葡萄果实成熟过程中两种质膜水通道蛋白的克隆与表达。植物学报2003;30:621-30。GydF4y2Ba
- 33.GydF4y2Ba
在根干细胞生态位维持过程中分泌的肽信号GydF4y2Ba拟南芥GydF4y2Ba.科学。2010;329:1065-7。GydF4y2Ba
- 34.GydF4y2Ba
Zeuthen T.水的被动和活性运输的分子机制。INT转速cytol。1995年; 160:99-161。GydF4y2Ba
- 35.GydF4y2Ba
朱国良,王志勇。膨胀,温度和植物细胞的生长:使用GydF4y2Ba查达·克拉纳GydF4y2Ba作为一个模型系统。J Exp Bot. 2000; 51:1481-94。GydF4y2Ba
- 36.GydF4y2Ba
刘凡,刘志强,刘志强,刘志强GydF4y2Ba拟南芥GydF4y2BaRNA结合蛋白FCA需要赖氨酸特异性的去甲基酶1同源物,以下调FLC。Mol细胞。2007; 28:398-407。GydF4y2Ba
- 37.GydF4y2Ba
Lim MH, Kim J, Kim YS, Chung KS, Seo YH, Lee I, Hong CB, Kim HJ, Park CM。一个新的GydF4y2Ba拟南芥GydF4y2BaFLK基因编码具有K同源基序的RNA结合蛋白,通过调控开花时间GydF4y2Ba开花轨迹CGydF4y2Ba.植物细胞。2004;16:731-40。GydF4y2Ba
- 38.GydF4y2Ba
Liu L, Zhang Y, Li Q, Sang Y, Mao J, Lian H, Wang L, Yang H. related to cryptochrome in(隐花色素)调控GydF4y2Ba拟南芥GydF4y2Ba.植物细胞。2008;20:292 - 306。GydF4y2Ba
- 39.GydF4y2Ba
王志强,王志强,王志强,等。水稻单株开花时间与生殖成功的关系GydF4y2BaAgalinis strictifoliaGydF4y2Ba(玄参科)。[中国科学(d辑:地球科学)]GydF4y2Ba
- 40。GydF4y2Ba
张志强,张志强,张志强,等。中国水稻开花物候、植株大小与繁殖成功的关系GydF4y2Ba莲花corniculatus.GydF4y2Ba(Fabaceae)。植物ECOL。1998年; 139:35-47。GydF4y2Ba
- 41。GydF4y2Ba
jang hy,ahn sj。过度表达GydF4y2Ba麻风手套GydF4y2Ba水通道蛋白基因,GydF4y2BaJcPIP1GydF4y2Ba和GydF4y2BaJcPIP2GydF4y2Ba,并不改变转基因拟南芥对盐和干旱胁迫的反应。作物科学与技术。2015;18:27-35。GydF4y2Ba
- 42。GydF4y2Ba
王旭,高峰,兵建,孙伟,冯旭,马旭,周勇,张刚GydF4y2BaJojoba.GydF4y2BaAquaporin基因,GydF4y2BaSCPIP1.GydF4y2Ba,增强转基因的干旱和耐盐性GydF4y2Ba拟南芥GydF4y2Ba.int j mol sci。2019; 20(1):153。GydF4y2Ba
- 43。GydF4y2Ba
张智勇,李胜华,李智勇,郑贞洁,安淑娟,姜浩GydF4y2Ba拟南芥GydF4y2Ba过表达Aquaporin的烟草植物与各种非生物应激不同。植物mol biol。2007; 64:621-32。GydF4y2Ba
- 44。GydF4y2Ba
过度表达天然质膜水通道蛋白MusaPIP1;2的转基因香蕉植株对不同的非生物胁迫表现出较高的耐受性。植物生态学报2013;11:942-52。GydF4y2Ba
- 45.GydF4y2Ba
一种天然水通道蛋白基因的结构性和胁迫诱导的过表达(GydF4y2BaMusapip2; 6.GydF4y2Ba)表明其在耐盐性方面的关键作用。植物学报。2015;88:41-52。GydF4y2Ba
- 46.GydF4y2Ba
卓聪,王涛,郭梓,卢森GydF4y2BaMFPIP2-7GydF4y2Ba从GydF4y2BaMedicago Falcata.GydF4y2Ba在NO3(-)缺乏条件下,促进转基因烟草植株的耐冷性和生长。BMC Plant Biol. 2016;16:138。GydF4y2Ba
- 47.GydF4y2Ba
王林,张超,王勇,杨超,卢敏,王超。GydF4y2Ba甘蒙柽柳hispidaGydF4y2Ba水通道蛋白GydF4y2BaThPIP2; 5GydF4y2Ba将盐和渗透胁迫耐受性赋予转基因GydF4y2BaTamarix.GydF4y2Ba和GydF4y2Ba拟南芥GydF4y2Ba.Environ Exp Bot。2018; 152:158-66。GydF4y2Ba
- 48.GydF4y2Ba
李胜,刘军,安勇,曹勇,刘勇,张杰,耿军,胡涛,杨鹏。GydF4y2BaMsPIP2; 2GydF4y2Ba,一种新的水素基因来自GydF4y2Ba紫花苜蓿GydF4y2Ba,赋予转基因植物耐盐性GydF4y2Ba拟南芥GydF4y2Ba.Environ Exp Bot。2019; 165:39-52。GydF4y2Ba
- 49.GydF4y2Ba
张Y,王Z,柴T,温Z,张H.印度芥末水素含水量提高了烟草的干旱和重金属抗性。莫尔生物科技。2008; 40:280-92。GydF4y2Ba
- 50。GydF4y2Ba
植物生长的细胞基础:几何结构的影响。植物学报2019;47:56-63。GydF4y2Ba
- 51。GydF4y2Ba
aslam u,哈哈霍a,cheema hm,bashir a。从纤维细胞中分离的质膜水素鉴定和表征GydF4y2BaCalotropis ProceraGydF4y2Ba.J Zhejiang Univ-SC B. 2013; 14:586-95。GydF4y2Ba
- 52。GydF4y2Ba
Tomos广告,Leigh Ra,Shaw Ca,琼斯RGW。测量红甜菜储存组织渗流压和渗透压渗透压的方法的比较。J Exp Bot。1984年; 35:1675-83。GydF4y2Ba
- 53.GydF4y2Ba
植物水通道蛋白与细胞伸长。在Chaumont F, Tyerman DS,编。植物水通道蛋白。施普林格国际出版,2017;p . 107 - 131。GydF4y2Ba
- 54.GydF4y2Ba
周H,歌X,魏K,赵Y,江C,王J,陆唐F m .生长调节因子15叶大小控制是必需的GydF4y2Ba杨树GydF4y2Ba.树生理。2019; 39:381-90。GydF4y2Ba
- 55.GydF4y2Ba
关键词:组蛋白H3 N-tail,赖氨酸修饰,干旱胁迫GydF4y2Ba拟南芥GydF4y2Ba.acta botanica yunnanica(云南植物研究). 2008;49:1580-8。GydF4y2Ba
- 56.GydF4y2Ba
花的倾斜:一种简化的方法GydF4y2Ba农杆菌GydF4y2Ba介导的变换GydF4y2Ba拟南芥GydF4y2Ba.植物j . 1998; 16:735-43。GydF4y2Ba
- 57.GydF4y2Ba
de Veylder L,Beeckman T,Beemster Gt,Krols L,Terras F,Landrieu I,Schueren Evd,Maes S,Naudts M,inzéD。inzéd的功能分析依赖性激酶抑制剂GydF4y2Ba拟南芥GydF4y2Ba.植物细胞。2001; 13:1653-68。GydF4y2Ba
- 58.GydF4y2Ba
Skirycz A, Claeys H, De-Bodt S, Oikawa A, Shinoda S, Andriankaja M, Maleux K, Eloy NB, Coppens F, Yoo S-D, Saito K, Inzé D. Pause-and-stop: the effects of osmotic stress on cell proliferation during early leaf development in拟南芥GydF4y2Ba以及乙烯信号在细胞周期阻滞中的作用。植物细胞。2011;23:876 - 1888。GydF4y2Ba
- 59.GydF4y2Ba
利用流式细胞仪测定植物核DNA含量。Nat Protoc。2007;2:2233-44。GydF4y2Ba
- 60。GydF4y2Ba
张超,龚福成,GM, Galbraith DW。复杂组织和器官中细胞核DNA内容的细胞类型特异性特征。工厂方法。2005;1:7。GydF4y2Bahttps://doi.org/10.1186/1746-4811-1-7GydF4y2Ba.GydF4y2Ba
- 61。GydF4y2Ba
Casamitjana-Martinez E,Hofhuis HF,Xu J,Liu Cm,Heidstra R,Scheres B.根特异性CLE19过表达和Sol1 / 2抑制器在控制中致暗GydF4y2Ba拟南芥GydF4y2Ba根业证维护。Curr Biol。2003; 13:1435-41。GydF4y2Ba
- 62。GydF4y2Ba
氮营养和水分胁迫对水稻细胞膜稳定性和叶片水分关系的影响GydF4y2BaAgrostis Palustris.GydF4y2BaHuds。Environ Exp Bot. 2004; 52:131-8。GydF4y2Ba
确认GydF4y2Ba
一个也没有。GydF4y2Ba
资金GydF4y2Ba
这项工作是由RIF(RIF-2014-08)到XS的基本研究基金和RIFNT(CAFYBBBB218SZ019)到XW的财务支持。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
H.L.,X.W.和M.L.设计了这项研究。H.L.和C.J.进行实验。H.L.和X.S.分析了数据。H.L.,M.L.,X.W.和X.S.所有人都参加了写作稿件。作者读并批准了最终的稿件。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者声明没有竞争利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
姜超,宋旭东。GydF4y2Ba等等。GydF4y2BaPoplar Aquaporin.GydF4y2BaPIP1; 1GydF4y2Ba促进GydF4y2Ba拟南芥GydF4y2Ba增长和发展。GydF4y2BaBMC植物杂志GydF4y2Ba21,GydF4y2Ba253(2021)。https://doi.org/10.1186/s12870-021-03017-2GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-03017-2GydF4y2Ba
关键词GydF4y2Ba
- PtoPIP1; 1GydF4y2Ba
- 开花的时间GydF4y2Ba
- 自治的途径GydF4y2Ba
- 增长GydF4y2Ba
- Turgor压力GydF4y2Ba