抽象的
背景
肉质水果的皮肤(exocarp)在物种上都是多样化的。大多数果实类型都有一个由由cutin组成的角质层覆盖的活表皮皮肤,而少数人创造了最外层的死细胞(白斑层)。
结果
本研究对猕猴桃表皮和周表皮表皮进行杂交,结果表明,表皮表皮是猕猴桃半显性性状。此外,将这些表皮剥皮的杂交种与周皮剥皮的果实回交,可以产生一系列不同的表型,从表皮剥皮的果实,到周皮有不同程度斑块(黄褐色)的果实,再到具有完整的周皮的果实。该群体的数量性状位点(QTL)分析表明,围皮形成与4个位点有关。这些qtl要么与19号染色体和24号染色体上与赤褐色形成相关的qtl,要么与3号染色体、11号染色体和24号染色体上的角质层完整性和覆盖度相关。
结论
从皮肤型和QTL分析的分离,似乎皮肤开发的皮肤开发由两个竞争因素,角质层强度和互感的倾向控制。强烈的角质层将抑制象征,而对赤褐色的强烈倾向可以造成连续死皮皮肤。
背景
在植物中,肉质果实与环境的蛋白质植物界面的exocarp(皮肤)对于内脏的保护和支持是必不可少的,并且通常会改变以吸引种子分散的食草动物。果实物种之间的exocarp类型的形态是多种多样的,颜色,组成和结构。虽然大多数果实具有活形表皮皮肤,但覆盖着厚厚的蜡质角质层,一些果实形式形成垂直的皮肤(萼片),形成死层以保护水果。Periderm通过多级过程形成,该过程涉及在表皮下的软木塞复合物的发展。软木塞套企业公司创造了许多薄壁细胞层,这些细胞层是顺序融合或徘徊的,并接受编程的细胞死亡[1].Periderm形成可以在整个果实上发生,或者仅在形成象征象征的果实部分上。
有许多果实具有密切相关的物种,其显示表皮和白斑皮肤类型,包括猕猴桃sp。(奇异果),Pyrus.sp。(梨)和马鲁斯sp。(苹果)。这些物种的研究表明,胰岛形成(象征)由遗传和环境控制。日本梨的皮肤(Pyrus Pyrifolia'nakai')可以用特征性垂体层呈孤立,并且由消费者优选[2].早期测试跨研究[2]预测赤褐色地层是具有两个控制因素的显性性状[3.].以后的研究使用两种日本梨隔离种群的粗偏析分析鉴定了一个RAPD标志物,解释了92%的未russrused绿色皮肤表型[4.].中文和日本梨之间的一个间隙的交叉确定了与LG8上互联网相关的基因座[5.那6.].最近,已经提出了罗布拉是一种单一的特征,由占优势基因控制[7.].这个新更新的概念是基于绿色和赤褐色exocarp之间的双向russration [8.那9.].这些研究表明,赤褐色和半赤褐色是独立遗传的,当共同遗传时,赤褐色掩盖了半赤褐色的外果皮。
一些马鲁斯sp。(Apple)还有品种,这些品种要么完整的赤褐版,如“Merton Russtr”,或部分象征障碍,如“金色美味”中的那些10.].在“Renetta Grigia di Torriana”中的一个主要QTL控制苹果徽章在LG12上报道了[11.].本研究提出了一种主要基因(茹)控制象征,建议ABCG家族运输车是最有可能的茹候选人。在另一个群体中,在LG2和LG15上又发现了两个与赤褐色相关的qtl [12.].本研究表明,SHN1 / WIN1转录因子(mdshn3.)可能是控制赤褐色的候选品种。一项对易发生赤褐色疾病的品种的皮肤发育的研究表明,开花时的皮肤损伤会导致赤褐色持续到成熟[10.].
最常见的商用绿色猕猴桃Actinidia chinensis.var。deliciosa“海沃德”的周围皮肤呈黄褐色。不太为人所知的猕猴桃有各种各样的果皮类型,包括表皮或周表皮,或两者的组合,以及各种各样的果毛类型[13.那14.那15.].其他锥形皮肤的kiwifruit包括黄色肉体A. Chinensis.var。中国人和红色肉体A. Chinensis.var。中国人“弘扬”,A. Arguta.和A. Melanandra种有表皮皮肤类型(生活角质层,有不同程度的毛)。对…的周围皮肤的详细研究A. Chinensis.[15.]显示了一个集中的杂化组织层,而A. Arguta.果实通过果实开发保持表皮皮肤层。研究了细胞壁变化A. Arguta.在水果软化过程中[14.],具有在整个发育的细胞壁染色的显着变化,表明即使是一个看似恒定的表皮层正在经历恒定的变化和调节。
除了在猕猴桃物种中各种皮肤类型外,还有许多物种的倍率复杂性,展示从二倍体到Decaploid的倍增性的范围,使遗传研究更复杂[16.].目前对果实形成果实形成的遗传理解仅限于几种物种。在这里,我们旨在通过检查从一系列间皮的跨越特异性群体中的皮肤形成来进一步了解皮肤类型的遗传基因座A. Chinensis.男性与表皮A. MelanandraXA. Chinensis.混合女性。通过测序(GBS)使用基因分型,我们构建了一种遗传图,以识别与皮肤相关性状相关的基因座。
结果
皮肤类型的遗传
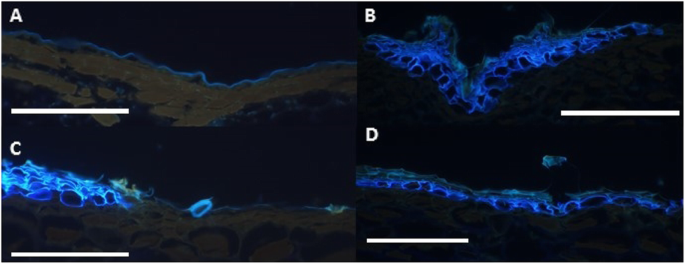
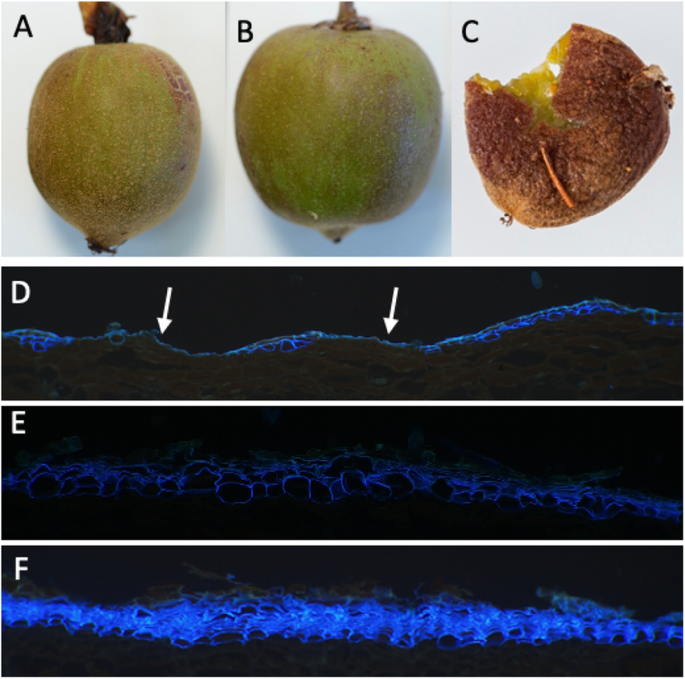
评估Kiwifruit的皮肤类型的遗传,四倍体A. Melanandra(ME)雄性与四倍体进行种间杂交A. Chinensis.(CK)女性。雌性CK具有睑形皮肤型(图。1一种)。兄弟姐妹女性(ME)的果实具有表皮(活)皮肤表型(图。1b)和角质层的连续覆盖,表面缺陷的发生率低,如芬化层和微观裂缝。
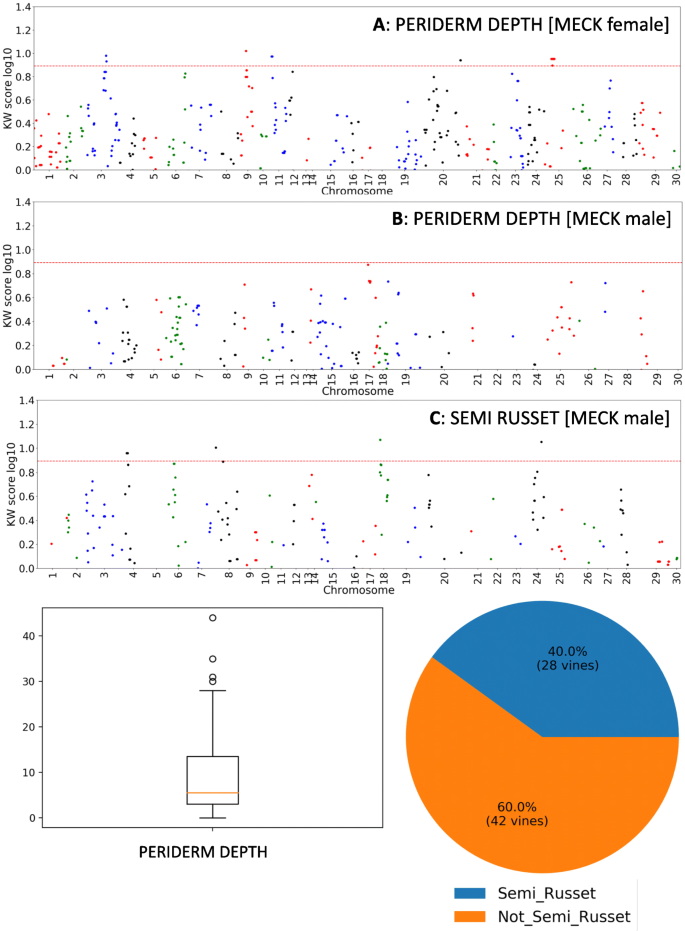
来自F1后代的雌性植物的果实,(这里称为梅克)具有鲜绿色表皮皮肤,表明这种表皮皮肤是一种显性性状(图。1C)。然而,在这些梅克女性的果实中,较小赤褐色的孤立地区的发生率增加,这表明这些水果中的较低强肥大的表皮蛋白质,因此参考半导性。虽然我的水果通常是一个小球形/卵形浆果,但F1后代比母亲更大,更卵形/椭圆形(图。1C)。随着所有F1后代具有表皮外甲虫,为了进一步调查全形Exocarp地层,将两个麦克F1兄弟女性被回交至单个CK雄性,导致两种回复群体,每个群体含有25%的原始父母Geatom组。发现两种群体都被瘫痪和表皮皮肤型分离(图。2).尽管有两个回交群体,只有一个被发现有足够数量的雌性果实进行基因研究,总共有76个葡萄藤。MECK和CK回交后代表现出一系列中间皮肤类型(图。2),不同于使表皮覆盖在厚角芯片中的表皮,以浓密的层状卵巢蛋白质。发现76个葡萄藤中的六个是克隆,留下70个回流基因型,其中60个主要是表皮外蛋白酶,10个具有完全的睑板蛋白。将这些分为0-25%,25-50%,50-75%,75-100%赤型的垃圾箱分别分别含有43,10,8和9种基因型的每个垃圾箱。当从具有一些表皮皮肤的60个回复个体中的每一个评估水果的块状物时,所有基因型至少含有一个较小的赤褐色标记的果实。从这种整个果实分析,在回复后代观察到的变化不仅包括赤褐色的存在,而且在赤褐色的外观中的存在,一些赤褐色贴片平稳,而其他互斥曲线也像黑褐色一样。在毛细尺寸和形状如毛毛和果实尺寸和形状等其他特征的人群中也观察到大量变化(补充数据 - 部分1).Pearson测量所有特征的相关性认为果实大小对测量的生理性状没有显着影响(补充数据 - 部分2).russtr的分布发生在各种位置(图。2),没有明显的优势花梗优势赤褐色,而是一系列的开始位置。
皮肤类型的微观结构变化
选择来自70个基因型中的每一个的典型果实用于微观结构分析。尽管从许多葡萄藤中收集多种水果,但显然只有少数葡萄藤有多种成熟的果实,因此虽然它降低了这项研究的力量,但使用显微镜检查每种基因型的一个果实。在可能的情况下,选择了具有象征和表皮exocarp的区域。用甲苯胺蓝染色切片,允许通过自动荧光和不同的染色图案鉴定角质层,裕定层和氧化层。Suberin沉积是通过亮蓝荧光,通常在亚表皮层中识别,并且指示的细胞可以考虑在往往朝向编程的细胞死亡的轨道上。蓝绿色自动荧光表明Lignin的存在。将作为蓝色单层的自动荧光作为L1表皮层上方的蓝色单层作为下角质层的荧光。微观结构检查揭示了比最初预期的更复杂的表型。一些基因型的皮肤类型似乎与父母完全不同,在预期的芬化的顶部,皮肤表面的数量和皮肤表面的跛行证据具有大范围(图3.和4.).
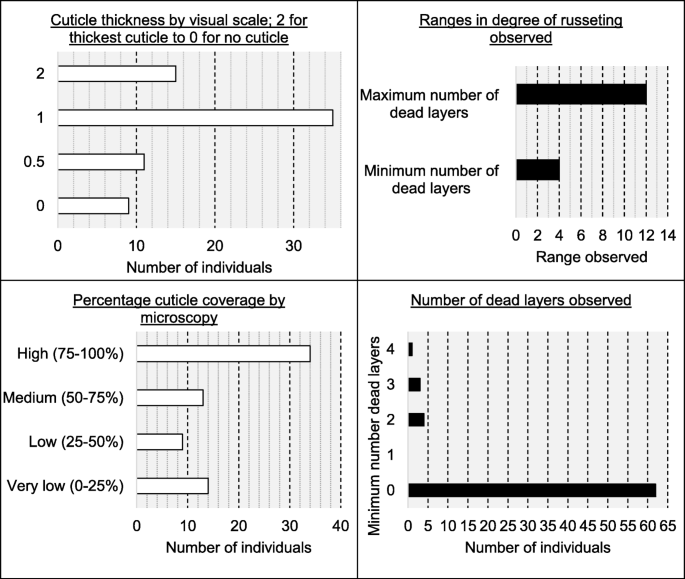
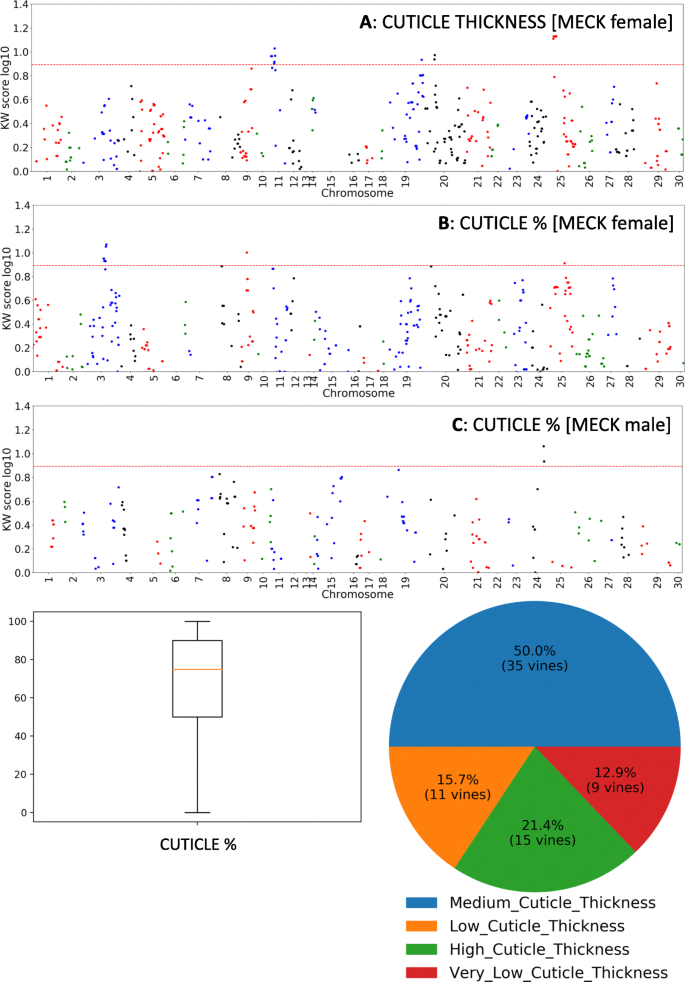
在70个果实中,在细胞水平观察时,八个具有总垂直覆盖率(用两种以前表征的白皮肌细胞果实,仅在更高的放大率下可见;例如,图。4.d)。剩余的62个基因型具有至少一个可观察角质层的点。在可能的情况下得分的角质层厚度(因为在切片期间,角质层通常损坏)。角质层厚度的视觉刻度将群体分成四个垃圾箱:2,1,0.5和0;分别由15,35,11和9个个体组成。显微镜观察到的角质层覆盖率的相对程度(果实表面的百分比长度为角膜覆盖; 0至100%等级)被评估为连续特征,但其中包括14,9,13和34个个体,如果进入以下四类:非常低的角质层覆盖率(0-25%),低角质层覆盖率(25-50%),中皮夹覆盖率(50-75%)和高角质层覆盖率(75-100%)(见图。5.视觉的总结)。
本研究中使用的70个基因型的角质层和周皮评分的总结。数据来源于显微镜研究,见表2进一步描述表型特征
褐化/分生生长的程度在种群内存在显著差异:显微镜观察的最大死层数在0 ~ 12层之间,最小死层数在0 ~ 4层之间。在人口组成回交的70人,62有最小数量的死亡层0,而没有基因型只有一个细胞层,四个基因型有至少两个细胞层,三个基因型至少有三个细胞层,一个人至少有四个的周皮细胞层外果皮的所有地区。因此,任何最少层数等于或大于两层的基因型都被认为具有如上所述的完全周皮外果皮表现型。
将云母层的最大数量分别分为四个箱1-3,4-6,7-9或10-12个死细胞层,其分别包括12,37,16和5种基因型。通过显微镜研究的其他显着特征涉及粒状的形成。发现所有个人(包括父母)含有毛状体,但回复的人口显示从单一到多纤维化,融合和木质化的子类型。58/70个体的子化毛状体由58/70个体表示,含有65/70的个体(补充数据)1).
宏观和微观表型评分的相关性
为了测试测量的特征之间是否存在任何相关性,产生每个性状的相关矩阵。结果发现,正神经表型随着俄罗斯分数和最小死区层的最小数量相关,Pearson相关系数为0.85。角质层覆盖率与锥形表型呈负相关,具有-0.73的Pearson相关系数。也观察到角质层覆盖率与软木塞分层数量之间的负相关(Pearson相关系数-0.86)。发现宏观评分的象征百分比与角质层覆盖率(Pearson相关系数-0.74)负相关,同时将与最小死亡层数和平均数量的白颌层数(Pearson相关系数分别为0.70和0.70)正相关(Pearson相关系数0.70和0.70)(补充数据2).其他特征之间没有显着的相关性,例如果子尺寸和毛状症的乳粥样族或reldrometing。
测序和遗传地图建设的基因分型
Genotyping.B.yS.使用来自麦克和CK父母和来自回复人群的父母和个体的DNA构建了等级(GBS)文库。每个文库获得平均每种单独的5,005,601个测序读数。使用Actinidia chinensis.Red5 Genome [17.],92.2%的序列读数被成功映射。检测到总共1,389,348个变体,其包含52,475个单核苷酸多态性(SNP)。
对本研究中使用的SNP分析发现SNPS呼叫的SNPS呼叫的比例为88.7%,平均样本深度的中位数为约230倍(补充数据3.).计算SNP呼出率及其次要等位基因频率(maf) (补充数据3.).样本对的平均共同呼叫率为0.7934,样本对的最小共同呼叫率为0.0234。一个地块是使用KGD套件开发的[18.其中绘制了Hardy-Weinberg不平衡,绘制了MAF,显示了SNP深度的密度。SNP深度的中位值为105.9,而平均自相关性(G5对角线)为1.9320(补充数据3.).
使用在使用的至少80%的个体中发生的分离单纯x无碱基SNP标记来构建每个父母的四种同源染色体(CHR)的联系地图。使用JOINMAP4.0制造联动地图[19.].共有7,568和6,062个标记分别用于雌性(梅克)和雄性(CK)父母的联系地图结构。梅克女性地图由157个连杆组(LG)组成,总共跨越8,139厘米,平均距离为每LG 51.84厘米。该地图每18.23千克平均一个SNP标记,最大间隙为1,320 kB。CK雄性地图由90Lg组成,总共跨越5,747厘米。这表示SNP之间的平均距离为217.52kb,标记之间的最大间隙为701kb。
使用这些链接图,针对每个测量的性状进行定量特征基因座(QTL)分析。使用MapQTL V5.0使用每个标记的非参数kruskal-wallis分析来测试这些方法的重要性[20.].
全果周皮/表皮(周皮)相关qtl
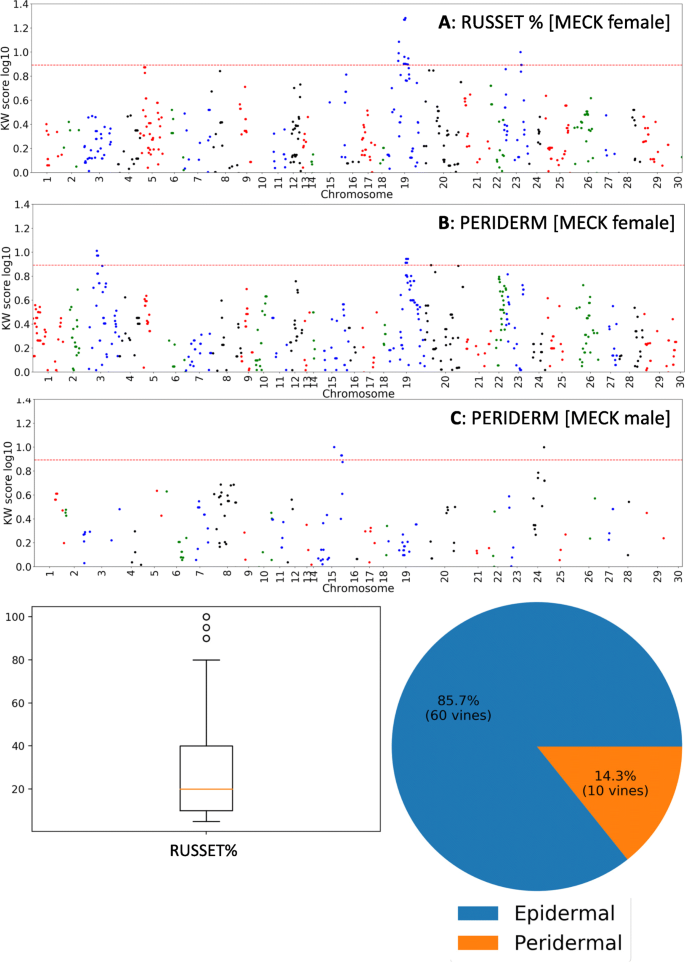
在LG154和LG102上鉴定出两种母体QTL,分别与三个和四个标记相关联(P.<0.005)。这些标记物理位于CHR3上,位于13,504,746bp和13,504,785bp和12,859,098bp和12,859,243bp之间的Chr19之间)(图。6.B,表格1).在LG39和LG85上识别了PATTERNAL QTL(P.<0.005),物理位于10,394,929bp和13,136,869 bp之间的CH11和LG1(P.<0.005),其位于12,647,436bp位置的CHR24上(图。6.C,表格1).
表中提出了与其他皮肤相关表型的重要标记相关的其他皮肤相关QTL。1(重要的经济价值P.< 0.001)和最小阈值为K > 7.8 (P.< 0.005)在补充数据部分4.和5..连锁图谱图在补充数据部分显示6.和7..
QTL与罗拉有关(赤褐色%)
鉴定了衍生自母体母体麦克的强QTL与LG102上的RG102上的rg19,k得分为19.753(P.<0.0001)。最重要的标志物定位在12,859,101和12,859,223bp之间(图。6.一张桌子1).Russeting也被映射到LG84 (P.<0.005)与标记物,在11,768,369bp下的CHR23上的k分数最高(图。6.a).映射到MECK母系图的周皮平均层数(周皮深度)的qtl(图5)。7.a)强qtl位于LG42 (CHR3)(最显著标记位于19,907,864 bp)和LG76 (CHR11;最显著的标记位于2,562,857bp和2,562,874bp)。从CK父本图谱中发现了一个控制表皮层数的显著QTL,位于CHR24上的LG1上,长度为12,647,436 bp1).在CK Payernal Map中发现了两个QTL用于半relstr,一个在LG1上,其物理位于CHR24上,并且位于9,523,224bp位置的最重要标记,距离与睑板数相关的QTL超过3MBp。LG61上的层和一个QTL,其在4,801,983bp处与Chr18对准(图。7.C)。
QTL与角质层形成相关
对于角质层相关的性状,角质层厚度具有LG76和LG120上的母体麦克酸QTL(表1和补充数据部分4.).来自LG76的最重要标记物理位于2,562,857和2,562,874bp处的CHR11上,而LG120上的标记物物理位于6,351,221至6,351,361bp的Chr25上(图。8.一张桌子1和补充数据部分4.).CK父亲在LG35上具有较弱的QTL,在LG35上与第2,817,564 BP(补充数据部分的CHR26)4.).
对于角质层覆盖(角质层%)母体麦克映射的LG42上的QT1分别在LG42上,分别在第19,907,864bp的PL3上物理位于CHR3和CHR2和CHR25(15,5,529,996bp)上的显着性QTLS(LG42和LG79)。(图。8.B,表格1和补充数据 - 部分4.).从CK姓氏继承的角质层覆盖包括在LG1上的QTL物理位于CHR24,位于12,647,436 BP(图。8.C和表格1).特质“裂缝”(显微镜下观察到角质层的微裂纹;补充数据1),有2个弱父本的CK qtl: LG81 (CHR26)和LG8 (CHR20)(补充数据段)4.).
可以在补充数据部分中找到QTLS与毛滴数和密度,寿命,跛足和果实长度相关联5..总之,木质素毛状体(ligtri)映射到CHR2(母图);毛状体(subtri)定位于CHRs 1、23和25(母图),CHRs 5、6和10(父图);毛发密度(hairy)映射到chrs5和9(母亲图)和chrs9、28和29(父亲图);果实截面积(area)映射为CHR7 (Mother map)和CHR19 (Father map),果实长度(length)映射为CHRs 11和29 (Father map)。
来自文献的Pericarp候选基因的位置与本文鉴定的QTL相关
许多研究已经列出了一系列与次生分生组织形成、赤褐色周皮、角质层形成、软木脂和角质层蜡生物合成有关的候选基因[11.那12.那21.那22.那23.那24.那25.那26.那27.那28.那29.那30.那31.那32.那33.那34.那35.那36.那37.那38.那39.那40那41.].当它们的肽序列在最近发表的猕猴桃基因组中搜索Blastp时[17.],发现同源猕猴桃基因位于所有标记位置附近(补充表)1).一个普遍的趋势是,所有qtl的多个候选位点位于3mbp以内。在CHR3上鉴定的两个标记之一(13.50 Mbp;而在19.59 Mbp(母亲:角质层覆盖/平均周皮深度)的QTL中,与KCS11的同源性仅为0.31 Mbp。KCS11是一种3-酮酰辅酶a合酶,参与角质层蜡的长链脂肪酸组成。在CHR11上鉴定的‘平均周皮深度’和‘角质层厚度’qtl(均为母图谱),距离最近的候选位点为0.17 MBp。其最佳反向BLASTP匹配为泛素特异性蛋白酶16 (UBP16;AT4G24560)与细胞增殖相关联[42.].其他值得注意的近端候选人包括WOX4样与角质层蜡合成有关kcs4样正轨。染色体15个Harbors'Periderm'QTLS(父亲地图)10.39和13.13 MBP和引人注目的候选者位于11.43 MBP的QTL之间,这是一个Cer1样参与切割蜡合成的基因。其他两个候选人列出(在补充表中1)不太引人注目,因为它们的最佳反向BLASTP匹配是不同的蛋白质,而不是原始输入查询。几种转录因子类型候选者靠近CHR15 13.13 MBP标记,但它们的最佳反向BLASTP匹配是不同的蛋白质,而不是原始输入查询使它们更少引人注目。
对于CHR18上的“半赤褐色(父亲)QTL”,有三个引人注目的候选QTL位于1.9 Mbp以内,包括ATMYB85和atmyb103样Mybs(与二级墙生物发生相关),和aBDG./CED1样正常角质层形成所需的α-β水解酶[43.].
CHR19分别为12.10和12.85 MBP的“relstr”和“reliderm”(母图)的QTL,以及12.85 Mbp,以及关键的角质层合成相关的候选者依靠近距离。其中之一是kas1样的正代(12,405,229 ... 12,414,036bp),其中Kas1对脂肪酸合成至关重要[23.].另外两个Cutin合成相关基因也靠近附近(补充表1).
对于在CHR20上观察到的“最小深度”QTL(最小睑板数),两种MYBS(atmyb52和atmyb94- 状基因)定位在附近,如另一种α-β水解酶(正常角质层形成所需)。过度表达MYB94导致切除蜡生物合成的激活[44.]但是,对MYBS的最佳反向BLASSP匹配是不同的MYBS:atmyb117和ATMYB60分别与外撇菌发育不太明确的相关性。
对于CHR23上的'rellar'Qtl(母版),一个引人注目的候选人是杨树ptshr2b短根状基因正交仅位于0.07 mbp;在杨树ptshr2b.参与调节咽部活性[45.].其他值得注意的候选物包括脂肪酸还原酶(游览游戏),涉及有切割蜡生物合成[21.]和ATP绑定盒式磁带传输车ABCG34类似基因。实际上,建议是类似的ABCG系列转运蛋白是苹果皮肤皮肤褐色的主要决定因素茹[11.]马铃薯块茎萼片中的Suberin形成需要ABCG转运蛋白ABCG1 [46.].
染色体24哈尔堡A'半relstr'(父映射)QTL,9.52 MBP,'平均垂体形式','角质层覆盖'和'Periderm'(来自父地图)QTL,约为12.64 Mbp。两个引人注目的候选人更接近9.52 MBP QTL并包括anac078和REVOLUTA-like基因。ANAC078.是拟南芥与马铃薯NAM样蛋白转录因子(Genbank:HO209042.1)匹配,其被鉴定为潜在的候选基因,涉及调节Periderm发育的潜在候选基因[47.],而REVOLUTA调节分生组织在侧位的起始[48.].同样在CHR24和更接近'角质层覆盖范围'和'Periderm'QTL,约为12.64 MBP是一种类似GPAT5的基因(BLASTP预期= 0),涉及Suberin涤纶的生物合成[49.]和一个WOX5样基因。WOX5与CYCD6; 1,和CASP1与稻草人和短根在Meristem诱导期间形成组织特异性高阶转录因子复合物[50.那51.].在水果Exocarp的咽部形成过程中可能发生这种过程[41.].
讨论
本研究对猕猴桃皮表皮形成的遗传和遗传控制进行了研究。该图谱研究受单株藤数和单株果实数的限制。一些葡萄的大小禁止三次取样,在某些情况下导致不成熟的果实被取样。镜检能清楚地观察到果实的周皮形成,成熟和半成熟果实的周皮均能被镜检出。由于所测序的猕猴桃为四倍体,另外由于我们的方法分别绘制了所有同源染色体,所以检测到的连锁群数量很高。在这种情况下,小群体大小并不排除鉴定高度显著的标记。
表皮exocarp的存在是半导性特性从A. Melanandra然而,在回交群体中,这种优势被分解为一个连续的表型谱。角质层厚度和覆盖度变化较大,角质层较薄或较薄的果实更容易形成较厚的栓皮分生层,覆盖在果实表面。这表明果周皮的形成是一种持续的皮肤黄褐色,而不是周皮形成的发育开关,而这种黄褐色与角质层的健壮性有关[52.].这种机制似乎类似于赤褐色苹果中的存在[12.]和赤褐色梨[8.那9.].环境因素会影响散发的周皮形成(黄褐色)[53.]我们只收集了一个季节的数据,因此在评估QTL时应考虑这一点。
绝经皮肤形成(连续象征)是隐性的,表明需要丧失基因功能,以发展死亡的皮肤果实。在CHR3,CHR19和CHR23上似乎有显着的象征基因座,母体麦克遗传学的CHR3上的一个关于CHR11,CHR18和CHR24的CHR3的角质层形成,表明有多种染色体位置有助于皮肤质量.这表明在观察到的表型范围内。最初提出了苹果和梨皮肤形成的遗传控制作为双因素模型[3.[但是,这已被重新检查,并提出有一个主要的显性基因和各种其他有影响力的遗传区域[7.].这项在猕猴桃的研究尚未解决这一点,并且在Kiwifruit中,它似乎是一种复杂的多基因特征,与角质层合成和relstings相关。
在过去的文献中,交叉参考以前建议的候选人发现了在本研究中发现的所有强大皮肤相关QTL的引人注目的候选人。Cutin和Suberin合成基因突出(CHR3 / 15/19 / 23),并鉴定了一些引人注目的潜在调节基因候选者。这些需要进一步调查和核实。
最终,皮肤/外果皮的类型与角质层强度和锈蚀特别相关,尽管锈蚀引发的机制仍不清楚。先前的研究表明,软木和黄褐色似乎是在特定的区域开始的,这表明这可能与膨胀的果实中微裂纹引起的伤口信号有关[1那54.那55.].还有证据表明,切割性的水暴露(在果实生长期间紧张)导致形成微裂纹,这反过来导致形成胰腺[53.].事实上,苏英也引起了猕猴桃的皮肤损伤。这些各种因素突出了exocarp形成的关键问题:角质层完整性降低导致白癜全层是否导致胰腺形成的引发导致减少角质层?
方法
植物材料
所有植物都在新西兰植物和食品研究有限公司(PFR)Motueka研究现场,新西兰的新西兰研究所生长和生长。猕猴桃melanandra和A. Chinensis.var。中国人来自PFR的种质收集在本研究中使用。所有植物材料都在荫淋有植入系统的标准果园条件下生长,其中营养蔗种植45度弦,并且在次年中被拉到水平,然后生长在开花和果实上。四倍体A. Melanandra雄性(Me)越过一位悸动皮肤的女性A. Chinensis.var。中国人(CK)。保存了一小部分F1(梅克)女性,随后用两种表皮皮肤是女性作为女性来使用A. Chinensis.var。中国人花粉(图。1).检查了70个个体的所得级别X CK Rescross群体之一并用于映射。
表现型
本研究中使用的水果是在商业收获前大约2-4周收获的,那时水果已经有一个外观成熟的外果皮组织。这与2016年3月中旬的主要收获时间相吻合,并于2017年3月最后一周收集了更多的后代,完成了70个基因型的集合(在这个阶段,并非所有种群都已经过了幼年期到开花和坐果)。70个基因型的果实利用率分别为64个重复、3个重复和3个单一生物重复。对雌性葡萄树的果实特征进行分析,包括宏观特征,如表皮类型(表皮、黄褐色或全周皮)、毛发和果实大小(如果可能的话重复3次,但有些基因型在收获时只有一个果实)。研究人员在摄影棚里给每个水果拍了彩色照片,并用数码卡尺测量水果的大小。
用光学显微镜研究显微结构特征(性状类型列于表中2,包括宏观结构测量的特征)。角质层及其厚度的覆盖范围聚焦在L1组织层上而不是亚表皮中的角质质含量。角质层厚度测量(通过显微镜)分为4个0/1/2/3的四个垃圾箱(得分0:角质层未存在于3:最厚的角质层)。使用Scalpel将样品收集涉及到果皮(〜2cm)的切片横截面,包括每种水果至少三种技术复制。在小闪烁小瓶中用固定剂(甲醛4%/乙醇50%/乙酸5%)用固定剂真空渗透。这些部分在乙醇中依次脱水并嵌入蜡块中,然后使用切片体切成至少五个薄〜5微米截面,然后在光学显微镜下观察,如先前的软化研究中所述A. Arguta.Kiwifruit Exocarp [14.].
切片用甲苯胺蓝染色(0.5% [w/v]在0.1% (w/v)碳酸钠pH值11.1中染色),然后装入玻片。切片在Olympus Vanox AHTB3复合显微镜上进行亮场和荧光观察,使用100w卤素光源进行亮场观察,AH3-RFC反射光荧光附件使用200W超高压汞燃烧器作为荧光观察光源。在亮场模式下,当选择一个客观功率时,冷凝器元件自动改变,所有其他调整都是手动的。照明强度由一系列中性密度滤镜调节。观测采用Olympus DPlanApo物镜(x10 NA 0.4, x20 NA 0.7, x40 NA 0.85)。图像(无花果。3.&4.)使用紫外线荧光(激发330-385nm,二向色镜400nm,发射≥420nm - 奥林巴斯bh2-dmu filterset)捕获。对于图像捕获光学测量仪COOLSNAP彩色摄像头(ROPER SCOITIFIC LTD,TUCSON,Alizona)使用NFK 1.67X照片目镜和0.3倍C安装适配器(OLYMPUS MTV-3)连接到显微镜。使用RS图像捕获软件(Roper Scientific Ltd,Tucson,Arizona)获得了图像。
利用木质素、角质层、蜡质和软木脂在紫外光下的自动荧光对MECK x CK分离群体的外果皮结构进行了分类。甲苯胺蓝所显示的组织学染色模式与之前关于猕猴桃外果皮中木质素和木质素定位的观察相关[15.].
DNA提取和GBS文库建设
来自田间种植植物的幼苗组织被收获到1.5ml微型管(Eppendorf,德国)并在液氮中冷冻。在制造商的协议之后,使用Qiagen植物DNeasy植物迷你套件(Qiagen,Hilden,德国)提取总基因组DNA。使用片段分析仪(高级分析,美国)量化DNA质量并检查完整性。拒绝具有小于10千克碱基对的DNA的样品并重新提取。
使用公开的协议完成通过测序(RTGB)的随机标记基因分型(dx.doi.org/10.17504/protocols.io.kzmcx46)下面详述的几个改变。选择的限制酶是太平洋标准时间我,已知在CTGCA ^ G网站上,预测频率为2.44x10-4在猕猴桃内(猕猴桃SP。)基因组。这太平洋标准时间I酶在参考基因组内具有366,211个切割位点,在每兆底〜244位。该文库在illumina Hiseq2000测序的两个通道上测序。总共使用澳大利亚基因组研究设施(Fillumina Inc)的两个通道,用100bp配对读数读取了76个GBS文库。使用澳大利亚基因组研究设施(Agrf.org.au.)作为序列提供商。Lane A中的样品总共249,263,071读数等于50.35千兆碱基对,而Lane B总共读取等于49.08千兆碱基对的读数,总共构成99.43千兆碱基对。最低绘图得分为86.25%,而最高元于99.26%。
生物信息学
用Fastx修剪器修剪测序读取(http://hannonlab.cshl.edu/fastx_toolkit/index.html)和用FASTQC测试的质量(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)和多议(https://multiqc.info/).读取与kiwifruit red5基因组对齐[17.](GenBank加入NKQK00000000; Genome版本NKQ000000001.1;汇编名称:使用Bowtie 2的Red5_PS1_1.69.0 [56.],它被设置为使用对端读。去除小于500bp的测序块以及插入/缺失。Freebayes [57.]用来调用最小读深度为50的SNPs。SNP调用结果合并在一起,只保留读深度为5000的SNP。GBS映射的压缩变体调用文件[634.1 MB],名为' CKMEXCK_PS1.1.69.0_K857.vcf.gz '可以在https://doi.org/10.5281/zenodo.4722054.此外,在这些基本过滤器之后,然后过滤读取识别在Kiwifruit基因组中不同物种中共用的高保守基因组区域。In this approach, researchers identify genomic regions of high conservation shared among divergent lineages, design synthetic oligonucleotide ‘baits’ that are complementary to these regions, hybridize genomic libraries to these oligonucleotide baits, ‘fish’ out the hybridized bait + library structure, remove the bait sequence and sequence the remaining pool of enriched, targeted DNA.
遗传地图结构和QTL分析
群体是四倍体,因此有四个等位基因分离在每个位点。所有四个等位基因(0/0/0/0)上的纯合子SNP被认为是单倍体纯合子,而任何杂合子的迹象,如0/1/1/1,0/0/0/1,1/2/3 /2被认为是杂合子SNP。对于每个父节点,只有Simplex X Nulliplex(例如0/0/0/1 X 0/0/0/0) snp被保留。
使用双伪测试谱映射策略构建父母遗传图[58.].使用JoinMap®V3.0C进行连接分析和地图结构[19.LOD评分为5分,用于分组和Kosambi的遗传距离计算功能。使用MAPQTL®版本5.0进行QTL分析[20.].在QTL分析之前,为每个性状进行验证数据分布:主要使用非正常和正常分布,主要使用非参数Kruskal-Wallis测试[59.]和区间映射(IM)分析,分别为(补充数据3.).对于IM分析,使用1,000个序列在基因组水平下计算QTL意义的LOD阈值。保留了具有LOD评分的QTL,其在大于90%的基因组范围内被保留。使用Kruskal Wallis试验检测QTLs的活皮或死皮肤,具有K值> 8的区域被认为是进一步分析的关键区域(表1).
为了识别可以映射的特征,使用Kruskal Wallis测试对每个映射的SNP进行分析每个测量的特征。Kruskal Wallis测试被选择过度映射,因为它适用于小群体。间隔映射假定数据集中的正常分布,这些数据集通常在少于100个人的群体中通常不会实现。Kruskal Wallis测试产生了许多QTL,但只有KW得分> 7.8(P.<0.005;k值在表中值意义概率阈值1或更大1;补充数据中4星或以上4.和5.)报道。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本文中及其补充信息文件中。用于发布的SNP Variants的压缩变体呼叫文件(634.1 MB)A. Chinensis.基因组[参考17.]可用https://doi.org/10.5281/zenodo.4722054.文件名:' CKMEXCK_PS1.1.69.0_K857.vcf.gz '。
缩写
- QTL:
-
定量特质基因座
- 装备:
-
染色体
- RAPD:
-
随机扩增多态DNA
- sp .:
-
物种
- ABCG:
-
ATP绑定盒式盒装家庭G.
- SHN1 / WIN1:
-
Shine1 / Wax Immucer1
- 我:
-
猕猴桃melanandra
- CK:
-
Actinidia chinensis.
- GBS:
-
通过测序进行基因分型
- RTGBS:
-
通过测序随机标记基因分型
- SNP:
-
单核苷酸多态性
- MAFS:
-
轻微的等位基因频率
- LG:
-
联动组
- MBP:
-
巨型基对
- 英国石油公司:
-
基对
- BLASTP:
-
基本的局部对齐搜索工具比较蛋白质序列
- MYB:
-
转录因子家族蛋白质,包括保守的MyB DNA结合结构域(在特征在于R2R3型MYB结构域的植物中),以AVIAN髓母细胞化病毒的同名基因命名
- PFR:
-
新西兰植物研究所和食品研究有限公司
参考
- 1。
Khanal BP,Grimm E,Knoche M.在苹果和梨中的russting:塑料白皙取代了一个僵硬的角质层。AOB植物。2013; 5(0)。https://doi.org/10.1093/aobpla/pls048.
- 2。
Kikuchi A.关于日本梨的起源和其水果皮肤颜色的遗传。日本J·雷德。1924; 1:1-19。
- 3.
日本日本梨繁殖的锡塔托。品种sci。2016; 66(1):46-59。https://doi.org/10.1270/jsbbs.66.46.
- 4。
e,Kasumi M,Sakuma F,Anzai H,Amano K,Hara H.鉴定RAPD标志物与日本梨子果皮颜色有关的RAPD标记相连(Pyrus Pyrifolianakai)。SCI Hortic。2006; 107(3):254-8。https://doi.org/10.1016/j.scienta.2005.07.009.
- 5。
关键词:梨,黄褐色皮,SSR,分子标记园艺学报,2010,37:1325 - 8。
- 6。
Yamamoto T,Terakami S,Takada N,Nishio S,Onou N,Nishitani C,等。鉴定日本梨子QTLS控制收获时间和果皮颜色(Pyrus Pyrifolianakai)。品种sci。2014; 64(4):351-61。https://doi.org/10.1270/jsbbs.64.351.
- 7。
王Y-Z,M-S D,D-Y C,张S,Shi Zb。赤褐色赤褐色Exocarp的分子研究综述及其遗传特征。SCI Hortic。2016; 210:138-42。https://doi.org/10.1016/j.scienta.2016.07.019.
- 8。
Katayama H,Uematsu C.梨(Pyrus.物种)日本岩手遗传资源。遗传资源作物evol。2006; 53(3):483-98。https://doi.org/10.1007/S10722-004-1802-3.
- 9。
王永忠,张珊,戴珊珊,史志斌。沙梨的色素沉着(Pyrus Pyrifolia)果实:生物化学表征,基因发现及与外豚色素沉着突变体的表达分析。植物mol biol。2014; 85(1-2):123-34。https://doi.org/10.1007/S11103-014-0173-1..
- 10.
Simons R,Chu M. Periderm的成熟“金色美味”苹果的形态,特别是relstring。SCI Hortic。1978; 8(4):333-40。https://doi.org/10.1016/0304 - 4238 (78) 90055 - 9.
- 11.
Falginella L,Cipriani G,Monte C,Gregori R,Testolin R,Velasco R等人。一个主要的QTL控制苹果皮肤皮肤射击地图“Renetta Grigia di Torriana”的联动组12。BMC植物BIOL。2015; 15(1):150。https://doi.org/10.1186/s12870-015-0507-4.
- 12.
Lashbrooke J, Aharoni A, Costa fmdshn3.,Apetala2-结构域转录因子基因,是苹果果皮形成的阳性调节剂和赤褐色抑制剂。J Exp Bot。2015; 66(21):6579-89。https://doi.org/10.1093/jxb/erv366.
- 13。
Crowurst RN,Gleave AP,Macrae Ea,Ampomah-Dwamena C,Atkinson Rg,Beuning Ll等。来自表达序列标签的分析猕猴桃:在味道,健康,颜色和成熟区域的基因发现中的交叉物种EST数据库的应用。BMC基因组学。2008; 9(1):351。https://doi.org/10.1186/1471-2164-9-351.
- 14。
Sutherland PW,Fullerton CG,Schroder R,Hallett Ic。细胞壁变化Actinidia Arguta.软化过程中。SCI Hortic。2017; 226:173-83。https://doi.org/10.1016/j.scienta.2017.08.027.
- 15.
哈雷特IC,萨瑟兰PW。猕猴桃果皮的结构与发育。植物保护学报,2005;https://doi.org/10.1086/431232.
- 16。
猕猴桃(猕猴桃spp)繁殖。见:Al-Khayri J, Jain S, Johnson D.(编)。植物育种策略进展:果实。可汗:施普林格;2018.https://doi.org/10.1007/978-3-319-91944-7_10.
- 17。
Pilkington Sm,Crowhurst R,Hilario E,Nardozza S,Fraser L,Peng Yy等。手动注释Actinidia chinensis.var。中国人(Kiwifruit)基因组突出了与植物中的基因组草案和基因预测相关的挑战。BMC基因组学。2018; 19:1-9。
- 18。
Dodds KG, McEwan JC, Brauning R, Anderson RM, van Stijn TC, Kristjánsson T,等。利用基因分型测序数据构建亲缘关系矩阵。BMC基因组学。2015;16(1):1047。https://doi.org/10.1186/s12864-015-2252-3.
- 19。
Van Ooijen J. JoinMap 4:用于计算二倍体物种实验群体遗传连锁图谱的软件。瓦赫宁根:Kyazma BV;2006.
- 20.
范ooijen JW。MAPQTL®5,实验人群中定量特质基因座的映射软件,Vol。63. Wageningen:Kyazma BV;2004年。
- 21。
Li-Beisson Y,Shorrosh B,Beisson F,Andersson MX,Arondel V,Bates Pd等。酰基脂质代谢。在:拟南芥书/美国植物学会生物学家,卷。11;2013年。
- 22。
Beisson F,Li-Beisson Y,Pollard M.解决Cutin和Suberin聚合物生物合成的谜题。CurrOp植物BIOL。2012; 15(3):329-37。https://doi.org/10.1016/j.pbi.2012.03.003.
- 23。
Pollard M,Beisson F,Li Y,Ohlrogge JB。建立脂质屏障:Cutin和Suberin的生物合成。趋势植物SCI。2008; 13(5):236-46。https://doi.org/10.1016/j.tplants.2008.03.003..
- 24。
关键词:生物力学,生物力学,生物力学,生物力学拟南芥ABCG11/WBC11的特性,一种ATP结合盒(ABC)转运体,是角质层油脂分泌所必需的。植物j . 2007; 52(3): 485 - 98。https://doi.org/10.1111/j.1365-313X.2007.03252.x.
- 25。
Suh Mc,Samuels Al,Jetter R,Kunst L,Pollard M,Ohlrogge J等人。在拟南芥干骺端中有基因脂质组合物,表面结构和基因表达。植物理性。2005; 139(4):1649-65。https://doi.org/10.1104/pp.105.070805..
- 26。
Lashbroke J,Cohen H,Levy-Samocha D,Tzfadia O,攀胶I,Zeisler V等。MyB107和MyB9同源物调节子植物中的Suberin沉积。植物细胞。2016; 28(9):2097-116。https://doi.org/10.1105/TPC.16.00490.
- 27。
关键词:广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义广义番茄mixta类转录因子协调果实表皮圆锥形细胞的发育和角质层脂质的合成和组装。植物杂志。2015;169(4):2553 - 71。https://doi.org/10.1104/pp.15.01145.
- 28。
Shi JX,Adato A,Alkan N,He Y,Lashbroke J,Matas AJ等人。番茄素3转录因子调节果皮形成和表皮图案化。新植物。2013; 197(2):468-80。https://doi.org/10.1111/3ph.12032.
- 29。
Legay S,Guerriero G,Andréc,Guiquard C,Cocco E,Charton S等人。MDMYB93是苏比苹果果皮中Suberin沉积的调节器。新植物。2016; 212(4):977-91。https://doi.org/10.1111/nph.14170.
- 30.
Wunderling A,Ripper D,Barra-Jimenez A,Mahn S,Sajak K,Targem MB等。拟南芥胰腺形成的分子框架。新植物。2018; 219(1):216-29。https://doi.org/10.1111/nph.15128.
- 31.
GOH T,Toyokura K,Wells DM,Swarup K,Yamamoto M,Mimura T等人。拟南芥侧根基金会的静止中心启动取决于稻草人转录因子。发展。2016; 143(18):3363-71。https://doi.org/10.1242/dev.135319.
- 32.
Almeida T, Menéndez E, Capote T, Ribeiro T, Santos C, Gonçalves sQuercus suber myb1.,是一种在软木组织中上调的转录因子。植物生理学杂志。2013;https://doi.org/10.1016/j.jplph.2012.08.023.
- 33.
müllerd,schmitz g,theres k。瞎的同源R2R3 MYB.基因控制横向分生成的模式拟南芥.植物细胞。2006; 18(3):586-97。https://doi.org/10.1105/tpc.105.038745.
- 34.
Boor P,Soler M,SánchezA,Hoede C,Noirot C,Paiva Jap,等。一种了解软木形成的比较转录组种方法。植物mol biol。2018; 96(1-2):103-18。https://doi.org/10.1007/S11103-017-0682-9..
- 35.
Verdaguer R,Soler M,Serra O,Garrote A,Fernándezs,Company-Arumíd,等。沉默的土豆STNAC103.基因增强了乌比丁聚酯的积累和块茎皮肤中的相关蜡。J Exp Bot。2016; 67(18):5415-27。https://doi.org/10.1093/jxb/erw305.
- 36。
Serra O,Soler M,Hohn C,Sauveplane V,Pinot F,Franke R等人。CYP86A33-靶向基因沉默在马铃薯块茎中改变了软木脂组成,扭曲了软木脂薄片,损害了周皮的水屏障功能。植物杂志。2009;149(2):1050 - 60。https://doi.org/10.1104/pp.108.127183.
- 37。
Serra O,Soler M,Hohn C,Franke R,Schreiber L,Prat S等人。沉默Stkcs6.在马铃薯胰岛上导致Suberin和蜡化合物的减小的链长,并增加透明蒸腾。J Exp Bot。2008; 60:697-707。
- 38。
Vishwanath SJ,Delude C,Domergue F,Rowland O. Suberin:一种保护细胞外屏障的生物合成,调节和聚合物组装。植物细胞代表2015; 34(4):573-86。https://doi.org/10.1007/s00299-014-1727-z..
- 39。
关键词:拟南芥,拟南芥,拟南芥DCR.编码一种可溶性BAHD酰基转移酶是角质聚酯形成和种子水化性能所必需的。植物杂志。2009;151(4):1773 - 89。https://doi.org/10.1104/pp.109.143388.
- 40。
Kannangara R,Branigan C,Liu Y,Penfield T,Rao V,Mouille G,等。转录因子Win1 / SHN1调节Cutin Biosynathesis拟南芥.植物细胞。2007; 19(4):1278-94。https://doi.org/10.1105/tpc.106.047076.
- 41.
Macnee NC,Rebstock R,Hallett Ic,Schaffer RJ,Blenley Sm。关于果实植入胚芽外豚形成的现状综述。Funct植物Biol。2020; 47(12):1019-31。https://doi.org/10.1071/FP19135.
- 42.
刘y,王f,张h,他h,ma l,邓xw。拟南芥特异性蛋白特异性蛋白酶基因家族的功能性表征揭示了个体成员在发育中的特定作用和冗余。工厂J. 2008; 55(5):844-56。https://doi.org/10.1111/j.1365-313x.2008.03557.x..
- 43.
Jakobson L,Lindgren Lo,Verdier G,Laanemets K,Broschém,Beisson F等人。拟南芥中Cutin的生物合成需要保镖。新植物。2016; 211(2):614-26。https://doi.org/10.1111/3/13924.
- 44.
李某,Suh Mc。采用拟南芥中的MyB94转录因子上调了切割蜡生物合成。植物细胞生理。2014; 56:48-60。
- 45。
Miguel A,Milhinhos A,Nováko,琼斯B,Miguel Cm。这短根- 麦基基因ptshr2b.参与杨树咽部活性。J Exp Bot。2015; 67:1545-55。
- 46。
Landgraf R,Smolka U,Altmann S,Eschen-Lippold L,Senning M,Sonnewald S等人。在马铃薯块茎间皮中的Suberin形成需要ABC转运蛋白ABCG1。植物细胞。2014; 26(8):3403-15。https://doi.org/10.1105/tpc.114.124776.
- 47。
Soler M., Serra O ., fluh S ., Molinas M., Figueras M.一个马铃薯表皮SSH文库产生新的候选基因软木脂生物合成和周皮形成。足底。2011;233(5):933 - 45。https://doi.org/10.1007/s00425-011-1350-y.
- 48。
otsuga d,deguzman b,prigge mj,drews gn,clark se。罗沃拉调节横向位置的分发启动。工厂J. 2001; 25(2):223-36。https://doi.org/10.1046/j.1365-313x.2001.00959.x..
- 49。
Beisson F,Li Y,Bonaventure G,Pollard M,Ohlrogge JB。酰基转移酶GPAT5是在种子涂层和根系中合成Suberin的拟南芥.植物细胞。2007; 19(1):351-68。https://doi.org/10.1105/TPC.106.048033.
- 50。
陈建平,陈建平。植物根系发育的分子机制与环境调控。植物学报。中国生物医学工程学报,2019;https://doi.org/10.1146/annurev-arplant-050718-100423.
- 51.
Long Y, Smet W, Cruz-Ramírez A, Castelijns B, de Jonge W, Mähönen AP,等。拟南芥BIRD锌指蛋白通过限制细胞命运调控因子SHORT-ROOT和促进命运规范共同稳定组织边界。植物细胞。2015;27(4):1185 - 99。https://doi.org/10.1105/TPC.114.132407.
- 52.
Knoche M,Lang A.正在进行的增长挑战果皮完整性。CRIT Rev Plant Sci。2017; 36(3):190-215。https://doi.org/10.1080/07352689.2017.1369333.
- 53.
陈永红,Straube J, Khanal BP, Knoche M, Debener T.等。组织学证据。植物。2020;9:1293。
- 54.
Knoche M,Khanal BP,BrüggenwirthM,Thapa S.苹果果皮的微裂纹模式反映了粘膜脊和表皮细胞壁的曲线。Planta。2018; 248(2):293-306。https://doi.org/10.1007/S00425-018-2904-018-2904-0..
- 55.
Martin LB, Rose JK。剥水果皮的方法不止一种:水果角质层的形成和功能。实验机器人。2014;65(16):4639-51。https://doi.org/10.1093/jxb/eru301.
- 56.
Langmead B, Salzberg SL.快速缺口读对齐领结2。Nat方法。2012;9(4):357 - 9。https://doi.org/10.1038/nmeth.1923.
- 57.
驻军E,Marth G.基于单倍型的基于单倍型的变体检测从短读测序。Arxiv预印迹arxiv:1207.3907。2012年。
- 58.
Grattapaglia D, Sederoff R.利用伪测试交叉作图策略和Rapd标记建立桉树-巨尾桉和桉树-巨尾桉的遗传连锁图谱。遗传学。1994;137(4):1121 - 37。https://doi.org/10.1093/genetics/137.4.1121.
- 59.
vargha a,delaney hd。Kruskal-Wallis测试和随机均匀性。J教育行为stat。1998年; 23(2):170-92。https://doi.org/10.3102/10769986023002170.
致谢
作者感谢猕猴桃育种家Ron Beatson博士(PFR),他负责创建了本研究中使用的群体。
资金
这项工作由新西兰植物研究所和食品研究所有限公司Krip'果实表征的计划资助。Baywa AG为N.M的财务援助提供了学生的形式。Baywa AG在研究设计中没有作用;在收集,分析或解释数据;在写作稿件,或在决定发布结果。
作者信息
隶属关系
贡献
所有作者均已阅读并批准稿件。概念、RS、JT、DC和SB;方法,NM, EH和DC;生物信息学,NM, BW, JT;形式分析,NM, JT和DC;资源、交流;数据管理、纳米;书面-原始草稿准备,NM;论文评审和编辑,SB、RS、DC;显微镜检查监督,IH; supervision, RS and SB; project administration, NM and RS; funding acquisition, NM and RS.
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者声明没有利益/竞争利益的冲突。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Macnee,N.,Hilario,E.,Tahir,J.等等。绝经果皮形成猕猴桃sp。(猕猴桃)与遗传相关位点控制象征和角质层形成。BMC植物BIOL.21,334(2021)。https://doi.org/10.1186/s12870-021-03025-2
收到了:
公认:
发表:
关键词
- 奇异果
- 猕猴桃sp。
- 果皮
- periderm.
- 黄褐色
- 表皮