抽象的
背景
糖、光和非生物胁迫等多种因素对花青素生物合成的调控是由转录水平上的众多调控因子介导的。本实验旨在证明核GARP转录因子AtGLK1在调控蔗糖诱导的拟南芥花青素合成中发挥重要作用。
结果
使用实时定量PCR和GUS染色测定获得的结果显示AtGLK1主要表达于拟南芥幼苗的绿色组织中,可被蔗糖诱导。的功能丧失glk1 glk2双突变体的花青素水平低于对照GLK2.单一突变体,尽管已经确定AtGLK1的缺失不会影响花青素的积累。过表达AtGLK1增强了伴有花青素生物合成和调控基因的表达增加的转基因拟南芥幼苗中的花青素。此外,我们发现ATGLK1还参与塑体信号传导介导的花青素累积。遗传,生理学和分子生物学方法证明,AtGlk1作用于MyBl2的上游,是花青素生物合成的关键负调节剂,遗传调节蔗糖诱导的花青素生物合成。
结论
我们的结果表明,AtGLK1通过MYBL2积极调节蔗糖诱导的拟南芥花青素生物合成。
背景
花青素是一组植物颜料,已称为植物零件的紫色着色,特定的发育阶段或在特殊的环境条件下。吸引花粉剂和种子分散动物需要花和水果中的花青素的存在[1.]. 花青素也是一类重要的多酚,具有显著的抗氧化活性。这些活动有助于保护植物免受不同的非生物和生物胁迫[2.,3.,4.,5.].
花色素苷的生物合成途径在各种植物物种进行了广泛研究。编码花色素苷生物合成途径所需的酶的基因不同植物之间是保守的[6.],并且可以分组为以下两类[7.,8.]. 这个early biosynthesis genes (EBGs) are involved in the common steps of the different flavonoid subpathways, and mainly include查尔酮合酶(CHS),查尔酮异构酶(气),黄烷酮3-HYDROXYLASE(F3h.). 晚期生物合成基因(LBG)主要包括类黄酮3'羟化酶(F3'H),二氢黄酮醇4-还原酶(DFR),LEUCOANTHOCYANIDIN加氧酶(Ldox.),花青素还原酶(ANR.),UDP-葡萄糖:黄酮类化合物3-O-葡糖基转移酶(UF3GT.).上述基因的表达水平受正、负调节转录因子的调控。例如,已经确定,独立于WD-repeat的myb和MYBs/bHLH/WD-repeat复合物分别调节EBGs和lbg的表达[9,10,11].在拟南芥中,转录因子PIF3和HY5通过直接与花青素生物合成基因的启动子结合,正向调节花青素生物合成,包括CHS,气,F3h.,F3′H,DFR,和Ldox.[12].在对比上述正转录因子中,R3-MYB蛋白MYBL2充当转录阻遏,并负调节花青素的生物合成[13,14].进一步研究发现,MYBL2通过与TT8蛋白相互作用形成转录抑制复合物,抑制花青素的生物合成,并与TT8蛋白结合DFR启动子和抑制DFR基因(14].
糖在高等植物的生长发育中起着重要的作用,它既是能量来源又是信号分子[15]. 蔗糖是几种植物不同器官产生花青素的强烈诱导剂[16,17,18,19]. 这个A.pplication of exogenous sucrose can significantly increase in the transcript levels ofDFR和Ldox.[20,21].这种蔗糖诱导的花青素生物合成基因的表达可归因于阳性转录因子的上调表达,例如PAP1,TT8., 和GL3[22]. 这个sucrose transporters (SUCs) may play an important role in sucrose-induced anthocyanin biosynthesis [18].人们已经发现AtSUC1与不含蔗糖的植物相比,含蔗糖植物的表达水平更高。当在含蔗糖的培养基中培养时,拟南芥suc1突变体的花青素积累较少。全球表达分析显示许多对花青素生物合成重要的基因表达减少[23].有趣的是,AtSUC1在植物根中优先表达,同时花青素趋向于主要堆积在整个背面的表皮层,以及子叶的近轴表面[边缘23,24]. 这个refore, it has been indicated that AtSUC1 may play a role in sucrose uptake, rather than acting as a sugar sensor for anthocyanin production [25].
AtGLKs (GOLDEN2-LIKE)是核GARP转录因子,其在调控叶绿体发育中的作用已被广泛研究[26].在拟南芥中,阿塔尔克基因存在被指定为一个同源对AtGLK1和AtGLK2.虽然GLK1和GLK2.单个突变体在大部分发育过程中均未表现出明显的表型glk1 glk2双突变体呈淡绿色,叶绿体类囊体严重减少,表明AtGLK基因在功能上是冗余的[26,27].与基本的紫花状薄片一致,编码与光合作用蛋白质的核基因的转录物丰富是下调的,尤其是与叶绿素生物合成和PSII相关的核基因[26,28].研究还发现,除了叶绿体发育外,AtGLK基因还参与介导叶绿体向细胞核的逆行信号,以响应叶绿体的功能状态[29,30,31]. 这个ppi2(质体蛋白质import2)缺乏Toc159叶绿体前蛋白受体的突变体表现出光合作用相关核基因表达的抑制、叶绿体形态的改变和严重的白化表型。转录本分析结果显示AtGLK1表达明显下调ppi2突变体。此外,在过表达的转基因植物中,一些光合作用相关基因的表达已部分恢复AtGLK1在一个ppi2背景。这些发现表明AtGLK1在叶绿体到核信号通路中起正调控作用,调控核基因的表达以响应叶绿体的功能状态[29].
在本研究中,验证了AtGLK1是蔗糖诱导花青素生物合成的正调控因子。我们的结果表明AtGLK1在绿色组织中优先表达,可由外源蔗糖诱导表达。功能丧失glk1 glk2双突变体幼苗在对蔗糖的反应中积累了较少的花青素,而AtGLK1.过表达的拟南芥幼苗在对蔗糖的反应中积累了更多的花青素。进一步的研究表明,AtGLK1作用于MYBL2的上游,在遗传上调控花青素的生物合成。以上结果表明,AtGLK1是通过MYBL2正向调控蔗糖诱导的花青素积累的关键因子。
结果
AtGLK1是拟南芥的蔗糖可诱导基因
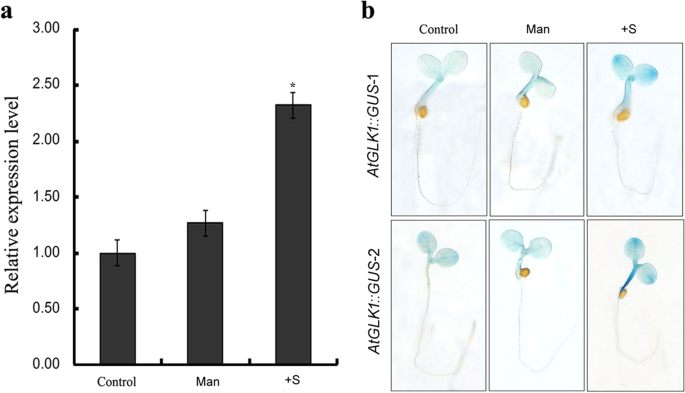
糖作为信号分子在高等植物中调节生长、发育和基因表达[15]. 为了研究拟南芥转录因子AtGLK1是否参与对糖信号的反应,我们研究了外源蔗糖对糖信号的影响AtGLK1表达水平。此外,实验中还加入甘露醇作为渗透控制。实时荧光定量PCR分析结果表明AtGLK1在2%蔗糖处理下,转录本显著上调。然而,甘露醇治疗并没有显著增加AtGLK1记录级别(无花果。1.a).为了进一步研究蔗糖诱导表达模式AtGLK1,AtGLK1还分析了启动子控制的GUS活性对外源蔗糖的响应。如图所示。1.b,转基因植株的子叶和下胚轴均有较强的GUS表达AtGLK1:格斯与对照相比,在添加2%蔗糖的1/2MS培养基上生长的拟南芥幼苗。与qPCR数据一致,观察到AtGLK1:格斯在甘露醇治疗后变化不大。蔗糖诱导的GUS表达表明AtGLK1可能与植物对糖信号的反应有关。
AtGLK1是拟南芥中蔗糖诱导基因。A.的积累AtGLK1用外源蔗糖和甘露醇治疗mRNA。野生型拟南芥(COL)的种子萌发并在没有蔗糖的1/2 ms培养基上生长4天。然后将4天龄幼苗转移至没有蔗糖(对照)的1/2 ms培养基,用58mM甘露醇(人),或用2%蔗糖(+ S),并且在24小时后收获。提取总RNA并用于实时PCR。BGUS基因表达的评价AtGLK1:格斯外源蔗糖和甘露醇处理的转基因拟南芥幼苗。AtGLK1:格斯来自两个代表性线的转基因拟南芥种子(AtGLK1:格斯-1和-2)在1/ 2ms缺乏蔗糖的培养基上萌发生长。在萌发后第4天,将幼苗转移到1/ 2ms无蔗糖(对照)、58 mM甘露醇(Man)或2%蔗糖(+ S)培养基中,再生长24 h,然后在gus染色液中孵育。星号表示与对照组相比在统计学上有显著差异(学生的T测试: *P < 0.05)
AtGLK1和AtGLK2在调节蔗糖诱导的花青素生物合成中表现出功能冗余
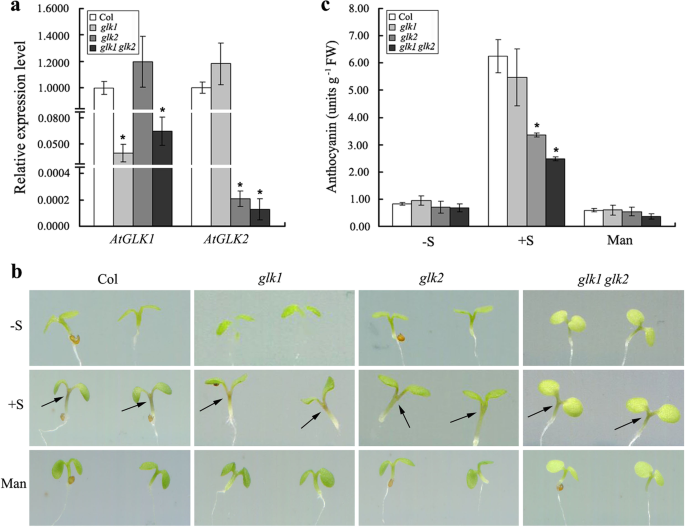
已经确定,蔗糖是拟南芥中的花青素产生的强烈诱导剂[18,32]. 这个在Duction ofAtGLK1拟南芥中蔗糖的表达表明它可能参与调控花青素的生物合成。为了证实这一点,单突变体GLK1和GLK2.和glk1 glk2研究双突变体。这些功能缺失的突变体此前已被证明会影响拟南芥叶绿体的发育[26].数字2.A说明了AtGLK1成绩单在整个过程中几乎没有积累GLK1突变体。然而,它们存在于正常水平GLK2.突变体。同样,AtGLK2转录本被观察到在GLK2.突变体,但累积到正常水平GLK1突变体。两者的转录水平AtGLK1和AtGLK2基因是非常低的glk1 glk2双突变体。野生型和glk突变体(GLK1,glk2,和glk1 glk2),在含2%蔗糖的1/2 MS培养基上垂直生长4 d。结果表明,花青素在植株中积累GLK2.单突变体glk1 glk2与相应的野生型幼苗相比,双突变体幼苗下胚轴上部明显减少。而在1/ 2ms无蔗糖或58 mM甘露醇培养基上萌发生长时,野生型、单突变体间差异不显著GLK1和GLK2.和glk1 glk2双突变体(图。2.b)。定量分析表明,在没有蔗糖的情况下生长的幼苗的花青素含量相当较低,并且之间没有显着差异glk突变体(GLK1,GLK2., 和glk1 glk2)和野生型幼苗。然而,野生型和野生型和野生型累积有明显的诱导glk突变体(GLK1,GLK2., 和glk1 glk2)。野生型与野生型花青素含量无显著差异GLK1突变体,的花色苷含量GLK2.单突变体和glk1 glk2双突变体被认为是比野生型幼苗的显著低。此外,这是glk1 glk2结果表明,双突变体在花青素积累方面存在缺陷GLK2.单突变体。为了确定野生型和野生型花青素积累水平的差异glk突变体(GLK1,GLK2., 和glk1 glk2)幼苗是由于渗透效应,幼苗也在甘露醇(58mm = 2%)的等摩尔浓度上生长,测定花青素内容物。甘露醇未能诱导野生型或野生型或野生型累积glk突变体(GLK1,GLK2., 和glk1 glk2)幼苗,表明蔗糖诱导的花青素累积不能被视为渗透效应(图。2.c)。
野生型、单突变体的花青素积累GLK1和glk2,和glk1 glk2双突变体。A.实时定量PCR技术分析AtGLK1和AtGLK2野生型(Col)中的转录物积累GLK1和glk2,和glk1 glk2双突变幼苗。总RNA从4- d龄幼苗生长于补充有2%蔗糖的1/2 MS培养基中分离出来。B野生型(Col)的代表性幼苗图像,单突变体GLK1和glk2,和glk1 glk2双突变体在不添加蔗糖(-S)的1/2 MS培养基上生长4天,添加2%蔗糖(+ S) 或分别使用58 mM甘露醇(Man)。黑色箭头表示不同基因型拟南芥幼苗中花青素积累的位置。C四维幼苗中花青素的定量测量(Col,GLK1,GLK2.和glk1 glk2在1/2 MS培养基中分别添加不含蔗糖(-S)、2%蔗糖(+ S)和58 mM甘露醇(Man)。星号表示与相应野生型(学生的T测试: *P < 0.05)
过度的AtGLK1提高蔗糖诱导拟南芥花青素积累
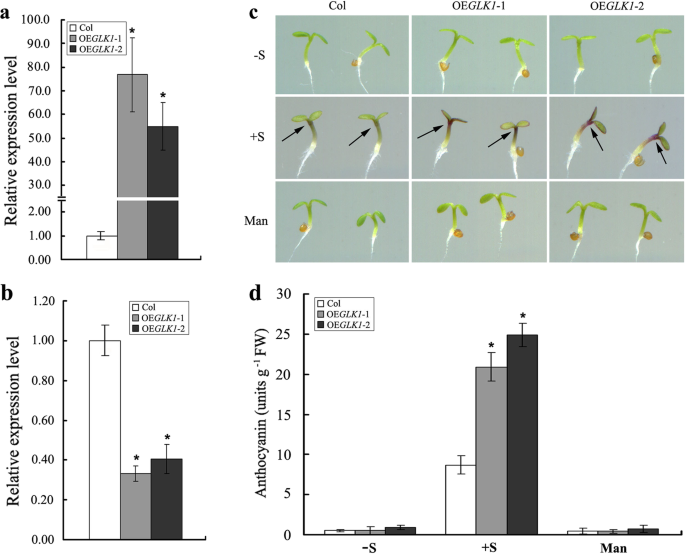
研究花青素的积累是否受到影响AtGLK1-overexpressing线条,AtGLK1基因,由CaMV 35 s9个独立的启动子被导入拟南芥35 s:: AtGLK1在50 μg ml的1/2 MS培养基上筛选获得转基因株系−1.卡那霉素。通过卡那霉素抗性试验和PCR分析(数据未显示),选择纯合转基因后代系(T3至T4代)进行进一步检查。两个具有代表性的独立转基因系(OE)的表达水平GLK1.1和OEGLK1.使用具有基因特异性引物的实时定量PCR分析检查-2)。正如预期的那样,转基因素线OEGLK1.1和OEGLK1.-2被发现有较高的相对表达水平AtGLK1与野生型比较(图。3.一种)。我们还检测到的表达AtGLK2的同源基因AtGLK1,野生型和野生型35 s:: AtGLK1转基因植物。有趣的是要注意的表达AtGLK2被发现在AtGLK1-过表达的幼苗,与相应的野生型植株进行比较(图。3.b)。
野生型和野生型的花青素积累AtGLK1-overexpressing幼苗。A.表达式的分析AtGLK1和AtGLK2B在野生型(Col)和35 s:: AtGLK1转基因线(OEGLK1.1和OEGLK1.2)。从4-d龄野生型中提取的总RNA35 s:: AtGLK1采用实时荧光定量PCR检测转基因苗。C野生型和35 s:: AtGLK1转基因株系分别在1/ 2ms不添加蔗糖(-S)、添加2%蔗糖(+ S)和添加58 mM甘露醇(Man)的培养基上生长4 d。黑色箭头表示不同基因型拟南芥幼苗花青素积累的位置。D4日龄幼苗中花青素的定量测定(Col,OEGLK1.1和OEGLK1.-2) 在1/2 MS培养基上生长,不添加蔗糖(-S),添加2%蔗糖(+ S) 或分别使用58 mM甘露醇(Man)。星号表示与相应野生型(学生的T测试: *P < 0.05)
在没有蔗糖的情况下在1/2 ms培养基上生长时,花青素积累AtGLK1-过度表达的幼苗与野生型幼苗没有区别,这一结果与在1/2 MS培养基上生长的幼苗在58 mM甘露醇存在下观察到的结果相似。然而,在蔗糖存在下,我们观察到这些幼苗下胚轴上部的花青素着色强度存在明显差异。与野生型幼苗相比,在两种选择的幼苗中观察到紫色花青素水平明显增加AtGLK1过表达系(图。3.c).花青素水平的量化验证了表型观察结果,并证实了两种选择中较高的花青素水平AtGLK1与野生型幼苗相比过表达线(图。3.d) 。综上所述,本研究中获得的数据显示AtGLK1拟南芥幼苗花青素的表达和积累。
花青素生物合成途径的结构和调控基因的表达
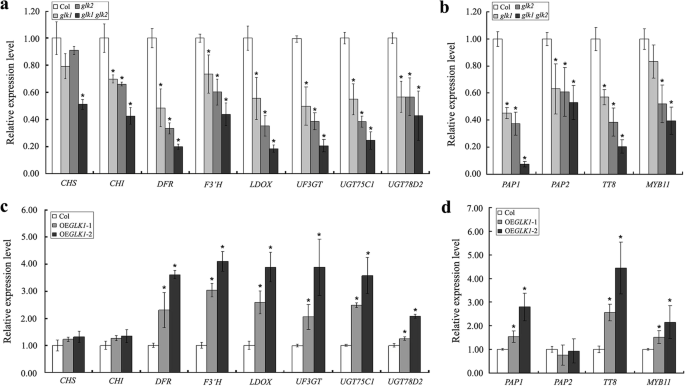
上述结果表明,ATGLK1参与了花青素合成的调节。因此,为了更清楚地了解花青素水平的变化的分子基础,我们首先检查了早期生物合成基因的表达查尔酮合酶(CHS),查尔酮异构酶(气)使用逆转录和实时定量PCR。如图所示。4.的成绩单水平CHS在基因的单个突变体中没有显著变化GLK1和glk2。然而,人们发现气两种突变体的转录水平明显降低。此外,与野生型相比,观察到的表达水平CHS和气没有大幅改变AtGLK1过表达系。然而,这两个基因的表达在实验组中显著降低glk1 glk2双突变体。然后我们监测以下晚期生物合成基因的表达水平二氢黄酮醇4-还原酶(DFR),类黄酮3'羟化酶(F3′H),LEUCOANTHOCYANIDIN加氧酶(Ldox.),UDP-GLUCOSE:黄酮类3-O-GLUCOSYL转移酶(UF3GT.),75 c1 UDP-GLUCOSYL转移酶(UGT75C1),UDP-葡萄糖基转移酶78D2(UGT78D2).晚期生物合成基因表现出相同的表达模式,但转录水平较低glk突变体(GLK1,GLK2., 和glk1 glk2),但比野生型高AtGLK1-过度表达线。随后,进一步研究了花青素生物合成途径中几个调控基因的表达水平,包括花青素色素1的生产(PAP1),花青素色素2的生产(PAP2),透明的外种皮8(TT8.),和MYB11.正如预期,PAP1,TT8,和MYB11研究发现,在癌症患者中,表达水平持续高得多AtGLK1-与野生型相比,过度表达株系的表达率较低glk突变体(GLK1,GLK2., 和glk1 glk2).但在基因表达水平上无显著差异PAP2介于野生型和AtGLK1-过表达的转基因株系中,其表达量显著降低glk突变体(无花果。4.).总之,本研究中获得的结果表明,ATGLK1积极调节花青素累积拟南芥通过调控幼苗的表达水平和调控花青素的生物合成基因。
AtGLK1参与拟南芥质体逆行信号介导的花青素积累
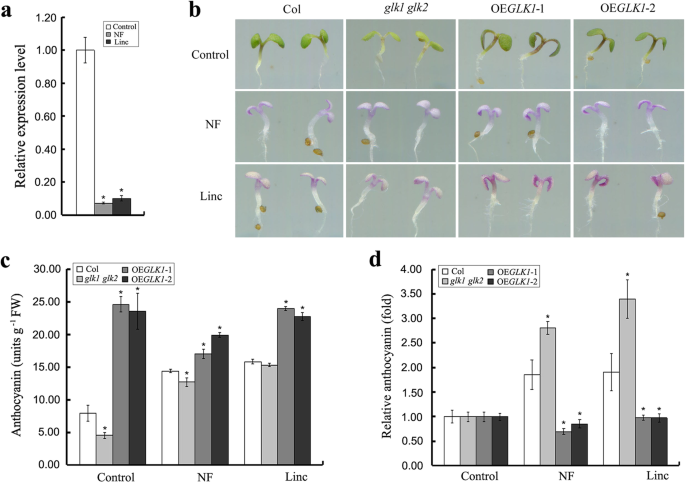
由于AtGLK1是质体逆行信号通路的重要组成部分[29],进一步研究AtGLK1是否参与质体逆行信号介导的花青素积累。因此,用norflurazon (NF)或Linc (Linc)处理野生型幼苗,这是两种已知的通过抑制叶绿体生物发生来激活逆行信号的药物[33,34]. 这个results of the real-time quantitative PCR analysis showed that theAtGLK1在转录水平上,NF和Linc处理显著下调了该基因的表达。5.a).利用NF或Linc处理野生型拟南芥;glk1 glk2双突变体,AtGLK1-过表达的幼苗,并测定其花青素含量。结果如图所示。5.B-C和图4. s1..在野生型幼苗中,NF和Linc均显著诱导花青素积累和花青素生物合成及调控基因的表达。在对照组中,花青素的积累量较低glk1 glk2双突变体,但更高AtGLK1与野生型相比,过度表达系。NF和Linc处理显著诱导野生型和野生型的花青素积累glk1 glk2双突变幼苗。但是,在任何一个都没有观察到显着的归纳效应AtGLK1-overexpressing线(图5.c)。由于发现未处理的对照幼苗中的绝对花青素含量在所有基因型中具有显着差异,因此计算了相对花青素含量(在治疗中对对照的含义的折叠)。统计学分析的结果揭示了相对花青素之间的显着差异glk1 glk2双突变体AtGLK1-过表达的幼苗,NF和Linc处理对花青素积累的诱导作用进一步增强glk1 glk2双突变体,但在AtGLK1-overexpressing线(图5.d)。这些发现表明,AtGLK1参与拟南芥中的塑性逆行信号介导的花青素积累。
Atglk1参与拟拟合拟拟合血浆逆行信号介导的花青素积累。A.实时定量PCR分析AtGLK1在1/2 MS培养基上生长的野生型幼苗中的转录物积累,不添加(对照)或添加5μM诺氟拉松(NF)或添加0.5 mM林可霉素(Linc)。B野生型(Col)代表性幼苗的图像,glk1 glk2双突变体,AtGLK1-过度表达(OE)GLK1.1和OEGLK1.-2) 幼苗在1/2 MS培养基上生长4天,不添加(对照)或添加5μM诺氟拉松(NF)或添加0.5 mM林可霉素(Linc)。C花青素的绝对含量和相对含量D野生型的glk1 glk2双突变体,AtGLK1-overexpressing上生长的1/2 MS培养基中4天的幼苗。星号表示与相应野生型(学生的T测试: *P < 0.05)
AtGLK1作用于MYBL2的上游,从遗传学角度调控拟南芥花青素的积累
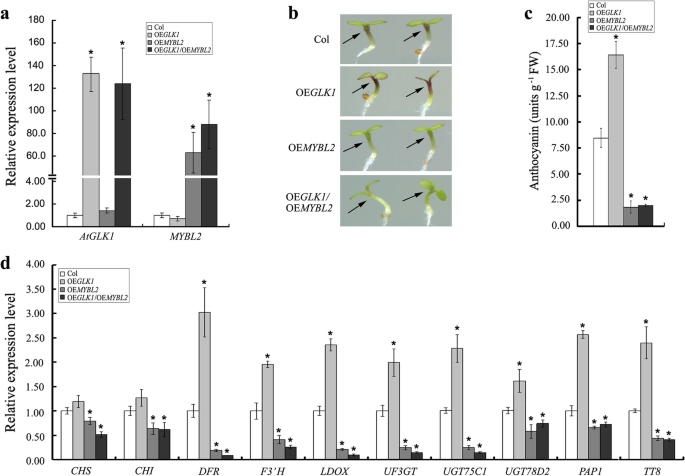
此前有报道称MYBL2作为一个转录抑制因子,负调控拟南芥花青素的生物合成[13,14]. 在MYBL2顶线(mybl2),花青素生物合成和调控基因的表达增强,导致花青素的异位积累,而MYBL2或嵌合阻遏物,它是MYBL2的主要负形式,抑制花青素生物合成和调控基因的表达,以及花青素生物合成[13,14].确定ATGLK1和MYBL2之间的遗传关系,35S :: MYBL2(OEMYBL2)他和警察交恶了AtGLK1过表达系(OEGLK1)和双过表达线35S :: MYBL2/OEGLK1(OE)GLK1 / OEMYBL2)获得(图。6.a).我们的研究结果表明,过度表达MYBL2显著抑制花青素的生物合成AtGLK1-过表达的幼苗,表明MYBL2具有上位性AtGLK1在花青素生物合成中的作用(图。6.c)。在花青素生物合成的转录水平上观察到一致性(DFR,F3′H,Ldox.,UF3GT.,UGT75C1, 和UGT78D2)及规管(PAP1和TT8.)基因,这些基因在AtGLK1- 大规处幼苗,所有人都被下调MYBL2在35S :: MYBL2/OEGLK1(OE)GLK1 / OEMYBL2)双过表达线(图。6.d)。因此,这些结果表明,AtGLK1作用MYBL2的上游,以调节基因在拟南芥中花青素的积累。
AtGLK1作用于MYBL2的上游,从遗传学角度调控拟南芥花青素的积累。A.表达式的分析AtGLK1和MYBL2在野生型(Col),AtGLK1-过度表达(OE)GLK1.),MYBL2-过度表达(OE)MYBL2),35S :: MYBL2/OEGLK1(OEGLK1/OEMYBL2)双过表达植物。B代表性幼苗和花青素含量的图像C野生型,AtGLK1-过度表达,MYBL2-overexpressing,35S :: MYBL2/OEGLK1双overexpressing线。D结构基因转录水平(CHS,气,DFR,F3'H,Ldox.,UF3GT.,UGT75C1, 和UGT75C2)及规管(PAP1和TT8.)参与野生型花青素生物合成的基因,AtGLK1-过度表达,MYBL2-overexpressing,35S :: MYBL2/OEGLK1双过表达植物。从在1/2 ms培养基上生长的不同基因型幼苗中提取的总RNA 4天。星号表示与相应野生型(学生的T测试: *P < 0.05)
讨论
在高等植物中,各种转录因子对花青素生物合成的调控[9,10,11,12,13,14,32,35]. 这个GLKTranscription factors were originally identified in maize, and were subsequently found in Arabidopsis, maize, rice, tomato, and the mossPhyscomitrella金属盘[26,27,36,37,38,39].GLK转录因子属于GARP转录激活家庭,和蛋白质序列不同物种间高度保守的,与Myb样DNA结合结构域和C端盒[26,39,40].在拟南芥中,阿塔尔克基因作为一对同源基因存在,AtGLK1和AtGLK2.以前的研究发现,AtGLKs主要是调节高等植物叶绿体发展[26,27,28].近年来,越来越多的研究表明AtGLKs不仅在应对生物和非生物胁迫中发挥重要作用,而且在调节叶片衰老中发挥重要作用[41,42,43,44,45]. 这个Current study found that AtGLKs have an important function in regulating the accumulation of anthocyanins in Arabidopsis.
花青素是植物中的水溶性液泡色素,属于类黄酮化合物家族[46].由于蔗糖是黄酮类生物合成的强烈诱导剂,并且已知在各种植物物种中诱导花青素积累[16,17,18,我们分析了的表达模式AtGLK1响应于外源性蔗糖处理。实时定量PCR分析表明,mRNA的积累AtGLK1显著促进了蔗糖(图。1.增加了)。AtGLK1外源蔗糖处理显著增加了水稻子叶和下胚轴中GUS基因的表达,因此,水稻对蔗糖的响应似乎来自于其启动子的活性AtGLK1:格斯转基因苗(无花果。1.b) 。这种表达模式表明AtGLK1可能参与了拟南芥发育早期蔗糖诱导的花青素积累。
通过在这项工作中进行的表型,生理学和分子分析,鉴定了强烈的正相关性AtGLK1花青素在蔗糖处理中的表达和积累。第一,功能丧失glk1 glk2双突变体的花青素水平低于GLK2.虽然AtGLK1的缺失对花青素的积累没有影响(图。2.). 缺乏花青素较少的表型GLK1突变体可能是由于ATGLK1和ATGLK2之间的功能冗余或补偿。类似地,ATGLK1和ATGLK2已被证明在调节叶绿体开发中的功能冗余[26,27].在拟南芥幼苗的早期发育阶段,单glk突变体(GLK1和GLK2.)很大程度上与野生型相似,只有glk1 glk2双突变体表现出叶绿体缺陷表型,表明两者各有缺陷阿塔尔克基因冗余作用于指导单数叶绿体发展[26]. 这个阿塔尔克基因显示部分冗余,因为有一个无花青素的表型特异性GLK2.突变等位基因,但没有特定于GLK1等位基因(图。2.).以下两个方面的实验数据可能反映了这两个基因的表达水平不同,而不是功能不同。一方面,过度表达AtGLK1显著增强了花青素的积累35 s:: AtGLK1转基因拟南芥幼苗,即使表达AtGLK2严重受损(图。3.).在另一方面,实时定量PCR结果表明,mRNA的积累AtGLK1显著低于AtGLK2在野生型拟南芥幼苗中(图S2.). 其次,当在拟南芥中过度表达时35 s:: AtGLK1转基因幼苗表现出增强的花青素积累(图。3.).我们还检测到的表达AtGLK2在野生型和35 s:: AtGLK1转基因幼苗。有趣的是,他的表情AtGLK2在这一过程中受到了显著的损害AtGLK1-与相应的野生型植物相比,过度表达的植物(图。3.b)。有两个可能的解释。第一种解释是,AtGLK1具有调节的附加功能AtGLK2表达式。第二种解释是AtGLK2在里面AtGLK1-过表达的植物最可能是为了维持mRNA总量不变AtGLKs通过两个同源基因之间的表达重编程。第三,我们发现glk突变体(GLK1,GLK2.和glk1 glk2)苗积累了较低的转录水平DFR,F3'H,Ldox.,UF3GT.,UGT75C1, 和UGT75C2,参与花青素生物合成的后期步骤,而AtGLK1-overexpressing苗显示比在野生型苗观察到的高转录物水平(图4.).相比之下,早期生物合成基因的转录水平,例如CHS和气没有观察到的是大大改变的AtGLK1-overexpressing植物(图。4.c)。ATGLK1行动的另一个潜在目标可能是PAP1,已被证明能激活晚期花青素生物合成基因的表达[18,47].PAP1是能够介导在几种植物物种,包括拟南芥属,烟草,矮牵牛及玫瑰[参与花色素苷生物合成基因的阵列的异位活化的R2R3 MYB型转录因子47,48,49,50].事实上,我们的研究发现PAP1低于glk突变体(GLK1,GLK2., 和glk1 glk2),但明显较高AtGLK1-过表达的幼苗,与相应的野生型植株进行比较(图。4.). 因此,AtGLK1似乎主要通过影响晚期花青素生物合成基因的表达来调节蔗糖诱导的花青素积累。因此,基于上述结果,我们的研究认为AtGLK1可能是拟南芥花青素积累的正调节因子。
从叶绿体到细胞核的胞内信号称为质体逆行信号。这些信号传导过程在协调核编码基因和质体编码基因的表达中发挥着重要作用[51]. 在present study, it was found that norflurazon and lincomycin (two drugs known to block chloroplast biogenesis via different mechanisms), which induce retrograde signaling [33,34研究发现,蔗糖处理的拟南芥幼苗的花青素积累增加(图。5.;无花果。1.).这些结果表明,花青素的生物合成受到质体逆行信号的正向调控。如果功能失调性叶绿体的阳性信号仅通过AtGLK1传递,那么这些信号应该被取消glk1 glk2双突变体。然而,观察到NORFLURAZON和LINCONCIN对蔗糖诱导的花青素积累的影响更大glk1 glk2双突变体,但在AtGLK1-过表达的幼苗,与野生型幼苗相比(图。5.c - d)。这些结果表明,AtGLK1可能在质体逆行信号介导的花青素积累中起负调控作用。实时荧光定量PCR分析结果与上述推测一致AtGLK1在转录水平的Norflurazon和LiNcomcin治疗中受到强烈调节(图。5.一种)。尽管这样,进一步的研究,将需要以解开从而调节花青素积累AtGLK1介导的质体逆行信号传导途径的详细分子机制。
mybl2是花青素生物合成的负调节剂。表达模式的分析mybl2突变体,或转基因植物过表达MYBL2,已经证明MYBL2调节花青素生物合成相关基因的表达[13,14].在花青素生物合成途径中的结构和调节基因中观察到类似的表达模式AtGLK1-overexpressing植物和glk1 glk2本研究的双突变体(图。4.),这提出了ATGLK1通过调节调节Atthocyanin生物合成的可能性MYBL2表达式。然而MYBL2转录水平在两组中均无明显变化glk1 glk2双突变体或AtGLK1-过表达的植物与野生型相比(数据未显示)。因此,推测AtGLK1可能调控MYBL2转录后水平的表达。为了确定AtGLK1和MYBL2之间的遗传关系,我们构建了过表达的转基因株系MYBL2在AtGLK1-overexpressing植物。结果表明,超表达MYBL2完全补充了花青素过度令人意料的表型AtGLK1-overexcressing幼苗(图。6.B-C),这表明MyBl2是在花青素生物合成中的AtGlk1的神经性。此外,在花青素生物合成的转录物水平中发现了一致性(DFR,F3'H,Ldox.,UF3GT.,UGT75C1, 和UGT75C2)及规管(PAP1和TT8.)基因,这些基因在AtGLK1-过表达的幼苗,均下调MYBL2过度表达(图。6.d)。
方法
植物材料和生长条件
野生型和突变系拟南芥蒂利亚纳都在哥伦比亚生态型(Col-0)。转移DNA插入突变体GLK1(CS9805),GLK2.(CS9806),和glk1 glk2(CS9807)从拟南芥生物资源中心(ABRC)获得,转基因拟南芥植株过表达AtGLK1和MYBL2(OE)GLK1./ OEMYBL2)是通过杂交过表达的纯合子转基因株系产生的AtGLK1和MYBL2.在4°C黑暗分层3天后,表面消毒的种子在22°C的1/ 2ms培养基上(0.8% (w/v)琼脂,2% (w/v)蔗糖,pH 5.8)发芽,16 h光/8 h暗循环,除非另有说明。所有表型鉴定实验均在多个生物样品上进行,且至少重复3次。
为了研究去氟拉松(NF)和林可霉素(Linc)对花青素生物合成的影响,将无菌和冷处理的种子在1/ 2ms无Mock、5 μM NF和0.5 mM Linc培养基上垂直发芽生长4天(连续光照条件下)。然后收获4日龄的幼苗进行花青素测定。
的验证dSpm在插入glk突变体
这个dSpm在插入GLK1和GLK2.利用PCR方法验证突变体dSpm-特异性引物,spm5为GLK1spm8用于GLK2.;和阿塔尔克基因特异性引物,2bgs2 forGLK1, ara4为GLK2..PCR基因分型引物列于表S1.突变体的PCR基因分型的结果如图1所示。1..
结构与植物转化
构建AtGLK1:格斯融合基因ATG起始密码子上游的1702 bp DNA片段AtGLK1基因(At2g20570)是从拟南芥蒂利亚纳基因组DNA的PCR。PCR中使用的引物为PGLK1-F.和PGLK1-R.(Bam我和以区域I)。然后将特异性PCR片段插入二元载体pCAMBIA 1301中Bam我和以区域I站点,替换CaMV 35 s启动子,以创建重组转录单元AtGLK1:格斯. 建设35 s:: AtGLK1单元,全长编码序列(CDS)对应于AtGLK1采用RT-PCR方法克隆了该基因的基因座拟南芥蒂利亚纳.PCR中使用的引物为OEGLK1-F和OEGLK1-R(Xba我和囊I网站被介绍)。将特异性PCR片段插入双载体PBI 121中Xba我和囊I站点,替换格斯基因,以创造重组转录单位35s :: Atglk1。为了建造35S :: MYBL2单元,全长编码序列(CDS)对应于MYBL2采用RT-PCR方法克隆了At1g71030基因座拟南芥蒂利亚纳.PCR中使用的引物为oemybl2-F.和oemybl2-R.(以区域我和英国理工学院E II位点被引入)。将特异性PCR片段插入到两种载体pCAMBIA 1301中以区域我和英国理工学院E II位,替换格斯基因,以创造重组转录单位35 s:: MYBL2。使用的所有底漆列于表s中1..
然后将重组质粒导入根癌土壤杆菌利用花浸法将菌株GV3101转化为野生型拟南芥(Col-0) [52]. 这个Transformants were then screened on 1/2 MS medium containing 50 μg ml−1.卡那霉素(35 s:: AtGLK1)或50 μg ml−1.潮霉素(AtGLK1:格斯和35S :: MYBL2).
RNA提取,cDNA合成和基因表达分析
根据前一项工作中报道的方法进行RNA提取和cDNA合成[53].对于实时定量PCR分析,按照制造商的说明,使用SYBR Green Perfect mix (TaKaRa,中国大连)在CFX96 (Bio-Rad)上进行反应。所有pcr均采用以下标准热剖面:95°C 2分钟;40个循环,95°C 10 s和60°C 30 s。基因表达归一化为ACTIN2减去的CT的价值ACTIN2从CT感兴趣基因的价值。然后从方程式获得表达比率。2.ΔΔCT.感兴趣基因的引物列于表S1..
花青素测量
花青素测定如以前描述的进行54]. 这个seedlings were grown for 4 days after sowing on 1/2 MS medium, and then used for anthocyanin measurement. Seedlings of each genotype were incubated overnight in 0.6 mL of 1% HCl in methanol at 4 °C and extracted using an equal volume of chloroform after the addition of 0.4 mL of water. After centrifugation, the quantity of anthocyanins was determined by spectrophotometric measurement of the aqueous phase (A530-0.25A657) and normalized to the fresh weight of each sample. 3 independent biological samples were used to measure anthocyanin for each genotype.
组织化学的GUS染色
纯合子T3.转基因线窝藏AtGLK1::格斯融合基因如前所述[55].至少有5个个人行进行了分析,给出如下所示的典型结果。
统计分析
每组的所有实验都至少进行3个重复。误差条表示±S.D.(n = 3)。该学生分析了控制和处理样本之间或野生型和其他基因型之间的显著差异T测试。与对照组相比,显著差异用一颗星表示,对应于P < 0.05.
可用性数据和材料
本研究中生成或分析的所有数据均包含在本文及其补充信息文件中。
工具书类
- 1.
黄酮类化合物的生物合成:遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物生理学126 2 485 493
- 2.
KS Gould J McKelvie KR Markham 2002花青素在叶子中起到抗氧化剂的作用吗?成像H2.O2.在机械损伤植物细胞环境后的红色和绿色叶子。25 10 1261 1269
- 3.
R Nakabayashi K Yonekura-Sakakibara K urano M铃木y yamada t nishizawa f Matsuda m kojima h sakakibara k shinozaki aj michael t Tohge M Yamazaki K Saito通过过度累积来增强抗氧化类黄酮植物J.77 3 367379.
- 4.
关键词:柑橘,UDP-GLUCOSYL TRANSFERASE,异位表达,花青素,原花青素
- 5.
Y Zhang E Butelli R Stefano De HJ Schoonbeek A Maqusin C Paqliarani N Wellner L Hill D Orzaez A Granell JDG Jones C Martin 2013花青素通过延缓番茄过熟和降低对灰霉病的敏感性,使番茄的货架期延长了一倍。23 12 1094 1100
- 6.
7 7 1071 1083
- 7.
Pelletier MK, Murrell JR, Shirley BW。拟南芥黄酮醇合酶和白花青素双加氧酶基因的研究。“早”和“晚”基因差异调控的进一步证据。植物杂志。1997;113(4):1437 - 1445。
- 8.
ËGrotewold 2006年的遗传学和花色素Annu启植物生物学的生物化学。57 1 761 780
- 9
˚FMehrtensħ克兰兹P贝德纳雷克乙Weisshaar 2005拟南芥转录因子MYB12是苯丙生物合成植物生理学的黄酮醇特异性调节剂。138 2 1083 1096
- 10
A Gonzalez M Zhao JM Leavitt AM Lloyd 2008 TTG1/bHLH/Myb转录复合物对拟南芥幼苗花青素合成途径的调控
- 11
R Stracke H Ishihara G Huep A Barsch F Mehrtens K Niehaus B Weisshaar 2007密切相关的R2R3-MYB转录因子的差异调节控制细胞不同部位的黄酮醇积累拟南芥蒂利亚纳苗木J. 50 4 660 677
- 12
Ĵ信Ë公园ģ彩2007 PIF3调节与两个因素的HY5依赖性花青素合成直接在拟南芥植物杂志49 6 981 994结合花青素合成基因启动子
- 13
C Dubos J Gourierec Le A Baudry G Huep E Lanet I Debeaujon JM Routaboul A Alboresi B Weisshaar L Lepiniec 2008 MYBL2是一种新的植物类黄酮生物合成调节因子拟南芥蒂利亚纳植物J。55 6 940 953
- 14
AtMYBL2是一种具有单一MYB结构域的蛋白,在拟南芥植物J. 55 6 954 967中扮演着负调控花青素生物合成的角色
- 15
HB Saksena M Sharma D Singh A Laxmi 2020葡萄糖信号在调节植物生长、发育和应激反应中的多功能作用J Plant Biochem Biotech。29 4 687 699
- 16
Y Nagira Y Ozeki 2004一个系统,在该系统中,花色素苷的合成在再生的torenia芽中诱导,J Plant Res.117 5 377 383
- 17
Y Nagira K Ikegami T Koshiba Y Ozeki 2006 ABA对环孢菊再生苗花青素合成的影响J Plant Res. 119 2 137 144
- 18
李志刚。2006拟南芥花青素生物合成途径的蔗糖特异性诱导。植物生理学。140 2 637 646
- 19
VDE WIM SK El-esawe 2014蔗糖信号通道导致煎锅和花青素积累:非生物和生物应激反应的双重功能?Environ Exp Bot。108 4 13.
- 20
R Gollop S甚至V COLOVA-TSOLOVA A PERI 2002表达葡萄二氢烷醇还原酶基因和其启动子区J EXP BOT的分析。53 373 1397 1409
- 21
白花色素双加氧酶基因表达的调控葡萄植物科学161 3 579 588
- 22
SW Jeong PK Das SC Jeong JY Song HK Lee YK Kim WJ Kim IP Yong SD Yoo SB Choi 2010乙烯抑制糖诱导的花青素色素沉着拟南芥蒂利亚纳植物生理学。154 1515 1531
- 23
AB Sivitz A Reinders JM Ward 2008拟南芥蔗糖转运蛋白AtSUC1对花粉萌发和蔗糖诱导的花青素积累具有重要作用。147 1 92 100
- 24
H Kubo AJM Peeters米高梅Aarts A Pereira M Koornneef 1999ANTHOCYNINLESS2,影响在拟南芥植物细胞花青素分布和根发育的同源框基因。11 7 1217 1226
- 25
B Chaudhuri F Hormann S Lalonde SM Brady DA Orlando P Benfey WB Formmer 2008通过FRET纳米传感器检测拟南芥根尖中质子载体和ph不敏感的葡萄糖和蔗糖积累
- 26
DW钳工DJ马丁MJ科普利RW苏格兰JA Langdale 2002GLK基因对调控不同植物叶绿体的发育
- 27
Y Yasumura EC Moylan JA Langdale 2005一种保守的转录因子介导了古代分化陆地植物细胞器生物发生的核控制。17 7 1894 1907
- 28
MT Waters P Wang M Korkaric RG Capper NJ Saunders JA Langdale 2009 GLK转录因子协调拟南芥光合机构的表达21 4 1109 1128
- 29
T Kakizaki H Matsumura K Nakayama FS Che R Terauchi T Inaba 2009 Coordination of plastid protein import and nuclear gene expression by plasmid to nucleus retrograde signaling . Plant Physiol 151 3 1339 1353
- 30
张丽丽,孙琦,张丽丽2013质体到核的胞内信号转导。植物学报64 559 582
- 31
L Tadini N Jeran C Peracchio S Masiero M Colombo P Pesaresi 1801质体转录机制及其与核基因组表达的协调:质体编码聚合酶、核编码聚合酶和基因组解耦1介导的逆行通讯Phil Trans R Soc B. 2020 375 20190399
- 32
S Teng J Keurentjes L Bentsink M Koornneef S Smeekens 2005拟南芥花青素生物合成的蔗糖特异性诱导需要MYB75/PAP1基因植物生理学。139 4 1840 1852
- 33
RE SUSEK FM AUSUBEL J CHORY 1993信号转导突变体拟南芥uncuply核出租车和红细胞叶绿体发育细胞的基因表达74 5 787 799
- 34
JA Sullivan JC Gray 1999核光合作用基因在暗区和豌豆根部的表达需要Plastid翻译LIP1突变植物细胞。11 5 901 910
- 35
Zong X Zhu Z Liu X Xi G Li D Cao L Wei J Li B Liu 2019功能性MYB转录因子编码基因AN2与植物花青素生物合成有关Lycium Ruthenicum Murray.BMC Plant Biol. 19 1 169
- 36
acta botanica yunnanica(云南植物研究中心)1998 GOLDEN 2:一种新的玉米叶植物细胞分化的转录调控因子10 6 925 936
- 37
L Rossini L Cribb DJ Martin JA Langdale 2001玉米Golden2该基因定义了植物细胞中一类新的转录调节因子。13 5 1231 1244
- 38
ALT鲍威尔简历阮T希尔KL程RFH Aktas H Ashrafi C脑桥R Fernandez-Munoz韦森特J Lopez-Baltazar CS Barry Y刘R Chetelat Granell AV Deynze JJ Giovannoni AB贝内特2012统一的成熟编码一个黄金2转录因子调控番茄果实叶绿体发展科学。336 6089 1711 1715
- 39
P Wang J Fouracre S Kelly S Karki U Gowik S Aubry MK Shaw P westthoff IH Slamet-Loedin WP Quick JM Hibberd JA Langdale 2013进化GOLDEN2-LIKEC基因功能3.和C4.种植植物。237 2 481 495
- 40
MT Waters JA Langdale 2009制造一个叶绿体EMBO J. 28 19 2861 2873
- 41
LV Savitch R Subramaniam GC Allard J Singh 2007 GLK1 ' regulation '编码疾病防御相关蛋白并产生抗性镰刀菌素graminearum在拟南芥Biochem Biophys Res Communce。359 2 234 238
- 42
KJ Schreiber CG Nasmith G Allard J Singh R Subramaniam D Desveaux 2011 Found in translation: high throughput chemical screening in拟南芥蒂利亚纳识别减少的小分子镰刀菌素小麦枯萎病的分子植物-微生物相互作用24 6 640 648
- 43
M Rauf M Arif H Dortay LP Matallana-Ramirez MT Waters H Gil Nam PO Lim B muller - roeber S Balazadeh 2013 ORE1通过拮抗g2样转录来平衡叶片衰老和维持
- 44
J Murmu M Wilton G Allard R Pandeya D Desveaux J Singh R Subramaniam 2014拟南芥GOLDEN2-LIKE (GLK)转录因子激活茉莉酸(JA)依赖的对生物营养病原体透明质酸(Hyaloperonospora arabidopsidis)的疾病敏感性,以及茉莉酸不依赖的植物对坏死营养病原体的免疫葡萄孢菌植物病理学。15 2 174 184
- 45
r啊,你刘tj王q萌h yin x王y wu n nan b liu zy xu 2019 Golden2样转录因子调节WRKY40植物生理学。179 4 1844 1860
- 46
ķSpringobĴ中岛中号山崎ķ齐藤在生物合成和花青素的积累天然产物代表2003的最新进展。20 3 288 303
- 47
zhao bovitz Y Xia J Blount RA Dixon C Lamb 2000 Activation tagging identification a保守的MYB regulator of phenylpropanoid biosynthesis Plant Cell. 12 12 2383 2394
- 48
MMB Zvi F negrei - zakharov T Masci M Ovadis E Shklarman H Ben-Meir T Tzfifira N Dudareva A Vainstein 2008 Interlinking showtraits: co-engineering of scent and colour biosynthesis in flowers plants Biotechnol J. 6 4 403 415
- 49
MMB Zvi E Shklarman T Masci H Kalev T Debener S Shafifir M Ovadis A Vainstein 2012PAP1转录因子增强玫瑰花朵新植物中苯丙醇丙烷和萜类化合物的产生。195 2 335 345
- 50
T Mitsunami M Nishihara I Galis KM Alamgir Y Hojo K Fujita N Sasaki K Nemoto T Sawasaki G Arimura 2014过度表达的PAP1转录因子揭示了黄酮类和苯丙类代谢的复杂调控尼科尼亚塔哈瓦姆植物的攻击Spodoptera litura公共科学图书馆之一。9个9 e108849
- 51
J . J . Chory 2008细胞器和核基因组间基因表达的协调
- 52
SJ Clough AF Bent 1998花浸:农杆菌介导的植物转化的简化方法拟南芥蒂利亚纳植物杂志16 6 735 743
- 53
D刘李j程2016年新型蛋白质延迟浅绿色,需要早期叶绿体生物发生拟南芥蒂利亚纳Sci代表6 1 25742
- 54
吴晓吕毅周勇曾东刘2019拟南芥叶绿体生物发生缺陷突变体的花青素积累。植物生长规律87 3 433 444
- 55
j yi d zhao j chu J yan J刘M吴j j江益血刘2019 atdpg1参与拟南芥幼苗通过abi4植物sci的盐应激响应。287 110180
确认
不适用。
基金
基金资助:国家自然科学基金项目(no . 31560077, no . 31801272);江西省自然科学基金项目(no . 20202BAB203023, no . 20202BABL215001)。
作者信息
从属关系
贡献
DZ、YZ、LY、ZY、JC、FZ和HJ进行了实验。DL帮助规划,解释,分析和手稿写作。所有作者都对结果进行了讨论,修改了手稿,并批准了这项工作的提交。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
补充信息
权利和权限
开放存取本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,前提是您给予原作者和来源适当的信任,提供知识共享许可证的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料信用额度中另有说明。如果文章的知识共享许可证中未包含材料,且您的预期用途未经法定法规许可或超出许可用途,则您需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
赵东,郑勇,杨磊。et al。转录因子AtGLK1在MYBL2上游起作用,在拟南芥中遗传调节蔗糖诱导的花青素生物合成。植物生物学21,242(2021)。https://doi.org/10.1186/s12870-021-03033-2
已收到:
认可的:
发表:
关键字
- 拟南芥
- AtGLK1
- 花青素生物合成
- MYBL2