抽象的
背景
梨和苹果都是多年生落叶乔木蔷薇科两者都是世界上重要的经济果树。市场上出现的许多品种大多是由野生驯化到栽培的,并受基因差异表达的调控。然而,这种现象背后的分子过程和途径仍不清楚。本研究利用4种典型的野生和栽培梨树和苹果树在三个发育阶段的转录组水平上研究了分子过程。
结果
生理观察结果表明每个发育阶段野生和品种果实中的大小,体重,糖酸含量和剥离颜色明显差异。利用基于下一代的RNA-SEQ表达分析技术,我们在大部分引燃梨和苹果基因的游行中产生了转录组,并提供了野生和品种果树差异现象的分子基础。在三个发育阶段分别在梨和苹果中鉴定5921和5744差异表达基因。我们在发展果实中进行了时间和空间差异基因表达谱。鉴定了诸如信号转导,光合作用,翻译和许多代谢等若干关键途径,如野生和品种水果的分化所涉及的。
结论
在这项研究中,我们报道了新一代测序研究的时间和空间的梨和苹果果树的mRNA表达谱。通过对梨和苹果的转录组进行综合分析,揭示了梨和苹果驯化过程的一致性蔷薇科果树。结果对改善品种物种和野生资源的利用产生很大影响。
背景
梨树和苹果树属多年生落叶乔木Malinae内亚族蔷薇科(Pyrus.) 家庭 [1].他们俩都是全球重要的经济水果,中国是主要生产者和消费者(粮农组织,2020年)。梨起源于野生梨'douli'(p . calleryana丹斯)中国西南部,在中国已有3000多年的种植历史[2,3.].品种梨树包括P. Bretschneideri.,P. Pyrifolia,P. Ussuriensis.,p . sinkiangensis,P. Communis.系统 [4],虽然典型的野梨包括杜梨(p . betulifolia、川梨(p . pashiaBuch),山梨(P. Ussuriensis.maxim)和ma梨(p . serrulataRehd) [5].野生苹果品种起源于300万年前,西亚安纳托利亚半岛的苹果果实化石遗迹可以追溯到公元前6500年左右[6].相信中亚野生苹果物种的研究人数是现代栽培苹果的祖先,即M. Sieversii.(LEDEB。)ROEM [6,7].
果树驯化是一种通过改变遗传特征来适应新环境的过程[8].一般野生种果实较小,扁圆形,含糖量低,含酸量高,果皮粗糙,叶小,叶柄短[9,10.].根据个人喜好,人们通常会选择体积大、颜色鲜艳、味道好的水果,如果一个品种要广泛种植,这些特征都是必须的。因此,果实大小、糖酸含量、果皮颜色、果实硬度等品质一直是研究的重点[11.,12.,13.].随着梨和苹果的几种基因组序列完成[14.,15.,16.,17.],对水果进化和品质的研究有了很大的发展。一些相关基因,如mir172g,MdSWEET9b, MdSWEET15a和MYB已在果树中确定[7,18.,19.].尽管梨和苹果中的一组基因组,SNP和QTL草案[17.,20.,21.,22.]野生和品种果实之间的巨大变化的分子过程仍不清楚。
mRNA表达水平的测量,它们之间的监管关系的清晰度对于了解许多途径和生物系统至关重要。随着基于第二代排序的RNA-SEQ技术的出现,可以以无偏见的方式测量基因组宽的表达范围[23.].RNA-SEQ技术具有很高的灵敏度和再现性,无疑将导致植物开发和反应的新洞察力[24.].
在目前的研究中,野梨'Douli'(p . calleryana丹斯)、野苹果“喜福海棠”(m . micromalus栽培梨‘砀山梨’(P. Bretschneideri.Rehd),品种苹果“金鲜”(M. Domestica.)被选为野生和品种果树的典型材料[2,14.,25.,26.].为了全面了解全基因组水平野生和品种巨大变化的分子途径,我们研究了使用RNA-SEQ技术在梨和苹果中的不同发育阶段的不同表达基因。结果将进一步探讨梨和苹果驯化的调节途径,尤其是水果尺寸,果味,剥离颜色和果实抗性的差异,这对培养物种的改善和利用野生资源有很大影响。
结果
梨和Apple库的转录RNA序列数据集
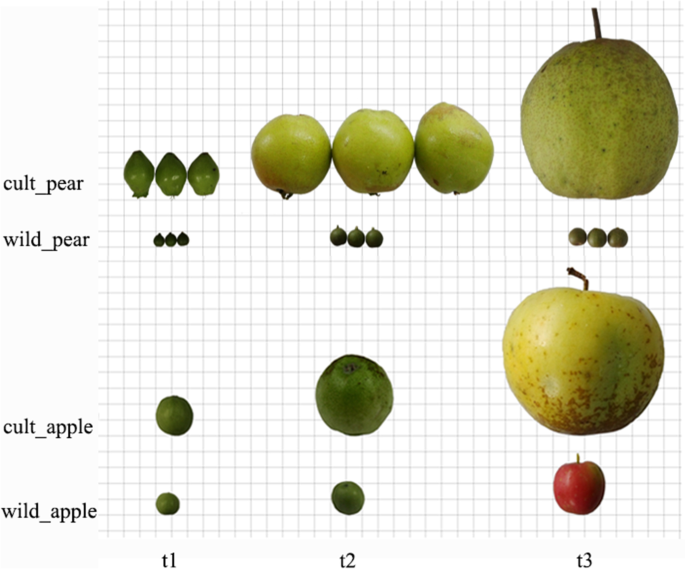
在本研究中,合并不同类型的材料(包括两个物种和三个发育阶段)的RNA,以提供与果实生长相关的广泛基因文库,并且最终产生了十六个文库,包括水果和叶子(图。1、表1).从梨的8个文库中共获得14937,456 ~ 30,370,082个reads,其中57.8% ~ 71.8%能被定位到‘党山苏里’参考基因组中,一致性对值为50.5% ~ 66.2% [14.].从苹果八个文库中获得总共16,219,542-34,807,619读,其中61.0%-76.3%,其可以映射到“金色美味”基因组和协调对值为54.2%-72.5%[17.].我们获得了84,055份转录物和40,402个基因,N50长度为2306英镑和中值1643. 95英镑在梨中;我们在苹果中获得了95,600种成绩单和56,781个基因,N50长度2117 BP和中位数长度为1470.5英镑(表2).
梨和苹果水果发育阶段的生理指标变异
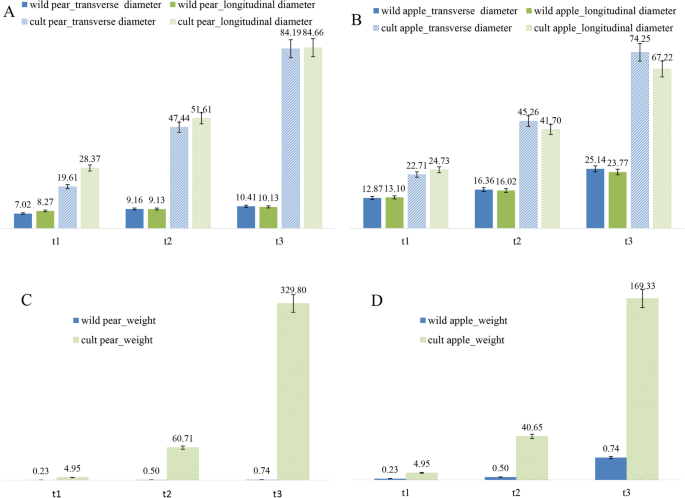
为了更好地了解生长,横向和纵向直径,观察到横向和纵向直径,单果重和糖酸含量被观察到(图。2、表3.).野生梨成熟期的横径和竖径分别是幼果期的1.46倍和1.23倍(图2)。2一个)。野梨的生长速率缓慢,水果开发过程中的果实大小没有明显变化。在成熟期的品种梨的横向和垂直直径分别为4.3%和2.9倍,在幼级果汁处为4.3和2.9倍。品种梨的横向生长速率高于纵向生长的速度,果实尺寸的生长速度比野生含量快得多。野生苹果在幼果阶段的横向和纵向直径分别为12.87毫米和13.1毫米,而在成熟阶段,它们为25.14毫米和23.77毫米,为年轻水果阶段的1.95%和1.48倍(图。2B).水果生长缓慢,大小没有显著变化。成熟期苹果的横向直径和纵向直径分别为74.25 mm和67.22 mm,约为幼果期的3.27倍和2.72倍。品种梨的成熟期重量约为野生梨的447倍(图1)。2苹果品种成熟期的重量是野生苹果的8.12倍。2D).野生品种和栽培品种在体积和重量上有明显的差异,两者的果实特性在栽培品种上都更大。
梨和苹果中的可溶性糖主要有山梨醇、果糖、葡萄糖和蔗糖[27.].有机酸主要包括奎酸,柠檬酸,苹果酸,草酸和shikimic酸(表3.)[28.].品种梨成熟时总糖含量达到43.6\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1和20.66\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1在野外,表明品种梨的总糖含量高于野生含量。品种梨果糖的含量为26.24\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1在成熟期,约为蔗糖的13倍。葡萄糖、果糖和蔗糖含量随果实发育而增加,并与总糖含量呈正相关。山梨醇与总糖含量呈负相关。野生梨中柠檬酸的含量高于其他酸。野生梨成熟期有机酸含量高于品种。
果糖含量高于其他糖,在成熟时的苹果中的苹果含量约为2.6倍的苹果。品种苹果成熟的总糖含量达到131.23\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1,野生苹果达到61.45\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1据表明,品种苹果中的总糖含量明显高于野外。果实发育过程中葡萄糖,果糖和蔗糖的含量增加,并与总糖含量正相关。柠檬酸和苹果酸的含量高于其他酸。在成熟时野生苹果的最高酸含量为柠檬酸8.18\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1,其次是苹果酸含量为6.36\ (\ mathrm {mg} \子弹\ mathrm {g} \)−1.与糖含量相反,果实成熟期间有机酸含量下降。野生酸总含量高于品种苹果。
在三个阶段鉴定野生和品种果实中差异表达的转录物和基因
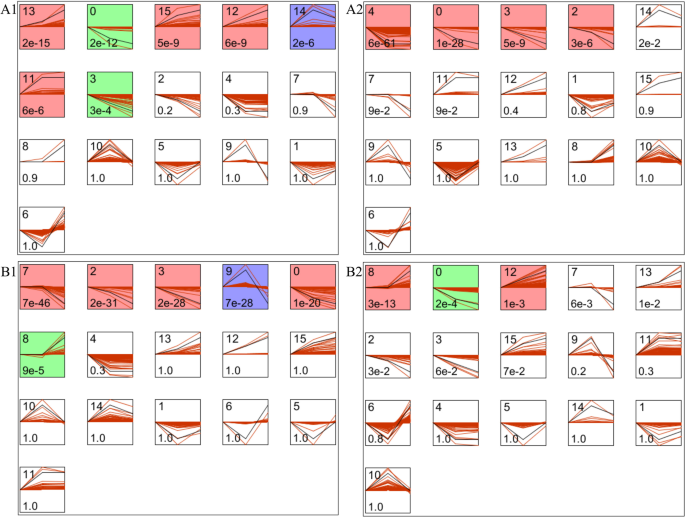
根据P < 0.001 and |Fold change|> 2, the significant differential expressed transcripts were identified (Fig.3.).两个梨品种在幼果期、膨大期和成熟期分别有3339、4005和4070个差异表达转录本(图2)。3.A).在所有三个阶段去除重复转录本后,剩下7051个转录本,对应5921个基因。有1228个转录本在所有阶段都有差异表达;这相当于1068个基因。在膨大期和成熟期同时存在2261个(1228 + 1033)差异表达转录本,在幼果期和膨大期、幼果期和成熟期分别存在1699个(1228 + 471)和1631个(1228 + 403)差异表达转录本(图2)。3.一个)。
蛋白表达转录物的数量分别为3188,2975和3918,分别为膨胀阶段和成熟阶段(图。3.b)。三组的交叉点和联合分别为1065和6381,分别对应于969和5744个基因。膨胀和成熟阶段,年轻和膨胀阶段,年轻和成熟阶段之间的常见差异表达的转录物分别为1586,1653和1526。在幼级果阶段,膨胀阶段和成熟阶段的独立差异表达的转录物分别为1074,801和1871年;这些仅在单一阶段表达。
差异表达基因在三个时期的表达趋势分析
利用STEM (Short Time-series expression Miner)对5921和5744个不同表达基因进一步聚类,分别分析梨和苹果中的表达趋势[29.].它鉴定了梨和苹果中的16种模型表达曲线(图。4).有颜色的配置文件具有统计学意义P < 0.05. Among the 7 colored profiles of cultivar pear, profile 13 (397 genes), 15 (239 genes), 12 (208 genes) and 11 (319 genes) were up-regulated, profile 0 (381 genes) and 3 (179 genes) were down-regulated and profile 14 (484 genes) was first up-regulated and then down-regulated (Fig.4A1)。在野生梨和所有野生梨中具有显着着色的四种型材(2007个基因)被下调(图。4A2)。
在苹果品种的3个发育阶段有6个显著的色谱。4B1)和野生苹果中的3个型材(图。4B2)。在苹果品种中,7号谱(539个基因)、2号谱(345个基因)、3号谱(298个基因)和0号谱(382个基因)下调,8号谱(692个基因)上调,9号谱(623个基因)先上调后下调(图2)。4B1)。野生苹果8号谱(726个基因)和12号谱(174个基因)表达上调,0号谱(299个基因)表达下调(图2)。4B2)。
Go功能注释富集分析差异表达基因
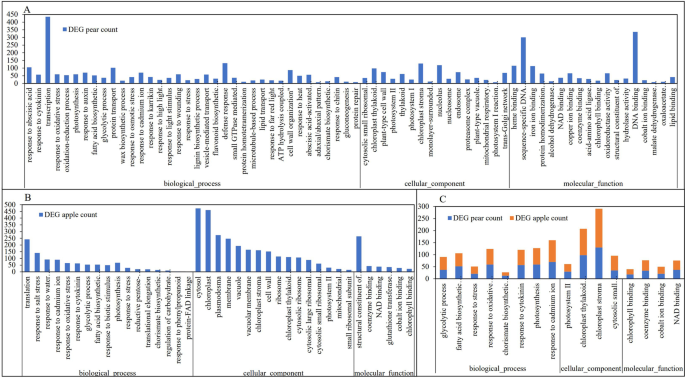
在梨和苹果中,在5921和5744个不同的表达基因上进行富集分析,其中4332和4378个基因分别注释为3261和3190个。符合超距离分布的功能丰富,其中P< 0.05显著富集至855和533项1)分别在梨和苹果中。与-log的条款(P> 6进一步富集到梨不同表达基因的36个生物学途径、16个细胞组分和18个分子功能(图1)。5a),17个生物途径,16个细胞组分和苹果不同表达基因中的6个分子官能(图。5b)。与-log的共同的Go术语(P- 梨和苹果在梨和苹果中的6种,将不同的表达基因富集成8个生物途径,4个细胞组分和4个分子官能(图。5C).生物过程中的主要富集项为糖酵解过程、脂肪酸生物合成过程、应激反应、氧化应激反应、chorismate生物合成过程、细胞分裂素反应、光合作用和镉离子反应(图)。5C)。
梨和苹果三个阶段差异表达基因途径富集分析
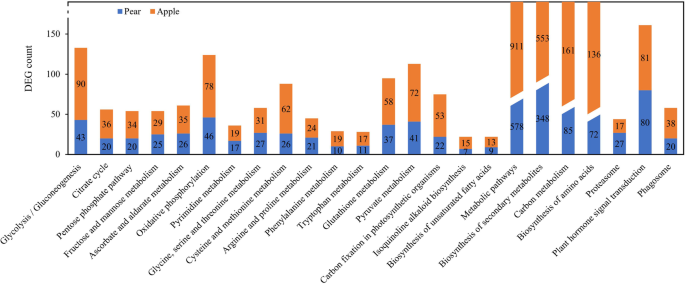
京都基因和基因组百科全书(KEGG)路径可以帮助进一步确定基因的生物学功能和相互作用[30.].通过与KEGG数据库的比较,在梨的40402个基因中,有13102个基因(32.43%)匹配显著,分布在133个KEGG通路上;在苹果56,781个基因中,18,459个(32.51%)基因匹配显著,分布在134个KEGG通路上。在梨5921个不同表达基因中,有1929个基因被分配到123个KEGG通路中,50个基因被分配到KEGG通路中P < 0.05 were significantly enrichment (Supplementary Fig S2).在5744个苹果不同的表达基因中,2578个基因参加了128个途径和30个途径P < 0.05 were significantly enrichment (Supplementary Fig S3.).梨和苹果中的24种途径显着富集,主要涉及代谢途径(梨,911基因在苹果中的578个基因)中,二次代谢物的生物合成(梨中348个基因,苹果中的553个基因),碳代谢(85个基因)(85个基因在梨,161个基因中,苹果中的161个基因)和氨基酸的生物合成(梨中72个基因,苹果中的136个基因)等(图。6).
三个阶段梨和苹果差异表达基因的共表达模块分析
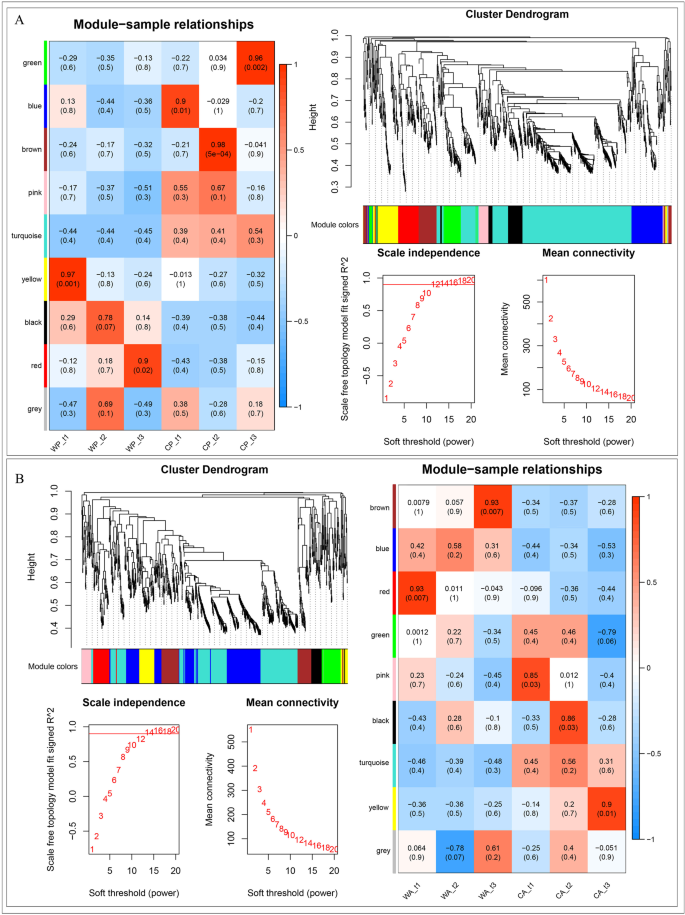
1068和969基因在梨和苹果各发育阶段的表达均有差异。根据基因表达的相关性,将这1068个基因和969个基因分别用Power = 14的WGCNA模型划分为9个模型(图2)。7)[31.].灰色模块是一个非功能模块,在梨和苹果中分别有4个和2个基因。检验各模块与6个样本之间的相关性。6个样本中9个模块大部分呈负相关,但正相关在某些阶段尤为显著(P< 0.05)。功能分类显示WP_t1 (r= 0.97, 84个基因)与类黄酮生物合成过程、镉离子响应等相关;红色在WP_t3 (r= 0.90, 78个基因)对转录、高光强、热、盐胁迫和脱落酸的响应;蓝色在CP_t1 (r = 0.90, 112 genes) associated with transcription, glycolytic process, photosynthesis; brown in CP_t2 (r= 0.98, 85个基因)还关注对缺水、脱落酸、寒冷和盐胁迫的反应;绿色在CP_t3 (r= 0.96, 78一族)的研究重点是植物型细胞壁组织、苹果酸代谢过程等。7一个额外的文件1).模块红色在WA_t1 (r = 0.93, 62 gens) associated with flavonoid biosynthetic process, anthocyanin-containing compound biosynthetic process, response to stress; brown in WA_t3 (r= 0.93, 117个基因)与转录、防御反应、对寒冷的反应有关;CA_t1粉红色(r = 0.85, 35 genes) associated with response to light stimulus, ATP hydrolysis coupled proton transport; black in CA_t2 (r = 0.86, 41 genes) associated with response to response to water deprivation, photosynthesis, response to cytokinin; yellow in CA_t3 (r = 0.90, 72 genes) associated with translation, defense response, fatty acid biosynthetic process (Fig.7b,附加文件1).结合各模块内的基因互作,选取梨和苹果各模块中显著表达的10个关键基因进行表达水平分析(附文件)2、补充图S4).
讨论
在这项研究中,我们报道了新一代测序研究的时间和空间的梨和苹果果树的mRNA表达谱。一种具有功能分类的差异表达基因(DEG)方法能够识别与野生和栽培材料之间长时间驯化相关的机制[32.].应用STEM、正相关分析和负相关分析对DEGs数据进行综合分析[29.].将WGCNA簇将差异表达基因分为模块,并将它们与表型相关[31.].这些提供了野生和栽培材料差异的分子基础。
样本数据的可靠性
研究表明,基因表达在不同的个体之间具有生物变异性,不同的基因表达程度也不同,而转录组测序技术并不能消除这种变异性[33.,34.].目前,最常见有效的方法是在实验设计中建立生物重复。虽然本研究中没有对个体特定的生物重复,但我们分析了本研究中梨数据的相同基因表达的相关性与已发表的数据[14.[比较相同的果实发育阶段,相关系数达到0.95,0.96和1(P < 2.2e-16) (Supplementary Fig S5).同时,将梨和苹果两个品种重复组合,共同分析驯化过程中野生和栽培果实的差异,强烈揭示了梨和苹果驯化过程的一致性蔷薇科果树。
梨和苹果果实的时间和空间生长模式
幼果期、膨大期和成熟期涉及到果实的生长期,在以往的研究中根据不同地区的物候期确定[14.,35.].为了确定野生和品种果实在不同生长阶段发生的转录调控变化,我们分析了差异表达基因。一般来说,差异表达基因的数量可以代表不同的生长程度,物种之间的数量越多,它们之间的差异就越大[36.].在果实生长过程中,野生果和栽培果的差异表达基因数量几乎都在增加,且梨和苹果的幼果期和成熟期的差异最大。3.).我们还发现共同差异表达基因在梨(r = 0.78,P= 0.07)和苹果(r = 0.58,P= 0.2)(图7).与其他品种相比,野生苹果和栽培苹果膨大期差异表达基因数量较少,这可能是由于苹果膨大期差异表达基因变化不大的内在机制所致。
GO和涉及野生和栽培果实表型和内在品质的途径
在野生果实到栽培水果的长期归类期间,外部和内部品质大大变化,本研究中的数据确认了这些变化(图。1,2和表格3.).GO和通路分析表明,梨和苹果在糖酵解过程、脂肪酸生物合成过程、应激反应、氧化应激、细胞分裂素、镉离子、光合作用、代谢途径和信号转导等方面的差异表达基因在果实(无花果)驯化过程中发挥了重要作用。5和6).
在本研究中,果实大小和重量的差异是野生材料和品种材料比较中最明显的特征。研究普遍认为,它们通常由细胞数量、细胞体积和细胞间隙决定[15.,37.].Daccord等人发现,在两个苹果系中,果实较大的细胞层明显大于另一个[15.].植物内源激素以及环境因素可以通过细胞周期调节植物生长和发展的进展[36.].已知几种植物激素,特别是植物素,细胞素,乙烯和赤霉素调节椎骨发育和细胞扩大[38.,39.,40].在本研究中,我们鉴定了乙烯生物合成过程、细胞分裂素反应、脱落酸反应等方面的差异表达基因1).这表明细胞分裂对于早期发育阶段期间对水果的快速增大至关重要。
光合作用是植物利用叶绿素将二氧化碳和水转化为有机物的过程,在植物生长和糖的积累中起着关键作用[41.,42.].事实上,在梨和苹果上发现了一个共同的趋势,栽培品种的总糖含量显著高于野生品种,并在果实生长过程中增加,而有机酸则呈现相反的趋势,这些发现与前人的研究一致[27.,28.].一些研究表明,血浆膜水素素的上调提高了树木的光合活性和生长[43.].我们的研究还发现,在野生品种梨和苹果的差异表达基因中,细胞成分如光系统II、核糖体和分子功能如叶绿素结合、辅酶结合、NAD结合均显著富集(图2)。5),这些结果共同表明,光合能力对野生和栽培果树的分化有重要影响。另一方面,叶绿素结合和光合作用决定了果皮颜色的变化[44.].水果不同颜色的形成是由色素引起的,苹果中的色素是叶绿素、花青素和类胡萝卜素,它们分别形成绿色、红色和黄色[45.].此外,发现光谱和强度的差异对色素的形成有影响[46.].在本研究中,果皮颜色调控主要涉及到亮色花青素还原酶活性和类黄酮生物合成过程,已有研究报道的几个相关基因在苹果中上调或下调(Supplementary Fig S6)它们互动以调节剥离[12.,47.,48.].
一些研究报告说,野生材料面对逆境应激或一些外部条件具有更多优势,有时选中关键基因以开发新的抗性品种[10.,49.,50.].在水稻和甜橙的发育过程中已经报道了许多与刺激反应有关的基因[50.,51.].本研究通过对氧化应激、细胞分裂素、生长素或脱落酸刺激、镉离子、冷、伤、光等刺激的防御反应基因的差异表达检测,揭示了环境因子在果实驯化中的重要作用。此外,野生植物中也存在优良的抗性基因,需要进一步研究。在从野生驯化到品种驯化的过程中,主要的代谢途径包括次生代谢产物的生物合成、碳代谢、糖酵解/糖异生、氨基酸的生物合成等。6)已经确定在植物的发展阶段中最受控制的。这些代谢过程可以为DNA复制,翻译,信号转导,激素生物合成和细胞生长提供能量和组分[36.,52.,这对果实在自然条件下的快速驯化至关重要。
材料和方法
植物材料和生物测量
野梨'douli'(p . calleryana栽培梨‘砀山梨’(P. Bretschneideri.采自南京农业大学试验场。野生苹果“喜福海棠”(m . micromalus牧野)和品种苹果“金鲜”(M. Domestica.),采自中国农业科学院郑州果树研究所。梨是5月6日收获的TH.,6月30日TH.和9月6日TH.2014;苹果在5月6日收获TH.,6月6日TH.和9月17日TH.分别对应幼果期、膨大期和成熟期1).每个阶段采10个果实。将同一组的水果切成小块,在田间集中包装,立即用液氮冷冻,然后在-80°C中保存,直到提取RNA。另外,用电子天平测量10个果实的单果重,在果实中心横截面上用游标卡尺测量每个果实的垂直直径和水平直径。采用高效液相色谱法测定可溶性糖(山梨糖醇+果糖+葡萄糖+蔗糖)和有机酸(奎尼酸+柠檬酸+苹果酸+草酸+莽草酸)。53.].将五克果组织研磨成粉末和杵中的液氮。与6mL 80%乙醇混合后,置于37℃浴中30分钟。将混合物在15,000g在4℃下以15,000g离心15分钟。重复上述步骤三次以确保萃取所有糖和酸的总体积为50ml。回收上清液并立即通过SEP-C18柱(Waters,Wat020515)过滤,以消除任何干扰的无恶体残基,并通过0.45μm的Sep-Pak滤波器(Jasco France,TR200102)以消除大颗粒。然后,提取物用于yao等人描述的特征后的糖和酸含量的HPLC系统。(2010)和Sha等人。(2011)分别[27.,28.].采用外部标准建立样品含量,以毫克每克新鲜重量(FW)表示。
转录组测序文库的准备
采集12个不同发育阶段、4个个体的果实组织进行RNA制备。按照制造商的说明,使用TRIzol试剂(Gibco BRL)提取总RNA,使用poly-T oligo-attached magnetic beads从总RNA中纯化mRNA。使用NanoDrop 2000 (Thermo Fisher Scientific, Wilmington, DE)测定RNA浓度和纯度。分裂后,使用随机六聚物合成第一链cDNA底漆和第二链cDNA合成随后执行使用DNA聚合酶和核糖核酸酶h . 240年优先选择cDNA片段bp在长度、图书馆片段与AMPure纯化XP系统(美国贝弗利贝克曼库尔特)。所选片段经PCR扩增后,在Agilent Bioanalyzer 2100系统上进行文库质量评估,然后利用Illumina平台进行测序,生成配对端reads。实验原始数据以登录号SRR9291270、SRR9291271、SRR9891658和SRR9891659提交到NCBI的序列读取档案(SRA)。
转录组数据分析
fastq格式的原始读取首先通过内部perl脚本进行处理。在这一步中,适配器序列和低质量序列读取被从数据集中删除。经过数据处理后,将原始序列转换为干净读取。然后利用Tophat工具软件(http://ccb.jhu.edu/software/tophat/index.shtml.)[14.,17.].仅基于参考基因组进一步分析和注释具有完美匹配或一个不匹配的读取。基于以下数据库注释基因功能:NR(NCBI非冗余蛋白序列);NT(NCBI非冗余核苷酸序列);PFAM(蛋白质);Kog / Cog(蛋白质群组的簇);Swiss-prot(手动注释和审查的蛋白质序列数据库);KO(kegg ortholog数据库);去(基因本体论)。使用Kallisto软件(TPM)估算基因表达水平估算(TPM)(https://pachterlab.github.io/kallisto/).
差异表达分析
通过R-Package Degseq分析水果中的差异表达转录物和基因[32.].DEGseq在利用转录本中阅读片段的数量直接检测差异表达基因和通过绘制日志检测差异表达基因的MA图方面效率更高2阅读特定转录物的读数段的价值。假设两种不同样本中的特定基因的读数的数量是c1和C2分别为:M = log2C1- - - - - -日志2C2,a =(日志2C1+日志2C2)/ 2。P值<0.001和|折叠变化| 2被设定为显着差异表达的阈值。
差异表达基因的Go和Kegg途径浓缩分析
基因本体论(GO)是一个提供基因功能注释的国际网站,提供一系列的语义学,以描述基因和基因产物的特征,包括细胞成分、分子功能和生物途径(http://www.geneontology.org/).京都基因和基因组百科全书(KEGG)是一个数据库资源,从分子水平的信息,了解生物系统的高级功能和效用,如细胞,有机体和生态系统,特别是基因组测序等高通量实验技术生成的大规模分子数据集(http://www.kegg.jp/).通过基于基于的非中枢超几何分布实施了差异表达基因的基因本体和Kegg途径浓缩分析P值<0.05 [54.].
差异表达基因短时间序列表达分析
短时间序列表达式矿工(STEM) [29.]是在短时间内序列聚类,比较和视觉表达式的软件。它适用于3-8个时间点。模型配置文件的最大数量为50,时间点之间的模型配置文件的最大单位变化为2. Stef可以通过“交换行和列”,“配置文件ID”,“意义”和“相关性”订购配置文件。在这项研究中,四个个体(野生和品种梨,野生和品种苹果)的所有差异表达基因作为输入文件,并与调节趋势显着变化P值<0.05。
差异表达基因共表达模块识别
WGCNA(加权基因Co表达网络分析)的R包是加权相关网络分析的常见工具[31.].在本研究中,分别在梨和苹果的三个阶段为1068和969次常见的差异表达基因作为输入数据。所有数据都是完整的,没有异常值。筛选软阈值功率,通过选择功率,将基因分成九个模块。模块被定义为密集互连基因的簇。最后,计算了三个开发阶段的每个模块和表型之间的相关性,模块显着相关r> 0.8和P值<0.05。
数据和材料的可用性
将实验的原始读取数据提交到NCBI SRA数据库(https://www.ncbi.nlm.nih.gov/sra),研究的登录号为SRR9291270,SRR9291271,SRR9891658和SRR9891659。
参考
- 1。
Potter D, Eriksson T, Evans RC, Oh S, Smedmark JEE, Morgan DR, Kerr M, Robertson KR, Arsenault M, Dickinson TA。蔷薇科的系统发育与分类。acta botanica sinica(云南植物学报). 2007;42(1):1 - 4。
- 2。
张成泽JT。的识别Pyrus.叶片过氧化物酶同工酶表型。acta Horticult Sci. 1992;61(2): 273-86。
- 3.
Silva GJ,Souza TM,Barbieri RL,Oliveira。起源,驯化和分散梨(Pyrus.spp)。阿阿格利司。2014;2014(1):1 - 8。
- 4.
郑X,Cai D,姚L,Teng Y.非协调其伪原的进化,早期和系统发育效用Pyrus..acta physica sinica . 2008;48(3): 892-903。
- 5。
田村,田abe K ., Itai A ., Morimoto M.对野生梨品种和品种叶片芽内休眠的低温需求的变化。acta hortichorticulult Sci. 2008;70(5): 596-8。
- 6。
Vavilov Ni。栽培植物起源研究。Trudy Byuro Prikl Bot。1926; 16:139-245。
- 7.
段宁,杨斌,孙辉,南伟,陈旭。苹果基因组重测序揭示了苹果发育历史,并支持果实膨大的两阶段模型。Nat Commun。2017;8(1):249。
- 8.
Pinhas。果树的驯化。Dev阿格利司。1986;16:201。
- 9。
刘志刚,刘志刚,刘志刚,等。植物的遗传多样性及其在植物分类中的应用Pyrus.在西班牙东北部,基于形态分析。植物资源学报。2007;54(7):1473-87。
- 10。
李文,迪塔米,罗德米,吴W,葛XJ。Deep RNA-SEQ分析揭示了野生香蕉相对耐受镰刀虫F的关键响应方面。sp。Cumenste热带比赛4. Funct综合基因组学。2020; 20:551-62。
- 11.
李米,李L,Dunwell JM,Qiao X,Liu X,张S.脂氧合酶(LOX)基因家族在中国白梨(Pyrus.与蔷薇科其他成员的比较。BMC基因组学,2014;15(1):444。
- 12.
张晓军,王丽霞,刘玉玲,陈晓晓,杨永忠,赵征镒。青苹果果皮着色过程中差异基因表达分析。[J] .中国生物医学工程学报,2013;
- 13。
李敏,李鹏,马芳,程磊。转基因苹果果实中山梨醇合成量的变化及其对糖代谢的影响。Horticult杂志2018;5(1):1。
- 14。
吴俊,王Z,施Z,张某,明河,朱S,汗马,陶某,korbanss,王h。梨的基因组(Pyrus bretschneideri Rehd。)。Genome Res。2013; 23(2):396-408。
- 15.
苹果基因组的高质量重组和早期果实发育的甲基组动态。Nat麝猫。2017;(7):1099。
- 16。
张丽丽,胡建军,韩旭,李军,高艳,Richards CM,张超,田勇,刘刚,Gul H.一个高品质苹果基因组组装揭示了逆转录转座子与果实红色的关联。Nat Commun。2019;10(1):1494。
- 17.
Velasco R, Zharkikh A, Affourtit J, Dhingra A, Cestaro A, Kalyanaraman A, Fontana P, Bhatnagar SK, Troggio M, Genetics DP。研究了苹果(Malus ×家蝇Borkh.)的基因组。Nat麝猫。2010;42(10):833 - 9。
- 18.
郑强,方涛,彭强,廖玲,赵磊,Owiti A,韩勇。苹果SWEET基因与糖积累的遗传关联分析。Horticult杂志2018;5(1):14。
- 19.
3 . Wei G, Han Y, Wei G, Korban SS.一种苹果MYB转录因子MdMYB3参与花色苷生物合成和花发育的调控。植物学报。2013;13(1):176。
- 20.
Chagnã D, Crowhurst RN, Pindo M, Thrimawithana A, Deng C, Ireland H, Fiers M, Dzierzon H, cesaro A, Fontana P.欧洲梨(Pyrus communis L. ' Bartlett ')基因组的初步序列。《公共科学图书馆•综合》。2014;9 (4):e92644。
- 21。
吴杰,李维,李米,汗马,李Xg,陈h,尹h,张sl。使用SNP和SSR标记的高密度遗传联系地图结构和梨果实QTLS的鉴定。J Exp Bot。2014; 65(20):5771-81。
- 22。
8 .马可汗,马海涛,韩毅。苹果果实品质性状数量性状位点(qtl)的鉴定。植物学报2013;32(1):109-16。
- 23。
Wang Z,Gerstein M,Snyder M.RNA-SEQ:转录组织的革命性工具。NAT Rev Genet。2009; 10(1):57。
- 24。
Haas bj,zody mc。推进RNA-SEQ分析。NAT BIOTECHNOL。2010; 28:421-3。
- 25。
郑智,孙安,于超,盛斌,程玉军。农杆菌介导转化苹果砧木小苹果的Rolc基因。植物学报。2006;42(6):491-7。
- 26。
李晓霞,凌科,张军,谢勇,王丽,严艳,那伟,徐军,李超,王伟。苹果改良杂种基因组重组的研究进展。Gigascience。2016;5(1):1 - 5。
- 27。
姚广发,张少林,曹艳芳,刘杰,吴杰,袁娟,张海平,肖春成。不同种梨果实可溶性糖组成及含量特征。中国农业科学,2010;43(20):4229-37。
- 28。
沙胜,李军,吴军,张胜。不同梨品种果实中有机酸的特征。农业科学学报2011;6(10):2403。
- 29.
STEM:用于分析短时间序列基因表达数据的工具。BMC生物信息学。2006;7(1):191。
- 30.
Minoru K,Michihiro A,Susumu G,Masahiro H,Mika H,Masumi I,Toshiaki K,Shuichi K,Shujiro O,Toshiaki TJ。Kegg用于将基因组联系到生命和环境。核酸RES。2008; 36(数据库问题):480-4。
- 31.
Peter L,Steve H. WGCNA:用于加权相关网络分析的R包。BMC生物信息学。2008; 9:559。
- 32.
王磊,冯震,王旭,王鑫,张晓军。DEGseq:一个用于从RNA-seq数据中识别差异表达基因的R包。生物信息学,2010,26(1):136 - 8。
- 33。
汉森·克,吴Z,Irtizarry Ra,韭菜JT。测序技术不会消除生物变异性。NAT BIOTECHNOL。2012; 29(7):572-3。
- 34。
在单个细胞中随机基因表达的研究。科学。2002;9:297。
- 35。
张旭,顾杰,殷杰。亚洲梨不同成熟期甲醇提取物及酚类化合物的抗氧化活性食品科学与生物技术。2006;15(1):44-50。
- 36。
他,崔克,张jg,段ag,zeng yf。基于下一代测序的mRNA和MicroRNA表达分析分析显示涉及在莫斯竹中发育秆的快速生长的途径。BMC植物BIOL。2013; 13(1):119。
- 37。
Goffinet MC, Robinson TL, Lakso AN。“帝国”苹果果实大小和解剖在未疏和手工疏树的比较。果树学报,1995;70(3):375-87。
- 38。
廖马,刘X,邓格,陈某,任yj,刘文。两种梨品种果实生长过程中内源激素变化的研究。J Fruit Sci。2009; 26:25-31。
- 39。
Teale Wd,Paponov Ia,Palme K.植物中的行动:信号,运输和植物生长和发展的控制。NAT Rev Mol Cell Biol。2006; 7(11):847-59。
- 40.
乙烯是杨树形成层分生组织中细胞分裂的内源刺激因子。美国国家科学院学报。2009; 106(14): 5984 - 9。
- 41.
植物光合作用、光呼吸作用与生产力。《圣经》1971;301-37。
- 42.
2个籼稻品种的糖积累、光合作用和生长对盐胁迫的响应。植物生理学报。2009;31(3):477-86。
- 43.
陈志强,韩波,王志强,王志强,王志强。白萝卜质膜水通道蛋白过表达对桉树水分利用效率、光合作用和生长的影响。树杂志。2010;30(3):417 - 30。
- 44.
海瑟林顿苏珊EJ。芒果果实的光合能力分析。果树学报,2015;72(5):755-63。
- 45。
Karanjalker GR, Ravishankar KV, Shivashankara KS, Dinesh MR, Roy TK, Sudhakar Rao DV。绿色、黄色和红色芒果品种果皮成熟过程中类胡萝卜素和花青素相关基因表达的研究应用生物化学。2018;184:140。
- 46。
Pearce GW,街道LR。浅色对苹果颜料形成的影响。J Biol Chem。1931; 92:743-9。
- 47。
MYB转录因子基因的分离和功能分析,MYB转录因子基因是苹果皮肤红色发育的关键调控因子。植物生理学杂志。2007;48(7):958。
- 48。
Takos Am,Felix WJ,Jacob SR,Jochen B,Robinson SP,Walker Ar。光诱导的MYB基因的表达调节红苹果中的花青素生物合成。植物理性。2018; 142(3):1216-32。
- 49。
Gunasekera D,Santakumari M,Glinka Z,Berkowitz Ga。野生和栽培的大麦基因型展示了适应植物水赤字的不同能力。植物SCI。1994; 99(2):125-34。
- 50.
姜伟。抗稻瘟病基因野生稻的筛选与利用。中国农业科学。1996;29(6):21-28。
- 51.
强X,刘y,朱艾,吴x,ye j,yu k,guo w,deng x.在甜橙红肉突变体中的微小Randas和比较分析。BMC基因组学。2010; 11(1):246。
- 52.
李坤,王永章,曲海勇。梨种授粉初期亲和和不亲和花型的RNA-Seq分析acta botanica sinica(云南植物学报),2019;
- 53.
利用高效液相色谱法研究糖蛋白中氨基酸、氨基糖和中性糖的含量。acta optica sinica (acta optica sinica, 1999);
- 54.
基于基因本体分析的RNA-seq选择偏倚分析。基因组医学杂志。2010;11 (2):R14-R14。
致谢
不适用。
资金
该项目得到了中央大学的基本研究资金,No.KyyJ202117。
作者信息
从属关系
贡献
HWZ分析了数据并起草了稿件。ML设计的实验,收集的样品并修改了稿件。MK,JMD,YYZ和CY修订了手稿,并为文章撰写了指导。JYW和SLZ支持实验设计并修订了稿件。所有作者都读过并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张红梅,李敏,孔敏。et al。基于RNA-seq技术的梨和苹果野生栽培材料基因表达差异研究BMC植物BIOL.21,256(2021)。https://doi.org/10.1186/s12870-021-03051-0
收到了:
接受:
发表:
关键词
- 梨
- 苹果
- 野生品种
- 差异表达
- 驯化
- RNA-SEQ.