抽象的
背景
地球上增长最快的植物莫斯竹是一个重要的亚洲收入来源,主要在中国培养。横向器官边界结构域(LBD)蛋白,植物特有独特的转录因子系列,参与多种转录调节途径,并在横向器官发育,病原体反应,二次生长和激素反应中起重要作用。这LBD公司基因家族以前尚未以莫斯竹子为特征(Phyllostachys Edulis.).
结果
在这项研究中,我们确定了55名LBD公司对毛竹的基因家族进行了研究,发现它们在毛竹的18条染色体上分布不均匀。系统发育分析表明毛竹LBD公司基因可分为两类。LBD公司来自同一类的S共享相对保守的基因结构和编码类似氨基酸的序列。许多激素响应相关顺式在研究中确定了监管要素LBD公司上游启动子序列。Synteny分析表明LBD公司毛竹基因组中的s与毛竹基因组中的s有较大的共线性O。莎蒂瓦(米)和Zea Mays.(玉米)而不是与拟南芥和一年生辣椒(胡椒)。在摩擦竹中发现了许多分段重复LBD公司基因家族。四种组织的基因表达谱显示LBD公司基因具有不同的空间表达模式。QRT-PCR测定与短时间序列表达矿工(Stem)时间表达分析表明六个基因(PeLBD20型那PELBD29.那PELBD46.那PeLBD10型那PELBD38,和PeLBD06型)在竹笋快速生长发育过程中不断上调。此外,基于共识LBD结合基序,鉴定出248个在多种途径中发挥作用的候选靶基因。
结论
在本研究中,我们鉴定了55个毛竹转录因子LBD的成员,并首次对其进行了鉴定。利用短时间序列表达软件和RNA-seq数据分析PeLBD基因的表达。我们还研究了所有的功能注释PeLBDs公司,包括PPI网络,Go和Kegg Encisment基于String数据库。这些结果提供了一种理论基础和候选基因,用于研究莫斯竹快速生长的分子育种机制。
背景
毛竹竹(Phyllostachys Edulis.)是来自亚家族班司(Poaceae)的非木材林业物种,原产于亚洲[1]. 它分布广泛,经济价值高,工业用途广泛,具有快速增长的特点,在水土保持和气候调节中发挥着重要作用[2]. 毛竹笋“爆裂生长”的能力已逐渐引起研究人员的注意,并推动了对这种快速生长的分子机制的研究[3.那4.]. 然而,毛竹笋快速生长的分子机制尚不清楚。
转录因子(TFS)调节控制许多重要的植物发育过程,例如细胞形态发生,信号转导和通过影响基因表达来响应的环境应激反应[5.]。其中,横向器官界限域(LBD公司)基因家族,也被称为AS2 / LOB.,一类仅在高等植物中发现的TF。首先通过插入增强子疏水阀鉴定它,并且在拟南芥初级侧向器官的近端轴的底部表达[6.那7.]. LBD-TFs包含从N端到C端排列的三个特定的保守结构域:锌指状C-block(C-block)、Gly-Ala-Ser block(GAS block)和亮氨酸状拉链模块(LX6LX3LX6L)。C区包含四个高度保守的半胱氨酸基序(CX2CX6CX3C),它们是结合DNA所必需的。气体块位于LoB结构域的中间,并含有不变的甘氨酸残基。亮氨酸样拉链模块,在C末端由大约30个氨基酸组成,参与蛋白质二聚[8.]. 根据LOB结构域的特点,以往的研究对LOB结构域进行了划分LBD公司基因家庭分为两类:I级和II级。I类蛋白质含有保守的CX2CX6CX3C锌指像图式图案和亮氨酸拉链模块。相比之下,II类蛋白质仅包含保守的锌指状结构域[6.那7.那9.]. 然而,最近的研究将I类进一步细分为五个亚类Ia–Ie,将II类进一步细分为两个亚类IIa和IIb[10那11]。另外,在保守的LOB结构结构域的亮氨酸状拉链模块之后立即发生变量C末端区域。该区域可以调节下游基因的表达,与核目标相关[12]. LOB结构域和可变C末端共同构成了基因的表达结构LBD公司基因[13]。
研究表明,LOB结构结构域不仅涉及早期横向器官发展的调节,而且还涉及额外的方法,例如组织再生和对应激和病原体侵染的反应[14那15那16]. 拟南芥的表达AtLOB公司/AtASL4公司首先在横向器官的近端轴的底部观察[6.]. Iwakawa等人发现AtLBD6公司(ATAS2)通过调节细胞生长抑制轴心区细胞增殖诺克斯基因,导致叶片近端轴对称地发展,形成涂抹叶。它还形成具有AS1和JAG的负反馈回路,以调节横向器官花序发育[7.那14那15]。TFS.区域F7和ARF19型用细胞分化过程表达并在下游行动LBD16.和LBD18参与拟南芥侧面根的形成[17]。atlbd15管理本人表达并参与顶端单位细胞分化[18]。atlbd38那atlbd39.,和atlbd40抑制花青素的生物合成,也影响氮的反应[19], 和奥斯陆BD37米中该基因的同源物也参与氮代谢[20]。AtLBD20型是第一个被鉴定出调控茉莉酸(jamonic acid,JA)信号通路的基因,它在植物对病原菌的反应中起着重要作用Fusarium oxysporum[21]. 最近的研究表明STLBD2-6在干旱胁迫下马铃薯茎中持续高表达,表明该基因可能与干旱期间的茎保护有关[11]。
最近释放莫斯竹子草案基因组和染色体水平参考基因组是实现竹基因家族的遗传操作的巨大潜力[22那23]。基于基因组测序技术的快速发展,在植物中报道了LBD TF基因的鉴定水稻[13],甘蓝型油菜[24],Gossypium raimondii.[25],葡萄[26],马铃薯[11],玉米[27], 和肺孢子虫[28]。LBD的特定分子功能已在模型植物拟南芥和水稻中验证。然而,LBD TFS尚未以摩托竹子在特征。因此,我们现在的工作旨在从最新的基因组数据库中识别莫斯诺竹的所有LBD家族成员,并提供综合分析蛋白质特征,进化关系,保守结构,重复模式,组织特异性以及射击快速生长表达趋势PeLBDs公司. 本研究结果为进一步研究毛竹LBD基因的功能和揭示其在毛竹笋快速生长中的分子机制提供了理论依据。
结果
识别LBD公司毛竹的基因
五十九个推定LBD公司使用植物LBD型LOB模型(PFAM PF03195)与竹蛋白数据库的HMMER3搜索获得候选基因E.- ≤10的值阈值− 20. 我们去除了多余的基因,并验证了保守域和基序的存在,最终得到55个LBD公司家庭成员(表1). 基因被重新命名PeLBD01型-PeLBD55型基于它们在染色体支架上的位置。
由55的蛋白质编码LBD公司基因包含95个(PeLBD13型)至493(PeLBD20型)氨基酸,其分子量(MWs)范围为10.25(PeLBD13型)至52.67 kda(PeLBD20型).大约80%的LBD蛋白质具有20-30kDa的Mws。他们预测的等电点(PI)范围为4.78(PeLBD55型)至9.44 (PeLBD25型). 不稳定性指数计算表明,51(95%)的LBD蛋白在体外是不稳定的。PELBD09.那PeLBD24型,和PELBD35.稳定性指数小于40并被分类为稳定蛋白质。脂族氨基酸指标表明,蛋白质的热稳定性范围为55.701至92.67,表明其热稳定性的差异相对较小。隆重性(肉汁)评分的盛大平均值为47(86%)的LBD蛋白,证明它们主要是亲水性的。细胞 - PLOC亚细胞定位预测表明,几乎所有LBD蛋白位于细胞核中(表1).
系统发育分析和保守序列对准
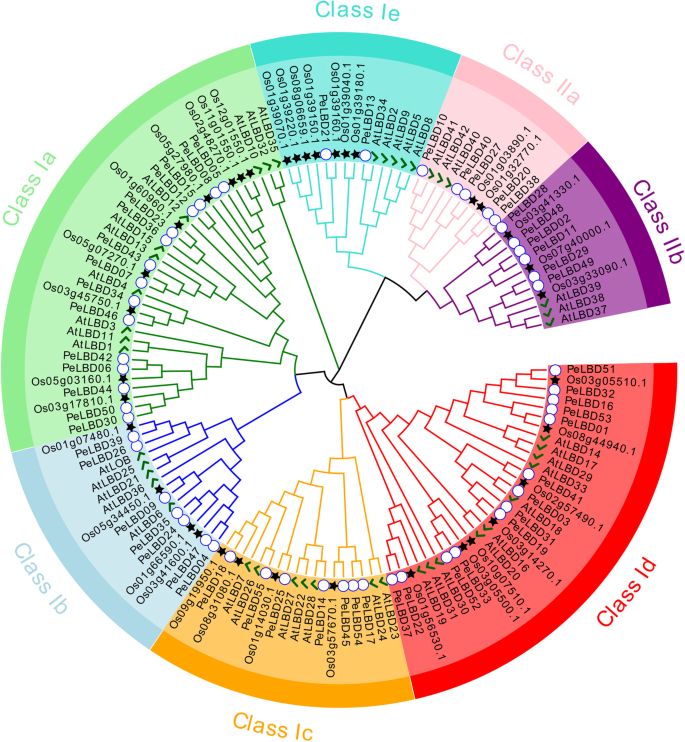
为了阐明毛竹PeLBD蛋白和其他物种LBD蛋白之间的进化关系,利用55个毛竹LBD、36个水稻LBD和43个拟南芥LBD的氨基酸序列构建了一个最大似然(ML)系统发育树(图。1). 基于成熟的拟南芥和水稻LBD科分类[13], LBD蛋白分为I类和II类两大类。I类有112个成员,分别为水稻(25.9%)、毛竹(39.3%)和拟南芥(34.8%)的29个、44个和39个。II类有24个成员,分别在水稻(25%)、毛竹(44%)和拟南芥(28%)中有6个、11个和7个。类I可细分为五个亚类(Ia-Ie),类II可细分为IIa和IIb。亚类Ia成员最多(34个),亚类IIa成员最少(10个)。每个种均包含各亚纲成员,表明单子叶植物和双子叶植物中均存在7个亚纲。系统发育关系表明,毛竹LBD蛋白与水稻的同源性高于与拟南芥的同源性。
的数量LBD公司毛竹(55)的基因与玉米(44)的基因相似,S块茎(43)和拟南芥(43),但与B那不勒斯(126)和苔藓(31)。与II类相比,I类在不同物种中有更多的成员(补充图。1).
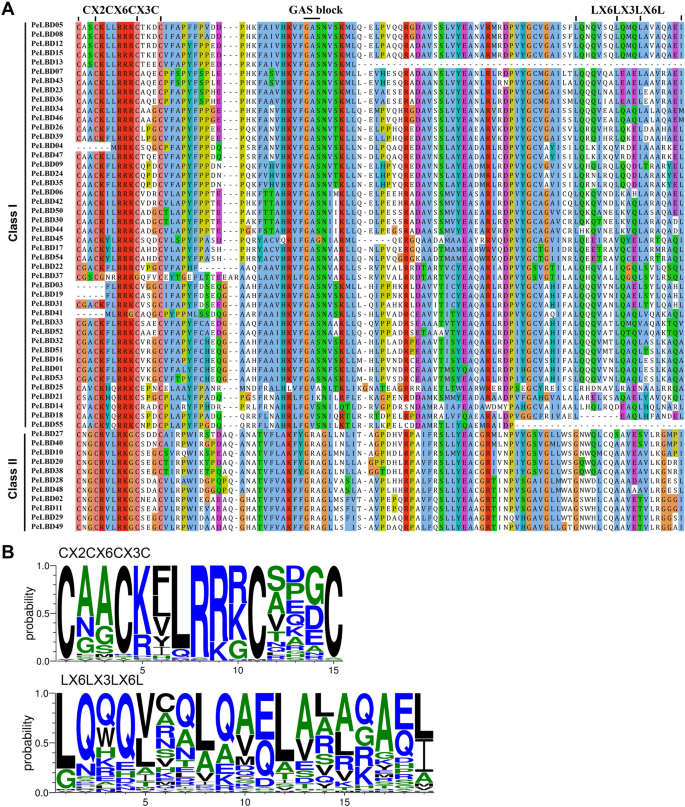
为55个PELBD蛋白产生多个序列比对,以研究保守蛋白质结构域的存在和位置。所有LBD家族成员含有高度保守的LOB区域,其N末端由大约100个氨基酸组成(图。2一种)。多种序列比较表明,所有LBD蛋白质含有锌指状结构域(图。2b) 是的。相比之下,亮氨酸ZIPPER样结构结构域仅存在于I类PELBD蛋白中,类似于其他植物物种的结果。
基因结构与基序组成分析
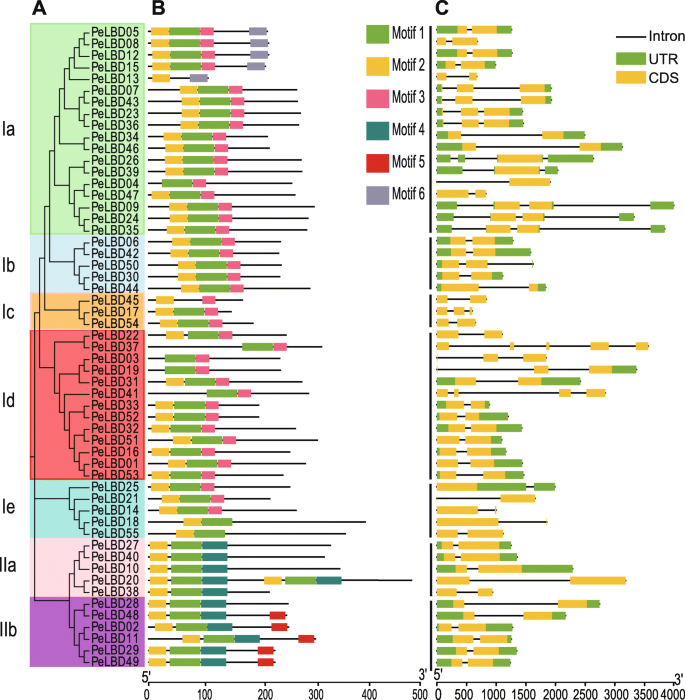
为了进一步研究MosoBable Pelbds之间的进化关系,我们仅使用全长PELBD蛋白序列构建了第二个系统发育树。该分析证实,I类分为五个子类,IA,IB,IC,ID,即18,5,3,13和5个成员。II级分为两个子类IIA和IIB,其中有5和6名成员(图。3.一种)。我们使用MEME鉴定了每个LBD蛋白中的六个高度保守的基序(图。3.B和补充图。2).几乎所有LBD包含了主题1和图案2,这些都构成了LOB域的最高级保守部分。在大多数序列中,图案的相对位置是相似的,除了PeLBD20型在亚类IIA中,有一个额外的主题1,2和4.有趣的是,只在特定的亚属中检测到一些基序。例如,图案6和图案5分别在子类IA和IIB中发现。
毛竹中内含子的数量LBD公司基因范围为一至四(图。3.c) 是的。约70%的基因含有1个内含子,9个基因含有2个内含子,5个基因含有3个内含子,1个基因含有4个内含子(PELBD37.).结构的结构LBD公司同一进化分支上的基因基本相似。
分析独联体-Elements佩尔布发起人
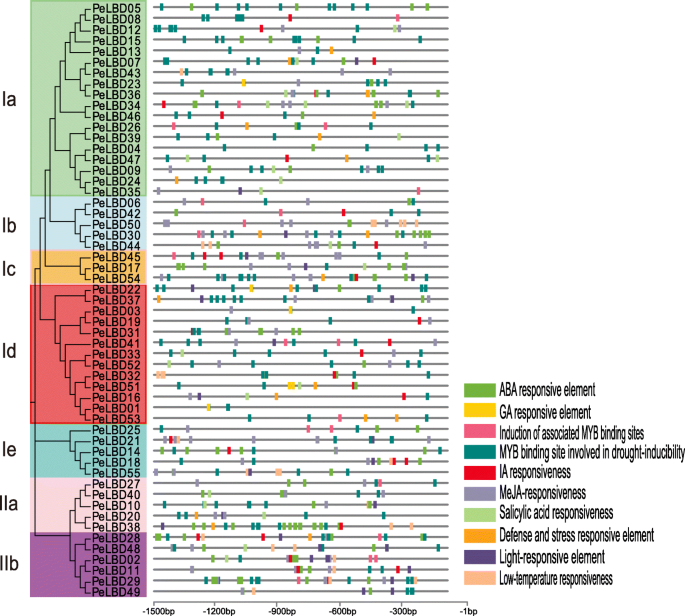
这独联体- 传递元素是基因启动子的非编码DNA序列,其调节其相关基因的转录。我们确定了十个重要独联体- 在摩梭竹子上游的元素1500 bp佩尔布使用PlantCare软件的基因(图。4.).众多独联体-中的元素佩尔布启动子与对激素的反应有关:脱落酸(ABRE),MejA(CGTCA-MOTIF),甘草酸(GaRE-MOTIF),水杨酸(TCA元素)和养肝剂(TGA元素)。一些启动子含有与压力相关的元素,特别是富含TC的重复,涉及防御和应力响应和低温响应(LTR)的元素。有趣的是,所有LBD公司促进剂含有涉及诱导干旱,高盐和低温响应的MyB结合位点。MYB是最丰富的元素(> 200)。此外,光响应元件(LRE)存在于28的启动子中佩尔布基因(图。4.和补充图。3.). 这些结果表明LBD公司毛竹的基因受顺式与植物发育过程和非生物胁迫耐受性相关的元素。
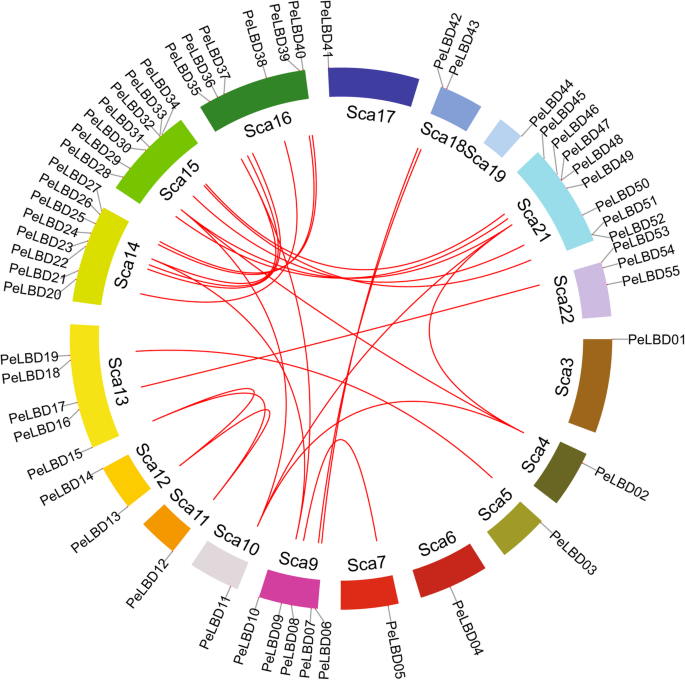
染色体定位与共线性分析
莫斯竹子佩尔布基因在毛竹的18个染色体支架上分布不均匀(图。5.). 支架数量最多的是14和21(8,14.54%),其次是15(7,12.72%),16(6,10.90%),9和13(5,9%),22(3,5.45%),12和18(2,3.63%)。所有其他染色体都含有一个佩尔布基因。基于基因簇的定义,在支架15和21上发现小基因簇。
基因复制事件在所有物种中普遍存在;它们可以产生新的功能基因并推动物种进化[29]。因此,我们使用McScanx基因组同步分析探索摩尔竹中的重复LBD公司基因家族(图。5.). 26个基因对似乎是由片段复制产生的,其中42个(76%)是由片段复制产生的佩尔布全基因组复制(WGDs)后基因被复制和保留。
进化分析佩尔布基因
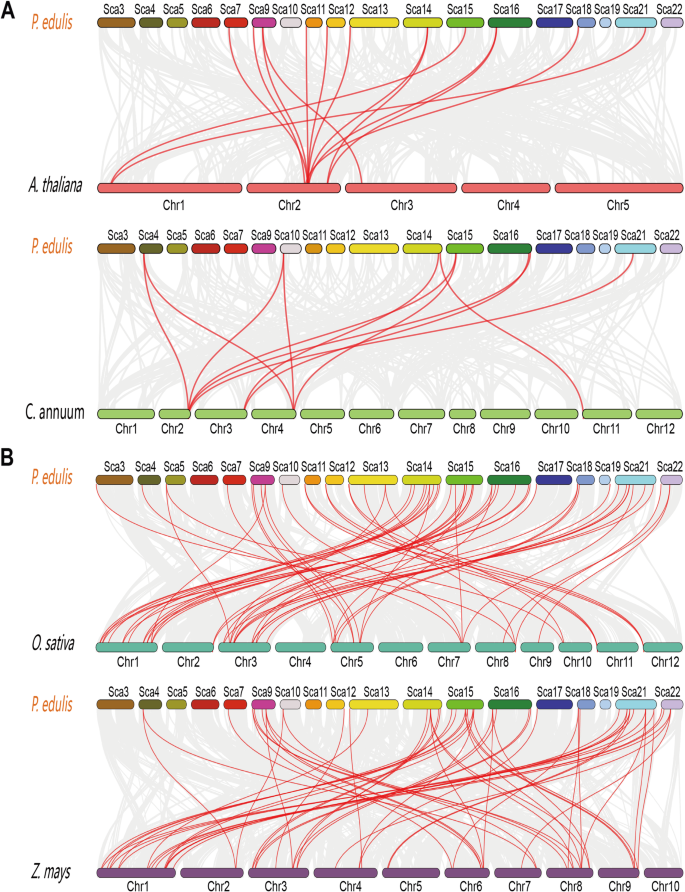
进一步调查基因重复LBD公司在基因家族中,我们对毛竹和四种代表性植物:两种双子叶植物(拟南芥和胡椒)进行了基因组间的同源性分析(图。6.a) 和两个单子叶植物(水稻和玉米)(图。6.b) 是的。14、11、58和60毛竹LBD公司基因分别与拟南芥,胡椒,米和玉米同步。因此,竹子和单子叶运动学之间的共同性大于竹子和单焦质基因组之间。此外,米饭LBD公司毛竹中的基因都有相应的同源序列,而且大多数基因都有两个以上的同源序列,说明毛竹在进化过程中经历了额外的WGD事件。
调查进化的限制和选择压力佩尔布计算了17个同源基因的Ka、Ks和Ka/Ks佩尔布基因对(补充表1). Ks代表背景碱基替换率,因此Ks值可用于预测全基因组复制(WGD)事件的时间。的Ks值佩尔布基因对的范围为0.0718~0.2392,表明一个大规模的佩尔布基因复制事件早在1840万年前(MYA),最近就是5.52 Mya。基因对的Ka / ks值均小于1.0,因此这些基因可能在进化期间经历了强烈的净化选择。
表达模式佩尔布在不同的组织中
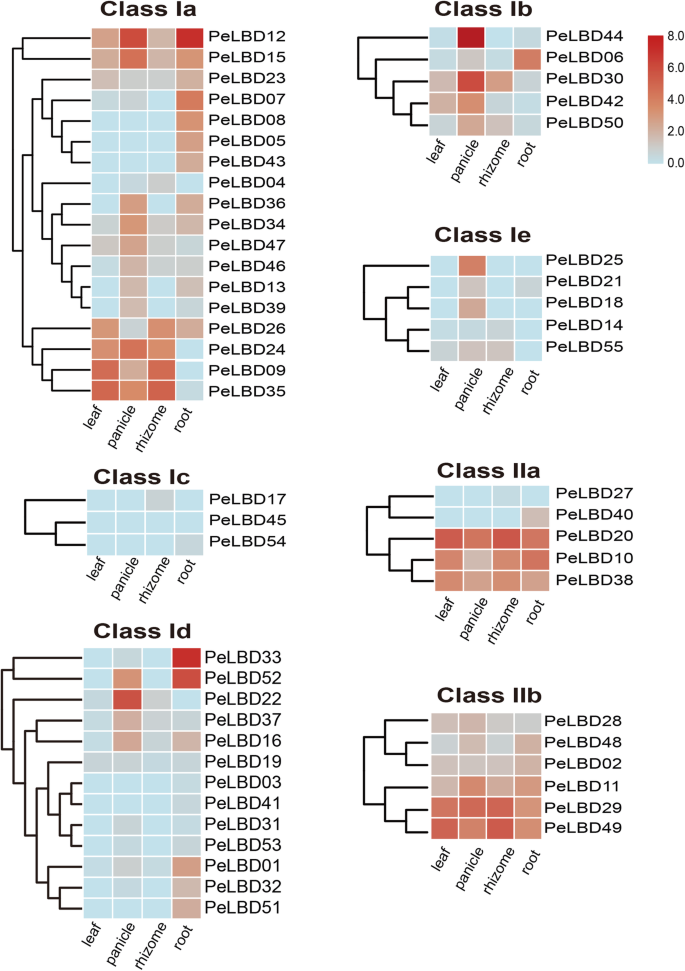
我们使用已发布的转录组数据来探索表达式模式佩尔布四种不同组织中的基因:根、根茎、圆锥花序和叶。基因表达计算为每千碱基百万转录本(TPM)。结果表明:55佩尔布基因在不同组织中有显著不同的表达模式(图。7.).15佩尔布基因在所有组织中都有可检测的表达,表明它们参与多种组织的发育或生理过程。四个基因(PeLBD12型那PELBD44那PELBD30,和PeLBD22型)在圆锥花序中有明显的高表达,说明它们可能参与了竹花的发育和功能。特别是,PeLBD12型和PELBD33在根(TPM> 100)中非常丰富。有趣的是,子类三种IC成员在任何组织中都不表达,暗示子类IC之间的潜在功能冗余佩尔布s。相比之下,亚类IIB的六个成员似乎在所有组织中表达,表明它们可能在组织生长中具有重要功能。总之,转录组测序分析结果证实了佩尔布在各种组织中显着表达基因。
log2(TPM)的表达热图 + 1) 55毛竹的价值佩尔布四种不同组织中的基因:根、根茎、圆锥花序和叶。根据系统发育结果(图。2a),LBD公司基因家族分为7个亚组:Ia-Ie类和IIa、IIb类。红色表示高表达,蓝色表示低表达
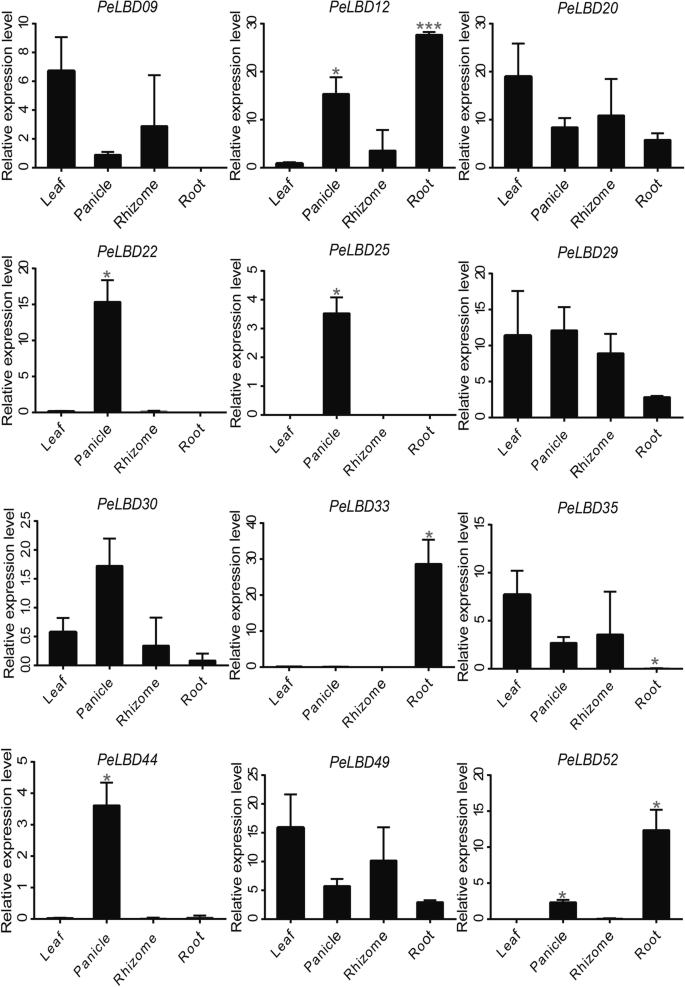
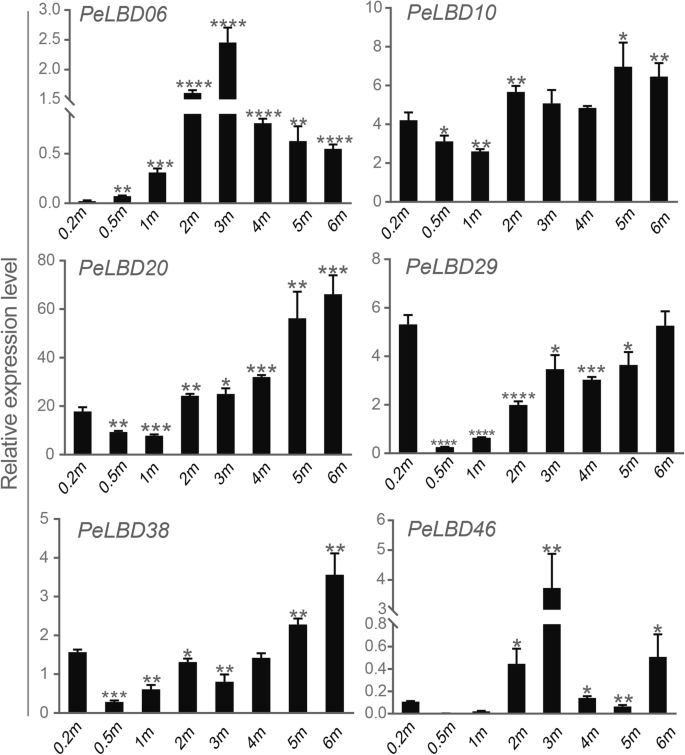
为了验证转录组数据的可靠性,我们还利用qRT-PCR进一步验证了12佩尔布四种组织中的基因:根,根茎,圆叶和叶子(图。8.).基因如PeLBD20型和PELBD29.在所有器官中表达,表明他们可能在增长过程中发挥一般作用。在相同的基因中,与其他组织相比,在根茎中适度地表达了LBD。然而,一些基因显示出组织特异性表达模式。例如,PeLBD22型那PELBD44那PeLBD25型,和PELBD29.在圆锥形中高度表达,和PELBD09.那PeLBD20型那PELBD49.,和PELBD35.在叶片中高表达。PeLBD20型和PELBD49.在根中的表达略低于在其它组织中的表达。尤其是,PELBD33仅在根中高表达,表明它可能是一个根特异性基因。总的来说,qRT-PCR结果支持转录组测序分析的结果。
鉴定竹笋快速发展的基因
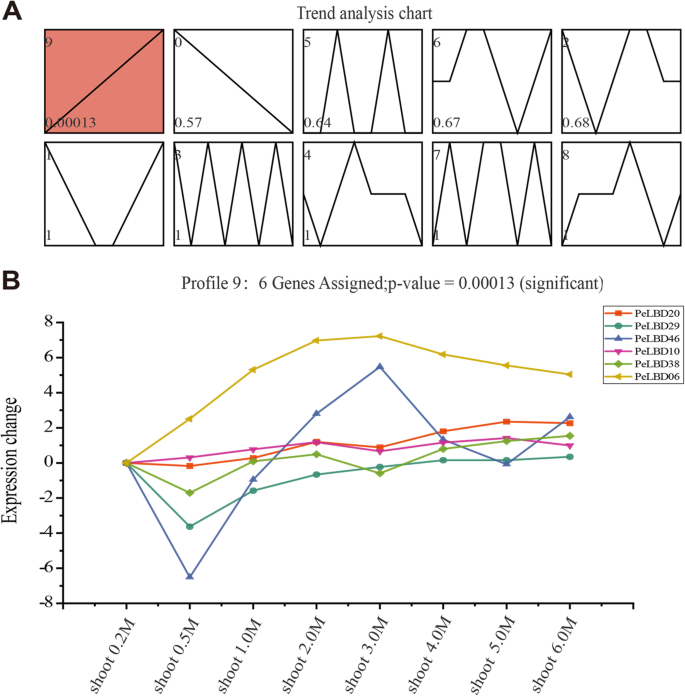
研究…的功能佩尔布基因在射击的快速发育途径中,我们进行了趋势分析LBD公司基因表达谱使用短时间系列表达矿工(Stew)软件基于在快速增长期间不同年龄/生长高度(0.2-6米)的表达数据的表达数据。鉴定了总共10个表达趋势(图。9.一种)。显着富集的趋势(简介9)显示出与拍摄发展的正相关,表明该型材中的基因在芽生长期间逐渐上调。六个基因(PeLBD20型那PELBD29.那PELBD46.那PeLBD10型那PELBD38,和PeLBD06型)它们的表达在新梢发育过程中普遍上调(即,随着生长高度的增加而增加)(图。9.b) 是的。
为了进一步验证茎分析的结果,我们进一步对六个基因进行了QRT-PCR(见上文),其表达在竹笋的快速生长和发育过程中表达显着增加(图。10). 除了PELBD46.这些基因的表达量随着地上部发育阶段的延长而普遍增加,但在增加的幅度和时间上存在差异。PeLBD06型表达显著增加,在3个月达到高峰 m嫩枝;PELBD29.以0.2的表达量最高 但当枝条高度从0.5增加到6时,又缓慢上升 M随着竹笋生长后期木质化程度的增加,竹笋木质素的表达量逐渐增加PeLBD20型和PELBD38与其他4种基因相比,与茎的快速发育呈正相关。总的来说,qRT-PCR结果支持STEM时间聚类分析的结果,这表明这些佩尔布基因可能在竹笋的快速增长,发展和瘫痪中发挥重要作用。
PPI网络的构建及GO富集分析
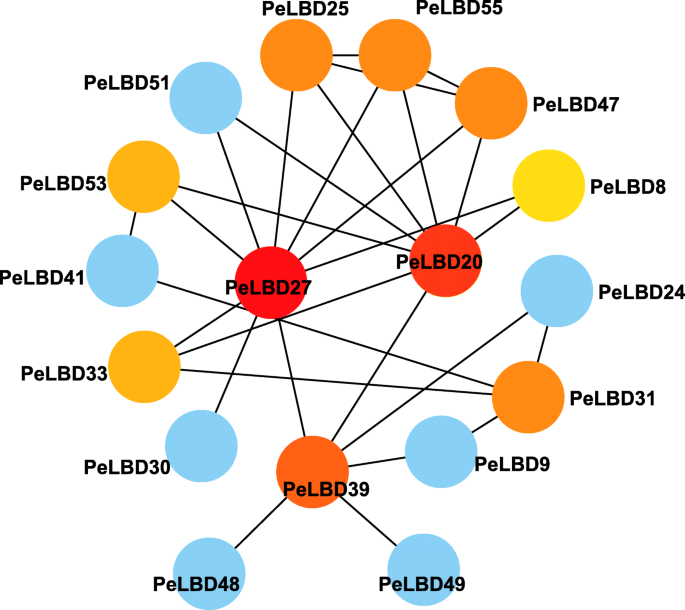
我们使用字符串数据库来预测PeLBD蛋白质之间的潜在相互作用(图。11). PeLBD蛋白相互作用网络中有17个节点,每个节点与其他节点相互作用。一些蛋白质表现出直接的相互作用,例如PELBD49.和PELBD39.,而另一些则表现出更复杂的多基因相互作用,比如PeLBD25型那PeLBD55型,和PELBD47。尤其,PeLBD20型和PeLBD27型预计将是中央节点,分别辐射八个和九个连接到其他基因。
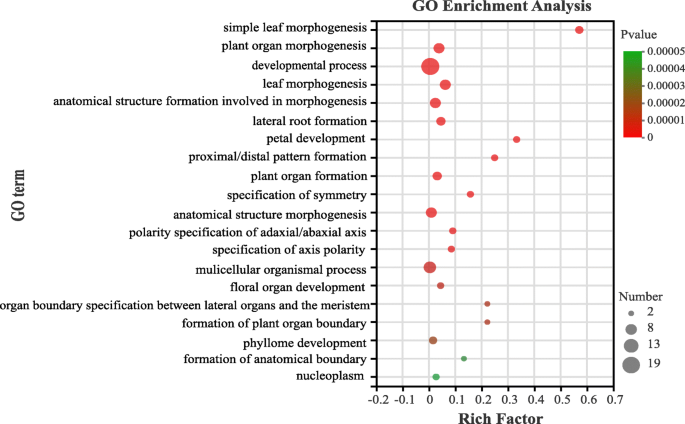
为了预测其生物学功能,我们进行了55种PELBD蛋白的注释和富集分析。前20个GO术语如图2所示。12。对于叶片形态发生的过程,观察到最强烈的富集和最高的富集因子(0.58),其次是花瓣发育过程(0.33)。此外,最大数量的基因(19)与流动“发育过程”有关。
PeLBD靶基因的鉴定与注释
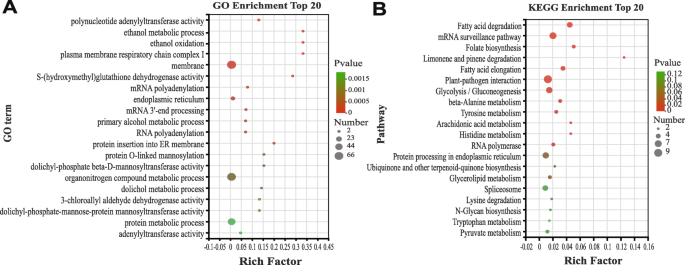
为了识别由竹磅调节的潜在下游靶基因,并确定其功能,来自Jaspar数据库的互联网基序(补充图。4.),搜索毛竹蛋白编码基因上游2.0 kb启动子序列。共鉴定248个目的基因用于进一步注释,分为3大类32个亚类。248个基因中有89个得到GO注释,107个被定位到KEGG数据库。GO分析结果显示,细胞部分(GO:0044464)、代谢过程(GO:0008152)和催化活性(GO:0003824)被分配到多个靶基因上(补充图)。5.).在富含靶基因组的前20种GO期间是乙醇代谢过程(GO:0006067),细胞膜分数(GO:0016020),有机腈复合代谢过程(GO:1901564),以及其他显着丰富的术语(P. < 0.05) (Fig.13一种)。同样,在Kegg分析中,将最大数量的靶基因(112)分配给碳水化合物代谢途径(补充图。6.). 在富含目标基因的前20个KEGG途径中,包括脂肪酸降解(Ko00071)、植物-病原相互作用(Ko04326)、叶酸生物合成(Ko00790)和mRNA监控途径(Ko03015)。这些结果表明PELBD可以通过调节靶基因影响多种途径(图。13b) 是的。
讨论
目前,毛竹染色体水平的参考基因组能够对重要基因家族进行全面的鉴定[22那23]. 在这里,我们确定了55佩尔布来自莫斯竹子的基因,分为两类,I类(44,80%)和II类(11,20%)(图。3.a) 是的。这两个类被进一步划分为不同的子类。以前的研究发现LBD公司拟南芥的基因和马铃薯的88%属于课程[11那13](补充图。1).我们的结果提供了进一步的证据表明我的数量LBD公司成员基本上高于不同物种II级成员的成员。一百三十四LBD公司来自几种物种的基因进一步分为七个亚类(IA-IE和IIA-IIB),并且它们的系统发育关系通常与先前研究报告的那些相一致[30那31](图。1). 许多同源的佩尔布基因对的表达水平相似(图。7.),建议重复LBD公司Moso Bamboo的基因可能主要导致功能冗余。
基因结构分析表明,同一亚类内的一些成员存在结构差异。例如,内含子的数量佩尔布来自亚类Ia的基因从1到3中变化。我们推测亚类Ia的成员可能在进化期间经历或插入基因片段[32那33]。然而,类似的保守序列和基因结构LBD公司亚类表明一个亚类中的基因通常具有相似的生物学功能。此外,对LOB保守结构域的比较表明,除LOB外,所有Ⅰ类基因中均检测到完整的亮氨酸样拉链基序PeLBD13型那PELBD18.,和PeLBD55型暗示在演变期间,LBD系列中的主题在广泛保守。
多个顺式位于基因启动子中的作用元件在信号传导中起着关键作用,它们之间的协同作用可以调控复杂的生物过程。AtLBD16型和AtLBD29型据报道曾涉及生长激素应答和侧根形成[34那35]。AtLBD20型(AtASL21)茉莉酸信号途径在植物抗病中的作用[21]. 我们发现LBD公司启动子包含许多与激素调节途径相关的基序,包括脱落酸、MeJA和IAA基序。因此,我们得出结论佩尔布基因也可能参与植物应激反应。有趣的是,所有佩尔布基因启动子具有参与干旱诱导性的MYB元素,MYB元素是最常见的独联体-检测到的元件(补充图。3.).以前有几次关于响应的研究LBD公司对非生物压力的基因,但近期在马铃薯的工作证实表达水平STLBD1-5和STLBD2-6在干旱胁迫下分别在干旱胁迫下进行下调和上调,以维持正常的生理功能[11]。此外,马铃薯的成员LBD公司家族还包含许多MYB元素。部分MYB基因已在拟南芥、小麦和水稻中进行了转基因,证实过表达MYB基因可以提高转基因植株的抗旱性[36那37那38]。总的来说,我们建议竹子LBD公司S可能在对非生物胁迫的反应中发挥重要作用,特别是干旱。尽管如此,不同的表达式模式LBD公司通过进一步的分子生物学实验仍然验证基因。
基因复制通过促进新基因的产生和基因功能在进化中起着重要作用。基因复制有三种主要的进化模式[39]:节段重复、串联重复和易位事件。片段和串联复制通常是植物基因家族扩展的基础[39那40]。莫斯伯含有55LBD公司比拟南芥多12个基因,是拟南芥的1.27、1.52、1.25、1.27和0.80倍LBD公司基因如拟南芥(43),水稻(36),玉米(44),马铃薯(43),和G. Raimondii.(68)分别。虽然Moso Bamboo(2051.7 MB)的基因组大小类似于其亲密相对,玉米(2066.4 MB),但数量LBD公司Moso Bamboo的基因显着高,与莫斯竹中的WGD报告一致[22那41]。因此,我们进行了内部和基因间的基因组共同分析LBD公司S毛竹基因组有28对重复序列LBD公司基因,包括26个分段重复的对和2串联重复对和节段性重复统治占据扩展LBD公司毛竹的基因家族。类似地,先前的一项研究也报道了131人中只有3个串联重复事件 G. Hirsutum LBD.基因[25]。用四种其他测序植物基因组的莫斯竹基因组的同时性分析表明,存在显着的共同性LBD公司竹子和单子叶植物之间的家庭成员玉米和水稻。只有几个LBD公司成员在竹子和乌龟拟南芥和胡椒之间的共线。该结果与Dicot和单子植物之间的进化关系一致。
虽然已显示LBD基因是一系列转录监管网络的下游基因。然而,迄今为止,在TF LBD基因上对下游靶基因的调节进行了很少的研究,该基因在细胞消除剂E2FA过程中诱导转录,这增强了愈合组织的形成[42]. 在拟南芥中,LOB/AS2通过抑制KNAT2和KNAT6的表达,将茎尖分化为叶原基形成叶片[14那43]。鉴定的靶基因的致富集结果表明,通过调节其靶基因,佩贝德可能会影响多种调节途径。在前20个GO期间,两个目标基因,PH0250093型和ph02gene50387.,不仅显着富含S-(羟甲基)谷胱甘肽脱氢酶活性的分子函数,还涉及生物方法如乙醇代谢(补充表2).此外,显着富集是几种靶基因,如电话:0221014那电话:0243347和电话:0243347与膜的组成有关。这些结果表明PeLBDs调控的靶基因可以通过多种途径发挥作用。
几项研究表明,LBDS调节横向器官发育,对花,茎,叶和根部形成期间对植物器官具有重要影响[14那44那45],与富集分析研究的结果一致。洛博德中十大富含20位富集的GO条款的一半以上与植物器官开发和形成有关,其中涉及花瓣发育和叶子的形态发生功能是最重要的。LBD公司在不同的竹组织中分析基因表达曲线,许多佩尔布S在特定组织中显示出相对高的表达水平(图。7.).例如,PeLBD12型和PELBD33在根中高表达,其功能可能与AS2公司,直接参与茎尖的共同组织的分化为水稻叶原金,是密切相关的物种。一些佩尔布在测试的所有组织中最小地表达基因,表明它们可以在其他组织中或其他发育阶段起作用。有趣的是,我们发现两个基因(PeLBD20型和PELBD29.)不仅在四种组织器官中表达了高度表达,而且在0.2-6米射击中检测到始终升高的表达趋势(图。10). 这个结果表明PeLBD20型和PELBD29.对竹子的快速发展起着重要的作用。采用qRT-PCR方法进一步验证12佩尔布在根、根茎、圆锥花序和叶中表达不同水平的基因。其中,我们确认了一个叶特异性基因,PELBD33和一个花特异基因,PeLBD25型。总的来说,QRT-PCR结果仅略微不同于转录组测序分析的分析,也许是由于实验条件的变化。根据这些结果,我们推测了这一点佩尔布基因在竹子组织发育中起着关键作用。
早期研究LBD公司基因家族主要研究这些基因在植物侧器官发育中的生物学作用。例如,AtLOB公司/AtASL4公司首先显示在侧外器官的近端轴的底部和拟南芥中侧根的底部特异性地表达[6.]. LBD基因家族与多种TFs共同形成多个分子调控网络,对植物对环境胁迫的响应、生长发育和其他生理过程的调控具有重要意义[46]. 在生长激素信号刺激愈合组织细胞后,赖氨酸甲基转移酶(ATXR2)促进细胞进入去分化阶段。随后,TFs ARF7和ARF19招募ATXR2,ATXR2又与LBD基因的启动子结合以诱导基因的表达LBD16.那LBD17.那LBD18和LBD29在细胞去分化过程中。LBD基因然后调节E2Fa,一种在细胞去分化中重要的TF,从而促进愈合组织的形成[42]. 在本研究中,我们重点研究了佩尔布竹笋快速生长过程中的基因。我们使用基因转录组数据进行时间聚类分析,并确定了六个基因(PeLBD20型那PELBD29.那PELBD46.那PeLBD10型那PELBD38,和PeLBD06型)其表达与竹笋的快速生长和发展强烈呈正常相关。通过QRT-PCR验证这六个基因的表达水平(图。10).随着竹笋的瘫痪在增长期间增加,他们的表情趋于增加,PeLBD20型和PELBD38表现出最显著的正相关关系。推测它们在毛竹快速生长期起着重要的生物学作用。这些结果不仅有力地说明了LBD公司在竹笋快速生长过程中的跛足过程中,还提供了潜在的候选基因,以便将来的竹生长和发展研究。
结论
这是毛竹中LBD-TFs的首次系统鉴定和分析。共鉴定出55个PeLBD基因,可分为2类7个亚类。每个亚类都有相似的基因结构和序列,说明LBD基因在进化过程中是保守的。进化分析表明,与WGD事件相关的片段复制是Mauve-LBD基因家族大部分扩展的原因。基于STEM软件和RNA-seq数据,揭示了PeLBD基因表达的组织特异性和时间特异性,并得到了定量分析和功能富集的支持。六个基因(佩尔BD6/10/20/29/38/46)展示拍摄发展的持续上升趋势,这意味着这些基因对于莫斯竹的快速发展至关重要。本研究为莫斯竹LBD TF家族基因的功能进行了深入研究的良好数据库,并提供了新的见解,探讨了莫斯竹中快速增长的分子机制。
方法
摩尔竹子蛋白质蛋白质的鉴定及序列分析
毛竹基因组数据下载自P教育基因组数据库(ftp://parrot.genomics.cn/gigadb/pub/10.5524/100001_101000/100498/). 从Pfam数据库中获得了侧器官边界域的隐马尔可夫模型(DUF260,PF03195)(http://pfam.xfam.org/)并用作HMMER3搜索的种子模型(http://hmmer.janelia.org/)当地竹子蛋白质数据库的建立(E. ≤ 10− 20) [47]去除多余的基因,得到一组LBD候选序列。为了验证这些候选者是lbd,我们使用了SMART(http://smart.embl-heidelberg.de/) [48]和pfam [49“要过滤缺掉完整LOB域的序列的数据库。确认LBD公司基因根据它们的摩梭竹染色体上的位置重命名。
使用Cell-Ploc 2.0产生亚细胞定位预测(http://www.csbio.sjtu.edu.cn/bioinf/cell-ploc-2/) [50],以及ExPASy ProtParam工具(https://web.expasy.org/protparam/) [51]预测蛋白质的分子量(MW)、等电点(PI)和总平均亲水性(GRAVY)等理化参数。
序列对准和系统发育树施工
拟南芥和水稻的全基因组信息从TAIR10数据库(http://www.arabidopesis.org/index.jsp.jsp.)和水稻基因组注释项目数据库(http://rice.plantbiology.msu.edu.), 分别。从Ensembl数据库下载玉米和辣椒基因组数据(http://asia.ensembl.org/index.html).
通过HMMER3检索相应的蛋白质数据库,鉴定出43个拟南芥LBD蛋白和36个水稻LBD蛋白[47]。拟南芥和水稻LBD序列与来自莫斯竹子的序列合并,并用肌肉产生多种蛋白质序列取向[52]. 由此产生的比对被用于构建MEGA 7.0中具有1000个引导复制的最大似然(ML)系统发育树[53]。还使用来自竹子的LBD蛋白质序列构建内部化学发育树。比较和使用JALVIEW软件进行比较和编辑保守域的氨基酸序列(http://www.jalview.org/) [54]使用WebLogo程序生成保守的主题徽标(http://weblogo.threeplusone.com.) [55]。
基因结构,基序组合物和启动子元素分析
毛竹的内含子-外显子分布LBD公司使用来自摩梭竹基因组的GFF注释文件获得基因。使用在线MEMEN工具分析LBD蛋白的保守氨基酸序列(http://meme-suite.org/) [56]。MEME分析参数包括最小宽度≥6,最大宽度为50,主题数为6;所有其他参数都设置为默认值。Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)用于识别独联体-在每个基因转录起始位点上游1500 bp启动子区域的作用元件,并使用TBtools(v1.0697)可视化结果[57]。
同线性分析与Ka/Ks比值
MOSO竹蛋白序列彼此相互排列或使用TBTOOLS软件彼此互拟拟南芥,米,玉米或胡椒蛋白序列对齐。McScanx [58]结果在TBtools中用Circos和双同线性图显示[59]。
对于Ka/Ks分析,BLASTn使用两个标准鉴定了17个同源基因对:(1)> 75%的序列相似性和(2)可对齐区域> 长序列长度的75%[60.]。KAKS_CALCULATOR2.0用于计算同源基因对之间的同义替代率(KS),非同义词替代率(KA)和KA / KS比率[61.]. 竹子内部的进化分化时代LBD公司使用竹子特异性发散时间公式T = Ks /2λ来计算基因系列(其中λ= 6.5×10− 9).
基因转录谱佩尔布基于RNA-SEQ数据
在最近的一项研究中,我们获得了24个原始转录组数据集(加入号码GSM2810849:SRR6171235-SRR6171258)从基因表达式omnibus(Geo)数据库(http://www.ncbi.nlm.nih.gov/geo.).包括八个快速增长的发育节点的组织样品(位于0.2,0.5,1,2,3,4,5和6米的幼苗上),每个发育节点三个生物学复制。此外,从欧洲核苷酸存档下载来自不同植物组织(根,根茎,圆锥)的转录组数据(https://www.ebi.ac.uk/ena/browser/home.)(注册号ERR105067–ERR105076)。不同组织的转录组数据以对数形式表达2(TPM + 1)并使用R中的函数pheatmap包可视化(https://cran.r-project.org/web/packages/pheatmap/index.html).
STEM版本1.3.11[62.用来分析和可视化趋势佩尔布基因表达在快速拍摄生长过程中,茎聚类方法,最多20个模型配置文件,以及设置为其默认值的所有其他参数[63.]。
植物材料、RNA提取和qRT–PCR分析
采用qRT-PCR分析验证表达佩尔布不同组织和器官(根,根茎,胰岛和叶)的基因,以及竹笋快速发展过程中的表达和潜在的调节作用。从与根茎联合的部分取出不同高度(0.2μm,0.5μm,1m,2m,3m,4m,5 m,6 m)的竹笋,并且将地下部分取下0.2 m as the base point.
从竹园生长的竹植物,桂林市生长的竹植物,获得竹质根茎,花序,幼叶,根和芽的组织样品,从竹园生长的竹植物获得,广西,中国。海拔155米的研究区,平均年度温度为19.0°C |66.3°F,平均年降雨量为2174 mm |85.6 In ..该领域收集的所有材料都不需要道德批准和许可证。获得每种组织类型的三种生物学重复。收获后,将组织样品立即置于液氮中并储存在-80℃直至RNA提取。
使用固体植物总RNA分离试剂盒(南京Vazyme Biotech,China,RC401)从每个样品中提取总RNA,并将逆转录的cDNA产物储存在-20℃下进行备用。在用作模板之前,CDNA在五折中稀释。使用信标设计器7设计QRT-PCR的引物(补充表1).QRT-PCR反应系统(最终体积20μL)含有10μL2×Chamq通用SYBR QPCR主混合物,0.4μL10μm正向引物,0.4μL10μm反向引物,2μL模板cDNA和7.2μLDDH2O。反应程序为95 30°C S95 °C持续10分钟 s和60 30°C S和40 95周 °C持续15分钟 s、 60个 60°C时 s、 和95 °C持续15分钟 S每个样本有三个技术复制品。平霉素(ph02gene08372.)被用作内部参考基因。使用Bio-rad Icycler IQ实时定量PCR仪器(CFX96,USA)进行扩增,并且使用2计算每个基因的相对表达水平-ΔΔct方法。所有统计分析均使用GraphPad Prism 7软件进行。配对组间比较采用Student t检验。
蛋白-蛋白相互作用(PPI)网络构建及氧化石墨烯富集分析
将LBD蛋白序列上载到串数据库(https://string-db.org/)对于节点比较,基于水稻蛋白质相互作用预测重要蛋白质之间的关系。Cytoscape(v3.7.1)用于可视化所得到的网络[64.]。
山山(http://github.com/tanghaibao/GOatools) [65.]将基因本体论(GO)注释分配给LBDs,Fisher精确检验用于确定PeLBDs相对于完整GO数据库丰富的生物学功能。一种错误发现率(FDR)多重测试校正方法[66.]被用来减少假阳性,并且当其fdr校正时,功能被认为显著丰富P.-值(Padjust) < 0.05。
LBD靶基因的鉴定和注释
为了获得可能受LBDs调控的下游靶基因列表,我们使用TBtools(v1.0697)[59]提取摩梭竹基因的2000-BP启动子序列。LBD DNA结合位点(MA1673.1)的共识基因是从JASPA_CORE数据库获得的(http://jaspar.genereg.net.)真核TF结合谱[67.]。MEME套件中的主题FIMO程序(5.3.0)(http://meme-suite.org/) [56]用于检测毛竹启动子集合中的LBD结合基序。最终的候选目的基因根据筛选标准P. < 1 × e− 6.。使用基因和基因组(KEGG)数据库的GO和Kyoto百科全书在功能上注释候选LBD靶基因。使用MajorBio在线平台进行分析和可视化(https://cloud.majorbio.com.).
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。本研究期间使用的原始测序数据已沉积在NCBI(http://www.ncbi.nlm.nih.gov/geo.)和欧洲核苷酸存档(https://www.ebi.ac.uk/ena/browser/home.)在加入号码GSM2810849:SRR6171235-SRR6171258和ERR105067-ERR105076分别。对图书馆的公共访问完全打开。
缩写
- MCScanX:
-
多个共线扫描工具包
- 灵魂:
-
非同义词
- ks:
-
同义词
- TPM:
-
每千碱基百万份成绩单
- WGDS:
-
全基因组复制
- 阀杆:
-
短时间系列表达矿工
- Kegg:
-
基因和基因组数据库的京都百科全书
工具书类
- 1。
Biswas P,Chakraborty S,Dutta S,PAL A,Dasl M.竹开花从比较基因组学和转录组织的角度来看。前植物SCI。2016; 7。https://doi.org/10.3389/fpls.2016.01900。
- 2.
罗摩克里希南M、Yrjl K、Vinod KK、Sharma A、Zhou M。毛竹(Phyllostachys edulis)的遗传学和基因组学:现状、未来挑战和可持续竹产业的生物技术机遇。粮食和能源安全。2020;9(4).https://doi.org/10.1002/FES3.229。
- 3.
魏Q,娇c,丁y,gao s,gu l,chen m等。缓慢生长变异的细胞和分子表征提供了竹子快速生长的见解。树生理。2018; 38(4):641-54。https://doi.org/10.1093/treephys/tpx129。
- 4.
Singh SR,Singh R,Kalia S,Dalal S,Dhawan AK,Kalia RK。生物技术工具在竹 - 一种具有非凡品质的植物改进中的应用的限制,进展与展望。physiolmol biol植物。2013; 19(1):21-41。https://doi.org/10.1007/S1147-1.。
- 5.
Latchman DS。介绍概述 - 转录因子:概述。int J生物摄影细胞Biol。1997年; 29(12):1305-1312(1308)。https://doi.org/10.1016/s1357 - 2725 (97) 00085 - x。
- 6。
帅。横向器官界限基因定义了一种新颖的植物特异性基因家族。植物理性。2002; 129(2):747-61。
- 7。
Hidekazu I,Yoshihisa U,Endang S,Hitoshi O,Shoko K,Hirokazu T,等。形成对称扁平叶片薄膜所需的拟南芥的不对称叶片2基因编码了一种以半胱氨酸重复和亮氨酸拉链为特征的新型蛋白质家族的成员。植物细胞生理。2002; 5:467。
- 8。
Majer C,Hochsheger F.定义边界:LOB域蛋白的结构和功能。趋势植物SCI。2011; 16(1):47-52。https://doi.org/10.1016/j.tplants.2010.09.009。
- 9。
Landschulz wh,johnson pf,mcknight sl。亮氨酸拉链:一类新的DNA结合蛋白共同的假设结构。科学。1988; 240(4860):1759-64。
- 10。
Chanderbali AS,He F,Soltis PS,Soltis DE.《走出水:LBD基因家族的起源和多样化》。分子生物学。2015;32(8):1996–2000.https://doi.org/10.1093/molbev/msv080。
- 11.
刘虎,曹米,陈X,叶m,赵p,南y,李文,张c,孔l,kong n等。Solanum Tuberosum中的外侧器官域域(LBD)基因家族的基因组分析。int j mol sci。2019; 20(21):5360。
- 12
关键词:拟南芥,lees2 - like18 /LATERAL ORGAN BOUNDARIES DOMAIN16 (ASL18/LBD16),核定位信号植物生理学杂志。2012;169(12):1221-6https://doi.org/10.1016/j.jplph.2012.04.004。
- 13
杨Y,Yu X,Wu P.两种稻米横向器官界域基因家族的比较及演化分析及其拟南芥的进化表征。mol文学进化。2006; 39(1):248-62。https://doi.org/10.1016/j.ympev.2005.09.016。
- 14
拟南芥(Arabidopsis thaliana)的不对称LEAVES2基因调控对称叶片的形成、脉序的建立和分生组织相关同源异型盒基因的抑制。发展。2001;128(10):1771 - 83。https://doi.org/10.1242/dev.128.10.1771。
- 15
Iwakawa H,Iwasaki M,Kojima S,Ueno Y,Soma T,Tanaka H,Semiarti E,Machida Y,Machida C. Arabidopsis的Adaxial结构域中的不对称叶片2基因的表达留下了该领域的细胞增殖,对其至关重要正确扩展叶片的发展。工厂J. 2007; 51(2):173-184。
- 16
Goh T,Toyokura K,Yamaguchi N,Okamoto Y,Uehara T,Kaneko S等人。侧根引发需要在拟南芥中的转录因子LBD16和Puchi的顺序诱导。新植物。2019; 224(2):749-60。https://doi.org/10.1111/3ph.16065。
- 17。
Lee HW,Cho C,Pandey SK,Park Y,Kim M-J,Kim J.SLBD16和LBD18作用在ARF7和ARF19下游的作用涉及拟南芥的不定根形成。BMC植物BIOL。2019; 19(1):46。https://doi.org/10.1186/s12870-019-1659-4。
- 18。
Sun X,Feng Z,Meng L,朱家,Geitmann A. Arabidopsis Asl11 / LBD11参与拍摄顶端公司发育并调节WUS表达。Planta。2013; 237(5):1367-78。https://doi.org/10.1007/S00425-013-1844-013-1844- x。
- 19。
Rubin G,Tohge T,Matsuda F,Saito K,Cheible WR。LBD系列转录因子的成员抑制了花青素的合成,并影响拟南芥中的额外氮反应。植物细胞。2009; 21(11):3567-84。https://doi.org/10.1105/tpc.109.067041。
- 20.
Albinsky D,Kusano M,Higuchi M,Hayashi N,Kobayashi M,Fukushima A,Mori M,Ichikawa T,Matsui K,Kuroda H等人。适用于水稻狐狸拟南芥系的代谢物筛查导致鉴定改变基因变化的氮代谢。莫尔植物。2010; 3(1):125-42。
- 21
撒切尔LF,Powell JJ,Aitken Eab,Kazan K,Lander JM。横向器官边界结构域转录因子LBD20在拟南芥中的枯萎病变和茉莉酮类信号中的作用。植物理性。2012; 160(1):407-18。https://doi.org/10.1104/pp.112.199067。
- 22
Peng Z,Lu Y,Li L,Zhao Q,Feng Q,Gao Z等。快速生长的非木材森林物种Moso Bamboo(Phyllostachys杂环)的基因组草案。NAT Genet。2013; 45(4):456-61。https://doi.org/10.1038/ng.2569。
- 23
赵H,高Z,王L,王J,Wang S,Fei B,Chen C,Shi C,Liu X,Zhang H等。摩擦竹子的染色体级参考基因组和替代拼接图谱(Phyllostachys Edulis.). Gigascience公司。2018;7(10):giy115。
- 24
谢T,Zeng L,Chen X,Rong H,Wu J,Batley J,Jiang J,Wang Y.横向器官界域基因系列的基因组分析甘蓝型油菜。基因。2020; 11(3):280。
- 25。
Yu J,谢Q,Li C,Dong Y,朱S,Chen J.Scolyium综合表征和基因表达模式。Planta。2020; 251(4):81。
- 26。
曹浩,刘春英,刘传祥,赵云龙,徐荣荣。葡萄侧器官边界结构域基因家族的全基因组分析。J麝猫。2016;95(3):515 - 26所示。https://doi.org/10.1007/s12041-016-0660-z。
- 27。
张Y-Z,Zheng C-C。ZEA中侧腔界域域基因家族的基因组分析。J Genet。2014; 93(1):79-91。https://doi.org/10.1007/S12041-014-0342-7。
- 28。
黄X,闫H,刘y,易y。基因组 - 范围横向器官界限域 - 在Physcomitrella含量的水平和压力反应。基因基因组学。2020; 42(6):651-62。https://doi.org/10.1007/S13258-020-00931-X.。
- 29。
林奇M,Conery JS。作用的进化命运和二份基因的后果。科学。2000; 290(5494):1151-5。
- 30
宋B,唐Z,李X,李继,张M,Zhao K,Liu H,张S,Zhang S,Wu J.中国白梨(Pyrus Bretschneideri)中侧琴界域(LBD)基因的挖掘和演化分析。BMC基因组学。2020; 21(1):644。
- 31
郭斌,王家,林某,天泽,徐瑞格。大麦(Hordeum Vulgare L.)的非对称叶片2 /侧面器官界(AS2 / LOB)基因家族的基因组宽分析。J Zhejiang Univ Sci B. 2016; 17(10):763-74。https://doi.org/10.1631/jzus.b1500277。
- 32。
Staiger D,布朗JWSJPC。生物时间交叉点的选择性剪接。发展应激反应。2013;25(10):3640–56.
- 33。
Jun L,Xiangbing,Meng Y,Zong K,Chen H,ZJN P.基因使用CRISPR-CAS9通过内含子靶向稻米的替代品和插入稻米;2016年。
- 34。
OKUSHIMA Y,Fukaki H,Onoda M,神学is,塔斯卡卡M.ARF7和ARF19通过直接激活拟南芥的LBD / ASL基因调节横向根部。植物细胞。2007; 19(1):118-30。https://doi.org/10.1105/tpc.106.047761。
- 35。
徐L. de Novo Root Root EngoRened叶片外植体:伤口,养羊酸和细胞命运过渡。CurrOp植物BIOL。2017; 41:39-45。
- 36
俞YT,吴Z,卢克,毕聪,梁S,王新芳,等。MYB37转录因子的过表达增强了拟南芥对脱落酸的敏感性,提高了拟南芥的耐旱性和种子生产力。植物分子生物学。2016;90(3):267–79.https://doi.org/10.1007/s11103-015-0411-1。
- 37
赵y,天x,王f,张l,xin m,hu z等。响应于高温的小麦MYB基因的特征。BMC植物BIOL。2017; 17(1):208。https://doi.org/10.1186/s12870-017-1158-4。
- 38
戴X,XU Y,MA,MA Q,XU W,Chong K.R1R2R3 MyB基因的过表达,OSMYB3R-2增加了转基因拟南芥中冻结,干旱和盐胁迫的耐受性。植物理性。2007; 143(4):1739-51。https://doi.org/10.1104/pp.106.094532。
- 39
Cannon SB,Mitra A,Baumgarten A,Young Nd,GJBPB M.分段和串联基因复制的作用在拟南芥拟南芥中大型基因家族演变中的作用。4;2004. p。10。
- 40.
朱奕、吴恩、宋伟、尹庚、秦奕、颜奕、胡奕。大豆(Glycine max)expansin基因超家族起源:亚家族间的片段和串联重复事件以及发散选择。BMC植物生物学。2014;14:93.
- 41.
Opanowicz M、Vain P、Draper J、Parker D、Doonan JH。短足草:用野草做干草。植物科学趋势。2008;13(4):172-7.
- 42.
植物愈伤组织诱导和抑制机制的研究进展[j]。植物细胞。2013;25(9):3159 - 73。https://doi.org/10.1105/tpc.113.116053。
- 43.
Borghi L,M局,Simon R。拟南芥锯齿状侧器官在边界和坐标中表达nox和PIN活性。植物细胞在线。2007;19(6):1795–808.https://doi.org/10.1105/tpc.106.047159。
- 44.
撒切尔夫人,鲍威尔JJ,艾特肯EAB,哈萨克,吉咪。拟南芥侧器官边界结构域转录因子LBD20在枯萎病易感性和茉莉酸信号转导中的作用。植物生理学。2012;160(1):407-18.
- 45
Cabrera J,Díaz-Manzano Fe,Sanchez M,Rosso Mn,MeliLlo T,Goh T等人。在相互作用拟南芥 - MeloidogyneSPP期间横向器官边界结构域16的作用。提供侧根和根结线虫喂养现场开发之间的分子链接。新植物。2014; 203(2):632-45。https://doi.org/10.1111/3ph.12826。
- 46
Lee K,Park OS,SEO PJ。Arabidopsis ATXR2沉积H3K36ME3在LBD基因的启动子上,以促进细胞去细胞化。SCI信号。2017; 10(507):eaan0316。
- 47
Finn RD,Clements J,Eddy SR.HMMER web服务器:交互式序列相似性搜索。核酸研究,2011年;39(网络服务器问题):W29-37。
- 48
Letunic I,Doerks T,Bork P。SMART 7:蛋白质结构域注释资源的最新更新。核酸研究,2012年;40(D1):D302–5。https://doi.org/10.1093/nar/gkr931。
- 49。
Finn Rd,Coggill P,Eberhardt Ry,Eddy SR,Mistry J,Mitchell Al,Potter SC,Punta M,Qureshi M,Sangrador-Vegas A等。PFAM蛋白质家族数据库:迈向更可持续的未来。核酸RES。2016; 44(D1):D279-85。
- 50
周国成,沈海波。Cell-ploc2.0:一个改进的web服务器包,用于预测各种生物体中蛋白质的亚细胞定位。自然科学。2010;2(10):1090–103.https://doi.org/10.4236/ns.2010.210136。
- 51
Wilkins先生,Gasteiger E,Bairoch A,Sanchez JC,Williams KL,Appel路,Hochstrasser DF。ExPASy服务器中的蛋白质识别和分析工具。方法分子生物学。1999;112:531-52.
- 52
Edgar Rc。肌肉:高精度和高吞吐量的多个序列对齐。核酸RES。2004; 32(5):1792-7。
- 53
Kumar S、Stecher G、Tamura K。分子进化遗传学分析7.0版,用于更大的数据集。分子生物学。2016;33(7):1870-4.
- 54
Waterhouse,Andrew,Procter,Jim,Martin,David A,Barton,Geoffrey J. Jalview:分子序列,对准和结构的可视化和分析。BMC生物信息学。2005; 6:28。
- 55
克鲁克斯,加文,E.,霍恩,加里,钱多尼亚,约翰马克,布伦纳,史蒂文,E.:网络标识:序列标识生成器。基因组研究2004,14(6):1188–1190,doi:https://doi.org/10.1101/gr.849004。
- 56。
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L等。MEME SUITE:主题发现和搜索的工具;2009年。https://doi.org/10.1093/nar/gkp335。
- 57。
Magali L,Patrice D,Gert T,Kathleen M,Yves M,Yves Vdp,Pierre R,Stephane R. Plantcare,植物CIS作用调节元件的数据库和用于启动子序列的硅分析的工具的门户网站。核酸RES。2002; 30(1):325-7。
- 58。
王y,唐h,debarry jd,tan x,li j,王x,李th,金h,marler b,gu h等。McScanx:一种用于检测和进化分析的工具包,对基因同步和共线性分析。核酸RES。2012; 40(7):E49。
- 59。
Chen C,陈H,张Y,Thomas Hr,Frank Mh,He Y等。TBTOOLS:为大生物数据的交互式分析开发了一个综合的工具包。莫尔植物。2020; 13(8):1194-202。https://doi.org/10.1016/j.molp.2020.06.009。
- 60
顾忠,卡瓦尔康蒂,陈福平,鲍曼,李文华。果蝇、线虫和酵母基因组中基因复制的程度。中国生物医学工程学报。2002;19(3):256-62。
- 61
王大平,万浩,张S,俞杰。Gamma-MYN:考虑可变替代率的Ka和Ks估计新算法。生化直接。2009;4:20.
- 62
Ernst J,Bar-Joseph Z. Stem:用于分析短时间序列基因表达数据的工具。BMC生物信息学。2006; 7(1):191。
- 63
Ernst J,Nau GJ,Bar-Joseph Z.聚类短时间序列基因表达数据。生物信息学。2005; 21(4):I159-68。
- 64.
Otasek D,Morris JH,BouçasJ,Pico Ar,Demchak B.Cytoscape自动化:赋予基于工作流的网络分析。基因组Biol。2019; 20(1):185。
- 65.
Klopfenstein dv,zhang l,Pedersen Bs,Fidel R,Alex WV,Aurélienn,等。goatools:基因本体分析的Python库。SCI批准。2018; 8(1):10872。
- 66.
Benjamini Y,Hochberg Y.控制虚假的发现率:多种测试的实用和强大的方法。j r stat soc。1995年; 57(1):289-300。
- 67.
Khan A,Fornes O,Stigliani A,Gheorghe M,Castro-Mondragon Ja,Van der Lee-R,Bessy A,ChènebyJ,Kulkarni SR,Tan G,等。JASPAR 2018:更新转录因子绑定配置文件及其Web框架的开放访问数据库。核酸RES。2018; 46(D1):D260-D266。
致谢
我们感谢实验室成员的帮助和有益的讨论。作者要感谢TopEdit(www.topeditsci.com.)在编写本手稿期间的语言援助。
资金
本研究得到中国国家自然科学基金资助项目(国家自然科学基金项目资助:31770721)。资助机构在设计、分析、解释数据或撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
BH执行了数据收集和处理,参与了研究设计和解释,进行了实验,并写了稿件。Zh参与了一些实验。RM先生Andjc协助解释了结果。ZZ和KY负责数据分析数据的完整性和准确性。所有作者都审查和编辑了稿件。作者读并批准了最终的稿件。
相应的作者
道德宣言
伦理批准和同意参与
本研究以生长在广西桂林市竹园中的竹类植物为材料,采集了不同高度的竹鞭、花序、幼叶、根和笋的快速生长期组织样品。这项研究不需要伦理批准或同意,因为它不涉及任何濒危或受保护的物种。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:补充图1. 1。
九种物种中的LBD基因亚壳总数。
附加文件2:补充图2. 2。
LBD蛋白六个氨基酸基序标志。
附加文件3:补充图3。
PELBD基因启动子的顺式作用元素数。
附加文件4:补充图4。
jaspa_core数据库中LBD DNA绑定站点的共识基序。
附加文件5:补充图5。
潜在PeLBD靶基因的GO分析。
附加文件6:补充图6。
潜在PeLBD靶基因的KEGG分析。
附加文件7:补充表1。
17型PELBD重复基因对的KA-KS分析。
补充文件8:补充表2。
PELBD靶基因中GO和KEGG富集分析的详细信息。
补充文件9:补充数据1。
摩西竹基因组三分之一的详细信息。
附加文件10:补充数据2。
QRT-PCR的PELBD基因的特异性引物。
附加文件11:补充数据3。
关于PeLBD家族基因本体富集分析的详细信息。
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
黄,B.,黄,Z.,Ma,R.等。LBD转录因子基因在莫斯竹子(Phyllostachys Edulis.).BMC植物生物学21,296 (2021). https://doi.org/10.1186/s12870-021-03078-3
收到:
公认:
发表:
关键词
- 毛竹
- LBD公司基因家族
- 同步分析
- 表达式模式
- 靶基因