- 研究
- 开放获取
- 发布:
配子体发育过程中的差异基因表达模式提供了在Diaticous海带中的性别分化中的见解Saccharina粳稻
BMC植物生物学体积21, 文章编号:<年代pan data-test="article-number">335(<年代pan data-test="article-publication-year">2021)
摘要
背景
在棕色藻类中,Dioicy是普遍的性系统,并且在许多小型物种中发现了雄性和雌性配子体之间的表型差异。Saccharina粳稻在配子发生之前在配子上显示出显着的性二态性。在配子发生后,在女性和雄性配子中也发现了更高水平的表型分化。然而,整个配子体发育的差异基因表达的模式以及这些变化的变化如何与配子阶段的性别特定的健身有关S. japonica.不众所周知。
结果
本研究采用比较转录组分析方法,研究雌雄配子体不同发育阶段基因表达的差异。单倍体配子体世代表达的20151个基因中,有37.53%的基因性别偏置。成熟配子体中性别偏置基因的丰度远高于未成熟配子体,且成熟阶段雄性偏置基因多于雌性偏置基因。大多数性别偏置基因的预测功能与配子的性别特异性特征密切相关,包括细胞壁生物合成、精子活力和精子和卵子识别。另外,有51个基因在这两个阶段的雄性中特异表达,显示了作为候选雄性性别决定区(SDR)基因的巨大潜力。
结论
本研究描述了在多发性海带中雄性和雌性配子体之间的差异基因表达的彻底调查美国japoni加利福尼亚州.成熟的有偏见的偏见基因在成熟的配子体中可能与在性分化期间女性配子(鸡蛋)和雄性配子(精子)之间的表型性状性状和生理功能的分歧相关。这些基因可能主要来自最近进化的新性偏见基因S. japonica.血统。性别偏置基因的复制可能增加配子发生后性别偏置基因的数量S. japonica.在某种程度上。成熟阶段雄性偏倚基因多于雌性偏倚基因可能反映了性别间性选择的不同水平。本研究加深了我们对雌雄异体海带性别发育和分化调控的认识S. japonica..
背景
褐藻是一种光自养的多细胞海洋生物,属于Stramenopiles,它独立于动物、真菌和绿色植物谱系进化超过10亿年[1,2].由于其独特的进化历史,褐藻表现出一些显著的特征。相比之下,只有6%的开花植物是雌雄异株的[3.,4],褐藻中普遍存在雌雄分离的现象,这可能与褐藻缺乏自交不亲和系统有关[5].此外,在棕榈藻类中展出了男性和女性之间的性别二态性水平的显着多样性,包括偶像,茴香和致殖种,在棕海藻中表现出[5].因此,近年来人们对褐藻性染色体进化和性别决定调控的研究越来越感兴趣[1].
雌雄异株和雌雄异株是褐藻生殖系统的两种常见类型,在生活史的二倍体和单倍体阶段分别发生两性分离。其中,双生孢子在褐藻中普遍存在,特别是在外腕藻和海带目[1,5].与二氧化物期性别测定系统(XX / XY或ZW / ZZ系统)相比,这些小型物种的性别由紫外线性测定系统确定,其中U和V性染色体存在于女性中和雄性的配子体分别[6,7].近年来,人们对褐藻中UV染色体的起源和进化以及褐藻中性别决定和性别二型性的调控进行了研究Ectocarpus,一种典型的棕色藻类,属于外腕藻[2,8,9,10,11].性别决定区域(SDR)的女性(U)和男性(V)性染色体Ectocarpus已被识别并表征[2].雄性和雌性特别提款权独立进化了超过7000万年,并且在序列水平上高度分化。然而,在U和V sdr之间观察到类似的大小和结构[1,2].除了基因密度低,大量的重复DNA在特别提款权和特别提款权基因的内含子的时间越长,他们是类似的估计尺寸(0.93 Mb 0.92 Mb,女性和男性特别提款权,分别)和相对较小,构成只有五分之一的性染色体。此外,在配子体世代中,只检测到一小部分性别偏颇基因(< 12%),雄性和雌性偏颇基因的进化率相似[8,12].U和V sdr的上述相似特征与低水平的性二型性相一致Ectocarpus.
Saccharina粳稻是中国培育的最具商业价值的褐藻之一。其农业年产量已超过100万吨,为食品和制药行业提供原料[13,14].此外,培养S. japonica.通过去除氮和磷,固碳和释放O<年代ub>2[15].S. japonica.属于层间顺序,其单倍体配子体的性别也由紫外线性系统决定。在单倍体生成期间,在雌性和雄性配子上表现出显着的性二态,并且在配子发生后的女性和雄性配子中也发现了高水平的表型分化[16,17[对比与性二甲性有限的程度形成鲜明对比Ectocarpus配子和配子体。性染色体和SDR基因在表型差异和物种形成的进化中发挥关键作用[18].虽然在几种海藻物种中报道了大型雌性染色体[19],未发现异型性染色体S. japonica.到现在 [20.,21].筛选后的S. japonica.基因组数据库通过SDR基因Ectocarpus,只有一小组同源基因被发现[22].此外,在褐藻U/V性染色体的长期进化过程中,观察到了基因进出SDR的运动[10].就这样S. japonica.SDR可能有其独特的性别二型性结构特征和调节机制。除了特别提款权基因之外,许多与性别相关的基因分布在整个基因组中,它们的性别偏见表达可能解释了大多数性别二型特征[23].在此,性偏见的基因表达是远行的,在无脊椎动物中发生性别的差异的机制中最多研究[24,25,26),脊椎动物(27,28植物[29,30.].然而,在海带中性别偏倚基因表达的全基因组模式还没有被识别和鉴定S. japonica.到目前为止。此外,有卵配子的海带种配子也表现出明显的表型分化。大而不运动的雌性配子(卵)可以释放信息素,而小而运动的雄性配子(精子)可以通过趋化反应直接游向信息素来源[31].最近,糖藻配子体发育过程中性别依赖的转录变化Saccharina Latissima.进行了研究,提供了对海带配子发生的分子水平的了解[32].但是,有必要加深对这些变化如何与性别分化有关的理解,以及在配子阶段的性别特定的健身S. japonica..
在该研究中,对不同发育阶段的男性和雌性配子体进行比较转录组分析。鉴定了许多性偏见的基因,讨论了性偏见基因丰富与性别分化水平之间的关系。我们还检测了一组性别特异性基因,代表了作为SDR基因和性别测定相关基因的良好候选者。结果概述了单倍体发电中的性差异基因,以加深对Diaticous海带中性别分化调节的理解S. japonica..
结果
配子体的性别鉴定与有性生殖
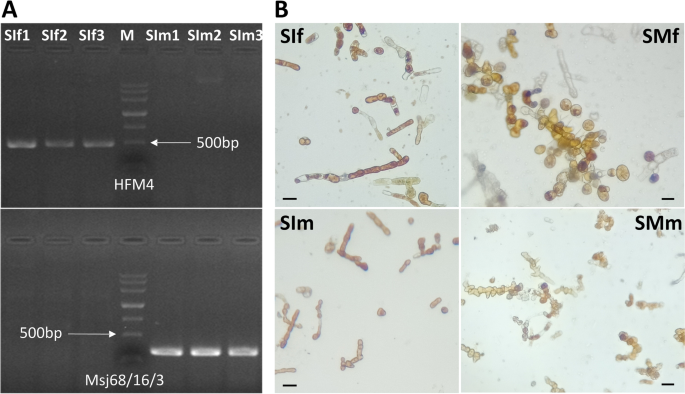
性别特异性标记用于鉴定样本的性别(附加文件1:表S1)。特异性PCR产物约为500bp和300bp,仅在雌配子体(SIf1-SIf3)和雄配子体(SIm1-SIm3)中扩增,表明我们的样本在本研究中的可靠性(图1。1一种)。PES培养基用于诱导配子体发育。在培养12天后,清楚地观察到雌性配子体样品(SMF)中的圆形鸡蛋(图。1b)。在雄性配子体样品(SMM)中也可见。
排序和测绘S. japonica.转录组
来自男性和女性配子素的12个cDNA文库S. japonica.在两个不同的性发育阶段测序,每个样品获得超过4500万清洁读数。此外,75.88至85.87%的总读数被映射到参考基因组(附加文件2:表S2)。以FPKM测量的转录本丰度,在每组的生物学重复之间具有很强的相关性r范围从0.919到0.987(附加文件9:图S1A)。PCA也显示了组的良好分离(附加文件9:图印地)。
配子体发育过程中的基因表达分析
共表达20151个基因(FPKM > 1),其中13221个基因在所有性别和分期中均有表达9:图就是S1C)。未成熟阶段,雌配子体中表达15290个基因,雄配子体中表达15438个基因,共表达16218个基因。相比之下,成熟期有19001个基因表达。其中雌性配子体中检测到16800个基因,雄性配子体中检测到17965个基因。这说明在中后期成熟阶段有较多的基因表达S. japonica.孢子体。
分析差异表达基因
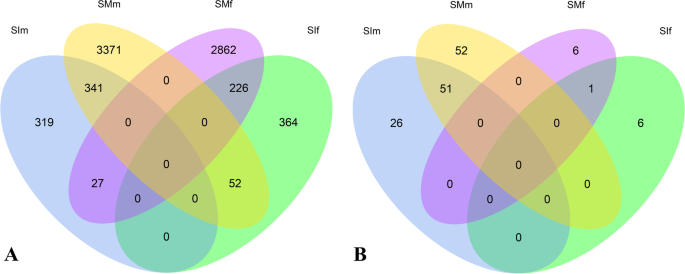
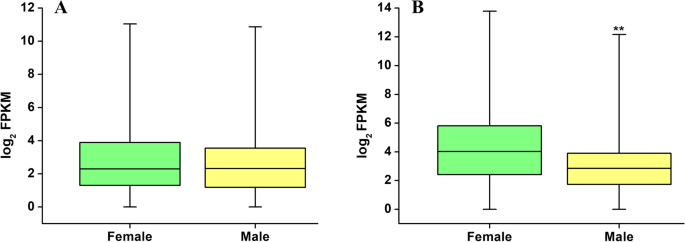
四组间两两比较共检测到7762个deg (fold change FC > 2),占本研究鉴定的所有表达基因的37.53%(图1)。2A).使用归一化FPKM值和层次聚类生成的热图显示,表达式可以分为几个不同的模式(附加文件10:图S2)。在不成熟的配方体阶段,检测仅687个雄性偏置基因(SIM组中的上调的次数)和642个雌性偏置基因(SIF组中的上调的次数)。相比之下,在成熟阶段鉴定了3,764个雄性偏置基因(SMM)和3,1115个雌性偏置基因(SMF),分别占所有表达基因的20.95%和18.54%(表1;无花果。2一种;附加文件3.:表S3)。性别倾向基因的数量在成熟阶段总是高于不成熟阶段,即使定义DEGs的FC阈值增加(表1).这表明更多性偏见的基因涉及游戏生成和配子形成而不是在配子上形成。此外,雄性偏置基因的比例高于成熟阶段(Fc> 2:20.95 Vs18.54%)中的雌性偏置基因的比例,并且随着Fc阈值增加(Fc> 10:6.43,该间隙变大vs 2.89%)。然而,在成熟阶段中的雄性偏置基因(Mann-Whitney U测试,所述偏偏的基因在显着高于雄性偏置基因的水平明显高。p< 0.05)(图3.).
大多数性别偏倚基因仅在分析的两个发育阶段中的一个表现出显著的性别偏倚表达。在未成熟配子体和成熟配子体中,只有8.3%(341/4110)的雄性偏置基因和6.4%(226/3531)的雌性偏置基因存在差异表达。2A).此外,未成熟配子体中有3.93%(27/687)的雄性偏倚基因在成熟配子体中有3.93%(52/642)的雌性偏倚基因在成熟配子体中有8.10%(52/642)的雄性偏倚基因。
性别偏倚基因的功能分析
将基因本体(GO)进行性偏向基因的筛查和分类为细胞组分(CC),分子功能(MF)和生物过程(BP)类别。在未成熟的配子体中,仅针对女性性偏见的基因发现了显着的GO类别的富集。然而,在成熟的配录体中检测到雌性和男性偏置基因的更显着富集的GO术语(附加文件4和5:表S4和S5)。有34项富集成熟的配子体中的男性偏见基因。它们中的大多数与细胞运动相关,包括“细胞或亚细胞组分”,“Dynein综合体”和“微管运动活性”,它们分别是BP,CC和MF类别中最重要的术语。对于成熟的杂化物中的雌性偏置基因,分别在BP,CC和MF类别中富集110种GO术语,包括“氧化还原过程”,“膜部分”和“氧化还原酶活性”(附加文件11:图S3)。
KEGG通路分析显示,只有在成熟阶段,性别偏倚基因才显著富集KEGG通路。途径“磷脂酰肌醇信号系统”是在成熟的雄性偏性基因中显著富集的唯一途径(附加文件6:表S6)。成熟的雌性偏置基因被分配到21个主要参与代谢和光合过程的富集途径,包括“代谢途径”、“碳代谢”和“光合生物体碳固定”。
细胞壁碳水化合物合成
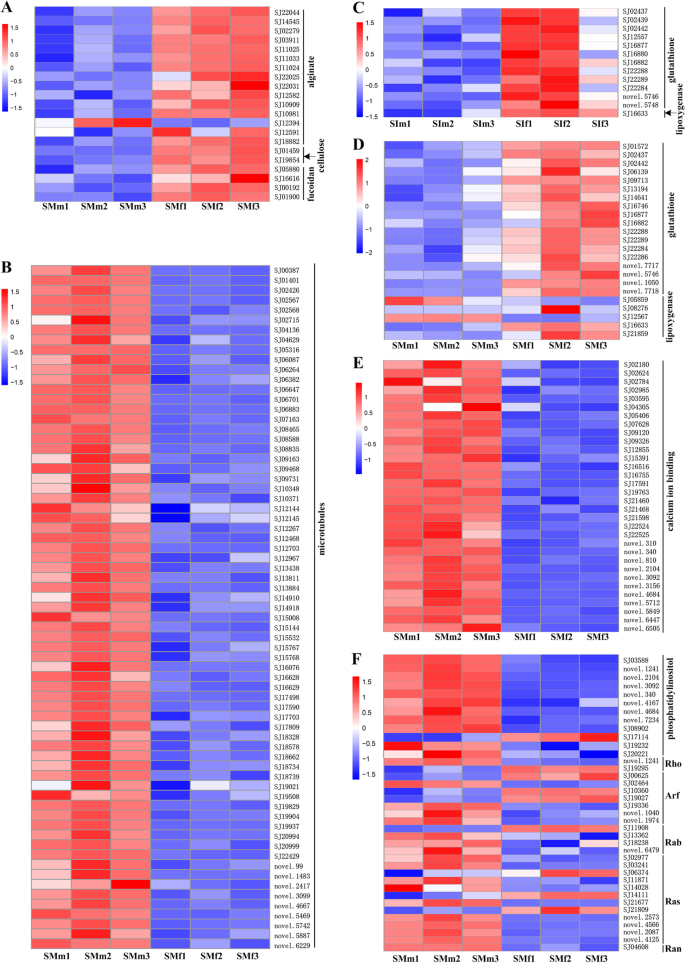
褐藻酸盐是褐藻细胞壁中最丰富的多糖成分。大多数涉及藻酸盐生物合成的性别偏置基因在成熟的雌性配子体中过表达,包括一个甘露糖-6-磷酸异构酶(MPI)基因SJ22044,两个磷酸聚糖酶(PMM)基因SJ14545和SJ02279、4个gpd -甘露糖6-脱氢酶(GMD)基因(SJ03911.,SJ11025,SJ11033.,SJ11024)和七个甘露甘露甘露烯酸C5-映酶(MC5E)基因,而一个MC5E基因SJ12394是表达下调(无花果。4A).纤维素和岩藻糖是细胞壁的其他多糖成分。2个纤维素相关基因和4个岩藻酸盐相关基因在成熟雌配子体中的表达水平也高于成熟雄配子体。4A).这些结果可能与雌性配子体孤雌生殖过程中初生细胞壁生物发生有关。另外,在上述成熟期性别偏倚基因中,有3个基因(2个MC5E基因,SJ22025和SJ12591,和一个硫转移酶基因,SJ01900.)在未成熟的阶段也是雌性偏见的,表明细胞壁多糖组合物中可能存在差异,并且在未成熟的雌性和成熟的配子体之间的含量。
微管组织
在S. japonica.,精子的运动取决于由鞭毛提供的推进。相应地,许多与微管结构和细胞运动相关的术语显着富集成熟的雄性配子体,涉及该研究该研究的69个雄性偏置基因(图。4b)。其中,只有一个基因(新颖2417)为雄性特异性,表达量极低(FPKM < 3)。这说明雌性配子体基因组中也保存了鞭毛相关基因,并在卵形成时表达,这与雌性鞭毛相关基因的表达一致S. Latissima.孢子体(32和有鞭毛的卵昆布属植物angustata[33].此外,两个男性偏见的基因(SJ17498.和novel.3099)在成熟的阶段也是在未成熟的雄性配子上的雄性偏置。正如预期的那样,它们的表达水平在未成熟的阶段较低,而不是雄性和雌性配子体中的成熟阶段。这SJ17498.基因用Dynein重链结构域编码蛋白质,可以用作用于沿微管的细胞器和囊泡运动的电动机。基因novel.3099编码一种包含肌凝蛋白和驱动蛋白运动域的蛋白质,它可能是肌凝蛋白和驱动蛋白介导的过程的驱动力。
Pheromone生物合成
除了精子的活性,对卵子释放的性信息素做出反应的精子趋化性对配子识别也至关重要。褐藻信息素是C-11烃类化合物,脂氧合酶(LOX)和过氧化氢裂解酶(HPL)参与其合成途径[34].在这项研究中,没有检测到HPL性偏置基因,并且在雌性配子体中过表达了5种成熟的性偏置的LOX基因中的3种(图。4D).其中LOX基因SJ16633在未成熟的雌配子体中也表达上调(图。4c),其编码蛋白质高度相似ESI0424_0006lox from.Ectocarpus,可能同时具有LOX和HPL活性[12].此外,所有谷胱甘肽相关的deg在雌配子体中均过表达,包括12个和18个雌偏置基因,分别在雌配子体的未成熟阶段和成熟阶段(图1)。4这一结果与在Ectocarpus,在信息素合成期间,支持谷胱甘肽(作为自由基清除剂)的抗氧化作用[12].
Ca<年代up>2+信号转导
据报道,一个Ca<年代up>2+- 通过CA依赖途径<年代up>2+频道参与棕榈藻类的趋化精子运动[35,36].在感应性信息素梯度后,细胞体和鞭毛CA增加<年代up>2+暂时诱导浓度,改变精子鞭毛波形[37].在该研究中,分别培养成熟的雌性和雄性配子细胞,并且在成熟的阳性配子体中显着过表达钙离子结合项(GO:0005509)的所有32个性偏置基因(图。4e)。这些基因均编码含EF手域的蛋白质,其可以结合钙来诱导构象变化,然后向其靶蛋白传递,通常催化酶促反应。该结果表明,在从鸡蛋中释放的性信息素诱导之前调节钙信号转导的基因。
磷脂酰肌醇信号传导途径
磷脂酰肌醇信号传导系统,其参与将细胞外信号转化为细胞内信号,是成熟的雄性偏置基因的唯一显着富集的途径(附加文件6:表S6)。与该途径相关的所有八个基因有未知功能的均偏置(图。4F)。此外,我们还鉴定了磷酸阳性介导的信号传导所需的两种基因,其在成熟的雄性配子体中过表达过表达。一种是磷脂酰肌醇3-和4-激酶(PI3K / PI4K)基因(SJ19232.),可以在其肌醇环上磷酸化磷脂酰肌醇(PTDIN)以产生PTDINS3P和PTDINS4P。另一种是磷酸膦酸磷脂酶C(PI-PLC)基因(SJ08902),将磷脂酰肌醇 - (4,5) - 磷酸盐(PIP2)切割成第二信使二酰基甘油和肌醇-1,4,5-三磷酸(IP3)[38,39].然而,磷脂酰肌醇-4-磷酸5-激酶(PIP5K)基因(SJ17114)在合成PIP2中,在成熟的雄性配子体中下调,其与观察到的结果不一致大肠siliculosus[12].在成熟期,也有许多具有性别偏见的Ras GTPase超家族基因(Ras、Ran、Rho和Arf)。4F)。Rho家族GTP酶,小G蛋白,充当活性和无活性形式的分子转换,并由两类调节蛋白调节[40,41].中观察到大肠siliculosus[12,负调控gtp激活蛋白(RhoRAP)基因(新颖.1241)在成熟的雄性配子体中高表达,而阳性调节剂鸟嘌呤核苷酸交换因子(Rhogef)基因(SJ19295)在成熟的女性配子上升级S. japonica..
性别差异基因的比较S. japonica.和E.sp。
性别偏见基因的数量S. japonica.在成熟阶段大大增加。我们比较了性偏见的基因S. japonica.与那些在E。sp。具有最大e值1e<年代up>−5.大多数性偏见的基因未分享S. japonica.和E。sp(本研究中新的性别偏见基因)(附加文件12:图S4)。研究中有2408个新的女性偏倚基因和3115个新的男性偏倚基因S. japonica.和139个新的女性偏见和237个新的男性偏见基因E。在同源基因中,一些性别偏倚在一个物种中表达(特定性别偏倚基因),而一些性别偏倚在两个物种中表达(共享性别偏倚基因)。特定性别偏见基因的比例S. japonica.(分别为女性和男性的22.0和15.5%)高于E。Sp .(女性8.0,男性9.3%)。共有的性别偏见基因的比例S. japonica.(女性为0.7,男性为1.6%)低于E。Sp .(女性为6.7%,男性为14.7%)。
性别特异性基因分析
在性偏置的基因中,分别在未成熟和成熟的配方体中检测到77和103个男性特异性基因(图。2B;附加文件3.和7:表S3和S7)。总共,51个基因是未成熟和成熟的配方体阶段的男性特异性,包括高迁移率组域编码基因(SJ05808.),一种膜转运蛋白基因(SJ00352.),ste20样激酶基因(SJ00948),植物转座蛋白基因(SJ15019.),Ankyrin重复蛋白质基因(SJ13170),起始因子2亚基家族蛋白基因(novel.5218)和3个乌头酸酶家族基因(SJ09771,SJ10505和novel.2780).然而,只有7个雌性特异性基因在未成熟和成熟阶段均低表达(FPKM < 6),大部分是本研究新预测的(附加文件3.和7:表S3和S7)。总共只有一个具有未知功能的基因(novel.7290,部分序列)是未成熟和成熟的配子体阶段的女性特异性。这与前一个结果一致,即参考基因组实际上是一个男性基因组[10而不是最初报道的女性基因组[42].
qRT-PCR检测DEG表达
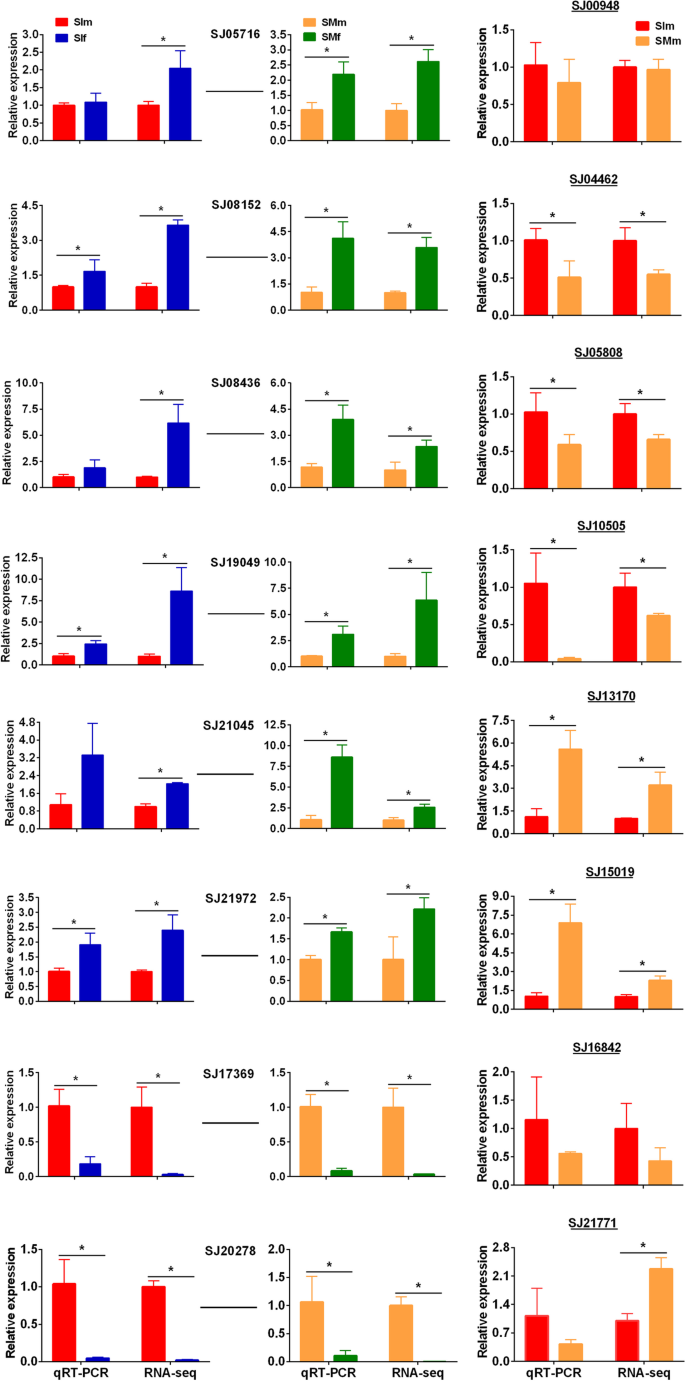
为了验证孢子体发育期间的基因表达水平,选择八个性交基因和八个具有高表达水平的八个男性特异性基因,用于QRT-PCR分析。在所有QRT-PCR扩增中检测到熔化曲线中的单一峰,表明所有PCR产物都被特异性扩增。对于性偏见的基因,QRT-PCR结果与RNA-SEQ在未成熟的游戏体阶段(相关系数0.873)和成熟的配方化合物级(相关系数0.780)中的结果显着相关(图。5).通过QRT-PCR证实了男性特异性基因的表达(附加文件13:图S5)。此外,发现QRT-PCR结果与RNA-SEQ结果一致,导致雄性配子体发育的不同阶段(相关系数0.745。5).两种方法的结果仍有差异。例如,基因SJ21771.RNA-seq结果显示成熟配子体中表达量高于未成熟配子体,而qRT-PCR结果显示两者无差异。一般情况下,qRT-PCR检测的基因相对转录水平与RNA-Seq检测的基因相对转录水平一致,说明转录组分析结果的可靠性和准确性。
QRT-PCR验证基因表达。大胆基因代表性别偏见的基因。粗体和下划线的基因代表特定性的基因。(1)基因ID:SJ05716-谷氨酸;(2)基因ID:SJ08152 - 未知;(3)基因ID:SJ08436未知;(4)基因ID:SJ19049-酪氨酸酶;(5)基因ID:SJ21045-叶绿素A-B结合蛋白;(6)基因ID:SJ21972-NAD依赖性映异构酶;(7)基因ID:SJ17369未知; (8) Gene ID: SJ20278- zinc finger C- × 8-C- × 5-C- × 3-H type family protein; (9) Gene ID: SJ00948-kinase domain protein (10) Gene ID: SJ04462-unknown; (11) Gene ID: SJ05808- high mobility group protein; (12) Gene ID: SJ10505-aconitate hydratase; (13) Gene ID: SJ13170-Ankyrin repeats protein; (14) Gene ID: SJ15019-plant transposon protein; (15) Gene ID: SJ16842-unknown; (16) Gene ID: SJ21771-unknown. SIf: immature female gametophytes; SIm: immature male gametophytes; SMf: mature female gametophytes; SMm: mature male gametophytes. Asterisks indicate a significant difference (t-test,p< 0.05)
讨论
S. japonica.是一种多种状态,其中在单倍式化学杂草生成期间表达性,并且在微观的游戏体和配子中显示出显着的性二态。在该研究中,通过在雄性和雌性配录上进行转录组测序来鉴定性偏置的基因和性特异性基因S. japonica.在不同的阶段。配子体中表达的20151个基因中,有37.53%表达性别偏倚。类似或更大比例的性别偏见基因也在其他具有显著性二型性的物种中被发现,包括节肢动物[43,44)、鱼(45],鸟儿[28]和哺乳动物[46].我们发现大量的性别偏见基因S. japonica.主要归因于配子体发生后性别偏倚基因显著增加。性别偏置基因比例从未成熟配子体阶段的8.19%(1,329/16,218)增加到成熟配子体阶段的36.20%(6879/19001)。与结果形成对比S. japonica.,在异常棕色的藻类中Ectocarpus在单倍体配子体发生过程中,性别偏置基因所占比例小于12%,且未成熟配子体的性别偏置基因多于可育配子体;Ectocarpus在配子上表现出低水平的性二态性[8].在以前的研究中,许多植物和动物的性别倾向基因表达随发育阶段的变化已被报道[24,47,48].在这项研究中,雄性和雌性配子体之间的表型差异仅在未成熟阶段的细胞尺寸中。在配子发生后,在生殖器官(Oogonia和Antheridia)和配子(鸡蛋和精子)中显示出更大的表型差异S. japonica.通过进一步的性别分化。在之前对另一种有性生殖物种的研究中,S. Latissima.,在配子形成诱导培养8天后,也比在蔬菜生长条件下鉴定出更多的性别偏见基因[32].本研究进一步预测了性别偏倚基因的功能。对于男性偏置基因,在未成熟阶段没有GO或KEGG通路显著富集。然而,成熟阶段检测到34个富集的氧化石墨烯,其中大部分与细胞运动、微管组装和活性以及钙离子结合有关。此外,唯一显著富集的KEGG通路是磷脂酰肌醇信号系统。磷脂酰肌醇信号系统在将细胞外信号转化为细胞内信号中起着关键作用。这些结果与成熟期精子的运动表型及其趋化生理功能相一致[31].对于女性偏见的基因,110个GO条款和21 kegg途径在成熟阶段富集。大多数细胞壁多糖相关基因和信息素生物合成相关基因在雌性配子上过表达,这也与蛋特异性表型(在营养期间形成细胞壁)和生理功能(释放信息素)[31].褐藻配子体发育过程中性别偏倚基因的功能差异与表型分化的一致性为配子体发育过程中性别偏倚基因表达的变化可能与褐藻性别分化水平有关的假说提供了证据。
我们进一步比较了配子发生后的性偏见基因S. japonica.与那些在E。sp。两种核心的性偏见基因集S. japonica.和E。经鉴定,sp.具有两个来自不同位点的序列,最大E值为1e<年代up>−5(附加文件14:图S6)。可能发生了这些性偏见基因的基因复制S. japonica..例如,七个雄性偏倚的动力蛋白重链编码基因(SJ06892,SJ06883,SJ06894,SJ06893,novel.2365,新颖.7097和SJ06649)被检测到S. japonica.,而只有一个(Ec-25_001350)在E。sp。所有七种基因只在配子发生后在雄性中上调。这些基因的类似表达模式表明它们的功能性分歧并不明显,尽管基因重复有助于获取新的基因并在棕藻中产生遗传新颖性[49,50,51].在性偏见的基因中S. japonica.,他们中的大多数没有与任何基因对齐Ectocarpus基因组,反之亦然(附加文件12:图S4)。的不完整的汇编和注释可能与S. japonica.本研究中使用的参考基因组。这一结果表明,更多的与性别分化相关的新基因在植物中进化S. japonica.谱系比在里面E。sp血统,根据大量的性别偏见基因S. japonica..此外,鉴定了一些特定的性偏置基因。在S. japonica.,没有特定的男性偏置基因丰富的途径(附加文件15:图S7)。然而,只有“磷脂酰肌醇信号系统”通路在新的男性偏置基因中显著富集,这与所有男性偏置基因的结果一致。此外,有18条通路为特定的雌性偏重基因而富集,而只有6条通路为新进化的雌性偏重基因而富集15:图S7)。这些结果表明,特定的性别偏倚基因和新进化的性别偏倚基因可能在不同的性别中发挥不同的作用S. japonica..
在许多具有雄性异配子性染色体系统的物种中,已经报道了过量的雄性偏置基因[4,52,53,这可能是因为雄性的性选择通常比雌性更强烈。在本研究中,尽管使用了雄性参照基因组,但未成熟配子体中雄性偏倚基因的数量与雌性偏倚基因的数量相似。这一结果提示可能不存在异型性染色体S. japonica..然而,在成熟配子体中观察到更多的偏雄性基因而非偏雌性基因,这与结果一致S. Latissima.[32].配子形成后,Saccharina雄性需要产生大量能快速向卵子游去的精子,这表明雄性之间的竞争可能多于雌性之间的竞争[54].本研究中雄性偏重基因多于雌性偏重基因可能反映了具有紫外性染色体系统的雌雄异体海带的不同性别选择水平。
与性别偏见基因相比,性别特异性基因可能在性别决定和性别二态性中发挥更重要的作用。因为参考基因组S. japonica.来自一种患有V性染色体但不是U性染色体的雄性菌株,发现只发现一个基因在两个阶段的女性中特异性表达。以下,我们专注于男性特异性基因。在51个男性特异性基因中,含HMG结构域的蛋白质基因(SJ05808.),一个类似ste20的蛋白激酶基因(SJ00948)和一个乌头酶家族基因(SJ10505)被确定(附加文件7:表S7),并确认了它们的特定表达式模式(附加文件12:图S4)。它们是褐藻中公认的保守的SDR基因[10].HMG结构域基因是唯一限于许多褐藻种类的男性SDR的唯一基因。许多研究表明HMG结构域基因Ectocarpus,Ec-13_001750,是一个特别强的男性性别测定候选基因[2,10,55].我们前期研究的特点和表达分析SJ05808.也证实了它们在性别决定中的潜在作用S. japonica.[17].据报道,STE20蛋白激酶是对单倍体细胞进行酵母中性信息素所必需的酿酒酵母[56];该激酶可以在蛋白激酶级联中转导信息素结合到膜受体所诱导的信号。乌头酸酶在三羧酸循环中起着重要作用。先前的研究证实了胞质乌头酸酶与鸟类Z染色体的连接[57].另外,不育植株花药发育过程中乌头酶基因的下调可能影响雄蕊发育过程中的能量供应,与小麦雄性不育密切相关小麦[58].这些结果表明,STE20蛋白激酶同源物可参与通过磷酸化的信息素信号转导,并且乌头酶同源物可能在棕海藻中的男性配子发育中发挥关键作用。
一些男性特异性基因S. japonica.在棕色藻类SDR进化期间并不保守。一个未知的功能基因(SJ21771.)存在于海带目的SDR中,但其同源基因位于常染色体上Ectocarpus.基因SJ00352.在特别提款权中只存在于S. japonica.但是在其他层间物种中的纯度体或伪变质区(PAR)上[10].该基因含有一个mem-trans超家族结构域,可能编码生长素外排载体蛋白的一个成员。前期研究表明,PIN生长素外排转运体在绿藻的胚囊细胞中优先表达轮藻寻常的[59在考古管家的形成期间,在雄花中Populus tomentose.[60].这些结果表明SJ00352.可能参与性别分化和男性生殖发展S. japonica..
六个基因(SJ09422.,SJ15797,SJ15874.,SJ05597,SJ18945.和SJ13722)已被报告转移出特别提款权S. japonica.基于rna的逆转录转位机制[10].对应褐藻UV系统中SDR退化的明显迹象[6] SDR-to-utosome转置可能是计数器基因损失的潜在机制[10,61].我们检查了这些基因的表达模式。它们没有差异表达(|log<年代ub>2(折叠变化)|> 1)在雄性和女性之间,除了雄性偏见的基因SJ05597在成熟的阶段。此外,这些基因显示出不同的表达模式。我们注意到了SJ13722在雌虫中,在未成熟期和成熟期分别略上调1.64倍和1.36倍。这SJ13722被预测编码一种备忘录样蛋白。该蛋白家族可能通过释放细胞外趋化信号参与细胞运动[62].这个结果表明SJ13722还能在生殖过程中发挥功能性作用吗S. japonica.并为sdr -常染色体转位可能与亲本基因功能的维持有关的假说提供了证据。另外,前期预测的雄性SDR基因在S. japonica.[10]全部包含在本研究中两个阶段的51个男性特异性基因中。因此,我们的研究提供了一组用于筛选男性SDR基因的基因。应进一步调查他们的生物学功能和性监管机制。
结论
本研究对褐藻雌雄偏置基因的表达模式进行了全面的研究,旨在了解雌雄偏置基因在褐藻性别发育和分化中的调控作用S. japonica..配子体发育后的性别偏置基因比未成熟阶段多,这与配子体发育成熟后的性别二型性较高是一致的。性别偏倚基因的重复在S. japonica.通过比较有性别偏见的基因S. japonica.和E。此外,许多新的性别偏见的基因进化S. japonica.谱系,可能有助于该研究中的性偏向基因数量的增加。许多性偏见的基因可能与配子形态发生和生理功能的调节有关,提供有价值的信息,以进一步调查性别分化。对女性偏置基因的过量偏见可能反映与紫外线性染色体系统的多发性海带的性别之间的性别不同水平。此外,还鉴定了一组特异性基因,其具有较大的潜力作为候选男性SDR基因。应在进一步的研究中阐明性别测定的功能和角色S. japonica..
方法
培养条件和样品采集
三十六个雌配子体和三十六个雄配子体Saccharina粳稻由海带物种和山东烟台烟台品种中心提供(附加档案8:表S8)。所有配子体均从我国养殖品种中分离,并在添加12 μmol NaNO的海水中保存<年代ub>3.和7.35μmolkh<年代ub>2宝<年代ub>4在10±1℃的恒定辐照度下,15-20 μmol的照片m<年代up>−2年代<年代up>−1.为了鉴定雌、雄配子体之间差异表达的基因,分别设置了未成熟雌配子体组(SIf)和未成熟雄配子体组(SIm)两个实验组(每组3个生物学重复)。每个复制由12个同性配子体组成。每个配子体样本的性别都通过显微镜检查和性别特异性标记鉴定来确定[22].有关性别特定标记的信息列于其他文件中1S1:表。为了促进配子体的发生,将每组配子体分解成短片段,放入前面所述的PES培养基中[17].培养12 d后,配子体达到性成熟(卵原体或雄蕊的产生),并作为另外两组收集,分别代表成熟雌配子体组(SMf)和成熟雄配子体组(SMm)(附文件)16:图S8)。所有实验样品均在液氮中闪蒸,并在RNA提取之前储存在-80℃。
性识别S. japonica.孢子体
性别特异性标记用于鉴定S. japonica.孢子体。用雄性特异性标记(Msj68/16/3)鉴定了雄配子体[22].根据一个特定的雌性序列(登录号:MF850255)[22],我们使用Primer3设计引物对[63,64]并在本研究中开发了一种新的特异性标记。进行PCR,如前一项研究中所述进行扩增[22].通过用溴化乙锭染色的1.0%琼脂糖凝胶,通过电泳分离PCR产物。
RNA提取和测序
根据制造商的说明,使用RNEasy植物迷你套件(Qiagen,Hilden,德国)提取总RNA。使用NanoDrop 1000分光光度计(Thermo Fisher Scientific,MA,USA)测量RNA纯度和RNA浓度。使用BioAnalyzer 2100系统(Agilent Technologies,CA,USA)的RNA纳米6000测定试剂盒评估RNA完整性。在制造商的说明之后使用NeBnext®ultATRNATRNA文库预备套件生成12个测序库,并在illumina Hiseq 4000平台上进行测序,使用150bp成对结束读取。
读取对参考基因组的映射和预测新的转录物
通过去除包含适配器、poly-N和低质量reads的reads,得到Clean reads,并对齐到S。粳稻参考基因组(GenBank号:JXRI00000000.1)使用Hisat2 v2.0.5 [65].参考基因组实际上来自于一个雄性株,尽管最初报道它是一个雌性株。使用StringTie v1.3.6对参照基因组中没有相应注释信息的每个样本的图谱reads进行组装,以预测新的转录本[66].新预测基因的注释信息显示在附加文件中17.Stringtie使用网络流量算法以及DE Novo集装步骤来组装和定量表示每个基因座位的多个剪接变体的全长转录物。FeatureCounts V1.5.0-P3用于将映射到每个基因的读数[67].然后,基于基因的长度和映射到该基因的读数的数量来计算每个基因的FPKM。对所有样品进行PCA以评估组之间的差异和本组内的样本复制。
差异表达分析
使用Deseq2 R包(1.16.1)分析两组之间的差异表达基因(DEG)[68].所得的p值用Benjamini和Hochberg的方法进行调整,以控制错误发现率。绝对日志<年代ub>2(折叠变化)> 1和调整P-value < 0.05为识别显著DEGs的阈值。此外,性别特异性基因中FPKM值为0,而另一性别配子体FPKM值大于1的基因被定义为性别特异性基因。
Go和Kegg Encichment对Degs的分析
采用clusterProfiler R软件包对基因本体(GO)分类和KEGG (Kyoto Encyclopedia of Genes and Genomes)富集分析进行分析。修改后的条款P-值小于0.05被认为是显著富集。
DEGs实时荧光定量PCR分析
为了估计RNA-SEQ分析的有效性,通过QRT-PCR测量16个预测的含量的表达水平。如上所述进行RNA提取。使用具有GDNA橡皮擦(Takara,China)的Primescript RT试剂盒合成cDNA。EF1α基因被用作内部标准化的参考。使用PRIMER3设计所有引物;它们列于其他文件中1:表S1 [63,64].使用Sybr Premix ExTaq™(Takara)对CFX96实时PCR检测系统(Bio-Rad Laboratories,CA)进行QRT-PCR。PCR条件如下:95℃的初始步骤30秒;然后在95℃下进行40个变性,在5秒和59℃下退火5秒;并且在65℃下进行最终的解离曲线分析5秒。进行扩增产物的熔化曲线分析以证明PCR产物的特异性。2<年代up>−ΔΔCt进行方法以分析比较mRNA表达水平[69].所有数据都显示为平均值±SD(平均值的标准偏差)。通过T检验分析组之间的统计学显着差异(p < 0.05),使用SPSS 19.0软件(SPSS Inc., Chicago, IL, USA)。用SPSS 19.0软件测定RNA-seq组与qRT-PCR组的fold change之间的相关系数。
数据和材料的可用性
在PRJNA656182加入下,所有原始RNA序列读取数据已存入NCBI (SRA) [https://www.ncbi.nlm.nih.gov/bioproject/prjna656182.].
缩写
- SDR:
-
决定性别的地区
- PES:
-
Provasoli-enriched自然海水
- PCA:
-
主成分分析
- QRT-PCR:
-
定量反转录PCR
- 舰队指挥官:
-
Foldchange
- 邮政编码:
-
高机动组
- 度:
-
差异表达基因
- 去:
-
基因本体论
- KEGG:
-
Kyoto基因和基因组的百科全书
- FPKM:
-
每千碱基每百万分之一的碎片
- 帕特:
-
伪体变量区域
- CC:
-
蜂窝组件
- MF:
-
分子功能
- BP:
-
生物过程
- MC5E:
-
Mannuronate C5-epimerase
- MPI:
-
Mannose-6-phosphate异构酶
- PMM:
-
磷喃胺酶
- GMD:
-
GDP-mannose 6-dehydrogenase
- 液态氧:
-
脂氧合酶
- HPL:
-
氢过氧化物裂解酶
- PI3K / PI4K:
-
磷脂酰肌醇3-和4-激酶
- PtdIns:
-
磷脂酰肌醇
- PI-PLC:
-
磷酸膦酸磷脂酶C.
- PIP2:
-
磷脂酰肌醇 - (4,5) - 磷酸盐
- IP3:
-
肌醇-1,4,5-三磷酸盐
- PIP5K:
-
磷脂酰肌醇-4-磷酸5-激酶
- Rhorap:
-
GTP-activating蛋白质
- RhoGEF:
-
鸟嘌呤核苷酸交换因子
参考文献
- 1.
Coelho SM, Mignerot L, Cock JM。褐藻性别决定系统的起源与演化。新植醇。2019;222:1751-6。
- 2.
艾哈迈德S,Cock JM,Pessia E,Luthringer R,鸬鹚A,Robuchon M,等。棕色藻类中性别测定的单倍体系统Ectocarpus sp。.Curr Biol。2014; 24:1945-7。
- 3.
黄建平,张建平。陆生植物性染色体的研究进展。植物学报。植物生物学杂志。2011;62:485-514。
- 4.
Renner Ss,Ricklefs Re。Diocy及其在开花植物中的相关性。我是J机器人。1995年; 82:596-606。
- 5.
Luthringer R, Cormier A, Ahmed S, Peters AF, Cock JM, Coelho SM。褐藻的性二型性。教谕Phycol。2014;1:11-25。
- 6.
Coelho Sm,Gueno J,Lipinska AP,公鸡JM,Umen JG。UV染色体和单倍体性系统。趋势植物SCI。2018; 23:794-807。
- 7.
Mignerot L, Coelho SM。性别的起源和进化:来自一个遥远的真核生物谱系的新见解。咕咕叫医学杂志。2016;339:252-7。
- 8.
Lipinska A, Cormier A, Luthringer R, Peters AF, Corre E, Gachon CM等。褐藻的性别二型性与性别偏倚基因表达的进化Ectocarpus.中国生物医学工程学报,2015;
- 9.
Luthringer R, Lipinska AP, Roze D, Cormier A, Macaisne N, Peters AF等。褐藻U/V性染色体的假常染色体区域Ectocarpus表现出不寻常的功能。mol Biol Evol。2015; 32:2973-85。
- 10.
美联社利平斯卡,Toda NRT, Heesch S, Peters AF, Cock JM, Coelho SM。多基因运动进入和离开单倍体性染色体。基因组医学杂志。2017;18:104。
- 11.
Avia K,Lipinska AP,Mignerot L,Montecinos AE,Jamy M,Ahmed S等人。棕色藻类紫外线性染色体中的遗传多样性Ectocarpus.基因。2018;9:286。
- 12.
发现早期同配子分化的遗传基础:一个个案研究异甲酸硅.BMC基因组学。2013;14:909。
- 13.
Hu ZM,Shan Tf,张J,张QS,克里德利,Choi Hg等。中国海带水产养殖:回顾和未来的前景。Rev水上扫描。2021。https://doi.org/10.1111/raq.12524.
- 14.
王小林,姚金涛,张娟,段德立。遗传研究与育种现状Saccharina粳稻在中国。海洋湖泊。2020;38:1064-79。
- 15.
郑永红,金荣军,张学军,王全新,吴建平。海藻养殖在中国具有可观的环境效益。Stoch Environ Res Risk A. 2019; 33:1203-21。
- 16.
张L,Cui C,Li X,Zhang Z,Luo S,Liang G,等。温度对发展发展的影响Saccharina粳稻孢子体。J Appl Phycol。2013; 25:261-7。
- 17.
配子体性别决定候选基因的分离与表达分析(sjhmg)的海藻(Saccharina粳稻).J Phycol。2019;55:343-51。
- 18.
Dean R, Mank JE。性染色体在性二型中的作用:分子和表型数据之间的不一致。中国生物医学工程学报,2014;
- 19.
埃文斯LV。层压核中的一个大染色体。自然。1963年; 198:215。
- 20。
周立荣,戴建新,沈世德。一种改良的配子体染色体制备方法Laminaria japonica(Heterokontophyta)。Hydrobiologia。2004;512:141-4。
- 21。
刘y,bi y,gu j,li l,周z.棕海染色体上的女性特异性标记的定位Saccharina粳稻使用荧光原位杂交。Plos一个。2012; 7:E48784。
- 22。
张玲,崔超,李颖,吴慧,李霞。一种用于开发性别特异性DNA标记的基因组筛选方法Saccharina粳稻.应用化学学报。2018;30:1239-46。
- 23。
ingleby fc,flis我,明天呃。在整个发展中性偏见的基因表达和性冲突。寒冷的春天港口洞察力。2015; 7:17。
- 24。
rago a,werren jh,colbourne jk。性偏见的表达和开发中的共同表达网络,使用Hymenopteran纳斯诺尼亚vitripennis..公共科学图书馆麝猫。2020;16:32。
- 25。
王晓,韦伦。宝石蜂性别偏向表达的遗传和表观遗传结构纳斯诺尼亚vitripennis.和Giraulti..Proc Natl Acad Sci USA。2015; 112:E3545-54。
- 26.
Veltsos P, Fang YX, Cossins AR, Snook RR, Ritchie MG。交配系统操纵与果蝇性别偏倚基因表达的进化。Nat Commun。2017;败坏。
- 27.
孔雀鱼的性别表达在装饰性色彩的存在下是不同的。PeerJ。2018; 14。
- 28.
Pointer MA, Harrison PW, Wright AE, Mank JE。基因表达的男性化与男性性别二型性的夸大有关。公共科学图书馆麝猫。2013;9:e1003697。
- 29.
关键词:生物医学工程,生物力学,生物力学,生物力学颈圈捕蝇者性别偏倚基因表达、性别拮抗及遗传多样性水平(Ficedula Albicollis.)基因组。Mol Ecol。2018; 27:3572-81。
- 30.
Sanderson Bj,Wang L,Tiffin P,Wu ZQ,Olson Ms。性偏见的鲜花基因表达,但不是叶,揭示了中学性二态Populus Balsamifera.新植物。2019; 221:527-39。
- 31.
Bartsch I,Wiencke C,Bischof K,Buchholz Cm,Buck BH,Eggert A等。属林蛙Sensu lato :最近的见解和发展。[J] .生物医学工程学报,2008;
- 32.
单倍体期糖海带配子体发育过程中性别依赖性和非依赖性的转录变化Saccharina Latissima..Plos一个。2019; 14:e0219723。
- 33.
Motomura T,Sakai Y.被鞭打鸡蛋的发生昆布属植物angustata(Phaeophyta,Laminariales)。J phycol。1988年; 24:282-5。
- 34.
褐藻和硅藻中的氧脂素化学。Nat Prod Rep. 2002; 19:108-22。
- 35.
迈尔I,Calenberg M.细胞外CA的作用<年代up>2+和加利福尼亚州<年代up>2+-拮抗剂对雄配子的运动和化学取向异甲酸硅(Phaeophyceae)。植物BIOL。1994年; 107:451-60。
- 36.
褐藻精子的趋化运动,Saccharina粳稻和岩藻distichus.原生质。2017; 254:547-55。
- 37.
Shiba K,Baba Sa,Inoue T,Yoshida M. CA<年代up>2+突发发生在局部最小浓度的引诱剂和触发精子趋化反应。Proc Natl Acad Sci USA。2008; 105:19312-7。
- 38.
薛HW,陈X,Mei Y.植物中磷脂信号传导的功能和调节。Biochem J. 2009; 421:145-6。
- 39.
Janda M,Planchais S,Djafi N,Martinec J,Burketova L,Valentova O,等。磷甘油脂是植物激素信号转导的主球员。植物细胞代表2013; 32:839-51。
- 40。
Vigil D, Cherfils J, Rossman KL, Der CJ。Ras超家族GEFs和gap:癌症治疗的有效和可控靶点?Nat Rev Cancer. 2010; 10:842-57。
- 41。
关键词:自闭症,GTPase,调节因子,效应因子,动物模型细胞。2020;9:835。
- 42。
叶娜,张欣,苗敏,范晓,郑勇,徐丹,等。Saccharina基因组提供对海带生物学的新颖洞察力。NAT Communce。2015; 6:6986。
- 43。
姜志峰,马夏多。性别依赖的基因表达在三种新分化物种中的进化果蝇.遗传学。2009;183:1175 - 85。
- 44。
Meiklejohn CD, Parsch J, Ranz JM, Hartl DL。雄性偏倚基因表达的快速进化果蝇.Proc Natl Acad Sci USA。2003; 100:9894-9。
- 45。
Small CM, Carney GE, Mo Q, Vannucci M, Jones AG。斑马鱼性别和性腺偏向基因表达的微阵列分析:转录组男性化的证据。BMC基因组学。2009;10:579。
- 46。
哺乳动物基因表达的性别二型性。趋势麝猫。2005;21:298 - 305。
- 47。
Harkess A, Mercati F, Shan HY, Sunseri F, Falavigna A, Leebens-Mack J.性别偏倚基因在雌雄异株花园芦笋中的表达芦笋officinalis).新植物。2015; 207:883-92。
- 48。
Perry JC,哈里森PW,人类JE。性偏见基因表达的血细胞生成和演变黑腹果蝇.mol Biol Evol。2014; 31:1206-19。
- 49。
基因复制是进化中的一种主要力量。J麝猫。2013;92:155 - 61。
- 50.
Lipinska AP,Serrano-Serrano ML,鸬鹚A,Peters AF,Kogame K,Cock JM等。棕海藻类中生命周期相关基因的快速成交。基因组Biol。2019; 20:35。
- 51.
滕LH,韩文涛,范昕,徐丹,张新文,Dittami SM,等。褐藻中原核类脂氧合酶家族的进化与扩展Saccharina粳稻.前植物SCI。2017; 8:2018。
- 52.
昌PL,敦厄姆JP,Nuzhdin SV,Arbeitman Mn。细粒性别特异性转录组差异果蝇通过整个转录组测序透露。BMC基因组学。2011; 12:364。
- 53.
Martins MJF,Mota CF,Pearson Ga。棕色藻类中性偏见的基因表达岩藻vesiculosus.BMC基因组学。2013; 14:14。
- 54.
Müller DG, Gaschet E, Godfroy O, Gueno J, Cossard G, Kunert M, et al. .一种部分性别颠倒的巨藻揭示了紫外线性系统中性别分化的机制。bioRxiv。2021;433149.
- 55.
Lipinska AP,Ahmed S,Peters AF,Faugeron S,Cock JM,Coelho SM。基于PCR的标记的发展,以确定Kelps的性别。Plos一个。2015; 10:E0140535。
- 56.
Leberer E,Dignard D,Harcus D,Thomas Dy,Whiteway M.蛋白激酶同源物STE20P需要将酵母信息酮响应G蛋白βγ亚单元连接到下游信号传导组分。Embo J. 1992; 11:4815-24。
- 57.
Lacson JM,华盛顿莫里佐特。鸡肝胞质乌头酶(ACO1)的性-染色体连锁的确认。Cytogenet Genome Res. 1988;48: 245 - 5。
- 58.
张明忠,袁玲,王金生,张国根,郭文杰,张丽丽。化学杂交剂SQ-1诱导雄性不育小麦cACO基因的表达分析。中国生物化学杂志。2010;26:740-8。
- 59.
Zabka A, Polit JT, Winnicki K, Paciorek P, Juszczak J, Nowak M等。在精子发生过程中,pin2样蛋白可能参与了形态发生过程的调控轮藻寻常的.植物细胞代表2016;35:1655-69。
- 60。
宋玉平,马克富,慈丹,陈qq,田建新,张德强。通过转录组分析、激素分析和DNA甲基化分析揭示雌雄异株植物的雌雄花发育Populus tomentosa..中国生物医学工程学报,2013;
- 61。
Hughes JF, Staketsky H, Koutseva N, Pyntikova T, Page DC。哺乳动物性染色体到常染色体转位事件对抗y染色体基因丢失。基因组医学杂志。2015;16:104。
- 62。
在erbb2驱动的细胞运动中,备忘录介导了erbb2驱动的细胞运动。Nat Cell biology, 2004; 6:515-22。
- 63。
引物设计程序Primer3的增强和修改。生物信息学。2007;23:1289 - 91。
- 64。
(1) Untergasser A, Cutcutache I, Koressaar T, Ye J, Faircloth BC, Remm M, et al。primer3 -新的功能和接口。核酸研究。2012;40:e115。
- 65。
HISAT:一种低内存要求的快速拼接对准器。Nat方法。2015;12:357-60。
- 66。
Pertea M, Pertea GM, Antonescu CM, Chang T-C, Mendell JT, Salzberg SL. StringTie能够改进从RNA-seq reads重建转录组。生物科技Nat》。2015;33:290-5。
- 67。
Liao Y,Smyth GK,Shi W. FeatureCounts:用于分配序列的有效通用程序读到基因组特征。生物信息学。2014; 30:923-30。
- 68。
DESeq2对RNA-seq数据的fold change和dispersion的调节估计。基因组医学杂志。2014;15:550。
- 69。
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析<年代up>−ΔΔCT方法。方法。2001;25:402-8。
确认
作者感谢Novogene Bioinfinomatics技术,用于协助高通量测序。
资金
资助者在实验设计中没有作用,数据分析,决定发布或准备手稿。作者承认中国国家自然科学基金会(32072962,41606184),“山东省第一级渔业纪律”计划,中国山东省山东省的特殊人才计划中国农业研究体系(汽车 -50),中国国家重点研发计划(2018YFD0901500)和青岛农业大学基金会(663-1118010)。
作者信息
隶属关系
贡献
所有作者均已阅读并批准稿件。LZ设计了实验。JZ、LZ、MC和XL进行了实验、实验室工作和数据分析;YL和SL制备样品并进行了性别鉴定。
相应的作者
道德声明
伦理批准和同意参与
Saccharina粳稻配子体的选择是经过海藻物种和精英品种中心许可的。Saccharina粳稻在中国的养殖品种中分离出杂种蛋白酶体。不需要伦理批准。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
本研究中使用的PCR引物列表。
附加文件2:表S2。
基于RNA-SEQ数据的读数和映射率S. japonica.孢子体。
附加文件3:表S3。
性偏见的基因和性别特异性基因在未成熟和成熟的配子上。
附加文件4:表S4。
成熟配子体中雄性偏置基因的富集GO术语。
附加文件5:表S5。
在未成熟和成熟配子体中富集的雌性偏置基因。
附加文件6:表S6。
富集的性偏见基因在成熟的配子上的致态途径。
附加文件7:表S7。
性别特异性基因S. japonica.在不同的阶段。
附加文件8:表S8。
关于本研究中使用的配子体的信息。
附加文件9:图S1。
配子体发育过程中的相关分析(A)、主成分分析(B)和基因表达分析(C)。A,对数的Pearson相关系数的热图可视化<年代ub>2样本之间的基因表达。B,样本之间的主成分分析。X、Y轴分别表示第一个分量和第二个分量的贡献者。其中一组样本的颜色点相同。C,未成熟和成熟配子体中基因表达的比较。SIf和SIm分别代表未成熟的雌配子体和雄配子体。SMf和SMm分别代表成熟雌配子体和雄配子体。
附加文件10:图S2。
基于z分数归一化FPKM值的差异表达基因(DEGs)分级聚类。每一列代表一个组,每一行代表一个基因。蓝色表示低表达,红色表示高表达。
附加文件11:图S3。
成熟雄配子体(A)和雌配子体(B)差异表达基因(DEGs)的GO分类。X轴代表GO术语。Y轴为GO项显著性水平。
附加文件12:图S4。
在成熟期来自不同来源的大量性别偏倚基因S. japonica.(一个,男;B,女性)和中Ectocarpussp。(c,雄性; d,女性)。
附加文件13:图S5。
用qRT-PCR验证雄性特异性基因的表达。(1)基因ID: SJ00948-kinase domain protein(2)基因ID: SJ04462-unknown;(3)基因ID: SJ05808-高迁移率组蛋白;(4)基因ID: SJ10505-aconitate水合酶;(5)基因标识:SJ13170-Ankyrin重复蛋白;(6)基因ID: sj15019 plant transposon protein;(7)基因ID: SJ16842-unknown;(8)基因ID: SJ21771-unknown。SIf:未成熟的雌配子体;SIm:未成熟的雄性配子体; SMf: mature female gametophytes; SMm: mature male gametophytes.
附加文件14:图S6。
基因复制性偏置基因分享S. japonica.和E。sp。
附加文件15:图S7。
特定性别偏见基因的富集途径(A,男性;C,女性)和新进化的性别偏见基因(B,男性;D,女性)S. japonica.成熟的孢子体。星号表示显著差异(Padj.<0.05)
附加文件16:图S8
.本研究的培养方法与策略。
额外的文件17。
本研究中新的预测基因注释信息。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张静,李勇,罗松。等等。配子体发育过程中的差异基因表达模式提供了在Diaticous海带中的性别分化中的见解Saccharina粳稻.BMC植物杂志21,335(2021)。https://doi.org/10.1186/s12870-021-03117-0.
收到了<年代pan class="u-hide">:
接受<年代pan class="u-hide">:
发表<年代pan class="u-hide">:
关键词
- 性别分化
- Dioicy.
- 褐藻
- Saccharina粳稻
- 性偏见基因
- 特定性别基因
- 两性异形