- 研究gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
代谢组和转录组分析揭示了青苹果皮中花青素积累的光和uv - b反应途径gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba, 文章编号:gydF4y2Ba351.gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
本质上,绿苹果与叶绿素的积累有关,而红苹果品种与花青素积累有关。值得注意的是,在这项研究中,用紫外线-B(UV-B)处理的绿色皮肤彩色苹果品种“白冬季Pearmain”表现出红色皮肤并显着的花青素积累,而可见光不能。但是,通过可见光和UV-B处理,少数关于青苹果中的花青素的生物合成差异。在这里,我们通过转录组和代谢探讨了绿色苹果中代谢物和基因表达水平的差异。gydF4y2Ba
结果gydF4y2Ba
代谢分析表明,与对照相比,可见光和UV-B处理的青苹果中有152和178显着变化了代谢物,而黄酮,黄酮和花青素最显着增加;转录组分析表明,37,110和37,709个差异表达基因,其中包括382和475个转录因子(TFS),分别在光和UV-B-处理果实中检测。定量逆转录PCR(QRT-PCR)结果证实了编码在类黄酮合成途径中涉及的代谢物的基因表达水平的变化。与在轻微处理下,UV-B治疗中的类黄酮代谢通量增加了Cyanidin 3-葡糖苷和Cyanidin 3,5-葡糖苷3,5-千兆糖苷的积累。此外,我们对花青素生物合成基因进行了QRT-PCR分析,并预测了基因gydF4y2BaMD00G1134400.gydF4y2Ba(UDP - gluc- flavonoid 3 - 0- glucsyltransferase)可能是在uv - b处理的果实中富集和高表达花青素的候选基因。MYB、bHLH、NAC等家族转录因子的表达谱与花色苷含量高度相关。gydF4y2Ba
结论gydF4y2Ba
紫外线治疗中绿苹果中花青素的组成和含量非常大。通过组合分析代谢物和转录组的组合分析,揭示了一系列代谢物和候选基因。这些结果提供了用于响应可见光和UV-B光的候选基因和用于治疗绿色苹果颜色形成的候选基因和分子基的重要数据。gydF4y2Ba
背景gydF4y2Ba
近年来,由于他们有吸引力的外表及其报告的营养价值,红苹果引起了消费者的关注[gydF4y2Ba1gydF4y2Ba那gydF4y2Ba2gydF4y2Ba]。“富士”等红苹果品种[gydF4y2Ba3.gydF4y2Ba和《财富》[gydF4y2Ba4.gydF4y2Ba]可以合成大量的花青素,并优选更多的消费者。相反,绿色苹果不能在天然生长期间合成花青素,使它们主要表现出绿色或黄色的颜色,例如“白冬季珠穆兰”[gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba6.gydF4y2Ba]和“mutsu”[gydF4y2Ba4.gydF4y2Ba]苹果品种。gydF4y2Ba
每年,在苹果生长季节,特别是在生长后期,阳光在果实颜色的形成中起着重要的作用[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba8.gydF4y2Ba那gydF4y2Ba9.gydF4y2Ba]。在中国,纸袋是一种适用于苹果或梨果生产的工具[gydF4y2Ba10.gydF4y2Ba那gydF4y2Ba11.gydF4y2Ba那gydF4y2Ba12.gydF4y2Ba],不仅可以控制昆虫和鸟类害虫,还可以增强红果品种的红色色素沉着在果实生长的后期[gydF4y2Ba7.gydF4y2Ba]。此外,由于光照强度和环境温度的不同,一个水果品种的红色色素沉着程度在几年的时间里会在一个地点发生显著变化。早期研究表明,光和UV-B (UV-B)辐射通过调控红皮果实花色苷生物合成途径关键酶的活性和基因转录水平来调控花色苷的合成[gydF4y2Ba13.gydF4y2Ba那gydF4y2Ba14.gydF4y2Ba那gydF4y2Ba15.gydF4y2Ba]。此外,与果皮中的高温相比,降低温度对花青素合成更有益[gydF4y2Ba15.gydF4y2Ba]。一些研究人员试图用高通量技术阐明水果着色的机制[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba9.gydF4y2Ba那gydF4y2Ba13.gydF4y2Ba]。然而,迄今为止,可见光和UV-B对苹果红皮色和绿皮色果实着色的影响及其分子基础研究较少。gydF4y2Ba
红苹果品种的红色着色是由于外果皮中花青素的合成[gydF4y2Ba4.gydF4y2Ba那gydF4y2Ba15.gydF4y2Ba]。花青素是通过类黄酮生物合成途径合成的,花青素的生物合成涉及几种关键酶和编码这些酶的基因表达,主要包括苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮-3-羟化酶(F3H)、二氢黄酮醇4-还原酶(DFR),花青素合成酶(ANS),和udp -葡萄糖:类黄酮3-葡萄糖基转移酶(UFGT) [gydF4y2Ba16.gydF4y2Ba]。调节编码这些酶的基因由R2R3-MYB,碱性螺旋环 - 螺旋和WD40形成的蛋白质复合物调节[gydF4y2Ba17.gydF4y2Ba]。复合物诱导基因表达通过与结构基因的启动子结合[gydF4y2Ba18.gydF4y2Ba]。在许多物种中,MYB转录因子(TFs)被认为对花青素生物合成相关基因的激活至关重要。在苹果,gydF4y2Bamdmyb1.gydF4y2Ba和gydF4y2BaMdMYB10gydF4y2Ba在果皮中充当花青素生物合成的阳性TFS [gydF4y2Ba19.gydF4y2Ba那gydF4y2Ba20.gydF4y2Ba),而gydF4y2BaMDBHLH3gydF4y2Ba在花青素生物合成过程中起调节作用[gydF4y2Ba21.gydF4y2Ba]。虽然对苹果果实着色的研究主要集中在红色品种上,但很少有人研究绿色品种,特别是青苹果品种对可见光和UV-B暴露的响应。因此,研究可见光和UV-B诱导青苹果品种花青素合成的潜在机制至关重要。gydF4y2Ba
In the present study, we reported the anthocyanin accumulation by metabolome and transcriptome analyses in ‘white winter pearmain’ apple fruit peel samples treated with artificial visible light (63 h), artificial UV-B radiation (63 h), and a control (CK, bagged fruit stored in the dark for 63 h) after harvesting. Based on an integrated analysis of the differential metabolites and gene expression levels, we identified the metabolites involved in visible light and UV-B-responsive reactions, and analyzed the differential regulation of structural genes involved in anthocyanins biosynthesis. The result of the present study could elucidate further the mechanisms by which visible light and UV-B regulate anthocyanin biosynthesis in apple. In addition, the metabolomic and transcriptomic data obtained would offer basic data that would facilitate further investigations on the influence of visible light- and UV-B-induced fruit coloration in green apple varieties.
结果gydF4y2Ba
“白冬季珠穆兰”水果果皮中水果色素沉着图案的变化gydF4y2Ba
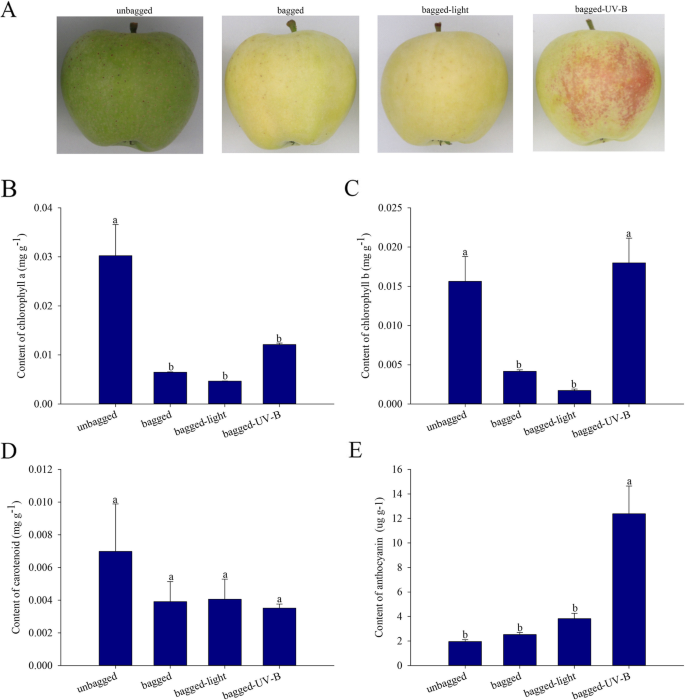
在对实验室和目视检查的运输之后,未燃烧的“白冬季珠穆兰”水果是绿色的,袋装果实淡黄色。此外,从袋中除去并进行光处理的水果在63小时后浅黄色,而从袋中除去并进行UV-B辐射处理的水果在63小时后被红色(图。gydF4y2Ba1gydF4y2Ba一种)。红光化伴随着花青素浓度的增加。此外,袋装和光处理果实中的类胡萝卜素,叶绿素A和叶绿素B的内容非常低,而用UV-B辐射处理后,叶绿素B和花青素累积水平显着增加(图。gydF4y2Ba1gydF4y2Ba是)。gydF4y2Ba
光、UV-B和CK剥皮处理的代谢差异gydF4y2Ba
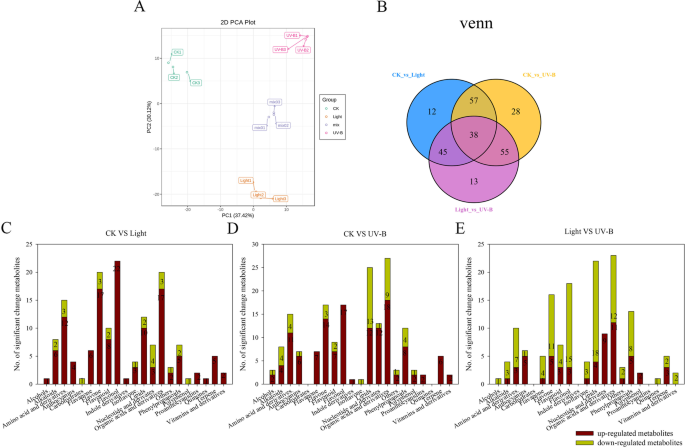
为了比较光处理、UV-B处理和CK处理的果皮代谢产物组成的差异,对果皮样品进行LC-MS /MS分析。本研究在248个代谢产物中,鉴定并定量了苹果皮中主要的苯丙烷代谢途径黄酮类化合物58个和花青素8个(见表)gydF4y2BaS2gydF4y2Ba).主成分分析(PCA)显示CK,LIGHT和UV-B处理在PC1-PC2得分图中清楚地分离(图。gydF4y2Ba2gydF4y2Ba一种)。另外,数据集的VENN图显示,在CK和UV-B辐射处理之间以及光和UV-B辐射处理之间,在CK和光处理之间差异地表达210代谢物在CK和光处理之间表达(图。gydF4y2Ba2gydF4y2BaB).在苹果皮中鉴定出的248个代谢物中,光处理和UV-B处理中分别有152个和178个(61.3和71.8%)与CK处理相比变化显著。与CK处理相比,光处理和UV-B处理分别有127和133个代谢物上调,25和45个代谢物下调(图2)。gydF4y2Ba2gydF4y2Bac - d)。此外,与光处理相比,UV-B处理中有57个代谢物上调,94个代谢物下调(图1)。gydF4y2Ba2gydF4y2Bae)。gydF4y2Ba
光和uv - b处理下的代谢途径和代谢产物分析gydF4y2Ba
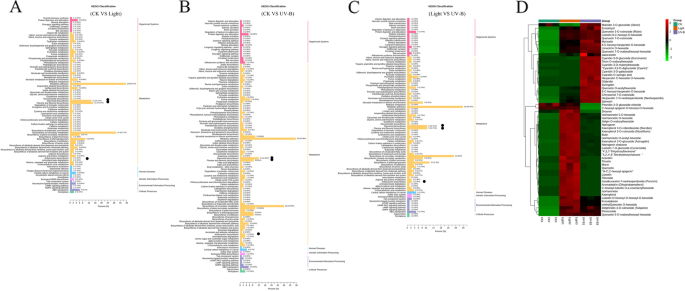
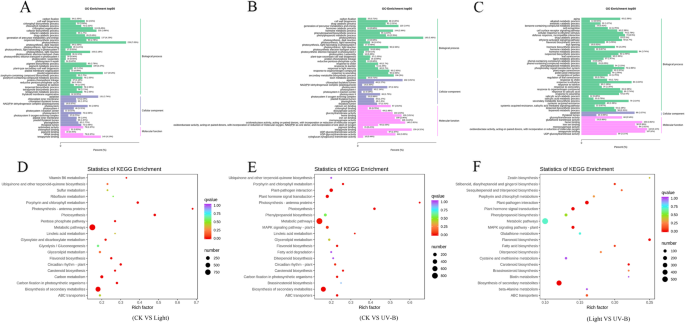
为鉴别光照、UV-B与对照、UV-B与光照下果皮的不同代谢物,对上述材料进行了代谢比较。KEGG途径富集分析显示,变化显著的代谢物主要富集在“苯丙类代谢过程”中,包括类黄酮生物合成、黄酮生物合成、黄酮生物合成、黄酮醇生物合成和花青素生物合成(图)。gydF4y2Ba3.gydF4y2Baa - c)。从代谢组数据中筛选出50种类黄酮和8种花青素,类黄酮和虾青素代谢产物变化显著,用于热图分析(图2)。gydF4y2Ba3.gydF4y2BaD,表gydF4y2BaS3.gydF4y2Ba).结果表明,在可见光和UV-B诱导下,与黄酮类和花青素相关的化合物如花青素3,5- o -二葡萄糖苷、花青素3- o -半乳糖苷、飞翠素3- o -芦丁苷、槲皮素等明显增多。gydF4y2Ba
果皮中基因的差异表达gydF4y2Ba
为了鉴定光、UV-B和CK处理之间的差异表达基因(DEGs),进行转录组学比较。PCA评分和基因表达的维恩图显示了数据的有效性(图)gydF4y2BaS1gydF4y2Ba).基于折叠变化≥2和FDR <0.05标准,在光线和UV-B处理中鉴定了37,110和37,709℃,分别与CK分别相比,显着上调了3469和4212个基因(表gydF4y2BaS4gydF4y2Baa - b)。此外,与光照相比,UV-B检测到37590个DEGs, 2762个基因显著上调(表)gydF4y2BaS4gydF4y2Bac).氧化石墨烯富集前50位的3355、3428和2659 DEGs分析表明,三大生物过程分别为生物过程、细胞组分和分子功能。在分子功能领域,DEGs具有丰富的催化活性和结合活性。在细胞成分域中,大多数DEGs富集于质外体、叶绿体、质体和类囊体管腔四种类型(图1)。gydF4y2Ba4.gydF4y2Baa - c)。Kegg途径浓缩分析显示,DEG主要富集在各种代谢过程中,包括类黄酮生物合成和次生代谢生物合成(图。gydF4y2Ba4.gydF4y2BaD-F)。gydF4y2Ba
黄酮类化合物和花青素生物合成的变化gydF4y2Ba
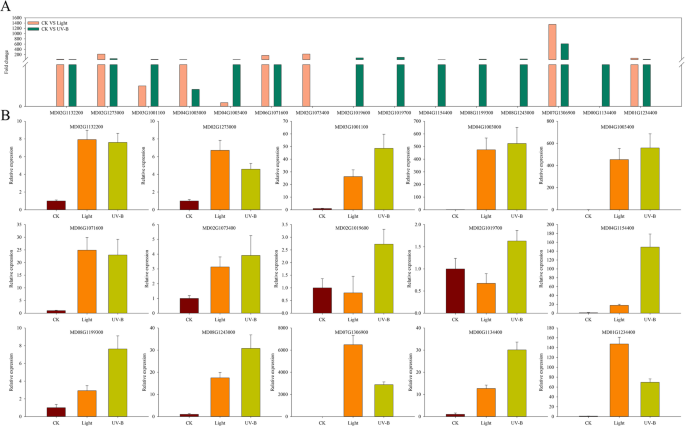
转录组数据显示,通过光和UV-B辐射处理差异诱导黄酮类化合物和花青素生物合成基因(图。gydF4y2Ba5.gydF4y2BaA).我们选择了15个表达显著不同的基因来验证转录组分析的结果。qRT-PCR结果显示,15个基因中有10个在UV-B下表达水平高于光处理。特别是,表达的水平gydF4y2BaMD00G1134400.gydF4y2Ba, 一种gydF4y2BaUFGTgydF4y2BaUV-B处理增强了上述结构酶在苹果花青素生物合成中的需求。gydF4y2Ba5.gydF4y2BaB)。gydF4y2Ba
代谢组和转录组数据集的整合分析gydF4y2Ba
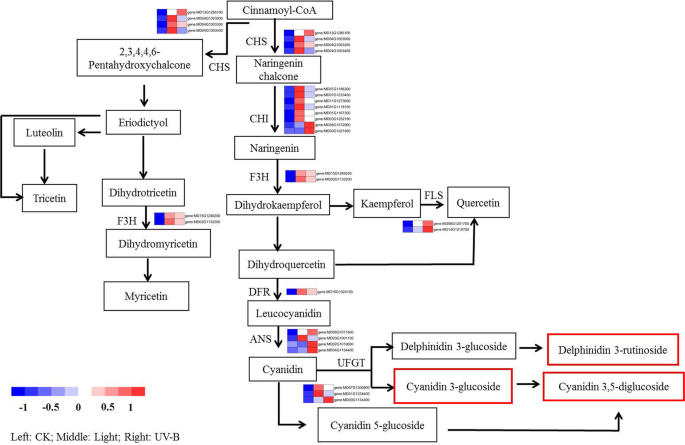
为揭示光照和UV-B辐射下果皮中类黄酮和花青素合成增强的调控机制,研究了58个代谢产物(类黄酮生物合成,50;和花青素代谢,8)和30 DEGs(类黄酮生物合成,27;和花青素代谢,3)进行进一步分析(图。gydF4y2Ba6.gydF4y2Ba).尽管在光和UV-B辐射处理下,果皮中检测到大量的类黄酮(见表)gydF4y2BaS3.gydF4y2Ba),UV-B辐射诱导比光处理更高的花青素浓度(图。gydF4y2Ba1gydF4y2BaA).特别是发生变化的化合物,包括花青素3,5 - o -二葡萄糖苷(cyanidin)和花青素3- o -葡萄糖苷(cyanidin 3- o -glucoside, kuromanin),在UV-B处理下比在可见光处理下显着更高的丰度(见表)gydF4y2BaS3.gydF4y2Ba).此外,我们根据其在苹果类黄酮生物合成途径中的对应位置,对30个deg进行了排列(图)。gydF4y2Ba6.gydF4y2Ba).其中,有些gydF4y2BaMdCHSgydF4y2Ba那gydF4y2BaMdCHIgydF4y2Ba那gydF4y2Bamdf3.gydF4y2Ba那gydF4y2BaMDFLgydF4y2Ba那gydF4y2BaMdDFRgydF4y2Ba那gydF4y2BaMdANSgydF4y2Ba, 和gydF4y2BaMdUFGTgydF4y2Ba同源物表现出不同的表达水平。gydF4y2Ba
花青素生物合成基因在果皮中的差异表达gydF4y2Ba
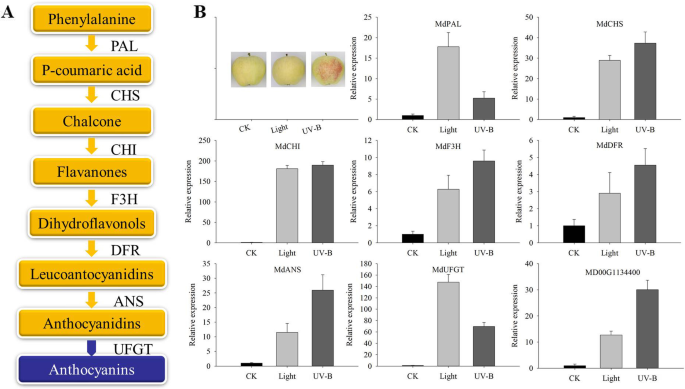
研究的皮肤中的花青素是通过类黄酮途径生物合成的(图。gydF4y2Ba7.gydF4y2Ba一种)。为了确定花青素生物合成基因在光和UV-B条件下的作用,分析了其生物合成中涉及其生物合成的基因的表达模式。在光和UV-B响应基因中观察到显着的表达变化。Pearson的相关性分析表明,转录组验证效果中的基因表达水平与报告的花青素生物合成相关基因的转录水平显着相关(gydF4y2BaP.gydF4y2Ba < 0.05, andP.gydF4y2Ba < 0.01) by light and UV-B treatment in apple peel (Table1gydF4y2Ba).我们进一步对报告的相关基因和候选基因进行了QRT-PCR分析。结果表明,大多数基因,如gydF4y2BaMdCHSgydF4y2Ba那gydF4y2Bamdf3.gydF4y2Ba那gydF4y2BaMdDFRgydF4y2Ba那gydF4y2BaMdANSgydF4y2Ba, 和gydF4y2BaMD00G1134400.gydF4y2Ba对UV-B诱导更敏感(图gydF4y2Ba7.gydF4y2BaB).结果表明,在青苹果中,UV-B诱导的花青素合成的贡献可能大于可见光。gydF4y2Ba
花青素在苹果中的生物合成途径。gydF4y2Ba一种gydF4y2Ba花青素生物合成途径的关键基因。gydF4y2BaB.gydF4y2BaQRT-PCR结果显示果皮中的黑暗(CK),可见光和UV-B辐射处理下的8个花青素相关基因的表达水平。PAL,苯丙氨酸氨酶,XM008357397;CHS,Chalcone合成酶,XM029091251;Chi,Chalcone异构酶,XM008394013;F3h,柚皮素3-二氧化根酶,AB074486;DFR,二氢萘酚4-还原酶,AY227728;ans,花青素合成酶,ab074487;UFGT,UDP葡萄糖 - 黄酮3-0-葡糖基转移酶,MD01G1234400gydF4y2Ba
转录因子(TF)和光信号转导相关基因的光 - ,UV-B响应gydF4y2Ba
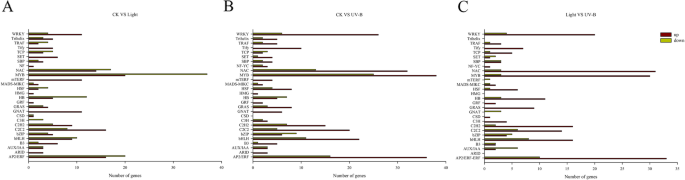
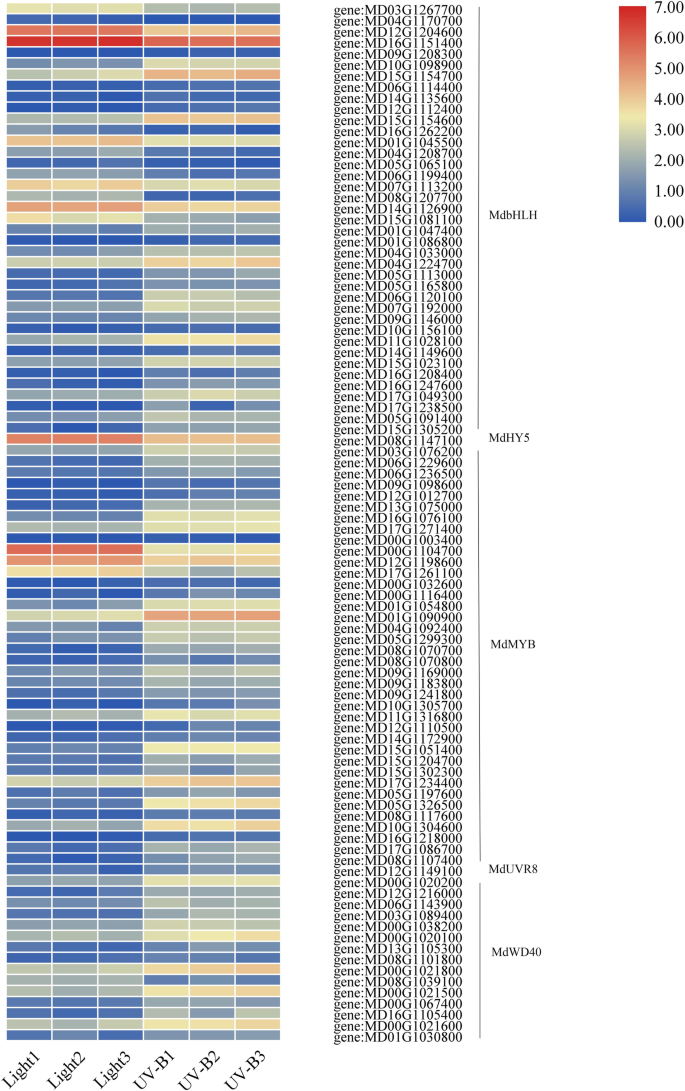
与对照相比,光处理和UV-B处理分别鉴定出52个TF家族的382个差异转录因子,59个TF家族的475个差异转录因子。UV-B处理与光处理相比,鉴定出48个TF家族的346个差异转录因子(表)gydF4y2BaS5gydF4y2Ba).此外,我们观察到了28种TF系列的上调和下调,既受光和UV-B辐射处理调节,包括WRKY,NAC,MYB,BHLH和AP2 / ERF系列(图。gydF4y2Ba8.gydF4y2Ba).虽然在光和UV-B辐射处理之间观察到相当类似的TFS数量,但大多数TFS在UV-B中升高。在基因组中,AP2 / ERF是具有47个成员的最大家庭,其次是MyB,NAC,BHLH和Wrky系列,分别在UV-B治疗中有46,45,33和32个成员(图。gydF4y2Ba8.gydF4y2BaB,表gydF4y2BaS5gydF4y2Ba).UV-B处理的TFs数量较光处理显著增加(图4)。gydF4y2Ba8.gydF4y2BaC).结果表明,UV-B可能通过上调TFs而增加花青素的积累。gydF4y2Ba
此外,MYB、bHLH和WD40组基因在UV-B处理下转录水平普遍较高,且UV-B处理与花青素含量呈现相同趋势。在这里,我们发现gydF4y2Bamdhy5.gydF4y2Ba(MD08G1147100)基因的转录。的转录水平gydF4y2Bamdhy5.gydF4y2Ba在苹果中的UV-B处理下减少,与花青素水平差相差。但是,成绩单丰富gydF4y2Bamduvr8.gydF4y2Ba(MD12G1149100)与花青素含量一致,UV-B诱导表达gydF4y2Bamduvr8.gydF4y2Ba与光处理相比,苹果的光合速率(图。gydF4y2Ba9.gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
套袋、未套袋、人工光和uv处理苹果果实的着色gydF4y2Ba
光和UV-B辐射均可诱导红苹果果实变色[gydF4y2Ba22.gydF4y2Ba那gydF4y2Ba23.gydF4y2Ba]。在自然界中,红苹果品种能合成花青素,花青素呈红色,且受阳光影响显著。相反,青苹果不能合成花青素,即使暴露在阳光下也会呈现绿色[gydF4y2Ba24.gydF4y2Ba]。然而,鲜有研究探讨青苹果果实品种对可见光和UV-B辐射的响应。先前的研究表明套袋可以促进水果着色[gydF4y2Ba7.gydF4y2Ba]。因此,我们在开发过程中对‘白冬梨主’苹果进行了套袋。我们观察到,长时间暴露在UV-B辐射下可以诱导青苹果变色,而长时间暴露在可见光下则没有影响(图2)。gydF4y2Ba1gydF4y2Ba).结果表明,绿苹果可以在类似于红苹果的UV-B诱导下合成红色颜料。gydF4y2Ba
参与可见光和UV-B辐射下着色诱导的代谢物gydF4y2Ba
以前的研究报道说,阳光影响水果的生理变化[gydF4y2Ba11.gydF4y2Ba那gydF4y2Ba25.gydF4y2Ba]。特别是,阳光影响果实成熟后期酚的合成[gydF4y2Ba26.gydF4y2Ba]建议阳光在水果开发中发挥着重要作用。有证据表明在暴露于阳光下的水果中的花青素和黄酮类化合物的增加,并且对阳光的适应性可能对红苹果品种的生长产生积极影响[gydF4y2Ba9.gydF4y2Ba]。然而,绿色水果品种在阳光照射下对花青素合成没有反应[gydF4y2Ba26.gydF4y2Ba]。在本研究中,可见光和UV-B辐射可以增加果实中代谢物的积累,主要是在氨基酸及其衍生物的代谢途径中,以及花青素,黄酮类黄酮(黄酮和黄酮)的代谢途径,脂质和有机酸及其衍生物。特别地,在黄酮类代谢途径中涉及的代谢产物显着上调(图。gydF4y2Ba2gydF4y2BaKEGG分析表明,可见光和UV-B辐射可以诱导代谢和生物合成途径,特别是类黄酮和花青素的生物合成途径(图2)。gydF4y2Ba3.gydF4y2Baa,b)。另外,可见光和UV-B辐射诱导不同类黄酮的合成,58代谢物中的花青素(图。gydF4y2Ba3.gydF4y2Bad)。结果表明可见光和UV-B辐射处理之间的代谢物合成存在显着差异。进一步鉴定了与代谢物数据中的花青素生物合成途径相关的代谢物,并且观察到可见光和UV-B辐射可诱导蛋白苷3-芦丁苷和Cyanidin 3-葡糖苷的合成,但只能诱导UV-B治疗形成花青蛋白3,5-吡葡糖苷(图。gydF4y2Ba6.gydF4y2Ba, 桌子gydF4y2BaS3.gydF4y2Ba).值得注意的是,Cyanidin 3,5-千葡糖苷是玫瑰花朵中的显性花青素[gydF4y2Ba27gydF4y2Ba]。在本研究中,Cyanidin 3-葡糖苷和Cyanidin 3,5-千葡糖苷是用UV-B辐射处理的果实中的主要花青素组分。此外,Cyanidin 3,5-千葡糖苷的浓度为12.3倍浓度的花青蛋白3-葡糖苷。相反,轻微的方法略微增加了Cyanidin 3-葡糖苷浓度,并没有增强Cyanidin 3,5-千兆糖苷的产生,这表明红色肤色可能归因于Cyanidin 3,5-葡糖苷的较高水平。gydF4y2Ba
差异表达基因和其他转录因子与果实着色有关gydF4y2Ba
阳光通过调节植物基因表达促进不同代谢化合物的积累[gydF4y2Ba28gydF4y2Ba]。几项研究表明,光通过在花青素生物合成途径中表达关键酶基因来诱导花青素合成[gydF4y2Ba16.gydF4y2Ba那gydF4y2Ba29gydF4y2Ba]。此外,已经研究了与花青素相关的许多转录因子,例如MDMYB1和MDMYB10 [gydF4y2Ba19.gydF4y2Ba那gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba30.gydF4y2Ba那gydF4y2Ba31gydF4y2Ba]。在本研究中,GO和KEGG分析显示,可见光和UV-B辐射处理下的基因表达变化主要是代谢途径和次级代谢物途径,特别是黄酮合成途径(结果与代谢物数据一致) (图。gydF4y2Ba4.gydF4y2Ba).转录组数据显示,参与类黄酮生物合成的15个基因中,有6个基因同时受到可见光和UV-B辐射的诱导,其中一个基因受到光的显著诱导,另外5个基因受到UV-B的显著诱导。此外,有3个基因与花青素合成途径密切相关,均受光和UV-B诱导。GenBank分析表明,这3个基因属于同一基因家族——UFGT。目前已有多篇研究报道MD01G1234400功能(GenBank: AF117267),受UV-B和温度调控[gydF4y2Ba15.gydF4y2Ba]。结果表明,MD01G1234400、MD07G1306900和MD00G1134400是由可见光和UV-B辐射诱导的。其中,UV-B诱导MD00G1134400表达更明显。采用qRT-PCR验证基因表达,结果与转录组数据一致(图2)。gydF4y2Ba5.gydF4y2BaB)。gydF4y2Ba
我们在分析了可见光和UV-B辐射对类黄酮生物合成途径中代谢物和基因表达的分析中的代谢组和转录组技术。我们确定了30次,包括gydF4y2BaMdCHSgydF4y2Ba那gydF4y2BaMdCHIgydF4y2Ba那gydF4y2Bamdf3.gydF4y2Ba那gydF4y2BaMDFLgydF4y2Ba那gydF4y2BaMdDFRgydF4y2Ba那gydF4y2BaMdANSgydF4y2Ba, 和gydF4y2BaMdUFGTgydF4y2Ba它们对可见光和UV-B辐射都有反应。gydF4y2Ba6.gydF4y2Ba).此外,可见光和UV-B辐射诱导TF家族基因的表达,主要包括MYB、bHLH和WRKY。特别是UV-B辐射诱导的TFs数量和转录水平显著(图2)。gydF4y2Ba8.gydF4y2Ba和gydF4y2Ba9.gydF4y2Ba).结果表明,光和UV-B在苯丙烷的合成中发挥着重要作用,尤其是在类黄酮和花青素的合成途径中,而UV-B在青苹果果实中的作用最为明显。gydF4y2Ba
花青素生物合成中基因的差异调节gydF4y2Ba
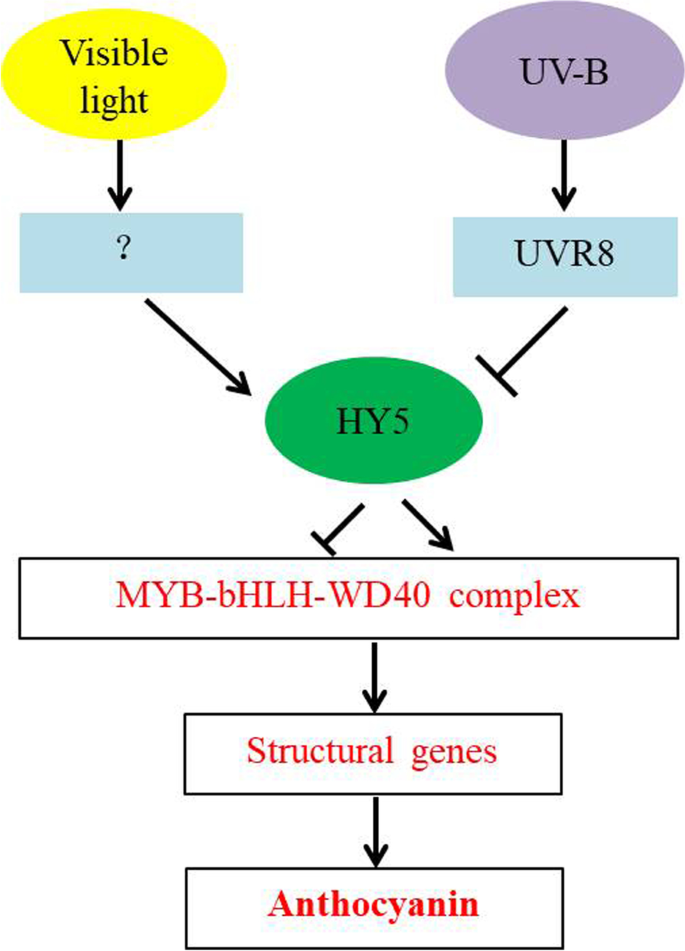
花青素主要通过类黄酮生物合成途径合成[gydF4y2Ba32gydF4y2Ba]。近年来,许多研究探索了关键酶基因,涉及花青素合成。以前的研究报道说,花青素合成途径基因受到“富士”苹果的阳光[gydF4y2Ba3.gydF4y2Ba那gydF4y2Ba9.gydF4y2Ba]。Ubi等人。[gydF4y2Ba15.gydF4y2Ba]表明该基因由低温强烈诱导。为了验证花青素生物合成途径中的关键酶基因受到绿苹果中可见光和UV-B辐射的影响,我们分析了相关基因的表达。根据结果,可见光和UV-B辐射均可诱导花青素生物合成途径中的基因表达。特别地,UV-B辐射诱导下游的基因表达(图。gydF4y2Ba7.gydF4y2Ba).代谢组和转录组分析结果显示UV-B诱导青花青蛋白如青春蛋白3,5-葡萄糖苷的表达,以及所涉及的候选基因的鉴定需要进一步的探索。相关性分析证实,转录组中的黄酮和花青素相关基因与报道的花青素生物合成基因密切相关(表gydF4y2Ba1gydF4y2Ba).因此,可以认为这些基因与苹果在UV-B环境下花青素的生物合成有关。在这项研究中,青苹果水果治疗使用可见光和紫外线辐射,和这些结果提供理论依据,促进理解光和紫外线的影响绿色水果,并提供新颖的见解,可以促进花青素合成基因的挖掘(无花果。gydF4y2Ba10.gydF4y2Ba).gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们分析了“白色冬季梨主”苹果果皮在收获和暴露于可见光和UV-B辐射后的代谢组和转录组。通过对差异代谢物和基因表达水平的综合分析,我们鉴定了参与可见光和UV-B响应的代谢物,并进一步利用qRT-PCR分析了参与花青素生物合成的基因的差异表达。通过转录组数据挖掘,我们发现一个苹果UDP葡萄糖类黄酮3 - 0-葡萄糖基转移酶基因Md00G1134400在青苹果果实中差异表达参与花青素生物合成的uv - b响应。综上所述,uv - b诱导的青苹果红色可能是通过调控uv - b响应信号UVR8和MBW复合物成员来调控花青素生物合成结构基因的转录表达。因此,我们的研究结果为UV-B辐射下绿色水果中花青素代谢产物的合成和基本基因表达网络提供了思路。进一步的基因功能验证工作需要深入了解青苹果果实着色的遗传和分子机制。gydF4y2Ba
材料和方法gydF4y2Ba
植物材料与实验gydF4y2Ba
“白冬季Pearmain”苹果果实是从中国山东省泰安商用果园获得的。共有150个生品,在全开花(DAFB)后45天用双层黄色黑纸袋覆盖。在收获前(160 dafb)之前,水果仍然袋装,并随着剩余的未爆破的水果运送到实验室。人造可见光处理(暴露于可见光的袋装水果[300-320μmolm-2 s-1])置于约10cm(苹果表面到可见光灯),光的波长为400-700nm,以及人造UV-B处理的果实(暴露于UV-B辐射的袋装水果[10-12 kJ m-2 s-1])被置于约25cm(苹果表面至uv-b灯),UV-B灯的波长为313nm。在室温(21°C)的袋子去除后63小时对63小时进行上述两组处理,每次治疗有三个生物重复,每次重复都有20个果实。将对照组(30水果)包括在黑暗中保持63小时的袋装果实。将果皮刮擦并立即收集,在液氮中快速冷冻,并储存在-80℃的冰箱中。三个苹果用于每种治疗,三个重复。 The phenotypes of the unbagged, bagged, bagged-light treatment, and bagged-UV-B treatment fruit were observed and recorded.
叶绿素,类胡萝卜素和总花青素浓度的测量gydF4y2Ba
在室温(21°C)下,在黑暗中使用3ml 95%乙醇从果皮样品(0.3 g)中提取色素,直到果皮组织完全按照前面描述的方法漂白[gydF4y2Ba33gydF4y2Ba]微小修改。将提取物以8000×离心 ggydF4y2Ba2分钟,并收集上清液,并使用665nm,649nm和470nm的UV-1780分光光度计(Shimadzu,日本)测量它们的吸光度。计算叶绿素浓度的公式如下:叶绿素A = 13.95 * A665 - 6.88 * A649;叶绿素B = 24.96 * A649 - 7.32 * A665。用于计算类胡萝卜素浓度的式如下:胡萝卜素=(1000 * A470-2.05 * CA - 114.8 * CB)/ 245,结果表示为MG G.gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
在根据先前描述的[中,在3mL 95%甲醇中在3ml 95%甲醇中的0.3g冷冻的剥离组织(85:15),在4℃下在4℃下萃取花青素。[gydF4y2Ba34gydF4y2Ba]微小修改。提取物以12,000×离心 ggydF4y2Ba收集上清,在530、620和650 nm处使用UV-1780分光光度计进行分析。花青素浓度计算公式为:46,200*[(A530 -A620)-0.1*(A650-A620)],用ug g表示gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
RNA-Seq分析,cDNA合成,数据分析gydF4y2Ba
从CK的果皮中提取总RNA,使用RNA文库预备套件(天根,中国)进行光和UV-B处理样品和cDNA合成。收集至少三种生物重复并混合。RNA-SEQ和数据分析由Metuke Biotechnology Co.,Ltd。(武汉,中国)进行[gydF4y2Ba35gydF4y2Ba那gydF4y2Ba36gydF4y2Ba那gydF4y2Ba37gydF4y2Ba那gydF4y2Ba38gydF4y2Ba那gydF4y2Ba39gydF4y2Ba那gydF4y2Ba40gydF4y2Ba那gydF4y2Ba41gydF4y2Ba那gydF4y2Ba42gydF4y2Ba那gydF4y2Ba43gydF4y2Ba]基于现有的遗传数据库,包括NCBI非冗余蛋白数据库、SwissProt数据库、TrEMBL数据库、Pfam数据库、KOG数据库、KEGG数据库和GO数据库,基于log2倍变化> 1,以及假发现率(FDR) < 0.05。实验重复了三次。gydF4y2Ba
多反应监测(MRM)gydF4y2Ba
多反应监测(MRM)由武汉迈特生物科技有限公司进行。将冻干的苹果皮在30hz下使用MM 400混合磨粉碎1.5分钟。称量粉末(100mg),在4°C下提取过夜。离心10000次后gydF4y2BaggydF4y2Ba10 min后,提取液被吸收并过滤。样品萃取物采用液相色谱-串联质谱(LC-MS /MS)系统(HPLC, HPLC, SHIMADZU CBM30A, SHIMADZU CBM30A, SHIMADZU CBM30A, SHIMADZU CBM30A, SHIMADZU CBM30A, SHIMADZU CBM30A)gydF4y2Bahttps://www.shimadzu.com.cn/gydF4y2Ba;MS/MS,串联质谱,Applied Biosystems 6500 QTRAPgydF4y2Bahttp://www.appliedbiosystems.com.cn/gydF4y2Ba).分析条件如下:HPLC:柱,水处理UPLC HSS T3 C18(1.8μm,2.1mm×100mm);溶剂系统,水(0.04%乙酸):乙腈(0.04%乙酸);梯度计划,95:5 v / v 0 min,在11.0分钟,5:95 v / v,5:95 v / v在12.0 min,95:5 v / v,95:5 v / v处,95:5 v / v at15.0分钟;流速,0.4毫升/分钟;温度40°C;注射体积:2μL。质谱条件主要包括500℃的电喷雾电离(ESI)温度,质谱电压为5500V,帘式气体压力为25psi,碰撞激活的解离参数设置为高。在三重四极杆质谱仪中,根据优化的降解潜力和碰撞能量扫描每个离子对[gydF4y2Ba44gydF4y2Ba]。根据在每个时期内洗脱的代谢物,监测一组特定的MRM转变。对每个治疗进行3个重复的MRM。实验重复了三次。gydF4y2Ba
RNA提取,DNA测序,实时定量逆转录(qRT-PCR)分析gydF4y2Ba
用总RNA分离系统(中国北京天根)提取-80°C冰箱保存的样本。使用第一链cDNA Synthesis Kit (Tiangen, Beijing, China)合成第一链cDNA。从‘白冬梨主’cDNA中分离得到基因的全长编码序列。根据MIQE指南进行实时定量逆转录(qRT-PCR)分析[gydF4y2Ba45gydF4y2Ba那gydF4y2Ba46gydF4y2Ba]。采用SYBR Real Master Mix (Transgen,中国北京)在Bio-Rad CFX96TM Real-time PCR系统上进行qRT-PCR, PCR热循环条件如下:95℃预变性30 s;95°C 5 s, 60°C 15 s, 72°C 20 s共39个循环。MdActin (GenBank登录号:AB638619)作为管家基因。所使用引物的序列列于补充表gydF4y2BaS1gydF4y2Ba.对每个基因进行三种生物重复,并在统计分析中施用标准曲线方法。gydF4y2Ba
统计分析gydF4y2Ba
最小差异(gydF4y2BapgydF4y2Ba< 0.05)用数据处理系统程序(浙江大学,浙江,中国)计算平均值分离。使用Sigma Plot v12.0 (Systat Software Inc., San Jose, CA, USA)计算标准误差并绘制图表。采用SPSS 16.0软件对数据进行pearson相关系数分析。对于RNA-seq,使用DESeq2包对两个样本进行差异表达分析。差异表达分析后,基于log2倍变化> 1和FDR < 0.05,采用Benjamini-Hochberg程序对p值进行多假设检验校正。这个过程重复了三次。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
我们已经将RNA测序数据上传到NCBI,链接是gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/prjna623676.gydF4y2Ba.支持本文结果的数据集包含在文章和补充表中。gydF4y2Ba
缩写gydF4y2Ba
- UV-B:gydF4y2Ba
-
紫外线bgydF4y2Ba
- TFS:gydF4y2Ba
-
转录因子gydF4y2Ba
- 存在:gydF4y2Ba
-
定量逆转录PCRgydF4y2Ba
- 朋友:gydF4y2Ba
-
苯丙氨酸氨 - 裂解酶gydF4y2Ba
- CHS:gydF4y2Ba
-
Chalcone合成酶gydF4y2Ba
- Chi:gydF4y2Ba
-
查耳酮异构酶gydF4y2Ba
- F3H:gydF4y2Ba
-
Naringenin 3-二恶英酶gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- UFGT:gydF4y2Ba
-
UDP glucose-flavonoid 3-0-glucosyltransferasegydF4y2Ba
- DAFB:gydF4y2Ba
-
盛开后的日子gydF4y2Ba
- MRM:gydF4y2Ba
-
多重反应监测gydF4y2Ba
- ESI:gydF4y2Ba
-
电喷雾电离gydF4y2Ba
- PCA:gydF4y2Ba
-
主成分分析gydF4y2Ba
- 可见:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- scm:gydF4y2Ba
-
显著改变代谢产物gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- Kegg:gydF4y2Ba
-
Kyoto基因和基因组的百科全书gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Espley RV,Bovy A,Bava C,Jaeger SR,Tomes S,Norling C,Puterill J.转基因红肉苹果的分析揭示了对生长和消费者属性的影响。植物Biotechnol J. 2013; 11(4):408-19。gydF4y2Ba
- 2。gydF4y2Ba
苹果品质和抗生物胁迫育种进展:面向欧洲市场的新品种。果树学报2004;12:13-52。gydF4y2Ba
- 3.gydF4y2Ba
关键词:红富士苹果,光照,酚类含量Sci Hortic。2009;123(2):234 - 9。gydF4y2Ba
- 4.gydF4y2Ba
冯飞,李敏,马飞,程立军。遮荫果皮中花青素合成关键基因的表达及其代谢产物的影响。植物生理与生物化学。2013;69:54-61。gydF4y2Ba
- 5.gydF4y2Ba
丁瑞荣,车新科,刘洪志,杜宾,董kt,张玉华。1-MCP和贮藏温度对' White Winter Pearmain '苹果α-farnesene甲戊酸(MVA)酶基因转录的影响Sci Hortic。2020;259:108841。gydF4y2Ba
- 6.gydF4y2Ba
叮咚,杜,张耶。共轭三烯醇和编程的细胞死亡与储存在低温下的苹果果实中的反应性氧物种更密切相关。SCI Hortic。2019; 246:597-603。gydF4y2Ba
- 7.gydF4y2Ba
白S,Sun Y,Qian M,Yang F,Ni J,Tao R,Teng Y.转录袋治疗的红细胞果皮剥皮揭示了在花青素积累中的轻响应途径功能。SCI REP。2017; 7:63。gydF4y2Ba
- 8.gydF4y2Ba
Rumainum Im,Worarad K,Yamaki Y,Yamane K.发育阶段,光和植物素极性转运抑制剂对红肉桃果皮皮肤和肉体色素沉着的影响。Hortic J. 2016; 85(2)。gydF4y2Ba
- 9.gydF4y2Ba
vimolmangkang s,郑d,韩伊,汗马,索里亚 - 格拉重新,korbans ss。苹果果实的转录组分析鉴定了涉及红颜色色素沉着的光诱导基因。基因。2014; 534(1):78-87。gydF4y2Ba
- 10。gydF4y2Ba
陈俊,高W,LV D,Cai M,Qin S,Ma H,Liu G.袋装对红富士苹果果皮开发过程的影响。J Fruit Sci。2009; 26:217-21。gydF4y2Ba
- 11.gydF4y2Ba
黄超,于波,滕勇,苏军,舒强,程志,曾磊。果实套袋对红沙梨成熟过程中果实着色及相关生理和品质的影响。Sci Hortic。2009;121:149-58。gydF4y2Ba
- 12.gydF4y2Ba
夏家,张Z,曲阵。发育阶段袋鼠小熊队的果皮颜料和肉糖含量的变化。Acta Bot Boreal-ocmid SiN。2010; 30:1675-80。gydF4y2Ba
- 13.gydF4y2Ba
vimybf1调控的黄酮醇通路基因的转录组范围鉴定。植物学报,2017;gydF4y2Ba
- 14.gydF4y2Ba
本田C,Kotoda N,Wada M,Kondo S,Kobayashi S,Soejima J,Moriguchi T.Anthocyanin生物合成基因在苹果皮中的红色时配合表达。植物理性生物化学。2002; 40:955-62。gydF4y2Ba
- 15.gydF4y2Ba
UBI是,本田C,Bessho H,Kondo S,Wada M,Kobayashi S,Moriguchi T.苹果皮中花青素生物合成基因的表达分析:UV-B和温度的影响。植物SCI。2006; 170(3):571-8。gydF4y2Ba
- 16.gydF4y2Ba
谢锐,郑丽,何松,郑玉英,易松,邓林。果树花青素合成的基因及其调控。生物技术学报。2011;10(86):19890-7。gydF4y2Ba
- 17.gydF4y2Ba
徐W,Dubos C,Lepiniec L. myB-BHLH-WDR复合物对类黄酮生物合成的转录控制。趋势植物SCI。2015; 20(3):176-85。gydF4y2Ba
- 18.gydF4y2Ba
杜博斯,李志刚,李志刚,李志刚。拟南芥MYB转录因子的研究进展。植物学报,2010;5(10):573-81。gydF4y2Ba
- 19.gydF4y2Ba
埃斯普利RV,Hellens RP,Putterill J,Stevenson de,Kutty-Amma S,Allan AC。苹果果实中的红色着色是由于MYB转录因子,MDMYB10的活动。工厂J. 2007; 49:414-27。gydF4y2Ba
- 20。gydF4y2Ba
胡dg,sun ch,ma qj,你cx,cheng l,hao yj。MDMYB1通过直接促进其运输在苹果中的空泡中来调节花青素和苹果酸盐积累。植物理性。2016; 170:1315-30。gydF4y2Ba
- 21。gydF4y2Ba
谢XB,李士,张立雷,赵家,陈烨,赵Q,郝yj。BHLH转录因子MDBHLH3促进苹果低温的花青素积累和果实着色。植物细胞环境。2012; 35:1884-97。gydF4y2Ba
- 22。gydF4y2Ba
JAAKOLA L.新见解果实中的花青素生物合成。趋势植物SCI。2013; 18(9):477-83。gydF4y2Ba
- 23。gydF4y2Ba
光诱导MYB基因表达调控红苹果花青素合成。植物杂志。2006;142:1216-32。gydF4y2Ba
- 24。gydF4y2Ba
陈志强,陈志强,陈志强,等。光辐照诱导红、黄苹果果肉中酚类化合物的合成。应用地球物理学报。2005;8(2):101-4。gydF4y2Ba
- 25.gydF4y2Ba
Opara Lu,Studman CJ,银行NH。阳光影响内圈裂缝的发生和“晚会”的内圈裂缝和其他物理属性。J树果脯。1997; 2(1):45-52。gydF4y2Ba
- 26.gydF4y2Ba
Sun S,Xin L,Gao H,Wang J,Li P.酚类化合物在“金色美味”和“红色美味”苹果剥落对水果袋的反应和随后的阳光再暴露。SCI Hortic。2014; 168:161-7。gydF4y2Ba
- 27.gydF4y2Ba
Mikanagi Y,Sait N,Yokoi M,Tatsuzawa F.罗莎属花的花青素,Cinnamomeae(= Rosa),栗子,加洛尼亚岛和一些现代园林玫瑰。生物学习系统系统。2000; 28(9):887-902。gydF4y2Ba
- 28.gydF4y2Ba
Stracke R, Ishihara H, Huep G, Barsch A, Mehrtens F, Niehaus K, Weisshaar B. R2R3-MYB转录因子的差异调控调控拟南芥幼苗不同部位黄酮醇的积累。植物j . 2010; 50:660 - 77。gydF4y2Ba
- 29.gydF4y2Ba
Henry-Kirk RA, Plunkett B, Hall M, McGhie T, Allan AC, Wargent JJ, Espley RV。太阳紫外线调节苹果类黄酮代谢。植物学报2018;41:675-88。gydF4y2Ba
- 30.gydF4y2Ba
白山,陶瑞,唐玉英,尹亮,滕玉英。bbx16蛋白通过激活myb10正向调节光诱导的花青素积累。植物生态学报;2019;17(10):1985-97。gydF4y2Ba
- 31。gydF4y2Ba
关键词:MdMYB1基因,甲基化,非红苹果,皮,花青素积累植物生态学报。2018;18(1):108。gydF4y2Ba
- 32。gydF4y2Ba
Kim Sh,Lee Jr,Hong St,Yoo Yk,G,Kim SR。苹果皮中优先表达的花青素生物合成基因的分子克隆与分析。植物SCI。2003; 165(2):403-13。gydF4y2Ba
- 33。gydF4y2Ba
Lichtenthaler HK。叶绿素和类胡萝卜素:光合生物膜的颜料。方法苄醇。1987; 148C:350-82。gydF4y2Ba
- 34。gydF4y2Ba
赵家,谢X,沉X,王Y.阳光暴露对浅谈抗氧化剂和抗氧化酶活性的影响浅谈。食品化学。2016; 210:18-25。gydF4y2Ba
- 35。gydF4y2Ba
Conesa A, Madrigal P, Tarazona S, Gomez-Cabrero D, Cervera A, McPherson A, Mortazavi A. RNA-seq数据分析的最佳实践调查。基因组医学杂志。2016;17(1):13。gydF4y2Ba
- 36。gydF4y2Ba
凝胶B,Serra E. Karyploter:一个R / Biocuconductor包,用于绘制显示任意数据的可定制基因组。生物信息学。2017; 33(19):3088-90。gydF4y2Ba
- 37.gydF4y2Ba
Kanehisa M,Araaki M,Goto S,Hattori M,Hirakawa M,Itoh M,Yamanishi Y. Kegg用于将基因组联系起来的生命和环境。核酸RES。2008; 36(1):D480-4。gydF4y2Ba
- 38.gydF4y2Ba
一种高效的基因组特征赋值通用程序。生物信息学。2013;30:923-30。gydF4y2Ba
- 39.gydF4y2Ba
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。gydF4y2Ba
- 40。gydF4y2Ba
Tatusov RL, Koonin EV, Lipman DJ。蛋白质家族的基因组视角。科学。1997;278(5338):631 - 7。gydF4y2Ba
- 41。gydF4y2Ba
Tatusov RL,Galperin My,Natale da,Koonin EV。COG数据库:蛋白质功能和演化的基因组规范分析工具。核酸RES。2000; 28(1):33-6。gydF4y2Ba
- 42。gydF4y2Ba
Varet H,Brient-GuéguenL,CoppéeJy,狄略马。Sartools:基于DESQ2和Edger的R管线,用于RNA-SEQ数据的全面差异分析。Plos一个。2016; 11:E0157022。gydF4y2Ba
- 43。gydF4y2Ba
Wang Z,Gerstein M,Snyder M.RNA-SEQ:转录组织的革命性工具。NAT Rev Genet。2009; 10(1):57。gydF4y2Ba
- 44。gydF4y2Ba
陈伟,龚玲,郭志,王伟,张辉,刘旭东,罗建军。一种新型的代谢产物大规模检测、鉴定和定量的集成方法:在水稻代谢组学研究中的应用。摩尔。2013;6(006):1769 - 80。gydF4y2Ba
- 45。gydF4y2Ba
Bustin Sa,Beaulieu JF,Huggett J,Jaggi R,Kibenge FS,Olsvik Pa,Toegel S. Miqe Precis:实际实施最低标准指南的基于荧光的定量实时PCR实验的最低标准指南。BMC MOL BIOL。2010; 11(1):74。gydF4y2Ba
- 46。gydF4y2Ba
Bustin Sa,Benes V,Garson Ja,Hellemans J,Huggett J,Kubista M,Vandesompele J. MIQE指南:公布定量实时PCR实验的最低信息。Clin Chem。2009; 55(4):611-22。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
该工作得到了中国国家自然科学基金(31370359)和山东省自然科学基金的支持[Grant Number ZR2020MC028]。资金用于实验传导和开放式接入付款。没有资助者参加了稿件的数据分析和解释或写作。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
RD和YZ构思和设计了实验;RD和ZS进行了实验;RD和XC分析了数据并起草了稿件;RD和XC格式化了这些数字,并修改了稿件。所有作者都已经阅读并赞成最终的手稿。gydF4y2Ba
通讯作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
这篇文章没有包含任何作者对人类参与者或动物进行的研究。gydF4y2Ba
同意出版gydF4y2Ba
本研究不适用于同意发表。gydF4y2Ba
利益争夺gydF4y2Ba
作者声明没有竞争的财务利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
QRT-PCR的引物。gydF4y2Ba
附加文件2:表S2。gydF4y2Ba
一种。与CK相比,光线中的代谢物显着改变了代谢物。湾与CK相比,UV-B中的代谢物显着改变了代谢物。C。与UV-B相比,光线中的代谢物显着改变。gydF4y2Ba
附加文件3:表S3。gydF4y2Ba
LC-MS/MS分析黄酮类化合物和花青素的丰度。gydF4y2Ba
附加文件4:表S4。gydF4y2Ba
A-1。与CK相比,所有差异改变的基因。a2。与CK相比,轻微表达基因显着表达基因。B-1。与CK相比,UV-B中的所有差异变化的基因。B-2。与CK相比,UV-B中显着表达基因。C-1。与光相比,UV-B中的所有差异变化的基因。 c-2. Significantly differentially expressed genes in UV-B compared with Light.
附加文件5:表S5。gydF4y2Ba
一种。与CK相比,光的差异表达转录因子。湾与CK相比,UV-B的差异表达转录因子。C。与UV-B相比,光的差异表达转录因子。gydF4y2Ba
附加文件6:图S1。gydF4y2Ba
在黑暗(CK)下的差异表达基因(DEGS),可见光和UV-B辐射处理。(a)从光,UV-B和CK的PCA分解基因曲线的图谱。(b)来自光,UV-B和CK的基因曲线的Venn图。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
丁,R.,Che,X.,Shen,Z.gydF4y2Baet al。gydF4y2Ba代谢组和转录组分析揭示了青苹果皮中花青素积累的光和uv - b反应途径。gydF4y2BaBMC植物杂志gydF4y2Ba21,gydF4y2Ba351(2021)。https://doi.org/10.1186/s12870-021-03121-3gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03121-3gydF4y2Ba
关键字gydF4y2Ba
- 苹果gydF4y2Ba
- 类黄酮和花青素的积累gydF4y2Ba
- 可见光gydF4y2Ba
- UV-B.gydF4y2Ba
- 代谢组学、转录组gydF4y2Ba