抽象的
背景
叶锈病,是由真菌引起的Hemileia vastatrix(Pucciniales),是一种影响咖啡植物的毁灭性疾病(Coffea阿拉比卡l .)。与目前发展的植物保护方法相关的缺点最近导致寻找替代策略。这些包括组成性地激活抗病信号通路的基因操作。然而,这些途径的分子作用者仍然未知c·阿拉比卡.在本研究中,我们对咖啡进行了分离和表征NDR1.的基因,拟南芥Ortholog是一种众所周知的超敏感响应的主调节器,其取决于卷绕式螺旋型R蛋白。
结果
两个高度同源的cDNA编码假定NDR1蛋白质进行鉴定,并从咖啡植物的叶子克隆。一个候选编码序列,然后在表达拟南芥敲除了空突变体NDR1-1..面对一种特殊菌株的挑战假单胞菌含油(DC3000 ::AVRRPT2.),宏观症状分析和在Planta.微生物生长显示咖啡cDNA能够恢复突变遗传背景中的抗性表型。因此,cDNA被称为CaNDR1a(站小粒咖啡非小种特异性抗病1a).最后,获得了生物化学和显微镜数据,强烈建议了机械保护NDR1.驱动功能在咖啡和拟南芥植物。通过瞬态表达系统,确实证明了CaNDR1a蛋白像它的拟南芥对应的,定位于质膜,在那里它可能是通过GPI锚栓。
结论
我们的数据为鉴定新功能提供了分子和遗传证据NDR1.同族体在植物。作为启动超敏感信号通路的关键调节器,CaNDR1基因可能是操纵咖啡固有免疫系统和实现对病原体的广谱抗性的选择靶点。给定的潜在守恒NDR1.-依赖的防御机制之间拟南芥和咖啡厂,我们的工作也表明了孤立的新方法,以孤立的尚未认识到R- 负责抵抗力的基因h . vastatrix.
背景
属咖啡包括约120种亚热带/热带多年生木本树木和灌木的(家庭茜草科),其中至少两个物种是全球农业经济利益。近75%的世界咖啡生产起源于Coffea阿拉比卡L.,大约20%来自c . canephoraPierre ex . Froehner =c·罗布斯塔).橙咖啡叶锈病被认为是主要的瘟疫之一c·阿拉比卡[1].对疾病负责的真菌,Hemileia vastatrixBerkeley & Broome,广泛分布在咖啡种植国,可导致严重的落叶,导致大量浆果减产[1,2].此外,目前两种限制病原体感染的方法优势有限。首先,使用杀菌剂虽然具有成本效益,但并不总是能有效地控制疾病,而且,它对环境有负面影响。第二,即使一些品种的咖啡对h . vastatrix已用于基因渗入目的[3.,4,由于携带新的毒力基因的真菌各种族的快速联合进化,这种替代方法耗时且不能提供持久的抗性[5].因此,需要额外的方法来控制叶锈病。
h . vastatrix是一种专性的生物营养寄生虫,属于担子菌纲,棒子目[6].随着尿孢子在叶背面萌发,菌丝生长并通过气孔进入叶肉组织的细胞间隙,然后分化细胞内的营养结构或吸器。在敏感的咖啡植物中,成功的病原体可以在感染后的三周内完成其双核循环并达到最终阶段,其特征是形成孢子菌。在抗性植物中,菌丝入侵能在2-3天内迅速被察觉并被阻止[7,8].基于定量和孟德尔遗传学研究[3.,4],发生至少九种显性抗性(R)基因咖啡属,和类似的真菌致病基因数量,已经推断。因此普遍认为咖啡/锈相互作用的结果,所述植物抗蚀剂病原体攻击(不相容性)或发展疾病(兼容性)是否依赖于基因对基因模型[9],最近已修订[10.].一旦进入咖啡细胞,h . vastatrix效应蛋白,并且它们触发细胞内的扰动,都应该通过R-特异性蛋白被感知。识别步骤促进信令防御途径(S)及随后的电阻的启动。或者,强毒锈病被认为分泌效应所逃脱或甚至抵消主机监视系统,其允许咖啡细胞代谢和组织定殖[的劫持11.].
在与生物营养病原体的不相容互作过程中,植物抗性表型的产生是由于一种复杂的多层防御反应的开始,即所谓的超敏反应(hypersensitive response, HR) [12.,13.].尽管对控制抗性的分子机制仍然知之甚少h . vastatrix在美国,有几项研究进一步证实了咖啡植物中存在类似hr的现象。接种无毒真菌菌株的抗性品种表现出许多HR特征的形态。这些包括宿主细胞的快速死亡,它局限于感染部位,并与真菌菌丝塌陷有关[7,8]、吸器的胼胝质包覆及随后的细胞壁木质化[8,早期氧化爆裂[14.,15.]和激活典型的防御相关基因[16.- - - - - -18.].
在之前的工作中,我们进行了抑制消减杂交为基础的筛选c·阿拉比卡这被挑战了h . vastatrix并确定在兼容或不相容的相互作用期间调节的一系列表达的序列标签(EST)[16.,19.].其中一个EST与编码序列共享了重要的身份非种族特异性抗病性1(NDR1.基因。最初被隔绝拟南芥,NDR1编码小质膜驻留蛋白,不足之处,其中发现取消HR并且赋予易感性一些真菌和细菌病原体携带特定效应基因[20.- - - - - -22.].值得注意的是,已经确定NDR1.驱动抗性依赖于r蛋白的一个特定子集(如RPM1、RPS2和RPS5),其定义是在其n端存在一个线圈(CC)结构[23.].从机械角度来看,说明NDR1功能的最佳特征示例是涉及菌株DC3000 ::的病理系统AVRRPT2.植物病原菌的假单胞菌含油PV。番茄(太平洋标准时间).在该模型中,AtNDR1在静息条件下,通过与rpm1 - interaction protein 4 (RIN4)相互作用,间接保留质膜胞质侧的RPS2蛋白,从而阻止HR的激活[24.].在感染太平洋标准时间,细菌蛋白酶AVRRPT2分泌到细胞质中,在那里它可以切割rin4,释放rps2并引发疾病阻力信号通路[25.].
在这项研究中,我们克隆了两个c·阿拉比卡候选的互补NDR1.并分析了推导出的一级氨基酸序列。咖啡蛋白与AtNDR1之间的结构域保护和高度同源性使我们采取了遗传互补的方法。使用拟南芥ndr1-1无效突变体,我们获得了遗传和分子证据,至少有一个候选基因是功能性的NDR1.直接同源。激光共聚焦显微镜和生化分析进一步表明,该蛋白可能通过糖基磷脂酰肌醇锚附着在质膜上。基于这些数据,可以调用ndr1相关机制的可能性R到 - 基因介导的耐药h . vastatrix进行了探讨。本文还概述了这一结果在提高抗性方面可能产生的影响。
结果
新型NDR1序列同源物的克隆与分析Coffea阿拉比卡
在以前的工作中[19.[我们使用了减肥杂交方法来鉴定涉及咖啡植物防御/抵抗的基因(c·阿拉比卡L。)到橙色锈菌h . vastatrix.在HR期间显著上调的9个ESTs中,有一个与canonical的同源性为43%NDR1.从编码序列A. Thaliana..在这项研究中,我们着重研究了咖啡的候选NDR1.基因和通过嵌套RACE-PCR分离的两个不同的全长转录物。如在所描述的相应的cDNA克隆“方法' 部分 (CaNDR1a[Genbank:DQ335596],CaNDR1b[Genbank:DQ335597])。开放阅读框架仅彼此不同,只有3个单核苷酸位置,其中一个取代是非沉默(F69L)。预计两种序列是编码214个氨基酸长的蛋白质,其计算的分子量为23.8kDa和等电点为9.58。
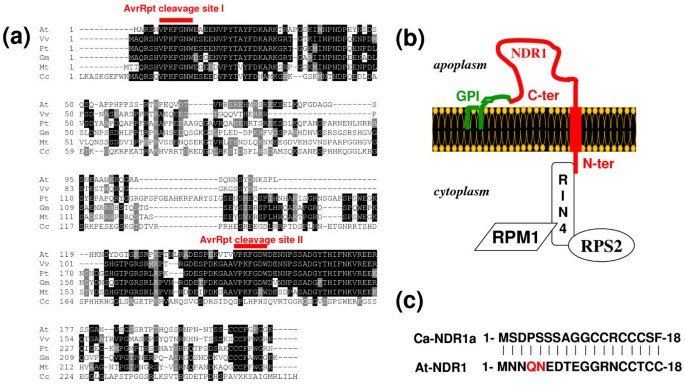
寻找拟南芥我们通过BLAST P算法筛选了GenBank数据库[26.]并检索15个非冗余命中。正如预期的那样,最佳匹配似乎是NDR1,具有42/61%的身份/同源性。除了未知的序列之外,所有已识别的同源物之前已被描述为NDR1 / hin1样(NHL)蛋白质超家族的成员[27.].性NHL占广阔类,它们的N-末端半部内,包含两个高度保守的肽图案(基序2和3)和一个较不保守的一个(基序1)植物防御相关蛋白〔28.].将这些蛋白质与烟草的HIN1比对,揭示了这三个基序在序列中的位置(图)1;参见附加文件1用于全长序列比对)。仅使用图中所示的保守区域进行系统发育分析1结果表明,CaNDR1a/b、NDR1、NHL38和NHL16形成了一个不同于其他NHL的组(图)2 a, b).这些数据表明NDR1, NHL38和NHL16最接近拟南芥Candr1a / b的亲属。
对于NDR1蛋白的两个咖啡候选者属于NHL家族.推定拟南芥通过使用两种推导的咖啡氨基酸序列的询问,通过喷射算法鉴定CANTR1A / B蛋白的直脑。使用群集x程序的2.0.10版对齐检索序列[59.],然后在BoxShade服务器(http://www.ch.embnet.org/software/BOX_form.html).含有三个NHL基序的保守区域被呈现。所述基序的位置显示为红色线和数字。以星号示出了两个咖啡蛋白质(F69L)之间的取代的氨基酸残基的位置。全长序列比对可以在其他文件中找到1.编码的基因的登录号拟南芥蛋白质如下:NDR1 [AGI:At3g20600];NHL1 [AGI:At3g11660];NHL2 [AGI:At3g11650];NHL5 [AGI:At1g61760];NHL6,[AGI:At1g65690];NHL11 [AGI:At2g35970];NHL12 [AGI:At2g35960;NHL16 [AGI:At3g20610];NHL18 [AGI:At3g52470];NHL21 [AGI:At4g05220]; NHL22 [AGI:At4g09590]; NHL23 [AGI:At5g06330]; NHL26 [AGI:At5g53730]; NHL38 [AGI:At3g20590]; unknown, [AGI:At5g05657]. The accession number of the烟草Hin1编码序列为GenBank: AB091429.1。
Candr1a的异位表达拟南芥ndr1-1 null突变体恢复特定的抵抗力假单胞菌含油PV..番茄(DC3000 :: AVRRPT2)
从我们的在网上分析后,问题出现了,这两种鉴定出的咖啡基因是否具有功能同源AtNDR1或不同的NHL对应物的代码。为了回答这个问题,采取了一种遗传互补方法。鉴于两种预测的甘露糖1氨基酸序列之间的高度的身份,我们决定研究CANDR1A并在控制中表达相应的ORFCaMV35S启动子的拟南芥ndr1-1零变异。在选择性培养基上进行分离分析,可分离出单位点、纯合子插入系(见附加文件)2种族隔离的结果)。然后通过RT-qPCR筛选T3细胞系,以获得高稳态水平的转基因转录本,并从中筛选出3个细胞系进行进一步实验。的表达水平CaNDR1a标记为T3-1、T3-2和T3-3的品系,分别比内源高92倍、190倍和714倍AtNDR1基因,与WT相比Col-0工厂完全相同的条件下生长。
先前的研究表明NDR1-1.null突变体不能激活HR响应太平洋标准时间菌株DC3000 ::AVRRPT2.携带AVRRPT2.含盒的质粒[20.,21.].相反,一个高的过度表达水平AtNDR1在里面Col-0发现遗传背景可增强DC3000菌株的抗病能力[22.].因此,我们检测了我们的过表达品系对两种同基因菌株(DC3000::AVRRPT2.和DC3000),通过记录宏观症状和以下在Planta.细菌生长在为期四天。虽然招商局等.[22.]已有报道未接种者出现hr样病变拟南芥转基因线overexpressingAtNDR1,在我们的非接种T3线中没有观察到这种病变。虽然三种基因型响应DC3000而发育了疾病症状(图3A),T3-2和T3-3线易感于NDR1-1.突变植物,如在4天所示由叶细菌内容接种后(DPI)(图3C).DC3000的挑战:: AvrRpt2, WT植物表现出典型的超敏病变位于浸润区,而NDR1-1.突变体表现出以组织发黄为特征的疾病样症状,并传播到接种区以外(图)3A).正如预期的那样,WT和NDR1-1.基因型与叶片细菌数量密切相关。例如,早在2 dpi时,突变体叶片的细菌浓度就已经比WT叶片增加了10倍(图3B.).更重要的是,接种菌株DC3000时::AVRRPT2.,所有三个CaNDR1a-表达系表现出类似hr的表型(图3A)与与WT植物的细菌水平相关联(图3B.).此外,咖啡转基因在拟南芥突变体对rps4协调的HR没有显著影响,而之前的研究表明,rps4协调的HR是独立的AtNDR1[23.](附加文件3.).总之,这些结果提供了遗传学证据CaNDR1a在功能上和具体的补充NDR1-1.突变体。
咖啡基因CaNDR1a功能上的补充拟南芥ndr1-1null突变体.细菌溶液被手用注射器渗透到叶子中,如“方法的部分。(a)有毒(DC3000)和无毒(DC3000::AVRRPT2.)太平洋标准时间菌株。一个2×107cfu毫升-1接种物用于该实验,其进行两次。接种后7天服用图片。(b)和(c)监测细菌生长在Planta.通过测定接种后0、2和4天的叶片样品。与WT植物一样,candr1a表达系(T3-1、T3-2、T3-3)也具有抗性PST DC3000::AVRRPT2., 然而NDR1-1.突变体易感。表达CANDR1ANDR1-1.遗传背景增加了对菌株的抗性DC3000,如在4 dpi的T3-2和T3-3线中叶细菌群的显着减少所示。一个2×105cfu毫升-1接种物用于该实验,实验进行两次。平均值和标准误差(4个生物重复)显示了一个代表性的实验。不同的字母表明2 DPI(罗马字母)或4个DPI(希腊字母)的显着差异,如方形转换数据的ANOVA所确定的,然后是学生 - 纽曼龙(SNK)测试(α<5%)。观察到叶细菌浓度的显着差异拟南芥在T0基因型。
成熟的CaNDR1a蛋白在c端被加工
的拟南芥NDR1蛋白经过多种翻译后修饰,包括多种糖基化和c端加工。后一种裂解去除了蛋白质的一小部分,从而释放出一个氨基酸残基,称为ω位(图)4)提出通过与糖基磷脂酰硫醇(GPI)-Achantor的共价结合来修饰[22.].按照ATNDR1在抗病信号中的同源作用[23.],GPI锚定在真核细胞膜驻留蛋白,通常会遇到,并且允许细胞表面栓系现象[29.].虽然目前还没有关于gpi -锚栓附着位点的共识序列,但在线上可以找到预测算法。使用Big-Pi植物预测器[30.,31.,我们在CaNDR1a的一级氨基酸序列中发现了两个可能重叠的剪切位点(图4,其中S189和G190残基是强ω位候选P-值为2.48 × 10-62.76 × 10-5分别)。此外,CaNDR1a及其拟南芥内质网(ER)膜中转氨酶复合物对GPI的附着具有共同的结构特征[31.].在可能的ω-残基的直接下游是一个区域,预计包含一个短极性间隔体,随后是疏水尾部。一个不可剪切的信号肽(1-39),包含一个潜在的跨膜结构域(16-32),也被预测具有很高的发生概率(P= 0.867)使用SignalP-3.0软件[32.,33.].如前所述[22.],这个n端信号序列可能是蛋白质进入ER网络并通过分泌通路所必需的。
结构上的相似性拟南芥和咖啡NDR1蛋白质.预测了NDR1蛋白的结构域和基序。这两种蛋白质的整体结构似乎是保守的;它更让人想起gpi锚定蛋白[29.].NDR1蛋白的c端显示了推定的裂解位点,包括锚定糖脂部分附着的ω-位点。附着位点后面的结构域显示了适当的转氨酶活性的必要特征,转氨酶是参与蛋白质GPI修饰的酶复合物,并定位于ER膜。一个假定的不可分裂的n端信号肽,可能涉及到内质网的靶向也存在于两种蛋白质中。TMD表示一个预测的跨膜结构域。每个蛋白结构域的大小用阿拉伯数字表示。预测的糖基化位点的数量(在中间区域,显示为浅灰色)也显示在蛋白质的上面和下面。为方便起见,三个保守的NHL基序显示为孵化区I、II和III。用于建立这一方案的预测模型和方法见“方法的部分。
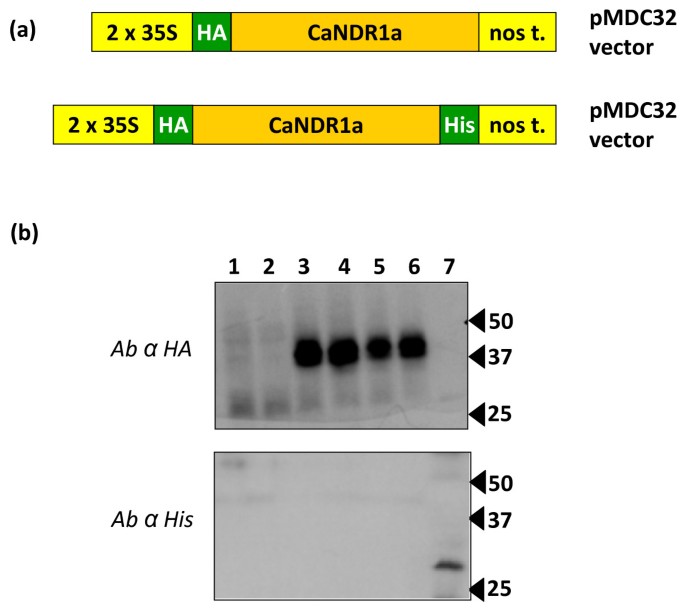
在此基础上在网上分析后,我们决定研究CaNDR1a的c端加工的可能性。为此,创建了一个双标记的CaNDR1a版本(HA-CaNDR1a-His)(图5A)在烟草叶中瞬时表达。我们推理的是,如果CANDR1A蛋白在烟草细胞中切割,则应通过没有他特定信号免疫引起的免疫引起的C-末端的丧失,而证明蛋白质被合成的证明将由存在HA特定信号。
将CaNDR1a的c端从烟草中的成熟蛋白中去除.(a)用于烟草叶片中瞬时表达HA-和HA- his标记的CaNDR1a蛋白的构建物。(b)免疫印迹法检测candr1a标记蛋白。上面和下面的面板分别显示了与抗ha和抗his血清印迹膜相对应的扫描胶片。为了比较,相同的蛋白质提取物用SDS-PAGE分离,然后转移到两种膜上。每个通道装载了10微克的蛋白质。样品中含有用SDS提取的主要不溶性蛋白,如方法'部分。lane 1和lane 2,阴性对照(分别来自表达GUS蛋白的叶片和未渗透的叶片);3 lane, ha阳性对照,his阴性对照(从表达n端ha标记的CaNDR1a蛋白组织制备的样本);lanes 4-6,表达双标记CaNDR1a蛋白组织制备的样品(3个独立实验);7巷,ha阴性对照,his阳性对照(标本制备于拟南芥组成表达c末端his标记的AtBI1蛋白)[56.].
两到三天后,用农杆菌属应变,这是专用于HA-CaNDR1a-His构建的表达,蛋白质提取物从新鲜组织通过SDS-PAGE得到解决制备和免疫印迹使用任一HA-或His特异性抗血清中所描述的“方法的部分。免疫印迹条件使用n端ha标记的CaNDR1a (HA-CaNDR1;数字5A)和c端his标记的Bax Inhibitor 1 (BI1-His)版本作为对照。6个独立实验包括独立实验农杆菌属进行渗透和蛋白提取。使用抗ha抗体,在装载NDR1样品的通道中只能检测到一个主要条带(图)5B.,车道3-6),而加载负控制样本的车道没有显示具体信号(图3-6)5B.1、2和7)HA-CaNDR1a和HA-CaNDR1a,他预测分子量平均为25-26 kDa的蛋白质编码,检测到的蛋白质在变性条件下迁移到大约45 kDa。根据之前的研究,这种明显的差异并不令人惊讶。Coppinger和同事[22.实际上表明,SDS-PAGE解决的天然ATNDR1蛋白显示了约48kDa的质量,而不是预测的24.6kDa。这些作者进一步证明了蛋白质在翻译时恢复理论规模在体外不专用于糖基化的机械,这表明后者的翻译后修饰可以解释成熟蛋白质的聚丙烯酰胺凝胶迁移移。一致地,CaNDR1a蛋白质,喜欢它的拟南芥在直方图中,显示了大量假定的糖基化位点(图4).因此,我们可以假设我们的蛋白提取物(图5B.可能含有糖基化形式的CaNDR1a,其迁移行为在聚丙烯酰胺凝胶上发生改变。
最后,使用同一组样本和抗his抗体,我们无法检测到HA-NDR1-His蛋白(图)5B.而BI1-His蛋白(31 kDa)则被清晰地鉴定出来(图4-6)5B.,泳道7)。后一项数据表明CANDR1A在烟叶中被C末端加工,强烈表明通过添加GPI部分来修饰蛋白质。尽管如此,还需要进一步的实验来证实这种假设。
CaNDR1a定位于质膜
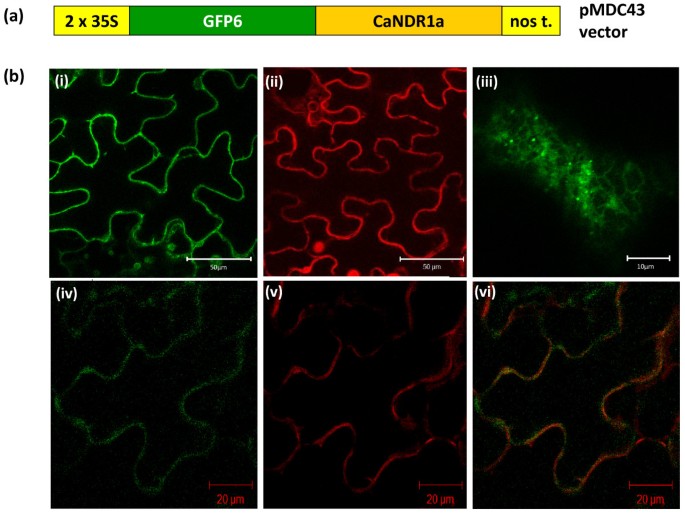
间接数据支持了CaNDR1a蛋白与膜的关联:(i)通过添加gpi锚定的潜在翻译后修饰;(ii)位于n端信号肽内的跨膜结构域(图)4),以及(iii)从烟叶组织中提取瞬时表达的蛋白质时,需要洗涤剂(附加文件)4).因此,使用ChloroP1.1和PSORTII软件预测CaNDR1a蛋白定位于质膜(PM) [34.,35.].因此,为了评估其亚细胞定位,我们创建了GFP6翻译融合(图)6)转化为叶表皮烟草细胞根癌土壤杆菌作为载体,并通过共聚焦显微镜(如“中所述)成像方法' 部分)。根据我们的工作假设,独立实验表明了一致的荧光图案,划定了细胞轮廓(图6 b,小组i)。也观察到这种模式(图6 b,图ii)与与mCherry荧光团融合的PM-resident蛋白[36.].此外,在进一步的实验中,这两种蛋白同时在同一细胞中表达,发现GFP6和mCherry信号在细胞表面有显著的重叠(图)6 b值得注意的是,一些表达gfp6 - candr1a的细胞不仅表现出细胞表面的标记,还表现出内部荧光,类似于er样网状结构,带有更亮的圆点,可以代表高尔基结构(图)6 b第三,面板)。
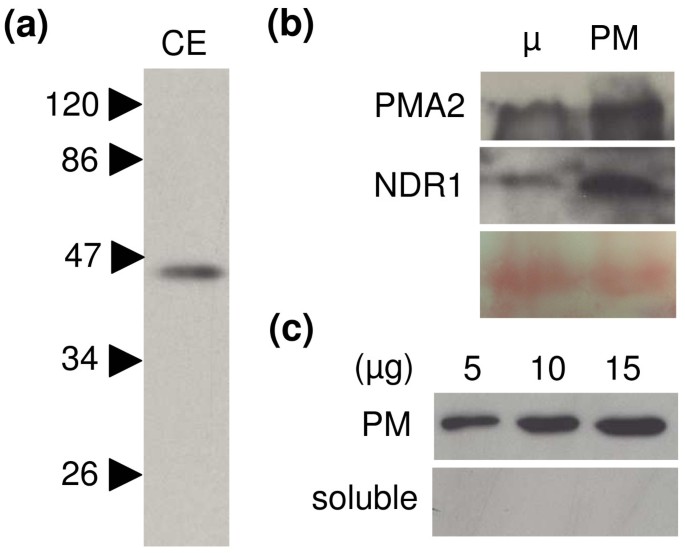
因为叶表皮烟草细胞具有中央大液泡是压在PM和细胞壁的细胞质车厢,很难缔结单靠我们的显微镜数据基于CaNDR1a的亚细胞定位。为了查明unambigously CaNDR1a的定位,N-末端HA标记CaNDR1a(图的版本5A)在烟叶中瞬时表达,用ha特异性抗血清免疫印迹法直接检测纯化的PM组分是否存在该蛋白。用Laemmli缓冲液直接煮沸农业浸润组织制备的粗提物(CE)的免疫印迹(Immunoblotting)显示HA-CaNDR1a蛋白在植物细胞中成功表达(图)7一个).最重要的是,CaNDR1a的标记形式在PM馏分相比微粒的,如也用于内源性PM-驻留蛋白PMA2观察被显著富集(图7 b).此外,当涂上5,10和15μg蛋白质(100.000×G上清液)的刺激时,没有检测到信号,并且随着所载的总蛋白质的量增加,较高的蛋白质(100.000×g上清液)的蛋白质,显然是随着总蛋白质的量增加可视化(图7 c).综上所述,这些结果表明,成熟的CaNDR1a蛋白在烟草异体系统中靶向PM,进一步表明该蛋白在咖啡细胞中具有类似的亚细胞定位。
质膜组分中富集了CaNDR1a蛋白.HA-CANDR1A构建体(参见图5A)用于实施两个独立的实验,该实验由两个独立的农药和质膜(PM)制剂组成。在该数字中提出了代表性实验。在“中”描述了农药过滤和免疫斑条件方法的部分。HA-CaNDR1a蛋白(a)的检测中农杆菌属渗透到叶组织。将组织直接置于1X Laemmli缓冲液中95°C孵育5分钟制备粗提物(CE) [57.].(b)微粒体和PM组分中HA-CaNDR1a蛋白和内源性PM驻留蛋白PMA2的检测。PMA2是一种质子- atp酶泵,以前证明只局限于PM [61.].使用特异性抗PMA2血清探测膜[58.,以检查PM馏分的纯度。正如预期的那样,与微粒体(μ)相比,PMA2蛋白在PM组分中明显富集,在用ha特异性抗血清对同一印迹膜进行剥离和重测时,也观察到HA-CaNDR1a蛋白(中图)。膜也被Ponceau S染色,显示两个组分之间的负荷相等,即μ和PM(下图)。(c)在可溶性组分中未检测到ha标记的CaNDR1a蛋白。可溶性(100.000 × g上清)和PM组分(5、10和15 μg)通过SDS-PAGE分离,并使用ha特异性抗血清进行免疫印迹。
咖啡植物中潜在同源RIN4蛋白的鉴定
的拟南芥NDR1蛋白质已经与RIN4都在酵母异源系统证明物理相互作用和在Planta.[24.].在收获中搜索RIN4序列同源物©小粒数据库导致从识别候选重叠群Coffea canephora[基因库:DV705409.1]。推导出的蛋白序列与我们的查询序列AtRIN4具有很高的同源性(36/53%)。该区域在RIN4蛋白家族中也是高度保守的(图)8).在细菌蛋白酶AvrRpt2进入后,允许RIN4水解的两个裂解位点之一拟南芥细胞(25.,37.,38.]也保存在咖啡蛋白中(图8).与我们之前的数据(图表)一致5,6和7),这在网上分析指向NDR1功能的潜在机械保护拟南芥和咖啡植物。
NDR1功能的假定机制守恒.(a) RIN4同源序列比对。AtRIN4 [AGI:At3g25070]最近的同源序列与推定的咖啡RIN4蛋白[harvEST:Coffea:UG5351]使用ClustalX比对[59.].两种AVRRPT2切割位点的位置[37.,38.]以红色突出显示。编码图中蛋白质的基因的加入数如下:大豆GM [GENBANK:ADJ67468];Medicago truncatula太[基因库ACJ83941):;杨树trichocarpapt [genbank:xp_002301798];vitis Vinifera, Vv基因银行:CBI33050]。(b)显示NDR1如何锚定在质膜上的方案。AtNDR1间接地在质膜上保留r蛋白RPS2和RPM1通过它与RIN4的相互作用[24.,48.].(c)来自两个同源NDR1蛋白的n端部分比较A. Thaliana.和c·阿拉比卡.与AtRIN4相互作用所需的氨基酸残基用红色标出。有趣的是,这些残基在咖啡序列中似乎并没有被保存下来。
讨论
的拟南芥NDR1.基因座在1990年代后期使用了基于对抵抗抵抗力的前瞻性遗传筛太平洋标准时间菌株DC3000 ::AVRRPT2.[20.,21.].自那以后,NDR1.通过其他植物种类的序列比较已经发现了同源基因,例如芸苔栗鸟[39.),vitis Vinifera[40].通过BERT P算法(数据未示出),也可以从GenBank数据库中检索许多序列同源物(11个植物物种内的19个非冗余次数)。但是,根据我们的知识,我们的数据构成了关于功能识别和表征的新报告NDR1.同源物,尽管含有普遍的候选人。
在这项研究中,一些证据确实证明的异位表达CaNDR1a编码序列能够挽救表型拟南芥ndr1-1零变异。DC3000感染后::AVRRPT2.研究发现,表达咖啡转基因的三个突变株出现了突变株所没有的超敏细胞死亡症状(图)3A).这一宏观研究被两个独立的机构进一步证实在Planta.细菌生长测定,显示我们转基因系中的细菌病原体的叶片均低且与WT植物的叶片(图3B.).此外,咖啡的高表达水平CaNDR1a基因的Col-0遗传背景也被发现赋予DC3000株增强抗病能力,如以前报道的AtNDR1基因过表达A. Thaliana.[22.].
重要的是,NDR1驱动阻力A. Thaliana.并不局限于细菌病原体的攻击。两份报告表明NDR1.突变使植物易受卵菌的感染Hyaloperonospora Arabidopsidis.[20.]和真菌黄萎病longisporum[41.].因此,鉴于(i)CaNDR1a是一个功能性同源物拟南芥NDR1.基因和(II)前者的转录物在咖啡叶中积聚,响应于真菌的人力资源h . vastatrix[16.,19.如果NDR1蛋白能够调控导致咖啡锈病抗性的防御信号通路,这也就不足为奇了。目前,我们实验室正在使用功能性方法对这一假设进行研究。最近,我们也证明了这一点答:芥Col-0植物对h . vastatrix.这种反应使得HR激发,因为它可以防止植物组织中的胰岛质形成和悬垂盐[42.].这项工作提出了测试NDR1在响应咖啡叶锈病中的作用的可能性A. Thaliana.异源系统。
正如我们的生物信息学分析所预测的,通过共聚焦显微镜对gfp6标记的CaNDR1a蛋白成像,显示出与质膜定位一致的荧光模式(图)6 b,(我))。与PM荧光蛋白标记物共定位实验也支持这一观察(图)6 b(iv-vi))。此外,从烟叶中提取ha标记的CaNDR1a蛋白需要十二烷基硫酸钠等阴离子洗涤剂(附加文件)4)表明与膜结合。最后,我们的生化方法基于PM通过两相PEG /葡聚糖分区纯化(图7B,C)清楚地证明了烟草PM馏分中HA-CANDR1A蛋白的存在。因此,成熟的CANDR1A蛋白可能存在于咖啡细胞的血浆膜中。
在叶绿体中没有观察到与GFP6光谱相对应的细胞器的荧光标记,尽管此前曾报道过AtNDR1的标记版本[27.].相反,内部网状标签请发加入ER网络(图6 b, (iii))在少数情况下观察到,可能与异位荧光蛋白超载的细胞相对应。这一观察结果与我们的结果一致,表明CaNDR1a蛋白可以通过在其c端添加GPI部分进行修饰(图)5B.).人们已经很好地描述了通过GPI锚栓连接到细胞表面的蛋白质在被分类之前在ER中经历这种翻译后修饰通过分泌途径到达它们的最终目的地,也就是质膜。
通常,GPI锚定蛋白也被认为定位在质膜的骨质侧上[43.].在A. Thaliana.,已经明确证实NDR1是通过c端GPI锚点附着在质膜上的[22.].我们推测NDR1的n端部分位于细胞质内,因为它被发现与胞质蛋白RIN4相互作用在Planta.[24.].由于AtNDR1的C端锚点能够抵抗磷脂酶C的切割,这些数据进一步导致了该蛋白具有跨膜结构域作为第二个锚点的假设。最近的一项建模研究证实了这一点[44.]事实上,咖啡中的蛋白质拟南芥相对,预计呈现单个跨膜域(图4),建议两个对应物的类似但非典型拓扑(图8 b).
最近,Knepper揭示了新的NDR1的新作用模式等.[44.].基于与哺乳动物整合素的结构同源性拟南芥晚期胚胎发生丰富蛋白14,已知参与非生物胁迫反应[45.],上述作者探讨了AtNDR1通过pm -细胞壁粘连控制细胞完整性的可能性。NDR1除了在病原体攻击过程中作为关键信号成分的作用外,在介导主要细胞功能方面的数据强烈暗示了其更广泛的功能Arabidospsis通过维护PM-Cell壁连接[44.].从这些意想不到的结果中,出现了一个问题,即CaNDR1a是否可以在c·阿拉比卡.
有趣的是,DC3000接种后::AVRRPT2.,成功激活HR需要NDR1-RIN4的物理作用。使用丙氨酸扫描突变策略进行的进一步研究表明,NDR1 n端有两个氨基酸残基是相互作用所必需的[24.].尽管在CandR1a结束中明显缺乏保护这两个氨基酸的决定因素(图8 c),我们的结果表明,咖啡基因能够恢复rps2介导的抗性NDR1-1.突变体倾向于证明在我们的转基因系中CaNDR1a确实与AtRIN4相互作用。因此,这提出了NDR1蛋白发挥其功能的机制可能是保守的拟南芥和咖啡植物。
与这个想法一致的是,在HarvEST中寻找RIN4序列同源物©小粒数据库导致从识别候选重叠群Coffea canephora.推导的蛋白质在其N末端部分内显示出具有rin4家族的成员的高度保守区域,以及推定的规范AVRRPT2切割位点(图8).尽管如此,还需要进一步的实验来回答这个问题,即CaNDR1a是否像它一样拟南芥可以作为PM锚点,间接招募r蛋白(s)通过它与类rin4中间体的相互作用(图8 b)[24.,46.].裂解泛素和酵母双杂交系统结合双分子荧光互补(BiFC)将是解决这一问题的有效工具。与传统的遗传方法相比,这可能是一种更快、更方便的隔离方法R-具有抗性的基因h . vastatrix.迄今为止,没有咖啡R -尽管咖啡研究团体做出了努力,基因还是被分离出来了[3.,4].影响二倍体咖啡物种与异聚倍数之间的遗传交换的生殖障碍c·阿拉比卡迄今为止,是否成功地隔离了对h . vastatrix透过以地图为基础的克隆策略[4].
方法
植物及生长条件
烟草植物(烟草benthamiana)在温室中培养,浓度为150 μmol/m2/s光照强度,光照周期14/10 h,光照周期23/20°C,相对湿度60%。
野生型拟南芥生态型哥伦比亚(Col-0),NDR1-1.零突变体(20.和转基因系表达CaNDR1a在短日照条件下(光周期10 h, 100 μmol/m2/s光照流畅度),白天/晚上22/20°C,相对湿度80%。以下将描述病原体的挑战条件。
CaNDR1a/b cDNA的分离与克隆
如前所述[19.],5'结束CaNDR1被称为DSS12的cDNA已经测序(Genbank:CO773976)。采用3'-RACE PCR法测定全长cDNA的序列。总RNA (1 μg)c·阿拉比卡简历。caturra那些被挑战过的叶子h . vastatrix18小时首次使用Smart CDS引物和RT的Omniscript(QIAGEN,Courtaboeuf,法国)和SMART PCR cDNA合成试剂盒(Clontech公司,山景,CA,USA)的组合反转录。和5'PCR智能引物(;然后RACE测定法使用在5' 非编码区(3R- NDR1,5'- CTACTTTGTTCACTGGTAGTCCCTC-3 'N3R-NDR1,5'- CATAATACTTCACCGGAGAACCACC-3'),设计特异性寡核苷酸进行Clontech公司)。将所得的1-kb的PCR产物克隆到pGEM-Teasy载体(Promega,Charbonnieres的莱班,法国)和最后测序(基因组快速,格勒诺布尔,法国)。
构造
来评估拟南芥null突变体NDR1-1.[20.], CaNDR1a的开放阅读框被克隆到双载体pCAMBIA 1305.1 (Cambia, Brisbane, Australia),位于花菜花叶病毒的强组成的35S启动子下游。为了这个目的iud用酶切法将基因从载体中分离BGLII.和BstEII酶。的编码序列CaNDR1a以相应的pGEM-T克隆(GenBank:DQ335596)为模板,用PCR (DAP Goldstar DNA聚合酶,Eurogentec, Seraing, Belgium)扩增,引物如下BglII 5'-TCAGATCTTATGGACAAAGGATGGGC-3'和CANDR1-BSTE.二5“-TAGGTCACCAAATTAATTCCCAGGAAA-3”。将酶切的PCR产物连接到二元载体上,得到最终的构建物。
为了验证CaNDR1a的c端部分从成熟蛋白中移除的假设,我们创建了单标签和双标签结构(图)5).CaNDR1a根据生产商的说明书,使用高保真度DNA聚合酶进行PCR扩增(pfuturbo., Stratagene, La Jolla, CA, USA)。下面的引物对分别在PCR产物的5'-和3'-端直接添加血凝素(HA)和多组氨酸(His)序列:CaNDR1-Forward 4,5 '-中国商用飞机有限责任公司ATG TAT CCC TAC GAC GTA CCA GAT TAT ATG TC AGA CCC CAG CAG CAG TGC-3'和CaNDR1-Reverse 3,5 '-CTA ATG GTG ATG GTG ATG GTG CAA CAG CAG AAC CAA GAA A-3'。获得单ha标记版本的引物为CaNDR1-Forward 4和CaNDR1-Reverse 2 (5'-CTA CAA CAG CAG AAC CAA GA-3')。PCR片段亚克隆到pENTR-D/TOPO载体(Invitrogen公司,Cergy Pontoise,法国)并进行测序。为了获得定向克隆,将划线的核苷酸序列添加到正向引物中。选择的克隆经消化MLU.-I与二元载体PMDC32过夜重组前的-I限制酶(R0198L,NEB,Ozyme,Saint Quentin Yvelines,法国)[49.使用LR克隆酶II试剂盒(Invitrogen公司)。
产生n末期GFP6标记版本以检查CANDR1A的亚细胞定位。PCR产物扩增,亚克隆,测序,并与二元载体pMDC43 [重组49.],如上所述。PCR起始步骤使用的引物如下:CaNDR1-Forward 1,5 '-中国商用飞机有限责任公司ATG TCA GAC CCC AGC AGC AGT-3'和CandR1-Reverse 2.用于在Planta.质膜荧光标记(mCherry-tagged protein)的表达购自俄亥俄州立大学拟南芥生物资源中心(ABRC) (Stock # CD3-1008) [36.].
最终的二进制结构全部测序(基因组快递)前转变成根癌土壤杆菌通过热休克或电穿孔的方法。用菌株GV3101进行转化拟南芥通过根据浸花植物[50.].菌株LBA1119用于在烟草植物中瞬时表达实验。
病原菌攻毒和生长曲线测定
的假单胞菌含油PV。番茄(太平洋标准时间) 拉紧DC3000表达细菌效应蛋白AvrRpt2或AvrRps4的同基因菌株由Jane Glazebrook博士(明尼苏达大学)提供[51.].用于病原体的挑战,细菌过夜,在28℃下轻度振摇在液体特大乙培养基中生长。PST DC3000细菌与利福平(50微克mL的选择-1);DC3000::AVRRPT2.和太平洋标准时间DC3000::AVRRPS4.利福平和四环素(10 μg mL-1).离心收集细菌,2 × 10重悬5CFU毫升-1在生理水(9 g NaCl/L)中接种。
后代的拟南芥ndr1-1T0植物(ndr1-1: CaNDR1a),在30 μg mL的半强度Murashige和Skoog培养基上筛选-1潮霉素。以基因组DNA为模板,通过PCR验证了抗性个体的转化candr1a-特定的引物(Candr1-BglII和CANDR1-BSTE.II)。然后通过在T2 / T3代的旋转霉素抗性植物的偏析下分离纯合单轨迹插入线(附加文件2).评估NDR1-1.互补,三条独立的T3线条显示不同的表达水平CaNDR1a(指定T3-1, T3-2和T3-3)太平洋标准时间和在Planta.细菌生长,随后在4天的时间内(0,2和4 DPI)。野生型 (哥伦比亚,Col-0) 和NDR1-1.为了比较,还接种了植物。阴性对照用生理水渗透。半叶(6 - 7周龄植物)用1ml无针注射器手浸。他们进行了两个独立的实验,得出了相似的结果。每个实验包括四个重复,每个重复由不同的个体执行。在一个重复中,每个植株基因型(5株/基因型)被水或悬浮液浸渍太平洋标准时间DC3000,太平洋标准时间DC3000::AVRRPT2.或太平洋标准时间DC3000::AVRRPS4..在渗透后,植物立即被放置在一个覆盖着塑料圆顶的托盘中,在接种24小时后将其移除。细菌的生长情况如下。在每个时间点,收割两片叶子(每株),用研钵和杵磨碎。将得到的混合物在无菌生理水中连续稀释,并在添加适当抗生素的King B固体培养基上进行电镀。在培养皿上记录两天的细菌数量。接种数据在方差分析前进行平方根变换,然后进行Student-Newman-Keuls多重比较检验。当变换不满足正态性和同方差的假设时,采用非参数Kruskal-Wallis检验。
在使用更高浓度的细菌悬液(2 × 10)的独立实验中,也对超敏反应和疾病症状进行了视觉评估7CFU毫升-1浸润性)。同时收集本实验样本进行RT-qPCR分析。
RNA提取、逆转录和实时定量聚合酶链反应
表达式AtNDR1和CaNDR1a测量方法如前所述[15.]有特定的引物(附加文件5)。[42.].每个测定以一式两份进行,并包含阴性对照而没有模板。选择强度和组成的肌动蛋白基因(AT3G18780)作为归一化的内部对照。通过分析熔化温度曲线估计扩增的特异性。使用比较循环阈值法进行基因表达量化的计算,如前所述[16.].
根癌土壤杆菌介导的瞬时表达
10毫升农杆菌属在含有25μgmL的常规Luria-Bertani培养基中,在30℃下在温和摇动下生长过夜。-1利福平,50 μg mL-1卡那霉素在必要的时候。次日离心收集细菌。微丸重悬于诱导缓冲液(20 mM MES pH5.5, 10 mM MgSO4, 200 μM acettosyringone)中,使OD值达到最佳600 nm.的浓度达到0.5-0.6。室温孵育3小时后,将菌悬液浸润于腋部烟草benthamiana叶子(4 - 6周的植物)使用无针注射器。收集2-3 dpi的样品用于western blot分析和显微镜观察。每个实验包括一个转化对照,通过渗透一个含a35 s:: uidA内含子构造(52.].组织化学β-葡糖醛酸酶(GUS)染色根据[53.以x -葡聚糖(5-溴-4-氯-3-吲哚基- d -葡萄糖醛酸)为底物。
通过共聚焦显微镜蛋白质分致化
如在上面部分中描述CaNDR1a的亚细胞定位是通过一个瞬时表达系统来评价。生长过夜的细菌悬浮液(GFP6稠合CaNDR1a和的mCherry融合标记)分别诱导,然后在1混合:渗入烟草叶之前1倍的比例。诱导缓冲液和个人细菌悬浮液也渗入作为对照。两到三天后浸润,叶盘(1.2厘米直径的)从渗透区冲压并直接与LSM观察510元蔡司直立激光扫描共聚焦显微镜(目标C复消色差透镜40X / 1,2-水,488nm的激光和505-530带通滤波器到GFP,543 nm激光和585-615的带通滤波器来的mCherry)。用488nm的激光的元检测器上获得光谱成像。后LAMBDA堆叠500和640纳米,GFP和mCherry的在细胞中的荧光之间共焦显微镜鉴别的,从来自GFP或mCherry的植物(从蔡司发射指纹图谱的方法)叶中获得这些分子的参考光谱的线性分解功能之间采集。通过650纳米的长通滤波器中检测到叶绿素的自发荧光。这些照片被编码为绿色(GFP)或红色(mCherry的)。实验重复5次(每次重复包括每株至少两个渗入的叶和三个独立的工厂)。
质膜净化
为了毫垂纤维地确定CandR1a蛋白的亚细胞定位,HA标记的CANDR1A版本被异常表达N. Benthamiana.叶子在上述条件下。质膜以2 dpi从渗透叶片中制备,并通过PEG/葡聚糖两相分割纯化,如前所述[54.].通过评估内源性PM驻留蛋白PMA2的富集程度来检测PM组分的纯度。下一节将介绍PMA2的Western blotting条件。
蛋白提取,SDS-PAGE和免疫印迹
通过两步萃取方案分离蛋白质样品。简而言之,在冰冷缓冲液100mm,pH 8.0,TRIS缓冲液(50mL)中磨削冷冻叶组织(1g鲜重),含有1mM乙二胺四乙酸,1mM二硫醇和蛋白酶抑制剂鸡尾酒(1片100ml缓冲液,完整的mini,roche诊断,梅兰,法国)。将混合物以12,000×g在4℃下以12,000×g离心40分钟。根据[蛋白质的上清液浓度55.以BSA为标准。过夜的丙酮沉淀是为了浓缩样品。通过western blot分析,这些包含主要可溶性蛋白的粗提物似乎不包含两个ha标记的CaNDR1版本。然后,在2% (w/v)十二烷基硫酸钠(SDS)存在的情况下,将微球重悬在400 μL的提取缓冲液中提取单和多异位膜蛋白(附加文件)4).混合物在70°C水浴中加热15分钟,室温18000 × g离心25分钟。球被丢弃。根据制造商的说明,使用双茚二酮酸测定法(B-9643/C-2284, Sigma-Aldrich, Saint-Quentin-Fallavier,法国)测定上清蛋白的浓度。蛋白样品载于12.5%聚丙烯酰胺凝胶上,用SDS-PAGE进行分离。使用X Cell II™印迹模块(Invitrogen公司)将蛋白通过电印迹转移到硝化纤维素膜(0.45 μm, Hybond, GE Healthcare, Saclay,法国)上进行免疫印迹分析。用庞索S溶液染色,检查蛋白转移是否成功。然后在含有4% (w/v)干牛奶的tris缓冲盐水溶液中(Cat。# 170-6404, Bio-Rad, Marnes-la-Coquette,法国)和0.2% (v/v) Tween 20。用抗ha - hrp (Cat。# A00169, GenScript Corporation, Paris, France) or anti-(His)5合(猫。# 34460, Qiagen)抗体检测表位标记蛋白。两种抗体均稀释为1:2000。
用作其印迹的蛋白质样品是由污点的阳性对照拟南芥转基因株系组成性过表达c末端his标记的AtBI1 [56.].种子由美国罗格斯大学农业与环境生物技术中心Eric Lam博士好心提供。按照作者的描述提取蛋白质[56.].新鲜收获的树叶直接在Laemmli缓冲区研磨[57., 95°C加热5分钟,离心。得到的上清液用SDS-PAGE分离,并像其他蛋白样品一样印迹。表位标记的AtBI1的预期大小约为31 kDa。
通过SDS-PAGE分解微粒体和血浆膜样品并转移到PVDF膜上,以在与其他蛋白质样品的完全相同的条件下免疫印迹。如上所述进行HA-CANDR1A检测。当用针对PMA2升高的抗体(1:16.000稀释)探测膜[58.[耦合到HRP(猫。#656120,Invitrogen)的山羊抗兔抗体用作1:2000稀释的二级抗体。为了试验HA-CANDR1A的存在,然后在50℃下在β-巯基乙醇(28mM终浓度)存在下,在电泳SDS-PAGE迁移缓冲液中剥离用PMA2特异性抗血清探测的膜。30分钟.然后用抗HA-HRP抗体阻断膜并再生。
生物信息学分析
在GenBank数据库CaNDR1序列同源物的搜索是由基本的局部比对搜索工具,或BLAST的方式执行的处理27.,可在国家生物技术信息中心(http://ncbi.nlm.nih.gov/).使用ClustalX算法对序列进行对齐(版本2.0.10)[59.]并在BoxShade服务器上进行在线处理(http://www.ch.embnet.org/software/BOX_form.html).系统发育树使用Phylowin免费软件,使用邻居连接方法[60.].使用Big-Pi植物预测器(http://mendel.imp.univie.ac.at/sat/gpi/plant_server.html)[30.,31.].使用SignalP-3.0评估原发性氨基酸序列内的信号肽和跨膜结构域的发生(http://www.cbs.dtu.dk/services/SignalP/)[32.,33.];使用NetNGlyc 1.0预测糖基化位点(http://www.cbs.dtu.dk/services/netnglyc/).采用免费软件Mwcalc计算蛋白质的理论分子量和等电点(http://sourceforge.net/search/?q=mwcalc.).利用PSORTII程序预测蛋白质的亚细胞定位[34.].ChloroP1.1 [35.[还用于检查我们感兴趣的蛋白质中是否存在推定的叶绿体靶向序列。收成©用于识别咖啡类rin4蛋白的软件可以在网上找到http://harvest.ucr.edu/.
缩写
- BiFC:
-
双分子荧光互补
- ER:
-
内质网
- 美东时间:
-
表达序列标签
- GPI:
-
糖基 - 磷脂酰肌醇
- HIN1:
-
Harpin诱导的基因1
- 人力资源:
-
过敏反应
- NDR1:
-
非小种特异性抗病性1
- (美国)全国曲棍球联合会:
-
NDR1 / HIN1样
- PCR:
-
聚合酶链反应
- 太平洋标准时间:
-
假单胞菌含油PV。番茄
- R-基因电阻:
-
-基因
- 种族:
-
cDNA末端的快速扩增
- RIN4:
-
RPM1-interacting蛋白质4。
参考文献
- 1。
Silva-Acuna R,Zambolim L,Berger Rd:Pathosystem中的发病率严重关系Coffea arabica-Hemileia vastatrix.植物保护学报,1998,33(4):457 - 461。
- 2。
关键词:咖啡,叶锈病,咖啡浆果病,咖啡抗性植物生理学杂志。2006,18:119-147。10.1590 / s1677 - 04202006000100010。
- 3。
Rodrigues的CJ,贝滕科特AJ,Rijo L:所述病原体和抗锈咖啡的种族。Annu Rev phytopathol。1975年,13:49-70。10.1146 / annurev.py.13.090175.000405。
- 4。
贝当古(Bettencourt AJ, Rodrigues CJ Jr):咖啡抗锈病和其他疾病育种的原则和实践。在咖啡农学。卷4。编辑:Clarke RJ, Macrae R.伦敦和纽约:Elsevier AppliedScience Publishers;1988:199 - 234。
- 5。
Várzea VMP, Marques DV:种群变异Hemileia vastatrix vs咖啡耐用性。咖啡叶锈病持久抗性。Zambolim L,Zambolim E,在VárzeaVMP:主编。维索萨:联邦大学deViçosa;2005:53-74。
- 6。
梅恩WW:生理的专业化Hemileia vastatrixB.&Br。自然。1932,129:510。
- 7。
马丁斯EMF,赖斯WBC:发展Hemileia vastatrix在具有遗传和诱导抗性的咖啡植物中。植物病虫害学报,1996,13(4):519-526。10.1111 / j.1439-0434.1996.tb00293.x。
- 8.
Silva MC,Nicole M,Guerra-GuimarãesL,Rodrigues CJ:过敏的细胞死亡和后欧洲防御反应逮捕了橙色生锈(Hemileia vastatrix)生长在具有抗性的咖啡叶上。植物营养与肥料学报。2002,30(6):649 - 654。10.1006 / pmpp.2002.0389。
- 9.
Flor HH:致病性的遗传亚麻锈病.植物病理学杂志,1994,32:653-669。
- 10.
植物的免疫系统。自然科学进展。2006,444:323-329。10.1038 / nature05286。
- 11.
Fernandez D,Cosererant E,Talhinhas P,Azinheira H,Vieira A,Petitot As,Loureiro A,Poulain J,Silva MC,Da Silva C,Duplessis S:454-PyroosequencingCoffea阿拉比卡被锈菌感染的叶子Hemileia vastatrix揭示了pathogen-secreted蛋白质在Planta.以及植物功能在晚期相容的植物锈病相互作用中触发。植物学报。2011。
- 12.
植物的超敏反应和细胞死亡的诱导。细胞死亡不同。1997,4:671-683。10.1038 / sj.cdd.4400309。
- 13。
内部的恶魔:植物程序性细胞死亡是否涉及到内膜系统?植物学报。2010,33:1453-1473。
- 14。
过氧化物酶在咖啡植物对橙锈病的超敏反应中的作用(Hemileia vastatrix).植物营养与肥料学报。2008,32(4):429 - 434。10.1016 / j.pmpp.2008.04.004。
- 15.
Ramiro da,Escoute J,Petitot As,Nicole M,Maluf MP,Fernandez D:咖啡铁锈的双相呼气差异(Hemileia vastatrix比赛II),在抗性和敏感品种咖啡防御反应有关。植物别墅。2009年,58:944-955。10.1111 / j.1365-3059.2009.02122.x。
- 16。
Ganesh D,Petitot As,Silva MC,Alary R,Lecouls AC,Fernandez D:监测咖啡的早期分子抗性响应(Coffea阿拉比卡L。)到锈菌(Hemileia vastatrix),采用实时定量RT-PCR。acta botanica sinica(云南植物学报),2006,27(5):527-536。
- 17。
王志强,王志强,王志强,等。一种重复基因的亚基因组起源和调控模式WRKY异源四倍体物种的基因Coffea阿拉比卡.植物基因组学杂志。2008,3:379-390。
- 18.
拉米罗d,Jalloul A,Petitot AS,格罗西德萨MF,马卢夫男,费尔南德斯d:咖啡鉴定WRKY转录因子基因及抗性应对病原体的表达分析。树遗传学基因组织。2010,6:767-781。10.1007 / s11295-010-0290-1。
- 19.
费尔南德斯d,桑托斯P,阿戈斯蒂尼C,盂兰盆MC,Petitot AS,C Silva的男,格拉-吉马良斯L,Ribeiro的A,Argout X,尼科尔L:咖啡(Coffea阿拉比卡L.)基因在锈菌侵染过程中早期表达(Hemileia vastatrix).植物营养与肥料学报。2004,5:527-536。10.1111 / j.1364-3703.2004.00250.x。
- 20.
世纪ks,holub eb,staskawicz bj:ndr1,一个轨迹拟南芥这是抵抗细菌和真菌病原体所需的。美国国家科学院学报。1995年,92:6597 - 6601。10.1073 / pnas.92.14.6597。
- 21.
NDR1,一种致病菌诱导的成分拟南芥抗病性。科学进展。1997,278:1963-1965。10.1126 / science.278.5345.1963。
- 22.
copinger P, Repetti PP, Day B, Dahlbeck D, Mehlert A, Staskawicz BJ:过表达质膜定位的NDR1蛋白可增强细菌的抗病能力。acta botanica sinica(云南植物学报),2004,40(4):457 - 461。
- 23.
AARTS N,Metz M,Holub E,Staskawicz BJ,Daniels MJ,Parker Je:不同的要求EDS1和NDR1.通过抗病抗性基因定义至少两个R基因介导的信号传导途径拟南芥.美国国家科学院学报。1998,95:10306-10311。10.1073 / pnas.95.17.10306。
- 24.
DAY B,DAHLBECK D,Staskawicz BJ:与RIN4的NDR1相互作用介导多种疾病抵抗途径的差异激活拟南芥.植物细胞。2006,18:2782-2791。10.1105 / TPC.106.044693。
- 25.
Coaker G, Falick A, Staskawicz B:真核生物嗜环蛋白激活植物致病菌效应蛋白。中国科学:地球科学。10.1126 / science.1108633。
- 26.
alschul SF, Lipman DJ:蛋白质数据库搜索多个比对。美国国家科学院学报。1990年,87:5509 - 5513。10.1073 / pnas.87.14.5509。
- 27.
郑明生,高桥H,宫崎骏A,滨本H,沙阿J,山口I,草野T:上调拟南芥NHL10到黄瓜花叶病毒感染的过敏性反应和衰老的叶子是通过信令水杨酸盐参与不同的途径来控制。Planta。2004年,218:740-750。10.1007 / s00425-003-1169-2。
- 28.
DörmannP,Gopalan S,He Sy,Penning C:基因家族拟南芥序列相似NDR1.和HIN1.植物生理与化学学报。2000,38:789-796。10.1016 / s0981 - 9428(00) 01186 - 4。
- 29。
王志强,王志强,王志强,等。GPI-anchors在植物信号转导中的应用[J]。植物科学进展。1998,3:426-431。10.1016 / s1360 - 1385(98) 01328 - 4。
- 30.
Eisenhaber B,Bork P,Eisenhaber F:翻译后GPI脂质锚固蛋白质在王国中的修饰:从完全基因组中分析蛋白质序列数据。蛋白质工程。2001,14:17-25。10.1093 /蛋白/ 14.1.17。
- 31.
Eisenhaber B, Wildpaner M, Schultz CJ, Borner GH, Dupree P, Eisenhaber F:植物蛋白糖基磷脂酰肌醇脂锚定。拟南芥和水稻的序列和全基因组研究的敏感预测。植物生理学报。2003,33(4):491 - 497。10.1104 / pp.103.023580。
- 32.
基于隐马尔可夫模型的信号肽和信号锚的预测。第六届分子生物学智能系统国际会议论文集:1998年6月28日至7月1日;蒙特利尔。编辑:Glasgow JI, Littlejohn TG, Major F, Lathrop RH, Sankoff D, Sensen C. 1998,门洛帕克:AAAI出版社,122-130。
- 33.
Nielsen H,Engelbrecht J,Brunak S,Von Heijne G:一种神经网络方法,用于鉴定原核和真核信号肽和裂解位点的预测。INT J神经系统。1997,8:581-599。10.1142 / s0129065797000537。
- 34.
在真核细胞中预测蛋白质定位位点的知识库。基因组学。1992,14:897-911。10.1016 / s0888 - 7543(05) 80111 - 9。
- 35。
基于神经网络的叶绿体转运肽及其裂解位点预测方法。中国生物医学工程学报。1999,8:978-984。10.1110 / ps.8.5.978。
- 36。
尼尔森BK,蔡X,Nebenführ答:多颜色集体内拟南芥和其他植物的细胞器标记共同定位研究。植物学报,2007,51:1126-1136。10.1111 / j.1365 - 313 x.2007.03212.x。
- 37。
Kim HS, Desveaux D, Singer AU, Patel P, Sondek J, Dangl JL: The假单胞菌含油效应分子AvrRpt2从其c端酰基化的靶标RIN4拟南芥膜阻断RPM1激活。美国国家科学院学报。2005,102:6496-6501。10.1073 / pnas.0500792102。
- 38。
拟南芥RIN4的膜释放和稳定性研究假单胞菌含油AvrRpt2。植物营养与肥料学报。2005,18:1258-1268。10.1094 / mpmi - 18 - 1258。
- 39。
Lee SB, Ham BK, Park JM, Kim YJ, Paek KH: BnNHL18A通过胁迫诱导的化学处理表现出局部变化。生物化学学报,2006,32(5):459 - 461。10.1016 / j.bbrc.2005.10.210。
- 40.
Chong J,Le Hananff G,Bertsch C,Walter B:防御和信号基因的鉴定,表达分析和表征vitis Vinifera.植物营养与肥料学报。2008,32(4):469-481。10.1016 / j.plaphy.2007.09.010。
- 41.
Johansson A, Staal J, Dixelius C:早期的回应拟南芥-黄萎病longisporum病理系统依赖于NDR1, JA-和et相关信号通过胞质NPR1和RFO。植物生态学报,2006,19:958-969。10.1094 / mpmi - 19 - 0958。
- 42.
王志强,王志强,王志强,等拟南芥到咖啡橙锈菌(Hemileia vastatrix).植物学。2010,88:621-629。10.1139 / b10 - 039。
- 43.
汤普森GA,奥山H:脂质连接的植物蛋白。PROG脂质水库。2000年,39:19-39。10.1016 / S0163-7827(99)00014-4。
- 44.
克内珀C,萨瓦利E, B天:拟南芥NDR1是一种整合素样蛋白,在液体流失和浆膜细胞壁粘附中起作用。植物营养与肥料学报。2011,32(4):591 - 598。10.1104 / pp.110.169656。
- 45.
Goyal K,Walton LJ,Tunnacliffe A:Lea蛋白防止由于水胁迫引起的蛋白质聚集。Biochem J. 2005,388:151-157。10.1042 / BJ20041931。
- 46.
Belkhadir Y, Nimchuck Z, Hubert DA, Mackey D, Dangl JL:拟南芥RIN4负性调节疾病抗性由RPS2和RPM1介导或独立于NDR1信号调节剂,并不是细菌III型效应因子AvrRpt2或AvrRpm1的毒力功能所必需的。植物营养学报。2004,16(3):491 - 498。10.1105 / tpc.104.024117。
- 47.
Etienne H, Anthony F, Dussert S, Fernandez D, Lashermes P, Bertrand B:生物技术在咖啡改良中的应用(Coffea阿拉比卡l .)。体外细胞发育-植物。2002年,38:129-138。10.1079 / IVP2001273。
- 48.
Albuquerque EVS, Cunha WG, Barbosa AEAD, Teixeira JB, Vianna GR, Cabral GB, Fernandez D, grossid -de- sa MF:转基因咖啡水果Coffea阿拉比卡由bombardement转基因。体外细胞发育-植物。2009年,45:532 - 539。10.1007 / s11627 - 009 - 9254 - 2。
- 49.
用于植物基因高通量功能分析的门户克隆载体。植物生理学报。2003,33(3):462-469。10.1104 / pp.103.027979。
- 50.
Clough SJ,弯曲AF:花浸:一个简化的方法农杆菌属介导的变换拟南芥.植物学报1998,16:735-43。10.1046 / j.1365 - 313 x.1998.00343.x。
- 51.
Whalen MC, Innes RW, Bent AF, Staskawicz BJ:鉴别假单胞菌含油病原体的拟南芥和一个细菌位点决定两者的毒性拟南芥和大豆。植物细胞。1991年,3:49-59。
- 52。
引擎盖E,Gelvin SB,Melchers LS,Hoekema A:新农杆菌属用于基因转移到植物的辅助质粒。转基因Res。1993年,2:208-218。10.1007 / BF01977351。
- 53。
杰弗森·雷,卡瓦坦塔,Bevan MW:GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和多功能基因融合标记物。Embo J. 1987,6:3901-3907。
- 54。
Mongrand S, Morel J, Laroche J, Claverol S, Carde JP, Hartmann MA, Bonneu M, Simon-Plas F, Lessire R, Bessoules JJ:高等植物的脂筏。烟草质膜triton x -100不溶微域的纯化与表征。中国生物医学工程学报。2004,27(3):457 - 461。10.1074 / jbc.M403440200。
- 55.
布拉德福德WR:利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。安生物学习。1976,72:248-254。10.1016 / 0003-2697(76)90527-3。
- 56.
BAX抑制剂-1可调节内质网应激介导的细胞程序性死亡拟南芥.J Biol Chem。2008,283:3200-3210。
- 57.
Laemmli UK:在噬菌体T4的头部组装过程中裂解结构蛋白。自然。1970,227:680-685。10.1038 / 227680A0。
- 58.
Maudoux O,Batoko H,Oecking C,吉华K,VandekerckhoveĴ,Boutry男,Morsomme,P:一种植物质膜H + -ATP酶在酵母中表达是通过磷酸化在它的倒数第二个残基激活并在14-3-3调节蛋白的结合没有fusicoccin的。J Biol Chem。2000,275:17762-17770。10.1074 / jbc.M909690199。
- 59。
Larkin MA, Blackshields G, Brown NP, Chenna R, mcgetigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG: Clustal W and Clustal X version 2.0。生物信息学。2007,23:2947-2948。10.1093 /生物信息学/ btm404。
- 60.
Galtier N, Gouy M, Gautier C: SEAVIEW和PHYLO_WIN:两个用于序列比对和分子系统发育的图形工具。嘉。1996年,12:543 - 548。
- 61.
王志强,王志强,王志强:广义的定义拟南芥富含甾醇的膜微粒通过差异化处理与甲基β-环糊精和定量蛋白质组学。Mol细胞蛋白质组学。2009,8:612-623。10.1074 / MCP.M800346-MCP200。
确认
的拟南芥null突变体NDR1-1.是Brian J. Staskawicz博士(加州大学伯克利分校,加州,美国)慷慨的礼物。拟南芥他标记的BAX抑制剂1系是由Eric Lam博士(农业生物技术中心,Rutgers University,New Brunswick,NJ,USA)提供的。构建CD3-1008(MCHerry血浆膜标记)购自拟南芥生物资源中心(俄亥俄州州立大学,俄亥俄州俄亥俄州俄亥俄州)。我们要感谢Jane Glazebrot博士(明尼苏达大学,圣保罗,MN,USA),提供毒性和无毒的菌株假单胞菌含油PV。番茄用于本研究(DC3000,DC3000 :: AvrRpt2和DC3000 :: avrrps4.).我们感谢博士。Patrick Moreau和Su Melser对显微镜研究的贡献。我们也感谢波尔多成像中心(BIC, Université Bordeaux 2, UMS 3420 CNRS-US4 INSERM, Bordeaux, France)。我们也希望热情感谢Drs马克钻石,和让-吕克·Montillet批判性阅读手稿,以及Drs。Alison D Munson, Mark Diamond和William FJ Parsons担任英文编辑。这项工作得到了法国和巴西之间的双边合作协议(cape - cofecub n°Sv 555/07)的部分支持。我们声明与本研究中引用的任何工作没有利益冲突。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
JLC&ASP进行的生物信息学分析;JLC,ASP&JE进行克隆实验;JLC,SM和GC进行了显微学研究;JLC纯化质膜并进行了蛋白质印迹的方法;JLC,JE,LB&DF进行病原体接种和在Planta.生长测定;ASP进行了RT-QPCR实验;LB进行了统计分析。JLC,LB&DF设计/解释了实验。JLC&DF写了稿件。所有作者阅读并认可的终稿。
电子辅料
12870 _2011_926_moesm1_esm.pdf
附加文件1:全长对齐CaNDR1a编码序列及其拟南芥不相关的亲戚(联系)。按照图1图例中描述的方式执行对齐。对于序列ID,请参见图1中的图例。序列中三个NHL基序的位置用红色突出显示。(PDF 112 KB)
T2偏析结果
附加文件2:CaNDR1a在这项研究中使用的转基因株系.Hyg分离的表格R和界面年代在T2代植株的表型从三个T1转基因系拟南芥表达CaNDR1a。为进一步研究选择的T3品系来源于只给出Hyg的T2个体R在自交表型。(PDF 251 KB)
异位表达
附加文件3:CaNDR1a在拟南芥ndr1-1null突变体不会改变抵抗力假单胞菌含油PV。番茄(DC3000 ::AVRRPS4.).接种实验的进行情况见方法的部分。一个2×10-5cfu毫升-1接种物用于该实验,并进行实验两次。测量细菌生长在Planta.为期四天。平均值和标准误差(4个生物重复)显示了一个代表性的实验。在T0和4 dpi下,通过方差分析(ANOVA)对平方根转换数据进行方差分析,然后进行SNK检验(α < 0.05),对叶片细菌浓度的推定差异进行统计评估。采用非参数Kruskal-Wallis检验分析2 dpi时测量的数据。叶面细菌浓度在不同品种间无显著差异拟南芥基因型。(PDF 76 KB)
需要洗涤剂来从烟草叶中提取CANDR1A
附加文件4:。在烟草叶片中瞬时表达的candr1a标记蛋白,通过SDS-PAGE解析,然后通过免疫印迹技术转移到膜上。面板显示了与抗ha血清印迹的代表性膜对应的扫描膜(3个独立实验)。每道注射10 μg蛋白质。含有SDS提取的主要不溶蛋白的样品载于车道1-4;含有未经过SDS提取的主要可溶性蛋白的蛋白装载在5-8车道上。蛋白质提取物的制备方法如“方法'部分。泳道1&5,由表达双标签的CANDR1A蛋白的组织制备的样品;泳道2&6,用叶片制备的样品表达N-末端HA标记的CANDR1A蛋白;泳道3和7,阴性对照,用叶子制备的样品用用于重新悬浮的缓冲液渗透农杆菌属球团;4和8巷,阴性对照,非渗透叶片制备的样品。(PDF 8 KB)
12870 _2011_926_moesm5_esm.pdf
附加文件5:用于实时定量PCR方法的引物35 s: a: CaNDR1芥转换线。用于RT-qPCR的引物名称和序列。(PDF 83 KB)
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
新泽西州,杰。,Petitot, AS., Bernier, L.et al。咖啡非小种特异性抗病1 (NDR1)同源蛋白的鉴定与特性研究。BMC植物BIOL.11,144(2011)。https://doi.org/10.1186/1471-2229-11-144
收到了:
接受:
发表:
关键字
- 咖啡树
- 拟南芥直接同源
- 咖啡叶锈病
- 应变DC3000
- 咖啡锈病