- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
在没有DGAT1活性的情况下,PDAT1合成三酰基甘油依赖于LPCAT2对LPC的再酰化gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba12.gydF4y2Ba文章编号:gydF4y2Ba4gydF4y2Ba(gydF4y2Ba2012gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
的gydF4y2Ba拟南芥dgat1gydF4y2Ba突变体,gydF4y2BaAS11gydF4y2Ba,与野生型相比,其含油量下降30%,比野生型高18:3/20:1。尽管缺少功能性DGAT1,gydF4y2BaAS11gydF4y2Ba仍能使WT的籽油含量达到70%最近,它被证明在没有gydF4y2BaDGAT1gydF4y2Ba,gydF4y2BaPDAT1gydF4y2Ba对于正常的种子发展至关重要,是一个主要的决定因素gydF4y2Ba拟南芥gydF4y2Ba标记生物合成。gydF4y2Ba
方法gydF4y2Ba
生化、代谢及基因表达研究结合遗传杂交选择gydF4y2Ba拟南芥gydF4y2Ba已经开展了突变体以证明贡献gydF4y2Ba拟南芥gydF4y2BaPDAT1和LPCAT2在没有DGAT1活性。gydF4y2Ba
结果gydF4y2Ba
通过微阵列和RT-PCR基因表达分析gydF4y2BaAS11gydF4y2Ba与WT中型的单片机,我们观察到两种方法之间的一致趋势。gydF4y2BaFAD2.gydF4y2Ba和gydF4y2BaFAD3.gydF4y2Ba差异,gydF4y2BaFAE1.gydF4y2Ba下调,与之一致gydF4y2BaAS11gydF4y2Ba酰基表现型。gydF4y2BaPDAT1gydF4y2Ba表达上调gydF4y2BacagydF4y2Ba65%而65%gydF4y2BaPDAT2gydF4y2Ba表达上调只有15%,增强的主导作用gydF4y2BaPDAT1gydF4y2Ba在gydF4y2BaAS11gydF4y2Ba标记生物合成。的表达gydF4y2BaLPCAT2gydF4y2Ba50-75%的上调,而gydF4y2BaLPCAT1gydF4y2Ba表达未受显著影响。gydF4y2Ba在体外gydF4y2Ba在发育中期的微粒体蛋白制备中,LPCAT活性提高75-125%gydF4y2BaAS11gydF4y2Ba种子gydF4y2Bavs.gydF4y2Ba同源纯合敲除系gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba显示出对TAG生物合成的严重惩罚,延迟植物发育和结实率,即使有功能PDAT1;双突变体gydF4y2Badgat1 / lpcat1gydF4y2Ba仅略低于较低的油含量gydF4y2BaAS11gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
总的来说,数据强烈支持这一点gydF4y2BaAS11gydF4y2Ba这是gydF4y2BaLPCAT2gydF4y2Ba上调是用于协助PDAT1催化TAG生物合成,保持PC的供给作为共底物转移到主要负责gydF4y2Ba桑gydF4y2Ba-2部分gydF4y2Ba桑gydF4y2Ba-3放大的位置gydF4y2BaAS11gydF4y2BaDAG池。gydF4y2Ba
背景gydF4y2Ba
三酰基甘油(trigacylglycerols, tag)是许多植物种子、花瓣、花药、花粉粒和果中果皮发育过程中积累的主要贮藏脂质[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].标签被认为不仅是种子萌发的主要能量来源,而且是许多植物花粉发育和有性生殖所必需的[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].在油籽,TAG bioassembly由内质网操作Kennedy途径的膜结合酶催化[gydF4y2Ba4gydF4y2Ba].三种酰基转移酶:甘油-3-磷酸酰基转移酶(GPAT)、甘油-3-磷酸酰基转移酶(GPAT)和甘油-3-磷酸酰基转移酶(GPAT)。gydF4y2BalysogydF4y2Ba-磷脂酸酰基转移酶(LPAAT)和甘油二酰基转移酶(DGAT)。DGAT催化DAG最终酰化生成TAG,这被认为是植物脂质积累的限速步骤。gydF4y2Ba
在传统的肯尼迪途径中,DGAT被认为是唯一只使用酰基-CoA作为其酰基供体标记生物合成的酶。首先gydF4y2BaDGATgydF4y2Ba基因克隆自小鼠,属于DGAT1家族,与固醇:acyl-CoA acyltransferase [gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
我们之前已经描述了ems诱导的突变体gydF4y2Ba拟南芥gydF4y2Ba,指定gydF4y2BaAS11gydF4y2Ba,其显示出储存的种子标签,延迟种子发育和改变的脂肪酸组合物的减少[gydF4y2Ba6gydF4y2Ba].我们分析了WTgydF4y2Ba与AS11gydF4y2Ba在此发育阶段,对完整种子进行了平行标记,gydF4y2Ba14.gydF4y2BaC)醋酸。我们发现,与WT相比,DAG池中的所有脂肪酸均有增加gydF4y2BaAS11gydF4y2Ba种子在发展中期,并在较小程度上,脂肪酸在PC池的相关备份。在AS11中,DAG从WT的1%升高到10-12%,PC池从WT的2%升高到8-12%gydF4y2BaAS11gydF4y2Ba.从野生型和gydF4y2BaAS11gydF4y2Ba研究人员比较了处于发育中期的绿色种子吸收[gydF4y2Ba14.gydF4y2BaC]-18:1-CoA在G-3-P存在下生成甘油脂。WT中标记LPA和PA在潜伏期形成的比例相似gydF4y2Bavs AS11gydF4y2Ba,表明肯尼迪途径酶GPAT和LPAAT(EC 2.3.1.51)的活动相对不受影响gydF4y2BaAS11gydF4y2Ba突变体。然而,标记的TAG所占比例要低得多,而DAG所占比例要高得多gydF4y2BaAS11gydF4y2Ba.因此,TAG/DAG比率始终降低了3-5倍gydF4y2BaAS11gydF4y2Ba与所有发展阶段(早期,发展和晚期开发)相比。此外,18:3/20:1的比率显着增加了约7-10折[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
累积起来,这些数据提示gydF4y2BaDGAT1gydF4y2Ba这是后来在克隆突变基因从gydF4y2BaAS11gydF4y2Ba.有一个81bp内插入插入完全由转录物中的外显子2组成gydF4y2BaAS11gydF4y2Ba.重复序列中的外显子2被正确拼接,因此转录本的改变不会干扰阅读框。然而,这个额外的外显子2序列gydF4y2BaAS11gydF4y2Ba转录产物会导致DGAT蛋白发生改变,内含27个氨基酸(gydF4y2Ba131.gydF4y2Bashaglfnlcvvvliavnsrliienlmk.gydF4y2Ba157.gydF4y2Ba)[gydF4y2Ba7gydF4y2Ba].值得注意的是,另外两个实验室独立地同时克隆了gydF4y2BaA. Thaliana.gydF4y2BaDGAT1gydF4y2Ba[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
研究如何操纵表达gydF4y2BaDGAT1gydF4y2Ba我们演示了这个表达式gydF4y2Ba拟南芥DGAT1gydF4y2BaCDNA以种子特定的方式gydF4y2BaAS11gydF4y2Ba突变体恢复野生类型的标签和VLCFA内容。酰基分布,具体而言,gydF4y2Ba桑gydF4y2Ba-3标签的组合物,也被恢复到WT的比例。此外,过度的gydF4y2Ba拟南芥DGAT1gydF4y2Ba在野生型植物中导致种子含油量和重量的增加[gydF4y2Ba10.gydF4y2Ba].在过去的10年里,gydF4y2BaDGAT1gydF4y2Ba表达已经被基因操纵来产生gydF4y2Ba芸苔属植物显著gydF4y2Ba含有增加的种子油的原型[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba].gydF4y2Ba
第二个家庭gydF4y2BaDGATgydF4y2Ba基因(gydF4y2BaDGAT2gydF4y2Ba),最早在油类真菌中发现gydF4y2BaMorteriella ramannianagydF4y2Ba,与DGAT1无序列相似性[gydF4y2Ba13.gydF4y2Ba].一个人的gydF4y2BaDGAT2gydF4y2Ba和植物gydF4y2BaDGAT2sgydF4y2Ba从桐油和蓖麻随后通过Cases等标识。[gydF4y2Ba14.gydF4y2Ba, Shockey等人[gydF4y2Ba15.gydF4y2Ba]和Kroon等人。[gydF4y2Ba16.gydF4y2Ba),分别。在假定的gydF4y2BaDGAT2gydF4y2Ba从gydF4y2Ba拟南芥gydF4y2Ba已经被包括我们在内的几个实验室研究过;在酵母中功能性表达尚未成功,因此是否为真正的功能性DGAT仍是一个问题。值得注意的是,一个gydF4y2Ba拟南芥dgat2gydF4y2Ba敲除突变体具有野生型种子油含量和脂肪酸组成[gydF4y2Ba17.gydF4y2Ba].gydF4y2Ba
标签也可以通过酰基 - 辅酶 - 辅酶酰基酶,磷脂酰胆碱:二酰基甘油酰基转移酶(PDAT)形成,其中酰基来自酰基gydF4y2BaSN-gydF4y2BaPC的2位置向gydF4y2Ba桑gydF4y2BaDAG -3位置产生TAG和gydF4y2BaSN-gydF4y2Ba1gydF4y2BalysogydF4y2Ba-个人电脑 [gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba].在酵母中指数生长阶段,PDAT1是标签合成中的主要决定因素。在gydF4y2BaArabidopsigydF4y2BaS,两个亲密的同源酵母gydF4y2BaPDATgydF4y2Ba基因已被确定:gydF4y2BaPDAT1gydF4y2BaAT5G13640和gydF4y2BaPDAT2gydF4y2BaAt3g44830 [gydF4y2Ba20.gydF4y2Ba].Mhaske等人[gydF4y2Ba21.gydF4y2Ba]孤立和表征敲除突变体gydF4y2Ba拟南芥gydF4y2Ba有T-DNA插入的gydF4y2BaPDAT1gydF4y2Ba轨迹AT5G13640(PDAT1,EC 2.3.1.158)。在该突变体上进行脂质分析,以评估PDAT1对种子脂质生物合成的贡献;令人惊讶的是,与酵母的情况相比,种子中的油含量和组成没有显示出突变体的显着变化。当时,这些结果被解释为表示由AT5G13640编码的PDAT1活动不是标签合成的主要决定因素gydF4y2Ba拟南芥gydF4y2Ba种子。gydF4y2Ba
尽管如此,因为拟南芥DGAT1突变体gydF4y2BaAS11gydF4y2Ba显示油含量下降30-35%[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,很明显,在发育的种子中,一定有其他酶参与合成油脂[gydF4y2Ba22.gydF4y2Ba].因此,检查DGAT2,PDAT2或PDAT1对油沉积的贡献gydF4y2BaAS11gydF4y2Ba本研究采用双突变体与gydF4y2BaAS11gydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].而gydF4y2Badgat2-kogydF4y2Ba品系无油表型,纯合双突变体由杂交而来gydF4y2BaAS11gydF4y2Ba与gydF4y2Badgat2-kogydF4y2Ba突变体表现出类似于gydF4y2BaAS11gydF4y2Ba.用所观察到的相同的图案gydF4y2Bapdat2-KOgydF4y2Ba突变体单独和在杂交gydF4y2Bapdat2-KOgydF4y2Ba突变体与gydF4y2BaAS11gydF4y2Ba.相反,而且gydF4y2Bapdat1-ko.gydF4y2Ba无油或脂肪酸组成表型,杂交的gydF4y2Bapdat1-ko.gydF4y2Ba与gydF4y2BaAS11gydF4y2Ba在双纯合条件下是胚胎致死的;只有杂合子系产生的表达gydF4y2BaPDAT1gydF4y2Ba或gydF4y2BaDGAT1.gydF4y2Ba基因仅被RNAi部分抑制,允许对双突变体进行检测。这些详细的研究结果表明,DGAT1和PDAT1在胚胎发育和发育中的种子和花粉中TAG生物合成方面具有重叠的功能。当DGAT1在gydF4y2BaAS11gydF4y2Ba,它是PDAT1,而不是DGAT2或PDAT2,负责合成的剩余的65-70%的标签。这一发现提出了一个专业,也许PDAT1在这个过程中的主要作用[gydF4y2Ba17.gydF4y2Ba].gydF4y2Ba
最近,特定脚轮gydF4y2BaPDATgydF4y2Ba,gydF4y2BaPDAT1-2gydF4y2Ba,被克隆并发现在发育的种子中高表达,定位于ER,类似于蓖麻FAH12羟化酶。转基因gydF4y2Ba拟南芥gydF4y2Ba共同表达castorgydF4y2BaPDAT1-2gydF4y2Ba和gydF4y2BaFAH12.gydF4y2Ba在tag中蓖麻油酸盐的积累可达25%(在tag中为17%)gydF4y2BaFAH12.gydF4y2Ba- only转基因)[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].这项研究表明,特殊的PDATs可能在pc合成的不寻常脂肪酸如蓖麻油或环氧脂肪酸(如蓖麻油)的通道中发挥重要作用gydF4y2Ba斑鸠菊科gydF4y2Ba),进TAG中。gydF4y2Ba
关键角色PDAT1的发现具有标签合成[gydF4y2Ba17.gydF4y2Ba]建议重新酰化的重要性gydF4y2BalysogydF4y2Ba磷脂和尤其是LPC,因为它是由于PDAT1活性产生的。我们假设在标签合成责任转移到PDAT1的情况下,例如在gydF4y2BaAS11 dgat1gydF4y2Ba突变体,重新酰化酶活性的深刻变化是明显的。作为编码此类酶的基因的候选者,我们提出了这两种gydF4y2Ba拟南芥gydF4y2Ba基因gydF4y2BaLPLAT1gydF4y2Ba(AT1G12640)和gydF4y2BaLPLAT2gydF4y2Ba(At1g63050),特征为Ståhl等[gydF4y2Ba25.gydF4y2Ba具有广泛的专一性gydF4y2BalysogydF4y2Ba磷脂酰基转移酶活性。虽然两种基因在一定程度上都可以酰化一系列不同的gydF4y2BalysogydF4y2Ba磷脂,它们被证明对LPC有强烈的偏好。因此,我们选择给这两个基因命名gydF4y2BaLPCAT1gydF4y2Ba(AT1G12640)和gydF4y2BaLPCAT2gydF4y2Ba(At1g63050)。gydF4y2Ba
在这里,我们报告了进一步的遗传和生化特征gydF4y2BaAS11 dgat1gydF4y2Ba突变体。在基因芯片和qRT-PCR研究过程中gydF4y2BaAS11 VSgydF4y2BaWT基因在发育中期的角子细胞中的表达,我们发现gydF4y2BaLPCAT2gydF4y2Ba编码酰coa:gydF4y2BalysogydF4y2Ba磷脂酰胆碱酰基转移酶2(EC 2.3.1.23),上调gydF4y2BaLPCAT1gydF4y2Ba并没有受到影响。通过一系列的生化研究和关键交叉gydF4y2BaAS11gydF4y2Ba与两者gydF4y2Balpcat1或lpcat2gydF4y2Ba敲除突变体后,我们确定LPCAT2 (LPCAT1)是最关键的TAG合成gydF4y2BaAS11gydF4y2Ba突变体,主要是为了保持用于TAG的PC池组件主要由PDAT1催化。gydF4y2Ba
结果与讨论gydF4y2Ba
的总结gydF4y2BaAS11gydF4y2Ba突变体发育和油表型gydF4y2Ba
的gydF4y2BaAS11gydF4y2Ba突变株的抽薹时间比WT晚一周左右,进入生殖阶段,因此,在我们的生长条件下,gydF4y2BaAS11gydF4y2Ba与WT中观察到的花期后3周相比,结实率也推迟了4周gydF4y2BaDGAT1gydF4y2Ba变种人,这是我们指定的gydF4y2BaA7gydF4y2Ba,这是一个纯合的Salk线(Salk 039456),其在最后外显子中的T-DNA插入gydF4y2BaDGAT1gydF4y2Ba基因(At2g19450)。gydF4y2BaA7gydF4y2Ba显示出类似于展览的发育延迟gydF4y2BaAS11gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。gydF4y2Ba
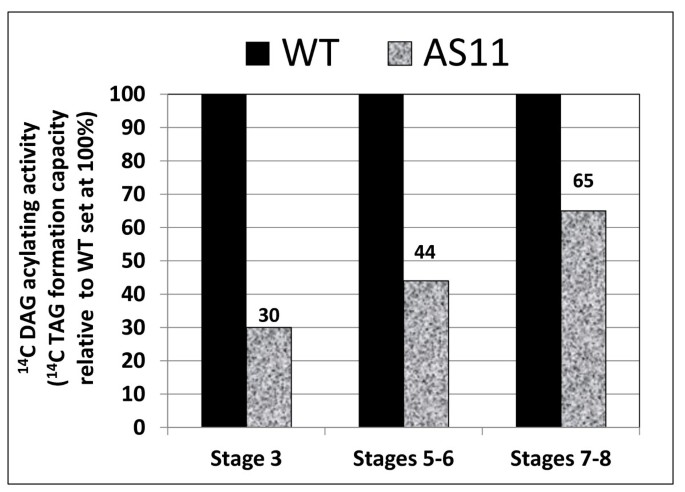
使用由wt和wt制备的蛋白质级分gydF4y2BaAS11gydF4y2Ba我们能够确定突变系中TAG组装活性的相对变化。在WT和gydF4y2BaAS11gydF4y2Ba线条gydF4y2Ba14.gydF4y2BaC标记的二油精和未标记的油酰 - 辅酶A作为共底物;的gydF4y2Ba14.gydF4y2Bac标记的三油酸产物如前所述用放射性高效液相色谱法测定[gydF4y2Ba26.gydF4y2Ba].如图gydF4y2Ba1gydF4y2Ba,在7-8阶段,放射性标记的DAG的酰化下降了35%gydF4y2BaAS11gydF4y2Ba,这一发现与gydF4y2BacagydF4y2Ba成熟的油含量减少30%gydF4y2BaAS11gydF4y2Ba种子(gydF4y2Ba6gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba].gydF4y2Ba
异源表达突变gydF4y2Ba拟南芥DGAT1gydF4y2Ba年代从gydF4y2BaA7gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba在酵母菌菌株中gydF4y2BaH1246MATα.gydF4y2Ba
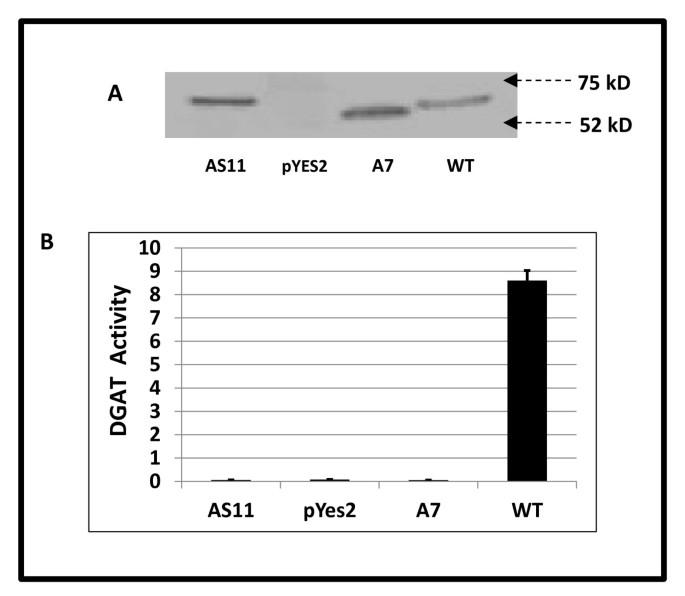
脂肪酸改变和低TAG表型gydF4y2BaAS11gydF4y2Ba种子提出了问题,如何gydF4y2BaAS11gydF4y2Ba突变体仍然能够产生65-70%的WT水平的种子油。因为gydF4y2BaAS11gydF4y2Ba有降低的TAG表型,确定DGAT1在gydF4y2BaAS11gydF4y2Ba只是发生了突变,并表现出我们最初认为的活动减少[gydF4y2Ba6gydF4y2Ba[实际上是非功能性的。这并没有得到确认。在PCR评估中,这样做的重要性将变得显而易见gydF4y2BaDGAT1.gydF4y2Ba记录在两个gydF4y2BaAS11gydF4y2Ba以及在当前研究中进行的一些遗传杂交,并在下面讨论。来自gydF4y2BaAS11gydF4y2Ba在半乳糖诱导基因的控制下,克隆到酵母表达载体pYES2.1中gydF4y2BaGAL1gydF4y2Ba启动子,并利用该构建物转化酵母突变株gydF4y2BaH1246MATα.gydF4y2Ba,它缺乏所有四种基因,gydF4y2BaARE1gydF4y2Ba,gydF4y2BaARE2gydF4y2Ba,gydF4y2BaDGAT1gydF4y2Ba和gydF4y2BaLRO1.gydF4y2Ba,发现有助合成TAG [gydF4y2Ba27.gydF4y2Ba].该酵母突变体已成功用于DGAT功能的研究,其中WT和突变形式的植物dgat1已被表达,从而推断其在植物中的功能或缺乏[gydF4y2Ba28.gydF4y2Ba- - - - - -gydF4y2Ba32.gydF4y2Ba].gydF4y2BaH1246MATα.gydF4y2Ba含有空pYES2.1载体质粒或用WT转化的酵母细胞gydF4y2BaDGAT1gydF4y2BacDNA分别用作阴性和阳性对照(图gydF4y2Ba2gydF4y2Ba).从诱导酵母中分离的微粒体膜组分的western blotgydF4y2BaH1246MATα.gydF4y2Ba细胞(图gydF4y2Ba2AgydF4y2Ba)显示突变gydF4y2BaAS11gydF4y2Ba和gydF4y2BaA7gydF4y2Ba和WT DGAT1蛋白(计算MgydF4y2BargydF4y2Ba62.2 kD的,53.9 kD和58.9 kD的,分别地)的稳定表达。在pYES质粒仅转化体,既没有检测DGAT1蛋白,也不具有类似尺寸的非DGAT1蛋白抗体的非特异性交叉反应性。西方表明,gydF4y2BaAS11gydF4y2BaDGAT1比WT略大(27个氨基酸,可能是由于外显子2重复),而对于gydF4y2BaA7gydF4y2BaDGAT1可能是最大的稳定转录本(在T-DNA插入开始时被截断),其编码的蛋白明显小于WT。然而,如图所示gydF4y2Ba2B.gydF4y2Ba,gydF4y2BaAS11gydF4y2BaDGAT1不能弥补此酵母四重突变体不能产生TAG的缺陷。同样,当我们检测转化的酵母微粒体蛋白组分时gydF4y2Ba在体外gydF4y2Ba对于使用未标记的油椰子(18:1)作为酰基供体的DGAT活性,以及gydF4y2Ba14.gydF4y2BaC -gydF4y2Ba桑gydF4y2Ba-1,2二烯烃(18:1)为受体,在突变的酵母菌株中未检测到酶活性gydF4y2BaDGAT1gydF4y2Ba互补脱氧核糖核酸的gydF4y2BaAS11gydF4y2Ba突变体和空对照pYES2.1载体,但在WT阳性对照中发现。这表明,也许并非意外,但这是第一次,突变的dgat1来自gydF4y2BaAS11gydF4y2Ba是功能性的。同样地,截断的DGAT1gydF4y2BaA7gydF4y2Ba突变体(Salk-039456)显示在表达时是非功能性的gydF4y2BaH1246MATα.gydF4y2Ba细胞(图gydF4y2Ba2B.gydF4y2Ba).gydF4y2Ba
突变的表达gydF4y2BaA7gydF4y2Ba和gydF4y2BaAS11 DGAT1.gydF4y2Ba和WTgydF4y2BaDGAT1gydF4y2BaCDNA in.gydF4y2BaH1246MATα.gydF4y2Ba缺乏DGAT1活性的酵母细胞gydF4y2Ba.插入照片(gydF4y2Ba一个gydF4y2Ba)的western blot结果显示,52 kD和75 kD M的DGAT蛋白在每个裂解液中表达gydF4y2BargydF4y2Ba箭头表示的标记位置。(gydF4y2BaBgydF4y2Ba)各裂解物DGAT活性(以pmol计gydF4y2Ba14.gydF4y2BaC三脂形成·mingydF4y2Ba-1gydF4y2Ba·(mg蛋白质)gydF4y2Ba-1gydF4y2Ba在......的存在下gydF4y2Ba14.gydF4y2Bac -1,2 diolein和18:1-CoA)报道为三次重复测定的平均值±s.dgydF4y2BaAS11gydF4y2Ba和gydF4y2BaA7gydF4y2BaDGAT1s非功能性。gydF4y2Ba
因此,我们的结果强烈支持DGAT1在发育中的种子中不起作用gydF4y2BaAS11gydF4y2Ba突变体线。显然,在蛋白质组分中观察到(放射性标记的)TAG形成gydF4y2BaAS11gydF4y2Ba从另一条路径,而不是通过降低DGAT1催化来了。gydF4y2Ba
鉴于PDAT1在石油生物合成中的重要性gydF4y2Ba拟南芥gydF4y2Ba正如我们前面定义[gydF4y2Ba17.gydF4y2Ba,并将这些新信息与gydF4y2Ba14.gydF4y2BaC TAG生物合成可用于WT的测定gydF4y2Bavs AS11gydF4y2Ba蛋白组分上面报告,它提出的问题是,如果不从DGAT1,DGAT2也不PDAT2,什么生化步骤,除了PDAT1可能是TAG生物合成的关键?gydF4y2Ba
AS11微阵列和QRT-PCR分析gydF4y2Ba
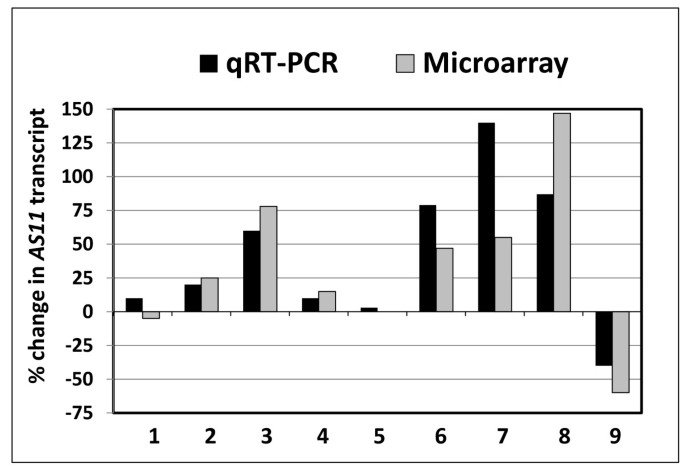
这些累积的发现促使我们考察了可以参与调节脂质生物合成中基因转录物/编码的蛋白质的更广泛的库存gydF4y2BaAS11gydF4y2Ba当DGAT1活性受到损害,相比于WT它们相应的表达模式。因此,我们在种子中期开发的突变体进行的基因表达的微阵列分析gydF4y2BaAS11gydF4y2Ba和WTgydF4y2Ba拟南芥gydF4y2Ba.基于选定的可能的脂质聚集相关转录本[gydF4y2Ba33.gydF4y2Ba]通过微阵列研究差异化,我们用半定量QRT-PCR分析补充了这一点,并比较了百分比变化gydF4y2BaAS11gydF4y2Ba转录物相对于wt,每个。虽然任何方法都没有真正定量,但gydF4y2Ba定性趋势gydF4y2Ba在每项研究中都高度一致(图gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
从微阵列数据和半定量RT-PCR数据中选择的脂质代谢基因表达的变化的比较,每个rT-PCR数据呈现为%变化gydF4y2BaAS11gydF4y2Ba转录物(相对于WT)gydF4y2Ba.使用与含有WT和含有WT和含量的中型模件分离的相同的三份生物RNA样品进行了两次评估。gydF4y2BaAS11gydF4y2Ba胚胎处于7-8阶段。基因被编号为1-9,并按缩略词和AGI号命名,如下:(1)gydF4y2BaDGAT1gydF4y2Ba(At2g19450);(2)gydF4y2BaDGAT2gydF4y2Ba(At3g51520);(3)gydF4y2BaPDAT1gydF4y2Ba(At5g13640);(4) PDAT2 (At3g44830);(5)gydF4y2BaLPCAT1gydF4y2Ba(At1g12640);(6)gydF4y2BaLPCAT2gydF4y2Ba(AT1G63050);(7)gydF4y2BaFAD2.gydF4y2Ba(At3g12120);(8)gydF4y2BaFAD3.gydF4y2Ba(At2g29980);(9)gydF4y2BaFAE1.gydF4y2Ba(AT4G34250)。gydF4y2Ba
从这些组合的基因表达研究一些一般性意见如下:在gydF4y2BaAS11gydF4y2Ba,gydF4y2BaFAE1.gydF4y2Ba是衰减,gydF4y2Ba集鱼2gydF4y2Ba&gydF4y2Ba3.gydF4y2Ba差异;这与gydF4y2BaAS11gydF4y2Ba酰基组成曲线(减少20:1并升高18:3)。gydF4y2BaDGAT1gydF4y2Ba表达未受显著影响。有趣的是,gydF4y2BaLPCAT2gydF4y2Ba平均上调了65%,而gydF4y2BaLPCAT1gydF4y2Ba表情冷漠。gydF4y2BaPDAT2gydF4y2Ba只有轻微的影响,但是gydF4y2BaPDAT1gydF4y2Ba表达较WT平均上调62%。gydF4y2Ba
鉴于PDAT1在胚胎发育和花粉和种子中TAG沉积中的关键作用[gydF4y2Ba17.gydF4y2Ba,我们感兴趣的是gydF4y2BaLPCAT1gydF4y2Ba和gydF4y2BaLPCAT2gydF4y2Ba之间的表达式gydF4y2BaAS11gydF4y2Ba突变和WT。我们假设一个acyl-CoA-dependent LPCAT也许是至关重要的维持PC池作为共基质PDAT1-catalyzed标记合成,尤其是在缺乏功能DGAT1和执行一系列的遗传和代谢研究这些关系。gydF4y2Ba
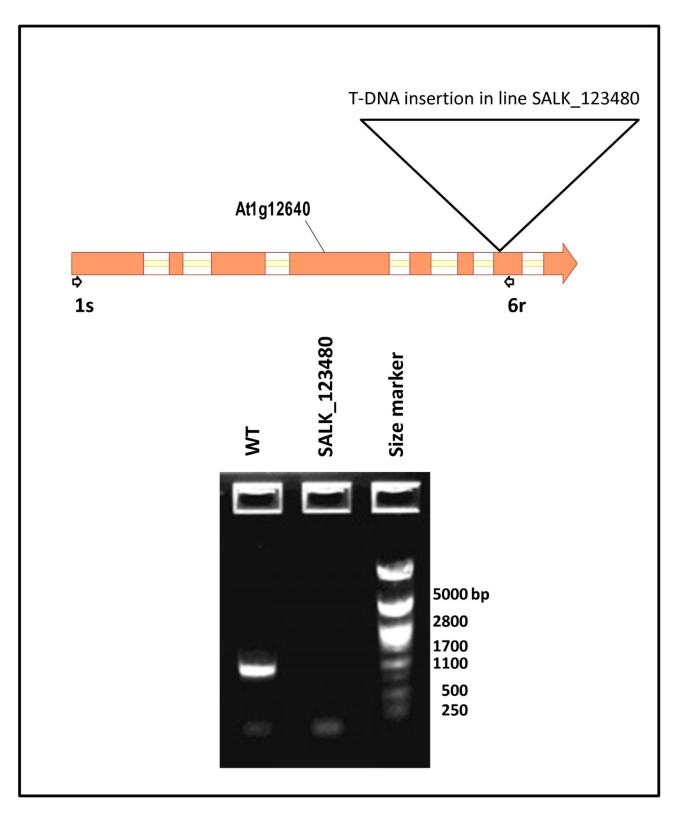
RT-PCR表征gydF4y2Balpcat1gydF4y2Ba,gydF4y2Balpcat2gydF4y2Ba和gydF4y2BaDGAT1.gydF4y2Ba(gydF4y2BaAS11gydF4y2Ba)突变体gydF4y2Ba
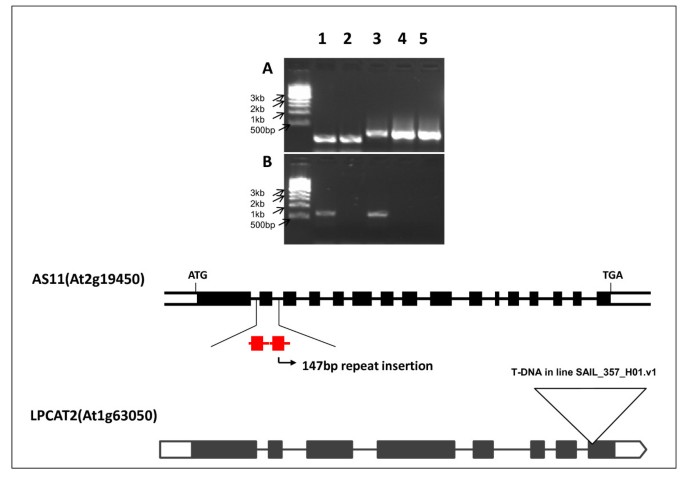
除了WT和gydF4y2BaAS11gydF4y2Ba行,我们选择了在假定的突变加入线gydF4y2BaLPCAT1gydF4y2Ba和gydF4y2BaLPCAT2gydF4y2Ba,并用RT-PCR表征每个单独的突变体以确认每条线的转录表型。如图gydF4y2Ba4gydF4y2Ba,在假定中gydF4y2Balpcat1gydF4y2Ba突变体的gydF4y2BacagydF4y2Ba缺失1100 bp的转录本,但在对照(WT)样本中扩增,表明At1g12640突变体确实是一个敲除gydF4y2BaLPCAT1gydF4y2Ba基因。如图所示gydF4y2Ba5B.gydF4y2Ba,泳道2,频带放大为gydF4y2BaLPCAT2gydF4y2Ba成绩单在推定中不存在gydF4y2Balpcat2gydF4y2Ba突变体,但存在于wt和gydF4y2BaAS11gydF4y2Ba突变体(分别为第1和第3车道)证实At1g63050线是一个敲除的gydF4y2BaLPCAT2gydF4y2Ba基因。正如预期的那样,WT和ThegydF4y2Balpcat2gydF4y2Ba突变体样品是阳性的WTgydF4y2BaDGAT1gydF4y2Ba扩增子(图gydF4y2Ba5AgydF4y2Ba,分别为泳道1和3)。如图gydF4y2Ba5AgydF4y2Ba,第三道gydF4y2BaAS11gydF4y2Ba突变体gydF4y2BaDGAT1.gydF4y2Ba转录物存在时,编码符合读框的外显子2,27个氨基酸的重复序列,扩增的片段是81bp的比较大的WT并在发现gydF4y2Balpcat2gydF4y2Ba突变体。然而,如图所示gydF4y2Ba2gydF4y2Ba如上所述,尽管目前存在,我们从酵母表达研究中获得了非常有力的证据,表明该转录本编码的突变体dgat1是非功能性的。gydF4y2Ba
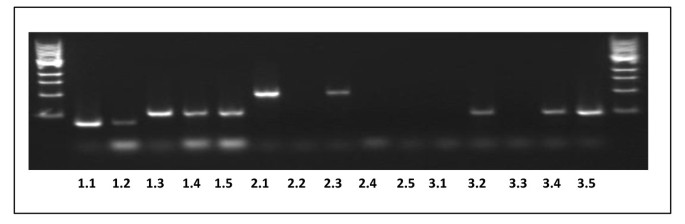
(gydF4y2Ba一个gydF4y2Ba)gydF4y2BaDGAT1gydF4y2BaLane 1: WT;巷2gydF4y2Balpcat2gydF4y2BaH单突变体,3巷gydF4y2BaAS11gydF4y2BaDGAT1.gydF4y2Ba单突变体;巷4gydF4y2Badgat1 / lpcat2gydF4y2Bah / h双突变线#6-3-10-19;泳道5.gydF4y2Badgat1 / lpcat2gydF4y2Bah / h双突变线#6-3-20-1gydF4y2Ba.(gydF4y2BaBgydF4y2Ba)gydF4y2BaLPCAT2gydF4y2Ba表达:Lane 1: WT;巷2gydF4y2Balpcat2gydF4y2BaH单突变体SAIL_357_H01, Lane 3-gydF4y2BaAS11 dgat1gydF4y2Ba单突变体;巷4gydF4y2Badgat1 / lpcat2gydF4y2Bah / h双突变线#6-3-10-19;泳道5.gydF4y2Badgat1 / lpcat2gydF4y2Bah / h双突变线#6-3-20-1。使用RT-PCR使用gydF4y2BaDGAT1gydF4y2Ba- 特异性的引物(gydF4y2Ba一个gydF4y2Ba) 和gydF4y2BaLPCAT2gydF4y2Ba- 特异性的引物(gydF4y2BaBgydF4y2Ba)如“方法”所述。图显示147 bp的重复插入位置gydF4y2BaAS11 DGAT1.gydF4y2Ba基因和T-DNA插入位点gydF4y2BaLPCAT2gydF4y2Ba基因。gydF4y2Ba
代谢研究gydF4y2Ba
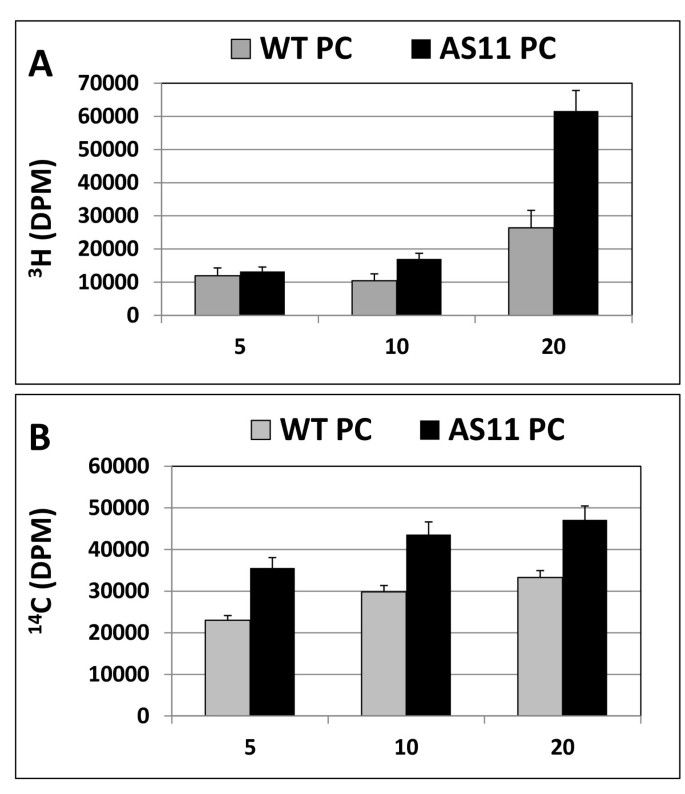
我们进行了gydF4y2Ba在体外gydF4y2BaLPCAT在时间过程中测定蛋白质级分的孵育gydF4y2BaAS11gydF4y2Ba和WT在种子发育中,存在gydF4y2Ba桑gydF4y2Ba-1 palmitoyl-gydF4y2Ba3.gydF4y2BaH LPC的+gydF4y2Ba14.gydF4y2BaC-18:1-CoA和跟随gydF4y2Ba3.gydF4y2BaH和gydF4y2Ba14.gydF4y2BaÇ标注在PC模式。如图gydF4y2Ba6AgydF4y2Ba的gydF4y2Ba3.gydF4y2BaH积累模式表明氚化PC是快速合成的gydF4y2Ba3.gydF4y2Bahlpc的速率是在gydF4y2BaAS11gydF4y2Ba在20分钟内比WT。基于比例gydF4y2Ba桑gydF4y2Ba-2gydF4y2Ba14.gydF4y2Ba掺入到PCÇ油酰基部分,所述LPCAT活性始终较高40-60%gydF4y2BaAS11gydF4y2Ba在所有时间点(图gydF4y2Ba6B.gydF4y2Ba).同样,比例gydF4y2Ba3.gydF4y2Ba中的H LPC伴随降低在gydF4y2BaAS11gydF4y2Ba在此期间相对于wt(数据未显示)。这表明了gydF4y2BaAS11gydF4y2Ba,LPCAT活性相对于WT强烈增强。gydF4y2Ba
在发育中含有WT和gydF4y2BaAS11gydF4y2Ba7-8阶段的胚胎(在方法中指定)gydF4y2Ba.LPCAT活性监测通过(gydF4y2Ba一个gydF4y2Ba)gydF4y2Ba3.gydF4y2Ba手 (gydF4y2BaBgydF4y2Ba)gydF4y2Ba14.gydF4y2BaC PC中的C标签,在20分钟内孵育WT或gydF4y2BaAS11gydF4y2Ba蛋白质在L-α-palmitoyl-[1- -gydF4y2Ba3.gydF4y2BaH甲基]gydF4y2BalysogydF4y2Ba3-phosphatidylcholine和[1 -gydF4y2Ba14.gydF4y2BaC] 18:1-CoA。数据代表两个实验重复的平均值±标准差。虽然绝对值不同,但在第二个独立的生物复制中观察到相似的趋势。gydF4y2Ba
我们还表演了gydF4y2Ba体内gydF4y2Ba我们提供的饲料研究gydF4y2Ba14.gydF4y2Ba醋酸C对栓茎含有荚果与中期发展的两种种子gydF4y2BaAS11gydF4y2Ba和WT植物,然后在追逐7,24和30小时后分析中显影种子中的各种脂质级分中的标记图案。两个主要差异立即显而易见(图gydF4y2Ba7gydF4y2Ba):gydF4y2BaAS11gydF4y2Ba显示出较高的相对合并gydF4y2Ba14.gydF4y2BaÇ到PC和的更低的相对掺入gydF4y2Ba14.gydF4y2BaC在时间课程中进入标记。这些趋势与LPCAT活性升高和减少标签合成完全一致gydF4y2BaAS11gydF4y2Ba如图所示gydF4y2Ba在体外gydF4y2Balpcat(图gydF4y2Ba6gydF4y2Ba)和DGAT1(图gydF4y2Ba1gydF4y2Ba)分析。gydF4y2Ba
基于这些趋势,我们有信心,除了DGAT1和PDAT1,LPCAT起着TAG合成一个显著的作用,并推测它不仅对膜的开发和酰基营业额是非常重要的在其中,但也补充PC对于PDAT1供应催化的生物合成TAG在发育的种子。要解决这个问题,我们需要学习的时候都发生了什么gydF4y2BaDGAT1gydF4y2Ba和gydF4y2BaLPCATgydF4y2Ba表达是共破坏的。gydF4y2Ba
遗传十字架gydF4y2Ba
它以前已经证明,按照在酵母表达gydF4y2BaLCA1δgydF4y2Ba变种人的背景gydF4y2Ba拟南芥LPCAT1gydF4y2Ba(AT1G12640)和gydF4y2BaLPCAT2gydF4y2Ba(AT1G63050)是功能性LPCATS。在......的存在下gydF4y2Ba桑gydF4y2Ba1 (gydF4y2Ba14.gydF4y2BaC] 16:0-LPC和18:1 - 辅酶A(在当前的研究中所用基片的相同的组合),表示LPCAT1和LPCAT2蛋白具有12纳摩尔/分钟/ mg / mg蛋白质和18纳摩尔/分钟/毫克的活动蛋白,分别[gydF4y2Ba34.gydF4y2Ba].gydF4y2Ba
如确认通过RT-PCR(上面讨论的),gydF4y2Balpact1gydF4y2Ba(AT1G12640)和gydF4y2Balpcat2gydF4y2Ba(At1g63050)是各自基因的T-DNA插入敲除,而gydF4y2BaAS11gydF4y2Ba编码突变和非功能(图gydF4y2Ba2gydF4y2Ba)DGAT1。检查这两个LPCATS与DGAT1之间的关系,我们在生物合成中进行了交叉gydF4y2BaAS11 dgat1gydF4y2Ba与gydF4y2Balpcat1gydF4y2Ba或者是gydF4y2Balpcat2gydF4y2BaT-DNA插入敲除突变体,其特征在于嗜血型/纯合,双敲除籽油谱。gydF4y2Ba
DGAT1×LPCAT1gydF4y2Ba
的gydF4y2Balpcat1gydF4y2Ba与其零偏析或WT相比,突变体没有任何显着的油表型(图gydF4y2Ba8gydF4y2Ba).十字架gydF4y2BaAS11 (dgat1)gydF4y2Ba与gydF4y2Balpcat1gydF4y2Ba两种突变产生后代纯合。双纯合突变体显示出正常的植物发育和种子组。张等人。[gydF4y2Ba17.gydF4y2Ba]显示没有DGAT1,PDAT1路线在AS11中贡献了75%的油;因此即使没有[DGAT1 + LPCAT1]的组合贡献,PDAT1路线仍然可以在开发中提供高达70%的石油gydF4y2BaAS11gydF4y2Ba种子。换句话说,LPCAT1和DGAT1的同时损失仅使pdat1催化的石油合成能力降低了5%。gydF4y2Ba
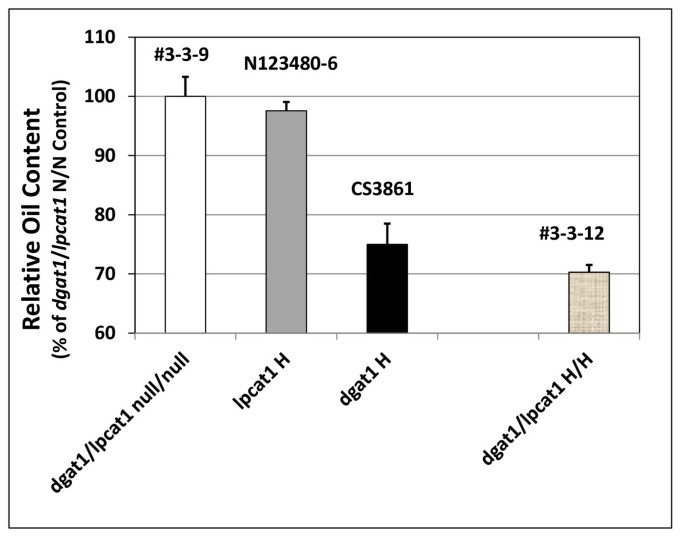
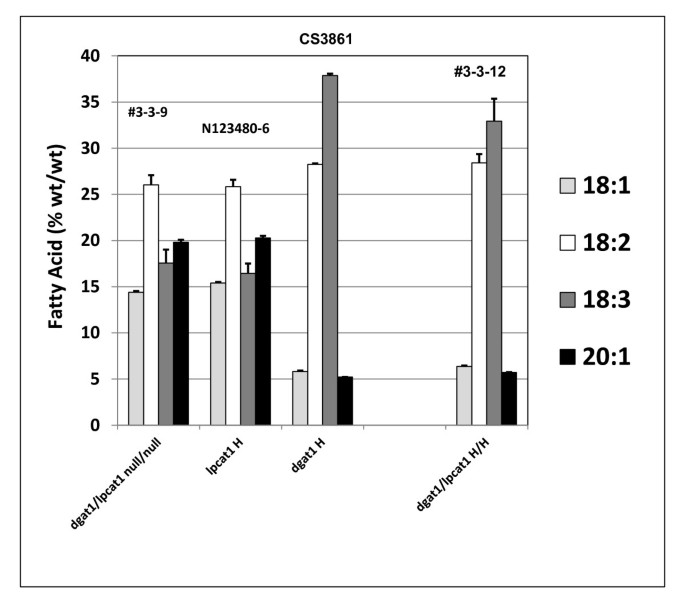
相对含油量gydF4y2Ba2gydF4y2Ba从杂交种子gydF4y2Balpcat1gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2BaNull两个突变# 3-3-9;gydF4y2Balpcat1gydF4y2Ba纯合突变体N123480-6;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2Ba两个突变都是纯合子#3-3-12。相对于设置为100%的双空控件,报告值。值是三份确定的平均值±S.D。gydF4y2Ba
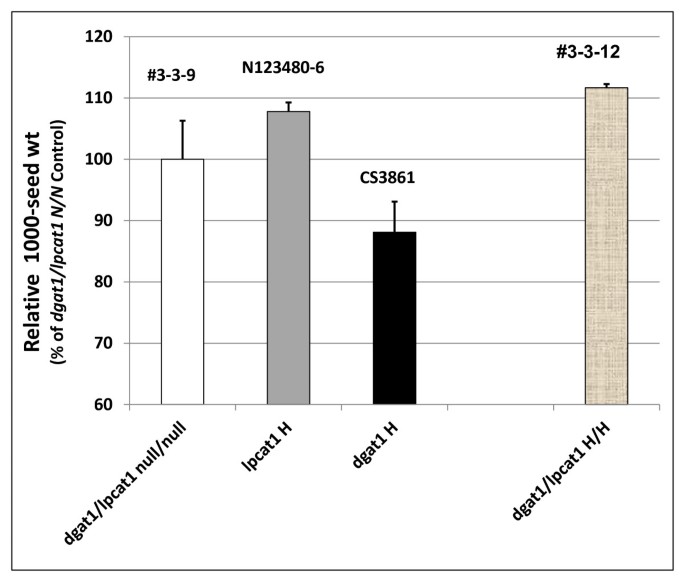
虽然石油含量gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2BaH/H株系减少,有趣的是,相对于种子重量,有显著增加(由gydF4y2BacagydF4y2Ba6%)相对于gydF4y2Badgat1 / lpcat1gydF4y2Ba空/空控制(图gydF4y2Ba9gydF4y2Ba).因此,虽然在这方面没有罚款,但需要进一步研究以确定种子的哪些组分。种子涂层的蛋白质或纤维素生物质)占这种观察。gydF4y2Ba
f中相对1000种子重量gydF4y2Ba2gydF4y2Ba从杂交种子gydF4y2Balpcat1gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2BaNull两个突变# 3-3-9;gydF4y2Balpcat1gydF4y2Ba纯合突变体N123480-6;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2Ba两个突变都是纯合子#3-3-12。报告的值相对于设置为100%的双零对照,是三次测定的平均值±标准差gydF4y2Ba
来自的脂肪酸谱gydF4y2Balpcat1gydF4y2Ba突变体与它的空分离体相同(图gydF4y2Ba10.gydF4y2Ba).的gydF4y2BaAS11(DGAT1)gydF4y2BaxgydF4y2Balpcat1gydF4y2Ba双淘汰线表示gydF4y2BaAS11gydF4y2Ba-like profile(低18:1和20:1;高十八3);18:3的比例比美国低2-5%gydF4y2BaAS11gydF4y2Ba一个人。后者并不是不一致的事实,即lpcat参与了18:1的部分到PC主干网的fads2和fads3去饱和。gydF4y2Ba
FgydF4y2Ba2gydF4y2Ba杂交种子gydF4y2Balpcat1gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2BaNull两个突变# 3-3-9;gydF4y2Balpcat1gydF4y2Ba纯合突变体N123480-6;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat1gydF4y2Ba两个突变都是纯合子#3-3-12。该值报告为%(wt / wt),并且是三份测定±s.d的平均值。gydF4y2Ba
DGAT1×lpcat2gydF4y2Ba
的gydF4y2Balpcat2gydF4y2Ba突变体没有一个显着的油表型相比,它的null分离-即。它类似于WT(图gydF4y2Ba11.gydF4y2Ba).脂肪酸组合物基本相同与WT和由其展示的gydF4y2BaLPCAT2gydF4y2Banull segregant(图gydF4y2Ba12.gydF4y2Ba).当我们执行gydF4y2BaAS11(DGAT1)gydF4y2BaxgydF4y2Balpcat2gydF4y2Ba十字架,gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaHe/H仅显示出少量的含油量下降,这表明当DGAT1部分表达(He), LPCAT2敲除(H)时,TAG生物合成的补偿能力降低,可能是因为PDAT与它的共底物PC的“供能”不足。在这些品系中,种子发育受到了严重的惩罚;由于胚珠未受精,角果发育中有许多缝隙(附加文件gydF4y2Ba1gydF4y2Ba:图S2A, B)。gydF4y2Ba
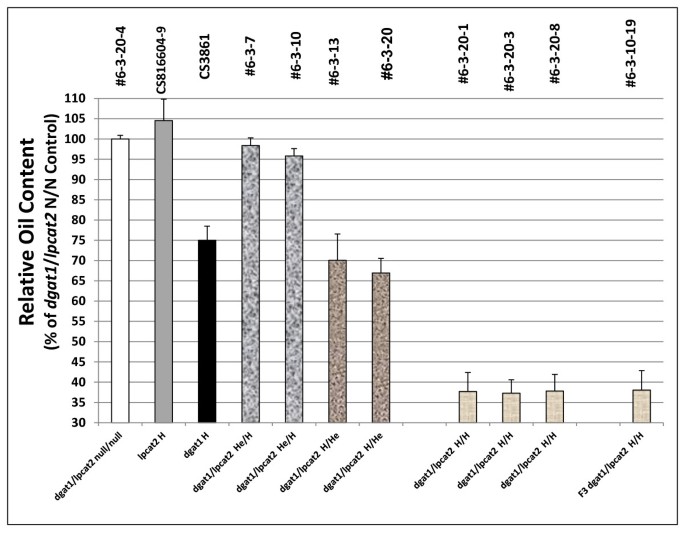
相对含油量gydF4y2Ba2gydF4y2Ba从杂交种子gydF4y2Balpcat2gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaNull为两个突变# 6-3-20-4;gydF4y2Balpcat2gydF4y2Ba纯合突变体CS816604-9;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他/H #6-3-7和# 6-3-10;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/He # 6-3-13和# 6-3-20;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba纯合的突变#6-3-20-1,#6-3-20-3和#6-3-20-8;FgydF4y2Ba3.gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba两个突变都是纯合子# 6-3-10-19。报告的值相对于设置为100%的双零对照,是三次测定的平均值±标准差gydF4y2Ba
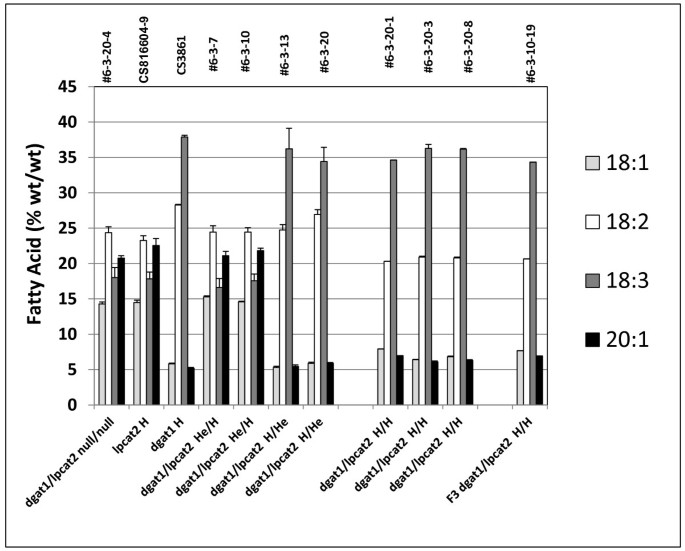
FgydF4y2Ba2gydF4y2Ba杂交种子gydF4y2Balpcat2gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaNull为两个突变# 6-3-20-4;gydF4y2Balpcat2gydF4y2Ba纯合突变体CS816604-9;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他/H #6-3-7和# 6-3-10;dgat1 / lpcat2 h / she#6-3-13和#6-3-20;dgat1 / lpcat2纯合的突变#6-3-20-1,#6-3-20-3和#6-3-20-8;F3 DGAT1 / LPCAT2均匀突变#6-3-10-19。该值报告为%(wt / wt),并且是三份测定±s.d的平均值。gydF4y2Ba
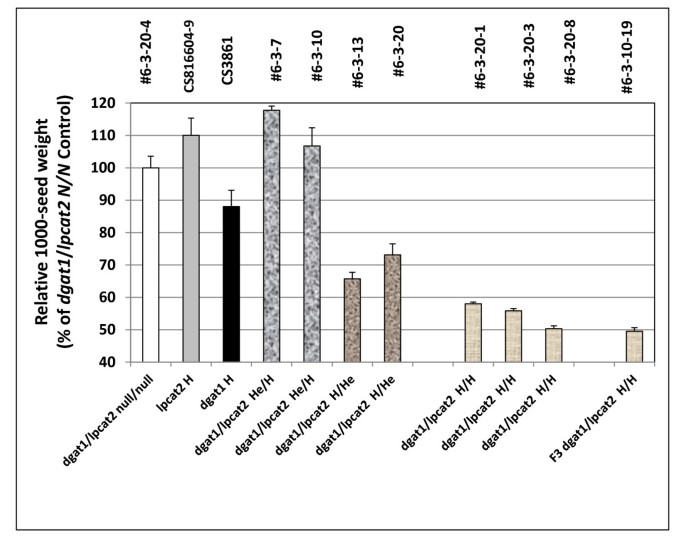
相对于gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba双空,在gydF4y2Balpcat2gydF4y2BaH和gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaHe/H系,种子重量增加约10%(图)gydF4y2Ba13.gydF4y2Ba).然而gydF4y2Badgat1 / lpcat2gydF4y2BaH / H线条显示出种子重量的强劲下降,即使在观察到gydF4y2BaDGAT1.gydF4y2Ba单独突变或双突变基因型时gydF4y2BaDGAT1.gydF4y2Ba在纯合的条件下,与种子重量一起增加,上面引用了gydF4y2Balpcat1gydF4y2Ba突变研究,这些发现使其非常清楚gydF4y2Balpcat1gydF4y2Ba或gydF4y2Balpcat2gydF4y2Ba突变对种子重量其可以或可以不与在油含量的变化的复杂的效果。gydF4y2Ba
f中相对1000种子重量gydF4y2Ba2gydF4y2Ba从杂交种子gydF4y2Balpcat2gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变体gydF4y2Ba.行号按附加文件中列出的方式指定gydF4y2Ba2gydF4y2Ba:表S3,具有在×轴上指定的基因型。gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaNull为两个突变# 6-3-20-4;gydF4y2Balpcat2gydF4y2Ba纯合突变体CS816604-9;gydF4y2BaAS11 dgat1gydF4y2BaCS3861突变纯合子;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他/H #6-3-7和# 6-3-10;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/He # 6-3-13和# 6-3-20;gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba纯合的突变#6-3-20-1,#6-3-20-3和#6-3-20-8;FgydF4y2Ba3.gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba两个突变都是纯合子# 6-3-10-19。报告的值相对于设置为100%的双零对照,是三次测定的平均值±标准差gydF4y2Ba
酰基的组成gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他/ H行再次基本上是一样的gydF4y2BaLPCAT2gydF4y2Bans(图gydF4y2Ba12.gydF4y2Ba).相比之下,gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH /他行有gydF4y2BaAS11gydF4y2Ba减少了大约70%的油含量,在WT和gydF4y2BaLPCAT2gydF4y2Banull segregant(图gydF4y2Ba11.gydF4y2Ba).有趣的是,在这种杂合子组合中没有发育惩罚,结实率正常gydF4y2BaAS11gydF4y2Ba背景,提供了表达gydF4y2BaLPCAT2gydF4y2Ba处于杂合状态(附加文件gydF4y2Ba1gydF4y2Ba:图S3)。没有意外地,这些线中的油的酰基组成与gydF4y2BaAS11gydF4y2Ba概要文件(图gydF4y2Ba12.gydF4y2Ba).gydF4y2Ba
结果是完全不同的gydF4y2BaAS11 (dgat1)gydF4y2BaxgydF4y2Balpcat2gydF4y2Ba双倍纯合子突变。如图gydF4y2Ba14.gydF4y2Ba是对推测的H/H系# 6-3-10-19、# 6-3-20-1与WT相比的基因型的PCR确认,gydF4y2BaAS11gydF4y2Ba和gydF4y2Balpcat2gydF4y2Ba行。AS11,gydF4y2Badgat1 / lpcat2gydF4y2BaH/H品系# 6-3-10-19和# 6-3-20-1的插入位点为147 bp,表明插入突变为纯合子,导致DGAT1无功能(如图所示)gydF4y2Ba2gydF4y2Ba,上图),而WT和gydF4y2Balpcat2gydF4y2Ba样品没有。T-DNA筛选是在相同线的样品上进行测试以测试存在gydF4y2BaLPCAT2gydF4y2Ba.使用[左底漆+右引物]或用[右引物+左边框2]底漆进行样品。的gydF4y2Balpcat2gydF4y2Ba和gydF4y2Badgat1 / lpcat2gydF4y2BaH/H品系# 6-3-10-19和# 6-3-20-1具有纯合子敲除gydF4y2BaLPCAT2gydF4y2Ba基因。qRT-PCR也证实了这两个品系的转录谱gydF4y2BaDGAT1.gydF4y2Ba(图gydF4y2Ba5AgydF4y2Ba,车道4和5)和gydF4y2Balpcat2gydF4y2Ba(图gydF4y2Ba5B.gydF4y2Ba,第4和第5车道)。生物化学上,在双纯合突变体(gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Bah / h)标签合成存在严重的罚款;相对于WT有65%的油含量降低:成熟的种子相对于WT和LPCAT2零分离比例仅具有约30%的油含量(图gydF4y2Ba11.gydF4y2Ba).没有DGAT1 (gydF4y2BaAS11gydF4y2Ba)最近的研究表明,PDAT1催化了基本上所有油的合成,该油积累在WT中的70-75%[gydF4y2Ba17.gydF4y2Ba].没有LPCAT2和DGAT1, PDAT1只能合成约35%的WT油水平。因此,LPCAT2的缺失极大地降低了PDAT1合成石油的能力。这表明,在TAG合成中,PDAT1与PC作为共底物的供应有很强的联系;显然,LPCAT2在供应PC方面发挥着强大的作用。当DGAT1突变为纯合子时gydF4y2BaAS11gydF4y2Ba当LPCAT2突变处于HE条件时,酰基剖面占主导地位(图gydF4y2Ba12.gydF4y2Ba).然而,在这两个gydF4y2Balpcat2gydF4y2Ba纯合突变体和双突变体gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Bah / h线,20:1和18:1略有gydF4y2Ba增加gydF4y2Ba虽然18:2是gydF4y2Ba减少gydF4y2Ba(图gydF4y2Ba12.gydF4y2Ba).很重要的是要注意Shen等人。[gydF4y2Ba34.gydF4y2Ba]证明了一个gydF4y2Baarabisdopsis.gydF4y2Ba用一个线转换gydF4y2BaLPCAT1-LPCAT2gydF4y2Ba双RNAi构建,部分抑制两个基因的表达,也显示了3%gydF4y2Ba增加gydF4y2Ba比例为20:1,1.5%gydF4y2Ba增加gydF4y2Ba18:1和伴随3%gydF4y2Ba减少gydF4y2Ba在18:2中,种子标签与wt相比。虽然目前的表型难以进行解释而无需进一步研究,但这些发现将在将LPCATS在基质选择性和脂肪酸中的潜在窜入油中分析LPCATS。gydF4y2Ba
PCR确认LPCAT2×DGAT1线的遗传构成gydF4y2Ba.gydF4y2Ba样品1.1 - -1.5gydF4y2Ba(来自wt,gydF4y2Balpcat2gydF4y2Ba,gydF4y2BaDGAT1.gydF4y2Ba,gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/H品系# 6-3-10-19和# 6-3-20-1分别用DGAT1引物扩增(附加文件)gydF4y2Ba2gydF4y2Ba:表S2)。样本gydF4y2BaDGAT1.gydF4y2Ba,gydF4y2Ba(1.3)gydF4y2Ba,gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/H线# 6-3-10-19gydF4y2Ba(1.4)gydF4y2Ba和# 6-3-20-1gydF4y2Ba(1.5)gydF4y2Ba,都有一个147碱基对插入物,表明它们是纯合的,导致非功能性DGAT1(如在图2中,上面的确认)的插入突变,而WTgydF4y2Ba(1.1)gydF4y2Ba和gydF4y2Balpcat2gydF4y2Ba(1.2)gydF4y2Ba样品没有。对同一品系的样本进行T-DNA筛选,以检测是否存在gydF4y2BaLPCAT2gydF4y2Ba.gydF4y2Ba样品2.1-2.5gydF4y2Ba(与上述相同的顺序)使用Sail_357_H01LP和Sail_357_H01RP引物放大(附加文件gydF4y2Ba2gydF4y2Ba:表S2)gydF4y2Ba样本gydF4y2Ba3.1-3.5.gydF4y2Ba使用SAIL_357_H01RP和SAIL_LB2引物进行扩增(顺序同上)gydF4y2Ba2gydF4y2Ba:表S2)。集合2.1-2.5和3.1-3.4表明gydF4y2Balpcat2gydF4y2Ba,gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/H品系# 6-3-10-19和# 6-3-20-1的样品具有纯合子敲除gydF4y2BaLPCAT2gydF4y2Ba基因。gydF4y2Ba
植物生长和发育也延迟了双纯合突变体(gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / H),因为它是在gydF4y2BaAS11gydF4y2Ba:幼苗很小,发育缓慢(图gydF4y2Ba15AgydF4y2Ba).一旦转移到土壤,抽薹进入生殖阶段被推迟gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / H(图gydF4y2Ba15B.gydF4y2Ba),但在中国是正常的gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH /他(图gydF4y2Ba15CgydF4y2Ba).种子发育不良,如在gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他每小时行;在发育的角果中有许多未受精的胚珠,导致种子明显减少,与正常情况下观察到的WT或gydF4y2BaLPCAT2gydF4y2Ba空隔离(NS)。因此,很明显,某种程度上gydF4y2BaLPCAT2gydF4y2Ba表达是必要的正常种子发育,特别是在gydF4y2BaAS11gydF4y2Ba背景。然而,这一初步观察的未来研究,包括发育表型的评分和花粉活力的微观研究,将需要确认由于双突变导致的花粉功能受到干扰gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / H线路。gydF4y2Ba
(a)从十字架中分离种群gydF4y2BaDGAT1.gydF4y2Ba与gydF4y2Balpcat2gydF4y2Ba.所有的株系都是纯合的gydF4y2BaDGAT1.gydF4y2Ba突变与纯合子、杂合子或零合子为gydF4y2Balpcat2gydF4y2Ba.的gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / H幼苗圈所示,示出了发展缓慢。gydF4y2Ba(b)gydF4y2Ba一旦转移到土壤中,螺栓就会延迟gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / H苗。相比之下gydF4y2Ba(C)gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH/He苗发育正常,苗栓正常。gydF4y2Ba
总结突变体杂交实验gydF4y2BaLPCAT2×DGAT1gydF4y2Ba,石油合成,营养生长和种子套装严重处罚。与相对油含量相比gydF4y2BaDGAT1.gydF4y2Ba单独(75%的WT),进一步相对减少只有5%gydF4y2Badgat1 / lpcat1gydF4y2Ba油(70%的WT),表明LPCAT2是主要决定因素,几乎可以完全弥补LPCAT1的损失。相比之下,在缺乏LPCAT2和DGAT1的情况下(gydF4y2BaLPCAT2×DGAT1gydF4y2Ba),相对含油量下降到WT的30%,说明LPCAT1只能部分补偿LPCAT2相对含油量的损失。代谢和微阵列研究gydF4y2BaAS11gydF4y2Ba单独支持这一假设为gydF4y2BaLPCAT2gydF4y2Ba在没有DGAT1的情况下,LPCAT的表达和活性上调。此外,酰基谱还表明,油的组成表型发生了变化gydF4y2Balpcat2gydF4y2BaxgydF4y2BaDGAT1.gydF4y2Ba主要是由影响gydF4y2BaDGAT1.gydF4y2Ba病变。集体,来自十字架的数据gydF4y2BaAS11gydF4y2Ba与gydF4y2BalpcatgydF4y2Ba1或gydF4y2Balpcat2gydF4y2Ba突变体强烈建议在gydF4y2BaAS11gydF4y2Ba背景,而LPCAT2和LPCAT1既可以向PDAT1催化TAG合成,它是gydF4y2BaLPCAT2gydF4y2Ba上调(而不是gydF4y2BaLPCAT1gydF4y2Ba),其是用于通过提供PC的增强池作为共底物,以转印在PDAT1催化TAG生物合成协助主要负责gydF4y2Ba桑gydF4y2Ba-2部分gydF4y2Ba桑gydF4y2Ba-3放大的位置gydF4y2BaAS11gydF4y2BaDAG池。尽管如此,LPCAT2在维持pdat1催化的TAG合成中是最重要的gydF4y2BaAS11gydF4y2Ba背景,在本研究中鉴定LPCATs 1和2的局部过度研磨功能需要进一步调查,以确定在油合成它们的相对角色时DGAT1处于WT背景功能。gydF4y2Ba
最近磷脂酰胆碱的发现:二酰甘油磷酸胆碱转移酶(PDCT),由编码gydF4y2Ba拟南芥ROD1gydF4y2Ba,表明TAG生物合成过程中DAG-PC相互转换的问题比之前认为的要复杂得多[gydF4y2Ba35.gydF4y2Ba].所述PDCT酶催化从PC磷酸胆碱头部基团转移到DAG和被认为是对18传送的主要反应:1到PC用于通过FAD2和FAD3去饱和,以及使18反向传输:2和18:3到TAG合成途径。在里面gydF4y2Ba罗德1.gydF4y2Ba突变体时,在tag中的PUFAs积累减少40%。然而,在gydF4y2BaAS11gydF4y2Ba其中18:3有强烈的增加,并且值得注意的是,显示出很强的立体特异性转移到gydF4y2Ba桑gydF4y2Ba-3标签的位置[gydF4y2Ba6gydF4y2Ba],尚不清楚PDCT是否有强大的参与;如果是这样的话,人们会认为18:3的比例会更平均吗gydF4y2Ba桑gydF4y2Ba-2和gydF4y2Ba桑gydF4y2Ba3位置。然而,强再分配的18:3比例以gydF4y2Ba桑gydF4y2Ba-3和远离gydF4y2Ba桑gydF4y2Ba-2职位gydF4y2BaAS11gydF4y2Ba表明PDAT1催化作用与位置组成的主要变化有关。因此,关于角色仍然有许多问题需要解决gydF4y2Ba罗德1.gydF4y2Ba和其他PC相关的代谢步骤如CPTase可能在油合成玩gydF4y2Ba拟南芥gydF4y2Ba而在gydF4y2BaAS11gydF4y2Ba在特定的。gydF4y2Ba
结论gydF4y2Ba
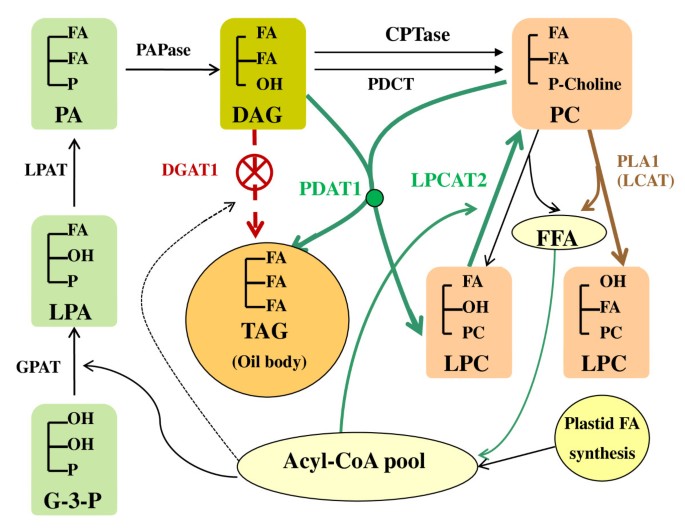
根据这些研究的累积结果,如图gydF4y2Ba16.gydF4y2Ba我们总结我们对在WT的TAG生物合成途径当前的假设gydF4y2Bavs.gydF4y2Ba.DGAT1受损时观察到的gydF4y2BaAS11gydF4y2Ba.当DGAT1和PDAT1同时工作时,它们都有助于TAG的合成,但最近的文献一致认为PDAT1是TAG合成的主要途径gydF4y2Ba拟南芥gydF4y2Ba.当DGAT1被淘汰时,PDAT1途径可产生高达75%的WT油水平[gydF4y2Ba17.gydF4y2Ba].PDAT1酰化的gydF4y2Ba桑gydF4y2Ba-3累积的dag的位置(在没有DGAT1的情况下),以给出TAG。的酰基组成gydF4y2BaAS11gydF4y2Ba高度增强的PUFAs和减少的VLCFAsgydF4y2Ba桑gydF4y2Ba-3位置[gydF4y2Ba6gydF4y2Ba]支持酰基捐赠酰基,尤其是18:3,来自gydF4y2Ba桑gydF4y2Ba-2位置PC到gydF4y2Ba桑gydF4y2Ba-3位DAG作为TAG合成的主要路线gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
此调整在TAG组装路线中进行gydF4y2BaAS11gydF4y2Ba由增强的LPCAT2活动辅助,以提供PDAT1所需的额外PC。鉴于这些发现和内隐可塑性gydF4y2Ba拟南芥gydF4y2Ba为了克服TAG组装机制的关键瓶颈,确定DGAT1和[PDAT1 + LPCAT2]在高含油种子(如油菜、大豆、向日葵、红花、亚麻)TAG组装过程中所起的相对作用将是一个有趣的问题。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥gydF4y2BaWT(生态型Columbia-0)gydF4y2BaAS11gydF4y2Ba(CS3861) ems诱导突变体gydF4y2BaA7gydF4y2Ba(Salk_039456),gydF4y2Balpcat1gydF4y2Ba(SALK_123480)和gydF4y2Balpcat2gydF4y2Ba(SAIL_357_H01) T-DNA插入突变株(均来自哥伦比亚背景)通过诺丁汉拟南芥种群中心(英国诺丁汉大学)从索尔克研究所获得。在22℃、光周期为16 h (120 μE·m)的生长室内培养这些品系及其后代gydF4y2Ba-2gydF4y2Ba·S.gydF4y2Ba-1gydF4y2Ba)和8小时黑暗。gydF4y2Ba
拟南芥是含有中绿发育胚胎(在6-8的阶段合并的单片机,如多伦多大学拟南芥EFP表达式浏览器所指定:gydF4y2Bahttp://bar.utoronto.ca/affydb/cgi-bin/affy_db_exprss_browser_in.cgi.gydF4y2Ba;参见种子进入gydF4y2BaLPCAT2gydF4y2Ba发展地图gydF4y2Bahttp://bbc.botany.utoronto.ca/efp/cgi-bin/efpWeb.cgi?primaryGene=AT1G63050&modeInput=AbsolutegydF4y2Ba),并在-80°C下冷冻,用于脂质分析、酶分析和DNA和RNA提取。gydF4y2Ba
脂质分析gydF4y2Ba
总脂提取物(TLEs)的制备、脂类的研究、油分含量和酰基组成的测定gydF4y2BaAS11gydF4y2Ba,gydF4y2Balpcat1gydF4y2Ba和gydF4y2BaLPCAT 2gydF4y2Ba如先前所述进行从杂交突变品系和后代[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].在所有情况下,这些数据代表了3 - 5个决定的平均值。gydF4y2Ba
拟南芥蛋白质分数的制备gydF4y2Ba
通常,酶制剂由200℃制成gydF4y2Ba拟南芥gydF4y2Ba的角果gydF4y2BaAS11gydF4y2Ba并且wt含有中绿显影种子(如上定义的阶段7-8),并立即用砂浆和杵粉末粉状粉状。加入研磨培养基(100mM Hepes-Koh,pH 7.4含有0.32μm蔗糖,1mM EDTA和1mM二硫代噻吩; 8ml / 50个单独的溶剂;立即加入65mg聚乙烯吡咯烷酮,并在冰上继续研磨5分钟。通过两层Miracloth(Calbiochem,La Jolla,Ca)过滤浆化细胞匀浆,以3,000×离心gydF4y2BaggydF4y2Ba弃球5min,上清液15000 ×离心gydF4y2BaggydF4y2Ba30分钟。上清液以100,000×重新离心gydF4y2BaggydF4y2Ba2 mL研磨培养基中重悬,探针在冰上超声30 s,蛋白浓度使用BioRad™试剂根据Bradford [gydF4y2Ba37.gydF4y2Ba].蛋白质浓度归一化到WT和相同的值gydF4y2BaAS11gydF4y2Ba在每个实验中。gydF4y2Ba
拟南芥中显影种子的标签合成活性的测定gydF4y2Ba
TAG组装检测在pH 7.4下进行,在30°C的水浴中以100转/分钟的转速振荡60分钟。检测混合物(最终体积500 μL)包含100-300 μg蛋白,如上文所述归一化,90 mM hepe - naoh, 0.5 mM ATP, 0.5 mM CoASH, 1 mM MgClgydF4y2Ba2gydF4y2Ba在100μm的存在[1-gydF4y2Ba14.gydF4y2BaC]gydF4y2Ba桑gydF4y2Ba-1,2二烯烃在0.02%吐温-20(比活性10 nCi/nmol;通过TLC在5%硼酸盐硅胶G板上预纯化)和18 μM unlabeled 18:1-CoA。用异丙醇:CH停止反应gydF4y2Ba2gydF4y2BaClgydF4y2Ba2gydF4y2Ba(2:1:) v/v,以及如上所述制备的TLE [gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].的gydF4y2Ba14.gydF4y2Bac标记产物在正己烷:乙醚:乙酸(70:30:1 v/v/v)显影的硅胶G板上用薄层色谱(TLC)进行分离gydF4y2Ba14.gydF4y2Ba使用Win-Scan 2D在Bioscan AR-2000无线tlc扫描仪上显示c -三油酸条带gydF4y2Ba©gydF4y2Ba软件(Bioscan Inc.,华盛顿特区)和带抓取和定量闪烁计数器。gydF4y2Ba
AtDGAT1突变体在酵母中的表达gydF4y2Ba
突变gydF4y2Baatdgat1.gydF4y2Ba(从gydF4y2BaAS11gydF4y2Ba也gydF4y2BaA7)gydF4y2Ba在pYES2.1/NT B质粒中转化为酵母四重突变体gydF4y2BaH1246MATα.gydF4y2Ba[gydF4y2Ba27.gydF4y2Ba] 使用gydF4y2Ba皮下gydF4y2Ba.EasyComp™转化试剂盒(Invitrogen公司,旧金山,CA)。用含WT的pYES2.1/NT B质粒转化酵母细胞gydF4y2BaDGAT1gydF4y2Ba或用空质粒分别用作正或阴性对照。通过缺乏尿嘧啶(SC-URA)的合成完全培养基的生长选择转化体,补充有2%(w / v)葡萄糖。将菌落转移到液体Sc-URA中,葡萄糖2%(w / v)葡萄糖,并在30℃下生长过夜。将过夜培养物稀释至诱导培养基(SC-URA + 2%半乳糖+ 1%奖金)中的OD 0.4,并在30℃下诱导24小时。收集酵母细胞并使用Beadboder TM用玻璃珠子破碎。使用Biorad TM测定法归一化酵母细胞裂解物的蛋白质浓度,并测定DGAT活性。DGAT测定在pH7.4处进行,在30℃的水浴中在100℃/ min的摇动60分钟。测定混合物(500μL最终体积)含有100μg裂解蛋白,90mM Hepes-NaOH,100μmgydF4y2Ba桑gydF4y2Ba-1,2迪洛林或gydF4y2Ba桑gydF4y2Ba-1,2 dierucin(10%硼酸硅H板TLC预纯化,0.02% Tween-20乳化)和18 μM 1-gydF4y2Ba14.gydF4y2BaC 18:1-CoA(比活性10 nCi/nmol)作为酰基供体。用异丙醇:CH停止反应gydF4y2Ba2gydF4y2BaClgydF4y2Ba2gydF4y2Ba(2:1 :)如前所述进行V / V,和脂质级分的提取[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].的gydF4y2Ba14.gydF4y2BaC标记的TAG通过TLC在己烷展开硅胶G板解决:二乙醚:乙酸(70:30:1体积/体积/体积),则gydF4y2Ba14.gydF4y2Ba使用Win-Scan 2D在Bioscan AR-2000无线tlc扫描仪上显示c -三油酸条带gydF4y2Ba©gydF4y2Ba软件(Bioscan Inc.,华盛顿特区)和带抓取和定量闪烁计数器。gydF4y2Ba
免疫缩编gydF4y2Ba
酵母细胞裂解液在10% Tris-HCl SDS-PAGE凝胶上运行,然后将蛋白质转移到硝化纤维素膜(Nitrobind, Thermo Fisher Scientific, Waltham, MA)。用含4%脱脂牛奶的PBST(含0.5%吐温20的磷酸盐缓冲盐水)封闭膜60 min,然后与一抗、Anti-Xpress(表位标记)抗体(Invitrogen公司,旧金山,CA)用含2%脱脂牛奶的PBST稀释至1:50 000,孵育。用PBST和PBS冲洗三次,以去除任何未结合的抗体。然后,用山羊抗小鼠IgG过氧化物酶抗体(Sigma-Aldrich, A2554, St. Louis, MO)孵育膜,用含2%脱脂牛奶的PBST稀释至1:50 000,孵育60分钟。用PBST洗三次,PBS洗三次,然后使用Amersham ECL Plus Western Blotting Detection Kit (GE Healthcare Life Sciences)检测蛋白,10分钟的暴露时间。gydF4y2Ba
LPCAT测定gydF4y2Ba
LPCAT测定在pH7.4处进行,在30℃的水浴中在30℃下在30℃下振荡,在20分钟的时间内。测定混合物(500μL最终体积)含有300μg蛋白质,如上所述,90mM Hepes-NaOH,0.5mm ATP,0.5mm的合并,1mM MgClgydF4y2Ba2gydF4y2Ba在6 μ L-α-棕榈酰- [1-gydF4y2Ba3.gydF4y2BaH甲基]gydF4y2BalysogydF4y2Ba-3-磷脂酰胆碱(比活性60 μCi/nmol;1.48-2.22 TBq/mmol)和18 μM [1-gydF4y2Ba14.gydF4y2BaC] 18:1 - 辅酶A(比活性10 NCI /纳摩尔; 0.37吉贝/毫摩尔)。反应,加入异丙醇在每个时间点停止:CHgydF4y2Ba2gydF4y2BaClgydF4y2Ba2gydF4y2Ba(2:1:) v/v,以及如上所述制备的TLE [gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].的gydF4y2Ba14.gydF4y2BaC和3H标记的产品通过如下进行的3D TLC解析:如yokoyama等人所述,运行前2个维度。[gydF4y2Ba38.gydF4y2Ba];1 D: CHClgydF4y2Ba3.gydF4y2Ba甲酸(88%):HgydF4y2Ba2gydF4y2BaO 60: 30: 9: 2;2 D: CHClgydF4y2Ba3.gydF4y2Ba:Meoh:氨溶液(28%):HgydF4y2Ba2gydF4y2BaO 50: 40: 7: 3;3D:第三D: 100%乙醚。用无线电薄层扫描仪识别与LPC和PC标准相对应的放射性标记点,在双闪烁计数器上刮取并计数条带gydF4y2Ba3.gydF4y2BaH /gydF4y2Ba14.gydF4y2BaÇ同位素测量程序。gydF4y2Ba
体内喂养实验gydF4y2Ba
在水下收获二十二螺栓茎,其中WT和AS11植物的中间显影是单独的,然后立即置于含有1μCI的溶液中gydF4y2Ba14.gydF4y2Ba加C乙酸钠,100 μL水,室温下置于通风柜中培养。一旦大部分溶液被吸收,在追踪期间向植物提供等量的蒸馏水。在0、7、24和30 h时,收获5个螺栓茎,计数并称重角果,然后用polytron研磨,并按Taylor等人的描述进行TLE提取[gydF4y2Ba26.gydF4y2Ba].将脂质提取物重悬于1ml CHCl中gydF4y2Ba3.gydF4y2Ba:甲醇2:1。计数10 μL溶液,在TLC plates上斑点,进行3D TLC,放射性标记斑点在radio-TLC扫描仪上分辨,刮除硅胶带,用闪烁计数器测量放射性。gydF4y2Ba
关键脂类基因AS11和WT表达的qRT-PCR比较gydF4y2Ba
采用Wang和Vodkin方法提取3个重复的总RNA生物样本[gydF4y2Ba39.gydF4y2Ba从gydF4y2Ba拟南芥gydF4y2Ba的角果gydF4y2BaAS11gydF4y2Ba和含有中绿色正在发育种子的WT(上述定义的7-8阶段),用于qRT-PCR [gydF4y2Ba40gydF4y2Ba].使用上标的一显rna的总RNA进行反转转录gydF4y2Ba®gydF4y2BaII .逆转录酶(Invitrogen),根据制造商的方案。用PCR扩增得到的cDNAgydF4y2BaTaq.gydF4y2BaDNA聚合酶(表达载体)。PCR条件包括94°C 3 min的初始循环;然后依次进行94°C for 30 s、56°C for 30 s、72°C for 1 min的30个循环;然后72°C, 10分钟反应完成。各组个体样本(AS11和WT)的浓度用18S rRNA水平归一化。基因特异性引物(列于附加文件gydF4y2Ba2gydF4y2Ba:表S1)根据GenBank™中的靶基因序列设计(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/genbank/gydF4y2Ba).通过电泳在1%琼脂糖凝胶和凝胶照片上通过电泳来解决扩增的RT-PCR产物。使用imagej图像分析软件(美国国家卫生研究院)分析了PCR带的密度gydF4y2Bahttp://rsbweb.nih.gov/nih-image/gydF4y2Ba)和定量相对于“持家基因” 18S rRNA基因转录的信号。则的比率gydF4y2BaAS11gydF4y2Ba:计算WT基因表达量。具体来说,对于每个感兴趣的基因,我们首先计算AS11密度/18S rRNA密度(=“AS11比率”)和WT密度/18S rRNA密度(=“WT比率”)的比率。AS11特异性基因表达的差异gydF4y2Bavs.gydF4y2Ba.WT,然后如( “AS11比”)计算值/( “WT比”)= V.如果V> 1.0,则基因是gydF4y2Ba上调gydF4y2Ba在gydF4y2BaAS11gydF4y2Ba相对于WT;在如果V <1.0,则该基因被下调gydF4y2BaAS11gydF4y2Ba,则相对增加或减少的百分比= ([gydF4y2BaVgydF4y2Ba-100×100])。gydF4y2Ba
Affymetrix微阵列分析gydF4y2Ba
对QRT-PCR研究(上述)制备的相同的三份生物样品被亚采样用于微阵列分析。使用三种生物复制样品对每个基因型进行含有代表〜22,800基因的探针组的Ath1全基因组阵列的Affymetrix微阵列杂交。标记,杂交和扫描由多伦多大学的Affymetrix基因芯片设施进行(gydF4y2Bahttp://www.csb.utoronto.ca/resources/facilities/affymetrix-genechipgydF4y2Ba).使用genspring™软件7.2版本进行数据分析。为了识别在两种基因型之间差异表达的关键脂类基因,对值进行单基因归一化,并进行参数检验。显示错误发现率的基因gydF4y2BapgydF4y2Ba< 0.05且通过最小信号和倍变阈值判定为差异表达。已报道的候选基因是通过比较Beisson等人列出的基因来选择的[gydF4y2Ba33.gydF4y2Ba利用我们的基因芯片和qRT-PCR数据。“fold change”被转换为% change。为图中详细的一组基因gydF4y2Ba3.gydF4y2Ba,最终变化范围为-60%至+ 150%。gydF4y2Ba
突变体十字架gydF4y2Ba
LPCAT1和LPCAT2 T-DNA插入突变线的确认gydF4y2Ba
拟南芥gydF4y2Ba插入突变系[gydF4y2Ba41.gydF4y2Ba] Salk_123480推荐gydF4y2BaLPCAT1gydF4y2Ba(At1g12640)和SAIL_357_H01假定gydF4y2BaLPCAT2gydF4y2Ba(At1g63050)在Salk研究所T-DNA插入文库数据库(gydF4y2Bahttp://signal.salk.edu/cgi-bin/tdnaexpressgydF4y2Ba),以及种子从诺丁汉拟南芥库存中心(诺丁汉大学,英国)获得。根据在数据库SALK_123480注释包含的第7外显子的中间的T-DNA插入gydF4y2BaLPCAT1gydF4y2Ba基因和SAIL_357_H01在第8外显子中插入T-DNAgydF4y2BaLPCAT2gydF4y2Ba基因。个体植物的纯合而每一个T-DNA插入gydF4y2BaLPCAT1gydF4y2Ba或gydF4y2BaLPCAT2gydF4y2Ba基因用引SALK_123480LP,SALK_123480RP和SALK_LBb1(附加文件PCR筛选鉴定gydF4y2Ba2gydF4y2Ba:表S2),用于gydF4y2BaLPCAT1gydF4y2Ba和sail_357_h01lp,sail_357_h01rp和sail_lb2(附加文件gydF4y2Ba2gydF4y2Ba:表S2),用于gydF4y2BaLPCAT2gydF4y2Ba.每个突变系的单株植株缺乏T-DNA插入gydF4y2BaLPCAT1gydF4y2Ba或gydF4y2BaLPCAT2gydF4y2Ba还在相同的PCR引物组中鉴定基因(零分离)。每组十字架的线路注释在附加文件中指定gydF4y2Ba2gydF4y2Ba:表S3。gydF4y2Ba
lpcat1, lpcat2, dgat1突变系和杂交的转录分析gydF4y2Ba
lpcat1(见图gydF4y2Ba4gydF4y2Ba)gydF4y2Ba
根据制造商提供的技术规格,使用CONCERT植物RNA试剂(Invitrogen公司,旧金山,CA)从对照和SALK_12340 T-DNA插入突变植物的发育子粒中分离总RNA。然后用TURBO™DNase (Ambion, Huntingdon, UK)对RNA进行DNase处理,并使用(1 mg)与Maxima first strand cDNA Synthesis Kit (Fermentas.)合成第一链cDNA。赛默费雪科学公司,圣里昂-罗特,德国)。采用Taq DNA聚合酶(Sigma-Aldrich, St. Louis, MO)和引物SALK_12640-1 s和SALK_12640-6r进行PCR扩增gydF4y2Ba2gydF4y2BaS2:表。PCR条件包括94°C 1 min的初始循环;94°C for 20 s, 64°C for 20 s, 72°C for 35 s共40个循环;然后72°C, 8分钟完成反应。PCR样品在1%琼脂糖凝胶上分离,用PstI酶切λ-DNA。gydF4y2Ba
lpcat2和AS11 dgat1(见图gydF4y2Ba5gydF4y2Ba)gydF4y2Ba
从WT对照的发育角子中分离出总RNA,gydF4y2BaAS11gydF4y2Ba(gydF4y2BaDGAT1.gydF4y2Ba), SAIL_357_H01插入突变(gydF4y2Balpcat2gydF4y2Ba)和AS11 / L.gydF4y2Bapcat2gydF4y2BaWang和Vodkin的方法[gydF4y2Ba39.gydF4y2Ba].使用上标的一显rna的总RNA进行反转转录gydF4y2Ba®gydF4y2BaII .逆转录酶(Invitrogen),根据制造商的方案。用PCR扩增得到的cDNAgydF4y2BaTaq.gydF4y2BaDNA聚合酶(表达载体)。PCR条件包括94°C 3 min的初始循环;然后依次进行94°C for 30 s、56°C for 30 s、72°C for 1 min的30个循环;然后72°C, 10分钟反应完成。各组个体样本(AS11和WT)的浓度用18S rRNA水平归一化。扩增T-DNA插入区域的基因特异性引物用于检测基因转录。为gydF4y2BaDGAT1gydF4y2Ba转录本分析在WT的lines,gydF4y2BaAS11gydF4y2Ba(gydF4y2BaDGAT1.gydF4y2Ba)突变体,gydF4y2Balpcat2gydF4y2Ba突变体和杂交的gydF4y2Balpcat2gydF4y2Ba与gydF4y2BaDGAT1.gydF4y2Ba,引物对分别为tag1 - mutmera和tag1 - mutmerb。为gydF4y2BaLPCAT2gydF4y2Ba引物为LPCAT2-F2和LPCAT2-R2(见附加文件)gydF4y2Ba2gydF4y2BaS2:表。gydF4y2Ba
创建DGAT1×LPCAT1和DGAT1×LPCAT2的双突变体gydF4y2Ba
之间的跨越gydF4y2BaAS11gydF4y2Ba突变体和gydF4y2Balpcat1gydF4y2Ba和gydF4y2Balpcat2gydF4y2Ba分别获得T-DNA插入突变系和FgydF4y2Ba1gydF4y2Ba植物的杂合的gydF4y2BaAS11gydF4y2Ba利用附加文件中列出的引物进行PCR鉴定gydF4y2Ba2gydF4y2BaS2:表。FgydF4y2Ba2gydF4y2Ba种子分离的突变种植,并通过PCR筛选。所有PCR筛选做了如上的gydF4y2BaLPCAT1gydF4y2Ba和gydF4y2BaLPCAT2gydF4y2Ba和gydF4y2BaAS11gydF4y2Ba突变gydF4y2Bavs.gydF4y2BaWT使用引物dgat1- mutprimera和dgat1- mutprimerb(附加文件gydF4y2Ba2gydF4y2Ba:表S2),由Zou等人设计。[gydF4y2Ba7gydF4y2Ba].个人鉴定纯合子两个gydF4y2BaAS11gydF4y2Ba突变和gydF4y2Balpcat2gydF4y2Ba插入突变只有在生长分离的FgydF4y2Ba2gydF4y2Ba种子群体(纯合子为gydF4y2BaAS11gydF4y2Ba和杂合的gydF4y2Balpcat2gydF4y2Ba突变体)含有1/3强度MS和1%蔗糖的琼脂培养基(附加文件gydF4y2Ba2gydF4y2Ba: 表3)。gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
甘油三酯的生物合成。植物的生物化学脂类:结构和功能。量9。编辑:Stumpf PK.纽约:学术出版社;1987:175 - 214。gydF4y2Ba
- 2。gydF4y2Ba
墨菲DJ,万斯Y:的脂质体形成机制。趋势Biochem SCI。1999年,24:109-115。10.1016 / S0968-0004(98)01349-8。gydF4y2Ba
- 3.gydF4y2Ba
威科艺术男,茂盛WM,马里亚尼C:脂质所需的定向花粉管生长。自然。1998年,392:818-821。10.1038 / 33929。gydF4y2Ba
- 4.gydF4y2Ba
Zheng Z, Xia Q, dak M, Shen W, Selvaraj G, Zou J:拟南芥AtGPAT1基因家族的成员,膜结合甘油-3-磷酸酰基转移酶家族的成员,毡层分化和雄性不育的关键。acta botanica sinica(云南植物学报),2003,27(5):457 - 461。10.1105 / tpc.012427。gydF4y2Ba
- 5。gydF4y2Ba
案例S,Smith Sj,Zheng YW,Myers HM,Lear SR,Sande E,Novak S,Collins C,Welch CB,Lusis AJ,Erickson S,Farese RV:鉴定编码酰基CoA的基因:二酰基甘油酰基转移酶,键三酰基甘油合成中的酶。美国国家科学院学报。1998,95:13018-13023。10.1073 / pnas.95.22.13018。gydF4y2Ba
- 6。gydF4y2Ba
2、拟南芥种子脂肪酸组成与甲基磺酸乙酯诱变对甘油酰基转移酶活性的影响植物营养与肥料学报,1995,21(4):429 - 434。10.1104 / pp.108.1.399。gydF4y2Ba
- 7。gydF4y2Ba
邹杰,魏勇,Jako C, Kumar A, Selvaraj G, Taylor DC:中国gydF4y2Ba拟南芥gydF4y2BaTAG1突变体具有二酰基甘油酰基转移酶基因突变。植物学报1999,19:645-653。10.1046 / j.1365 - 313 x.1999.00555.x。gydF4y2Ba
- 8。gydF4y2Ba
王志强,王志强,王志强:丙三醇酰基转移酶cDNA的克隆gydF4y2Ba拟南芥gydF4y2Ba及其功能表达式。2月。1999年,452:145 - 149。10.1016 / s0014 - 5793(99) 00646 - 8。gydF4y2Ba
- 9。gydF4y2Ba
Routaboul JM,本宁C,贝希托德N,Caboche男,Lepiniec L:拟南芥的编码为二酰基甘油酰基转移酶的基因座TAG1。植物生理学和生物化学。1999年,37:831-840。10.1016 / S0981-9428(99)00115-1。gydF4y2Ba
- 10.gydF4y2Ba
关键词:拟南芥,甘油酯酰基转移酶,高表达基因,种子含油量,种子质量植物生理学报。2001,26(6):861-874。10.1104 / pp.126.2.861。gydF4y2Ba
- 11.gydF4y2Ba
Weselake RJ,Shah S,Tang M,Quan,Snyder Cl,Furukawa-Stoffer TL,Zhu W,Taylor DC,Zou J,Kumar A,Hall L,Laroche A,Rakow G,Raney P,Moloney MM,Harwood JL:代谢控制分析有助于提供油菜的知识遗传操作(gydF4y2Ba芸苔属植物显著gydF4y2Ba)增加种子油含量。J Exp Bot。2008,59:3543-3549。10.1093 / JXB / ERN206。gydF4y2Ba
- 12.gydF4y2Ba
泰勒DC,张Y,库马尔A,弗朗西斯T,吉布林EM,巴顿DL,费利JR,拉罗奇A,沙S,诸W,斯奈德CL,霍尔L,Rakow G,哈伍德JL,Weselake RJ:三酰基甘油累积的分子修饰场的条件下,以产生具有增加的种子油含量的低芥酸菜子。植物学。2009年,87:533-543。10.1139 / B08-101。gydF4y2Ba
- 13。gydF4y2Ba
DGAT2是一种新的甘油基酰基转移酶基因家族:从枯草被孢霉(Mortierella ramanniana)中分离得到的具有甘油基酰基转移酶活性的两种多肽的纯化、克隆及在昆虫细胞中的表达。中国生物医学工程杂志。2001,27(6):862- 869。10.1074 / jbc.M106168200。gydF4y2Ba
- 14。gydF4y2Ba
2 .动物二酰基甘油酰基转移酶DGAT2的克隆及相关家族成员。中国生物医学工程杂志。2001,27(4):487 - 498。10.1074 / jbc.M106219200。gydF4y2Ba
- 15.gydF4y2Ba
DGAT1和DGAT2在三酰基甘油生物合成中具有非冗余功能,并定位于内质网的不同亚域。acta botanica sinica(云南植物研究),2006,27(5):457 - 461。gydF4y2Ba
- 16。gydF4y2Ba
Kroon JT,Wei W,Simon WJ,Slabas AR:2型酰基CoA的鉴定和功能表达:在发育蓖麻籽中的二酰基甘油酰基转移酶(DGAT2),其对真菌和动物的主要甘油三酯生物合成酶具有高同源性。植物化学。2006,67:2541-2549。10.1016 / J.Phytochem.2006.09.020。gydF4y2Ba
- 17。gydF4y2Ba
章呒,扇形区j,泰勒DC,Ohlrogge JB:DGAT1和PDAT1酰基转移酶在拟南芥三酰基甘油的生物合成功能重叠,并且是正常的花粉和种子发育是必不可少的。植物细胞。2009年,21:3885-3901。10.1105 / tpc.109.071795。gydF4y2Ba
- 18。gydF4y2Ba
磷脂:二酰基甘油酰基转移酶:一种在酵母和植物中催化酰基辅酶A独立形成三酰基甘油的酶。美国国家科学院学报。2000年,97:6487 - 6492。10.1073 / pnas.120067297。gydF4y2Ba
- 19。gydF4y2Ba
Banas A,Dahlqvist A,Stahl U,Lenman M,Stymne S:磷脂的参与:二酰基甘油生产中的二酰基甘油酰基转移酶。Biochem Soc Trans。2000,28:703-705。10.1042 / bst0280703。gydF4y2Ba
- 20。gydF4y2Ba
黄志刚,黄志刚,黄志刚:磷脂酰甘油酰基转移酶的克隆和功能鉴定gydF4y2Ba拟南芥gydF4y2Ba.植物理性。2004年,135:1324年至1335年。10.1104 / pp.104.044354。gydF4y2Ba
- 21。gydF4y2Ba
马志强,李志强,李志强,等gydF4y2Ba拟南芥gydF4y2Ba磷脂淘汰线:二酰基甘油酸杂化酶基因(AT5G13640)。植物理性生物化学。2005,43:413-417。10.1016 / J.Plaphy.2005.01.013。gydF4y2Ba
- 22。gydF4y2Ba
陈志强,陈志强,陈志强,等:甘油三酯生物合成中甘油酰基转移酶1的表达模式gydF4y2Ba拟南芥gydF4y2Ba.植物mol biol。2003,52:31-41。10.1023 /答:1023935605864。gydF4y2Ba
- 23.gydF4y2Ba
关键词:蓖麻,内质网,PDAT1-2,羟基脂肪酸,转基因植物营养与肥料学报。2011,32(4):591 - 598。10.1093 /卡式肺囊虫肺炎/ pcr051。gydF4y2Ba
- 24.gydF4y2Ba
蓖麻磷脂:二酰基甘油酰基转移酶促进转基因植物中羟基脂肪酸的高效代谢gydF4y2Ba拟南芥gydF4y2Ba.植物理性。2011,155:683-693。10.1104 / pp.110.167239。gydF4y2Ba
- 25.gydF4y2Ba
sthl U, stellberg K, Stymne S, Ronne H:真核生物的一个家族gydF4y2BalysogydF4y2Ba具有广泛特异性的磷脂酰转移酶。FEBS Lett. 2008, 582: 305-309。10.1016 / j.febslet.2007.12.020。gydF4y2Ba
- 26.gydF4y2Ba
1,2-二甘油酯经小孢子来源的胚胎匀浆形成三甘油酯(Trierucin)gydF4y2Ba芸苔属植物显著gydF4y2Ba石油化学学报,1992,32(4):457 - 461。10.1007 / BF02636067。gydF4y2Ba
- 27.gydF4y2Ba
Sandager L,Gustavsson的MH,斯塔尔U,Dahlqvist A,维贝格E,巴尼亚斯A,Lenman男,龙尼H,斯蒂姆内S:寄存脂质合成是在酵母中的非必需。J Biol Chem。2002年,277:6478-6482。10.1074 / jbc.M109109200。gydF4y2Ba
- 28。gydF4y2Ba
徐J,弗朗西斯·T Mietkiewska E,吉布林EM,巴顿DL,张Y,张M,泰勒DC:克隆和表征的acyl-CoA-dependent二酰基甘油酰基转移酶1 (DGAT1)从旱金莲majus基因,并研究DGAT蛋白质的功能主题使用定点诱变修改酶活性和含油量。生物技术学报,2008,6:799- 718。10.1111 / j.1467-7652.2008.00358.x。gydF4y2Ba
- 29。gydF4y2Ba
张敏,范建平,张敏,等:DGAT1和PDAT1酰基转移酶具有重叠功能gydF4y2Ba拟南芥gydF4y2Ba三酰基甘油的生物合成和是正常花粉和种子发育所必需的。acta botanica sinica(云南植物学报),2009,31(4):489 - 494。10.1105 / tpc.109.071795。gydF4y2Ba
- 30.gydF4y2Ba
Mañas-fernándeza,vilches-ferrónm,garrido-cárdenasj,belarbi e-h,Alonso D,García-Maroto F:酰基-CoA的克隆和分子表征:二酰基甘油酰基转移酶1(DGAT1)基因来自gydF4y2BaEchiumgydF4y2Ba.脂质。2009年,44:555-568。10.1007 / s11745-009-3303-9。gydF4y2Ba
- 31.gydF4y2Ba
Guihéneuf女,亮氨酸S,Zarka女士A,Khozin-戈德堡I,哈利洛夫I,Boussibab S:克隆和一种新颖的酰基辅酶A的分子特征:二酰甘油酰基转移酶1状gydF4y2Ba基因(PtDGAT1)gydF4y2Ba从硅藻gydF4y2BaPhaeodactylum tricornutumgydF4y2Ba.中国海洋大学学报(自然科学版),2011,33(2):451 - 466。10.1111 / j.1742-4658.2011.08284.x。gydF4y2Ba
- 32.gydF4y2Ba
Turchetto-Zolet AC, Maraschin FS, de Morais GL, Cagliari A, Andrade CMB, Margis- pinheiro M, Margis R:酰基辅酶A二酰基甘油酰基转移酶(DGAT)的进化观点,这是中性脂类生物合成的关键酶。中国生物医学工程学报。2011,31(4):489 - 498。doi: 10.1186 / 1471-2148-11-263gydF4y2Ba
- 33.gydF4y2Ba
Beisson楼辜AJK,Ruuska S,SchwenderĴ,波拉德男,Thelen JJ,围场T,Salas的JJ,野蛮L,Milcamps A,Mhaske VB,卓Y,Ohlrogge JB:参与酰基脂质代谢的2003年人口普查拟南芥基因候选人,表达序列标签的器官分布的研究,以及基于网络的数据库。植物理性。2003,132:681-697。10.1104 / pp.103.022988。gydF4y2Ba
- 34.gydF4y2Ba
沈伟,陈强,王磊,邹杰:功能性研究gydF4y2BaLysogydF4y2Ba磷脂酰胆碱的酰基转移酶gydF4y2Ba拟南芥gydF4y2Ba.第18届植物脂质国际研讨会的诉讼程序。波尔多;2008年:102。gydF4y2Ba
- 35.gydF4y2Ba
一种调节三酰基甘油组成的酶被编码gydF4y2Ba罗德1.gydF4y2Ba基因的gydF4y2Ba拟南芥gydF4y2Ba.美国国家科学院。2009年,106:18837 - 18842。10.1073 / pnas.0908848106。gydF4y2Ba
- 36。gydF4y2Ba
泰勒DC,巴顿DL,RIOUX KP,麦肯齐SL,里德DW,昂德希尔EW,波默罗伊MK,韦伯N:含有在孢子衍生和合子胚非常长链脂肪酸酰基的脂质的生物合成gydF4y2Ba芸苔属植物显著gydF4y2Ba我的简历莱斯顿。植物生理学报。1992,19(4):591 - 598。10.1104 / pp.99.4.1609。gydF4y2Ba
- 37。gydF4y2Ba
布拉德福德MM:利用蛋白质染料结合原理的微克数量蛋白质量化的快速敏感方法。肛门生物化学。1976,72:248-254。10.1016 / 0003-2697(76)90527-3。gydF4y2Ba
- 38。gydF4y2Ba
横山K, Shimiza F, Setaka M:同时分离gydF4y2BalysogydF4y2Ba用二维薄层色谱法从粗生物样品的总脂馏分中提取磷脂。中国海洋大学学报(自然科学版),2000,41(4):457 - 461。gydF4y2Ba
- 39。gydF4y2Ba
Wang CS, Vodkin LO:从含有高水平结合RNA的原花青素的组织中提取RNA。植物生态学报1994,12:132-145。10.1007 / BF02668374。gydF4y2Ba
- 40.gydF4y2Ba
Meadus WJ:一个半定量RT-PCR法来测量gydF4y2Ba体内gydF4y2Ba日粮共轭亚油酸对猪肌肉PPAR基因表达的影响。生物信息学杂志。2003,5:20-28。10.1251 / bpo43。gydF4y2Ba
- 41.gydF4y2Ba
阿隆索JM,开朗,Leisse TJ,金正日CJ,陈H,希恩P,史蒂文森DK,齐默尔曼J,巴拉哈斯P, Cheuk R, Gadrinab C,海勒C, Jeske, Koesema E,迈耶斯CC,帕克H, Prednis L,安萨里Y,白菜N,迪恩H, Geralt M, Hazari N, Hom E,圆锥形石垒,穆赫兰C, Ndubaku R,施密特,古兹曼P, Aguilar-Henonin L,施密德M,魏盖尔D,卡特,Marchand T, Risseeuw E, Brogden D, Zeko A, Crosby WL, Berry CC, Ecker JR:拟南芥全基因组插入突变。中国科学(d辑):地球科学(英文版)。10.1126 / science.1086391。gydF4y2Ba
确认gydF4y2Ba
这项工作部分得到了加拿大基因组:基因组草原二期(Genome Canada: Genome Prairie Phase II)对D.C.T.的资助,以及瑞典环境、农业科学和空间规划研究理事会(Swedish Research Council for Environment, Agricultural Sciences and Spatial Planning)对A.S.C.的资助。作者也感谢博士的好心帮助。马克·史密斯和艾莉森·费里对手稿进行了仔细的审查,约翰·奥罗格博士在工作过程中进行了有益的讨论。这是加拿大国家研究委员会的第50191号出版物。我们感谢索尔克研究所基因组分析实验室提供的序列索引拟南芥T-DNA插入突变体,以及诺丁汉拟南芥砧木中心提供的种子。SIGNAL索引插入突变体的收集由美国国家科学基金会提供资金。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
JX进行了脂质基因表达的QRT-PCRgydF4y2BaAS11gydF4y2Ba在本研究的设计中,ASC进行了杂交gydF4y2BalpcatgydF4y2Ba突变体与gydF4y2BaAS11gydF4y2Ba并选择具有杂合或纯合突变条件的品系,TF对AS11和WT基因集进行微阵列分析,并对突变的AS11和A7 DGAT1蛋白在酵母突变体中的异位表达进行分析gydF4y2BaH1246MATα.gydF4y2Ba, MZ开展了PDAT1在中占主导地位的工作gydF4y2Ba拟南芥gydF4y2BaTH和MG对突变体进行LPCAT和DGAT分析,并对突变体的含油量、种子质量和酰基谱进行分析。DCT构思了这项研究,领导了它的设计和协调,并起草了手稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
电子补充材料gydF4y2Ba
图S1gydF4y2Ba
附加文件1:WT生长表型的比较,gydF4y2BaAS11gydF4y2Ba和gydF4y2BaA7gydF4y2Ba拟南芥gydF4y2Ba行。而WT已经螺栓,两者gydF4y2BaAS11gydF4y2Ba和gydF4y2BaA7gydF4y2Ba植物发育延迟:生殖(生殖)期延迟约1周(比WT成熟长33%)。图S2。(gydF4y2Ba一个gydF4y2Ba)是F开发的角果照片gydF4y2Ba2gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2Ba他/ h行#6-3-7(左)和#6-3-10(右)显示由于非受精胚珠的许多差距。(gydF4y2BaBgydF4y2Ba)照片1-4:用箭头指向非受精胚珠的线#6-3-10的分层的特写镜头(第1&2)。图S3。从f开发单片机的照片gydF4y2Ba2gydF4y2BaDGAT1.gydF4y2Ba/gydF4y2Balpcat2gydF4y2BaH / HE线#6-3-13显示正常的种子开发和模式。(PPT 1 MB)gydF4y2Ba
表S1gydF4y2Ba
附加文件2:本研究半定量RT-PCR使用的引物。表S2。用来筛选的引物gydF4y2BaAS11 dgat1gydF4y2BaEMS突变体和gydF4y2Balpcat1gydF4y2Ba和gydF4y2Balpcat2gydF4y2BaPCR扩增T-DNA插入突变株。表S3。为发展两个纯合子的系而进行的杂交的细节gydF4y2BaDGAT1.gydF4y2Ba和gydF4y2Balpcat1gydF4y2Ba突变或者两者都有gydF4y2BaDGAT1.gydF4y2Ba和gydF4y2Balpcat2gydF4y2Ba突变。(PDF 35 KB)gydF4y2Ba
作者的原始提交的图像文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
徐,J.,Carsson,A.S.,Francis,T.gydF4y2Baet al。gydF4y2Ba在没有DGAT1活性的情况下,PDAT1合成三酰基甘油依赖于LPCAT2对LPC的再酰化。gydF4y2BaBMC植物BIOL.gydF4y2Ba12,gydF4y2Ba4(2012)。https://doi.org/10.1186/1471-2229-12-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-4gydF4y2Ba
关键字gydF4y2Ba
- DGAT1.gydF4y2Ba突变体gydF4y2BaAS11gydF4y2Ba, LPCAT1, LPCAT2, PDAT1,石油生物合成gydF4y2Ba拟南芥gydF4y2Ba库存中心WT(Columbia生态型-0)gydF4y2Ba
- DGAT1.gydF4y2Ba,gydF4y2BaAS11gydF4y2Ba(CS3861)gydF4y2Ba
- A7gydF4y2Ba(Salk_039456)gydF4y2Ba
- lpcat1gydF4y2Ba(SALK_123480)gydF4y2Ba
- lpcat2gydF4y2Ba(SAIL_357_H01)gydF4y2Ba